–Я–Њ—Б–ї–µ–і—Б—В–≤–Є—П –Њ—Б—В—А—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П (–Ю–Э–Ь–Ъ) –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞, –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Є –Є–Ј–≤–Є—В–Њ—Б—В—М –Љ–∞–≥–Є—Б—В—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–є, —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Є –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–∞—П –∞—А–Є—В–Љ–Є—П, –Ї–Њ–∞–≥—Г–ї–Њ–њ–∞—В–Є–Є, –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л, –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Н–љ–і–Њ–Ї—А–Є–љ–љ–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П (–і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –∞–љ–≥–Є–Њ- –Є –љ–µ–є—А–Њ–њ–∞—В–Є—П), —Н–Ї—Б—В—А–∞–≤–∞–Ј–∞–ї—М–љ–∞—П –Ї–Њ–Љ–њ—А–µ—Б—Б–Є—П –Є —Ж–µ–ї—Л–є —А—П–і –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–Є–≤–Њ–і–Є—В—М –Ї –≤–µ—Б—М–Љ–∞ –њ—А–Є—З—Г–і–ї–Є–≤—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ, –Ј–∞—В—А—Г–і–љ—П—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г. –Я—А–Є —Н—В–Њ–Љ –≤–∞–ґ–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –•–Ш–Ь —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –ї–∞—В–µ–љ—В–љ–Њ—Б—В–Є, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ–Ј–і–љ–µ–Љ—Г –љ–∞—З–∞–ї—Г –Є —З–∞—Б—В–Њ–є –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –•–∞—А–∞–Ї—В–µ—А–љ–Њ–µ –і–ї—П –•–Ш–Ь –Ї–Њ–≥–љ–Є—В–Є–≤–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ – –Њ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —Б–Њ—Е—А–∞–љ–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Є–љ—В–µ–ї–ї–µ–Ї—В–∞ –Є —Г–Љ–µ—А–µ–љ–љ—Л—Е –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –і–Њ —В—П–ґ–µ–ї–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є – —В–∞–Ї–ґ–µ –љ–∞–Ї–ї–∞–і—Л–≤–∞–µ—В —Б–≤–Њ–є –Њ—В–њ–µ—З–∞—В–Њ–Ї –љ–∞ –≤–µ–і–µ–љ–Є–µ —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–ґ–∞—П –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М.
–Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –•–Ш–Ь –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤ –≤–Є–і–µ –і–Є—Б—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–є —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є (–Ф–≠), –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–µ–є –≤—Б–ї–µ–і—Б—В–≤–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–є —Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є. –Я—А–Є —Н—В–Њ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М —П–≤–ї—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –њ—А–Є—З–Є–љ–Њ–є –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–≥–Њ –љ–∞—А–∞—Б—В–∞–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤, –љ–Њ –Є —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ю–Э–Ь–Ъ.
–Т–µ—Б—М–Љ–∞ –≤–µ–ї–Є–Ї–∞ –Є —Б–Њ—Ж–Є–∞–ї—М–љ–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М —Н—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, —В. –Ї. –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –њ—А–Є –•–Ш–Ь –Љ–Њ–≥—Г—В –±—Л—В—М –њ—А–Є—З–Є–љ–Њ–є —Б–µ—А—М–µ–Ј–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –Є —В—П–ґ–µ–ї–Њ–є –Є–љ–≤–∞–ї–Є–і–Є–Ј–∞—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ґ–∞–Ї, —В–Њ–ї—М–Ї–Њ –≤ –≥. –Ь–Њ—Б–Ї–≤–µ –љ–∞ —Г—З–µ—В–µ –≤ –≥–Њ—А–Њ–і—Б–Ї–Є—Е –њ–Њ–ї–Є–Ї–ї–Є–љ–Є–Ї–∞—Е –≤ 2003 –≥. —Б–Њ—Б—В–Њ—П–ї–Њ –±–Њ–ї–µ–µ 450 —В—Л—Б. –±–Њ–ї—М–љ—Л—Е —Б —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ —П–≤–Є–ї–Є—Б—М –њ—А–Є—З–Є–љ–Њ–є –≤—А–µ–Љ–µ–љ–љ–Њ–є –љ–µ—В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є (–±–Њ–ї–µ–µ 330 —В—Л—Б. –і–љ–µ–є), –∞ –њ–Њ—З—В–Є —Г 13 —В—Л—Б. —З–µ–ї–Њ–≤–µ–Ї – –Њ—Б–љ–Њ–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –≤—Л—Е–Њ–і–∞ –љ–∞ –Є–љ–≤–∞–ї–Є–і–љ–Њ—Б—В—М [1, 2].
–Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –≤ –Ь–Ъ–С-10 –Ї–∞–Ї —В–µ—А–Љ–Є–љ –•–Ш–Ь, —В–∞–Ї –Є —В–µ—А–Љ–Є–љ –Ф–≠ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В (—В–∞–Ї –ґ–µ, –Ї–∞–Ї –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є –≤ –Ь–Ъ–С–9). –≠—В–Њ –љ–µ–Є–Ј–±–µ–ґ–љ–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В «—А–∞–Ј–Љ—Л–≤–∞–љ–Є—О» –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–є –Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –і–∞–љ–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –С–ї–Є–Ј–Ї–Є–Љ–Є –Ї –љ–µ–Љ—Г –њ–Њ —Б–Љ—Л—Б–ї—Г, —Б–Њ–≥–ї–∞—Б–љ–Њ –Ь–Ъ–С-10, —П–≤–ї—П—О—В—Б—П —Б–Њ—Б—В–Њ—П–љ–Є—П, –Њ–±–Њ–Ј–љ–∞—З–µ–љ–љ—Л–µ –Ї–∞–Ї –Ј–∞–Ї—Г–њ–Њ—А–Ї–∞ –Є —Б—В–µ–љ–Њ–Ј —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е –Є–ї–Є –њ—А–µ—Ж–µ—А–µ–±—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–є, –љ–µ –њ—А–Є–≤–Њ–і—П—Й–Є–µ –Ї –Є–љ—Д–∞—А–Ї—В—Г –Љ–Њ–Ј–≥–∞ (I65.*, I66.*); –і—А—Г–≥–Є–µ —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є (I67), –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј – –∞—В–µ—А–Њ–Љ–∞ –∞—А—В–µ—А–Є–є –Љ–Њ–Ј–≥–∞ (I67.2), –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–∞—П —Б–Њ—Б—Г–і–Є—Б—В–∞—П –ї–µ–є–Ї–Њ—Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П – –±–Њ–ї–µ–Ј–љ—М –С–Є–љ—Б–≤–∞–љ–≥–µ—А–∞ (I67.3), –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ–∞—П —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П (I67.4), –і—А—Г–≥–Є–µ —Г—В–Њ—З–љ–µ–љ–љ—Л–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–Њ—Б—Г–і–Њ–≤ –Љ–Њ–Ј–≥–∞ (I67.8), –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Є—И–µ–Љ–Є—П –Љ–Њ–Ј–≥–∞ (—Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П), —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П –±–Њ–ї–µ–Ј–љ—М –љ–µ—Г—В–Њ—З–љ–µ–љ–љ–∞—П (I67.9); —В—А–∞–љ–Ј–Є—В–Њ—А–љ—Л–µ —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є—Б—В—Г–њ—Л (–∞—В–∞–Ї–Є) –Є —А–Њ–і—Б—В–≤–µ–љ–љ—Л–µ —Б–Є–љ–і—А–Њ–Љ—Л (G45.*). –Я—А–Є —Н—В–Њ–Љ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Ь–Ъ–С-10 –Є–Љ–µ–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –і–Є–∞–≥–љ–Њ–Ј –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–µ–і—Г—Й–µ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ (—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –і–µ–Љ–µ–љ—Ж–Є–Є, –љ–µ–Ї–Њ—В–Њ—А—Л–µ –і—А—Г–≥–Є–µ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–Є–љ–і—А–Њ–Љ—Л). –Я—А–Є –Њ–њ–Є—Б–∞–љ–Є–Є –њ–Њ–Ј–і–љ–Є—Е, –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–Є—Е —Б—В–∞–і–Є–є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –≤ –Ј–∞—А—Г–±–µ–ґ–љ–Њ–є, –Є –≤ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –Њ–±—Л—З–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —В–µ—А–Љ–Є–љ «—Б–Њ—Б—Г–і–Є—Б—В–∞—П –і–µ–Љ–µ–љ—Ж–Є—П».
–Я–∞—В–Њ–≥–µ–љ–µ–Ј –•–Ш–Ь –≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –Є–Љ–µ–µ—В –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А, —З–∞—Й–µ –≤—Б–µ–≥–Њ –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –Є–≥—А–∞—О—В –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П (–Р–У), —Б—В–µ–љ–Њ–Ј–Є—А—Г—О—Й–µ–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Љ–∞–≥–Є—Б—В—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є–є –≥–Њ–ї–Њ–≤—Л, –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–∞—П –∞—А–Є—В–Љ–Є—П –Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ —Б–Є—Б—В–µ–Љ—Л –≥–µ–Љ–Њ—Б—В–∞–Ј–∞.
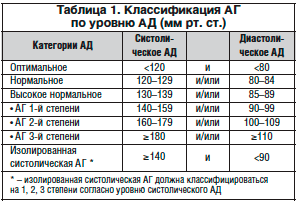
–°—В–Њ–є–Ї–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Р–Ф —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Љ–µ–ї–Ї–Є—Е –Љ–Њ–Ј–≥–Њ–≤—Л—Е –∞—А—В–µ—А–Є–є – –Љ–Є–Ї—А–Њ–∞–љ–≥–Є–Њ–њ–∞—В–Є–µ–є, –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –њ—А–Њ—П–≤–ї—П—О—Й–Є–Љ—Б—П –∞p—В–µp–Є–Њ—Б–Ї–ї–µp–Њ–Ј–Њ–Љ –Є–ї–Є –ї–Є–њ–Њ–≥–Є–∞–ї–Є–љ–Њ–Ј–Њ–Љ. –Ю–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П –∞—А—В–µ—А–Є–є –Љ–Њ–Ј–≥–∞ –≤ –≤–Є–і–µ –Њ—З–∞–≥–Њ–≤ –њ–ї–∞–Ј–Љ–Њ-, –≥–µ–Љ–Њ—А—А–∞–≥–Є–є, –Ј–Њ–љ –љ–µ–Ї—А–Њ–Ј–∞ —Б—В–µ–љ–Ї–Є —Б–Њ—Б—Г–і–∞ —Б –µ–µ –Є—Б—В–Њ–љ—З–µ–љ–Є–µ–Љ, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —А–µ–≥–Є—Б—В—А–Є—А—Г—О—В—Б—П —Н–ї–µ–Љ–µ–љ—В—Л —А–µ–њ–∞—А–∞—В–Є–≤–љ—Л—Е –Є –∞–і–∞–њ—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≤ –≤–Є–і–µ –≥–Є–њ–µ—А—В—А–Њ—Д–Є–Є –Љ—Л—И–µ—З–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є —Б –њ–µ—А–µ–Ї–∞–ї–Є–±—А–Њ–≤–Ї–Њ–є –∞—А—В–µ—А–Є–є, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ «–≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Є—Е —Б—В–µ–љ–Њ–Ј–Њ–≤», –≤–њ–ї–Њ—В—М –і–Њ –њ–Њ–ї–љ–Њ–є –Њ–±–ї–Є—В–µ—А–∞—Ж–Є–Є –њ—А–Њ—Б–≤–µ—В–∞ —Б–Њ—Б—Г–і–Њ–≤ [3]. –Ґ–∞–Ї –Ї–∞–Ї –Р–У —П–≤–ї—П–µ—В—Б—П –≤–µ–і—Г—Й–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –њ—А–Њ–≥—А–µ–і–Є–µ–љ—В–љ—Л—Е —Д–Њ—А–Љ —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –Њ–і–Є–љ –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е –≤–Њ–њ—А–Њ—Б–Њ–≤ – –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –љ–∞–ї–Є—З–Є—П –Є —Е–∞—А–∞–Ї—В–µ—А–∞ –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–∞, –њ—А–Є—З–µ–Љ –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л —В–∞–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л, –Ї–∞–Ї —Г—А–Њ–≤–µ–љ—М –Р–Ф, —Б—В–µ–њ–µ–љ—М –њ–Њ—А–∞–ґ–µ–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤-–Љ–Є—И–µ–љ–µ–є (—Б–µ—А–і—Ж–µ, –њ–Њ—З–Ї–Є, –≥–Њ–ї–Њ–≤–љ–Њ–є –Љ–Њ–Ј–≥) –Є —Н—В–Є–Њ–ї–Њ–≥–Є—П. –Т —В–∞–±–ї–Є—Ж–µ 1 –њ—А–Є–≤–µ–і–µ–љ–∞ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Р–У –њ–Њ —Г—А–Њ–≤–љ—О –Р–Ф –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–Њ –Р–У –Є –Т—Б–µ—А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –љ–∞—Г—З–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–≤ (3-–є –њ–µ—А–µ—Б–Љ–Њ—В—А, 2008) [4].
–Ф–∞–љ–љ–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, —В. –Ї. –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–≥–ї—П–і–љ–Њ –Њ—Ж–µ–љ–Є—В—М —В—П–ґ–µ—Б—В—М –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ю–Э–Ь–Ъ –ї–Є–±–Њ –њ—А–Њ–≥—А–µ–і–Є–µ–љ—В–љ–Њ–≥–Њ —Г—Е—Г–і—И–µ–љ–Є—П —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–є –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї–Є —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Є —Г—Б—Г–≥—Г–±–ї–µ–љ–Є–µ–Љ –Ї–Њ–≥–љ–Є—В–Є–≤–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є. –Ґ–∞–Ї–ґ–µ –Ї—А–∞–є–љ–µ –≤–∞–ґ–љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —Б—В–∞–і–Є—О –Р–У –Є –љ–∞–ї–Є—З–Є–µ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞. –Я—А–Є I —Б—В–∞–і–Є–Є –Р–У –Њ–±—К–µ–Ї—В–Є–≤–љ—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –њ–Њ—А–∞–ґ–µ–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤-–Љ–Є—И–µ–љ–µ–є –Њ—В—Б—Г—В—Б—В–≤—Г—О—В. –Я—А–Є II —Б—В–∞–і–Є–Є –Є–Љ–µ–µ—В—Б—П –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –Њ–і–Є–љ –Є–Ј –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ –Є–ї–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ –≤—Л—П–≤–ї—П–µ–Љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤-–Љ–Є—И–µ–љ–µ–є, —В–∞–Ї–Є—Е –Ї–∞–Ї –≥–Є–њ–µ—А—В—А–Њ—Д–Є—П –ї–µ–≤–Њ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞, —Б—Г–ґ–µ–љ–Є–µ —Б–Њ—Б—Г–і–Њ–≤ —Б–µ—В—З–∞—В–Ї–Є, –Љ–Є–Ї—А–Њ–∞–ї—М–±—Г–Љ–Є–љ—Г—А–Є—П, –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ —Б–Њ–љ–љ—Л—Е, –њ–Њ–і–≤–Ј–і–Њ—И–љ—Л—Е –Є –±–µ–і—А–µ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є –Є–ї–Є –∞–Њ—А—В—Л. –Я—А–Є III —Б—В–∞–і–Є–Є, –Ї—А–Њ–Љ–µ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤, –Є–Љ–µ—О—В—Б—П –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П (–Р–Ъ–°), –Ї —З–Є—Б–ї—Г –Ї–Њ—В–Њ—А—Л—Е, —Б–Њ–≥–ї–∞—Б–љ–Њ —Г–њ–Њ–Љ—П–љ—Г—В—Л–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ, –Њ—В–љ–Њ—Б—П—В—Б—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–є –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Є–љ—Б—Г–ї—М—В, –∞ —В–∞–Ї–ґ–µ —В—А–∞–љ–Ј–Є—В–Њ—А–љ–∞—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–∞—П –∞—В–∞–Ї–∞ (–Ґ–Ш–Р). –° –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –Є —В–∞–Ї–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П, –Ї–∞–Ї —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–µ –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є–Ј—Л, –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–∞—П –Ф–≠, —Б–Њ—Б—Г–і–Є—Б—В–∞—П –і–µ–Љ–µ–љ—Ж–Є—П. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Б–Њ—З–µ—В–∞–љ–Є–µ –≤ –і–Є–∞–≥–љ–Њ–Ј–µ –Њ–і–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –•–Ш–Ь (–Є–ї–Є –Ф–≠), –Ґ–Ш–Р –Є–ї–Є –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ї—А–Є–Ј–Њ–≤ –Є –Р–У I–II —Б—В–∞–і–Є–Є, —З—В–Њ –≥–Њ–≤–Њ—А–Є—В –Њ –љ–µ–і–Њ–Њ—Ж–µ–љ–Ї–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ –Є —Б—В–µ–њ–µ–љ–Є —А–Є—Б–Ї–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
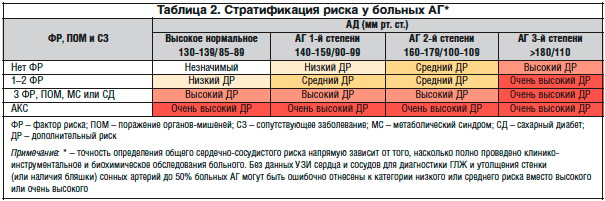
–Я—А–Є –Њ—Ж–µ–љ–Ї–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞ —В–∞–Ї–ґ–µ –±–Њ–ї—М—И—Г—О —А–Њ–ї—М –Є–≥—А–∞–µ—В –љ–∞–ї–Є—З–Є–µ –і—А—Г–≥–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –Ї —Д–∞–Ї—В–Њ—А–∞–Љ —А–Є—Б–Ї–∞ –Њ—В–љ–Њ—Б—П—В –±–Њ–ї—М—И—Г—О –≤–µ–ї–Є—З–Є–љ—Г –њ—Г–ї—М—Б–Њ–≤–Њ–≥–Њ –Р–Ф (—Г –њ–Њ–ґ–Є–ї—Л—Е), –≤–Њ–Ј—А–∞—Б—В (–Љ—Г–ґ—З–Є–љ—Л >55 –ї–µ—В; –ґ–µ–љ—Й–Є–љ—Л >65 –ї–µ—В), –Ї—Г—А–µ–љ–Є–µ, –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є–Є, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В –Є –љ–∞—А—Г—И–µ–љ–љ—Г—О —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В—М –Ї –≥–ї—О–Ї–Њ–Ј–µ, —Б–µ–Љ–µ–є–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј —А–∞–љ–љ–Є—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–µ –Њ–ґ–Є—А–µ–љ–Є–µ –Є —А—П–і –і—А—Г–≥–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є. –°—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є—П —А–Є—Б–Ї–∞ –Љ–Њ–ґ–µ—В –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М—Б—П —Б–Њ–≥–ї–∞—Б–љ–Њ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–Љ –≤ —В–∞–±–ї–Є—Ж–µ 2 [4].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Є —В–µ—З–µ–љ–Є–µ —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є –Ј–∞–≤–Є—Б—П—В –Њ—В —А—П–і–∞ —Д–∞–Ї—В–Њ—А–Њ–≤, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –Њ—В –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞. –Т —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –≤–µ–і—Г—Й–Є–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –•–Ш–Ь (–Ф–≠) – –Р–У, –љ–∞–Є–±–Њ–ї–µ–µ —В–Є–њ–Є—З–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ —Б—В—Г–њ–µ–љ–µ–Њ–±—А–∞–Ј–љ–Њ–≥–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є —А–∞–Ј–≤–Є–≤–∞—О—Й–Є–Љ–Є—Б—П –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–Љ–Є –Ї—А–Є–Ј–∞–Љ–Є. –Я—А–Є —Н—В–Њ–Љ –њ–Њ—А–∞–ґ–∞—О—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Є–љ—В—А–∞—Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–µ –∞—А—В–µ—А–Є–Є –і–Є–∞–Љ–µ—В—А–Њ–Љ 70–500 –Љ–Ї–Љ –Є –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–µ —А—Г—Б–ї–Њ –Љ–Њ–Ј–≥–∞. –•–∞—А–∞–Ї—В–µ—А–µ–љ —Б–µ–≥–Љ–µ–љ—В–∞—А–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А —Б–Њ—Б—Г–і–Є—Б—В—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–і—А–∞–Ј–і–µ–ї—П—О—В—Б—П –љ–∞ –њ–µ—А–≤–Є—З–љ—Л–µ –Є –≤—В–Њ—А–Є—З–љ—Л–µ. –Я–µ—А–≤–Є—З–љ—Л–µ – –Њ—Б—В—А—Л–µ, –њ–Њ–≤—В–Њ—А–љ—Л–µ –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ —Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ї—А–Є–Ј–∞–Љ–Є (–њ–ї–∞–Ј–Љ–Њ—А—А–∞–≥–Є–Є, —Д–Є–±—А–Є–љ–Њ–Є–і–љ—Л–є –љ–µ–Ї—А–Њ–Ј —Б –љ–∞–±—Г—Е–∞–љ–Є–µ–Љ —Б—В–µ–љ–Ї–Є –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –Њ—Б—В—А–Њ–≥–Њ –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В–µ–љ–Њ–Ј–∞, –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л–є –љ–µ–Ї—А–Њ–Ј –Љ–Є–Њ—Ж–Є—В–Њ–≤ —Б—А–µ–і–љ–µ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –∞—А—В–µ—А–Є–є, –Љ–Є–ї–Є–∞—А–љ—Л–µ –∞–љ–µ–≤—А–Є–Ј–Љ—Л, —А–∞–Ј—А—Л–≤ —Б—В–µ–љ–Ї–Є, —В—А–Њ–Љ–±–Њ–Ј). –Т—В–Њ—А–Є—З–љ—Л–µ – —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–њ–∞—А–∞—В–Є–≤–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л (–∞—А—В–µ—А–Є–Њ—Б–Ї–ї–µ—А–Њ–Ј, –≥–Є–∞–ї–Є–љ–Њ–Ј —Б —Г—В–Њ–ї—Й–µ–љ–Є–µ–Љ —Б—В–µ–љ–Њ–Ї –Є —Б—Г–ґ–µ–љ–Є–µ–Љ –њ—А–Њ—Б–≤–µ—В–∞ –∞—А—В–µ—А–Є–є –≤–њ–ї–Њ—В—М –і–Њ –Њ–±–ї–Є—В–µ—А–∞—Ж–Є–Є), –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ-–њ—А–Є—Б–њ–Њ—Б–Њ–±–Є—В–µ–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П (–Љ–Є–Њ—Н–ї–∞—Б—В–Њ—Д–Є–±—А–Њ–Ј, –≥–Є–њ–µ—А—Н–ї–∞—Б—В–Њ–Ј, –Љ—Л—И–µ—З–љ–Њ-—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–µ «–њ–Њ–і—Г—И–Ї–Є» –≤ –Љ–µ—Б—В–∞—Е –Њ—В—Е–Њ–ґ–і–µ–љ–Є—П –≤–µ—В–≤–µ–є, –≥–Є–њ–µ—А—В—А–Њ—Д–Є—П —Б—А–µ–і–љ–µ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—П —Б–Њ—Б—Г–і–Њ–≤ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ —А—Г—Б–ї–∞). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–µ –і–Є—Д—Д—Г–Ј–љ—Л–µ –Є –Љ–µ–ї–Ї–Њ–Њ—З–∞–≥–Њ–≤—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞, –Є–Љ–µ—О—Й–Є–µ —А–∞–Ј–ї–Є—З–љ—Л–є –њ–∞—В–Њ–≥–µ–љ–µ–Ј, –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—О, —Е–∞—А–∞–Ї—В–µ—А –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М, –њ—А–Є–≤–Њ–і—П—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Њ–є –∞–љ–≥–Є–Њ—Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є.

–£ –±–Њ–ї—М–љ—Л—Е —Б —В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Р–У –Є –њ–Њ–≤—В–Њ—А–љ—Л–Љ–Є —Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ї—А–Є–Ј–∞–Љ–Є –Њ–±—Л—З–љ–Њ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П —В–∞–Ї–Є–µ –ї–∞–Ї—Г–љ–∞—А–љ—Л–µ —Б–Є–љ–і—А–Њ–Љ—Л, –Ї–∞–Ї «—З–Є—Б—В—Л–є –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л–є» –Є–љ—Б—Г–ї—М—В, «—З–Є—Б—В—Л–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–є» –Є–љ—Б—Г–ї—М—В –Є–ї–Є «—З–Є—Б—В—Л–є –Љ–Њ–Ј–ґ–µ—З–Ї–Њ–≤—Л–є» –Є–љ—Б—Г–ї—М—В, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Љ–∞–ї—Л—Е (–ї–∞–Ї—Г–љ–∞—А–љ—Л—Е) –Є–љ—Д–∞—А–Ї—В–Њ–≤ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –Ї–Њ—В–Њ—А—Л–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ—Б–Њ–±–Њ–є —Д–Њ—А–Љ—Л –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Љ–Њ–Ј–≥–∞. –Я—А–Є –њ–Њ–≤—В–Њ—А–µ–љ–Є–Є –њ–Њ–і–Њ–±–љ—Л—Е —Н–њ–Є–Ј–Њ–і–Њ–≤ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –ї–∞–Ї—Г–љ–∞—А–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ – —В—П–ґ–µ–ї–∞—П –Љ–љ–Њ–≥–Њ–Њ—З–∞–≥–Њ–≤–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П –Љ–Њ–Ј–≥–∞ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞, —Д–Њ—А–Љ–Є—А—Г—О—Й–∞—П—Б—П –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л—Е –≥–Є–њ–µ—А—В–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Љ–∞–ї—Л—Е –≥–ї—Г–±–Є–љ–љ—Л—Е (–ї–∞–Ї—Г–љ–∞—А–љ—Л—Е) –Є–љ—Д–∞—А–Ї—В–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, —Г –±–Њ–ї—М–љ—Л—Е —Б —В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Р–У, –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Ґ–Ш–Р), –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Љ–∞—Б—Б—Л –Є –Њ–±—К–µ–Љ–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —А–∞—Б—И–Є—А–µ–љ–Є—О –Њ–±—К–µ–Љ–∞ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤ –Є —Б—Г–±–∞—А–∞—Е–љ–Њ–Є–і–∞–ї—М–љ—Л—Е –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤. –Ф–ї—П —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±—Л—З–љ–Њ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –Ї–Њ–≥–љ–Є—В–Є–≤–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –≤–њ–ї–Њ—В—М –і–Њ –і–µ–Љ–µ–љ—Ж–Є–Є. –Я—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –Р–У —Б —Н—И–µ–ї–Њ–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ –Є–ї–Є –µ–≥–Њ –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–Є —В–∞–Ї–ґ–µ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –Љ–∞–ї—Л—Е –≥–ї—Г–±–Є–љ–љ—Л—Е (–ї–∞–Ї—Г–љ–∞—А–љ—Л—Е) –Є–љ—Д–∞—А–Ї—В–Њ–≤, –Є–Љ–µ—О—Й–Є—Е –Є–љ–Њ–є –њ–∞—В–Њ–≥–µ–љ–µ–Ј. –Я—А–Є —Н—В–Њ–Љ –њ–Њ—А–∞–ґ–∞—О—В—Б—П –љ–µ —Б–∞–Љ–Є –њ–µ—А—Д–Њ—А–Є—А—Г—О—Й–Є–µ –∞—А—В–µ—А–Є–Є (–Ї–∞–Ї –њ—А–Є –Р–У), –∞ –њ–µ—А–µ–і–љ–Є–µ, —Б—А–µ–і–љ–Є–µ –Є –Ј–∞–і–љ–Є–µ —Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–µ, –∞ —В–∞–Ї–ґ–µ —Н–Ї—Б—В—А–∞–Ї—А–∞–љ–Є–∞–ї—М–љ—Л–µ –Њ—В–і–µ–ї—Л —Б–Њ–љ–љ—Л—Е –Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ—Л—Е –∞—А—В–µ—А–Є–є –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Њ—З–µ—В–∞–љ–Є—П—Е. –°–љ–Є–ґ–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –њ–µ—А—Д–Њ—А–Є—А—Г—О—Й–Є—Е –∞—А—В–µ—А–Є—П—Е —П–≤–ї—П–µ—В—Б—П –≤—В–Њ—А–Є—З–љ—Л–Љ. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б—В–∞–і–Є–Є –Ф–≠ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 3.
–Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–Њ–≥—Г—В —А–∞–Ј–≤–Є–≤–∞—В—М—Б—П –Є –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–Њ–є –∞—А–Є—В–Љ–Є–Є. –Ф–∞–ґ–µ –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–∞—А—Г—И–µ–љ–Є–µ —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Б–µ—А—М–µ–Ј–љ–Њ–µ –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Є—Б—В–µ–Љ–љ—Г—О –Є —Ж–µ—А–µ–±—А–∞–ї—М–љ—Г—О –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є–Ї—Г, –≤—Л–Ј—Л–≤–∞—П –Є–ї–Є —Г—Б—Г–≥—Г–±–ї—П—П –Є–Љ–µ—О—Й—Г—О—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –Є —Г—Б–Ї–Њ—А—П—П —А–∞–Ј–≤–Є—В–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е –Є –Є–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є. –Я–Њ—Н—В–Њ–Љ—Г –∞–і–µ–Ї–≤–∞—В–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Є–ї–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–∞—П –Ї–Њ—А—А–µ–Ї—Ж–Є—П –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ –≤—Б–µ–≥–і–∞ –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –≤ —З–Є—Б–ї–µ –≤–∞–ґ–љ—Л—Е –≤–Њ–њ—А–Њ—Б–Њ–≤ –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Н—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є.
–Х—Й–µ –Њ–і–Є–љ –≤–∞–ґ–љ—Л–є –Є —З–∞—Б—В–Њ —Г–њ—Г—Б–Ї–∞–µ–Љ—Л–є –њ—А–Є –≤–µ–і–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ш–Ь –≤–Њ–њ—А–Њ—Б – –≤–µ–љ–Њ–Ј–љ–∞—П —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П. –Х–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Б—Г–±—Б—В—А–∞—В–Њ–Љ –Њ–±—Л—З–љ–Њ —П–≤–ї—П–µ—В—Б—П –і–ї–Є—В–µ–ї—М–љ—Л–є –≤–µ–љ–Њ–Ј–љ—Л–є –Ј–∞—Б—В–Њ–є –≤ –Љ–Њ–Ј–≥–µ –≤—Б–ї–µ–і—Б—В–≤–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–Є—З–Є–љ: —Б–µ—А–і–µ—З–љ–Њ–є –Є–ї–Є —Б–µ—А–і–µ—З–љ–Њ-–ї–µ–≥–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, —Б–і–∞–≤–ї–µ–љ–Є—П –≤–љ–µ—З–µ—А–µ–њ–љ—Л—Е –≤–µ–љ –≤ –Њ–±–ї–∞—Б—В–Є —И–µ–Є (–љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є —Б–Є–љ–і—А–Њ–Љ–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –±–ї–Њ–Ї–∞ –≤–µ—А—Е–љ–µ–є –∞–њ–µ—А—В—Г—А—Л –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є), –і–Є—Б—В–Њ–љ–Є–Є –Є –≥–Є–њ–Њ—В–Њ–љ–Є–Є –Љ–Њ–Ј–≥–Њ–≤—Л—Е –≤–µ–љ. –•–∞—А–∞–Ї—В–µ—А–љ—Л–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –≤–µ–љ–Њ–Ј–љ–Њ–є —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є —П–≤–ї—П—О—В—Б—П:
1) —Г—В—А–µ–љ–љ–Є–µ –Є –љ–Њ—З–љ—Л–µ —А–∞—Б–њ–Є—А–∞—О—Й–Є–µ –≥–Њ–ї–Њ–≤–љ—Л–µ –±–Њ–ї–Є;
2) –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Њ–љ–љ—Л–є (–њ—Б–µ–≤–і–Њ—В—Г–Љ–Њ—А–Њ–Ј–љ—Л–є) —Б–Є–љ–і—А–Њ–Љ;
3) —Б–Є–љ–і—А–Њ–Љ —А–∞—Б—Б–µ—П–љ–љ–Њ–≥–Њ –Љ–µ–ї–Ї–Њ–Њ—З–∞–≥–Њ–≤–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Љ–Њ–Ј–≥–∞;
4) –∞—Б—В–µ–љ–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ;
5) –±–µ—В—В–Њ–ї–µ–њ—Б–Є—П.
–С–µ–Ј –≤—Л—П–≤–ї–µ–љ–Є—П –Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –•–Ш–Ь —А–∞—Б—Б—З–Є—В—Л–≤–∞—В—М –љ–∞ –µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –љ–µ –њ—А–Є—Е–Њ–і–Є—В—Б—П, —В. –Ї. –≤—Л—Б–Њ–Ї–Є–є —Г–і–µ–ї—М–љ—Л–є –Є–Љ–њ–µ–і–∞–љ—Б —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –љ–µ —В–Њ–ї—М–Ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–µ—В –њ–µ—А—Д—Г–Ј–Є—О –≤–µ—Й–µ—Б—В–≤–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –љ–Њ –Є –њ–Њ–≤—Л—И–∞–µ—В –≤–љ—Г—В—А–Є—Б–Њ—Б—Г–і–Є—Б—В–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ, –≤ —В. —З. –Є –љ–∞ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ–Њ–Љ —Г—А–Њ–≤–љ–µ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П —А–∞–Ј–≤–Є—В–Є—О –Њ—В–µ–Ї–∞ –Є —Г—Б—Г–≥—Г–±–ї–µ–љ–Є—О –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—В–Њ—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є.
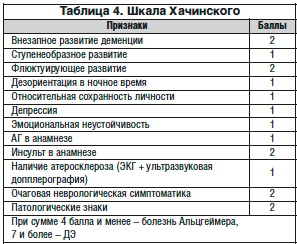
–°–ї–Њ–ґ–љ—Л–Љ–Є –≤–Њ–њ—А–Њ—Б–∞–Љ–Є –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ш–Ь —П–≤–ї—П—О—В—Б—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞. –Т –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –і–ї—П –≤—Л–±–Њ—А–∞ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є —В–∞–Ї—В–Є–Ї–Є –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М –≤–µ–і—Г—Й–Є–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Є —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ —Г –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞. –Ґ–∞–Ї–ґ–µ –≤–µ—Б—М–Љ–∞ –≤–∞–ґ–љ–∞ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —Б—Е–Њ–і–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є – –љ–∞–њ—А–Є–Љ–µ—А, —Б –±–Њ–ї–µ–Ј–љ—М—О –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Є –±–Њ–ї–µ–Ј–љ—М—О –Я–Є–Ї–∞. –Ф–ї—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є —Н—В–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Ї–∞–Ї —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Г—О —И–Ї–∞–ї—Г –•–∞—З–Є–љ—Б–Ї–Њ–≥–Њ (—В–∞–±–ї. 4), —В–∞–Ї –Є —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –Љ–µ—В–Њ–і—Л –љ–µ–є—А–Њ–≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ—Г—О –Є –њ–Њ–Ј–Є—В—А–Њ–љ–љ–Њ-—Н–Љ–Є—Б—Б–Є–Њ–љ–љ—Г—О —В–Њ–Љ–Њ–≥—А–∞—Д–Є—О.
–Ю—Б–љ–Њ–≤–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –•–Ш–Ь —П–≤–ї—П–µ—В—Б—П –∞–і–µ–Ї–≤–∞—В–љ—Л–є –њ–Њ–і–±–Њ—А –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П, «–њ–µ—А–µ–Ї—А—Л–≤–∞—О—Й–Є—Е» –≤—Б–µ –Њ—Б–љ–Њ–≤–љ—Л–µ —Н–ї–µ–Љ–µ–љ—В—Л –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞. –Ю—Б–љ–Њ–≤–љ—Л–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 5.
–£ –±–Њ–ї—М–љ—Л—Е —Б –њ—А–µ–Њ–±–ї–∞–і–∞—О—Й–Є–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –Р–У –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ф–≠ –≤–∞–ґ–љ–µ–є—И—Г—О —А–Њ–ї—М –Є–≥—А–∞–µ—В –Ї–Њ–љ—В—А–Њ–ї—М –Р–Ф. –£ –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ґ–Ш–Р –Є–ї–Є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Є–љ—Б—Г–ї—М—В, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Б—В—А–µ–Љ–Є—В—М—Б—П –Ї —Ж–µ–ї–µ–≤–Њ–Љ—Г –Р–Ф 130/80 –Љ–Љ —А—В. —Б—В. –Є –Љ–µ–љ–µ–µ. –Ф–ї—П –µ–≥–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Р–Ф —Б–ї–µ–і—Г–µ—В —Б–љ–Є–ґ–∞—В—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Н—В–∞–њ–љ–Њ–є —Б—Е–µ–Љ—Л, —Г—З–Є—В—Л–≤–∞—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Г—О –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Є –Є–Ј–±–µ–≥–∞—П —Н–њ–Є–Ј–Њ–і–Њ–≤ –≥–Є–њ–Њ—В–Њ–љ–Є–Є. –Я—А–Є —Н—В–Њ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ –≤–Њ–Ј—А–∞—Б—В–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Њ–њ—В–Є–Љ–∞–ї—М–љ–∞—П –≤–µ–ї–Є—З–Є–љ–∞ —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –Р–Ф –і–ї—П –њ–Њ–ґ–Є–ї—Л—Е –Њ–±—Л—З–љ–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 135–150 –Љ–Љ —А—В. —Б—В. («—А–∞–±–Њ—З–µ–µ» –і–∞–≤–ї–µ–љ–Є–µ), –і–∞–ї—М–љ–µ–є—И–µ–µ –µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –≤–µ–і–µ—В –Ї —Г—Б—Г–≥—Г–±–ї–µ–љ–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Ф–≠ –Є –њ–Њ–≤—Л—И–µ–љ–Є—О —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ю–Э–Ь–Ъ. –Ю—Б–Њ–±–µ–љ–љ–Њ –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ —Б–ї–µ–і—Г–µ—В —Б–љ–Є–ґ–∞—В—М –Р–Ф —Г –±–Њ–ї—М–љ—Л—Е —Б –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ —Б–Њ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є. –Ґ–∞–Ї–ґ–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М –Р–Ф –≤ –љ–Њ—З–љ—Л–µ —З–∞—Б—Л (—Б—Г—В–Њ—З–љ—Л–є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥), —В. –Ї. —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б—Г—В–Њ—З–љ—Л–Љ —А–Є—В–Љ–Њ–Љ —В–Є–њ–∞ «over-dipper» –Є –≤—Л—Б–Њ–Ї–Є–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –Є–љ–і–µ–Ї—Б–∞ «–і–µ–љ—М – –љ–Њ—З—М» –Є–Љ–µ–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –љ–∞—А—Г—И–µ–љ–Є–є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞. –Р–і–µ–Ї–≤–∞—В–љ–∞—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–Ј–Є—В—М —А–Є—Б–Ї –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Б–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П PROGRESS, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –њ—А–Є–µ–Љ –њ–µ—А–Є–љ–і–Њ–њ—А–Є–ї–∞ 4 –Љ–≥ 1 —А./—Б—Г—В –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–љ–Є–Ј–Є—В—М —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≤—Б–µ—Е –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –љ–∞ 45%, –і–µ–Љ–µ–љ—Ж–Є–Є – –љ–∞ 30%.

–Т —Б–ї—Г—З–∞–µ –µ—Б–ї–Є —Г –±–Њ–ї—М–љ–Њ–≥–Њ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –Љ–µ—А—Ж–∞—В–µ–ї—М–љ–∞—П –∞—А–Є—В–Љ–Є—П, —В–Њ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Н–Љ–±–Њ–ї–Є–Ј–∞—Ж–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤–∞—А—Д–∞—А–Є–љ–∞ –њ–Њ–і –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–≥–Њ –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ –Њ—В–љ–Њ—И–µ–љ–Є—П, –і–∞–±–Є–≥–∞—В—А–∞–љ–∞ —Н—В–µ–Ї—Б–Є–ї–∞—В–∞ –Є–ї–Є –Р–°–Ъ. –Я—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –≤–∞—А—Д–∞—А–Є–љ–∞ –Є–ї–Є –і–∞–±–Є–≥–∞—В—А–∞–љ–∞ —Н—В–µ–Ї—Б–Є–ї–∞—В–∞ –Є –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є–ї–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–°–Ъ –≤ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј–∞—Е –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ–Є –Ј–∞–Љ–µ–љ–∞–Љ–Є –Љ–Њ–≥—Г—В –±—Л—В—М —Б–Њ—З–µ—В–∞–љ–Є–µ –Р–°–Ъ (25 –Љ–≥) –Є –і–Є–њ–Є—А–Є–і–∞–Љ–Њ–ї–∞ (200 –Љ–≥) 2 —А./—Б—Г—В, –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї (75 –Љ–≥/—Б—Г—В) –Є–ї–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –і–Є–њ–Є—А–Є–і–∞–Љ–Њ–ї–Њ–Љ (200 –Љ–≥ 2 —А./—Б—Г—В). –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Р–°–Ъ —Б –і–Є–њ–Є—А–Є–і–∞–Љ–Њ–ї–Њ–Љ –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П –≥–Њ–ї–Њ–≤–љ–Њ–є –±–Њ–ї—М—О, —З—В–Њ –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ –≤–ї–Є—П–µ—В –љ–∞ –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М. –Ґ–∞–Ї–ґ–µ —Б –±–Њ–ї—М—И–Њ–є –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М—О –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–љ–Њ—Б–Є—В—М—Б—П –Ї –µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ —Б—В–µ–љ–Њ–Ї–∞—А–і–Є–µ–є –љ–∞–њ—А—П–ґ–µ–љ–Є—П –Є –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ —В—П–ґ–µ–ї—Л–Љ —Б—В–µ–љ–Њ–Ј–Њ–Љ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є –Є–Ј-–Ј–∞ —А–Є—Б–Ї–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Т–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л—Е —Б—Е–µ–Љ –ї–µ—З–µ–љ–Є—П —В—А–µ–±—Г–µ—В –±–Њ–ї–µ–µ —З–∞—Б—В–Њ–≥–Њ (–≤ —В. —З. –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ) –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞.
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –Ф–≠ –љ–∞ –њ–µ—А–≤–Њ–µ –Љ–µ—Б—В–Њ –≤—Л—Е–Њ–і–Є—В —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞. –Х—Б–ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–Њ–є –Ф–≠ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—П, –∞ –њ–Њ –і–∞–љ–љ—Л–Љ —Ж–≤–µ—В–Њ–≤–Њ–≥–Њ –і—Г–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ —Б–Ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –Є–ї–Є –Љ—Г–ї—М—В–Є—Б–њ–Є—А–∞–ї—М–љ–Њ–є –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є –Є–Љ–µ–µ—В—Б—П —Е–Њ—В—П –±—Л –Њ–і–љ–∞ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–∞—П –±–ї—П—И–Ї–∞ –≤ –Љ–∞–≥–Є—Б—В—А–∞–ї—М–љ—Л—Е –∞—А—В–µ—А–Є—П—Е –≥–Њ–ї–Њ–≤—Л –Є —И–µ–Є, —В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ—Б—В–∞–≤–ї–µ–љ –≤–Њ–њ—А–Њ—Б –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Б—В–∞—В–Є–љ–Њ–≤, –љ–∞–њ—А–Є–Љ–µ—А, –∞—В–Њ—А–≤–∞—Б—В–∞—В–Є–љ–∞ –≤ –Љ–∞–ї–Њ–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –і–Њ–Ј–µ 10 –Љ–≥/—Б—Г—В. –Я—А–Є —А–µ—И–µ–љ–Є–Є —Н—В–Њ–≥–Њ –≤–Њ–њ—А–Њ—Б–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —А—П–і —Д–∞–Ї—В–Њ—А–Њ–≤, –≤ —В. —З. —Г—А–Њ–≤–µ–љ—М —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, –≥–µ–Љ–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї—Г—О –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –±–ї—П—И–Ї–Є (–њ—А–Њ—Ж–µ–љ—В —Б—В–µ–љ–Њ–Ј–∞), –µ–µ —В–Є–њ (I–III —В–Є–њ—Л –њ–Њ Gray-Weale —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Є), —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й—Г—О –њ–∞—В–Њ–ї–Њ–≥–Є—О (–њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О —П–≤–ї—П—О—В—Б—П –∞–Ї—В–Є–≤–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –њ–µ—З–µ–љ–Є, —В—П–ґ–µ–ї–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј –Є –і—А.). –°–љ–Є–ґ–µ–љ–Є–µ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –ї–µ—З–µ–љ–Є—П —Б—В–∞—В–Є–љ–∞–Љ–Є —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–Њ–≤ –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –љ–∞ 1,0 –Љ–Љ–Њ–ї—М/–ї –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї —Б–љ–Є–ґ–µ–љ–Є—О —А–Є—Б–Ї–∞ –≤—Б–µ—Е –Є–љ—Б—Г–ї—М—В–Њ–≤ –љ–∞ 10%, –∞ –љ–∞ 1,8 –Љ–Љ–Њ–ї—М/–ї – –љ–∞ 17%.
–Т —Б–ї—Г—З–∞–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є—П –Љ–Њ–ґ–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –±–µ—В–∞–≥–Є—Б—В–Є–љ 24 –Љ–≥/—Б—Г—В. –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–Љ–µ–љ—М—И–Є—В—М –≤—Л–Ј—Л–≤–∞–µ–Љ—Л–µ –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ–Љ –љ–∞—А—Г—И–µ–љ–Є—П –њ–Њ—Е–Њ–і–Ї–Є, —Б–љ–Є–Ј–Є—В—М —А–Є—Б–Ї —В—А–∞–≤–Љ–∞—В–Є–Ј–∞—Ж–Є–Є –Є –Њ–±–ї–µ–≥—З–Є—В—М —Б–Њ—Ж–Є–∞–ї—М–љ—Г—О –∞–і–∞–њ—В–∞—Ж–Є—О –њ–∞—Ж–Є–µ–љ—В–∞.
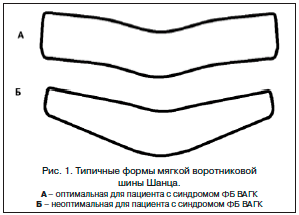
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ—А–µ–Њ–±–ї–∞–і–∞—О—Й–Є–Љ –≤–µ–љ–Њ–Ј–љ—Л–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–Њ–Љ —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–Є, –∞ —В–∞–Ї–ґ–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ —Н–ї–µ–Љ–µ–љ—В–∞ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –і—А—Г–≥–Є—Е —Д–Њ—А–Љ –Ф–≠ –Љ–Њ–ґ–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е –≤–µ–љ–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ–∞—Ж–Є–µ–љ—В—Г —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –љ–Њ—И–µ–љ–Є–µ –Љ—П–≥–Ї–Њ–є –≤–Њ—А–Њ—В–љ–Є–Ї–Њ–≤–Њ–є —И–Є–љ—Л –®–∞–љ—Ж–∞ (—А–Є—Б. 1) –і–ї—П —А–∞–Ј–≥—А—Г–Ј–Ї–Є –Љ—Л—И—Ж –њ–ї–µ—З–µ–≤–Њ–≥–Њ –њ–Њ—П—Б–∞ –Є —И–µ–Є, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О —Н–Ї—Б—В—А–∞–≤–∞–Ј–∞–ї—М–љ–Њ–є –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Є –≤–µ–љ. –Я–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В –і–Њ–ї–ґ–µ–љ –±—Л—В—М –њ—А–Њ–Ї–Њ–љ—Б—Г–ї—М—В–Є—А–Њ–≤–∞–љ –Љ–∞–љ—Г–∞–ї—М–љ—Л–Љ —В–µ—А–∞–њ–µ–≤—В–Њ–Љ (–Њ—Б—В–µ–Њ–њ–∞—В–Њ–Љ) –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —Б–Є–љ–і—А–Њ–Љ–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –±–ї–Њ–Ї–∞ –≤–µ—А—Е–љ–µ–є –∞–њ–µ—А—В—Г—А—Л –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є [15].
–°–ї–µ–і—Г—О—Й–Є–Љ –≤–∞–ґ–љ—Л–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ш–Ь —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–µ–є—А–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Є –≤–∞–Ј–Њ–∞–Ї—В–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ъ –Є—Е —З–Є—Б–ї—Г –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П (–Э–µ–є—А–Њ–Ї—Б), –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ–є—А–Њ—В—А–Њ–њ–љ—Л–µ (–¶–µ—А–µ—В–Њ–љ), –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–ї–Є—П—О—Й–Є–µ –љ–∞ –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Ї—А–Њ–≤–Њ—В–Њ–Ї (—Ж–Є–љ–љ–∞—А–Є–Ј–Є–љ, –љ–Є—Ж–µ—А–≥–Њ–ї–Є–љ, –Ї—Б–∞–љ—В–Є–љ–Њ–ї–∞ –љ–Є–Ї–Њ—В–Є–љ–∞—В), —Г–ї—Г—З—И–∞—О—Й–Є–µ –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—О (–њ–µ–љ—В–Њ–Ї—Б–Є—Д–Є–ї–ї–Є–љ), –Њ–±–ї–∞–і–∞—О—Й–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ–є—А–Њ—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ.
–Э–µ–є—А–Њ–Ї—Б —П–≤–ї—П–µ—В—Б—П –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–Њ–Љ, –Њ–і–љ–∞–Ї–Њ —В–∞–Ї–ґ–µ –Њ–±–ї–∞–і–∞–µ—В –∞–љ—В–Є–≥–Є–њ–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ, –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ—Л–Љ –Є –Љ–µ–Љ–±—А–∞–љ–Њ—Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Њ—В—З–µ—В–ї–Є–≤–Њ–µ –Ї–Њ—А—А–Є–≥–Є—А—Г—О—Й–µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –љ–∞—А—Г—И–µ–љ–љ—Л–µ –њ—А–Є —Б—В–∞—А–µ–љ–Є–Є –њ—А–Њ—Ж–µ—Б—Б—Л –Њ–±—Г—З–µ–љ–Є—П –Є –њ–∞–Љ—П—В–Є, —Г–ї—Г—З—И–∞—П –њ—А–Њ—Ж–µ—Б—Б —Д–Є–Ї—Б–∞—Ж–Є–Є, —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –Є –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Є—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є; —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞; —Г–Љ–µ–љ—М—И–∞–µ—В –њ—А–Њ—П–≤–ї–µ–љ–Є—П –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞; —Б–љ–Є–ґ–∞–µ—В –≤ –Љ–Њ–Ј–≥–µ –Є –Ї—А–Њ–≤–Є —Г—А–Њ–≤–љ–Є –Љ–∞—А–Ї–µ—А–Њ–≤ —Б—В–∞—А–µ–љ–Є—П. –Ь–µ—Е–∞–љ–Є–Ј–Љ –≥–µ—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ —Б–≤—П–Ј–∞–љ —Б –µ–≥–Њ –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, –њ—А—П–Љ—Л–Љ –Љ–µ–Љ–±—А–∞–љ–Њ—В—А–Њ–њ–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М –њ—А–Њ—Ж–µ—Б—Б—Л –њ–µ—А–µ–Ї–Є—Б–љ–Њ–≥–Њ –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ї–Є–њ–Є–і–Њ–≤, –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—В—М —Г–ї—М—В—А–∞—Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≥—А–∞–љ—Г–ї—П—А–љ–Њ–є —Н–љ–і–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —Б–µ—В–Є –Є –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є, –Љ–Њ–і—Г–ї–Є—А–Њ–≤–∞—В—М —А–∞–±–Њ—В—Г —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ [5–7]. –Э–Њ–Њ—В—А–Њ–њ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –Э–µ–є—А–Њ–Ї—Б–∞ –≤—Л—А–∞–ґ–∞—О—В—Б—П –≤ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Г–ї—Г—З—И–∞—В—М –њ—А–Њ—Ж–µ—Б—Б—Л –Њ–±—Г—З–µ–љ–Є—П –Є –њ–∞–Љ—П—В–Є, –њ—А–Њ—В–Є–≤–Њ–і–µ–є—Б—В–≤–Њ–≤–∞—В—М —Г–≥–∞—Б–∞–љ–Є—О –њ—А–Є–≤–Є—В—Л—Е –љ–∞–≤—Л–Ї–Њ–≤ –Є —А–µ—Д–ї–µ–Ї—Б–Њ–≤ [8, 9]. –Я—А–µ–њ–∞—А–∞—В –Њ—В–ї–Є—З–∞–µ—В—Б—П —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –Є –Љ–Њ–ґ–µ—В –±—Л—В—М —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –≤ –Ї–∞—З–µ—Б—В–≤–µ —Н–ї–µ–Љ–µ–љ—В–∞ –±–∞–Ј–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ш–Ь, –≤ —В. —З. –Є —Б—В–∞—А—И–µ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ—Л. –Ю–њ—В–Є–Љ–∞–ї—М–љ–∞—П —Б—Е–µ–Љ–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–Є –•–Ш–Ь –±–µ–Ј –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є – –Ї—Г—А—Б–Њ–≤–Њ–µ –ї–µ—З–µ–љ–Є–µ 100 –Љ–≥ 2 —А./—Б—Г—В –≤/–Љ –≤ —В–µ—З–µ–љ–Є–µ 10–14 –і–љ–µ–є. –Я—А–Є –ї–µ–≥–Ї–Є—Е –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є—П—Е —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Є –њ—А–Є —В—А–µ–≤–Њ–ґ–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞—Е – 100–300 –Љ–≥/—Б—Г—В –≤/–Љ –≤ —В–µ—З–µ–љ–Є–µ 14–30 –і–љ–µ–є.
–Т –Ї–∞—З–µ—Б—В–≤–µ –љ–Њ–Њ—В—А–Њ–њ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Љ–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М –¶–µ—А–µ—В–Њ–љ, —Е–Њ—А–Њ—И–Њ –Ј–∞—А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–≤—И–Є–є —Б–µ–±—П –≤ –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ —В–Њ–ї—М–Ї–Њ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є, –љ–Њ –Є —Б –Њ—Б—В—А–Њ–є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞. –Я–Њ –љ–∞—И–Є–Љ –і–∞–љ–љ—Л–Љ [10], —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Є–љ—Б—Г–ї—М—В, –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –¶–µ—А–µ—В–Њ–љ–∞ —Б 1-–≥–Њ –і–љ—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –і–Њ—Б—В–Є—З—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Г–ї—Г—З—И–µ–љ–Є—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є. –Ґ–∞–Ї, —Б 16-–≥–Њ –і–љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ—Л –Њ—В–Љ–µ—З–µ–љ–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є, —Б–Њ–≥–ї–∞—Б–љ–Њ —И–Ї–∞–ї–µ MMSE, –Є–Љ–µ—О—Й–µ–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ (—А<0,05) –Њ—В–ї–Є—З–Є–µ –Њ—В —В–∞–Ї–Њ–≤–Њ–≥–Њ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ. –Ґ–∞–Ї–∞—П –ґ–µ –і–Є–љ–∞–Љ–Є–Ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –Є –њ—А–Є –Є–Ј–Љ–µ—А–µ–љ–Є–Є –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –ґ–Є–Ј–љ–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–∞—З–Є–љ–∞—П —Б 30-–≥–Њ –і–љ—П –±–Њ–ї–µ–Ј–љ–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –¶–µ—А–µ—В–Њ–љ–∞ –Њ–Ї–∞–Ј–∞–ї–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Њ–љ–љ—Л–є –њ—А–Њ–≥–љ–Њ–Ј –Є –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –•–Њ—А–Њ—И–Є–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Н—В–Њ–є –≥—А—Г–њ–њ—Л –±—Л–ї–Њ —Б–Њ—З–µ—В–∞–љ–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –¶–µ—А–µ—В–Њ–љ–∞ –Є –Э–µ–є—А–Њ–Ї—Б–∞, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–ї–Њ —Б—Г–Љ–Љ–Є—А–Њ–≤–∞—В—М –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є. –Э–∞–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї–∞—Б—М —Б—Е–µ–Љ–∞ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –¶–µ—А–µ—В–Њ–љ–Њ–Љ –≤ –і–Њ–Ј–µ 1000 –Љ–≥ –Є –Э–µ–є—А–Њ–Ї—Б–Њ–Љ –≤ –і–Њ–Ј–µ 250 –Љ–≥ –≤ —В–µ—З–µ–љ–Є–µ 14 –і–љ–µ–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–µ–≥–Ї–Є–Љ –Є —Б—А–µ–і–љ–µ—В—П–ґ–µ–ї—Л–Љ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 30 –і–љ–µ–є. –Я–Њ–Ї–∞–Ј–∞–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ (p<0,05) –≤–ї–Є—П–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ —Б—В–µ–њ–µ–љ—М –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Г—О —В–µ—А–∞–њ–Є—О –Ї 30-–Љ—Г –і–љ—О –љ–∞–±–ї—О–і–µ–љ–Є—П. –Т—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ (p<0,05) –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ —А–µ–≥—А–µ—Б—Б–∞ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–µ—А–µ–љ–Њ—Б—П—Й–Є—Е –ї–∞–Ї—Г–љ–∞—А–љ—Л–є –Є–љ—Б—Г–ї—М—В –Є –Є–љ—Б—Г–ї—М—В –њ–Њ —В–Є–њ—Г –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Ї—А—Г–њ–љ—Л—Е –∞—А—В–µ—А–Є–є. –Т –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –Њ–Ї–∞–Ј–∞–ї–∞ –≤–ї–Є—П–љ–Є–µ –љ–∞ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї 30-–Љ—Г –і–љ—О –љ–∞–±–ї—О–і–µ–љ–Є—П, –љ–µ –і–Њ—Б—В–Є–≥–љ—Г–≤ —Б—В–µ–њ–µ–љ–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є. –Ю–і–љ–∞–Ї–Њ –≤—Л—П–≤–ї–µ–љ–љ–∞—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П —В–µ–љ–і–µ–љ—Ж–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞—В—М –њ–Њ–ї—Г—З–µ–љ–Є–µ –ї—Г—З—И–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –љ–∞ —Д–Њ–љ–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –≤ —А–∞–љ–љ–µ–Љ —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ [11].
–Я—А–Є –ї–µ—З–µ–љ–Є–Є –•–Ш–Ь –≤–Њ–Ј–Љ–Њ–ґ–љ—Л —А–∞–Ј–ї–Є—З–љ—Л–µ —Б—Е–µ–Љ—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –¶–µ—А–µ—В–Њ–љ–∞. –Ю–љ –Љ–Њ–ґ–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ –µ–ґ–µ–і–љ–µ–≤–љ–Њ –≤ –і–Њ–Ј–µ 1000 –Љ–≥/—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 15 –і–љ–µ–є –≤/–≤ –Ї–∞–њ–µ–ї—М–љ–Њ. –Ь–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –Є –≤/–≤ –Ї–∞–њ–µ–ї—М–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –¶–µ—А–µ—В–Њ–љ–∞ 1000 –Љ–≥ – 4 –Љ–ї –љ–∞ 200 –Љ–ї —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –≤ —В–µ—З–µ–љ–Є–µ 5 –і–љ–µ–є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –њ–µ—А–µ—Е–Њ–і–Њ–Љ –љ–∞ –≤/–Љ –≤–≤–µ–і–µ–љ–Є–µ –≤ —В–Њ–є –ґ–µ –і–Њ–Ј–µ –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є [12]. –Ґ–∞–Ї–ґ–µ –њ—А–Є –•–Ш–Ь –Є —Б–Є–љ–і—А–Њ–Љ–∞—Е –і–µ–Љ–µ–љ—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В –Љ–Њ–ґ–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П –≤–љ—Г—В—А—М –њ–Њ 400 –Љ–≥ (1 –Ї–∞–њ—Б.) 3 —А./—Б—Г—В, –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–Њ –њ–Њ—Б–ї–µ –µ–і—Л, –≤ —В–µ—З–µ–љ–Є–µ 3–6 –Љ–µ—Б.
–¶–µ–ї—М—О –Њ–і–љ–Њ–≥–Њ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Р.–Т. –°–Њ–ї–Њ–≤—М–µ–≤–Њ–є –Є —Б–Њ–∞–≤—В. –≤ 2009 –≥., –±—Л–ї–Њ –Є–Ј—Г—З–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –¶–µ—А–µ—В–Њ–љ–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Б –•–Ш–Ь. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є –њ—А–µ–њ–∞—А–∞—В –≤ —В–µ—З–µ–љ–Є–µ 15 –і–љ–µ–є –њ–Њ 1000 –Љ–≥ –њ—Г—В–µ–Љ –≤/–≤ –Є–љ—Д—Г–Ј–Є–є. –С–Њ–ї–µ–µ –њ–Њ–ї–Њ–≤–Є–љ—Л –±–Њ–ї—М–љ—Л—Е –њ–Њ–ї—Г—З–∞–ї–Є —В–Њ–ї—М–Ї–Њ –¶–µ—А–µ—В–Њ–љ, –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –љ–∞–Ј–љ–∞—З–∞–ї–∞—Б—М –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П. –Я—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ —З–µ—А–µ–Ј 1 –Љ–µ—Б. –њ–Њ–≤—В–Њ—А–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –Є–Ј –љ–Є—Е —Г–ї—Г—З—И–Є–ї–Њ—Б—М: —Г–Љ–µ–љ—М—И–Є–ї–Є—Б—М –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М (63%), –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ (43%) –Є —Г–ї—Г—З—И–Є–ї–∞—Б—М –њ–∞–Љ—П—В—М (56%). –Ш–Ј—Г—З–∞–ї–Є—Б—М –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ –Є –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ. –£—А–Њ–≤–µ–љ—М –∞–љ—В–Є—В–µ–ї –Ї –Њ—Б–љ–Њ–≤–љ–Њ–Љ—Г –±–µ–ї–Ї—Г –Љ–Є–µ–ї–Є–љ–∞ –і–Њ –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї 0,359±0,05 –µ–і. –Ю–Я, –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П – 0,21±0,04 –µ–і. –Ю–Я (—А<0,05) [13].
–Ю—Б–Њ–±–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П –Ј–∞—Б–ї—Г–ґ–Є–≤–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Э–µ–є—А–Њ–Ї—Б–∞ –Є –¶–µ—А–µ—В–Њ–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ш–Ь. –°–Њ—З–µ—В–∞–љ–Є–µ –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–≥–Њ, –∞–љ—В–Є–≥–Є–њ–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ, –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–љ–Њ–≥–Њ, –Љ–µ–Љ–±—А–∞–љ–Њ—Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–Њ–≤ –Э–µ–є—А–Њ–Ї—Б–∞ —Б –љ–µ–є—А–Њ–Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –¶–µ—А–µ—В–Њ–љ–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ «–њ–µ—А–µ–Ї—А—Л—В—М» –Њ—Б–љ–Њ–≤–љ—Л–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —А–∞–Ј–≤–Є—В–Є—П –≤—Б–µ—Е —Д–Њ—А–Љ –Ф–≠ [14].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –•–Ш–Ь –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–±–µ—Б–њ–µ—З–Є—В—М –≤—Л–±–Њ—А –∞–і–µ–Ї–≤–∞—В–љ–Њ–є —В–∞–Ї—В–Є–Ї–Є –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ–Њ–≥–Њ, –њ–Њ–і–±–Њ—А –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Њ—Е–≤–∞—В—Л–≤–∞—О—Й–µ–є –≤–µ—Б—М —Б–њ–µ–Ї—В—А –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –°–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–µ –љ–∞—З–∞–ї–Њ –ї–µ—З–µ–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–µ —В–Њ–ї—М–Ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–ї—Г—З—И–Є—В—М –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–∞, –љ–Њ –Є –њ—А–Њ–і–ї–Є—В—М –њ–µ—А–Є–Њ–і –µ–≥–Њ —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є.











