–Т–≤–µ–і–µ–љ–Є–µ
–Я—А–µ—Н–Ї–ї–∞–Љ–њ—Б–Є—П (–Я–≠) –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В –Њ—Б—В–∞–≤–∞—В—М—Б—П –Њ–і–љ–Њ–є –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л—Е –њ—А–Њ–±–ї–µ–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –∞–Ї—Г—И–µ—А—Б—В–≤–∞, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Ј–∞–љ–Є–Љ–∞–µ—В –Њ–і–љ–Њ –Є–Ј –≤–µ–і—Г—Й–Є—Е –Љ–µ—Б—В —Б—А–µ–і–Є –њ—А–Є—З–Є–љ –Љ–∞—В–µ—А–Є–љ—Б–Ї–Њ–є –Є –њ–µ—А–Є–љ–∞—В–∞–ї—М–љ–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є [1]. –Т –†–Њ—Б—Б–Є–Є –Я–≠ –Ј–∞–љ–Є–Љ–∞–µ—В 3-–µ –Љ–µ—Б—В–Њ –≤ —Б—В—А—Г–Ї—В—Г—А–µ –њ—А–Є—З–Є–љ –Љ–∞—В–µ—А–Є–љ—Б–Ї–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ –†–§ —З–∞—Б—В–Њ—В–∞ —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ —А–Њ–і–∞ –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –њ—А–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –і–Њ—Б—В–Є–≥–∞–µ—В 30% [2]. –І–∞—Б—В–Њ—В–∞ –Я–≠ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤ —Б—А–µ–і–љ–µ–Љ 11,7% –Є –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 5 –ї–µ—В –≤ –†–§ –Є–Љ–µ–µ—В —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —А–Њ—Б—В—Г, –њ—А–Є —Н—В–Њ–Љ –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л —В—П–ґ–µ–ї—Л—Е —Д–Њ—А–Љ –Я–≠.
–Я—А–µ—Н–Ї–ї–∞–Љ–њ—Б–Є—П –љ–µ—А–∞–Ј—А—Л–≤–љ–Њ —Б–≤—П–Ј–∞–љ–∞ —Б –њ–ї–∞—Ж–µ–љ—В–∞—А–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О, –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–µ–є –њ–ї–Њ–і–∞, –Ј–∞–і–µ—А–ґ–Ї–Њ–є —А–Њ—Б—В–∞ –њ–ї–Њ–і–∞, —А–∞–Ј–≤–Є—В–Є–µ–Љ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є —Г –Љ–∞—В–µ—А–Є –Є –њ–ї–Њ–і–∞, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –Њ—Б—В—А–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–µ–є –Є –њ—А–µ–ґ–і–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Њ—В—Б–ї–Њ–є–Ї–Њ–є –њ–ї–∞—Ж–µ–љ—В—Л [3]. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –і–∞–ґ–µ –і–Њ—Б—А–Њ—З–љ–Њ–µ —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є–µ –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –њ—А–Є—З–Є–љ–Њ–є –≥–Є–±–µ–ї–Є –Є–ї–Є —В—П–ґ–µ–ї—Л—Е –њ–µ—А–Є–љ–∞—В–∞–ї—М–љ—Л—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є –і–ї—П –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ–Њ–≥–Њ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ–Њ–≥–Њ [4].
–Ф–Њ —Б–Є—Е –њ–Њ—А –љ–µ—В –µ–і–Є–љ–Њ–≥–Њ –Љ–љ–µ–љ–Є—П –њ–Њ –њ–Њ–≤–Њ–і—Г –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л—Е —Б—А–Њ–Ї–Њ–≤ —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Я–≠. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –∞–≤—В–Њ—А—Л –Њ—В—Б—В–∞–Є–≤–∞—О—В —В–∞–Ї—В–Є–Ї—Г –і–Њ—Б—А–Њ—З–љ–Њ–≥–Њ —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є—П –≤–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –Љ–∞—В–µ—А–Є [5]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Б—Г—Й–µ—Б—В–≤—Г–µ—В –Љ–љ–µ–љ–Є–µ –Њ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –≤–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –њ–ї–Њ–і–∞, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –µ–≥–Њ –љ–µ–Ј—А–µ–ї–Њ—Б—В—М—О [6].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–Њ–Љ–Є–љ–Є—А—Г—О—Й–µ–є –Ї–Њ–љ—Ж–µ–њ—Ж–Є–µ–є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Я–≠ —П–≤–ї—П–µ—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Є–љ–≤–∞–Ј–Є–Є —Ж–Є—В–Њ—В—А–Њ—Д–Њ–±–ї–∞—Б—В–∞ —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –Љ–∞—В–Њ—З–љ–Њ-–њ–ї–∞—Ж–µ–љ—В–∞—А–љ—Л—Е –∞—А—В–µ—А–Є–є –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –Є—И–µ–Љ–Є–Є –њ–ї–∞—Ж–µ–љ—В—Л [7, 8]. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ —Ж–µ–ї—Л–є –Ї–∞—Б–Ї–∞–і —Б–Њ–±—Л—В–Є–є –≤ —Ж–µ–њ–Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Я–≠ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О —Б–Є—Б—В–µ–Љ–љ–Њ–є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, –Ї–Њ—В–Њ—А–∞—П –Є —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є [8вАУ16]. –Р–Ї—В—Г–∞–ї—М–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –њ–Њ–Є—Б–Ї –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –Я–≠, —З—В–Њ, –љ–∞—А—П–і—Г —Б –Њ—Ж–µ–љ–Ї–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –±—Л –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ –Є –∞–і–µ–Ї–≤–∞—В–љ–Њ –≤—Л–±–Є—А–∞—В—М –Љ–µ—В–Њ–і –Є —Б—А–Њ–Ї–Є —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є—П.
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ї—А–Є—В–µ—А–Є–µ–≤ –њ—А–Њ–≥–љ–Њ–Ј–∞ —В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –Я–≠ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Њ—Ж–µ–љ–Ї–Є —Н–љ–і–Њ—В–µ–ї–Є–є–Ј–∞–≤–Є—Б–Є–Љ–Њ–є –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є (–≠–Ч–Т–Ф –Я–Р).
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–µ–љ—Л 97 –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б —Г–Љ–µ—А–µ–љ–љ–Њ–є –Я–≠, –Ї–Њ—В–Њ—А—Л–µ –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В—П–ґ–µ—Б—В–Є —В–µ—З–µ–љ–Є—П –Я–≠ –љ–∞ 2 –≥—А—Г–њ–њ—Л: 1-—О –≥—А—Г–њ–њ—Г (n=42, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 30,0¬±0,5 –≥–Њ–і–∞), –≤ –Ї–Њ—В–Њ—А–Њ–є –Я–≠ –њ–µ—А–µ—И–ї–∞ –≤ —В—П–ґ–µ–ї–Њ–µ —В–µ—З–µ–љ–Є–µ, –Є 2-—О –≥—А—Г–њ–њ—Г (n=55, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 31,0¬±0,7 –≥–Њ–і–∞), –Ї–Њ—В–Њ—А—Г—О —Б–Њ—Б—В–∞–≤–Є–ї–Є –±–µ—А–µ–Љ–µ–љ–љ—Л–µ –±–µ–Ј –љ–∞—А–∞—Б—В–∞–љ–Є—П —В—П–ґ–µ—Б—В–Є –Я–≠. –Ф–≤–∞–і—Ж–∞—В—М –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є —Б–Њ—Б—В–∞–≤–Є–ї–Є –Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г (3-—П –≥—А—Г–њ–њ–∞, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В 26,0¬±0,9 –≥–Њ–і–∞).
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П: —Б—А–Њ–Ї –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –±–Њ–ї–µ–µ 28 –љ–µ–і. –≥–µ—Б—В–∞—Ж–Є–Є, —Г–Љ–µ—А–µ–љ–љ–∞—П –Я–≠, –њ–Њ–і–њ–Є—Б–∞–љ–љ–Њ–µ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є.
–Ъ—А–Є—В–µ—А–Є–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П: —В—П–ґ–µ–ї–Њ–µ —В–µ—З–µ–љ–Є–µ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Њ—Б—В—А—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤—А–Њ–ґ–і–µ–љ–љ—Л–µ –∞–љ–Њ–Љ–∞–ї–Є–Є –њ–ї–Њ–і–∞, –Љ–љ–Њ–≥–Њ–њ–ї–Њ–і–љ–∞—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М.
–Т—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –Ї–ї–Є–љ–Є–Ї–Њ-–ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є —В–µ—А–∞–њ–Є—П –Я–≠.
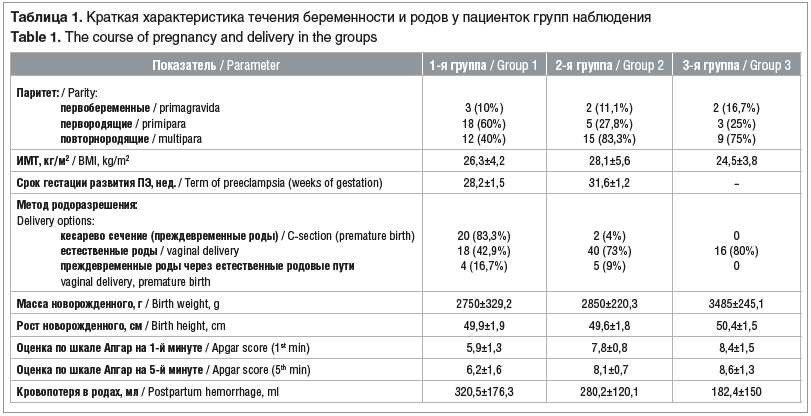
–Я–∞—Ж–Є–µ–љ—В–Ї–Є –≥—А—Г–њ–њ –љ–∞–±–ї—О–і–µ–љ–Є—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –њ–Њ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ—Л–Љ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ. –Ъ—А–∞—В–Ї–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ —В–µ—З–µ–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є —А–Њ–і–Њ–≤ —Г –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –њ–Њ –≥—А—Г–њ–њ–∞–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 1.
–§—Г–љ–Ї—Ж–Є—О —Н–љ–і–Њ—В–µ–ї–Є—П –Є–Ј—Г—З–∞–ї–Є –Љ–µ—В–Њ–і–Њ–Љ –Њ—Ж–µ–љ–Ї–Є –≠–Ч–Т–Ф –Я–Р [6, 17вАУ20], –Ї–Њ—В–Њ—А—Л–є –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Н–љ–і–Њ—В–µ–ї–Є—П –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞—В—М –Њ–Ї—Б–Є–і –∞–Ј–Њ—В–∞ –≤ —Г—Б–ї–Њ–≤–Є—П—Е —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А¬≠–µ–Љ–Є–Є. –Я–Њ—Б–ї–µ–і–љ—П—П –Љ–Њ–і–µ–ї–Є—А—Г–µ—В—Б—П –Љ–∞–љ–ґ–µ—В–Њ—З–љ–Њ–є –Њ–Ї–Ї–ї—О–Ј–Є–µ–є –Я–Р. –Ю—Ж–µ–љ–Ї–∞ –≤–∞–Ј–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є –њ—А–Њ–≤–Њ–і–Є—В—Б—П —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤—Л–Љ —Б–Њ—Б—Г–і–Є—Б—В—Л–Љ –і–∞—В—З–Є–Ї–Њ–Љ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–∞–Ј—А–µ—И–µ–љ–Є—П –њ–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—О –і–Є–∞–Љ–µ—В—А–∞ —Б–Њ—Б—Г–і–∞.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є –љ–∞ –∞–њ–њ–∞—А–∞—В–µ Philips EPIQ 7 —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –ї–Є–љ–µ–є–љ–Њ–≥–Њ –і–∞—В—З–Є–Ї–∞ —Б —З–∞—Б—В–Њ—В–Њ–є 7,5 –Ь–У—Ж. –Ш–Ј–Љ–µ—А—П–ї–Є –Є—Б—Е–Њ–і–љ—Л–є –і–Є–∞–Љ–µ—В—А –Я–Р –Є –њ–Є–Ї–Њ–≤—Г—О —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї—Г—О —Б–Ї–Њ—А–Њ—Б—В—М –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Я–Р (–Я–°–° –Я–Р). –Ф–∞–ї–µ–µ –≤—Л–њ–Њ–ї–љ—П–ї–Є –њ—А–Њ–±—Г —Б —А–µ–∞–Ї—В–Є–≤–љ–Њ–є –≥–Є–њ–µ—А–µ–Љ–Є–µ–є –Є –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л–є —Н–љ–і–Њ—В–µ–ї–Є–є–Ј–∞–≤–Є—Б–Є–Љ—Л–є –Њ—В–≤–µ—В –љ–∞ –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Њ–љ–љ—Г—О –њ—А–Њ–±—Г –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 15 —Б –Є —З–µ—А–µ–Ј 1 –Љ–Є–љ –њ–Њ—Б–ї–µ —Б–љ—П—В–Є—П –Љ–∞–љ–ґ–µ—В—Л. –Ф–ї—П —А–∞—Б—З–µ—В–∞ –і–Є–љ–∞–Љ–Є–Ї–Є –±—А–∞–ї–Є —Б—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –і–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ–Њ—Б–ї–µ —Б–љ—П—В–Є—П –Љ–∞–љ–ґ–µ—В—Л –Є –њ–Њ–і—Б—В–∞–≤–ї—П–ї–Є –Є—Е –≤ —Д–Њ—А–Љ—Г–ї—Г:
–Я–Я–Ф–Ш = –Ф–Я–Р2 - –Ф–Я–Р1,
–Ф–Я–Р1 √Ч 100%
–≥–і–µ –Я–Я–Ф–Ш вАФ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –њ–Њ—В–Њ–Ї–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–є –і–Є–ї–∞—В–∞—Ж–Є–Є –њ–ї–µ—З–µ–≤–Њ–є –∞—А—В–µ—А–Є–Є, –Ф–Я–Р2 вАФ –і–Є–∞–Љ–µ—В—А –Я–Р –њ–Њ—Б–ї–µ –Љ–∞–љ–ґ–µ—В–Њ—З–љ–Њ–є –њ—А–Њ–±—Л, –Ф–Я–Р1 вАФ –і–Є–∞–Љ–µ—В—А –Я–Р –≤ –њ–Њ–Ї–Њ–µ (–і–Њ –њ—А–Њ–±—Л).
–Я–Њ–≤—В–Њ—А–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є —З–µ—А–µ–Ј 1 –љ–µ–і. –Є–ї–Є –њ—А–Є —Г—Е—Г–і—И–µ–љ–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є—П.
–Ф–ї—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –њ—А–Є–ї–Њ–ґ–µ–љ–Є–µ Microsoft Exel (2013), Statistica 6.0. –Я—А–Є–Љ–µ–љ—П–ї–Є –Ї—А–Є—В–µ—А–Є–є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є –°—В—М—О–і–µ–љ—В–∞ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б—А–µ–і–љ–Є—Е –≤–µ–ї–Є—З–Є–љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П. –Я—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–Є–є –і–ї—П –Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Є –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –≤—Л–±–Њ—А–Њ–Ї –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –њ–Њ t-–Ї—А–Є—В–µ—А–Є—О –°—В—М—О–і–µ–љ—В–∞, –њ—А–Є –љ–µ–љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–Є вАФ –њ–Њ –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–Љ—Г U-–Ї—А–Є—В–µ—А–Є—О –Ь–∞–љ–љ–∞ вАФ –£–Є—В–љ–Є. –†–∞–Ј–ї–Є—З–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б—З–Є—В–∞–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ–Є –њ—А–Є p<0,05.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є (3-—П –≥—А—Г–њ–њ–∞) —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –і–Є–∞–Љ–µ—В—А–∞ –Я–Р –≤ –Њ—В–≤–µ—В –љ–∞ –њ—А–Њ–±—Г —Б –Љ–∞–љ–ґ–µ—В–Њ–є вАФ –љ–∞ 15,7% —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ –њ—А–Њ–±—Л –Є –љ–∞ 23,9% —З–µ—А–µ–Ј 1 –Љ–Є–љ. –Я–Њ–≤—В–Њ—А–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ —З–µ—А–µ–Ј 1 –љ–µ–і., –≤—Л—П–≤–Є–ї–Њ –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В–Є: —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –љ–∞ 17,8% –Є 21,3% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
–Т –≥—А—Г–њ–њ–∞—Е —Б –Я–≠ –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –і–Є–∞–Љ–µ—В—А–∞ –Я–Р –≤ –Њ—В–≤–µ—В –љ–∞ –њ—А–Њ–±—Г —Б –Љ–∞–љ–ґ–µ—В–Њ–є –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ. –Я—А–Є —Н—В–Њ–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –і–Є–∞–Љ–µ—В—А–∞ –Я–Р —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ (p<0,05) –Њ—В–ї–Є—З–∞–ї–Є—Б—М –Њ—В —В–∞–Ї–Њ–≤—Л—Е –≤ 3-–є –≥—А—Г–њ–њ–µ (—А–Є—Б. 1A).
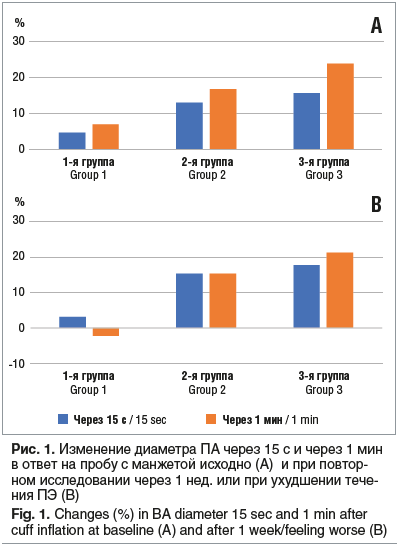
–Я–Њ–≤—В–Њ—А–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≠–Ч–Т–Ф –Я–Р, –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–µ —З–µ—А–µ–Ј 1 –љ–µ–і. –Є–ї–Є –њ—А–Є —Г—Е—Г–і—И–µ–љ–Є–Є —В–µ—З–µ–љ–Є—П –Я–≠, –≤—Л—П–≤–Є–ї–Њ –љ–µ —В–Њ–ї—М–Ї–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ—А–Є—А–Њ—Б—В–∞ –і–Є–∞–Љ–µ—В—А–∞ –≤ –Њ—В–≤–µ—В –љ–∞ –њ—А–Њ–±—Г –≤ 1-–є –≥—А—Г–њ–њ–µ, –љ–Њ –і–∞–ґ–µ –њ–∞—А–∞–і–Њ–Ї—Б–∞–ї—М–љ—Г—О —А–µ–∞–Ї—Ж–Є—О вАФ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –і–Є–∞–Љ–µ—В—А–∞ –Я–Р –≤ –Њ—В–≤–µ—В –љ–∞ —А–∞–Ј–і—А–∞–ґ–Є—В–µ–ї—М. –Я—А–Є —Н—В–Њ–Љ –≤–Њ 2-–є –≥—А—Г–њ–њ–µ –љ–∞ —Д–Њ–љ–µ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Я–≠ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –њ—А–Є–±–ї–Є–ґ–∞–ї–Є—Б—М –Ї –Ј–љ–∞—З–µ–љ–Є—П–Љ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л (—А–Є—Б. 1B).
–Я—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –Я–°–° –Я–Р –љ–∞ —Д–Њ–љ–µ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є (3-—П –≥—А—Г–њ–њ–∞) —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–µ–љ –њ—А–Є—А–Њ—Б—В —Б–Ї–Њ—А–Њ—Б—В–Є –љ–∞ 5,2% –Є 16% –≤ –Њ—В–≤–µ—В –љ–∞ –њ—А–Њ–±—Г —З–µ—А–µ–Ј 15 —Б –Є —З–µ—А–µ–Ј 1 –Љ–Є–љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Я–≠ (1-—П –Є 2-—П –≥—А—Г–њ–њ–∞), –љ–∞–њ—А–Њ—В–Є–≤, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–∞—Б—М –љ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ, –∞ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Я–°–° –Я–Р –≤ –Њ—В–≤–µ—В –љ–∞ –њ—А–Њ–±—Г, –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –њ—А–Є –Є–Ј–Љ–µ—А–µ–љ–Є–Є —З–µ—А–µ–Ј 1 –Љ–Є–љ –њ–Њ—Б–ї–µ –њ—А–Њ–±—Л (—А–Є—Б. 2A).

–Я–Њ–≤—В–Њ—А–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–µ —З–µ—А–µ–Ј 1 –љ–µ–і. –Є–ї–Є –њ—А–Є —Г—Е—Г–і—И–µ–љ–Є–Є —В–µ—З–µ–љ–Є—П –Я–≠, —В–∞–Ї–ґ–µ –≤—Л—П–≤–Є–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ (p<0,05) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї–µ–Љ —Б–љ–Є–ґ–µ–љ–Є–µ –Я–°–° –Я–Р –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е (—А–Є—Б. 2B).
–Ш–Ј –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е —Б–ї–µ–і—Г–µ—В, —З—В–Њ –њ—А–Є –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є (–Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П –≥—А—Г–њ–њ–∞) –њ–Њ—Б–ї–µ –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Њ–љ–љ–Њ–є –њ—А–Њ–±—Л –Њ—В–Љ–µ—З–∞–µ—В—Б—П –Ј–љ–∞—З–Є–Љ—Л–є –њ—А–Є—А–Њ—Б—В –і–Є–∞–Љ–µ—В—А–∞ –Я–Р, —В–Њ–≥–і–∞ –Ї–∞–Ї —А–∞–Ј–≤–Є—В–Є–µ –Я–≠ –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —В–∞–Ї–Є–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є.
–Я–Є–Ї–Њ–≤–∞—П —Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–∞—П —Б–Ї–Њ—А–Њ—Б—В—М –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ –Я–Р –≤ –Њ—В–≤–µ—В –љ–∞ –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Њ–љ–љ—Г—О –њ—А–Њ–±—Г –њ—А–Є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —В–µ—З–µ–љ–Є–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –≤–Њ–Ј—А–∞—Б—В–∞–µ—В, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ—А–Є –Я–≠, –љ–∞–њ—А–Њ—В–Є–≤, –Я–°–° –Я–Р —Б–љ–Є–ґ–∞–µ—В—Б—П, —З—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–∞—Б—Ж–µ–љ–µ–љ–Њ –Ї–∞–Ї –њ—А–Є–Ј–љ–∞–Ї —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Т –ї–Є—В–µ—А–∞—В—Г—А–µ –Є–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ —В–Њ–Љ, —З—В–Њ —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –µ—Й–µ –і–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Я–≠ [21, 22]. –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Н—В–Њ–≥–Њ –њ—А–µ–і–ї–∞–≥–∞—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—В–Њ–і—Л, –≤ —В–Њ–є –Є–ї–Є –Є–љ–Њ–є –Љ–µ—А–µ —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Њ—Ж–µ–љ–Ї–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П [17, 23]. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ—А–µ–і–ї–∞–≥–∞–µ–Љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П —П–≤–ї—П—О—В—Б—П –Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ–Є –Є –і–Њ–≤–Њ–ї—М–љ–Њ –і–Њ—А–Њ–≥–Є–Љ–Є, —З—В–Њ –Ј–∞—В—А—Г–і–љ—П–µ—В –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —И–Є—А–Њ–Ї–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є, –Њ—Б–Њ–±–µ–љ–љ–Њ, –і–ї—П –Ї–Њ–љ—В—А–Њ–ї—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я—А–Є–Љ–µ–љ—П–µ–Љ—Л–є –љ–∞–Љ–Є –Љ–µ—В–Њ–і –≠–Ч–Т–Ф –Я–Р –≤ —Н—В–Њ–Љ —Б–Љ—Л—Б–ї–µ –±–Њ–ї–µ–µ –і–Њ—Б—В—Г–њ–љ—Л–є.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ —Е–Њ–і–µ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–∞–љ–љ—Л–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—В—М, —З—В–Њ –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П –±–Њ–ї–µ–µ —В–Њ—З–љ–Њ –Њ—В—А–∞–ґ–∞—О—В –≥–ї—Г–±–Є–љ—Г –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ—А–Є –Я–≠, —З–µ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞, —З—В–Њ –≤ —Ж–µ–ї–Њ–Љ —Б–Њ–≤–њ–∞–і–∞–µ—В —Б –і–∞–љ–љ—Л–Љ–Є –ї–Є—В–µ—А–∞—В—Г—А—Л.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ю—Ж–µ–љ–Ї–∞ –≠–Ч–Т–Ф –Я–Р —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї—П —Б–Њ—Б—В–Њ—П–љ–Є—П –±–µ—А–µ–Љ–µ–љ–љ—Л—Е —Б –Я–≠, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б —В—П–ґ–µ—Б—В—М—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П, –Є –Љ–Њ–ґ–µ—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–∞ –≤ –њ—А–Њ–≥–љ–Њ–Ј–µ —В–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –і–Є–∞–Љ–µ—В—А–∞ –Я–Р –Є –Я–°–° –Я–Р —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Є –Є —З–µ—А–µ–Ј 1 –Љ–Є–љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —В–µ—З–µ–љ–Є–Є –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –Ю—В—Б—Г—В—Б—В–≤–Є–µ –њ—А–Є—А–Њ—Б—В–∞ –Љ–µ–љ–µ–µ 10% —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≥–Њ–≤–Њ—А–Є—В –Њ –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є–Є —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–µ–є—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –≤ –≤–Є–і–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Я–≠. –Ю—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –і–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –Я–≠ вАФ –њ–µ—А–µ—Е–Њ–і –≤ —В—П–ґ–µ–ї—Г—О —Д–Њ—А–Љ—Г.
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е:
–®–∞–≤–∞–µ–≤–∞ –†—Г–Ј–∞–љ–љ–∞ –•—Г—Б–µ–љ–Њ–≤–љ–∞ вАФ –∞—Б–њ–Є—А–∞–љ—В –Ї–∞—Д–µ–і—А—Л –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є вДЦ 1 –Ш–љ—Б—В–Є—В—Г—В–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –Є–Љ. –Э.–Т. –°–Ї–ї–Є—Д–Њ—Б–Њ–≤—Б–Ї–Њ–≥–Њ –§–У–Р–Ю–£ –Т–Ю –Я–µ—А–≤—Л–є –Ь–У–Ь–£ –Є–Љ. –Ш.–Ь. –°–µ—З–µ–љ–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є (–°–µ—З–µ–љ–Њ–≤—Б–Ї–Є–є –£–љ–Є–≤–µ—А—Б–Є—В–µ—В); 119991, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Ґ—А—Г–±–µ—Ж–Ї–∞—П, –і. 8; ORCID iD 0000-0002-5953-0503.
–Ь—Г—А–∞—И–Ї–Њ –Р–љ–і—А–µ–є –Т–ї–∞–і–Є–Љ–Є—А–Њ–≤–Є—З вАФ –і.–Љ.–љ., –і–Њ—Ж–µ–љ—В, –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ї–∞—Д–µ–і—А—Л –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є вДЦ 1 –Ш–љ—Б—В–Є—В—Г—В–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –Є–Љ. –Э.–Т. –°–Ї–ї–Є—Д–Њ—Б–Њ–≤—Б–Ї–Њ–≥–Њ –§–У–Р–Ю–£ –Т–Ю –Я–µ—А–≤—Л–є –Ь–У–Ь–£ –Є–Љ. –Ш.–Ь. –°–µ—З–µ–љ–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є (–°–µ—З–µ–љ–Њ–≤—Б–Ї–Є–є –£–љ–Є–≤–µ—А—Б–Є—В–µ—В); 119991, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Ґ—А—Г–±–µ—Ж–Ї–∞—П, –і. 8; ORCID iD 0000-0003-0663-2909.
–Ч—Г–µ–≤ –Т–ї–∞–і–Є–Љ–Є—А –Ь–Є—Е–∞–є–ї–Њ–≤–Є—З вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А, –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ї–∞—Д–µ–і—А—Л –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є вДЦ 1 –Ш–љ—Б—В–Є—В—Г—В–∞
–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –Є–Љ. –Э.–Т. –°–Ї–ї–Є—Д–Њ—Б–Њ–≤—Б–Ї–Њ–≥–Њ –§–У–Р–Ю–£ –Т–Ю –Я–µ—А–≤—Л–є –Ь–У–Ь–£ –Є–Љ. –Ш.–Ь. –°–µ—З–µ–љ–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є (–°–µ—З–µ–љ–Њ–≤—Б–Ї–Є–є –£–љ–Є–≤–µ—А—Б–Є—В–µ—В); 119991, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Ґ—А—Г–±–µ—Ж–Ї–∞—П, –і. 8; ORCID iD 0000-0001-8715-2020.
–Ґ–Є–Љ–Њ—Д–µ–µ–≤ –°–µ—А–≥–µ–є –Р–љ–∞—В–Њ–ї—М–µ–≤–Є—З вАФ –∞—Б—Б–Є—Б—В–µ–љ—В –Ї–∞—Д–µ–і—А—Л –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є вДЦ 1 –Ш–љ—Б—В–Є—В—Г—В–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –Є–Љ. –Э.–Т. –°–Ї–ї–Є—Д–Њ—Б–Њ–≤—Б–Ї–Њ–≥–Њ –§–У–Р–Ю–£ –Т–Ю –Я–µ—А–≤—Л–є –Ь–У–Ь–£ –Є–Љ. –Ш.–Ь. –°–µ—З–µ–љ–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є (–°–µ—З–µ–љ–Њ–≤—Б–Ї–Є–є –£–љ–Є–≤–µ—А—Б–Є—В–µ—В); 119991, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Ґ—А—Г–±–µ—Ж–Ї–∞—П, –і. 8; ORCID iD 0000-0001-7380-9255.
–Ф–ґ–Є–±–ї–∞–і–Ј–µ –Ґ–µ–∞ –Р–Љ–Є—А–∞–љ–Њ–≤–љ–∞ вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А, –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ї–∞—Д–µ–і—А—Л –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є вДЦ 1 –Ш–љ—Б—В–Є—В—Г—В–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –Є–Љ. –Э.–Т. –°–Ї–ї–Є—Д–Њ—Б–Њ–≤—Б–Ї–Њ–≥–Њ –§–У–Р–Ю–£ –Т–Ю –Я–µ—А–≤—Л–є –Ь–У–Ь–£ –Є–Љ. –Ш.–Ь. –°–µ—З–µ–љ–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є (–°–µ—З–µ–љ–Њ–≤—Б–Ї–Є–є –£–љ–Є–≤–µ—А—Б–Є—В–µ—В); 119991, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Ґ—А—Г–±–µ—Ж–Ї–∞—П, –і. 8.; ORCID iD 0000-0003-1540-5628.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –®–∞–≤–∞–µ–≤–∞ –†—Г–Ј–∞–љ–љ–∞ –•—Г—Б–µ–љ–Њ–≤–љ–∞, e-mail: ruzanna-shavaeva@mail.ru.
–Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е.
–Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В.
–°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 12.08.2021.
–Я–Њ—Б—В—Г–њ–Є–ї–∞ –њ–Њ—Б–ї–µ —А–µ—Ж–µ–љ–Ј–Є—А–Њ–≤–∞–љ–Є—П 06.09.2021.
–Я—А–Є–љ—П—В–∞ –≤ –њ–µ—З–∞—В—М 29.09.2021.
About the authors:
Ruzanna Kh. Shavaeva вАФ postgraduate student of the Department of Obstetrics and Gynecology No. 1 of N.V. Sklifosovskiy Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-5953-0503.
Andrey V. Murashko вАФ Dr. Sc. (Med.), Associate Professor, professor of the Department of Obstetrics and Gynecology No. 1 of N.V. Sklifosovskiy Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-0663-2909.
Vladimir M. Zuev вАФ Dr. Sc. (Med.), Professor, professor of the Department of Obstetrics and Gynecology No. 1 of N.V. Sklifosovskiy Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0001-8715-2020.
Sergey A. Timofeev вАФ assistant of the Department of Obstetrics and Gynecology No. 1 of N.V. Sklifosovskiy Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0001-7380-9255.
Tea A. Dzhibladze вАФ Dr. Sc. (Med.), Professor, professor of the Department of Obstetrics and Gynecology No. 1 of N.V. Sklifosovskiy Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-1540-5628.
Contact information: Ruzanna Kh. Shavaeva, e-mail: ruzanna-shavaeva@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 12.08.2021.
Revised 06.09.2021.
Accepted 29.09.2021.












