–Т–≤–µ–і–µ–љ–Є–µ
–Т –Њ–±—Й–µ–є —Б—В—А—Г–Ї—В—Г—А–µ –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г –і–µ—В–µ–є –±–Њ–ї—М—И–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї—П–µ—В—Б—П –њ—А–Њ–±–ї–µ–Љ–µ –∞—В–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—А–Љ–∞—В–Є—В–∞ (–Р—В–Ф) вАФ –Љ—Г–ї—М—В–Є—Д–∞–Ї—В–Њ—А–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ї–Њ–ґ–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–µ–≥–Њ—Б—П –Ј—Г–і–Њ–Љ, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ, –≤–Њ–Ј—А–∞—Б—В–љ—Л–Љ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–Є –Њ—З–∞–≥–Њ–≤ –њ–Њ—А–∞–ґ–µ–љ–Є—П [1вАУ3]. –°—А–µ–і–Є –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –Р—В–Ф (–љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–∞—П –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М, –і–Є—Б–±–∞–ї–∞–љ—Б –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е —А–µ–≥—Г–ї—П—В–Њ—А–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–µ–Љ–±—А–∞–љ–љ–Њ–є —А–µ—Ж–µ–њ—Ж–Є–Є –Є –і—А.) –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –Є–≥—А–∞–µ—В –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Б —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –і–µ—В–µ—А–Љ–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–Є–њ–µ—А—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞, –і–Є—Б–±–∞–ї–∞–љ—Б–Њ–Љ –≤ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є Th1-/Th2-–ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤–Њ–є —А–µ–≥—Г–ї—П—Ж–Є–Є [4вАУ6], –Њ—Б–ї–∞–±–ї–µ–љ–Є–µ–Љ —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ [7]. –Ы–µ—З–µ–љ–Є–µ –Р—В–Ф –Њ—Б—В–∞–µ—В—Б—П –њ—А–µ–і–Љ–µ—В–Њ–Љ –њ—А–Є—Б—В–∞–ї—М–љ–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П –і–ї—П –і–µ—А–Љ–∞—В–Њ–ї–Њ–≥–Њ–≤, –њ–µ–і–Є–∞—В—А–Њ–≤ –Є –∞–ї–ї–µ—А–≥–Њ–ї–Њ–≥–Њ–≤. –Ф–∞–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Б —А–∞–љ–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Є –Є–Љ–µ–µ—В —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ї —Е—А–Њ–љ–Є–Ј–∞—Ж–Є–Є, —А–µ—Ж–Є–і–Є–≤–Є—А–Њ–≤–∞–љ–Є—О, –Ї –њ–Њ–ї–Є–≤–∞–ї–µ–љ—В–љ–Њ–є —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Є –Ј–∞—З–∞—Б—В—Г—О —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ —А–∞–Ј–ї–Є—З–љ–Њ–є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є [5, 8], –≤ —В. —З. –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –њ–∞—В–Њ–≥–µ–љ–љ–∞—П –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–∞ –≤—Л–њ–Њ–ї–љ—П–µ—В —А–Њ–ї—М —В—А–Є–≥–≥–µ—А–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є [4, 9]. –° —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Є–Љ–Љ—Г–љ–Њ–њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Р—В–Ф –Њ—З–µ–≤–Є–і–љ–∞ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –µ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є, –Ї–Њ—В–Њ—А–∞—П, –љ–µ —П–≤–ї—П—П—Б—М —Н—В–Є–Њ—В—А–Њ–њ–љ–Њ–є, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є—О –≤—В–Њ—А–Є—З–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [10]. –Я—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—Л–±–Њ—А–∞ –Љ–Њ–≥—Г—В –±—Л—В—М –Є–Љ–Љ—Г–љ–Њ—В—А–Њ–њ–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –≤–ї–Є—П—В—М –љ–∞ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ Th1-/Th2-–Ї–ї–µ—В–Њ–Ї. –Т —Н—В–Њ–є —Б–≤—П–Ј–Є –≤–љ–Є–Љ–∞–љ–Є—П –Ј–∞—Б–ї—Г–ґ–Є–≤–∞–µ—В –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–є —Д—А–∞–≥–Љ–µ–љ—В –Љ—Г—А–∞–Љ–Є–ї–і–Є–њ–µ–њ—В–Є–і–Њ–≤ (–Ь–Ф–Я) вАФ –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–Є–ї–Љ—Г—А–∞–Љ–Є–ї–і–Є–њ–µ–њ—В–Є–і (–У–Ь–Ф–Я), –Ї–Њ—В–Њ—А—Л–є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Ь–Ф–Я –±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–µ–љ —Б –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Є –њ—А–Є —Н—В–Њ–Љ –Љ–µ–љ–µ–µ –њ–Є—А–Њ–≥–µ–љ–µ–љ [11]. –У–Ь–Ф–Я —П–≤–ї—П–µ—В—Б—П –∞–Ї—В–Є–≤–љ—Л–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–∞ –Ы–Є–Ї–Њ–њ–Є–і (–Р–Ю ¬Ђ–Я–µ–њ—В–µ–Ї¬ї, –†–Њ—Б—Б–Є—П), –Ї–Њ—В–Њ—А—Л–є —Г–ґ–µ –±–Њ–ї–µ–µ 20 –ї–µ—В —Г–і–∞—З–љ–Њ —Б–Њ–≤–Љ–µ—Й–∞–µ—В –≤ —Б–µ–±–µ –≤—Л—Б–Њ–Ї—Г—О –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є —Е–Њ—А–Њ—И–Є–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, –∞ –µ–≥–Њ –≤–∞–ґ–љ—Л–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ —П–≤–ї—П–µ—В—Б—П –Є–Ј–≤–µ—Б—В–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–∞—П –Љ–Є—И–µ–љ—М –і–µ–є—Б—В–≤–Є—П [12, 13].–¶–µ–ї—М—О –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–Є–ї–∞—Б—М –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –і–µ—В–µ–є —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ IgE-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–≥–Њ –Р—В–Ф –њ—Г—В–µ–Љ –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –љ–µ–µ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–∞ –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П вАФ –У–Ь–Ф–Я (–Ы–Є–Ї–Њ–њ–Є–і–∞).
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–µ–љ—Л 85 –і–µ—В–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 6 –і–Њ 9 –ї–µ—В —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ IgE-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–≥–Њ –Р—В–Ф —Б—А–µ–і–љ–µ–є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є, –љ–µ –Є–Љ–µ—О—Й–Є—Е –љ–∞ –Љ–Њ–Љ–µ–љ—В –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є, –≤–Є—А—Г—Б–љ–Њ–є –Є –Љ–Є–Ї–Њ—В–Є—З–µ—Б–Ї–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є. –Ф–µ—В–Є –±—Л–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ—Л –љ–∞ 3 –Њ—Б–љ–Њ–≤–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –≥—А—Г–њ–њ—Л, —А–∞–≤–љ–Њ—Ж–µ–љ–љ—Л–µ –њ–Њ —В–µ—З–µ–љ–Є—О –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Ї–Њ–ґ–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –Є –Њ—В–ї–Є—З–∞—О—Й–Є–µ—Б—П –њ–Њ —Б–њ–Њ—Б–Њ–±–∞–Љ –ї–µ—З–µ–љ–Є—П: 1-—П –≥—А—Г–њ–њ–∞ вАФ 30 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е, –Ї—А–Њ–Љ–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –У–Ь–Ф–Я (–Ы–Є–Ї–Њ–њ–Є–і) –Њ–і–љ–Є–Љ –Ї—Г—А—Б–Њ–Љ; 2-—П –≥—А—Г–њ–њ–∞ вАФ 25 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–∞—Е–Њ–і–Є–≤—И–Є—Е—Б—П –љ–∞ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є –±–µ–Ј –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є; 3-—П –≥—А—Г–њ–њ–∞ вАФ 30 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е, –Ї—А–Њ–Љ–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –У–Ь–Ф–Я (–Ы–Є–Ї–Њ–њ–Є–і) –і–≤—Г–Љ—П –Ї—Г—А—Б–∞–Љ–Є —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ 2 –Љ–µ—Б.
–Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –≤–Ї–ї—О—З–∞–ї–∞: –≥–Є–њ–Њ–∞–ї–ї–µ—А–≥–µ–љ–љ—Л–є –±—Л—В, —Н–ї–Є–Љ–Є–љ–∞—Ж–Є—О –њ—А–Є—З–Є–љ–љ–Њ-–Ј–љ–∞—З–Є–Љ—Л—Е –Є –Њ–±–ї–Є–≥–∞—В–љ—Л—Е –∞–ї–ї–µ—А–≥–µ–љ–Њ–≤, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є (–Љ–µ—Б—В–љ–Њ–є –Є —Б–Є—Б—В–µ–Љ–љ–Њ–є), –≤ —В. —З. –∞–љ—В–Є–≥–Є—Б—В–∞–Љ–Є–љ–љ–Њ–є, —В–µ—А–∞–њ–Є–Є –Є –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є вАФ –Ї–Њ—А—А–µ–Ї—Ж–Є—О –і–Є—Б—Д—Г–љ–Ї—Ж–Є–є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞.
–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≥—А—Г–њ–њ–∞—Е –±—Л–ї–Є –њ—А–Є–љ—П—В—Л —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ї–Њ–ґ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є, –Є—Е –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –Є —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л–µ –Њ—Й—Г—Й–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е, –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –Ї–∞—А—В–∞—Е, –Ј–∞–њ–Њ–ї–љ–µ–љ–љ—Л—Е –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б SCORAD (scoring of atopic dermatitis вАФ —И–Ї–∞–ї–∞ –Њ—Ж–µ–љ–Ї–Є –∞—В–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—А–Љ–∞—В–Є—В–∞). –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б–Њ–≥–ї–∞—Б–љ–Њ –љ–∞—Г—З–љ–Њ-–њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ–≥—А–∞–Љ–Љ–µ ¬Ђ–Р—В–Њ–њ–Є—З–µ—Б–Ї–Є–є –і–µ—А–Љ–∞—В–Є—В –Є –Є–љ—Д–µ–Ї—Ж–Є–Є –Ї–Њ–ґ–Є —Г –і–µ—В–µ–є: –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –ї–µ—З–µ–љ–Є–µ –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞¬ї (2004), –Ї–Њ—В–Њ—А–∞—П –≤–Ї–ї—О—З–∞–µ—В –Њ—Ж–µ–љ–Ї—Г —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–Њ–≤—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П. –Я—А–Є —Н—В–Њ–Љ —Г—З–Є—В—Л–≤–∞–ї–Є—Б—М 6 –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –њ–Њ—А–∞–ґ–µ–љ–Є–є –≤ –≤–Є–і–µ —Н—А–Є—В–µ–Љ—Л, –Њ—В–µ–Ї–∞/–њ–∞–њ—Г–ї, –Љ–Њ–Ї–љ—Г—В–Є–є/–Ї–Њ—А–Њ–Ї, —Н–Ї—Б–Ї–Њ—А–Є–∞—Ж–Є–Є, –ї–Є—Е–µ–љ–Є—Д–Є–Ї–∞—Ж–Є–Є, —Б—Г—Е–Њ—Б—В–Є (–љ–µ–≤–Њ—Б–њ–∞–ї–µ–љ–љ–Њ–є –Ї–Њ–ґ–Є) –њ–Њ —И–Ї–∞–ї–µ –Њ—В 0 –і–Њ 3 –±–∞–ї–ї–Њ–≤: 0 вАФ –Њ—В—Б—Г—В—Б—В–≤–Є–µ, 1 вАФ —Б–ї–∞–±–Њ–µ –≤—Л—А–∞–ґ–µ–љ–Є–µ, 2 вАФ —Г–Љ–µ—А–µ–љ–љ–Њ–µ –≤—Л—А–∞–ґ–µ–љ–Є–µ, 3 вАФ —А–µ–Ј–Ї–Њ–µ –≤—Л—А–∞–ґ–µ–љ–Є–µ. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–ґ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –≤ –њ—А–Њ—Ж–µ–љ—В–∞—Е –њ–Њ –њ—А–∞–≤–Є–ї—Г ¬Ђ–і–µ–≤—П—В–Њ–Ї¬ї (–≥–Њ–ї–Њ–≤–∞ –Є —И–µ—П вАФ –њ–Њ 9%, –њ–µ—А–µ–і–љ—П—П –Є –Ј–∞–і–љ—П—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М —В—Г–ї–Њ–≤–Є—Й–∞ вАФ –њ–Њ 18%, –≤–µ—А—Е–љ–Є–µ –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є вАФ –њ–Њ 9%, –љ–Є–ґ–љ–Є–µ –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є вАФ –њ–Њ 18%, –Њ–±–ї–∞—Б—В—М –њ—А–Њ–Љ–µ–ґ–љ–Њ—Б—В–Є –Є –њ–Њ–ї–Њ–≤—Л–µ –Њ—А–≥–∞–љ—Л вАФ –њ–Њ 1%). –°—Г–±—К–µ–Ї—В–Є–≤–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (–Ј—Г–і, –љ–∞—А—Г—И–µ–љ–Є–µ —Б–љ–∞) –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М –≤ –±–∞–ї–ї–∞—Е –Њ—В 0 –і–Њ 10.
–Ш–љ–і–µ–Ї—Б SCORAD —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є –њ–Њ —Д–Њ—А–Љ—Г–ї–µ:
–Ш–° = –Р / 5 + 7–Т / 2 + –°,
–≥–і–µ: –Р вАФ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ї–Њ–ґ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є, –Т вАФ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є, –° вАФ —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –≤–Ї–ї—О—З–∞—П —А–∞—Б—З–µ—В –Є–љ–і–µ–Ї—Б–∞ SCORAD, –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤ –і–Є–љ–∞–Љ–Є–Ї–µ: –і–Њ –ї–µ—З–µ–љ–Є—П, —З–µ—А–µ–Ј 1, 2 –Є 6 –Љ–µ—Б. –Њ—В –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П.
–°–Њ–≤–Љ–µ—Б—В–љ–Њ —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ–Њ —Б–ї–µ–і—Г—О—Й–µ–є —Б—Е–µ–Љ–µ: –Ы–Є–Ї–Њ–њ–Є–і —Б—Г–±–ї–Є–љ–≥–≤–∞–ї—М–љ–Њ –Ј–∞ 30 –Љ–Є–љ –і–Њ –µ–і—Л –њ–Њ 1 –Љ–≥ 2 —А./–і–µ–љ—М –≤ —В–µ—З–µ–љ–Є–µ 5 –і–љ–µ–є, –Ј–∞—В–µ–Љ –њ–Њ 1 –Љ–≥ 1 —А./–і–µ–љ—М –≤ —В–µ—З–µ–љ–Є–µ 15 –і–љ–µ–є (—Б—Г–Љ–Љ–∞—А–љ–∞—П –і–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–∞ 25 –Љ–≥) –Њ–і–љ–Є–Љ –Ї—Г—А—Б–Њ–Љ вАФ –≤ 1-–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ–µ –Є –і–≤—Г–Љ—П –Ї—Г—А—Б–∞–Љ–Є (—Б—Г–Љ–Љ–∞—А–љ–∞—П –і–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–∞ 50 –Љ–≥) —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ 2 –Љ–µ—Б. вАФ –≤ 3-–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ–µ.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Р–љ–∞–ї–Є–Ј –і–∞–љ–љ—Л—Е –∞–ї–ї–µ—А–≥–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ —Г 59,9% –Љ–∞—В–µ—А–µ–є –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е –і–µ—В–µ–є –±—Л–ї–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –Є —А–Њ–і–Њ–≤, 33,1% –Љ–∞—В–µ—А–µ–є –Є–Љ–µ–ї–Є —В–Њ–Ї—Б–Є–Ї–Њ–Ј—Л –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є. –£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –і–µ—В–µ–є —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ –Р—В–Ф –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –Є–Љ–µ–ї–Є –Љ–µ—Б—В–Њ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ –≤–Є–і–µ –њ–Њ–ї–ї–Є–љ–Њ–Ј–∞ —А–Є–љ–Њ-–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л (—Г 23%), –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –∞—Б—В–Љ—Л (—Г 19%), –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–Є–љ–Є—В–∞ (—Г 10,8%), —Б—Г—Е–Њ–≥–Њ –љ–Њ—З–љ–Њ–≥–Њ –Ї–∞—И–ї—П (—Г 19%), –Њ—Б—В—А—Л—Е —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –Њ—В 2 –і–Њ 8 —А–∞–Ј –≤ –Љ–µ—Б—П—Ж (—Г 47%), –∞–љ–≥–Є–љ—Л (—Г 10,8%), —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–є —Б—В—А–µ–њ—В–Њ–і–µ—А–Љ–Є–Є (—Г 4,8%), —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–≥–Њ —Д—Г—А—Г–љ–Ї—Г–ї–µ–Ј–∞ –Є —П—З–Љ–µ–љ—П (—Г 4,8%). –Ю–і–љ–∞–Ї–Њ –љ–∞ –Љ–Њ–Љ–µ–љ—В –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є —Г–Ї–∞–Ј–∞–љ–љ—Л—Е —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –Є–љ—Д–µ–Ї—Ж–Є–є. –Я–Њ—З—В–Є —Г 60% –і–µ—В–µ–є –Њ–±–Њ—Б—В—А–µ–љ–Є–µ –Р—В–Ф —Б–Њ–≤–њ–∞–і–∞–ї–Њ —Б –Ї–Є—И–µ—З–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є (–љ–µ—Г—Б—В–Њ–є—З–Є–≤—Л–є —Б—В—Г–ї, —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ї –Ј–∞–њ–Њ—А–∞–Љ), –і–Є—Б–Ї–Є–љ–µ–Ј–Є–µ–є –ґ–µ–ї—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є (–њ–Њ –і–∞–љ–љ—Л–Љ –£–Ч–Ш), –і–Є—Б–њ–∞–љ–Ї—А–µ–∞—В–Є–Ј–Љ–Њ–Љ.–Ъ–Њ–ґ–љ—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Р—В–Ф —Г –і–µ—В–µ–є –љ–Њ—Б–Є–ї–Є –њ–Њ–ї–Є–Љ–Њ—А—Д–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А: –Ї–Њ–ґ–∞ –±—Л–ї–∞ —Б—Г—Е–∞—П —Б —Б–µ—А–Њ–≤–∞—В—Л–Љ –Њ—В—В–µ–љ–Ї–Њ–Љ, —Б–Њ —Б–Ї—А—Л—В—Л–Љ –Є–ї–Є –Њ—В—А—Г–±–µ–≤–Є–і–љ—Л–Љ —И–µ–ї—Г—И–µ–љ–Є–µ–Љ. –Т—Л—Б—Л–њ–∞–љ–Є—П –Є–Љ–µ–ї–Є —Н—А–Є—В–µ–Љ–∞—В–Њ–Ј–љ–Њ-–Є–љ—Д–Є–ї—М—В—А–∞—В–Є–≤–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А. –£ –±–Њ–ї—М—И–µ–є —З–∞—Б—В–Є –і–µ—В–µ–є (66%) –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л–µ –Є –ї–Є—Е–µ–љ–Њ–Є–і–љ—Л–µ –њ–∞–њ—Г–ї—Л —Б–ї–Є–≤–∞–ї–Є—Б—М –Є –Њ–±—А–∞–Ј–Њ–≤—Л–≤–∞–ї–Є –Њ—З–∞–≥–Є –ї–Є—Е–µ–љ–Є—Д–Є–Ї–∞—Ж–Є–Є, –Є–Љ–µ–ї–Є—Б—М —Н–Ї—Б–Ї–Њ—А–Є–∞—Ж–Є–Є. –£ 23% –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е –і–µ—В–µ–є –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г—В–Њ–ї—Й–µ–љ–Є–µ –љ–Є–ґ–љ–Є—Е –≤–µ–Ї —Б –≥–Є–њ–µ—А–њ–Є–≥–Љ–µ–љ—В–∞—Ж–Є–µ–є –љ–∞—А—Г–ґ–љ–Њ–≥–Њ —Г–≥–ї–∞ –≥–ї–∞–Ј.
–Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Є–Ј—Г—З–µ–љ–Є—П –Є –Њ–±—А–∞–±–Њ—В–Ї–Є —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –Ї–∞—А—В, –Ј–∞–њ–Њ–ї–љ–µ–љ–љ—Л—Е –љ–∞ –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б SCORAD, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М (–Р) –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–ґ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –і–Њ –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ 25,33¬±2,38%, –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М (–Т) –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є вАФ 8,40¬±0,52 –±–∞–ї–ї–∞, –Њ—Ж–µ–љ–Ї–∞ —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ (–°), –Њ—В—А–∞–ґ–∞—О—Й–Є—Е –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є, вАФ 7,40¬±0,91 –±–∞–ї–ї–∞. –Ш–љ–і–µ–Ї—Б SCORAD —Б–Њ—Б—В–∞–≤–Є–ї 41,86¬±2,56 –±–∞–ї–ї–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г –і–µ—В–µ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ IgE-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ—Л–є –Р—В–Ф —Н—А–Є—В–µ–Љ–∞—В–Њ–Ј–љ–Њ-—Б–Ї–≤–∞–Љ–Њ–Ј–љ–Њ–є –Є –ї–Є—Е–µ–љ–Њ–Є–і–љ–Њ–є —Д–Њ—А–Љ—Л –≤ —Б—В–∞–і–Є–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П –≤ —Д–∞–Ј–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є, —Б —Г–њ–Њ—А–љ–Њ-—А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ (–і–Њ 3вАУ4 —А–∞–Ј –≤ –≥–Њ–і), –і–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –њ–µ—А–Є–Њ–і–∞–Љ–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–µ–є —Г—З–∞—Б—В–Ї–Њ–≤ –ї–Є—Е–µ–љ–Є–Ј–∞—Ж–Є–Є –љ–∞ —Б–≥–Є–±–∞—В–µ–ї—М–љ—Л—Е –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—П—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –Є —И–µ–µ.
–†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ї–Њ–ґ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є —Г –і–µ—В–µ–є —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ IgE-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–≥–Њ –Р—В–Ф –њ–Њ—Б–ї–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б–љ–Є–Ј–Є–ї–∞—Б—М –≤ 1,8 —А–∞–Ј–∞ —З–µ—А–µ–Ј 1 –Љ–µ—Б. –Є –≤ 3 —А–∞–Ј–∞ —З–µ—А–µ–Ј 2 –Љ–µ—Б., —В–Њ–≥–і–∞ –Ї–∞–Ї –≤–Ї–ї—О—З–µ–љ–Є–µ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –У–Ь–Ф–Я (–Ы–Є–Ї–Њ–њ–Є–і–∞) –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –њ–ї–Њ—Й–∞–і–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ї–Њ–ґ–љ—Л—Е –њ–Њ–Ї—А–Њ–≤–Њ–≤ –≤ 3,5 —А–∞–Ј–∞ —З–µ—А–µ–Ј 1 –Љ–µ—Б. –Є –≤ 8,3 —А–∞–Ј–∞ —З–µ—А–µ–Ј 2 –Љ–µ—Б. (—А–Є—Б. 1).

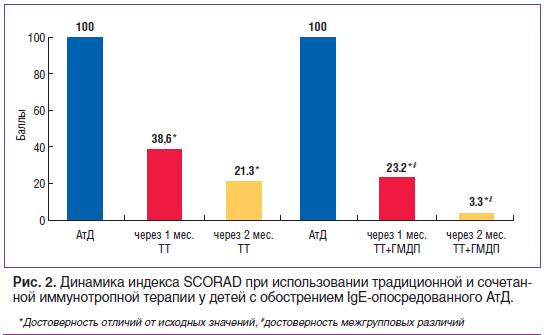
–Ъ—Г—А—Б –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є –У–Ь–Ф–Я (–Ї—Г—А—Б–Њ–≤–∞—П –і–Њ–Ј–∞ 25 –Љ–≥) –њ—А–Є–≤–µ–ї –Ї –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–Љ—Г, —З–µ–Љ –њ—А–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Ї–Њ–ґ–љ–Њ–≥–Њ –Ј—Г–і–∞ –Є –љ–∞—А—Г—И–µ–љ–Є–є —Б–љ–∞: —З–µ—А–µ–Ј 1 –Љ–µ—Б. –±–Њ–ї–µ–µ —З–µ–Љ –≤ 30 —А–∞–Ј, —З–µ—А–µ–Ј 2 –Љ–µ—Б. –і–Њ –њ–Њ–ї–љ–Њ–≥–Њ –Њ—В—Б—Г—В—Б—В–≤–Є—П —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤. –†–∞—Б—З–µ—В –Є–љ–і–µ–Ї—Б–∞ SCORAD –њ–Њ–Ї–∞–Ј–∞–ї –њ–Њ–Ј–Є—В–Є–≤–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В —Б–Њ—З–µ—В–∞–љ–љ–Њ–є –Є–Љ–Љ—Г–љ–Њ—В—А–Њ–њ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Ј–∞–Ї–ї—О—З–∞—О—Й–Є–є—Б—П –≤ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–Љ –µ–≥–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Є—Б—Е–Њ–і–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –Є —З–µ—А–µ–Ј 1 –Љ–µ—Б. (–≤ 1,6 —А–∞–Ј–∞) –Є 2 –Љ–µ—Б. (–≤ 6 —А–∞–Ј) –њ–Њ—Б–ї–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (—А–Є—Б. 2).
–Ф–∞–ї—М–љ–µ–є—И–Є–µ –Ї–∞—В–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ 1-–є –Є 2-–є –≥—А—Г–њ–њ–∞—Е, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л–µ —З–µ—А–µ–Ј 6 –Љ–µ—Б. –Њ—В –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є, –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є —Б–ї—Г—З–∞–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–∞–љ–≥–Є–љ—Л, –∞–і–µ–љ–Њ–Є–і–Є—В—Л, —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ-–≤–Є—А—Г—Б–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є, –љ–Њ—З–љ–Њ–є –Ї–∞—И–µ–ї—М), –±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Њ—В–Љ–µ—З–∞–µ–Љ—Л–µ –≤ –≥—А—Г–њ–њ–µ –і–µ—В–µ–є, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Г—О —В–µ—А–∞–њ–Є—О –±–µ–Ј –У–Ь–Ф–Я. –†–µ—Ж–Є–і–Є–≤—Л –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Р—В–Ф –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л —Г –і–µ—В–µ–є –Њ–±–µ–Є—Е –≥—А—Г–њ–њ, –Њ–і–љ–∞–Ї–Њ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Њ–љ–Є –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —З–∞—Й–µ вАФ —Г 58% –і–µ—В–µ–є, —В–Њ–≥–і–∞ –Ї–∞–Ї —Г –і–µ—В–µ–є, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –љ–∞—А—П–і—Г —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А –Ы–Є–Ї–Њ–њ–Є–і, –Њ–љ–Є –љ–µ –њ—А–µ–≤—Л—И–∞–ї–Є 35%. –≠—В–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ—Б–ї—Г–ґ–Є–ї–Є –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П 3-–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ—Л –і–µ—В–µ–є —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ IgE-–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ –Р—В–Ф —Б—А–µ–і–љ–µ–є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є, —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л—Е –њ–Њ –Ї–ї–Є–љ–Є–Ї–Њ-–ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –і–∞–љ–љ—Л–Љ —Б –і–µ—В—М–Љ–Є 1-–є –Є 2-–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≥—А—Г–њ–њ. –Т 3-–є –≥—А—Г–њ–њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М 2 –Ї—Г—А—Б–∞ –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є –У–Ь–Ф–Я (–Ы–Є–Ї–Њ–њ–Є–і–Њ–Љ) —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ 2 –Љ–µ—Б. (—Б—Г–Љ–Љ–∞—А–љ–∞—П –і–Њ–Ј–∞ –њ—А–µ–њ–∞—А–∞—В–∞ вАФ 50 –Љ–≥) –Є –Њ—Ж–µ–љ–Ї–Њ–є –µ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–њ—Г—Б—В—П 6 –Љ–µ—Б. –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П —В–µ—А–∞–њ–Є–Є. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Б–Њ—З–µ—В–∞–љ–љ–∞—П —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є—П –і–≤—Г–Љ—П –Ї—Г—А—Б–∞–Љ–Є –У–Ь–Ф–Я (–Ы–Є–Ї–Њ–њ–Є–і–∞) –Њ–±–ї–∞–і–∞–µ—В –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, –Њ —З–µ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —З–Є—Б–ї–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–є –Р—В–Ф –≤ 1-–є –Є 2-–є –≥—А—Г–њ–њ–∞—Е –≤ 3,4 —А–∞–Ј–∞ –Є –≤ 2 —А–∞–Ј–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ (–≤ 3,2 —А–∞–Ј–∞), —З–µ–Љ –њ—А–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–≤ 1,5 —А–∞–Ј–∞), —Б–љ–Є–ґ–µ–љ–Є–µ —З–Є—Б–ї–∞ —Б–ї—Г—З–∞–µ–≤ –Њ–±–Њ—Б—В—А–µ–љ–Є–є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ 2 –Ї—Г—А—Б–Њ–≤ –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є –У–Ь–Ф–Я (–Ы–Є–Ї–Њ–њ–Є–і–Њ–Љ) –≤ —Б–Њ—Б—В–∞–≤–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П IgE-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–≥–Њ –Р—В–Ф —Г –і–µ—В–µ–є —Б —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є –Њ—В–Љ–µ—З–µ–љ–∞ –±√≥–ї—М—И–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –њ–µ—А–≤–Њ–Љ —Б–ї—Г—З–∞–µ. –†–∞–љ–µ–µ –љ–∞–Љ–Є –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л in vitro –Ї–ї–Є–љ–Є–Ї–Њ-—Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –У–Ь–Ф–Я (–Ы–Є–Ї–Њ–њ–Є–і–∞) –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞—В—М —Г—А–Њ–≤–µ–љ—М –Њ–±—Й–µ–≥–Њ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ IgE [14] –Ј–∞ —Б—З–µ—В —Г—Б–Є–ї–µ–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –Є–љ—В–µ—А—Д–µ—А–Њ–љ–∞-ќ≥ –Є —Б–љ–Є–ґ–µ–љ–Є—П –њ—А–Њ–і—Г–Ї—Ж–Є–Є –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞-4 [15], —З—В–Њ –Њ—В–Ї—А—Л–≤–∞–µ—В –љ–Њ–≤—Л–µ —Б—В–Њ—А–Њ–љ—Л –і–µ–є—Б—В–≤–Є—П –У–Ь–Ф–Я –≤ –Ї–∞—З–µ—Б—В–≤–µ —А–µ–≥—Г–ї—П—В–Њ—А–Њ–≤ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є Th1- –Є Th2-–ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ—Б–ї–µ–і–љ–Є—Е.–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –У–Ь–Ф–Я (–Ы–Є–Ї–Њ–њ–Є–і–∞) –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є IgE-–Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–≥–Њ –Р—В–Ф —Н—А–Є—В–µ–Љ–∞—В–Њ–Ј–љ–Њ-—Б–Ї–≤–∞–Љ–Њ–Ј–љ–Њ–є –Є –ї–Є—Е–µ–љ–Њ–Є–і–љ–Њ–є —Д–Њ—А–Љ—Л –≤ —Б—В–∞–і–Є–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П –≤ —Д–∞–Ј–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є, —Б —Г–њ–Њ—А–љ–Њ-—А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б—З–Є—В–∞—В—М –µ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ –і–ї—П –Є–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є–Є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –і–Њ–Ј–µ 25 –Љ–≥ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–Њ–Ї—А–∞—Й–∞–µ—В –њ–ї–Њ—Й–∞–і—М –њ–Њ—А–∞–ґ–µ–љ–Є—П –Ї–Њ–ґ–љ—Л—Е –њ–Њ–Ї—А–Њ–≤–Њ–≤ –Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –њ–Њ–ї–љ—Л–Љ –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ–Љ —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —З–µ—А–µ–Ј 2 –Љ–µ—Б. –Њ—В –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, 2 –Ї—Г—А—Б–∞ –У–Ь–Ф–Я (–Ы–Є–Ї–Њ–њ–Є–і–∞) –≤ —Б—Г–Љ–Љ–∞—А–љ–Њ–є –і–Њ–Ј–µ 50 –Љ–≥ —Г–Љ–µ–љ—М—И–∞—О—В —З–∞—Б—В–Њ—В—Г —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Р—В–Ф –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ, —З–µ–Љ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П.–Р–≤—В–Њ—А—Л –Х.–Р. –Ъ–Њ–Ї–Њ–≤, –Э.–Т. –Ъ–Њ–ї–µ—Б–љ–Є–Ї–Њ–≤–∞, –Ы.–Э. –Ъ–Њ–Ї–Њ–≤–∞ –Ј–∞—П–≤–ї—П—О—В –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Ї–Њ–љ—Д–ї–Є–Ї—В–∞ –Є–љ—В–µ—А–µ—Б–Њ–≤; –Ґ.–Ь. –Р–љ–і—А–Њ–љ–Њ–≤–∞ —П–≤–ї—П–µ—В—Б—П —Б–Њ—В—А—Г–і–љ–Є–Ї–Њ–Љ –Р–Ю ¬Ђ–Я–µ–њ—В–µ–Ї¬ї.












