Введение
Недостаточность противоинфекционной защиты является одной из причин возникновения и рецидивирующего течения пиодермии [1]. В этой связи выкристаллизовывается целесообразность включения иммунокоррекции в комплексное лечение хронических форм этого заболевания [2].Среди различных иммунотропных средств, эффективность которых изучалась у больных пиодермией, особого внимания заслуживают низкомолекулярные фрагменты пептидогликана клеточной стенки грамотрицательных бактерий — мурамилпептиды. Эти соединения, действуя через цитозольные NOD-подобные рецепторы, не только прямо и опосредованно стимулируют соответственно врожденные и адаптивные составляющие противоинфекционного ответа, но и способны снижать избыточные воспалительные реакции [3].
В 2013 г. в России зарегистрирован и разрешен к клиническому применению, в т. ч. при различных формах пиодермии и вторичных иммунодефицитных состояниях, проявляющихся в виде инфекционно-воспалительных хронических и рецидивирующих процессов кожи, природный иммуномодулятор Полимурамил — стандартизованная и полностью охарактеризованная композиция трех мурамилпептидных фрагментов пептидогликана клеточной стенки грамотрицательных бактерий. Компоненты препарата содержат остаток мезо-диаминопимелиновой кислоты, из-за наличия которой Полимурамил является не только агонистом внутриклеточных рецепторов NOD2, но и лигандом цитозольных рецепторов NOD1 [4].
Несмотря на то, что действенность Полимурамила в лечении пиодермии в целом доказана и отражена в инструкции по медицинскому применению, степень клинической эффективности, в частности способность индуцировать стойкую ремиссию заболевания, и характер иммуномодулирующего действия этого препарата у больных с хронической рецидивирующей пиодермией требуют уточнения.
Цель исследования — оценить клиническую эффективность Полимурамила и его влияние на отсроченную динамику концентрации провоспалительных и регуляторных цитокинов у больных с хронической рецидивирующей
пиодермией.
Материал и методы
Исследование проводилось как открытое рандомизированное испытание. У всех пациентов получено информированное согласие на участие в исследовании до начала лечения и выполнения каких-либо процедур.Клинической базой исследования была многопрофильная профессорская клиника «СитиМед» центра ООО «Экология здоровья» (г. Челябинск). Иммунологические исследования выполнены в Центральной научно-исследовательской лаборатории ФГБУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России (г. Челябинск).
Полимурамил предоставлен для исследования разработчиком/производителем — ООО «Корус Фарм» — в виде ампул по 0,5 мл, содержащих 200 мкг стандартизованной композиции трех мурамилпептидов, полученных из пептидогликана клеточной стенки грамотрицательных бактерий.
Критерии включения: больные c обострением хронической рецидивирующей пиодермии; информированное согласие пациента; мужской пол; возраст от 23 до 55 лет.
Критерии невключения: участие в любом другом исследовании; прием иммунотропных препаратов (иммуностимуляторов, иммуномодуляторов, иммунодепрессантов, цитостатиков) менее чем за 3 мес. до начала исследования; сахарный диабет 1-го и 2-го типа; верифицированные сифилис, ВИЧ/СПИД-инфекция, гепатиты С и В или положительные результаты лабораторных исследований на наличие возбудителей этих инфекций или специфических антител к ним; пациенты с заболеваниями в стадии декомпенсации, которые могли повлиять на проведение исследования (органические поражения центральной нервной системы, декомпенсированная патология сердечно-сосудистой системы, больные с любыми проявлениями почечной или острой печеночной недостаточности, онкологические заболевания); аутоиммунные заболевания (аутоиммунный тиреоидит, диффузный токсический зоб, ревматоидный артрит, системная красная волчанка).
Критерии исключения: невозможность или нежелание продолжать участие в исследовании; возникновение серьезных нежелательных явлений, которые могли быть расценены как связанные с приемом Полимурамила; несоблюдение пациентом режима лечения и обследования; индивидуальная непереносимость Полимурамила.
В исследование включены 35 мужчин в возрасте 23–55 лет с обострением хронической рецидивирующей пиодермии (остиофолликулит, фолликулит, сикоз, фурункулез).
За 1 день до начала лечения (0-й день) проведено обследование всех включенных в исследование больных: собран полный медицинский анамнез, осуществлены физикальный осмотр с фотофиксацией и дерматоскопией, клинический анализ крови, определение цитокинов в плазме крови, посев из фурункула (при возможности взятия материала).
Распределение пациентов по группам проводилось случайным образом:
1-я группа — основная (18 человек), в которой больные получали внутримышечно Полимурамил по 200 мг ежедневно в течение 5 сут (1–5-й дни исследования) в сочетании со стандартной терапией, включающей топические антисептические (фукорцин наружно на область высыпаний 3–4 р./сут в течение 7–14 дней) и антибактериальные средства (фузидовая кислота (крем или мазь 2%) наружно на область высыпаний 3–4 р./сут в течение 7–14 дней), а при необходимости (при поражении лица и/или распространенном процессе) — системно действующие антибактериальные средства (доксициклина моногидрат 100 мг перорально 2 р./сут в течение 10 дней);
2-я группа — сравнения (17 человек), в которой пациенты получали только стандартную терапию, как описано выше.
Клинические симптомы пиодермии оценивали ежедневно с 0-го по 7-й день, затем на 14-й день, через 1 и 6 мес. исследования.
Критерии клинической эффективности: во время каждого визита в течение всего исследования подсчитывали общее число пустул/фурункулов у больных. Через 6 мес. исследования сравнивалось количество больных в группах с наличием/отсутствием морфологических элементов пиодермии.
При оценке клинического эффекта на 14-й день, через 1 и 6 мес. исследования использовались следующие градации: значительное улучшение, улучшение, без эффекта.
Значительным улучшением считали:
на 14-й день — полное разрешение патологического процесса (отсутствие пустул, отека, гиперемии), отсутствие новых элементов в течение 14 дней, легкая поствоспалительная гиперпигментация; через 1 мес. — сохранение полной клинической ремиссии заболевания, отсутствие новых элементов, отсутствие поствоспалительной гиперпигментации; через 6 мес. — сохранение полной клинической ремиссии заболевания, отсутствие новых элементов, отсутствие поствоспалительной гиперпигментации.
Улучшением считали: на 14-й день — разрешение патологического процесса, единичные (не более 2 элементов в одной анатомической зоне) высыпания, выраженная поствоспалительная гиперпигментация, отсутствие появления новых элементов; через 1 мес. — сохранение клинической ремиссии заболевания, появление единичных (не более 2 в одной анатомической зоне) новых элементов, невыраженная поствоспалительная гиперпигментация; через 6 мес. — сохранение клинической ремиссии заболевания, появление новых единичных (не более 2 в одной анатомической зоне) элементов, сохранение невыраженной гиперпигментации.
Отсутствием эффекта считали: на 14-й день — сохраняющиеся признаки воспалительного процесса в уже существовавших элементах (умеренная гиперемия, болезненность, инфильтрация), появление новых пустул (более 2 в одной анатомической зоне), присутствие выраженной поствоспалительной гиперпигментации; через 1 мес. — отсутствие клинической ремиссии, сохранение признаков воспалительного процесса (умеренная гиперемия, болезненность, инфильтрация), появление новых пустул (более 2 в одной анатомической зоне); через 6 мес. — отсутствие клинической ремиссии, сохранение признаков воспалительного процесса (умеренная гиперемия, болезненность, инфильтрация), появление новых пустул (более 2 в одной анатомической зоне), более 2 обострений заболевания за 6 мес.
Концентрацию цитокинов (фактор некроза опухоли (ФНО-α), интерферон-γ, интерлейкин (ИЛ)-1β, ИЛ-4, ИЛ-8, ИЛ-10) в плазме крови определяли на 0-й, 14-й дни и через 6 мес. исследования с помощью «сэндвич»-варианта твердофазного иммуноферментного анализа с применением наборов реагентов производства АО «Вектор-Бест» (Новосибирск) в соответствии с приложенными инструкциями.
Статистическая обработка результатов осуществлялась с помощью программы Statistica 10 (StatSoft, США). Значимость отличий количественных показателей независимых выборок определяли с помощью U-критерия Манна — Уитни, зависимых выборок — критерия Уилкоксона. Значимость отличий независимых выборок по качественным признакам оценивали с помощью точного критерия Фишера, зависимых выборок — критерия МакНемара. Статистически значимыми считали отличия при p<0,05.
Результаты и обсуждение
Все пациенты, включенные в исследование, завершили его согласно протоколу.Анализ результатов первичного обследования больных, проведенного до начала лечения, не выявил межгрупповых отличий по анамнестическим, клиническим и лабораторным признакам и возрасту. Таким образом, рандомизация привела к формированию вполне сопоставимых групп больных. В обеих группах преобладали пациенты с 2–3 рецидивами пиодермии в течение предыдущего года.
Не зарегистрировано ни одного случая нежелательных явлений у включенных в исследование больных и непереносимости Полимурамила.
Выраженность основных симптомов пиодермии снижалась в течение 1-го мес. наблюдения в обеих группах, но к 6–7-му дню проявлялись клинические преимущества лечения, включающего внутримышечные инъекции Полимурамила; эти преимущества становились еще более заметными на 14-й день и через 1 мес. от начала исследования и сохранялись в течение полугода.
Добавление Полимурамила к стандартному лечению обострения пиодермии вызывало выраженную тенденцию к увеличению доли больных, у которых зарегистрировано значительное улучшение, и к снижению числа пациентов без эффекта на 14-й день, а также через 1 и 6 мес. исследования (табл. 1).
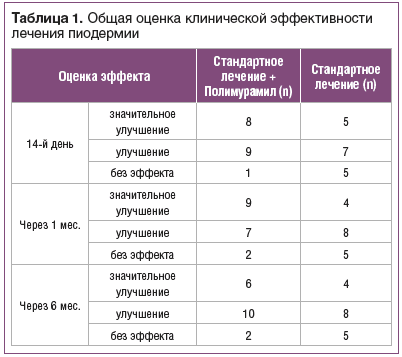
Полимурамил существенно изменял динамику числа пустул/фурункулов. Если у больных группы сравнения математически подтвержденное снижение количества морфологических элементов пиодермии наблюдалось только с 7-го дня исследования (рис. 1), то у пациентов, получавших в комплексном лечении Полимурамил, статистически значимое падение числа пустул/фурункулов отмечали уже с 3-го дня исследования (рис. 2).

Через 6 мес. от начала исследования количество морфологических элементов пиодермии у пациентов основной группы было значительно ниже, чем у больных группы сравнения (рис. 1 и 2).
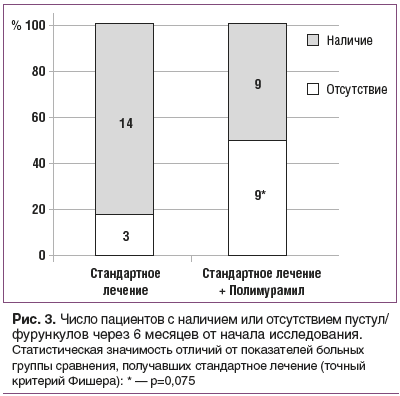
У половины пациентов, получавших Полимурамил, через полгода пустулы/фурункулы отсутствовали. При этом доля больных с отсутствием основных морфологических элементов пиодермии через 6 мес. от начала исследования в основной группе была заметно выше, чем таковая в группе сравнения (рис. 3). Статистическая значимость этого отличия (p=0,075) была близка к уровню, при котором нулевая гипотеза в медико-биологических исследованиях традиционно отклоняется.
Выявлены различия между группами в отсроченной динамике концентрации ряда цитокинов в плазме крови после проведенного лечения (табл. 2). В основной группе уровни провоспалительного цитокина ФНО-α и хемоаттрактанта нейтрофилов ИЛ-8 имели заметный нисходящий тренд на 14-й день исследования, а через полгода были существенно ниже, чем до лечения. У больных, получавших Полимурамил, обнаружено значительное снижение содержания еще одного провоспалительного медиатора ИЛ-1β через 6 мес., тогда как в группе сравнения к этому сроку отмечена лишь тенденция к падению исходного уровня указанного цитокина.

У пациентов основной группы концентрации интерферона-γ и ИЛ-4 начинали существенно снижаться уже
с 14-го дня наблюдения, а через полгода уровень ИЛ-4 был в математически подтвержденной степени ниже, чем в группе сравнения.
Через 6 мес. установлено значительное падение содержания противовоспалительного цитокина ИЛ-10 в основной группе, тогда как у пациентов группы сравнения наблюдалась лишь тенденция к снижению этого показателя.
Вышеуказанные сдвиги концентрации цитокинов в плазме крови, связанные с применением Полимурамила, в целом можно трактовать как результат индукции клинической ремиссии заболевания и снижения числа участков и выраженности инфекционного воспаления в коже. При этом регрессия уровней противовоспалительного цитокина ИЛ-10, стимуляторов клеточного и гуморального ответа интерферона-γ и ИЛ-4, а также хемокина для нейтрофилов ИЛ-8 может отражать вполне закономерное падение выраженности компенсаторных и ответных реакций на фоне снижения выработки эндогенных флогогенных факторов и степени колонизации/поражения кожи патогенными бактериями.












