Боль является наиболее частым симптомом, ассоциированным с диабетической нейропатией. Согласно литературным данным, диабетическая нейропатическая боль (ДНБ) развивается в 10–20% случаев в диабетической популяции и в 40–50% случаев – при диагностированной нейропатии [3]. ДНБ является симптомом ранней манифестации диабетической нейропатии и нередко появляется у пациентов с предиабетом – в случаях нарушения гликемии натощак или при нарушении толерантности к глюкозе (НТГ). Существуют данные о том, что пациенты с НТГ обращаются с жалобами на боли, аналогичные ДНБ, в 1/3 случаев [4–6], или боль диагностируется до установления диагноза СД [7]. Часто боль описывается пациентом как жжение, покалывание, она бывает стреляющей, ноющей или сопровождается судорогами, носит постоянный характер, начинается в стопах и распространяется проксимально с течением времени. У пациентов с ДНБ также могут наблюдаться аллодиния и гипералгезия, особенно беспокоящие в ночное время и нарушающие сон. При сочетании всех симптомов и их значительной выраженности существенно снижается качество жизни [8].
ДНБ может быть вызвана острой сенсорной или хронической сенсомоторной нейропатией [9]. Острая сенсорная нейропатия обычно встречается у пациентов с плохим контролем СД 1-го типа. Боль начинается остро и имеет характер выраженного жжения, бывает ноющей, иногда пронзающей наподобие электрического разряда. Предполагается, что острое начало боли сопровождает выраженные колебания концентрации глюкозы в крови, что связано с ишемическими состояниями периферического нерва [10].
Хроническая сенсомоторная нейропатия характеризуется постепенным началом и связана, как полагают, с метаболическими изменениями периферических нервных волокон вследствие хронической гипергликемии [9]. Наиболее часто ДНБ является следствием хронической сенсомоторной нейропатии, но может возникать и при других диабетических невропатиях, например плексопатии [11], мононейропатии как результат туннельных синдромов [12, 13] и мультифокальных нейропатий [11]. Через месяцы и годы существования ДНБ может уменьшиться, и на передний план выйдут симптомы потери чувствительности, свидетельствующие о развитии инвалидизирующей диабетической стопы с утратой защитной чувствительности.
В настоящее время обсуждается комплекс связанных между собой различных патофизиологических звеньев, которые играют важную роль в патогенезе диабетической полинейропатии [1, 14]. При увеличении внутриклеточной концентрации глюкозы ее избыток восстанавливается альдозоредуктазой до сорбитола с потреблением никотинамидадениндинуклеотидфосфата (НАДФ), который необходим для регенерации восстановленного глутатиона. Глутатион в свою очередь является важным внутриклеточным антиоксидантом [15–17].
Образование конечных продуктов гликирования (КПГ) и их предшественников (метилглиоксаль) приводит также к повреждению тканей. Метилглиоксаль реагирует со свободными аминогруппами лизина и аргинина в составе белков, образуя КПГ [15] внутри клеток, что приводит к нарушению их функции, воспалению, изменению транскрипции генов, структуры белков внеклеточного матрикса и циркулирующих белков крови.
Повреждение тканей вызывает механизм активации протеинкиназы С (РКС), что способствует активации внутриядерного фактора каппа-В (NFkB), подавляет эндотелиальную синтетазу оксида азота (eNOS), повышает уровень эндотелина-1, трансформирующего фактора роста β (TGF-β) и ингибитора активатора плазминогена-1 (PAI-1). В итоге это приводит к нарушению кровотока и окклюзии капилляров [18, 19].
При гексозаминовом механизме глутамин – фруктозо-6-фосфат амидотрансфераза (GFAT) трансформирует глюкозо-6-фосфат в глюкозамин-6-фосфат и затем в уридиндифосфат-N-ацетилглюкозамин. Этот конечный продукт метаболизма вызывает нарушения транскрипции, приводя к гиперэкспрессии TGF-β, PAI-1 и изменению структуры белковых рецепторов, вследствие чего развивается резистентность к инсулину [20].
Все эти патогенетические пути объединены общим процессом – усиленной продукцией свободнорадикального супероксид-аниона и активных форм кислорода. Супероксид-анион, образующийся в виде побочного продукта окисления глюкозы, активирует основные пути гипергликемического повреждения тканей, снижая при этом активность глицеральдегид-3-фосфата (GAPDH) – основного фермента гликирования [21–23].
Данные механизмы приводят к сосудистым и метаболическим изменениям, которые сначала проявляются обратимыми функциональными повреждениями нервов, а впоследствии – серьезными морфологическими дефектами вплоть до необратимых. Таким образом, диабетическая полинейропатия отличается сложнейшим многофакторным патогенезом, но, несмотря на обилие теорий развития этого осложнения, ее основным патогенетическим фактором является гипергликемия.
Многие крупные рандомизированные исследования показали, что ранний интенсивный гликемический контроль снижает риск развития осложнений СД. Однако существуют другие данные, говорящие о долгосрочном влиянии раннего гликемического контроля на клинические исходы заболевания, на основании чего была выдвинута концепция «гипергликемической памяти», или «метаболической памяти» [Ihnat et al., 2007].
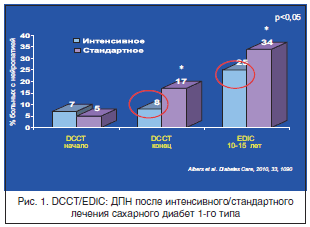
О роли «гипергликемической памяти» впервые свидетельствуют результаты рандомизированного контролируемого исследования контроля и осложнений диабета (Diabetes Control and Complications Trial (DCCT), 1993) и исследования «Эпидемиология лечения и осложнений диабета» (Epidemiology of Diabetes Interventions and Complications (EDIC)) [JAMA, 2002]. В этих исследованиях участвовал 1441 пациент с СД 1-го типа в возрасте 13–39 лет. Пациенты получали традиционную и интенсивную инсулинотерапию. По истечении периода последующего наблюдения (в среднем – 6,5 года) было обнаружено прогрессирование диабетических нейропатии и ретинопатии в обеих группах, однако кривая зависимости была более крутой у пациентов, получавших традиционную терапию. Эта разница в значительной мере соотносилась с уровнем гликированного гемоглобина (HbA1c): при традиционной инсулинотерапии он составлял 9,1%, при интенсивной инсулинотерапии – 7,3% (рис. 1).
Пациенты, получавшие интенсивную инсулинотерапию, после завершения рандомизированной контролируемой фазы исследования DCCT продолжили участие в нем, а больным, получавшим традиционную терапию, было рекомендовано перейти на интенсивную инсулинотерапию. Это привело к повышению уровня HbA1c в 1-й группе с 7,3 до 7,9% и к его снижению с 9,1 до 8,3% во 2–й группе. Значения HbA1c в обеих группах стали статистически неразличимыми и не менялись на протяжении всего исследования EDIC. Кривые прогрессирования нейропатии оставались неизменными в обеих группах, различие между группами было достоверно на протяжении 15-летнего наблюдения за пациентами [24].
Представленные результаты свидетельствуют о том, что предшествующие высокие показатели уровня глюкозы могут влиять на риск будущих осложнений СД. Даже длительное поддержание удовлетворительного уровня глюкозы может не снижать скорость развития осложнений СД. Этот феномен также наблюдается у больных СД 2-го типа, и для них роль «гипергликемической памяти» может быть более актуальной с учетом отсроченного установления диагноза [24].
Возможные патобиологические механизмы «гипергликемической памяти» были изучены на эндотелиальных клетках артерий человека и на модели грызунов в отсутствие диабета [El-Osta et al., 2008]. Как в условиях in vitro, так и в условиях in vivo преходящая гипергликемия (продолжительностью 16 и 6 ч соответственно) вызывала долгосрочные активирующие эпигенетические изменения в промоторе субъединицы p65NFkB (так называемые «белки теплового шока») [20, 25]. Эти изменения оставались неизменными на протяжении последующих 6 дней, в течение которых наблюдался нормальный уровень глюкозы в крови, и их можно было предотвратить путем уменьшения образования активных форм кислорода или метилглиоксаля [26]. Подобные долгосрочные эпигенетические изменения опосредованы участием гистон-модифицирующих ферментов, ремоделирующих цепи хроматина ДНК для обеспечения транскрипции гена [26].
Существование феномена «гипергликемической памяти» свидетельствует о необходимости раннего адекватного и длительного гликемического контроля и введения препаратов для сокращения количества внутриклеточных активных форм кислорода, уменьшения скорости развития или устранения последствий отдаленных осложнений СД [Ihnat et al., 2007].
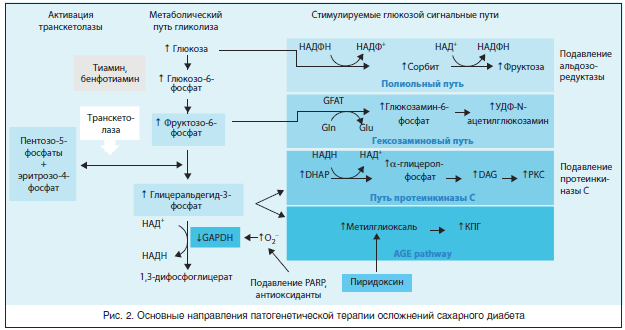
Рассмотренные патогенетические механизмы гипергликемического поражения позволяют обосновать применение ингибиторов PARP (фермент поли-АДФ-рибозо-полимераза), ингибиторов альдозоредуктазы, активаторов транскетолазы и антиоксидантов [27]. В нескольких клинических исследованиях были применены ингибиторы альдозоредуктазы. В исследованиях, проведенных Thornalley et al., определяли преимущества активатора транскетолазы – бенфотиамина при лечении осложнений СД. Транскетолаза – тиамин-зависимый фермент, являющийся лимитирующим компонентом неокислительной стадии пентозофосфатного пути, когда образуются фруктозо-6-фосфат и глицеральдегид-3-фосфат (рис. 2). Увеличение количества этих метаболитов вследствие гипергликемии теоретически может приводить к их превращению в пентозо-5-фосфат и эритрозо-5-фосфат при условии, что транскетолаза активирована ее кофактором тиамином или жирорастворимой формой тиамина – бенфотиамином [28].
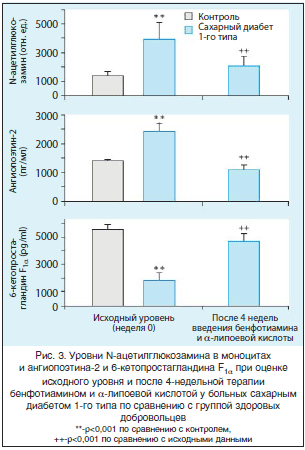
Hammes et al. (2003) в экспериментах на эндотелиальных клетках аорты и в длительных экспериментах на моделях диабетической ретинопатии у животных смогли продемонстрировать, что бенфотиамин подавляет пути развития гипергликемических повреждений, опосредованные гексозамином, РКС и КПГ, а также связанную с гипергликемией активацию NFkB. Введение бенфотиамина также предупреждало развитие экспериментальной диабетической ретинопатии [29]. С целью подтверждения этих экспериментальных данных было проведено клиническое исследование [25] с участием больных СД 1-го типа (9 пациентов с длительностью заболевания от 0 до 15 лет) без микро- или макрососудистых осложнений. Больные получали перорально комбинацию бенфотиамина 300 мг 2 р./сут и α-липоевой кислоты 600 мг 2 р./сут в течение 4-х нед. Выбор данной комбинации обусловливал возможное благоприятное действие антиоксидантов на инактивацию простациклинсинтазы в условиях гипергликемии [25].
В данной работе терапия бенфотиамином и α–липоевой кислотой обеспечивала нормализацию маркера образования КПГ (ангиопоэтина-2) и приводила к снижению на 40% уровня модифицированных под действием N-ацетилглюкозамина белков в моноцитах крови [25]. Активность простациклинсинтазы, которая у больных СД 1-го типа часто значительно снижена, практически нормализовалась после 4-недельного приема бенфотиамина и α-липоевой кислоты (4,698±533 пг/мл 6-кето-PGF1α), при этом не наблюдалось снижения уровня глюкозы в крови, фруктозамина и HbA1 (рис. 3).
Патофизиологические исследования позволяют по-новому взглянуть на связь между высоким уровнем глюкозы и нарушением клеточного метаболизма, что способствует разработке патогенетических подходов к лечению осложнений СД [32].
Подобной направленностью действия обладают нейротропные витамины группы В: тиамин (В1), пиридоксин (В6), цианокобаламин (В12). Уникальным препаратом, содержащим комбинацию бенфотиамина и пиридоксина, является препарат Мильгамма композитум. У бенфотиамина возможность проникать внутрь клетки намного больше, чем у водорастворимых тиаминов, что определяет более высокий внутриклеточный уровень тиаминдифосфата. Достаточное количество бенфотиамина в тканях способствует активности ферментных систем и нейтрализации КПГ, оказывает положительное влияние на дегенеративные процессы в нервном волокне, улучшает кровоток в тканях, увеличивает количество АТФ [30–32].
Было продемонстрировано, что бенфотиамин блокирует основные патологические механизмы: образование КПГ, гексозамина и протеинкиназы – С-диацилглицерина. Помимо блокирования данных механизмов бенфотиамин способствует включению глюкозы в пентозофосфатный цикл путем активации транскетолазы. Было также установлено, что бенфотиамин воздействует на боль как воспалительного, так и нейропатического происхождения. Этот объединенный механизм был описан Brownlee, за что он был удостоен медали Американской диабетической ассоциации [15, 16].
Витамин В6 в своей фосфорилированной форме (пиридоксаль-5`-фосфат-ПФ) является коферментом большого числа ферментов, которые участвуют в общем неокислительном обмене аминокислот, частично – жиров. Наряду с бенфотиамином пиридоксину свойственно анальгетическое действие. Как показали исследования, воздействие оказывается непосредственно на болевые рецепторы, чувствительность которых варьирует в результате влияния различных тканевых гормонов (брадикинин) и нейропептидов [1, 14, 33].
Сенсибилизация болевых рецепторов может проявляться воспалительной гиперальгезией. В стволе головного мозга существуют области, которые оказывают тормозящее влияние на вторичный нейрон, притупляя болевую чувствительность. При этом пиридоксальфосфат выступает в качестве кофермента в синтезе серотонина, являющегося медиатором. Вероятно, на данном этапе реализуется анальгетическое действие фармакологических доз пиридоксина [22, 31]. Бенфотиамин и пиридоксин потенцируют действие друг друга.
Первое плацебо-контролируемое исследование положительного влияния бенфотиамина и витамина В6 на состояние пациентов с диабетической полинейропатией было проведено в 1989 г., его данные были впоследствии подтверждены другими авторами [29, 30, 34].
Эффективность бенфотиамина при диабетической полинейропатии подтверждена также в нескольких плацебо-контролируемых двойных исследованиях. В работе Ledermann 20 пациентов с диабетической полинейропатией получали бенфотиамин в ежедневной дозе 320 мг (в сочетании с витаминами В6 и В12) или плацебо. Исследовались такие субъективные критерии, как показатель нейропатии (Katzenwadel) и объективные величины (измерение вибрационного порога с помощью калибровочного камертона). Через 3 нед. приема препарата наблюдались улучшение показателей полинейропатии (на основании шкалы нейропатических нарушений) (p<0,01) и вибрационных ощущений (p<0,01), а также уменьшение болевых ощущений (p<0,01) и расстройств чувствительности (p<0,05) [14, 35].
В исследовании Stracke эффективность бенфотиамина также была подтверждена с помощью оценки объективного параметра – скорости проведения импульса по нерву. 24 больным СД 1-го и 2-го типов с диабетической полинейропатией был назначен прием бенфотиамина более 3 мес. В течение первых 2-х нед. больные получали 320 мг бенфотиамина в сутки, а затем ежедневно по 120 мг до 12-й нед. Через 3 мес. терапии в группе, получавшей бенфотиамин, скорость проведения по нерву (n. peroneus) достоверно улучшилась (p<0,006), а в группе, получавшей плацебо, – ухудшилась. Отмечалось также улучшение вибрационного порога на 30%, в группе плацебо – ухудшение на 32%. Через 12 мес. с начала приема препарата скорость проведения импульса по n. рeroneus еще более увеличилась (p<0,005). Во время приема препарата в течение всего периода исследования нежелательных явлений не отмечалось [30, 35]. Экспериментальные данные показали благоприятное влияние бенфотиамина на проявление автономной нейропатии.
Положительные сдвиги в функционировании вегетативной нервной системы под влиянием Мильгаммы композитум подтверждались динамикой кардиоваскулярных тестов при проведении кардиоинтервалографии, что было показано А.М. Вейном и А.Б. Даниловым [14, 36].
Установлено, что бенфотиамин с помощью процессов, происходящих при участии NO, способен компенсировать нейрональный и сосудистый дефицит. В связи с этим интересными представляются результаты совместного исследования Нью-Йоркской рабочей группы (под руководством H. Vlassara, США) и исследователей из Дюссельдорфа и диабетического центра в Бад-Ойнхаузене (Германия). С помощью лазерной допплеровской флоуметрии было установлено, что через 1 ч после еды, содержащей токсические КПГ, микрососудистая функция у больных СД 2-го типа значительно ухудшалась, что проявлялось сужением просвета сосудистого русла. Благодаря приему бенфотиамина можно предупредить развитие сосудистой дисфункции, вызванной конечными продуктами гликозилирования, что крайне актуально в профилактике осложнений СД [14, 30].
Поражение микрососудов, обусловленное повреждающим действием хронической гипергликемии, может приводить к слепоте, почечной недостаточности и ампутации конечностей, в то время как макрососудистые осложнения становятся причиной атеросклеротического поражения сердечно-сосудистой системы. Как микро-, так и макрососудистые осложнения влияют на качество жизни пациентов и обусловливают значительную часть затрат в системе общественного здравоохранения [24].
Существование феномена «гипергликемической памяти» дает основания предполагать, что многие больные СД утрачивают способность к восстановлению оптимального контроля уровня глюкозы в крови после длительного периода его повышения. Учитывая, что оптимальный контроль уровня глюкозы достигается у меньшинства пациентов, возрастает необходимость в дополнительных, обусловленных особенностями патогенеза методах лечения диабетической полинейропатии [17, 37].
Терапевтическая эффективность бенфотиамина при диабетической нейропатии патогенетически обоснованна. Применение бенфотиамина и пиридоксина открывает новые возможности использования Мильгаммы композитум в патогенетическом лечении сосудистых осложнений СД, особенно учитывая способность бенфотиамина влиять на транскетолазу и тем самым – на пентозофосфатный путь. Пероральную терапию препаратом Мильгамма композитум, содержащим 100 мг бенфотиамина и 100 мг пиридоксина, рекомендуется проводить длительно, в течение 6–8 нед. по 1 драже 3 р./сут.
Таким образом, клинические исследования подтверждают, что бенфотиамин в комбинации с пиридоксином является эффективным и надежным нейротропным средством, позволяющим обеспечивать всестороннюю защиту от тяжелых последствий СД.
Литература
1. Строков И.А., Манухина Е.Б., Бахтина Л.Ю. с соавт. Состояние эндогенных протекторных систем у больных инсулинзависимым сахарным диабетом с полинейропатией – эффект антиоксидантной терапии // Бюлл. экспер. биол. и мед. 2000. № 10. С. 437–442.
2. Гурьева И.В., Давыдов О.С. Невропатическая боль при сахарном диабете: причины, диагностика и обзор международных рекомендаций и алгоритмов лечения // Consilium medicum. 2013. № 4. Т. 15. С. 14–20.
3. Galer B.S. et al. Painful diabetic polyneuropathy: epidemiology, pain description, and quality of life // Diabetes Res Clin Pract. 2000. Vol. 47 (2). Р. 123–128.
4. Boulton A.J. et al. Diabetic neuropathies: a statement by the American Diabetes Association // Diabetes Care. 2005. Vol. 28. Р. 956–965.
5. Feldman E.L. et al. Somatosensory neuropathy. In: Inzucchi S. ed. The Diabetes Mellitus Manual. New York: McGraw-Hill, 2005. Р. 366–384.
6. Singleton J.R. et al. Microvascular complication of impaired glucose tolerance // Diabetes. 2003. Vol. 52. Р. 2867–2873.
7. Singleton J.R., Smith A.G., Bromberg M.B. Painful sensory polyneuropathy associated with impaired glucose tolerance // Muscle Nerve. 2001. Vol. 24 (9). Р. 1225–1228.
8. Dworkin R.H. et al. Symptom profiles differ in patients with neuropathic versus non-neuropathic pain // J Pain. 2007. Vol. 8. Р. 118–126.
9. Boulton A.J. Painful diabetic neuropathies. In: Cervero F., Jensen T.S., eds. Handbook of Clinical Neurology. Oxford: Elsevier, 2006. Р. 609–619.
10. Tesfaye S. et al. Prevalence of diabetic peripheral neuropathy and its relation to glycaemic control and potential risk factors: the EURODIAB IDDM Complication Study // Diabetologia. 1996. Vol. 39 (11). Р. 1377–1384.
11. Thomas P.K., Tomlinson D.R. Diabetic and hypoglycemic neuropathy. In: Dyck D.J., Thomas P.K., eds. Peripheral Neuropathy. Philadelphia: WB Saunders, 1993. Р. 1219–1241.
12. Wilbourn A.J., Dyck P.J., Thomas P.K. Diabetic entrapment and compression neuropathies. In: Dyck D.J., Thomas P.K., eds. Diabetic Neyropathy. Philadelphia: WB Saunders, 1999. Р. 481–508.
13. Thomas P.K., Ochoa J. Clinical features and differential diagnosis. In: Peripheral Neuropathy, In: Dyck P.J., Thomas P.K., Griffin J.W., Low P.A., Poduslo J.F., eds. Peripheral Neuropathy. Philadelphia: WB Saunders, 1993. Р. 749–774.
14. Аметов А.С., Строков И.А. Диабетическая полинейропатия настоящее и будущее // Российские медицинские вести. 2001. Т. 4. № 1. С. 35–40.
15. Thornally P.J., Glyoxalase I. Structure, function and a critical role in the enzymatic defence against glycation // Biochem Soc Trans. 2003. Vol. 31. Р. 1343–1348.
16. Thornalley P.J. The potential role of thiamine (vitamin B1) in diabetic complications // Curr Diabetes Rev. 2005. Vol. 1. Р. 287–298.
17. Zigler D. Thioctic acid for patients with symptomatic diabetic polyneuropathy: a critical review // Treat Endocrinol. 2004. Vol. 3. Р. 173–189.
18. Du X., Edelstein D., Obici S., Higham N., Zou M.H., Brownlee M. Insulin resistance reduces arterial prostacyclin synthase and eNOS activities by increasing endothelial fatty acid oxidation // J Clin Invest. 2006. Vol. 116. Р. 1071–1080.
19. Thornalley P.J., Jahan I., Ng R. Suppression of the accumulation of triosephosphates and increased formation of methylglyoxal in human red blood cells during hyperglycaemia by thiamine in vitro // J Biochem. 2001. Vol. 129. Р. 543–549.
20. Yang X., Ongusaha P.P., Miles P.D., Havstad J.C., Zhang F., So W.V., Kudlow J.E., Michell R.H., Olefsky J.M., Field S.J., Evans R.M. Phosphoinositide signalling links O-GlcNAc transferase to insulin resistance // Nature. 2008. Vol. 451. Р. 964–969.
21. Brownlee M. Biochemistry and molecular cell biology of diabetic complications // Nature. 2001. Vol. 414. Р. 813–820.
22. Du X., Edelstein D., Rossetti L., Fantus I.G., Goldberg H., Ziyadeh F., Wu J., Brownlee M. Hyperglycemia-induced mitochondrial superoxide overproduction activates the hexosamine pathway and induces plasminogen activator inhibitor-1 expression by increasing SP1 glycosylation // Proc Nat Acad Sci USA. 2000. Vol. 97. Р. 12222–12226.
23. Du X., Matsumura T., Edelstein D., Rosetti L., Zsengeller Z., Szabo C., Brownlee M. Inhibition of GADPH activity by poly-(ADP ribose-) polymerase activates three major pathways of hyperglycemic damage in endothelial cells // J Clin Invest. 2003. Vol. 112. Р. 1049–1057.
24. EDIC: The Writing Team for the Diabetes Control and Complications Trial / Epidimiology of Diabetes Interventions and Complications Research Group. Effect of intensive therapy on microvascular complications of type 1 diabetes mellitus // J Am Assoc. 2002. Vol. 287. Р. 2563–2569.
25. Du X., Edelstein D., Brownlee M. Oral benfotiamine plus α-lipoic acid normalizes complication-causing pathways in type 1 diabetes // Diabetologia. 2008. Vol. 51. Р. 1930–1932.
26. Turner B.M. Defining an epigenetic code // Nat Cell Biol. 2007. Vol. 9. Р. 2–6.
27. Chalk C., Benstead T.J., Moore F. Aldose reductase inhibitors for the treatment of diabetic polyneuropathy // Cochrane Database Syst Rev. 2007. Vol. 4. CD 004572.
28. Thornalley P.J., Babaei-Jadidi R. Prevention of microvascular complications of diabetes by high-dose S-benzoylthiamine monophosphate (benfotiamine): mechanism of thiamine delivery into cells // Diabetologia. 2005. Vol. 48. Р. 377.
29. Hammes H.P., Du X., Edelstein D., Taguchi T. et al. Benfotiamine blocks three major pathways of hyperglycemic damage and prevents experimental diabetic retinopathy // Nat Med. 2003. Vol. 9. Р. 194–299.
30. Аметов А.С., Солуянова Т.Н. Преимущества бенфотиамина в лечении диабетической полинейропатии // Эффективная фармакотерапия в эндокринологии. 2008. № 1. С. 50–55.
31. Beltramo E., Berrone E., Tarallo S., Porta M. Effects of thiamine and benfotiamine on intracellular glucose metabolism and relevance in the prevention of diabetic complications // Acta Diabetol. 2008. Vol. 45. Р. 131–141.
32. Brownlee M. The pathobiology of diabetic complications. An unifying mechanism // Diabetes. 2005. Vol. 54. Р. 1615–1625.
33. Kempler P., Tesfaye S., Chaturvedi N. et al. Autonomic neuropathy is associated with increased cardiovascular risk factors: the EURODIAB IDM Complications Study // Diabet Med. 2002. Vol. 19. Р. 900–909.
34. Haupt E., Ledermann H., Kopcke W. Benfotiamine in the treatment of diabetic polyneuropathy – a three-week randomized, controlled pilot study (BEDIP study) // Int J Clin Pharmacol Ther. 2005. Vol. 43. Р. 71–77.
35. Zigler D., Ametov A., Barinov A. et al. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial // Diabetes Care. 2006. Vol. 29. Р. 2356–2370.
36. Ткачева О.Н., Вёрткин А.Л. Диабетическая автономная невропатия: руководство для врачей. М.: ГЭОТАР-Медиа, 2009. С. 115.
37. Nishikawa T., Edelstein D., Du X., Yamagishi S., Matsumura T., Kaneda Y., Yorek M.A., Beebe D., Oates P.J., Hammes H.P., Giardino I., Brownlee M. Normalizing mitochondrial superoxide production blocks three pathways of hyperglycemic damage // Nature. 2000. Vol. 404. Р. 787–790.












