–Ю–і–љ–∞–Ї–Њ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Њ—Б—В–∞–µ—В—Б—П –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–∞ –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В–Є —Б–Њ—Ж–Є–∞–ї—М–љ–Њ –Ј–љ–∞—З–Є–Љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В–∞ –±–Њ–ї—М–љ—Л—Е –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П, –∞ –Є–Љ–µ–љ–љ–Њ –Њ—Б—В–µ–Њ–∞—А—В—А–Є—В–∞ (–Ю–Р) –Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –Т –љ–∞—Б—В–Њ—П—Й–µ–Љ –Њ–±–Ј–Њ—А–µ –Ї–Њ—Б–љ–µ–Љ—Б—П —В–Њ–ї—М–Ї–Њ –њ—А–Њ–±–ї–µ–Љ—Л –Ю–Р, –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј—Г –ґ–µ –њ–Њ—Б–≤—П—В–Є–Љ –Њ—В–і–µ–ї—М–љ—Г—О —Б—В–∞—В—М—О.
–Ю—Б—В–µ–Њ–∞—А—В—А–Є—В –Є –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П
–Ч–∞ –њ–µ—А–≤–Њ–µ –і–µ—Б—П—В–Є–ї–µ—В–Є–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –≤–µ–Ї–∞, –Њ–±–Њ–Ј–љ–∞—З–µ–љ–љ–Њ–µ –Т—Б–µ–Љ–Є—А–љ–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–µ–є –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П (–Т–Ю–Ч) –Ї–∞–Ї –Ї–Њ—Б—В–љ–Њ-—Б—Г—Б—В–∞–≤–љ–∞—П –і–µ–Ї–∞–і–∞, –Є–Ј—Г—З–µ–љ—Л —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—П –Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —З—В–Њ –Њ—В–Ї—А—Л–ї–Њ –љ–Њ–≤—Л–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ —В–µ—А–∞–њ–Є–Є —Б –њ–Њ–Ј–Є—Ж–Є–є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л. –Ш, –љ—Г–ґ–љ–Њ –њ—А–Є–Ј–љ–∞—В—М—Б—П, –љ–Њ–≤—Л–µ —Д–∞–Ї—В—Л –љ–∞—Б —Г–ґ–∞—Б–љ—Г–ї–Є!–°–µ—А–Є—П –љ–∞—Г—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Њ—Д–µ—Б—Б–Њ—А–∞ –Ы.–Ш. –Р–ї–µ–Ї—Б–µ–µ–≤–Њ–є –њ–Њ–і—В–≤–µ—А–і–Є–ї–∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ю–Р –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –љ–∞ —Г—А–Њ–≤–љ–µ 13%. –Ю–і–љ–∞–Ї–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–µ –≤ –Љ–∞–µ —Н—В–Њ–≥–Њ –≥–Њ–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ [1] —Г–≤–µ—А–µ–љ–љ–Њ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В –љ–∞–Љ –±–Њ–ї–µ–µ –≥–ї–Њ–±–∞–ї—М–љ—Л–µ —Ж–Є—Д—А—Л. –Ґ–∞–Ї, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ю–Р –Ї–Є—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 47,1% (95% –Ф–Ш 37,8вАУ56,7%), –±–µ–Ј –Њ–ґ–Є—А–µ–љ–Є—П вАУ 36,1% (95% –Ф–Ш 29,7вАУ42,9%) (–Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ–∞—П –њ–Њ–њ—Г–ї—П—Ж–Є—П –≤–Ї–ї—О—З–∞–ї–∞ 2218 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б—В–∞—А—И–µ 45 –ї–µ—В).
–Ф—А—Г–≥–Є–Љ —Д–∞–Ї—В–Њ–Љ, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—Й–Є–Љ –Њ–њ–∞—Б–љ–Њ—Б—В—М –Є —В—П–ґ–µ—Б—В—М –њ—А–Њ–±–ї–µ–Љ—Л, —П–≤–ї—П—О—В—Б—П –і–∞–љ–љ—Л–µ –Т–Ю–Ч –Є–Ј –њ—А–Њ–µ–Ї—В–∞ ¬Ђ–Ш–Ј—Г—З–µ–љ–Є–µ –≥–ї–Њ–±–∞–ї—М–љ–Њ–≥–Њ –±—А–µ–Љ–µ–љ–Є –±–Њ–ї–µ–Ј–љ–µ–є¬ї [2], –Ї–Њ—В–Њ—А—Л–µ —Г–Ї–∞–Ј—Л–≤–∞—О—В —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О –±–Њ–ї—М, –Ї–∞–Ї –Њ—Б–љ–Њ–≤–љ—Г—О –њ—А–Є—З–Є–љ—Г –љ–µ—В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –љ–∞—Б–µ–ї–µ–љ–Є—П. –С–Њ–ї–µ–≤—Л–µ —Б–Є–љ–і—А–Њ–Љ—Л –≤ —Б—В—А—Г–Ї—В—Г—А–µ –≥–ї–Њ–±–∞–ї—М–љ–Њ–≥–Њ –±—А–µ–Љ–µ–љ–Є –±–Њ–ї–µ–Ј–љ–µ–є –Ј–∞–љ–Є–Љ–∞—О—В –≤–µ–і—Г—Й–µ–µ –Љ–µ—Б—В–Њ –≤–Њ –≤—Б–µ—Е —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞, –њ—А–Є–≤–Њ–і—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –њ–Њ—Б–ї–µ–і–љ–Є—Е 20 –ї–µ—В –Ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ї–µ—В, –њ—А–Њ–ґ–Є—В—Л—Е —Б –љ–∞—А—Г—И–µ–љ–љ—Л–Љ –Ј–і–Њ—А–Њ–≤—М–µ–Љ, –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Г—Е—Г–і—И–µ–љ–Є—О –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –љ–∞—Б–µ–ї–µ–љ–Є—П.
–Т –і–∞–љ–љ–Њ–Љ –Њ–±–Ј–Њ—А–µ –Ю–Р –Њ—В–Љ–µ—З–∞–µ—В—Б—П 9-–є –њ–Њ –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –њ—А–Є—З–Є–љ–Њ–є, –љ–∞—А—Г—И–∞—О—Й–µ–є –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –љ–∞—Б–µ–ї–µ–љ–Є—П –†–§, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤ –Љ–Є—А–µ –≤ —Ж–µ–ї–Њ–Љ —Н—В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Ј–∞–љ–Є–Љ–∞–µ—В –ї–Є—И—М 13-—О –њ–Њ–Ј–Є—Ж–Є—О. –Ю–Р –≤ —З–Є—Б–ї–µ –≤–µ–і—Г—Й–Є—Е 10 –њ—А–Є—З–Є–љ —Г—Е—Г–і—И–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є —Е–∞—А–∞–Ї—В–µ—А–µ–љ –і–ї—П –Т–Њ—Б—В–Њ—З–љ–Њ–є –Х–≤—А–Њ–њ—Л –Є —Б—В—А–∞–љ –њ–Њ—Б—В—Б–Њ–≤–µ—В—Б–Ї–Њ–≥–Њ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞. –Э–µ –Є—Б–Ї–ї—О—З–µ–љ–Њ, —З—В–Њ –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –і–ї—П –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є —Б–≤—П–Ј–∞–љ–∞ —Б –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О –≤—Л—Б–Њ–Ї–Њ—В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є –њ–Њ —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є—О —Б—Г—Б—В–∞–≤–Њ–≤.
–°–Њ–±—Б—В–≤–µ–љ–љ—Л–µ –љ–∞—И–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–µ–і–µ–љ–Є—П –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В–∞ –±–Њ–ї—М–љ—Л—Е –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В, —З—В–Њ –±–Њ–ї—М –≤ —Б—Г—Б—В–∞–≤–∞—Е –Є —Б–њ–Є–љ–µ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ —Г 84% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –Ю–Р (–Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ –Є–ї–Є —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–Њ–≤) вАУ —Г 59,2%. –Я—А–Є —Н—В–Њ–Љ —П–і—А–Њ –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В–Є —Г –і–∞–љ–љ—Л—Е –±–Њ–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–Є–ї–Є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л (–∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П, –Є—И–µ–Љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї–µ–Ј–љ—М —Б–µ—А–і—Ж–∞) –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ (–°–Ф) 2-–≥–Њ —В–Є–њ–∞ –Є–ї–Є –±–µ–Ј –љ–µ–≥–Њ.
–Т —Н—В–Њ–є —Б–≤—П–Ј–Є —Б—В–Њ–Є—В –њ—А–Є–≤–µ—Б—В–Є –і–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ –≤ –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–Љ –ґ—Г—А–љ–∞–ї–µ —Б–µ—А–і—Ж–∞ [3], —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є–µ –Њ –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–Є —З–Є—Б–ї–∞ –±–Њ–ї—М—И–Є—Е –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Ю–Р:
вАҐ —А–Є—Б–Ї –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ вАУ 3,09 (2,69вАУ3,54);
вАҐ —А–Є—Б–Ї –Є–љ—Б—Г–ї—М—В–∞ вАУ 2,47 (2,22-2,75);
вАҐ —А–Є—Б–Ї —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–•–°–Э) вАУ 2,40 (2,06-2,79);
вАҐ —А–Є—Б–Ї –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є вАУ 1,71 (1,49вАУ1,98) [4].
–Ш–Љ–µ–љ–љ–Њ —Д–∞–Ї—В —Г–≤–µ–ї–Є—З–µ–љ–Є—П —А–Є—Б–Ї–∞ —Б–µ—А—М–µ–Ј–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–°–°–Ч) –Є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–∞, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Љ–∞–љ–Є—Д–µ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ю–Р –Ј–∞—Б—В–∞–≤–ї—П–µ—В –≤–Ј–≥–ї—П–љ—Г—В—М –љ–∞ –і–∞–љ–љ—Г—О –њ—А–Њ–±–ї–µ–Љ—Г —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –љ–µ —Б—В–Њ–ї—М–Ї–Њ –±–Њ–ї–µ–Ј–љ–Є, –Є–Ј–Љ–µ–љ—П—О—Й–µ–є –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є, —Б–Ї–Њ–ї—М–Ї–Њ –њ—А–Њ–±–ї–µ–Љ—Л, –≤–љ–Њ—Б—П—Й–Є–є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–є –≤–Ї–ї–∞–і –≤ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ–Њ–њ—Г–ї—П—Ж–Є–Є. –Р —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–µ –Є —Н–Ї—Б—В—А–∞–њ–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л–µ —А–∞—Б—З–µ—В—Л —Б —Г—З–µ—В–Њ–Љ –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Ю–Р –і–Њ 40% –Ј–∞—Б—В–∞–≤–ї—П—О—В –њ—А–Є–љ–Є–Љ–∞—В—М —А–µ—И–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—А—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б—В—А–∞—В–µ–≥–Є–є —В–µ—А–∞–њ–Є–Є.
–Р–љ–∞–ї–Є–Ј —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е –Є –ї–Є—В–µ—А–∞—В—Г—А–љ—Л—Е –і–∞–љ–љ—Л—Е –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞—В—М —Б–ї–µ–і—Г—О—Й–Є–µ –њ—А–Є—З–Є–љ—Л, –њ–Њ –Ї–Њ—В–Њ—А—Л–Љ –Ю–Р –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б–Љ–µ—А—В–љ–Њ—Б—В—М:
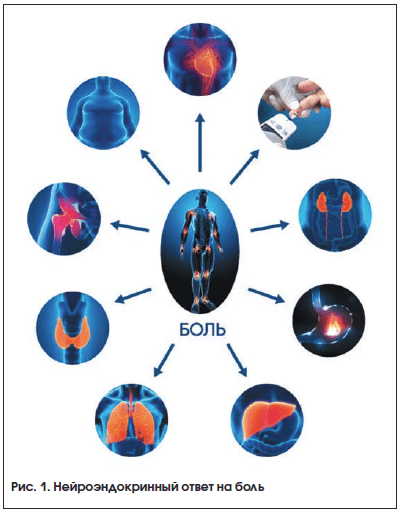
1) –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–є –Њ—В–≤–µ—В –љ–∞ –±–Њ–ї—М (—Б–Є–Љ–њ–∞—В–Њ–∞–і—А–µ–љ–∞–ї–Њ–≤—Л–µ —А–µ–∞–Ї—Ж–Є–Є), —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–є—Б—П –Њ–±–Њ—Б—В—А–µ–љ–Є—П–Љ–Є —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (—А–Є—Б. 1);
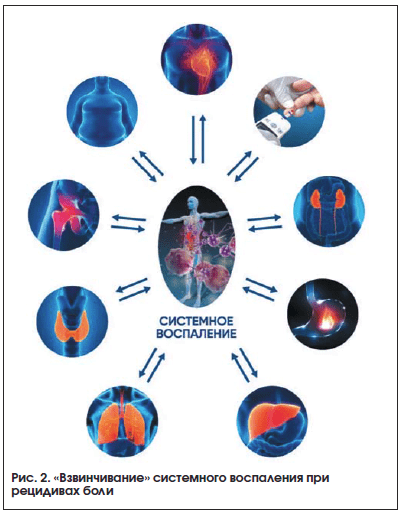
2) ¬Ђ–≤–Ј–≤–Є–љ—З–Є–≤–∞–љ–Є–µ¬ї —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ—А–Є —А–µ—Ж–Є–і–Є–≤–∞—Е –±–Њ–ї–Є, —Г—Б—Г–≥—Г–±–ї—П—О—Й–µ–µ —В–µ—З–µ–љ–Є–µ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (—А–Є—Б. 2).
–Ы–µ—З–µ–љ–Є–µ
–Э–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, —З—В–Њ —Б –њ–Њ–≤—Б–µ–Љ–µ—Б—В–љ—Л–Љ –≤–љ–µ–і—А–µ–љ–Є–µ–Љ –≤—Л—Б–Њ–Ї–Њ—В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є (—Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є–µ —Б—Г—Б—В–∞–≤–Њ–≤) –њ—А–Њ–±–ї–µ–Љ–∞ –Ю–Р –њ–Њ–ї—Г—З–Є–ї–∞ —А–µ–≤–Њ–ї—О—Ж–Є–Њ–љ–љ–Њ–µ —А–µ—И–µ–љ–Є–µ –≤ —Б–ї—Г—З–∞—П—Е –љ–µ—Г—Б–њ–µ—И–љ–Њ—Б—В–Є –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Ю–і–љ–∞–Ї–Њ –≤—Б–µ –≤–Њ–Ј—А–∞—Б—В–∞—О—Й–∞—П –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є–Є, —П–≤–љ–Њ –њ—А–µ–≤—Л—И–∞—О—Й–∞—П —А–µ–∞–ї—М–љ—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Б–Є—Б—В–µ–Љ—Л –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П, —А–Њ–ґ–і–∞–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є —Б–Ї–µ–њ—В–Є—Ж–Є–Ј–Љ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —В–Њ–≥–Њ, —З—В–Њ –і–∞–љ–љ–∞—П —В–µ—Е–љ–Њ–ї–Њ–≥–Є—П –ї–µ—З–µ–љ–Є—П –Ю–Р –њ–Њ–Ј–≤–Њ–ї–Є—В –≤ –±—Г–і—Г—Й–µ–Љ —А–µ—И–Є—В—М —Н—В—Г –Њ—Б—В—А—Г—О –њ—А–Њ–±–ї–µ–Љ—Г.–Я–Њ—Н—В–Њ–Љ—Г –≤ –љ–∞—Б—В–Њ—П—Й–Є–є –Љ–Њ–Љ–µ–љ—В –Њ—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –Ї–ї–Є–љ–Є—Ж–Є—Б—В–Њ–≤ –њ—А–Є–≤–ї–µ–Ї–∞—О—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О –Ю–Р.
–°—А–∞–Ј—Г —Б—В–Њ–Є—В –Њ–≥–Њ–≤–Њ—А–Є—В—М—Б—П, —З—В–Њ –Љ—Л –љ–µ –Љ–Њ–ґ–µ–Љ –њ–Њ—Е–≤–∞—Б—В–∞—В—М—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—П–Љ–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –Ю–Р. –Ґ–∞–Ї, –≤ —В—А–µ—Е —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Њ–±–Ј–Њ—А–∞—Е –Ъ–Њ—Е—А–∞–љ–Њ–≤—Б–Ї–Є—Е —Н–Ї—Б–њ–µ—А—В–Њ–≤ –±—Л–ї–Є —Г–Ї–∞–Ј–∞–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є:
вАУ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П —В–µ—А–∞–њ–Є—П: (вАУ10%) –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П (The Cochrane Library 2015, Issue 1);
вАУ –ї–µ—З–µ–±–љ–∞—П —Д–Є–Ј–Ї—Г–ї—М—В—Г—А–∞: (вАУ12%) –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П (The Cochrane Library 2015, Issue 1);
вАУ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л: (вАУ8%) –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П (The Cochrane Library 2010, Issue 10).
–Т —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Ю–Р (n=280; –±–Њ–ї—М–љ—Л–µ —Б –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В—М—О –°–°–Ч –Є –°–Ф 2-–≥–Њ —В–Є–њ–∞ –Є–ї–Є –±–µ–Ј –љ–µ–≥–Њ) —Г 36,4% (n=102) –ї–µ—З–µ–љ–Є–µ –љ–µ –њ—А–Є–љ–µ—Б–ї–Њ –і–Њ–ї–ґ–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞. –Я—А–Є—З–µ–Љ —Б—А–µ–і–Є —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –≤ 94,1% —Б–ї—Г—З–∞–µ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М —А–∞–Ј–ї–Є—З–љ—Л–µ –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–Э–Я–Т–Я), –≤ 48,03% —Б–ї—Г—З–∞–µ–≤ вАУ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ–і–ї–µ–љ–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, –≤ 26,5% вАУ –Љ–µ—Б—В–љ—Л–µ —Д–Њ—А–Љ—Л –Э–Я–Т–Я.
–Т —А–∞—Б–њ–Њ—А—П–ґ–µ–љ–Є–Є –ї–µ—З–∞—Й–µ–≥–Њ –≤—А–∞—З–∞ –µ—Б—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–Њ–Ї—Г–Љ–µ–љ—В–Њ–≤: –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –љ–µ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О –Ю–Р –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞–љ—В–Є—А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –ї–Є–≥–Є (EULAR), –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–≥–Њ –Ї–Њ–ї–ї–µ–і–ґ–∞ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Њ–≤ (ACR), –С—А–Є—В–∞–љ—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Њ–≤ (NICE), –†–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –љ–∞—Г—З–љ–Њ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ —В–µ—А–∞–њ–µ–≤—В–Њ–≤ (–†–Э–Ь–Ю–Ґ), –†–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –Є —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є–Љ –∞—Б–њ–µ–Ї—В–∞–Љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є –Њ—Б—В–µ–Њ–∞—А—В—А–Є—В–∞ (ESCEO), –Р—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Њ–≤ –†–Њ—Б—Б–Є–Є (–Р–†–†).
–Э–∞–Є–±–Њ–ї–µ–µ –Њ–±—Й–Є–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –і–ї—П –≤—Б–µ—Е —Н—В–Є—Е –і–Њ–Ї—Г–Љ–µ–љ—В–Њ–≤ —П–≤–ї—П—О—В—Б—П –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л–µ –Є–љ—В–µ—А–≤–µ–љ—Ж–Є–Є: –Њ–±—Г—З–∞—О—Й–Є–µ –њ—А–Њ–≥—А–∞–Љ–Љ—Л (–Ї–∞–Ї —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–µ –Ї–Њ–≥–љ–Є—В–Є–≤–љ–Њ-–њ–Њ–≤–µ–і–µ–љ—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є), —Б–љ–Є–ґ–µ–љ–Є–µ –≤–µ—Б–∞ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Њ–ґ–Є—А–µ–љ–Є—П, –њ—А–Њ–≥—А–∞–Љ–Љ—Л –∞—Н—А–Њ–±–љ—Л—Е —Г–њ—А–∞–ґ–љ–µ–љ–Є–є, –±–∞–ї—М–љ–µ–Њ—В–µ—А–∞–њ–Є—П, –ї–µ—З–µ–±–љ–∞—П —Е–Њ–і—М–±–∞.
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є–µ –Ї–Њ–ї–ї–µ–≥–Є —Г–≤–µ—А–µ–љ–љ–Њ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –њ—А–Є–Њ—А–Є—В–µ—В–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ —В–µ—А–∞–њ–Є–Є –Ю–Р (—А–Є—Б. 3).
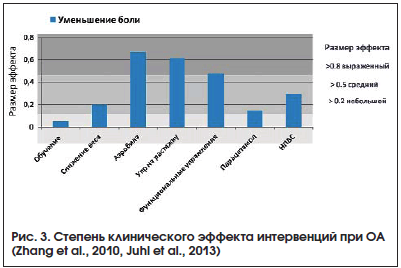
–Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Њ–љ–љ—Л–µ –Љ–µ—А–Њ–њ—А–Є—П—В–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –љ–∞ –і–≤–Є–≥–∞—В–µ–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е, –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П. –≠—В–Њ —П–≤–ї—П–µ—В—Б—П —Б–µ—А—М–µ–Ј–љ–Њ–є –Є –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ–є –Њ—И–Є–±–Ї–Њ–є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –Ї–∞–Ї –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, —В–∞–Ї –Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –≤ —Е—А—П—Й–µ–≤—Г—О –Є –Ї–Њ—Б—В–љ—Г—О —В–Ї–∞–љ—М –њ—А—П–Љ–Њ –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–Њ –Њ–±—К–µ–Љ—Г –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б—Г—Б—В–∞–≤–Њ–≤.
–Т–Њ –≤—Б–µ—Е –њ—А–Є–≤–µ–і–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е —Г–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –µ–і–Є–љ—Л–є –њ—А–Є–љ—Ж–Є–њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –±—Л—Б—В—А–Њ–і–µ–є—Б—В–≤—Г—О—Й–Є—Е –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–Є—Е —Б—А–µ–і—Б—В–≤, –∞ –Є–Љ–µ–љ–љ–Њ:
вАУ –Љ–µ—Б—В–љ—Л–µ —Д–Њ—А–Љ—Л –Э–Я–Т–Я;
вАУ –Э–Я–Т–Я —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П;
вАУ —В—А–∞–Љ–∞–і–Њ–ї –Є –Є–љ—Л–µ —Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Є.
–Ю–і–љ–∞–Ї–Њ –≤ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –љ–µ —Г–Ї–∞–Ј–∞–љ—Л —Б—В—А–∞—В–µ–≥–Є–Є, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤. –Ш –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Н—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є —Б–Є—Б—В–µ–Љ—Л, —В—А–µ–±—Г—О—Й–µ–є —Б–Њ–±–ї—О–і–µ–љ–Є—П –Љ–љ–Њ–ґ–µ—Б—В–≤–∞ —Д–Њ—А–Љ–∞–ї—М–љ–Њ—Б—В–µ–є –Є —Б–ї–Њ–ґ–љ—Л—Е —Б–Њ–≥–ї–∞—Б–Њ–≤–∞–љ–Є–є –љ–∞ –Ї–ї–Є–љ–Є–Ї–Њ-—Н–Ї—Б–њ–µ—А—В–љ–Њ–є –Ї–Њ–Љ–Є—Б—Б–Є–Є (–Ъ–≠–Ъ) –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –≤—А–∞—З–Њ–Љ –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –•–Њ—В—П –њ—А–Є–љ—П—В–∞—П –Я—А–∞–≤–Є—В–µ–ї—М—Б—В–≤–Њ–Љ –†–§ ¬Ђ–і–Њ—А–Њ–ґ–љ–∞—П –Ї–∞—А—В–∞¬ї –њ–Њ –Њ–±–ї–µ–≥—З–µ–љ–Є—О –і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є —Б–Є–ї—М–љ–Њ–і–µ–є—Б—В–≤—Г—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –љ–∞—Б–µ–ї–µ–љ–Є—П –≤ —Б–Ї–Њ—А–Њ–Љ –≤—А–µ–Љ–µ–љ–Є –њ–Њ–Ј–≤–Њ–ї–Є—В –њ–µ—А–µ–ї–Њ–Љ–Є—В—М —Б–ї–Њ–ґ–Є–≤—И—Г—О—Б—П —Б–Є—В—Г–∞—Ж–Є—О —Б —З—А–µ–Ј–Љ–µ—А–љ–Њ —А–µ–≥–ї–∞–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–љ—Л–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –і–∞–љ–љ—Л—Е –≥—А—Г–њ–њ –ї–µ–Ї–∞—А—Б—В–≤. –Э–Њ —Б—В–Њ–Є—В –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ, —З—В–Њ –њ–Њ–≤—Б–µ–Љ–µ—Б—В–љ–Њ–µ –Є —И–Є—А–Њ–Ї–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –Є –љ–∞—А–Ї–Њ—В–Є—З–µ—Б–Ї–Є—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤ –њ—А–Є –љ–µ–Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –≤ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е –Є –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є—Е —Б—В—А–∞–љ–∞—Е –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П —Б–µ—А—М–µ–Ј–љ–Њ–Љ—Г –Њ–±—Б—Г–ґ–і–µ–љ–Є—О –Є –Ї—А–Є—В–Є–Ї–µ, –Є –≤ –±—Г–і—Г—Й–µ–Љ –Њ–ґ–Є–і–∞–µ—В—Б—П –њ–Њ—П–≤–ї–µ–љ–Є–µ –±–Њ–ї–µ–µ —Г–Ј–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –і–ї—П –Є—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –њ—А–Є –љ–µ–Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є.
–Э–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, —З—В–Њ –Љ–µ—Б—В–љ—Л–µ —Д–Њ—А–Љ—Л –Є —Б–Є—Б—В–µ–Љ–љ—Л–µ –Э–Я–Т–Я –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ. –Ю–і–љ–∞–Ї–Њ —А–µ–∞–ї—М–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Ж–µ–љ—В –љ–µ—Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ–љ–Њ—Б—В–Є –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–Љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ (—Б–Љ. –њ—А–Є–≤–µ–і–µ–љ–љ–Њ–µ –≤—Л—И–µ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ). –Ґ–∞–Ї–ґ–µ –Љ–Њ–ґ–љ–Њ —Б–Њ—Б–ї–∞—В—М—Б—П –љ–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ CATI [5], –≥–і–µ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –ї–Є—И—М 20% –±–Њ–ї—М–љ—Л—Е —Б –±–Њ–ї—М—О —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ—Л —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –ї–µ—З–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є.
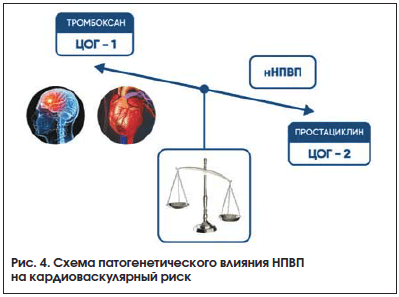
–°–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ—А–∞–Ї—В–Є–Ї–∞ –≤–љ–µ—Б–ї–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –њ–Њ –њ—А–Є–µ–Љ—Г –Э–Я–Т–Я —Г –±–Њ–ї—М–љ—Л—Е —Б —В—П–ґ–µ–ї–Њ–є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є. –С–Њ–ї–µ–µ 10 –ї–µ—В —И–Є—А–Њ–Ї–Њ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л—Е —А–Є—Б–Ї–Њ–≤ –њ—А–Є –њ—А–Є–µ–Љ–µ –Э–Я–Т–Я, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –±–Њ–ї—М—И–Њ–є —Б—В–µ–њ–µ–љ—М—О –њ–Њ–і–∞–≤–ї–µ–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ—Б—В–∞—Ж–Є–Ї–ї–Є–љ–∞ (–≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ–Њ–ї—Г—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Є —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Э–Я–Т–Я), —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —А–Є—Б–Ї–∞ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (—А–Є—Б. 4).
–Э–µ–і–∞–≤–љ–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–∞—П —А–∞–±–Њ—В–∞ [6], –Њ—Ж–µ–љ–Є–≤–∞—О—Й–∞—П —Ж–µ–ї—Л–є —А—П–і –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (–†–Ъ–Ш), –≤—Л–і–µ–ї–Є–ї–∞ –Ї–∞—В–µ–≥–Њ—А–Є–Є –±–Њ–ї—М–љ—Л—Е —Б –∞–±—Б–Њ–ї—О—В–љ—Л–Љ–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –Э–Я–Т–Я, —В. –µ. —Б —Б–Њ—Б—В–Њ—П–љ–Є—П–Љ–Є, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –і–∞–љ–љ–∞—П –≥—А—Г–њ–њ–∞ —Б—А–µ–і—Б—В–≤ —А–µ–Ј–Ї–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–є —А–Є—Б–Ї:
1) –±–Њ–ї—М–љ—Л–µ, –њ–µ—А–µ–љ–µ—Б—И–Є–µ –∞–Њ—А—В–Њ–Ї–Њ—А–Њ–љ–∞—А–љ–Њ–µ —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є–µ (–Р–Ъ–®), —Б—В–µ–љ—В–Є—А–Њ–≤–∞–љ–Є–µ –Є–ї–Є –і—А—Г–≥–Є–µ —З—А–µ—Б–Ї–Њ–ґ–љ—Л–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ (–І–Ъ–Т), —А–µ–Ї–Њ–љ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ —Б–Њ–љ–љ—Л—Е, –Љ–Њ–Ј–≥–Њ–≤—Л—Е –Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ—Л—Е –∞—А—В–µ—А–Є—П—Е вАУ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–µ –Ї –њ—А–Є–µ–Љ—Г –Э–Я–Т–Я –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–є –ґ–Є–Ј–љ–Є;
2) –±–Њ–ї—М–љ—Л–µ —Б —Д–Є–±—А–Є–ї–ї—П—Ж–Є–µ–є –њ—А–µ–і—Б–µ—А–і–Є–є;
3) –±–Њ–ї—М–љ—Л–µ —Б –і–µ—Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –•–°–Э;
4) —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї—П, –∞ —В–∞–Ї–ґ–µ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –њ—А—П–Љ—Л–Љ–Є –Њ—А–∞–ї—М–љ—Л–Љ–Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–∞–Љ–Є;
5) –њ—А—П–Љ—Л–µ –Њ—А–∞–ї—М–љ—Л–µ –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В—Л.
–†–Є—Б–Ї–Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є –њ—А–Є–µ–Љ–µ –Э–Я–Т–Я –Ј–љ–∞—З–Є–Љ–Њ –њ—А–µ–≤—Л—И–∞—О—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≤ —Н—В–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е. –Ш –µ—Б–ї–Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–µ —П–≤–ї—П–µ—В—Б—П –∞–±—Б–Њ–ї—О—В–љ—Л–Љ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Э–Я–Т–Я, —В–Њ —Г–Ї–∞–Ј–∞–љ–љ—Л–µ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–∞ —В—А–µ–±—Г—О—В –њ–Њ–ї–љ–Њ–≥–Њ –Ј–∞–њ—А–µ—В–∞ –≤ —В–µ—А–∞–њ–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Н—В–Њ–є –≥—А—Г–њ–њ—Л.
–Ш—В–∞–Ї, —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, —В–µ—А–∞–њ–Є—П —В–Њ–ї—М–Ї–Њ –Э–Я–Т–Я –±–Њ–ї–µ–µ —З–µ–Љ –≤ —В—А–µ—В–Є —Б–ї—Г—З–∞–µ–≤ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –і–Њ–ї–ґ–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Є –Є–Љ–µ–µ—В —А—П–і –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е —Б –°–°–Ч, —Б –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М (–∞ –≤–Є–і–Є—В—Б—П, —З—В–Њ –Є –љ–µ–љ—Г–ґ–љ–Њ—Б—В—М) —И–Є—А–Њ–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤ –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Ю–Р –љ–µ–Њ—В–≤—А–∞—В–Є–Љ–Њ —Б—В–∞–≤–Є—В –≤–Њ–њ—А–Њ—Б –≤—Л–±–Њ—А–∞ –Є–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –≥—А—Г–њ–њ.
–†–µ—З—М –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Є–і–µ—В –Њ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ–і–ї–µ–љ–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–∞—Е (—Е–Њ–љ–і—А–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А—Л вАУ —Г—Б—В–∞—А–µ–≤—И–Є–є —В–µ—А–Љ–Є–љ), –Ї –Ї–Њ—В–Њ—А—Л–Љ –Њ—В–љ–Њ—Б—П—В—Б—П: —Е–Њ–љ–і—А–Њ–Є—В–Є–љ, –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ, –і–Є–∞—Ж–µ—А–µ–Є–љ, –љ–µ–Њ–Љ—Л–ї—П–µ–Љ—Л–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –∞–≤–Њ–Ї–∞–і–Њ –Є —Б–Њ–Є.
–Ю–і–љ–∞–Ї–Њ –≤ –≤–Њ–њ—А–Њ—Б–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–Љ–µ–љ–љ–Њ —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ—Л—Е —Б–Њ–Њ–±—Й–µ—Б—В–≤ —А–∞–Ј–љ—Л—Е —Б—В—А–∞–љ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ—Л–µ —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П. –Ґ–∞–Ї, –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є–µ –Є –∞–љ–≥–ї–Є–є—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е, –љ–µ –≤–Ї–ї—О—З–∞—О—В –і–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –≤ —Б–њ–Є—Б–Њ–Ї –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л—Е –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О. –Т—Б—В–∞–µ—В –ї–Њ–≥–Є—З–љ—Л–є –≤–Њ–њ—А–Њ—Б: –њ–Њ—З–µ–Љ—Г?
–≠—В–Њ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ, –љ–∞–Є–ї—Г—З—И–Є–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ –Њ—В—А–∞–ґ–µ–љ–Њ –≤ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–є –њ–Њ–Ј–Є—Ж–Є–Є –≤–µ–і—Г—Й–µ–≥–Њ –∞–≤—В–Њ—А–∞ –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ—А–Њ—Д–µ—Б—Б–Њ—А–∞ Marc C. Hochberg [7].
–Р–≤—В–Њ—А —Г–Ї–∞–Ј—Л–≤–∞–µ—В –Њ—Б–љ–Њ–≤–љ—Г—О –њ—А–Є—З–Є–љ—Г –љ–µ–≤–Ї–ї—О—З–µ–љ–Є—П –і–∞–љ–љ—Л—Е —Б—В—А–∞—В–µ–≥–Є–є –≤ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є вАУ —Н—В–Њ –љ–Є–Ј–Ї–Њ–µ –Є –љ–µ–њ—А–Њ–≤–µ—А–µ–љ–љ–Њ–µ –Ї–∞—З–µ—Б—В–≤–Њ —Б—Г–±—Б—В–∞–љ—Ж–Є–є, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –і–ї—П –Є–Ј–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є–Є –°–®–Р, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Б—Г–±—Б—В–∞–љ—Ж–Є–Є –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї–µ–є –њ—А–Њ—И–ї–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ –њ—А–Њ—Ж–µ–і—Г—А—Л, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л (—В. –µ. –†–Ъ–Ш, —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –Њ–±–Ј–Њ—А—Л, –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј—Л). –Ъ —В–Њ–Љ—Г –ґ–µ –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є–Є –°–®–Р, –≤–µ—А–Њ—П—В–љ–Њ, –њ–Њ –њ—А–Є—З–Є–љ–µ, —Г–Ї–∞–Ј–∞–љ–љ–Њ–є –≤—Л—И–µ, –Ъ–Њ–Љ–Є—В–µ—В–Њ–Љ –њ–Њ –Ї–Њ–љ—В—А–Њ–ї—О –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –њ–Є—Й–µ–≤—Л—Е –і–Њ–±–∞–≤–Њ–Ї –°–®–Р (FDA) –≤—Б–µ –њ—А–µ–њ–∞—А–∞—В—Л –љ–∞ –Њ—Б–љ–Њ–≤–µ —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞ –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л –ї–Є—И—М –Ї–∞–Ї –њ–Є—Й–µ–≤—Л–µ –і–Њ–±–∞–≤–Ї–Є. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є–Љ –Ї–Њ–Љ–Є—В–µ—В–Њ–Љ (EMA) —А—П–і –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Б—Г–±—Б—В–∞–љ—Ж–Є–Є, –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–љ–Њ–є –Є–Ј —В—А–∞—Е–µ–є –±—Л–Ї–Њ–≤ (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є —Б—Г–±—Б—В–∞–љ—Ж–Є–Є –°S Bioactive¬Ѓ, –С–Є–Њ–Є–±–µ—А–Є–Ї–∞ –°.–Р.–£. (–Ш—Б–њ–∞–љ–Є—П)), –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л –Ї–∞–Ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Є —П–≤–ї—П—О—В—Б—П —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є. –Ш–Љ–µ–љ–љ–Њ –њ—А–µ–њ–∞—А–∞—В—Л, –Є–Ј–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–µ –Є–Ј –і–∞–љ–љ–Њ–є —Б—Г–±—Б—В–∞–љ—Ж–Є–Є, –±—Л–ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ—Л –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –і–Њ—Б—В—Г–њ–љ—Л—Е –і–ї—П –Є–Ј—Г—З–µ–љ–Є—П –†–Ъ–Ш.
–У–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ –Є —Е–Њ–љ–і—А–Њ–Є—В–Є–љ —П–≤–ї—П—О—В—Б—П –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б—А–µ–і–Є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ–і–ї–µ–љ–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–Є—Е —Б—А–µ–і—Б—В–≤, –Ї–Њ—В–Њ—А—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П –і–ї—П –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ю–Р. –Ґ–∞–Ї–Њ–µ –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ —Н–Ї—Б–њ–µ—А—В–∞–Љ–Є ESCEO —Б–і–µ–ї–∞–љ–Њ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –≤–µ—Б–Ї–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–і–ї–∞–≥–∞–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ—Б–Њ–±–µ–љ–љ–Њ –љ–∞ —А–∞–љ–љ–µ–є —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Є—Е —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –Є –≤—Л—Б–Њ–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ Marc C. Hochberg [8] –љ–∞ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е —Б—Г–±—Б—В–∞–љ—Ж–Є—П—Е, —В–∞–Ї–ґ–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Њ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Г—О —Б –Э–Я–Т–Я –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞ –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. (—А–Є—Б. 5).

–Я—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П, —З—В–Њ —А–∞—Б—Е–Њ–ґ–і–µ–љ–Є–µ –њ–Њ–Ј–Є—Ж–Є–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—О —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞ –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ –±–Њ–ї—М–љ—Л–Љ —Б –Ю–Р –љ–Њ—Б–Є—В –±–Њ–ї–µ–µ –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А, –Ї–Њ—В–Њ—А—Л–є, –њ–Њ–Љ–Є–Љ–Њ —З–Є—Б—В–Њ—В—Л —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —Б—Г–±—Б—В–∞–љ—Ж–Є–Є, –≤–Ї–ї—О—З–∞–µ—В –Є –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є—П –Ї—А—Г–њ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤. –Ґ–∞–Ї, —Б—А–µ–і–љ–µ–µ —З–Є—Б–ї–Њ —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є–є –Ї—А—Г–њ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –≤ –°–®–Р –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —Б–Њ—Б—В–∞–≤–ї—П–µ—В –і–ї—П —В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ вАУ 230вАУ250 —В—Л—Б. –≤ –≥–Њ–і, –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ вАУ 500 —В—Л—Б. –≤ –≥–Њ–і, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –†–§, –њ–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤, –Њ–±—Й–∞—П —З–∞—Б—В–Њ—В–∞ —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є–є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 72вАУ80 —В—Л—Б. –≤ –≥–Њ–і –і–ї—П –Њ–±–Њ–Є—Е —Б—Г—Б—В–∞–≤–Њ–≤. –Ю–і–љ–∞–Ї–Њ —Б—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –Є—Е —З–∞—Б—В–Њ—В–∞ —А–∞—Б—В–µ—В –Ї–∞–ґ–і—Л–є –≥–Њ–і (—А–Є—Б. 6).
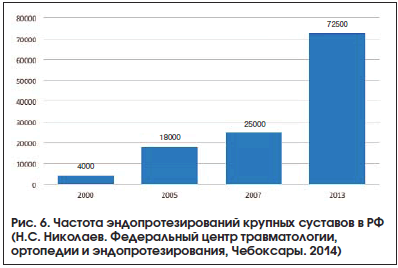
–Ъ–∞–Ї –Њ–і–љ–Њ –Є–Ј –Њ–±—К—П—Б–љ–µ–љ–Є–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є—П –∞–≤—В–Њ—А –њ—А–Є–≤–Њ–і–Є—В —А–∞–Ј—А—Л–≤ –Љ–µ–ґ–і—Г —А–µ–∞–ї—М–љ–Њ–є —Б—В–Њ–Є–Љ–Њ—Б—В—М—О –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –њ–Њ—Б–Њ–±–Є—П –Є —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–Љ–Є –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є —В–∞—А–Є—Д–∞–Љ–Є –љ–∞ –Є—Е –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ (—А–Є—Б. 7).
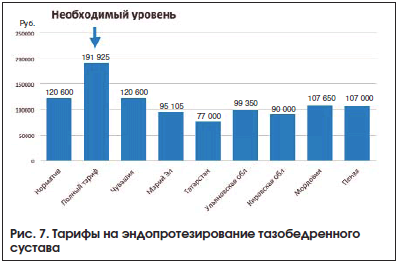
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–∞—П –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є—П –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–Љ –Є–≥–љ–Њ—А–Є—А–Њ–≤–∞—В—М –і–Њ—Б—В—Г–њ–љ—Л–µ –љ–µ—Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –Є–љ—В–µ—А–≤–µ–љ—Ж–Є–Є –≤ —В–µ—А–∞–њ–Є–Є –Ю–Р.
–Т –°–®–Р —Б–ї–Њ–ґ–Є–≤—И–∞—П—Б—П —Б–Є—Б—В–µ–Љ–∞ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ —Б—В—А–∞—Е–Њ–≤–∞–љ–Є—П —Б–Њ–Њ—В–љ–Њ—Б–Є—В –Њ–±—К–µ–Љ –Њ–Ї–∞–Ј–∞–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ—Л—Е –Њ–±—Й–µ—Б—В–≤, –≤ —В. —З. –Є –њ—А–Є –Ю–Р. –°—В–∞–љ–Њ–≤–Є—В—Б—П –њ–Њ–љ—П—В–љ—Л–Љ, —З—В–Њ –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ –і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є—П –≤–Ї–ї—О—З–∞—В—М –≤ –±—О–і–ґ–µ—В–љ—Л–µ —А–∞—Б—Е–Њ–і—Л –њ–Є—Й–µ–≤—Л–µ –і–Њ–±–∞–≤–Ї–Є, –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–љ—Л–µ –љ–∞ –Њ—Б–љ–Њ–≤–µ —Б—Г–±—Б—В–∞–љ—Ж–Є–є —Б –љ–µ–і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –љ–µ–ї–Њ–≥–Є—З–љ—Л–Љ. –Ф–∞–љ–љ—Л–є —Д–∞–Ї—В —В–∞–Ї–ґ–µ –Њ—В–љ–Њ—Б–Є—В—Б—П –Є –Ї –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є. –Ґ–Њ–≥–і–∞ –Ї–∞–Ї –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е —Б—В—А–∞–љ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ —Б—Г–±—Б—В–∞–љ—Ж–Є–Є, –Њ–±–ї–∞–і–∞—О—Й–Є–µ –≤—Л—Б–Њ–Ї–Њ–є —Б—В–µ–њ–µ–љ—М—О –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є, —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П –Ї –≤—А–∞—З–µ–±–љ–Њ–Љ—Г –љ–∞–Ј–љ–∞—З–µ–љ–Є—О. –≠—В–Њ —Б–њ—А–∞–≤–µ–і–ї–Є–≤–Њ –Є –і–ї—П –љ–∞—И–µ–є —Б—В—А–∞–љ—Л.
–°–ї–µ–і—Г–µ—В —В–∞–Ї–ґ–µ –њ—А–Є–≤–µ—Б—В–Є —Н–Ї—Б–њ–µ—А—В–љ–Њ–µ –Љ–љ–µ–љ–Є–µ [9] –≥–ї–∞–≤–љ—Л—Е –≤–љ–µ—И—В–∞—В–љ—Л—Е —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ —А–µ–≥–Є–Њ–љ–∞–ї—М–љ—Л—Е –і–µ–њ–∞—А—В–∞–Љ–µ–љ—В–Њ–≤ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –†–§ (—А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥, —В–µ—А–∞–њ–µ–≤—В, –Ї–∞—А–і–Є–Њ–ї–Њ–≥, –љ–µ–≤—А–Њ–ї–Њ–≥, —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥), —Г–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е –љ–∞ –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (—А–Є—Б. 8).
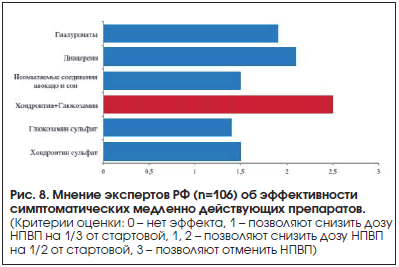
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –µ—Б—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –њ–Њ–Ј–Є—Ж–Є–Є, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–µ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —Е–Њ–љ–і—А–Њ–Є—В–Є–љ —Б—Г–ї—М—Д–∞—В –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ.
вАҐ –Т–Њ-–њ–µ—А–≤—Л—Е, —Н—В–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є —А–µ–∞–±–Є–ї–Є—В–∞—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е, –Њ–±—К—П—Б–љ—П–µ–Љ–Њ–µ –љ–Є–Ј–Ї–Њ–є –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М—О –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–∞–љ–љ–Њ–є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є.
вАҐ –Т–Њ-–≤—В–Њ—А—Л—Е, —В—А—Г–і–љ–Њ—Б—В–Є —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤.
вАҐ –Т-—В—А–µ—В—М–Є—Е, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞—П –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є—П.
вАҐ –Ш –љ–∞–Ї–Њ–љ–µ—Ж, –Љ–љ–µ–љ–Є–µ –≤–µ–і—Г—Й–Є—Е –ї–Є–і–µ—А–Њ–≤ –Є –≥–ї–∞–≤–љ—Л—Е —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤, –Њ—Ж–µ–љ–Є–≤–∞—О—Й–Є—Е –і–∞–љ–љ—Г—О —В–µ—А–∞–њ–Є—О –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –Є–љ—В–µ—А–≤–µ–љ—Ж–Є–µ–є –≤ —В–µ—А–∞–њ–Є–Є –±–Њ–ї–Є –њ—А–Є –Ю–Р.
–°—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ —Б–Њ–±—Л—В–Є–µ–Љ, –Њ–Ј–љ–∞–Љ–µ–љ–Њ–≤–∞–≤—И–Є–Љ —Г–≤–µ—А–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞, –±—Л–ї–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –≤ 2015 –≥. —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ъ–Њ—Е—А–∞–љ–Њ–≤—Б–Ї–Њ–≥–Њ –Њ–±–Ј–Њ—А–∞ [10]. –≠–Ї—Б–њ–µ—А—В—Л –Ј–∞–Ї–ї—О—З–Є–ї–Є, —З—В–Њ —Е–Њ–љ–і—А–Њ–Є—В–Є–љ —Б—Г–ї—М—Д–∞—В –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–Њ–Љ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ –њ–Њ –≤–ї–Є—П–љ–Є—О –љ–∞ –±–Њ–ї—М –≤ —Б—Г—Б—В–∞–≤–∞—Е –њ—А–Є –Ю–Р (—А–Є—Б. 9).
![–†–Є—Б. 9. –†–µ–Ј—Г–ї—М—В–∞—В—Л —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ъ–Њ—Е—А–∞–љ–Њ–≤—Б–Ї–Њ–≥–Њ –Њ–±–Ј–Њ—А–∞ [10] (2015) –†–Є—Б. 9. –†–µ–Ј—Г–ї—М—В–∞—В—Л —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ъ–Њ—Е—А–∞–љ–Њ–≤—Б–Ї–Њ–≥–Њ –Њ–±–Ј–Њ—А–∞ [10] (2015)](/upload/medialibrary/e2a/1805-9.png)
–Т –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —Д–∞—А–Љ–∞–Ї–Њ–њ–µ–є–љ—Л–µ —Б—Г–±—Б—В–∞–љ—Ж–Є–Є –Ї–∞–Ї –≤ —В–∞–±–ї–µ—В–Є—А–Њ–≤–∞–љ–љ—Л—Е, —В–∞–Ї –Є –≤ –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е —Д–Њ—А–Љ–∞—Е.
–Ш–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ —Д–Њ—А–Љ—Л —Е–Њ–љ–і—А–Њ–Є—В–Є–љ —Б—Г–ї—М—Д–∞—В–∞ (–•–°) (–•–Њ–љ–і—А–Њ–≥–∞—А–і¬Ѓ) –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ —Б—Г–ї—М—Д–∞—В–∞ (–У–°) (–°—Г—Б—В–∞–≥–∞—А–і¬Ѓ –Р—А—В—А–Њ) –Є–Љ–µ—О—В —Ж–µ–ї—Л–є —А—П–і –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –і–ї—П —Б—В–∞—А—В–Њ–≤–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П—Е —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –≤ —Б—Г—Б—В–∞–≤–∞—Е –Є —Б–њ–Є–љ–µ –њ—А–Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–Љ –Њ—Б—В–µ–Њ–∞—А—В—А–Є—В–µ. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –±–Њ–ї–µ–µ –±—Л—Б—В—А—Л–Љ–Є —В–µ–Љ–њ–∞–Љ–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –њ–Є–Ї–Њ–≤—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –≤ –Ї—А–Њ–≤–Є, —З—В–Њ –њ—А—П–Љ–Њ –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є (—А–Є—Б. 10).
![–†–Є—Б. 10. –°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Є —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є [11] –†–Є—Б. 10. –°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Є —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є [11]](/upload/medialibrary/a31/1805-10.png)
–°–Њ–Ј–і–∞–љ–Є–µ –≤—Л—Б–Њ–Ї–Є—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –∞–Ї—В–Є–≤–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї –•–° –Є –У–° –≤ —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є —Б–Њ–Ј–і–∞–µ—В —Г—Б–ї–Њ–≤–Є—П –і–ї—П –ї—Г—З—И–µ–є –і–Є—Д—Д—Г–Ј–Є–Є –ї–µ–Ї–∞—А—Б—В–≤–∞ –≤ —Е—А—П—Й–µ–≤—Г—О —В–Ї–∞–љ—М –Є —Б–љ–Є–ґ–µ–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –Є –≤ —Е–Њ–љ–і—А–Њ—Ж–Є—В–∞—Е, –Є –≤ —Б–Є–љ–Њ–≤–Є–Њ—Ж–Є—В–∞—Е. –Ф—А—Г–≥–Є–Љ –≤–∞–ґ–љ—Л–Љ –∞—А–≥—Г–Љ–µ–љ—В–Њ–Љ –≤ –њ–Њ–ї—М–Ј—Г –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є —Б –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е —Д–Њ—А–Љ –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М 100% –Ї–Њ–Љ–њ–ї–∞–є–µ–љ—Б. –Р —В–∞–Ї–ґ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–∞ ¬Ђ–і–Њ –Љ–µ—Б—В–∞ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є–љ—К–µ–Ї—Ж–Є–Є¬ї, —З—В–Њ, –љ–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, —Б–њ–Њ—Б–Њ–±–љ–Њ —Г–ї—Г—З—И–Є—В—М —Б–Њ–Ј–і–∞–љ–Є–µ –≤—Л—Б–Њ–Ї–Є—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –њ–Њ–ї–Є- –Є –Љ–Њ–љ–Њ—Б–∞—Е–∞—А–Є–і–Њ–≤ –•–° –Є –У–° —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –≤ —Е–Њ–љ–і—А–Њ—Ж–Є—В–∞—Е.
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Њ—В–Ї—А—Л—В–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [12] –≤—Л—П–≤–ї–µ–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –•–Њ–љ–і—А–Њ–≥–∞—А–і¬Ѓ –Ї–∞–Ї —Б–Є–Љ–њ—В–Њ–Љ-–Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–µ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —В–µ—А–∞–њ–Є–Є –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ю–Р –Ї—А—Г–њ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤. –•–Њ–љ–і—А–Њ–≥–∞—А–і¬Ѓ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї—М–≥–µ–Ј–Є—А—Г—О—Й–Є–є —Н—Д—Д–µ–Ї—В –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–∞—Б—И–Є—А—П—В—М —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є —Г–ї—Г—З—И–∞—В—М –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я—А–µ–њ–∞—А–∞—В –Њ–±–ї–∞–і–∞–µ—В —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –≤ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –і–Њ–Ј–∞—Е, –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л –Є –љ–µ —В—А–µ–±—Г—О—В –Њ—В–Љ–µ–љ—Л.
–С—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–ї–µ–њ–Њ–µ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –°—Г—Б—В–∞–≥–∞—А–і¬Ѓ –Р—А—В—А–Њ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Р –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ –≤ –њ–∞—А–∞–ї–ї–µ–ї—М–љ—Л—Е –≥—А—Г–њ–њ–∞—Е. –°—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –њ–Њ –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —И–Ї–∞–ї–µ, –Њ–њ—А–Њ—Б–љ–Є–Ї—Г –Ь–∞–Ї-–У–Є–ї–ї–∞ –Є —И–Ї–∞–ї–µ WOMAC –Ї –Ј–∞–≤–µ—А—И–µ–љ–Є—О –ї–µ—З–µ–љ–Є—П –Њ–Ї–∞–Ј–∞–ї–Є—Б—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–Є–ґ–µ –≤ –≥—А—Г–њ–њ–µ, –њ—А–Є–Љ–µ–љ—П–≤—И–µ–є –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–є –њ—А–µ–њ–∞—А–∞—В –°—Г—Б—В–∞–≥–∞—А–і¬Ѓ –Р—А—В—А–Њ, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ [13].
–Ю—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –°—Г—Б—В–∞–≥–∞—А–і¬Ѓ –Р—А—В—А–Њ —В–∞–Ї–ґ–µ –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ —Г 52 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Р –њ–Њ–ї–Є–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П. –Я–∞—Ж–Є–µ–љ—В—Л –њ–µ—А–≤–Њ–є (–Њ—Б–љ–Њ–≤–љ–Њ–є) –≥—А—Г–њ–њ—Л, –њ–Њ–Љ–Є–Љ–Њ –Э–Я–Т–Я –Є —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–Є–Є, –њ–Њ–ї—Г—З–∞–ї–Є –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ –њ—А–µ–њ–∞—А–∞—В –°—Г—Б—В–∞–≥–∞—А–і¬Ѓ –Р—А—В—А–Њ –њ–Њ 400 –Љ–≥ —З–µ—А–µ–Ј –і–µ–љ—М –≤ —В–µ—З–µ–љ–Є–µ 4вАУ6 –љ–µ–і. –Я–∞—Ж–Є–µ–љ—В—Л –≤—В–Њ—А–Њ–є (–Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є) –≥—А—Г–њ–њ—Л –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –њ–Њ –њ–Њ–ї—Г, –≤–Њ–Ј—А–∞—Б—В—Г, –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Є –Є–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –ї–µ—З–µ–љ–Є–µ —В–Њ–ї—М–Ї–Њ –Э–Я–Т–Я –Є —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–Є–µ–є. –Ю—Ж–µ–љ–Ї–∞ —Г—Б–њ–µ—И–љ–Њ—Б—В–Є –Є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є—Б–њ—Л—В—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ—Л, –њ—А–Њ–ї–µ—З–µ–љ–љ—Л—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–µ–є –њ—А–µ–њ–∞—А–∞—В–∞ –°—Г—Б—В–∞–≥–∞—А–і¬Ѓ –Р—А—В—А–Њ (–≥–ї—О–Ї–Њ–Јa–Љ–Є–љ —Б—Г–ї—М—Д–∞—В) –Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —Б —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –ї–µ—З–µ–±–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –≥—А—Г–њ–њ—Л –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —В–Њ–ї—М–Ї–Њ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Г—О —В–µ—А–∞–њ–Є—О, —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–∞ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ–Њ–є –≤ —В–µ—А–∞–њ–Є–Є –Є—Б–њ—Л—В—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ—Л –±–Њ–ї—М–љ—Л—Е [14].
–Ф–∞–љ–љ—Л–µ —Д–∞–Ї—В—Л –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –Њ—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є–љ—Ж–Є–њ—Л –°–Ґ–Р–†–Ґ-–Ґ–Х–†–Р–Я–Ш–Ш —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є.
–°–Ґ–Р–†–Ґ-–Ґ–Х–†–Р–Я–Ш–ѓ - —Н—В–Њ –Љ–µ—В–Њ–і —В–µ—А–∞–њ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –≤ —Б—Г—Б—В–∞–≤–∞—Е –Є/–Є–ї–Є —Б–њ–Є–љ–µ, –љ–µ —Б–≤—П–Ј–∞–љ–љ–Њ–є —Б –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є, –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Є –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–Ј–∞–Љ–Є, –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞—О—Й–Є–є:
вАҐ –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О;
вАҐ –і–≤–Є–≥–∞—В–µ–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М;
вАҐ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –≤–µ—Б–∞;
вАҐ –њ–∞—А–µ–љ—В–µ—А–∞–ї—М–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞ —Б—Г–ї—М—Д–∞—В–∞ –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ —Б—Г–ї—М—Д–∞—В–∞ –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є—П;
вАҐ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е —Д–Њ—А–Љ —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞ —Б—Г–ї—М—Д–∞—В–∞ –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ —Б—Г–ї—М—Д–∞—В–∞;
вАҐ –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—О –≤—Б–µ—Е –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є.
–Э–µ —Б—В–Њ–Є—В –Ј–∞–±—Л–≤–∞—В—М, —З—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—Й–Є–µ —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е —Е–Њ–љ–і—А–Њ–Є—В–Є–љ –Є/–Є–ї–Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ, –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –≤ —А–µ–ґ–Є–Љ–µ –њ–Њ—Б—В–Њ—П–љ–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ—В 12 –і–Њ 48 –Љ–µ—Б. [15]. –Я–Њ—Н—В–Њ–Љ—Г –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Б—В–∞—А—В–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –•–° –Є –У–° —Б–ї–µ–і—Г–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –њ–∞—Ж–Є–µ–љ—В–∞–Љ –њ—А–Њ–і–Њ–ї–ґ–Є—В—М –њ–µ—А–Њ—А–∞–ї—М–љ—Л–є –њ—А–Є–µ–Љ —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞ —Б—Г–ї—М—Д–∞—В–∞, –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–∞ –Є –Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є –љ–∞ –і–ї–Є—В–µ–ї—М–љ—Л–є —Б—А–Њ–Ї.
–Т —Б–ї—Г—З–∞–µ –Њ—В—Б—Г—В—Б—В–≤–Є—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ—А–µ–і–ї–∞–≥–∞—О—В –љ–∞–Ј–љ–∞—З–∞—В—М –≤–љ—Г—В—А–Є—Б—Г—Б—В–∞–≤–љ—Л–µ –Є–љ—К–µ–Ї—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –≠–Ї—Б–њ–µ—А—В—Л EULAR —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ—Г—О —Б—В–∞—В–Є—Б—В–Є–Ї—Г —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–Є–∞–ї—Г—А–Њ–љ–∞—В–Њ–≤ –Ї–∞–Ї –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П –±–Њ–ї–Є, —В–∞–Ї –Є –і–ї—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Г–ї—Г—З—И–µ–љ–Є—П —Б—Г—Б—В–∞–≤–Њ–≤ –њ—А–Є –Ю–Р.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–° —Г—З–µ—В–Њ–Љ –њ—А–Є–≤–µ–і–µ–љ–љ—Л—Е —Д–∞–Ї—В–Њ–≤ –Є –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —А—П–і –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–є –≤ –Њ—В–і–µ–ї—М–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е, –Њ—В–Љ–µ—В–Є–Љ, —З—В–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–µ –і–Њ–Ї—Г–Љ–µ–љ—В—Л –Њ–њ—А–µ–і–µ–ї—П—О—В —Б—Е–Њ–ґ—Г—О —Б—В—А–∞—В–µ–≥–Є—О –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –Ю–Р. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ–і–ї–µ–љ–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–Є—Е —Б—А–µ–і—Б—В–≤ –Є–Љ–µ–µ—В —А–µ–≥–Є–Њ–љ–∞–ї—М–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є —Б—Г–±—Б—В–∞–љ—Ж–Є—П–Љ–Є –Є –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤.–Т –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є —Б–њ—А–∞–≤–µ–і–ї–Є–≤–Њ –Є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Э–Я–Т–Я, –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –∞–±—Б–Њ–ї—О—В–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –Є—Е –љ–∞–Ј–љ–∞—З–µ–љ–Є—О, –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–Њ–Љ –Є –≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–Њ–Љ, –∞ —В–∞–Ї–ґ–µ –і—А—Г–≥–Є–Љ–Є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Љ–µ–і–ї–µ–љ–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є.












