В последние годы подобные исследования находятся в состоянии интенсивного изучения, чрезвычайно быстрого накопления новых данных, которые, к сожалению, не успевают быть освоенными ни в фундаментальном, ни в практическом плане.
Важно отметить, что современное представление о нейрофизиологии боли со всей очевидностью предопределяет, что анальгетический эффект препаратов должен быть обусловлен их действием на различные уровни центральной нервной системы.
Нейрофизиология боли
Первичным центральным субстратом сложного взаимодействия ноцицептивной и антиноцицептивной систем являются задние рога спинного мозга. Именно здесь происходит взаимодействие между каналами болевой и неболевой чувствительности, на основании которого возникает поток восходящей импульсации нового качества.Следует считать общепризнанным, что передача ноцицептивных сигналов может первично изменяться уже на уровне спинного мозга и что сегментарные механизмы действия анальгетиков играют существенную роль в реализации анальгезии.
На сегментарном уровне осуществляется реализация нисходящих влияний гетерогенных антиноцицептивных систем мозга, модулирующих формирование ноцицептивного потока импульсов к эффекторным нейронам разного функционального назначения и в конечном итоге определяющих выраженность ответного реагирования организма на боль и сдвиг эмоциональных, моторных и вегетативных показателей.
До сих пор дискутируется вопрос о сопряженности изменений моторных и гемодинамических реакций под влиянием антиноцицептивных систем, их функциональной роли в определении кардинального механизма жизнеобеспечения – механизма вегетомоторного сопряженного контроля.
Прогресс, наметившийся в понимании боли как сложного психофизиологического феномена, в формировании и модуляции которого существенную роль играют эмоциональные, мотивационные, типологические и другие психологические факторы, определил новую, психофармакологическую стратегию обезболивания.
Необходимо подчеркнуть, что центральным звеном, воспринимающим разномодальную афферентную информацию, является нейрональная система заднего рога спинного мозга. По современным данным, она представляет собой весьма сложную структуру, а в функциональном отношении рассматривается как своеобразный первичный интегративный центр сенсорной информации.
Нейроны дорсальной части заднего рога могут быть разделены на три основные группы. Первая – состоит из клеток, активируемых исключительно ноцицептивными стимулами или раздражением ноцицептивных А-δ- и С-волокон. Вторая группа включает клетки, отвечающие на ноцицептивные и неноцицептивные воздействия и на стимуляцию как высокопороговых, так и низкопороговых афферентов. Третья – представлена нейронами желатинозной субстанции, которые, взаимодействуя с клетками первых двух групп, образуют систему модулирующего контроля афферентного входа в спинной мозг и формирования восходящего ноцицептивного потока импульсов.
Нейроны, активируемые разномодальными афферентными входами, или «мультирецептивные», «конвергентные», «нейроны широкого афферентного диапазона», играют основную роль в переработке ноцицептивной информации, в передаче ее в восходящем направлении и в реализации низкоинтегрированных простейших реакций на повреждающие воздействия.
Нейроны основания заднего рога имеют достаточно широкое, хорошо контурируемое рецептивное поле, окруженное подпороговой зоной. В тех случаях, когда эффективность афферентного входа возрастает, рецептивное поле может увеличиваться. На этих нейронах конвергируют афферентные волокна различного спектра и модальности, поскольку они отвечают на прикосновение, давление, механическую и термическую ноцицептивную стимуляцию рецептивного поля. Частота и продолжительность ответов нейрона возрастает пропорционально интенсивности ноцицептивных, особенно термических стимулов.
Важно отметить, что не все нейроны заднего рога имеют ноцицептивные афферентные входы. Имеется большая популяция клеток с узким функциональным диапазоном, которые активируются легкими механическими воздействиями (прикосновением, небольшим давлением) и не отвечают на повреждающие стимулы.
С учетом изложенного желатинозную субстанцию заднего рога спинного мозга следует рассматривать как зону преимущественной концентрации нейронов с определенными свойствами, а не как строго функционально специализированную ноцицептивную структуру.
В настоящее время немало данных свидетельствуют о важной роли желатинозной субстанции в генерации деполяризации первичных афферентов.
Желатинозной субстанции отводится ключевая роль в теории «воротного контроля боли», предложенной P. Мелзаком и Р. Уоллом в 1965 г. [4], вокруг которой до сих пор ведутся дискуссионные споры (рис. 1, 2).


Данная теория объясняет формирование ноцицептивного потока на сегментарном уровне на основе центрального взаимодействия быстропроводящей миелиновой (неноцицептивной) и медленнопроводящей безмиелиновой систем на первых релейных (конвергентных, мультирецептивных) нейронах спинного мозга. Афферентная импульсация, возникающая в миелиновых волокнах при неповреждающих раздражениях, одновременно с активацией релейных нейронов (Т-клетки) через коллатерали возбуждает нейроны желатинозной субстанции. Они, в свою очередь, деполяризуют первичные миелиновые афференты и тем самым пресинаптически ограничивают активирующее их влияние на Т-клетки. При ноцицептивном воздействии активируются тонкие миелиновые и безмиелиновые волокна, которые оказывают тормозное влияние на нейроны желатинозной субстанции, в результате чего уменьшается деполяризация (или возникает гиперполяризация) миелиновых волокон, т.е. открывается афферентный вход и возрастает эффективность синаптического воздействия на Т-нейроны. В свою очередь, Т-нейроны при достижении критического уровня, определяемого временной и пространственной суммацией ноцицептивных и неноцицептивных сигналов, формируют восходящий поток импульсов нового качества, который воспринимается вышерасположенными структурами мозга в большей степени как неноцицептивный (неболевой).
Положения теории Р. Мелзака и П. Уолла, объясняющие тот факт, что формирование восходящего ноцицептивного потока в спинном мозге происходит на основании взаимодействия разномодальных афферентных входов на релейных (конвергентных) нейронах и в результате активации «специфических болевых» нейронов, имеющих восходящие проекции, позволяют с научной точки зрения объяснить эффективность локальных раздражающих средств и средств, содержащих капсаицин или нонивамид (Капсикам), комбинацию 3% камфоры, 3% скипидара и 1% салициловой кислоты (Випросал).
Капсаицин (ванилиламид 8-метил-6-ноненовой кислоты) – природный алкалоид плодов стручкового перца рода Capsicum – был впервые выделен в 1816 г. C. F. Bucholz и получил название «капсицин». В более привычный нам «капсаицин» он был переименован в 1876 г., когда J.C. Thresh выделил его в практически чистом состоянии, а синтез этого вещества в лабораторных условиях впервые был осуществлен в 1930 г.
Капсаицин широко используется для локального обезболивания, в т. ч. для лечения нейропатической боли, поскольку селективно активирует Ca2+-проницаемые катионные каналы TRPV1, которые в достаточно большом количестве располагаются в окончаниях ноцицепторов.
В свою очередь, активация TRPV1 ведет к деполяризации, ассоциированной с притоком ионов Na+ и Ca2+, т. е. с возникновением потенциала действия в ноцицептивных волокнах. Именно этот механизм способствует появлению ощущения жжения при нанесении капсаицина. Далее следует пролонгированная рефрактерность – сниженный ответ на болевые стимулы. Связывание капсаицина с рецептором TRPV1 открывает ионный канал, однако в условиях постоянной активации рецептор становится нечувствительным, а канал – непроницаемым для ионов.
С рецепторами TRPV1 связано два типа десенситизации: функциональная и фармакологическая (J. Donnerer, R. Amann, 1993). Функциональная десенситизация обеспечивает кратковременное снижение или потерю чувствительности сенсорных нейронов к прочим стимулам при однократном использовании капсаицина, а фармакологическая десенситизация заключается в постепенном снижении ответа на стимуляцию после повторного применения вещества. Нервные волокна, выделившие в ответ на воздействие капсаицином значительное количество центральных нейротрансмиттеров, становятся «химически денервированными» и некоторое время не отвечают на раздражитель (А. Szallasi, Р.М. Blumberg, 1999). Так называемую дефункционализацию нервных волокон можно объяснить несколькими причинами: временной потерей электрического потенциала клеточной мембраны, невозможностью транспортировать нейротрофические факторы и оборотной ретракцией эпидермальных и дермальных нервных окончаний (Р. Anand, К. Bley, 2011). Однако следует отличать десенситизацию рецепторов TRPV1 к ваниллоидам от аналгезии, вызванной капсаицином. Степень потери чувствительности этой разновидности рецепторов не обязательно коррелирует с повреждением функций других ноцицептивных окончаний. Таким образом, существуют два разных типа снижения ответа на боль в результате воздействия капсаицина: десенситизация рецепторов TRPV1 и угнетение функции всех ноцицепторов в целом (М.-К. Chung et al., 2016).
Применение капсаициноидов
В соответствии с рекомендациями Европейской антиревматической лиги (EULAR 2007) при лечении остеоартрита суставов кисти местному лечению необходимо отдавать предпочтение, при этом эффективными и безопасными способами лечения являются локальные нестероидные противовоспалительные препараты и капсаицин (уровень доказательности – ІА) (Task Force of EULAR, 2007).Многочисленные исследования показали, что местное применение капсаицинсодержащих локальных средств низкой концентрации достаточно эффективно в лечении боли (Р. Anand, К. Bley, 2011).
Исследование R. A. Westerman et al. (1988), где сравнивалось капсаицинсодержащее локальное средство (в концентрации 0,01% и 0,05%), наносившееся 3–4 р./сут на протяжении 3–4-х недель, показало, что применение концентрации 0,05% сопровождается выраженным уменьшением боли в пораженных сегментах у 77% участников, а концентрации 0,01% – только у 30% пациентов.
В рандомизированном клиническом исследовании, выполненном T. Minami et al. (2001), продемонстрировано, что применение 0,05% капсаицинсодержащего средства существенно снижает аллодинию, индуцированную введением простагландина E2.
В рандомизированном двойном слепом многоцентровом исследовании S. Chrubasik et al. (2010) пациенты (n=281) с хронической болью были рандомизированы на две группы: пациентам первой группы (n=140) в качестве анальгетической терапии был назначен капсаицинсодержащий препарат (0,05%), а пациентам второй группы (n=141) – плацебо. В качестве первичной конечной точки рассматривался положительный ответ на лечение, определяемый как снижение выраженности боли на 30% и более. По истечении трех недель лечения суммарная балльная оценка боли в обеих группах снизилась на 49% и 23% соответственно (p=0,0006). Отношение шансов в пользу капсаицина составило 4,3 (нижняя граница 95% ДИ: 97,5%–1,9; p<0,0001). Более того, все конечные точки показали значимое улучшение в группе капсаицина.
Таким образом, результаты рандомизированных клинических исследований подтверждают, что концентрация капсаицина 0,05% в средстве для местного применения характеризуется оптимальным балансом эффективности и безопасности [4–10].
Согласно стандартам Европейской федерации неврологических обществ (EFNS), топический капсаицин рекомендован при лечении различных невропатических состояний, сопровождающихся болевым синдромом [11]. Европейские рекомендации по лечению хронической неспецифической боли в пояснице также включают короткие курсы капсаицина для купирования обострений у пациентов с хроническими болями в спине и шее [12]. На IX конгрессе Европейской федерации боли EFIC 2–5 сентября 2015 г. (Вена, Австрия) отмечен положительный эффект применения пластырей с высокой концентрацией капсаицина для лечения периферической невропатической боли [13].
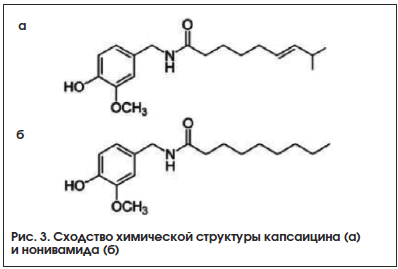
Синтетическим аналогом капсаицина является нонивамид (ванилиламид пеларгоновой кислоты) (рис. 3), который входит в состав комбинированного средства для местного применения – мази Капсикам.
В 2012 г. T. Weiser et al. выполнили исследование на культуре клеток с экспрессированными рецепторами TRPV1 [14]. При добавлении нонивамида и капсаицина с помощью метода фиксации потенциала было выявлено, что на рецепторном уровне кривые концентрация-эффект, кинетика активации тока, а также ингибирование конкурентным антагонистом капсазепином значимо не различались между двумя капсаициноидами (рис. 4).
![Рис. 4. Результаты фиксации потенциалов на культуре клеток с рецепторами TRPV1 [14]. Рис. 4. Результаты фиксации потенциалов на культуре клеток с рецепторами TRPV1 [14].](/upload/medialibrary/310/1800-4.png)
Помимо нонивамида, в составе Капсикама содержится комплекс веществ, которые также являются основными компонентами, оказывающими адъювантное местнораздражающее, гиперемизирующее и болеутоляющее действие:
• рацемическая камфора;
• живичный скипидар;
• бензилникотинат;
• диметилсульфоксид.
Показаниями для применения мази Капсикам являются мышечные и суставные боли (рис. 5). При этом следует учитывать, что раздражающее действие мази Капсикам улучшает общее самочувствие пациентов, страдающих от ушибов, растяжений, прострелов, люмбаго, травм и воспалительных явлений в суставах, а также ревматических состояний. В спортивной медицине Капсикам целесообразно использовать у спортсменов для энергичного разогрева мышц, которые испытывают максимальные нагрузки при тренировке.

Способ применения препарата Капсикам: при мышечных и суставных болях – 1–3 г мази наносят при помощи аппликатора на область болезненного участка и слегка втирают в кожу 2–3 р./день. При применении в качестве разогревающего средства у спортсменов наносят на массируемую область при помощи аппликатора. Небольшое количество мази (2–3 г) втирают массируемыми движениями до покраснения кожи. После тренировки следует смыть мазь с кожи прохладной водой. Длительность курса лечения зависит от характера и тяжести заболевания, однако не следует применять препарат более 10 дней без консультации врача.












