Боль, согласно современному определению, – это неприятное ощущение и эмоциональное переживание, связанное с действительным или возможным повреждением тканей или описываемое в терминах такого повреждения. Но если жалобы звучат примерно одинаково, то патофизиологические механизмы, приведшие к этому, могут быть совершенно различными.
Современная классификация боли выглядит следующим образом: выделяют боль острую и хроническую. Острая боль является сенсорной реакцией с последующим вовлечением эмоционально-мотивационных вегетативных и других факторов, возникающих при нарушении целостности организма [2]. Острая боль всегда является ответом на ноцицептивное (болевое) раздражение. Длительность острой боли определяется временем восстановления поврежденных тканей или нарушенной функции гладких мышц. Острую боль разделяют на поверхностную, глубокую, висцеральную.
Хроническая боль определяется как «боль, которая продолжается сверх нормального периода заживления» (Международная ассоциация по изучению боли IASP). По мнению экспертов по изучению боли, о хронизации можно говорить, если срок существования боли превышает 3 мес. Хроническая боль в последнее время рассматривается как отдельная нозология, и ее патогенез и терапия являются не до конца решенными проблемами современной медицины.
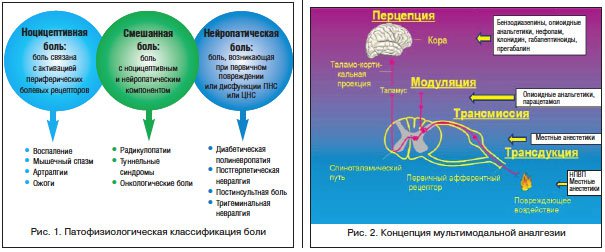
Также принято выделять ноцицептивную и нейропатическую боль. В основу этого деления положены патофизиологические механизмы развития. Ноцицептивная боль – синоним острой боли с повреждающим механизмом в основе. Нейропатическая боль связана с повреждением периферической и/или центральной нервной системы, но это повреждение может не носить структурного характера, а выражаться в нарушении восприятия афферентной стимуляции. Нейропатическая боль по своим характеристикам отличается от острой (ноцицептивной) боли и для ее выявления часто используются различные опросники (например, опросник DN4). Основные виды боли и их причины приведены на рисунке 1.
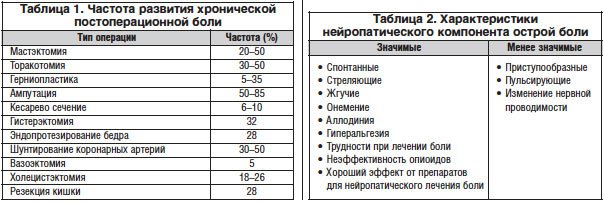
Ноцицептивная или острая боль всегда связана с повреждающим фактором (травма, повреждение, операция, а также воспаление, ишемия, растяжение и т. д.). Острая боль, как правило, ограничена по продолжительности, четко локализована местом травмы или оперативного вмешательства. Острые болевые синдромы, возникающие вследствие активации ноцицепторов, имеют восходящий трехнейронный путь с переключением импульса в межпозвоночных ганглиях, задних рогах спинного мозга и таламусе (рис. 2). Процессы, происходящие при формировании острого болевого синдрома, имеют свою терминологию.
Трансдукция – активация специализированных нервных окончаний (ноцицепторов). В процесс активации включены так называемые механизмы «сенситизации», выработка биологически активных веществ «алгогенов», усиливающих восприятие боли.
Трансмиссия – процесс проведения ноцицептивных стимулов из периферических структур в центральные структуры спинного мозга и таламические структуры головного мозга.
Модуляция – процесс обработки интернейронами II пластины задних рогов спинного мозга приходящего импульса и их реакция в виде высвобождения нейротрансмиттеров (как правило, это возбуждающие аминокислоты).
Перцепция – осознание восприятия боли, оценка интенсивности, локализация и т. д. корой головного мозга.
Все эти процессы хорошо изучены, и мы можем повлиять на любой из них с помощью различных групп медикаментов-анальгетиков. Обоснованными для терапии острых болевых синдромов будут методы, направленные на ограничение поступления ноцицептивной импульсации из зоны повреждения в ЦНС, подавление синтеза и выделения алгогенов, активацию структур антиноцицептивной системы [3].
Современные знания в области лечения острой боли требуют соответствия концепции мультимодальной анальгезии, т. е. воздействия сразу на несколько звеньев ноцицептивной дуги, что улучшает эффективность обезболивания и профилактирует развитие хронических болевых синдромов (рис. 2).
Тем не менее проблема хронизации боли не теряет своей актуальности, несмотря на все успехи современной медицины. Развитие хронической боли после хирургических вмешательств и травм – нередкое явление. Согласно данным статистики, у каждого 5-го прооперированного пациента или пациента с травмой развивается хронический болевой синдром. А при некоторых категориях операций (ампутация, торакотомия, мастэктомия) этот процент повышается до 50 (табл. 1). Категория пациентов с хроническим болевым синдромом является непростой как для медицинских, так и для социальных служб [4].
В сентябре 2011 г. Европейский парламент принял резолюцию, согласно которой хроническая боль рассматривается в числе социально значимых проблем, а эксперты IASP хроническую боль считают самостоятельным заболеванием.
Хотя послеоперационная боль традиционно считается ноцицептивной, существует доля пациентов, которые описывают типичные нейропатические характеристики как компонент испытываемой ими острой боли. Однако сегодня не существует инструментов и четких рекомендаций, которые помогли бы выявить этот компонент. В 2012 г. был созван диагностический консенсус, куда вошли мировые эксперты по изучению боли, которые на основе процедуры «Delphi survey» попытались разграничить нейропатические и ноцицептивные характеристики постоперационной боли [5]. Их выводы представлены в таблице 2.
Каковы возможные механизмы развития нейропатического компонента острой боли и хронизации боли?
Переключение импульса в межпозвоночных ганглиях, задних рогах спинного мозга и таламусе на восходящий болевой дуге, как и зоны первичного повреждения, способны формировать участки с повышенной болевой чувствительностью или сниженными порогами болевого восприятия (зоны гиперальгезии). Выделяют первичную и вторичную гиперальгезию. В основе развития первичной гиперальгезии лежит феномен сенситизации периферических ноцицепторов. Вторичная гиперальгезия развивается в результате сенситизации центральных ноцицептивных нейронов.
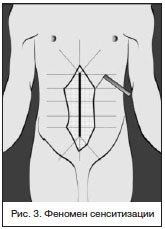
Феномен сенситизации (повышение чувствительности ноцицепторов к действию повреждающих стимулов) возникает вследствие выработки алгогенов; биологически активных веществ, поступающих из плазмы крови (брадикинин, каллидин), выделяющихся из поврежденных тучных клеток (гистамин), тромбоцитов (серотонин, аденозинтрифосфат), нейтрофилов (лейкотриены), макрофагов (интерлейкин-1, фактор некроза опухоли), эндотелия (интерлейкин-1, фактор некроза опухоли, эндотелины, простагландины (ПГ), оксид азота), а также секретируемых из терминалей С-афферентов (субстанция P, нейрокинин А, кальцитонин-ген-родственный пептид). Выделение алгогенов происходит в результате прямого повреждения тканей и активации С-афферентов. Нейропептиды С-афферентов обладают провоспалительным эффектом и, выделяясь из периферических терминалей С-волокон, приводят к развитию «нейрогенного воспаления», вызывая расширение сосудов и увеличение их проницаемости. Кроме этого, они способствуют высвобождению из тучных клеток и лейкоцитов ПГЕ2, цитокинов и биогенных аминов, которые, в свою очередь воздействуя на мембрану нервных окончаний, повышают возбудимость С-афферентов и замыкают патологический круг (рис. 3).
Воспалительный процесс, возникающий при повреждении тканей, способствует не только функциональным, но и структурным изменениям ноцицепторов. В условиях воспаления изменяется фенотип ноцицепторов, на их поверхности образуются рецепторы, отсутствующие в нормальных условиях. Это в свою очередь расширяет диапазон раздражителей, способных активировать ноцицепторы.
Представленные механизмы сенситизации характерны для ноцицепторов, локализованных в любой ткани, и развитие первичной гиперальгезии отмечается не только в коже, но и в мышцах, суставах, костях и внутренних органах.
Развитие вторичной гиперальгезии обусловлено сенситизацией центральных ноцицептивных нейронов и главным образом нейронов, располагающихся в дорсальных рогах спинного мозга. Окончания первичных афферентных волокон содержат возбуждающие аминокислоты (аспартат и глутамат), а также пептиды (субстанция Р, кальцитонин-ген-связанный пептид и нейротрофический фактор). Суммация повторных стимулов С-волокон приводит к прогрессирующему усилению деполяризации постсинаптической мембраны. Сенситизированные нейроны имеют повышенную возбудимость и в ответ на предъявляемые раздражения не только генерируют разряды с увеличенной частотой, но и сохраняют усиленную активность более продолжительное время.
Следствием сенситизации ноцицептивных нейронов является феномен «взвинчивания» (от англ. wind-up) или прогрессивное увеличение возбудимости ноцицептивных нейронов в ответ на повторную стимуляцию С-афферентов. Такая повышенная возбудимость ноцицептивных нейронов возникает вследствие усиления выделения глутамата и нейрокининов из центральных терминалей ноцицепторов в дорсальных рогах спинного мозга. Считается, что кратковременный болевой стимул вызывает непродолжительное возбуждение ноцицептивных нейронов в дорсальных рогах спинного мозга. Это связано с взаимодействием глутамата с АМРА-рецепторами (α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты) ноцицептивных нейронов. В случае повторной или более продолжительной стимуляции С-волокон выделяющиеся нейрокинины (субстанция Р и нейрокинин А) деполяризуют мембрану ноцицептивных нейронов, после чего осуществляется взаимодействие глутамата с NMDA-рецепторами (N-метил-D-аспартат), которое приводит к активному поступлению Са2+ в ноцицептивные нейроны, активации фосфолипаз, продукции оксида азота и ПГ. Показанный каскад биохимических процессов завершается стойким увеличением возбудимости и реактивности ноцицептивных нейронов.
Помимо сенситизации ноцицептивных нейронов дорсального рога, повреждение тканей инициирует сенситизацию ноцицептивных нейронов и в вышележащих центрах, включая ядра таламуса и соматосенсорную кору больших полушарий. Одновременно с этим происходит активация структур антиноцицептивной системы, деятельность которой направлена на торможение ноцицептивных нейронов и снижение их сенситизации. В механизмах развития анальгезии при активации антиноцицептивных структур важную роль играют опиоидергическая, серотонинергическая и норадренергическая системы мозга.
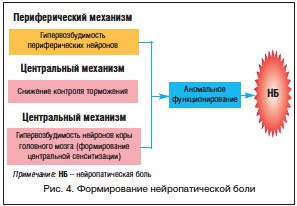
Центральная сенситизация – один из механизмов развития нейропатической боли. Учитывая сложный генез развития хронических болевых синдромов, можно думать о схожести между нейропатической и хронической болью (рис. 4).
Таким образом, проблема послеоперационного и посттравматического обезболивания сегодня представляется сложным взаимодействием между ноцицептивными воздействиями и ответом организма, в котором нейропатический механизм присутствует в той или иной мере. В связи с этим антинейропатические лекарства все чаще используются в послеоперационном периоде, и есть доказательства, что превентивное их применение снижает возможность хронизации послеоперационных болевых синдромов.
Для активации антиноцицептивной системы, осуществляющей контроль за проведением ноцицептивной импульсации в ЦНС, могут использоваться адъювантные (вспомогательные) анальгетики – агонисты α2-адренорецепторов, антидепрессанты, бензодиазепины, противосудорожные препараты и др., а также немедикаментозные средства, снижающие болевую чувствительность и уменьшающие негативное эмоциональное переживание (рефлексотерапия, физиотерапия).
Препараты, известные как противоэпилептические или противосудорожные, используются для лечения нейропатической боли с 1960-х гг. Карбамазепин был признан препаратом первого выбора при лечении тригеминальной невралгии. Однако даже в самых ранних сообщениях говорилось об ограниченности применения антиконвульсантов при лечении болевых синдромов. Так, была показана их более высокая эффективность при болевом синдроме, связанном с периферическими поражениями, чем при центральных болях. Данных о препаратах 2-го поколения (ламотриджин, топирамат, леветирацетам) немного, и ни один из них не зарегистрирован для лечения нейропатической боли [6].
Появление в 1990-х гг. препарата габапентин открыло новые перспективы в лечении нейропатической боли и множества других хронических болевых синдромов [7]. Позже в США и Европе был зарегистрирован новый препарат фирмы Pfizer – прегабалин (Лирика). Это лекарство является продолжением разработок в направлении специфических препаратов, действующих независимо от этиологии на центральные и периферические механизмы нейропатической боли, и обеспечивает высокую эффективность при купировании нейропатического болевого синдрома. Каковы механизмы анальгетического действия этих препаратов? Антиноцицептивный эффект обусловлен связыванием препарата с α2δ-субъединицами пресинаптических потенциал-зависимых Са2+-каналов нейронов задних рогов спинного мозга, функциональная активность и количество которых резко увеличиваются при повреждении периферических тканей. Активация α2δ-субъединиц усиливает поток ионов Са2+ по кальциевым каналам и удлиняет деполяризацию. Повышенный вход ионов Са2+ в клетку увеличивает высвобождение глутамата и субстанции Р из нервных окончаний. При этом активируются NMDA-рецепторы и развивается феномен «взвинчивания» (wind-up).
Примечательно, что габапентин и прегабалин блокируют потенциал-зависимые Са2+-каналы только с активированными α2δ-субъединицами, не оказывая влияния на вход ионов Са2+ в интактные, не активированные ноцицептивной стимуляцией нейроны. В результате блокады α2δ-субъединиц уменьшается вхождение ионов кальция в нервные окончания и высвобождение нейротрансмиттеров. Таким образом, анальгетический эффект габапентина и прегабалина обусловлен снижением глутаминергической передачи на уровне спинного мозга и подавлением активности потенциал-зависимых Са2+-каналов, что в совокупности снижает интенсивность синаптической передачи [8, 9].
Прегабалин имеет более высокую аффинность к α2δ–протеину в ЦНС, связывание с которым приводит к уменьшению высвобождения ряда нейротрансмиттеров боли (включая глутамат, норадреналин и субстанцию Р) в перевозбужденных нейронах. Благодаря уменьшению высвобождения нейротрансмиттеров прегабалин селективно подавляет возбудимость сети нейронов, причем только при патологических состояниях [10, 11]. В специальных исследованиях прегабалин показал эффективность, идентичную таковой габапентина, но при существенно более низких дозировках [11]. Вследствие этого вероятность побочных реакций при применении прегабалина значительно ниже, чем при использовании габапентина.
В одном из первых обзоров H. Clarke, R.P. Bonin (август 2012 г.) проведен анализ профилактики хронической послеоперационной боли с помощью габапентина и прегабалина. Критериям включения соответствовали 11 исследований, из них в 8 использовался габапентин и в 3–х – прегабалин. В 4-х исследованиях с габапентином (т. е. в 50% случаев) обнаружили, что периоперационное назначение габапентина снизило частоту развития хронической боли. Все исследования с прегабалином показали значительное снижение частоты развития хронической боли, и в 2-х из 3-х исследований также обнаружили улучшение послеоперационного статуса пациента. При этом прегабалин использовался в гораздо меньших дозировках, чем габапентин: 600–1200 мг габапентина и 150–300 мг прегабалина [12]. Настоящий обзор подтверждает мнение, что периоперационное назначение габапентина и прегабалина приводит к эффективному уменьшению хронической постоперационной боли, хотя данный класс препаратов и не имеет официального одобрения к применению.
В августе 2014 г. британскими исследователями был представлен еще один систематический обзор с метаанализом, посвященный анальгетической эффективности периоперационного назначения прегабалина (в России данное применение препарата находится за рамками официальных показаний). Анализ 55 исследований показал, что назначение прегабалина было связано со значительным уменьшением боли в состоянии покоя и во время движения и снижением потребления опиоидов в течение первых 24 ч после операции по сравнению с плацебо. Режимы дозирования прегабалина (≤75, 100–150 и 300 мг) не влияли на снижение дозы опиоидов. Также не было никаких существенных различий в результатах эффективности уменьшения боли при применении прегабалина в дозировках 100–300 мг и между отдельными предоперационными режимами дозирования, в т. ч. и в количестве дополнительных доз до и после операции. Данных было недостаточно, чтобы сделать выводы относительно хронической боли, но результаты 2-х исследований показали, что прегабалин может эффективно уменьшать нейропатическую боль. Таким образом, можно сделать вывод, что прегабалин улучшает послеоперационное обезболивание по сравнению с плацебо [13].
Небольшое исследование, проведенное у 60 пациентов, показало, что назначение 75 мг прегабалина однократно перед операцией снижает послеоперационную интенсивность боли и потребность в опиоидах у взрослых с перкутанной нефролитотомией. В этом же исследовании оценивались возможные нарушения почечной функции, клиренса креатинина. Было отмечено отсутствие побочных эффектов, влияющих на функционирование почек [14].
Очень интересное исследование было представлено японскими специалистами, работающими в области торакальной хирургии. По данным авторов, 97% пациентов, перенесших торакотомию по поводу рака легких, испытывают достаточно интенсивную ипсилатеральную боль в плече после операции. В группе исследования пациенты получали прегабалин 150 мг внутрь и нестероидные противовоспалительные препараты (НПВП) или только НПВП (контрольная группа). Выраженность послеоперационной боли в плече была значительно ниже в группе пациентов, получавших прегабалин, по сравнению с контрольной группой [15].
Американские анестезиологи назначали 150 мг прегабалина за 1 ч до пластической операции на веках, и в послеоперационном периоде отмечалось уменьшение интенсивности боли, а также потребности в парацетамоле (1,3 г) по сравнению с группой плацебо (2,6 г) [16].
Еще один проведенный метаанализ (2014) показал, что использование прегабалина в качестве вспомогательного средства после гинекологической операции является эффективным методом снижения интенсивности послеоперационной боли. В этом обзоре исследовалась также частота побочных эффектов прегабалина. Согласно приведенным данным, прегабалин не увеличивает частоту побочных эффектов [17].
Интересные данные получили южнокорейские исследователи. Они применили прегабалин в мультимодальной схеме контроля боли у пациентов, перенесших тотальное эндопротезирование коленного сустава. Одним из критериев включения было наличие предшествующего хронического болевого синдрома. Цель данного исследования заключалась в исследовании эффективности прегабалина в послеоперационном обезболивании у пациентов с предшествующим хроническим болевым синдромом. Были сделаны следующие выводы:
– осложнения со стороны органов дыхания, почек и гемодинамические осложнения были значительно меньше у пациентов, получавших прегабалин;
– количество желудочно-кишечных осложнений, которые включали тошноту, существенно не отличалось между группами;
– пациенты, получающие прегабалин, принимали более низкую среднюю дозу опиоидов;
– пациенты с предшествующим хроническим болевым синдромом имели более высокие баллы по визуально-аналоговой шкале (ВАШ), но те же дозы потребления опиоидов по сравнению с пациентами без хронического болевого синдрома;
– никакой разницы не было замечено в уровне интенсивности боли при оценке по ВАШ между пациентами, которые получали прегабалин, и контрольной группой.
Таким образом, применение прегабалина в контексте мультимодального обезболивания может быть связано со снижением потребления опиоидов и других медицинских осложнений у пациентов, перенесших тотальное эндопротезирование коленного сустава, в т. ч. у пациентов с хронической болью [18].
Выводы
• Наличие нейропатического компонента острой боли – это ожидаемый факт, особенно после больших травматичных операций.
• Проблема хронизации послеоперационной боли зависит не от объема операции, а от вида оперативного вмешательства и наличия факторов риска (к которым относится и неадекватное периоперационное обезболивание).
• Включение в мультимодальные схемы обезболивания препаратов, снижающих выраженность центральной сенситизации, – один из перспективных путей профилактики и лечения нейропатической и хронической боли.
• Прегабалин – один из современных, активно изучаемых препаратов для профилактики и лечения нейропатической и хронической боли.
• Доказаны наличие опиоидсберегающего эффекта, снижение интенсивности послеоперационного острого болевого синдрома, уменьшение риска хронизации болевого синдрома при применении прегабалина.
Совокупность накопленных на сегодняшний день научных данных позволяет рассматривать применение прегабалина в дозе 75–300 мг 2 р./сут для лечения нейропатического компонента послеоперационной боли.
Литература
1. Polomano R., Dunwoody C., Krenzischer D. Perspective on pain management in the 21st century // Pain Management Nurs. 2008. Vol. 9. P. 3–10.
2. А.М. Вейн, М.Я. Авруцкий. Боль и обезболивание. М. Медицина. 1997. С. 21.
3. Postoperative Pain Management – Good Clinical Practice. General recommendations and principles for successful pain management. Produced with the consultations with the Europeans Society of Regional Anaesthesia and Pain Therapy. Project chairman N. Rawal, 2005. 57 S.
4. Akkaya T., Ozkan D. Chronic post-surgical pain // Agri. 2009 Jan. Vol. 21 (1). Р. 1–9.
5. R. D. Searle, S. J. Howell and M. I. Bennett Diagnosing postoperative neuropathic pain: a Delphi survey // British Journal of Anaesthesia. 2012. Vol. 109 (2). Р. 240–244.
6. Данилов А.Б. Нейропатическая боль. М.: Нейромедиа, 2004.
7. Данилов А.Б. Габапентин (Нейронтин) в лечении нейропатической боли // Клиническая фармакология и терапия. 2004. № 13. С. 4.
8. Turan A., White P., Karamanlioglu B. Gabapentin: an alternative to the cyclooxigenase-2 inhibitors for perioperative pain management // Anesth.Analg. 2006. Vol.102. P. 175–181.
9. Fehrenbacher J.C., Taylor C.P., Vasko M.R. Pregabalin and gabapentin reduce release of substance P and CGRP from rat spinal tissues only after inflammation or activation of protein kinase C // Pain. 2003 Sep. Vol. 105 (1-2). Р. 133–141.
10. Wesche D., Bockbrader H. A pharmacokinetic comparison of pregabalin and gabapentin.
11. Levien T.L. Summary of new drug applications and biologic license applications submitted to the Food and Drug Administration: Pregabalin-Pfizer // Advances in Pharmacy. 2004. Vol. 2 (2). Р. 185–186.
12. Clarke H., Bonin R.P., Orser B.A., Englesakis M., Wijeysundera D.N., Katz J. The prevention of chronic postsurgical pain using gabapentin and pregabalin: a combined systematic review and meta-analysis // Anesth Analg. 2012 Aug. Vol.115 (2). Р. 428–442.
13. Mishriky B.M., Waldron N.H., Habib A.S. Impact of pregabalin on acute and persistent postoperative pain: a systematic review and meta-analysis // Br J Anaesth. 2014 Sep 10.
14. Aydoğan H., Kucuk A., Yuce H.H., Karahan M.A., Ciftci H., Gulum M., Aksoy N., Yalcin S. Adding 75mg pregabalin to analgesic regimen reduces pain scores and opioid consumption in adults following percutaneous nephrolithotomy // Braz J Anesthesiol. 2014 Sep-Oct. Vol. 64 (5). Р. 335–342.
15. Imai Y., Imai K., Kimura T., Horiguchi T., Goyagi T., Saito H., Sato Y., Motoyama S., Nishikawa T., Minamiya Y. Evaluation of postoperative pregabalin for attenuation of postoperative shoulder pain after thoracotomy in patients with lung cancer, a preliminary result // Gen Thorac Cardiovasc Surg. 2014 Aug 29.
16. Wei L.A., Davies B.W., Hink E.M., Durairaj V.D. Perioperative Pregabalin for Attenuation of Postoperative Pain After Eyelid Surgery // Ophthal Plast Reconstr Surg. 2014 Jul 3.
17. Yao Z., Shen C., Zhong Y. Perioperative Pregabalin for Acute Pain After Gynecological Surgery: A Meta-analysis // Clin Ther. 2014 Jun 2.
18. Sawan H., Chen A.F., Viscusi E.R., Parvizi J., Hozack W.J. Pregabalin reduces opioid consumption and improves outcome in chronic pain patients undergoing total knee arthroplasty // Phys Sportsmed. 2014 May. Vol. 42 (2). Р. 10–18.












