По данным Всероссийского центра изучения общественного мнения, Россия находится на 1-м месте в мире не только по потреблению табака на душу населения, но и по темпам роста табакокурения [7]. Следовательно, заболеваемость ХОБЛ в России будет увеличиваться или, по крайней мере, оставаться на прежнем, очень высоком уровне. По представленным академиком РАМН А.Г. Чучалиным данным, в нашей стране ХОБЛ протекает со значительным снижением качества жизни, а средняя продолжительность жизни больных ХОБЛ существенно меньше, чем в развитых странах [8]. Следует обратить внимание, что действие медиаторов воспаления, продуктов оксидативного стресса не ограничивается легочной тканью, поражается также скелетная мускулатура, при этом больной теряет мышечную массу и силу, страдают также сердечно-сосудистая и кроветворная системы [9, 10].
Итак, ХОБЛ – хроническое воспалительное заболевание легких, основными клетками, участвующими в его развитии, являются нейтрофилы, Т-лимфоциты (CD8+) и макрофаги. Эти клетки запускают каскад воспалительных реакций в стенке бронхиального дерева, паренхиме легких и легочных сосудах, которые приводят к ограничению бронхиальной проводимости и воздушного потока, а также к системному воспалению вне легких. Высвобождаются фактор некроза опухоли–α (ФНО-α), матриксные металлопротеиназы и интерлейкины 1, 6, 8 [11]. Воспаление приводит к морфологическим изменениям в легких (бронхоконстрикции, отеку слизистой оболочки бронхов, гиперсекреции слизи, эмфиземе). Необратимые обструктивные изменения, которые возникают в процессе болезни со стороны всех составляющих респираторной системы, обусловливают меньшую эффективность лечения [12].
Гетерогенность пациентов с ХОБЛ. Нужно отметить, что пациенты с ХОБЛ составляют весьма разнообразные группы, по-разному отвечающие на лечение и имеющие различный прогноз. Первая попытка разделить пациентов с ХОБЛ на группы в зависимости от особенностей течения заболевания и клинической картины была предпринята в 1960-х гг., когда были выделены 2 типа болезни: бронхитический и эмфизематозный [13, 14]. Дальнейшее изучение клинико-морфологической картины ХОБЛ выявило ее гетерогенность, начиная от морфологической картины и заканчивая прогнозом заболевания. Таким образом, можно говорить о большом числе фенотипов ХОБЛ. В GOLD 2011 в основу разделения пациентов на группы и, следовательно, выбора для них схемы терапии была положена не только степень нарушения функции легких по данным спирометрии (показатель объема форсированного выдоха за 1-ю с (ОФВ1)), как это было ранее, но и другие важные параметры: выраженность симптомов болезни и частота обострений в анамнезе.
Недавно группой экспертов было предложено определение фенотипа ХОБЛ: это характерная черта или комбинация таких черт, которые описывают различия между пациентами с ХОБЛ, связанные с клинически значимыми исходами (симптомы, обострения, ответ на терапию, скорость прогрессирования заболевания или смерть). Пациенты, соответствующие одному и тому же фенотипу, имеют сходные клинические исходы и должны иметь сходный ответ на проводимое лечение. Таким образом, фенотипы ХОБЛ отражают определенные особенности пациентов, которые важны прежде всего для лечения и прогноза заболевания. Выделение отдельных фенотипов ХОБЛ позволяет улучшить качество жизни и прогноз больных ХОБЛ.
Определению клинически значимых фенотипов ХОБЛ со II–IV степенями тяжести течения и параметров, которые прогнозируют прогрессирование заболевания, было посвящено исследование ECLIPSE (Evaluation of COPD Longitudinally to Identify Predictive Surrogate End-point) [15, 16]. В нем было показано, что ХОБЛ действительно имеет различные фенотипы, среди которых наиболее неблагоприятным в отношении прогноза является фенотип, «проявляющийся частыми обострениями». Обострения ХОБЛ увеличивают скорость падения функции легких, снижают физическую активность и качество жизни, увеличивают риск летального исхода, приводят к значительным расходам здравоохранения. Некоторые из клинических фенотипов ХОБЛ уже имеют доказательную базу, другие пока еще изучаются.
Фенотип ХОБЛ с частыми обострениями. Этот фенотип определяют при наличии 2-х и более обострений за прошедший год. В ходе 3-летнего наблюдательного исследования ECLIPSE, в котором приняли участие 2138 пациентов с ХОБЛ, была не только подтверждена прямая корреляция частоты обострений с тяжестью бронхообструкции, но и показана правомерность выделения фенотипа ХОБЛ с частыми обострениями. Даже при умеренно выраженном нарушении функции легких у значительной части больных (22%) уже имеют место частые обострения (≥2). Данные позволили сделать вывод о том, что фенотип с частыми обострениями является устойчивым: 2 и более обострений ХОБЛ в 3-й год наблюдения отмечены у 71% пациентов с частыми обострениями в 1-й и 2-й годы наблюдения. В основе этого лежит дальнейшее усиление процесса воспаления, присутствующего и в стабильном состоянии [17, 18].
Таким образом, ранее перенесенные частые обострения (≥2) являются самым важным предиктором новых обострений [16]. Влияние на частоту обострений ХОБЛ является одним из путей лечения, направленным на улучшение прогноза этой болезни.
Таким образом, сама природа воспалительного процесса при ХОБЛ и логика научного поиска подсказали, что необходимо разрабатывать препараты, которые могли бы воздействовать на специфический характер воспаления при этом заболевании и его ключевые звенья.
Ярким примером высокой эффективности фенотип-ориентированной терапии может служить рофлумиласт – инновационный противовоспалительный препарат, созданный специально для лечения ХОБЛ. Этот ингибитор фосфодиэстеразы 4-го типа (ФДЭ-4) показан прежде всего пациентам с тяжелым и очень тяжелым течением ХОБЛ, наличием хронического бронхита и частыми обострениями в анамнезе.
Роль фосфодиэстеразы-4 в воспалении при ХОБЛ. Одним из ключевых звеньев воспаления при ХОБЛ является ФДЭ. Способность ингибировать ФДЭ есть у применяемого с 1930-х гг. препарата теофиллин. Однако применение неселективных ингибиторов, подобных теофиллину, было ограничено большим числом лекарственных взаимодействий и узким диапазоном терапевтических доз, что приводило к частым нежелательным явлениям со стороны сердечно-сосудистой системы и желудочно-кишечного тракта (ЖКТ). Дальнейшее изучение ФДЭ привело к выделению 11 изоформ, среди которых ФДЭ-4 играет ключевую роль в патогенезе ХОБЛ. ФДЭ-4 является преобладающей изоформой, которая экспрессируется иммунными и провоспалительными клетками, и регулирует метаболизм циклического аденозинмонофосфата (цАМФ) практически во всех провоспалительных и структурных клетках, вовлеченных в хроническое воспаление при ХОБЛ [19]. Ингибирование ФДЭ-4 приводит к повышению внутриклеточного уровня цАМФ и уменьшению степени связанной с ХОБЛ дисфункции лейкоцитов, клеток дыхательных путей и легочных васкулярных гладких мышц, эндотелиальных клеток и эпителиальных клеток дыхательных путей, а также фибробластов. Теофиллин, будучи слабым и неселективным ингибитором ФДЭ, не способен оказывать влияние на ФДЭ-4 в своих терапевтических концентрациях. Интенсивный поиск новых молекул, которые могли бы в терапевтических концентрациях подавлять ФДЭ-4, привел к созданию селективных ингибиторов ФДЭ-4, таких как циломиласт и рофлумиласт, которые изначально разрабатывались как противовоспалительные препараты для лечения ХОБЛ и бронхиальной астмы.
Влияние препарата Даксас (рофлумиласт) на воспалительные маркеры при ХОБЛ. В исследованиях, проведенных на животных моделях, рофлумиласт показал способность подавлять основные патогенетические механизмы ХОБЛ: воспаление, связанное с воздействием табачного дыма, дисфункцию мукоцилиарного аппарата, фиброзные и эмфизематозные изменения легочной ткани, оксидативный стресс и ремоделирование легочных сосудов.
В отличие от рофлумиласта циломиласт демонстрировал некоторую селективность в отношении 4D-подтипа ФДЭ, что стало причиной высокой частоты нежелательных явлений со стороны ЖКТ (тошнота, рвота) и в итоге привело к отказу от его применения. Рофлумиласт (Даксас) обладает намного большей активностью, воздействует на все подтипы ФДЭ-4 и вызывает значительно меньше нежелательных явлений [20, 21]. Таким образом, рофлумиласт имеет более высокий фармакологический потенциал для воздействия на процессы воспаления и является более безопасным по сравнению с циломиластом. Рофлумиласт активно метаболизируется с образованием основного фармакодинамически активного метаболита N-оксида рофлумиласта. Фармакокинетика рофлумиласта и его метаболита N-оксида носит линейный характер в диапазоне доз от 250 до 1000 мкг [22]. Стимуляция человеческих нейтрофилов, моноцитов, макрофагов или лимфоцитов (in vitro) показала, что рофлумиласт и N–оксид рофлумиласта ослабляют высвобождение медиаторов воспаления, таких как лейкотриен В4, активные формы кислорода, ФНО-α, интерферон гамма и гранзим В. У пациентов с ХОБЛ рофлумиласт понижает уровень нейтрофилов в мокроте, а также уменьшает миграцию нейтрофилов и эозинофилов в дыхательные пути [23, 24]. Противовоспалительный эффект рофлумиласта обусловлен:
• уменьшением количества нейтрофилов (подавление хемотаксиса и адгезии);
• снижением активности нейтрофилов и продукции факторов, вызывающих повреждение дыхательных путей (нейтрофильной эластазы, активных форм кислорода) и ремоделирование соединительнотканного матрикса бронхов (матриксная металлопротеиназа-9);
• снижением активности макрофагов и Т-лимфоцитов, которые инициируют воспаление в дыхательных путях при ХОБЛ;
• уменьшением выраженности системных проявлений воспаления (подавление синтеза ФНО-a и ряда хемокинов) [19].
Влияние препарата Даксас (рофлумиласт) на функцию внешнего дыхания (ФВД) при ХОБЛ. В отличие от теофиллина Даксас (рофлумиласт) не является бронхолитиком, т.е. после его назначения не увеличиваются показатели спирометрии. В исследованиях рофлумиласта ОФВ1 у больных не изменялся в первые 6 ч после назначения препаратов [25]. Но при регулярном назначении ингибиторов ФДЭ-4 ОФВ1 у больных постепенно увеличивается, достигая максимума спустя 2–4 нед. лечения. Это обстоятельство свидетельствует о том, что ингибиторы ФДЭ-4 влияют на бронхиальную проходимость опосредованно – благодаря своему противовоспалительному действию. Повышенные уровни нейтрофилов коррелировали также с более быстрым снижением ОФВ1. У пациентов с наибольшим процентом нейтрофилов в индуцированной мокроте отмечалась максимальная скорость снижения параметров ФВД. Эти результаты представляются очень важными для объяснения того, как противовоспалительный препарат, не являющийся бронходилататором, может влиять на скорость снижения ФВД [26].
Влияние препарата Даксас (рофлумиласт) на снижение частоты и тяжести обострений ХОБЛ. Одной из главных целей лечения ХОБЛ, определенных экспертами в Глобальной стратегии по диагностике, лечению и профилактике ХОБЛ, является снижение частоты и тяжести обострения заболевания. Для изучения влияния рофлумиласта на обострения ХОБЛ были проведены 2 сходных по дизайну 12-месячных рандомизированных плацебо-контролируемых двойных слепых исследования в параллельных группах – M2-111 и M2-112 [27]. Суммарно в них участвовали 2686 пациентов, а различие заключалось в том, что в первое из них включали пациентов с ХОБЛ в соответствии с критериями Американского торакального общества, а во второе – в соответствии с критериями GOLD. При проведении ретроспективного анализа с целью выявить подгруппы пациентов, у которых наблюдался наибольший эффект от лечения рофлумиластом, было показано, что наличие кашля с отделением мокроты коррелирует с более выраженным снижением частоты обострений. У этой категории больных частота обострений при терапии рофлумиластом снизилась на 26,2%, тогда как у пациентов с эмфиземой – на 1,1%. В результате пациенты с клиническими симптомами хронического бронхита были выделены в качестве целевой популяции для дальнейших исследований. Эта категория больных ХОБЛ также характеризовалась функциональными признаками выраженного ограничения бронхиальной проходимости и наличием обострений в анамнезе (рис. 1).
Кроме того, использование рофлумиласта достоверно снизило частоту среднетяжелых и тяжелых обострений ХОБЛ на 17% по сравнению с плацебо (p=0,0003). Это сопровождалось увеличением периода времени до возникновения обострения в группе рофлумиласта по сравнению с группой плацебо – относительный риск 0,89 (p=0,02) [27, 28]. Способность рофлумиласта снижать риск обострений ХОБЛ лучше всего проявляется у больных с более тяжелым течением ХОБЛ. В исследовании М2-112 [21] у больных с IV стадией ХОБЛ разница в числе обострений между группами рофлумиласта и плацебо составила 36% (р=0,02).
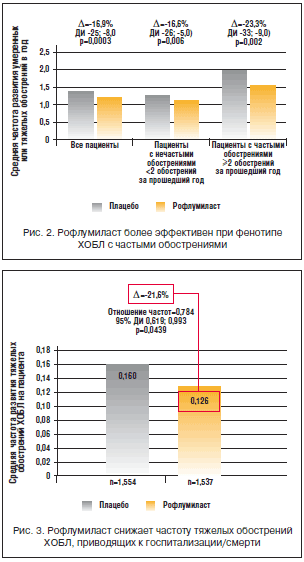
Также рофлумиласт особенно эффективен при фенотипе ХОБЛ с частыми обострениями. Ретроспективный анализ исследований М2-124 и М2-125 показал, что у больных с ≥2 обострениями в течение года, предшествовавшего включению в исследование, лечение рофлумиластом снижало частоту обострений на 23,3%, а у пациентов с редкими обострениями – только на 16,6% (рис. 2) [27].
Для определения влияния рофлумиласта на частоту тяжелых обострений ХОБЛ, приводящих к госпитализации и/или смерти, и частоту госпитализаций по любой причине был проведен дополнительный анализ двух годовых многоцентровых рандомизированных клинических исследований рофлумиласта (М-124 и М–125). Результаты анализа показали, что рофлумиласт снижает частоту тяжелых обострений ХОБЛ, приводящих к госпитализации/смерти, на 21,6%. [44]. Уменьшение госпитализаций является важной целью лечения ХОБЛ и дает дополнительные преимущества в виде снижения затрат, будущего риска ухудшения течения заболевания и даже смертности (рис. 3).
Как показал обзор Кокрановского сотрудничества, включивший 23 исследования по изучению эффективности ингибиторов ФДЭ-4 рофлумиласта (n=9211) и циломиласта (n=6457), эти препараты обеспечивают улучшение показателя ОФВ1 в среднем на 45,59 мл, а снижение риска обострений ХОБЛ – на 22% (отношение шансов 0,78) по сравнению с плацебо [29]. Поскольку циломиласт в связи с неблагоприятным профилем безопасности не был одобрен для клинического применения, в настоящее время единственным представителем класса, разрешенным для применения, является Даксас (рофлумиласт).
Эффективность рофлумиласта
в комбинации с другими препаратами
Рофлумиласт и длительно действующие β2–агонисты (ДДБА). В упоминавшихся выше 52–недельных исследованиях [27] около половины пациентов продолжали принимать ДДБА во время лечения. В группе рофлумиласта частота обострений снижалась независимо от того, принимали ли пациенты сопутствующую поддерживающую терапию ХОБЛ. Анализ эффектов рофлумиласта в подгруппе пациентов, принимавших ДДБА, выявил, что частота обострений снижалась у них на 21% по сравнению с плацебо (p=0,0011). Помимо этого лечение рофлумиластом достоверно улучшило показатели ОФВ1 до и после применения бронходилататора по сравнению с плацебо у всех пациентов независимо от того, получали ли они одновременно ДДБА или нет.
Рофлумиласт и длительно действующие м–холинолитики. Эффекты рофлумиласта изучали в 24-недельном исследовании у пациентов с ХОБЛ, принимавших антихолинергический бронходилататор длительного действия тиотропий [30]. Рофлумиласт при добавлении к лечению тиотропием достоверно улучшал ОФВ1 до и после применения бронходилататора по сравнению с плацебо (p<0,0001). Улучшение показателей ФВД становилось очевидным уже через 4–8 нед. лечения рофлумиластом и сохранялось на всем протяжении исследования. Положительные эффекты рофлумиласта и бронходилататоров длительного действия являются аддитивными, т.к. эти препараты обладают разными механизмами действия. Иными словами, добавление к терапии рофлумиласта позволяет получить дополнительные благоприятные эффекты помимо тех, что уже были достигнуты с помощью препаратов первого ряда для поддерживающей терапии ХОБЛ.
Рофлумиласт и ингаляционные глюкокортикостероиды (ИГКС). Влияние ИГКС на воспалительный процесс в легких при ХОБЛ оценивалось в опубликованном в 2012 г. метаанализе 8 исследований. Оказалось, что эти препараты способствовали уменьшению количества лимфоцитов в бронхоальвеолярном лаваже и биоптате слизистой бронхов, а также нейтрофилов в бронхоальвеолярном лаваже, но не в биоптате, увеличению содержания макрофагов в бронхоальвеолярном лаваже, но не в биоптате [31]. Полученные данные позволили авторам предположить, что ИГКС могут быть наиболее эффективны у больных ХОБЛ с преимущественно лимфоцитарным типом воспаления в легких (однако у большинства пациентов с ХОБЛ доминирует нейтрофильное воспаление). Однако в большинстве клинических исследований, в которых изучалось длительное применение ИГКС у пациентов с ХОБЛ, не удалось показать статистически значимого влияния этих препаратов на ОФВ1 (ISOLDE, EUROSCOP, Copenhagen City Lung Study, Lung Health Study). Кроме того, не во всех исследованиях было продемонстрировано влияние ИГКС на такие конечные точки, как частота обострений и качество жизни [32–34]. При этом существуют достаточно веские доказательства повышения риска нежелательных явлений, прежде всего пневмонии [35]. Кроме того, курение и характер нейтрофильного воспаления, характерные для ХОБЛ, формируют стероидорезистентность. Одним из показателей стероидорезистентности является снижение активности гистон-деацетилазы. По мере прогрессирования ХОБЛ возрастает ацетилирование гистонов и формируется резистентность к ИГКС [36–38].
При добавлении рофлумиласта к терапии ИГКС снижался риск обострения ХОБЛ и повышалась противовоспалительная активность ИГКС. Так, в исследованиях М2-111 и М2-112 пациентам разрешалось продолжать лечение ИГКС в дозе, не превышающей эквивалент 2000 мкг беклометазона дипропионата, если они использовали ИГКС в постоянной дозе не менее 3 мес. до включения в исследование. Поэтому около 60% всех больных (1622 пациента) одновременно с исследуемыми препаратами принимали ИГКС [32]. При объединенном анализе данных этих исследований выяснилось, что рофлумиласт снизил частоту среднетяжелых и тяжелых обострений ХОБЛ у пациентов, получавших ИГКС, на 18,8%. Большая способность рофлумиласта снижать количество обострений у пациентов, получающих ИГКС, может частично объясняться тем, что ИГКС принимали пациенты с более тяжелым течением ХОБЛ. Кроме того, у больных ХОБЛ, имеющих бронхитический фенотип с частыми обострениями, которые получали ИГКС, прием рофлумиласта снизил частоту среднетяжелых и тяжелых обострений на 30,2% по сравнению с плацебо [39, 40]. Добавление рофлумиласта повышает эффективность комбинированной терапии у пациентов с ХОБЛ [41, 42].
Безопасность и побочные эффекты препарата Даксас. Как показывает анализ профиля безопасности, нежелательные явления со стороны ЖКТ (преимущественно диарея и тошнота) регистрировались на фоне терапии рофлумиластом чаще, чем в группе плацебо (5,1% против 0,8%), в то время как частота остальных нежелательных явлений была сопоставимой в обеих группах (9,2 и 8,4% соответственно). Даксас – это препарат, влияющий на прогноз заболевания, а значит, польза, т.е. эффективность, выражающаяся в снижении риска обострений ХОБЛ, значительно перевешивает риск развития гастроинтестинальных нежелательных явлений, не являющихся жизнеугрожающими. Более того, у большинства больных и диарея, и тошнота исчезают в течение 1–4 нед. терапии, у остальных их выраженность существенно уменьшается. Средняя продолжительность диареи в исследованиях была 11–12 дней. Отмечается также влияние рофлумиласта на снижение массы тела, однако наиболее выраженное уменьшение массы тела наблюдается у лиц с избыточным весом или ожирением и происходит за счет жировой, а не мышечной ткани. Как показало проспективное наблюдение за пациентами, завершившими лечение рофлумиластом, вес восстанавливается в течение нескольких недель после окончания терапии.
Особенно важным является то, что Даксас (рофлумиласт) характеризуется высокой сердечно-сосудистой безопасностью. В ретроспективном анализе, в который было включено 14 клинических исследований с применением рофлумиласта у пациентов со среднетяжелой и тяжелой ХОБЛ [43], было показано, что вероятность развития основных неблагоприятных сердечно-сосудистых событий (MACE: сердечно-сосудистая смерть, нефатальный инфаркт и нефатальный инсульт) была статистически значимо ниже в группе рофлумиласта на 35%. Предположительно, это связано с уменьшением системного воспаления. Что касается лекарственных взаимодействий, то единственным препаратом, который нежелательно применять вместе с рофлумиластом, является рифампицин.
Тошнота, расстройство желудка и потеря в весе – наиболее частые побочные эффекты, зафиксированные у пациентов в ходе 4-х исследований, – были, как правило, легкими или умеренными по тяжести и обычно возникали в течение первых недель применения препарата. Пациентам с недостаточной массой тела следует контролировать ее. В случае необъяснимого уменьшения массы тела (не связанного с диетой или физическими упражнениями) пациенту требуется консультация врача. В клинических исследованиях снижение массы тела наблюдалось у пациентов с избыточной массой тела и не носило характер нежелательных эффектов.
Особенности применения препарата Даксас. Препарат назначают внутрь. Рекомендуемая доза – 500 мкг 1 р./сут. Даксас применяется длительно. Для достижения терапевтического эффекта может потребоваться лечение в течение нескольких недель. Даксас не предназначен для лечения острого приступа одышки (острого бронхоспазма). Несмотря на то, что такие побочные реакции, как диарея, тошнота, боли в животе и головная боль возникают в основном в первые недели лечения и в большинстве случаев проходят при его продолжении, в случае устойчивой непереносимости следует пересмотреть вопрос о терапии препаратом Даксас. Не рекомендуется назначать Даксас одновременно с теофиллином. У пациентов пожилого возраста (старше 65 лет) коррекция дозы не требуется.
Заключение
Имеющиеся на сегодняшний день данные, полученные в крупных клинических исследованиях, свидетельствуют о большом потенциале рофлумиласта как первого представителя принципиально нового класса препаратов, нацеленных на лечение специфичного для ХОБЛ воспаления. Анализ совокупных результатов показал, что наибольшая эффективность рофлумиласта отмечается у пациентов с тяжелым течением ХОБЛ с частыми обострениями. Рофлумиласт (Даксас) улучшает функцию легких и сокращает количество обострений у больных со средней и тяжелой формами ХОБЛ. Сокращение количества обострений не зависит от сопутствующего лечения β2-агонистами, холинолитиками (стандартной бронхолитической терапии). Эта эффективность подтверждается улучшением легочной функции, а также уменьшением частоты обострений при добавлении рофлумиласта к поддерживающей терапии бронходилататорами длительного действия и ИГКС. Рофлумиласт продемонстрировал статистически значимые улучшения ОФВ1 в диапазоне от 48 до 80 мл. Рофлумиласт, в отличие от бронхолитиков, оказывает влияние на причину, а не на ежедневные симптомы. Он действует медленно и обладает последовательным и длительным эффектом. У пациентов пожилого возраста, женщин и лиц не европеоидной расы общая ингибирующая активность ФДЭ-4 увеличивалась и несколько снижалась у курильщиков. Ни одно из этих изменений нельзя рассматривать как клинически значимое. Поэтому не рекомендуется проводить никаких коррекций доз в отношении этих групп пациентов.

Литература
1. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO workshop report. Last updated 2011. www.goldcopd.org.
2. Респираторная медицина. Руководство / под ред. А.Г. Чучалина. М.: ГЭОТАР- Медиа, 2007. Т. 1. С. 626.
3. Anthonisen N.R., Connett J.E., Murray R.P., for the Lung Health Study Research Group. Smoking and lung function of Lung Health Study participants after 11 years // Am. J. Respir. Crit. Care Med. 2002. Vol. 166. Р. 675–679.
4. Чучалин А.Г. Система оксиданты – антиоксиданты и пути коррекции / А.Г. Чучалин // Пульмунология. 2004. № 4. С. 111–115.
5. Соодаева С.К. Роль свободнорадикального окисления в патогенезе ХОБЛ / С.К. Соодаева // Атмосфера. Пульмонология и аллергология. 2000. № 5. С. 27–31.
6. Increased oxidative stress in asymptomatic current chronic smokers and GOLD stage 0 COPD / P. Rytila, T. Rehn, H. Ilumets, A. Rouhos, A. Sovijarvi, M. Myllarniemi, V.L. Kinnula // Respir Res. 2006. Vol. 28. № 7. P. 69.
7. Пресс-выпуск ВЦИОМ № 1234 от 29 мая 2009 г.
8. Чучалин А.Г. и др. Качество жизни больных хронической обструктивной болезнью легких в России: результаты многоцентрового популяционного исследования «ИКАР-ХОБЛ» // Пульмонология. 2004. № 1. С. 93–102.
9. Andreassen H. Chronic obstructive pulmonary disease as a systemic disease: an epidemiological perspective / H. Andreassen, J. Vestbo // Eur Respir J Suppl. 2003. Vol. 46. P. 2–4.
10. Gan W.Q., Man S.F., Senthilselvan A., Sin D.D. The association between chronic obstructive pulmonary disease and systemic inflammation: a systematic review and a meta-analysis // Thorax. 2004. Vol. 59. P. 574–580.
11. Domagala-Kulawik J., Hoser G., Dabrowska M., Chazan R.. Increased proportion of Fas positive CD8+ cells in peripheral blood of patients with COPD // Respir Med. 2006. Vol. 10. P. 20.
12. Pauwels R.A., Rabe K.F. Burden and clinical features of chronic obstructive pulmonary disease (COPD) // Lancet. 2004. Vol. 364. Р. 613–620.
13. Burrows B., Fletcher C.M., Heard B.E. et al. The emphysematous and bronchial types of chronic airways obstruction. A clinicopathological study of patients in London and Chicago // Lancet. 1966. Vol. 87. Р. 830–835.
14. Авдеев С.Н. Фенотипы хронической обструктивной болезни легких: особенности терапии // Consilium medicum. 2010. Т. 12. № 1. С. 23–28.
15. Vestbo J., Anderson W., Coxson H.O., Crim C., Dawber F., Edwards L., Hagan G., Knobil K., Lomas D.A., MacNee W., Silverman E.K., Tal-Singer R. Evaluation of COPD Longitudinally to Identify Predictive Surrogate End-points (ECLIPSE) // Eur Respir J. 2008. Vol. 31. Р. 869–873.
16. Agusti A., Calverely P., Celli B. et al. Characterization of COPD heterogeneity in the ECLIPSE cohort // Respir Research. 2010.
Vol. 11. Р. 122.
17. Soler-Cataluna J.J., Martinez-Garcia M.A., Roman S.P., Salcedo E., Navarro M., Ochando R. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease // Thorax. 2005. Vol. 60. Р. 925–931.
18. Seemungal T.A., Donaldson G.C., Paul E.A., Bestall J.C., Jeffries D.J., Wedzicha J.A. Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease // Am J Respir Crit Care Med. 1998. Vol. 157. Р. 1418–1422.
19. Hatzelmann A., Morcillo E.J., Lungarella G. et al. The preclinical pharmacology of roflumilast - a selective, oral phosphodiesterase 4 inhibitor in development for chronic obstructive pulmonary disease. // Pulmonary Pharmacology & Therapeutics. 2010. doi: 10.1016/j.pupt.2010.03.011.
20. Soto F.J., Hanania N.A. Selective phosphodiesterase-4 inhibitors in chronic obstructive lung disease // Curr Opin Pulm Med. 2005. Vol. 11. Р. 129–134.
21. Calverley P.M., Sanchez-Toril F., McIvor A., Teichmann P., Bredenbroeker D., Fabbri L.M. Effect of 1-year treatment with roflumilast in severe chronic obstructive pulmonary disease // Am J Respir Crit Care Med. 2007. Vol. 176. Р. 154–161.
22. Wang D., Cui X. Evaluation of PDE4 inhibition for COPD // Int J Chron Obstruct Pulmon Dis. 2006. Vol. 1. Р. 373–379.
23. Bethke T.D., Bohmer G.M., Hermann R. et al. Dose-proportional intraindividual single- and repeated-dose pharmacokinetics of roflumilast, an oral, once-daily phosphodiesterase 4 inhibitor // J. Clin. Pharmacol. 2007. Vol. 47. Р. 26–36.
24. Lahu G., Hunnemeyer A., Diletti E. et al. Population pharmacokinetic modelling of roflumilast and roflumilast N-Oxide by total phosphodiesterase 4 inhibitory activity and development of a population pharmacodynamicadverse event model // Clin. Pharmacokinet. 2010. Vol. 49. Р. 589–606.
25. Boszormenyi-Nagy G., Pieters W.R., Steffen H. et al. The effect of roflumilast treatment and subsequent withdrawal in patients with COPD [abstract] // Proc. Am. Thor. Soc. 2005. Vol. 2. Р. 544.
26. Grootendorst D.C., Gauw S.A., Verhoosel R.M., Sterk P.J., Hospers J.J., Bredenbroker D., Bethke T.D., Hiemstra P.S., Rabe K.F. Reduction in sputum neutrophil and eosinophil numbers by the PDE4 inhibitor roflumilast in patients with COPD // Thorax. 2007. Vol. 62. Р. 1081–1087.
27. Bateman E.D., Rabe K.F., Calverley P.M. et al. Roflumilast with long-acting/β2-agonists for COPD: influence of exacerbation history // Eur. Respir. J. 2011. Vol. 38 (3). Р. 553–560.
28. Rabe K.F., Bateman E.D., O'Donnell D., Witte S., Bredenbroker D., Bethke T.D. Roflumilast - an oral anti-inflammatory treatment for chronic obstructive pulmonary disease: a randomised controlled trial // Lancet. 2005. Vol. 366. Р. 563–571.
29. Chong J., Poole P., Leung B. et al. Phosphodiesterase 4 inhibitors for chronic obstructive pulmonary disease // Cochrane Database Syst. Rev. 2011. № 5. CD002309.
30. Fabbri L.M., Calverley P.M.A., Izquierdo-Alonso J.L. et al. Roflumilast in moderate-to-severe chronic obstructive pulmonary disease treated with long acting bronchodilators: two randomised clinical trials // Lancet. 2009. Vol. 374. Р. 695–703.
31. Jen R., Rennard S.I., Sin D.D. Effects of inhaled corticosteroids on airway inflammation in chronic obstructive pulmonary disease: a systematic review and metaanalysis // Int. J. Chron. Obstruct. Pulmon. Dis. 2012. Vol. 7. P. 587–595.
32. Rennard S.I., Calverley P.M.A., Goehring U.M. et al. Reduction of exacerbations by the PDE4 inhibitor roflumilast - the importance of defining different subsets of patients with COPD // Respiratory Research. 2011. Vol. 12. Р. 18.
33. Burge P.S., Calverley P.M., Jones P.W., Spencer S., Anderson J.A., Maslen T.K. Randomised, double blind, placebo controlled study of fluticasone propionate in patients with moderate to severe chronic obstructive pulmonary disease: the ISOLDE trial // BMJ. 2000. Vol. 320. Р. 1297–1303.
34. Yernault J.C. Inhaled corticosteroids in COPD: the EUROSCOP study in perspective // Eur Respir J. 1992 Nov. Vol. 5 (10). Р. 1169–1170.
35. Calverley P.M., Anderson J.A., Celli B. et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease // N. Engl. J. Med. 2007. Vol. 356. № 8. P. 775–789.
36. Ito K., Barnes P.J., Adcock I.M. Glucocorticoid receptor recruitment of histone deacetylase 2 inhibits interleukin-1b-induced histone H4 acetylation on lysines 8 and 12 // Mol Cell Biol. 2000. Vol. 20. Р. 6891–6903.
37. Ito K., Lim S., Caramori G. et al. Cigarette smoking reduces histone deacetylase 2 expression, enhances cytokine expression and inhibits glucocorticoid actions in alveolar macrophages // FASEBJ. 2001. Vol. 15. Р. 1100–1102.
38. Ito K., Ito M., Elliott W.M., Cosio B., Caramori G., Kon O.M., Barczyk A., Hayashi S., Adcock I.M., Hogg J.C., Barnes P.J. Decreased histone deacetylase activity in chronic obstructive pulmonary disease // N Engl J Med. 2005. Vol. 352. Р. 1967–1976.
39. Barnes P.J., Adcock I.M., Ito K. Histone acetylation and deacetylation: importance in inflammatory lung diseases // Eur Respir J. 2005. Vol. 25. Р. 552–563.
40. Ito K., Ito M., Elliott W.M. et al. Decreased histone deacetylase activity in chronic obstructive pulmonary disease // N Engl J Med. 2005. Vol. 352. Р. 1967–1976.
41. Aaron S.D., Vandemheen K.L., Fergusson D. et al. Tiotropium in combination with placebo, salmeterol, or fluticasone-salmeterol for treatment of chronic obstructive pulmonary disease: a randomized trial // Ann. Intern. Med. 2007. Vol. 146. № 8. P. 545–555.
42. Calverley P.M., Martinez F.J., Fabbri L.M. et al. Does roflumilast decrease exacerbations in severe COPD patients not controlled by inhaled combination therapy? The REACT study protocol // Int. J. Chron. Obstruct. Pulmon. Dis. 2012. Vol. 7. P. 375–382.
43. White W.B. et al. Major adverse cardiovascular events in patients with chronic obstructive pulmonary disease: analysis of 14 pooled roflumilast studies // Am. J. Respir. Crit. Care Med. 2011. Vol. 183. P. A3092.
44. Bateman E.D., Jardim J., Goehring U.M. et al.. European Respiratory Society Annual Congress. Vienna, Austria. 1–5 September 2012. P. 2109.












