2015. вДЦ 18. –°. 1109вАУ1115.
–†–µ–Ј–Ї–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–Є—Б–ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –ї–µ–≥–Ї–Є—Е (–•–Ю–С–Ы), –љ–∞–Љ–µ—В–Є–≤—И–µ–µ—Б—П –≤ –Ї–Њ–љ—Ж–µ XX –≤., –≥—А–Њ–Ј–Є—В —Б—В–∞—В—М —Б–µ—А—М–µ–Ј–љ—Л–Љ –≤—Л–Ј–Њ–≤–Њ–Љ —З–µ–ї–Њ–≤–µ—З–µ—Б—В–≤—Г –Є –≤ –≤–µ–Ї–µ XXI. –£—Е—Г–і—И–∞—О—Й–∞—П—Б—П —Н–Ї–Њ–ї–Њ–≥–Є—П, —А–∞–Ј—А–∞—Б—В–∞—О—Й–∞—П—Б—П —Н–њ–Є–і–µ–Љ–Є—П —В–∞–±–∞–Ї–Њ–Ї—Г—А–µ–љ–Є—П –Є –і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤–µ–і—Г—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –љ–µ —В–Њ–ї—М–Ї–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –•–Ю–С–Ы, –љ–Њ –Є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –Њ—В –љ–µ–µ [1, 25]. –Ю–ґ–Є–і–∞–µ—В—Б—П, —З—В–Њ –Ї 2020 –≥. –•–Ю–С–Ы, –Ј–∞–љ–Є–Љ–∞–≤—И–∞—П –≤ 1990 –≥. 6-–µ –Љ–µ—Б—В–Њ –≤ –Њ–±—Й–µ–є —Б—В—А—Г–Ї—В—Г—А–µ –њ—А–Є—З–Є–љ —Б–Љ–µ—А—В–Є, –≤—Л–є–і–µ—В –љ–∞ 3-–µ –Љ–µ—Б—В–Њ [24]. –£—Б—Г–≥—Г–±–ї—П–µ—В —Б–Є—В—Г–∞—Ж–Є—О –Є –≤—Л—Б–Њ–Ї–Њ–µ —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Њ–µ –±—А–µ–Љ—П, –Ї–Њ—В–Њ—А–Њ–µ –љ–µ—Б—Г—В –≥–Њ—Б—Г–і–∞—А—Б—В–≤–Њ –Є –Њ–±—Й–µ—Б—В–≤–Њ –≤ —Ж–µ–ї–Њ–Љ –њ–Њ –њ—А–Є—З–Є–љ–µ –•–Ю–С–Ы, –њ—А–Є—З–µ–Љ –љ–µ —В–Њ–ї—М–Ї–Њ –Є–Ј-–Ј–∞ —А–∞—Б—Е–Њ–і–Њ–≤ –љ–∞ –Њ–Ї–∞–Ј–∞–љ–Є–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є, –љ–Њ –Є –Є–Ј-–Ј–∞ —В–Њ–≥–Њ, —З—В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —Б–љ–Є–ґ–∞–µ—В –≤–µ—А—Е–љ—О—О –њ–ї–∞–љ–Ї—Г —В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞: –і–Њ 40% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы –≤—Л—Е–Њ–і—П—В –љ–∞ –њ–µ–љ—Б–Є—О —А–∞–љ—М—И–µ —Б—А–Њ–Ї–∞ [11].
–Ю–Ј–∞–±–Њ—З–µ–љ–љ–Њ—Б—В—М –Љ–Є—А–Њ–≤–Њ–≥–Њ —Б–Њ–Њ–±—Й–µ—Б—В–≤–∞ –њ—А–Є–≤–µ–ї–∞ –Ї —Б–Њ–Ј–і–∞–љ–Є—О –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –њ—А–Њ–≥—А–∞–Љ–Љ—Л –њ–Њ –±–Њ—А—М–±–µ —Б –•–Ю–С–Ы вАУ Global Initiative for Chronic Obstructive Lung Disease (GOLD), –≤ —А–∞–Љ–Ї–∞—Е –Ї–Њ—В–Њ—А–Њ–є —Б 2001 –≥. –њ—Г–±–ї–Є–Ї—Г–µ—В—Б—П –≥–ї–∞–≤–љ—Л–є –і–Њ–Ї—Г–Љ–µ–љ—В –њ–Њ –≤–µ–і–µ–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы ¬Ђ–У–ї–Њ–±–∞–ї—М–љ–∞—П —Б—В—А–∞—В–µ–≥–Є—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –ї–µ–≥–Ї–Є—Е¬ї.
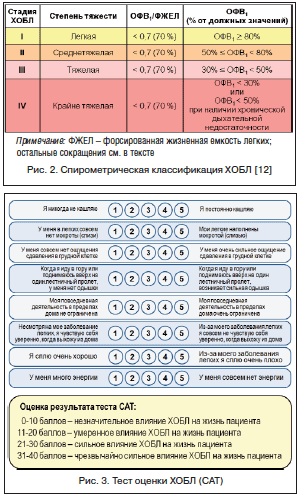
–Ъ–∞–Ї –Њ–њ—А–µ–і–µ–ї—П–µ—В GOLD, –•–Ю–С–Ы вАУ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –Є –ї–µ—З–Є—В—М, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–µ–µ—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –≤–љ–µ–ї–µ–≥–Њ—З–љ—Л–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є, —Б–њ–Њ—Б–Њ–±–љ—Л–Љ–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Њ—В—П–≥–Њ—Й–∞—В—М —В–µ—З–µ–љ–Є–µ –±–Њ–ї–µ–Ј–љ–Є —Г –Њ—В–і–µ–ї—М–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Х–µ –ї–µ–≥–Њ—З–љ–∞—П —Б–Њ—Б—В–∞–≤–ї—П—О—Й–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ–Љ —Б–Ї–Њ—А–Њ—Б—В–Є –≤–Њ–Ј–і—Г—И–љ–Њ–≥–Њ –њ–Њ—В–Њ–Ї–∞, –Ї–Њ—В–Њ—А–Њ–µ –Њ–±—А–∞—В–Є–Љ–Њ –љ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О. –Ю–≥—А–∞–љ–Є—З–µ–љ–Є–µ —Б–Ї–Њ—А–Њ—Б—В–Є –≤–Њ–Ј–і—Г—И–љ–Њ–≥–Њ –њ–Њ—В–Њ–Ї–∞ –Њ–±—Л—З–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г–µ—В –Є —Б–≤—П–Ј–∞–љ–Њ —Б –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –Њ—В–≤–µ—В–Њ–Љ –ї–µ–≥–Ї–Є—Е –љ–∞ –і–µ–є—Б—В–≤–Є–µ –Є–љ–≥–∞–ї–Є—А—Г–µ–Љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–љ—Л—Е —З–∞—Б—В–Є—Ж –Є–ї–Є –≥–∞–Ј–Њ–≤ [12].
–Т –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –•–Ю–С–Ы –љ–µ–Њ–±—Л—З–љ–Њ –Ј–≤—Г—З–Є—В —Д—А–∞–Ј–∞: ¬Ђ–Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –Є –ї–µ—З–Є—В—М¬ї. –Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П—Е –ї—О–±–Њ–є –і—А—Г–≥–Њ–є –±–Њ–ї–µ–Ј–љ–Є —В–∞–Ї—Г—О —Д—А–∞–Ј—Г –љ–µ –љ–∞–є—В–Є. –Х–µ –њ–Њ—П–≤–ї–µ–љ–Є–µ —Б–≤—П–Ј–∞–љ–Њ —Б –і–≤—Г–Љ—П –њ—А–Є—З–Є–љ–∞–Љ–Є. –Т–Њ-–њ–µ—А–≤—Л—Е, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М—О –њ—А–Є–≤–ї–µ—З–µ–љ–Є—П –≤–љ–Є–Љ–∞–љ–Є—П –Ї –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –±–Њ–ї–µ–µ —А–∞–љ–љ–µ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –•–Ю–С–Ы, —В. –Ї. —А–∞–љ–љ–Є–µ –≤—Л—П–≤–ї–µ–љ–Є–µ –Є –љ–∞—З–∞–ї–Њ –ї–µ—З–µ–±–љ—Л—Е –њ—А–Њ–≥—А–∞–Љ–Љ –≤–ї–Є—П—О—В –љ–∞ —В–µ—З–µ–љ–Є–µ –Є –Є—Б—Е–Њ–і –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Є —Н—В–Њ —В–Њ—З–љ–Њ –і–Њ–ї–ґ–љ—Л –Ј–љ–∞—В—М –Є –≤—А–∞—З, –Є –њ–∞—Ж–Є–µ–љ—В. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Г—А–Њ–≤–µ–љ—М –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –•–Ю–С–Ы –љ–µ–ї—М–Ј—П –њ—А–Є–Ј–љ–∞—В—М —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л–Љ: —Н–Ї—Б–њ–µ—А—В—Л –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ (European Respiratory Society) —Г–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –ї–Є—И—М –≤ 25% —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ [29]. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —В–µ–Љ, —З—В–Њ –љ–∞ —А–∞–љ–љ–Є—Е —Б—В–∞–і–Є—П—Е —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ (—Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–∞—П –Њ–і—Л—И–Ї–∞, –Ї–∞—И–µ–ї—М –Є –њ—А–Њ–і—Г–Ї—Ж–Є—П –Љ–Њ–Ї—А–Њ—В—Л) –Њ–±—Л—З–љ–Њ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ –≤—Л—А–∞–ґ–µ–љ–∞ [7]. –≠—В–Є —Б–Є–Љ–њ—В–Њ–Љ—Л –њ–Њ—П–≤–ї—П—О—В—Б—П –Є –љ–∞—А–∞—Б—В–∞—О—В –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ, –Є—Е –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ —А–∞—Б—В—П–љ—Г—В–Њ –љ–∞ –Љ–љ–Њ–≥–Є–µ –≥–Њ–і—Л, –Є –њ–Њ–љ–Є–Љ–∞–љ–Є–µ —В–Њ–≥–Њ, —З—В–Њ –Њ–љ –±–Њ–ї–µ–љ, –њ—А–Є—Е–Њ–і–Є—В –Ї –њ–∞—Ж–Є–µ–љ—В—Г, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —В–Њ–≥–і–∞, –Ї–Њ–≥–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –љ–∞—З–Є–љ–∞–µ—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –Ј–∞–Љ–µ—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –µ–≥–Њ –ґ–Є–Ј–љ–Є [33]. –Ш–Љ–µ–љ–љ–Њ –љ–∞ —Н—В–Њ–Љ —Н—В–∞–њ–µ –Ї—А–∞–є–љ–µ –≤–∞–ґ–љ–Њ –љ–∞—З–∞—В—М –∞–і–µ–Ї–≤–∞—В–љ—Г—О —В–µ—А–∞–њ–Є—О вАУ —Б —Ж–µ–ї—М—О –љ–µ —В–Њ–ї—М–Ї–Њ –Ј–∞–Љ–µ–і–ї–µ–љ–Є—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –•–Ю–С–Ы, –љ–Њ –Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —Г–ї—Г—З—И–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞ –Є –њ–Њ–≤—Л—И–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –µ–≥–Њ –ґ–Є–Ј–љ–Є.
–≠–Ї—Б–њ–µ—А—В—Л GOLD —Б–Њ–Ј–і–∞–ї–Є –Ї–Њ–љ—Ж–µ–њ—Ж–Є—О –Є–љ—В–µ–≥—А–∞–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –•–Ю–С–Ы (—А–Є—Б. 1), –Њ–њ–Є—А–∞—О—Й–µ–є—Б—П –љ–∞ –њ—А–Њ–±–ї–µ–Љ–љ–Њ-–Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞–љ–љ—Г—О –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В—М –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞. –Ґ–∞–Ї–Њ–є –њ–Њ–і—Е–Њ–і –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ—Ж–µ–љ–Є—В—М –і–≤–∞ –≤–∞–ґ–љ–µ–є—И–Є—Е –њ–∞—А–∞–Љ–µ—В—А–∞: –њ—А–Њ–≥–љ–Њ–Ј (—А–Є—Б–Ї) –Є –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–∞ [12].
–Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –њ—А–Њ–≥–љ–Њ–Ј–∞ (—А–Є—Б–Ї–∞) –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —В–∞–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є, –Ї–∞–Ї —Б—В–µ–њ–µ–љ—М –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –≤–Њ–Ј–і—Г—И–љ–Њ–≥–Њ –њ–Њ—В–Њ–Ї–∞ (—А–Є—Б. 2) –Є —З–∞—Б—В–Њ—В–∞ –µ–ґ–µ–≥–Њ–і–љ—Л—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є. –Ъ–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –±–Њ–ї–µ–Ј–љ–Є. –Ф–ї—П —Н—В–Њ–є —Ж–µ–ї–Є –Њ–њ—А–µ–і–µ–ї–µ–љ—Л 2 –Њ–њ—А–Њ—Б–љ–Є–Ї–∞: –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П —И–Ї–∞–ї–∞ –Њ—Ж–µ–љ–Ї–Є –Њ–і—Л—И–Ї–Є –С—А–Є—В–∞–љ—Б–Ї–Њ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Њ–≥–Њ —Б–Њ–≤–µ—В–∞ (modified Medical Research Council Dyspnea Scale вАУ mMRC) –Є —В–µ—Б—В –њ–Њ –Њ—Ж–µ–љ–Ї–µ –•–Ю–С–Ы (COPD Assessment Test вАУ CAT) (—А–Є—Б. 3, 4). –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –≥—А—Г–њ–њ—Л —Б—В–µ–њ–µ–љ–Є —А–Є—Б–Ї–∞ –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –њ–Њ —В–Њ–Љ—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О, –Ї–Њ—В–Њ—А—Л–є –Є–Љ–µ–µ—В –љ–∞–Є–±–Њ–ї—М—И—Г—О –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М. –Э–∞–њ—А–Є–Љ–µ—А, –µ—Б–ї–Є –њ–Њ —Б—В–µ–њ–µ–љ–Є –љ–∞—А—Г—И–µ–љ–Є—П –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –≥—А—Г–њ–њ–µ –љ–Є–Ј–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ (GOLD 1, 2), –∞ –њ–Њ —З–∞—Б—В–Њ—В–µ –Њ–±–Њ—Б—В—А–µ–љ–Є–є вАУ –Ї –≤—Л—Б–Њ–Ї–Њ–Љ—Г (вЙ•2 —А./–≥–Њ–і), —В–Њ –њ–∞—Ж–Є–µ–љ—В–∞ —Б–ї–µ–і—Г–µ—В –Њ—В–љ–µ—Б—В–Є –Ї –≥—А—Г–њ–њ–µ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ (—А–Є—Б. 1).
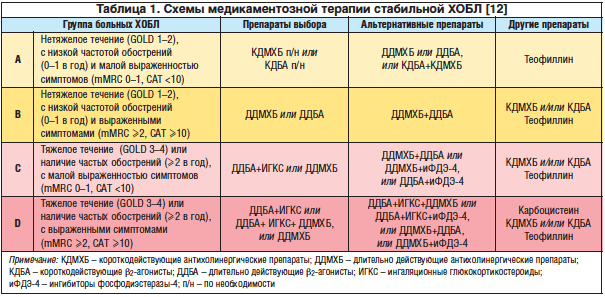
–Ю—В–љ–µ—Б–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –Ї –Њ–і–љ–Њ–є –Є–Ј –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≥—А—Г–њ–њ (–Р, B, C, D) –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ—З–µ–љ—М —В–Њ—З–љ–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М –Њ–±—К–µ–Љ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є (—В–∞–±–ї. 1) –і–ї—П —А–µ—И–µ–љ–Є—П —Б–ї–µ–і—Г—О—Й–Є—Е —В–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–і–∞—З:
вАУ —Г–ї—Г—З—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –ї–µ–≥–Ї–Є—Е;
вАУ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є;
вАУ —Г–ї—Г—З—И–µ–љ–Є—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –љ–∞–≥—А—Г–Ј–Њ–Ї;
вАУ —Г–ї—Г—З—И–µ–љ–Є—П –Њ–±—Й–µ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є—П;
вАУ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є;
вАУ –Љ–Є–љ–Є–Љ–Є–Ј–∞—Ж–Є–Є –љ–µ–≥–∞—В–Є–≤–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –ї–µ—З–µ–љ–Є—П.
–С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–Њ—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Ј–∞–і–∞—З —А–µ—И–∞–µ—В—Б—П –њ—А–∞–≤–Є–ї—М–љ—Л–Љ –њ–Њ–і–±–Њ—А–Њ–Љ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ —Н—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ–Њ—П–≤–ї–µ–љ–Є—П –Є –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞–љ–Є—П –Є–Љ–µ—О—Й–Є—Е—Б—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, —Г–Љ–µ–љ—М—И–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л –Є —В—П–ґ–µ—Б—В–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є, —Г–ї—Г—З—И–µ–љ–Є—П —Б–Њ—Б—В–Њ—П–љ–Є—П –Ј–і–Њ—А–Њ–≤—М—П –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –љ–Є–Ї–∞–Ї–∞—П –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П —В–µ—А–∞–њ–Є—П –љ–µ –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є –≤ –і–Њ–ї–≥–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–µ –њ—А–µ–і—Г–њ—А–µ–і–Є—В—М —Б–љ–Є–ґ–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –ї–µ–≥–Ї–Є—Е [29]. –£–Љ–µ–љ—М—И–Є—В—М —Б–Ї–Њ—А–Њ—Б—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Љ–Њ–ґ–љ–Њ —В–Њ–ї—М–Ї–Њ –≤ —Б–ї—Г—З–∞–µ –њ–Њ–ї–љ–Њ–≥–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ —В–∞–±–∞—З–љ–Њ–≥–Њ –і—Л–Љ–∞.
–Ф–ї—П —А–µ—И–µ–љ–Є—П –і—А—Г–≥–Є—Е –њ–Њ—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Ј–∞–і–∞—З –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–Њ–±–Є—В—М—Б—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–Є, —З—В–Њ –Њ—Б—Г—Й–µ—Б—В–≤–Є–Љ–Њ –ї–Є—И—М –њ—А–Є –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г –Ї—А–∞–µ—Г–≥–Њ–ї—М–љ—Л–Љ –Ї–∞–Љ–љ–µ–Љ –ї–µ—З–µ–љ–Є—П –•–Ю–С–Ы —П–≤–ї—П–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –±—А–Њ–љ—Е–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є [14].
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Ї–ї–∞—Б—Б–∞–Љ–Є –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–≤ —П–≤–ї—П—О—В—Б—П –Ь-—Е–Њ–ї–Є–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л, ќ≤2-–∞–і—А–µ–љ–Њ–Љ–Є–Љ–µ—В–Є–Ї–Є –Є –њ—А–µ–њ–∞—А–∞—В—Л —В–µ–Њ—Д–Є–ї–ї–Є–љ–∞.
–•–Њ–ї–Є–љ–Њ–ї–Є—В–Є–Ї–Є, –њ—А–µ–њ—П—В—Б—В–≤—Г—П –і–µ–є—Б—В–≤–Є—О –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–∞ –љ–∞ –Ь-—А–µ—Ж–µ–њ—В–Њ—А—Л –±—А–Њ–љ—Е–Њ–≤, —Б–љ–Є–Љ–∞—О—В —Б–њ–∞—Б—В–Є—З–µ—Б–Ї–Њ–µ –≤–∞–≥—Г—Б–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –≥–ї–∞–і–Ї—Г—О –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Г –±—А–Њ–љ—Е–Њ–≤, –Ї–Њ—В–Њ—А–Њ–µ —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –≤–µ–і—Г—Й–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –Њ–±—Б—В—А—Г–Ї—Ж–Є–Є –њ—А–Є –•–Ю–С–Ы [13]. –Ю–љ–Є —Г–Љ–µ–љ—М—И–∞—О—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ —Б–µ–Ї—А–µ—В–∞, –Є–Ј–Љ–µ–љ—П—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–µ –љ–∞—В—П–ґ–µ–љ–Є–µ –Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—П –Ї–Њ–ї–ї–∞–њ—Б –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є [20]. –Я–Њ–і–∞–≤–ї–µ–љ–Є–µ —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –Љ—Г—Б–Ї–∞—А–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Б–љ–Є–ґ–∞–µ—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О —Н–љ–і–Њ—В–µ–ї–Є–љ–∞-1 –≤ —Д–Є–±—А–Њ–±–ї–∞—Б—В–∞—Е, –Њ–Ї–∞–Ј—Л–≤–∞—П –∞–љ—В–Є—Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В [20]. –Ш—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–Ј–Є—В—М —З–∞—Б—В–Њ—В—Г —В—П–ґ–µ–ї—Л—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є –Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Г—О —Б–Љ–µ—А—В–љ–Њ—Б—В—М [28]. –Я–ї—О—Б–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Е–Њ–ї–Є–љ–Њ–ї–Є—В–Є–Ї–Њ–≤ —П–≤–ї—П–µ—В—Б—П —В–Њ—В —Д–∞–Ї—В, —З—В–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ь-—Е–Њ–ї–Є–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –љ–µ —А–µ–і—Г—Ж–Є—А—Г–µ—В—Б—П, –∞ –Ј–љ–∞—З–Є—В, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ —Б–љ–Є–ґ–∞–µ—В—Б—П –Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [5].
ќ≤2-–∞–і—А–µ–љ–Њ–Љ–Є–Љ–µ—В–Є–Ї–Є –Ј–∞ —Б—З–µ—В –њ—А—П–Љ–Њ–є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є ќ≤2-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Њ–Ї–∞–Ј—Л–≤–∞—О—В —А–∞—Б—Б–ї–∞–±–ї—П—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –≥–ї–∞–і–Ї—Г—О –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Г. –Ш—Е –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–Є—А—Г—О—Й–Є–є —Н—Д—Д–µ–Ї—В, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А–µ–≤—Л—И–∞–µ—В —В–∞–Ї–Њ–≤–Њ–є —Е–Њ–ї–Є–љ–Њ–ї–Є—В–Є–Ї–Њ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Ј–∞ —Б—З–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–і–µ–љ–Њ–Ј–Є–љ–Љ–Њ–љ–Њ—Д–Њ—Б—Д–∞—В–∞ (—Ж–Р–Ь–§) –Њ—В–Љ–µ—З–∞—О—В—Б—П —Б—В–Є–Љ—Г–ї—П—Ж–Є—П —Ж–Є–ї–Є–∞—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —Н–њ–Є—В–µ–ї–Є—П –Є —Г–ї—Г—З—И–µ–љ–Є–µ –Љ—Г–Ї–Њ—Ж–Є–ї–Є–∞—А–љ–Њ–≥–Њ –Ї–ї–Є—А–µ–љ—Б–∞ [23]. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞—О—Й–Є–µ—Б—П –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є ќ≤2-–∞–≥–Њ–љ–Є—Б—В–Њ–≤: —Б–Є–љ—Г—Б–Њ–≤–∞—П —В–∞—Е–Є–Ї–∞—А–і–Є—П (–≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е вАУ –і–∞–ґ–µ –љ–∞—А—Г—И–µ–љ–Є—П —А–Є—В–Љ–∞), —В—А–µ–Љ–Њ—А –Є –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є–µ, –Ї–Њ—В–Њ—А—Л–µ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ —В—А–µ–±—Г—О—В –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ –Є —Б–Њ –≤—А–µ–Љ–µ–љ–µ–Љ —Г–Љ–µ–љ—М—И–∞—О—В—Б—П –Є–ї–Є –њ–Њ–ї–љ–Њ—Б—В—М—О –Є—Б—З–µ–Ј–∞—О—В.
–Ґ–µ–Њ—Д–Є–ї–ї–Є–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ—А–Є –•–Ю–С–Ы: —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Ј–∞ —Б—З–µ—В –Є–љ–≥–Є–±–Є—Ж–Є–Є —Д–Њ—Б—Д–Њ–і–Є—Н—Б—В–µ—А–∞–Ј—Л (–§–Ф–≠) –Њ–љ –Њ–±–ї–∞–і–∞–µ—В –њ—А—П–Љ—Л–Љ –±—А–Њ–љ—Е–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Њ–њ–Є—Б—Л–≤–∞—О—В—Б—П –Є —В–∞–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л, –Ї–∞–Ї —Г–ї—Г—З—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Л –Ј–∞ —Б—З–µ—В –±–ї–Њ–Ї–∞–і—Л –і–µ–є—Б—В–≤–Є—П –∞–і–µ–љ–Њ–Ј–Є–љ–∞ –Є –љ–µ–њ—А—П–Љ–Њ–≥–Њ —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П –љ–∞ –і—Л—Е–∞—В–µ–ї—М–љ—Л–є —Ж–µ–љ—В—А [3], —Б—В–Є–Љ—Г–ї—П—Ж–Є—П —Ж–Є–ї–Є–∞—А–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –Є –Љ—Г–Ї–Њ—Ж–Є–ї–Є–∞—А–љ–Њ–≥–Њ –Ї–ї–Є—А–µ–љ—Б–∞. [22]. –Ъ–∞–Ї –±—А–Њ–љ—Е–Њ–ї–Є—В–Є–Ї —В–µ–Њ—Д–Є–ї–ї–Є–љ –Љ–µ–љ–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ, —З–µ–Љ ќ≤2-–∞–≥–Њ–љ–Є—Б—В—Л –Є–ї–Є –Ь-—Е–Њ–ї–Є–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А—Л.
–Ъ–∞–Ї –њ–Њ–Ј–Є—В–Є–≤–љ—Л–µ, —В–∞–Ї –Є –љ–µ–≥–∞—В–Є–≤–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —В–µ–Њ—Д–Є–ї–ї–Є–љ–∞ —П–≤–ї—П—О—В—Б—П –і–Њ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є, —З—В–Њ, —Г—З–Є—В—Л–≤–∞—П —Г–Ј–Њ—Б—В—М –µ–≥–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ—А–Є–і–Њ—А–∞, —П–≤–ї—П–µ—В—Б—П –Љ–Є–љ—Г—Б–Њ–Љ –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —В–µ–Њ—Д–Є–ї–ї–Є–љ–∞ –≤ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј–∞—Е —Г–Љ–µ–љ—М—И–∞–µ—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Њ–±–Њ—Б—В—А–µ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е –•–Ю–С–Ы, –љ–Њ –љ–µ —Г–ї—Г—З—И–∞–µ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –њ–Њ—Б—В–±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –ї–µ–≥–Ї–Є—Е [34]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–µ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—Ж–Є–Є –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л —В–µ–Њ—Д–Є–ї–ї–Є–љ–∞ —П–≤–ї—П—О—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ —В–Њ–Ї—Б–Є—З–љ—Л–Љ–Є [19]. –Э–∞–Є–±–Њ–ї–µ–µ –Њ–њ–∞—Б–љ—Л–Љ–Є –Є–Ј –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —В–µ–Њ—Д–Є–ї–ї–Є–љ–Њ–≤ —П–≤–ї—П—О—В—Б—П –њ—А–µ–і—Б–µ—А–і–љ—Л–µ –Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л–µ –∞—А–Є—В–Љ–Є–Є –Є –±–Њ–ї—М—И–Є–µ —Н–њ–Є–ї–µ–њ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–њ–∞–і–Ї–Є. –І–∞—Б—В–Њ –Њ—В–Љ–µ—З–∞—О—В—Б—П –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М, —В–Њ—И–љ–Њ—В–∞, —А–≤–Њ—В–∞, –±–µ—Б—Б–Њ–љ–љ–Є—Ж–∞, –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В –≤ –Њ–±–ї–∞—Б—В–Є —Б–µ—А–і—Ж–∞.
–Т —Б–≤—П–Ј–Є —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ –њ—А–Њ—Д–Є–ї–µ–Љ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є (–≤ —В. —З. –Є –Ј–∞ —Б—З–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—Г—В–Є –≤–≤–µ–і–µ–љ–Є—П) –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ –Њ—В–і–∞–µ—В—Б—П –њ–µ—А–≤—Л–Љ 2-–Љ –≥—А—Г–њ–њ–∞–Љ –±—А–Њ–љ—Е–Њ–ї–Є—В–Є–Ї–Њ–≤, –∞ –њ—А–µ–њ–∞—А–∞—В—Л —В–µ–Њ—Д–Є–ї–ї–Є–љ–∞ –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П —В–Њ–ї—М–Ї–Њ –≤ —Б–ї—Г—З–∞–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є ќ≤2-–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –Є —Е–Њ–ї–Є–љ–Њ–ї–Є—В–Є–Ї–Њ–≤ (—В–∞–±–ї. 1).
–Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –±—А–Њ–љ—Е–Њ–ї–Є—В–Є–Ї–Є –Љ–Њ–≥—Г—В –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П –Ї–∞–Ї ¬Ђ–њ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є¬ї (–і–ї—П —Г–Љ–µ–љ—М—И–µ–љ–Є—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤), —В–∞–Ї –Є —А–µ–≥—Г–ї—П—А–љ–Њ (–≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –≤–∞–ґ–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є —П–≤–ї—П—О—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —А–µ–і—Г–Ї—Ж–Є—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є, –љ–Њ –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ —Г—Б–Є–ї–µ–љ–Є—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –њ—А–Њ—П–≤–ї–µ–љ–Є–є –•–Ю–С–Ы) [12].
–Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М —Б–ї–µ–і—Г—О—Й–Є–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є—П:
вАУ –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ —Б–ї–µ–і—Г–µ—В –Њ—В–і–∞–≤–∞—В—М –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ—Л–Љ —Д–Њ—А–Љ–∞–Љ –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–≤;
вАУ –њ—А–Є –љ–µ–њ–Њ—Б—В–Њ—П–љ–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–∞—Е –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А—Л –Ї–Њ—А–Њ—В–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –њ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є;
вАУ –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–µ –Њ—В–і–∞–µ—В—Б—П –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л–Љ –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–∞–Љ, —В. –Ї. –Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —П–≤–ї—П–µ—В—Б—П –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ (—Б–љ–Є–ґ–∞—О—В —А–Є—Б–Ї –Њ–±–Њ—Б—В—А–µ–љ–Є–є, –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є, —Г–ї—Г—З—И–∞—О—В —Б–Є–Љ–њ—В–Њ–Љ—Л –Є –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є) –Є –њ–Њ–≤—Л—И–∞–µ—В –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є;
вАУ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —А–∞–Ј–љ—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–≤ –њ–Њ–≤—Л—И–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Є —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –љ–µ–≥–∞—В–Є–≤–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е;
вАУ –≤—Л–±–Њ—А –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–∞ –Є–ї–Є –Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є –Њ—Б–љ–Њ–≤—Л–≤–∞–µ—В—Б—П –љ–∞ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–Љ –њ–Њ–і–±–Њ—А–µ –њ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, —Б —Г—З–µ—В–Њ–Љ –і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–∞.
–Р–≤—В–Њ—А—Л —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–∞ GOLD —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В –і–ї–Є—В–µ–ї—М–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–Є–µ –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А—Л –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤—Л–±–Њ—А–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –•–Ю–С–Ы –≥—А—Г–њ–њ –Т, C –Є D. –Я—А–Є —Н—В–Њ–Љ, –њ–Њ –Є—Е –Љ–љ–µ–љ–Є—О, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ –≤ –њ–Њ–ї—М–Ј—Г –њ—А–µ–≤–Њ—Б—Е–Њ–і—Б—В–≤–∞ –∞–љ—В–Є—Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤ –љ–∞–і ќ≤2-–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є –ї–Є–±–Њ –љ–∞–Њ–±–Њ—А–Њ—В. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –≤ –Ї–∞–ґ–і–Њ–Љ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–Љ —Б–ї—Г—З–∞–µ –Њ—В–і–∞–µ—В—Б—П —В–Њ–Љ—Г –Ї–ї–∞—Б—Б—Г –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–≤, –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Ї–Њ—В–Њ—А–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–є –Є—Б–њ—Л—В—Л–≤–∞–µ—В –±–Њ–ї—М—И–µ–µ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –Њ–±–ї–µ–≥—З–µ–љ–Є–µ [12]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –і–ї–Є—В–µ–ї—М–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–≤ –њ–Њ–≤—Л—И–∞—О—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П, —Б–љ–Є–ґ–∞—О—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є –Њ–Ї–∞–Ј—Л–≤–∞—О—В –±–Њ–ї—М—И–µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Њ–±—К–µ–Љ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤—Л–і–Њ—Е–∞ –Ј–∞ –њ–µ—А–≤—Г—О —Б–µ–Ї—Г–љ–і—Г (–Ю–§–Т1), —З–µ–Љ –Ї–∞–ґ–і—Л–є –Є–Ј –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –Њ—В–і–µ–ї—М–љ–Њ—Б—В–Є. –С–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –і–ї–Є—В–µ–ї—М–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –Ь-—Е–Њ–ї–Є–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ (–Ф–Ф–Ь–•–С) —Б –і–ї–Є—В–µ–ї—М–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–Є–Љ–Є ќ≤2-–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є (–Ф–Ф–С–Р) –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –µ—Й–µ –≤ 2005 –≥. [32]. –Ф–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ —В–∞–Ї–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є. –Т–Њ-–њ–µ—А–≤—Л—Е, —А–∞–Ј–љ—Л–µ —В–Њ—З–Ї–Є –њ—А–Є–ї–Њ–ґ–µ–љ–Є—П: –Ф–Ф–Ь–•–С –Є–љ–≥–Є–±–Є—А—Г—О—В –і–µ–є—Б—В–≤–Є–µ –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–∞ –љ–∞ –Ь1- –Є –Ь3-—А–µ—Ж–µ–њ—В–Њ—А—Л; –Ф–Ф–С–Р —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В ќ≤2-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А—Л, —Г–≤–µ–ї–Є—З–Є–≤–∞—П —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —Ж–Р–Ь–§), –њ–Њ—В–µ–љ—Ж–Є—А—Г—О—В —А–µ–ї–∞–Ї—Б–Є—А—Г—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –≥–ї–∞–і–Ї—Г—О –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Г –±—А–Њ–љ—Е–Њ–≤, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Б–Є–љ–µ—А–≥–Є–Ј–Љ–∞ –љ–∞ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–Љ —Г—А–Њ–≤–љ–µ [21]. –Т–Њ-–≤—В–Њ—А—Л—Е, —В–∞–Ї–∞—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Н—Д—Д–µ–Ї—В –Ї—А—Г–≥–ї–Њ—Б—Г—В–Њ—З–љ–Њ, –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Ж–Є—А–Ї–∞–і–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –Є –њ–∞—А–∞—Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є —Б–Є—Б—В–µ–Љ [4]. –Т-—В—А–µ—В—М–Є—Е, –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є—Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –∞–і—А–µ–љ–µ—А–≥–Є—З–µ—Б–Ї—Г—О —Б—В–Є–Љ—Г–ї—П—Ж–Є—О ќ≤2-–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є –≤—Л—А–∞–±–Њ—В–Ї–Є –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–∞ [20].
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б—В–Њ–ї—М —Б–Њ–ї–Є–і–љ—Г—О –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Г—О –±–∞–Ј—Г, –і–Њ —Б–Є—Е –њ–Њ—А —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –њ—А–µ–і–ї–∞–≥–∞—О—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ—В–і–µ–ї—М–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –і–Є—Б—Б–Њ–љ–Є—А—Г—П —Б –њ–Њ—Б—В—Г–ї–∞—В–Њ–Љ GOLD –Њ —В–Њ–Љ, —З—В–Њ ¬Ђ–Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —А–∞–Ј–љ—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–≤ –њ–Њ–≤—Л—И–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П –Є —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –љ–µ–≥–∞—В–Є–≤–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е¬ї [12]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–Є—Б–ї–∞ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ —В–µ—А–∞–њ–Є–Є –Є –Ї—А–∞—В–љ–Њ—Б—В—М –µ–ґ–µ–і–љ–µ–≤–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤–µ–і—Г—В –Ї –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ—Г —Б–Њ–±–ї—О–і–µ–љ–Є—О –њ—А–∞–≤–Є–ї –њ—А–Є–µ–Љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —З—В–Њ —Г–Љ–µ–љ—М—И–∞–µ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы [2]. –Ю–±—К–µ–і–Є–љ–µ–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ —В–µ—А–∞–њ–Є–Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –і–Њ–ї–ґ–љ–Њ –њ–Њ–Љ–Њ—З—М –≤ –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є–Є —Н—В–Є—Е –њ—А–Њ–±–ї–µ–Љ. –Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Price et al. –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ–Ј—Л –Ї–∞–ґ–і–Њ–≥–Њ –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –њ—А–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –≤ –Њ–і–љ–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–µ —Б —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –і–Њ–Ј–Њ–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ 2-—Е –Љ–Њ–љ–Њ–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б–љ–Є–ґ–∞–µ—В —З–∞—Б—В–Њ—В—Г –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є (–Э–ѓ), –∞ —В–∞–Ї–ґ–µ –њ–Њ–≤—Л—И–∞–µ—В –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –Ј–∞ —Б—З–µ—В –±–Њ–ї–µ–µ –њ—А–Њ—Б—В–Њ–є —Б—Е–µ–Љ—Л –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П [26].
–° —Н—В–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –±–Њ–ї—М—И–Њ–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –љ–Њ–≤—Л–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А 24-—З–∞—Б–Њ–≤–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –і–ї—П –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ –µ–ґ–µ–і–љ–µ–≤–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П вАУ –≤–Є–ї–∞–љ—В–µ—А–Њ–ї / —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—А–Њ–Љ–Є–і.
–£–Љ–µ–Ї–ї–Є–і–Є–љ–Є–є вАУ —Н—В–Њ –љ–Њ–≤—Л–є –∞–љ—В–Є—Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–є –њ—А–µ–њ–∞—А–∞—В —Б —Б–Є–ї—М–љ—Л–Љ —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї M3-—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ. –Ю–љ –Є–Љ–µ–µ—В –±—Л—Б—В—А–Њ–µ –љ–∞—З–∞–ї–Њ –і–µ–є—Б—В–≤–Є—П (–°max = 5вАУ15 –Љ–Є–љ) –њ—А–Є –Љ–µ–і–ї–µ–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –Њ–±—А–∞—В–Є–Љ–Њ—Б—В–Є –Ь3-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б—В–Њ–ї—М –±—Л—Б—В—А–Њ–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є, –Ј–∞ —Б—З–µ—В –≤—Л—Б–Њ–Ї–Њ–є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є [30]. –Т –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–ї –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы II, III –Є IV —Б—В–∞–і–Є–є. –Ґ–∞–Ї, –≤ 12-–љ–µ–і–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤ –≥—А—Г–њ–њ–µ —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—Л–ї –њ–Њ–Ї–∞–Ј–∞–љ –њ—А–Є—А–Њ—Б—В –Ю–§–Т1 –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –љ–∞—З–∞–ї—М–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –љ–∞ 127 –Љ–ї (–і–ї—П –і–Њ–Ј—Л 62,5 –Љ–Ї–≥/—Б—Г—В) –Є –љ–∞ 152 –Љ–ї (–і–ї—П –і–Њ–Ј—Л 125 –Љ–Ї–≥/—Б—Г—В). –Ґ–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –Ј–љ–∞—З–Є–Љ–∞—П —А–µ–і—Г–Ї—Ж–Є—П –Њ–і—Л—И–Ї–Є –Є —Г–ї—Г—З—И–µ–љ–Є–µ –Њ–±—Й–µ–≥–Њ –Ј–і–Њ—А–Њ–≤—М—П, –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ–Њ–µ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Њ–њ—А–Њ—Б–љ–Є–Ї–∞ –У–Њ—Б–њ–Є—В–∞–ї—П –°–≤. –У–µ–Њ—А–≥–Є—П (–Њ–У–°–У) [31]. –Ъ–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ —Б—Е–Њ–і–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б —В–µ–љ–і–µ–љ—Ж–Є–µ–є –Ї –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤—Г —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –≤ –і–Њ–Ј–∞—Е 62,5 –Љ–Ї–≥/—Б—Г—В –Є 125 –Љ–Ї–≥/—Б—Г—В —Б —В–Є–Њ—В—А–Њ–њ–Є–µ–Љ (18 –Љ–Ї–≥/—Б—Г—В) –њ–Њ –≤–ї–Є—П–љ–Є—О –љ–∞ –Ю–§–Т1 –њ—А–Є —Б—А–∞–≤–љ–Є–Љ–Њ–Љ –њ—А–Њ—Д–Є–ї–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —В–∞–Ї–ґ–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є J.F. Donohue et al. [9]. –Т –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –і–ї–Є–≤—И–µ–Љ—Б—П 24 –љ–µ–і., —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є–є (125 –Љ–Ї–≥/—Б—Г—В) –њ–Њ–Ї–∞–Ј–∞–ї –±–Њ–ї—М—И–µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ю–§–Т1 –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–Є–Њ—В—А–Њ–њ–Є–µ–Љ (18 –Љ–Ї–≥/—Б—Г—В). –Т –Ї–Њ–љ—Ж–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –≥—А—Г–њ–њ–µ —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –Њ—В–Љ–µ—З–∞–ї—Б—П –њ—А–Є—А–Њ—Б—В –Ю–§–Т1 –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –љ–∞ 186 –Љ–ї, –∞ –≤ –≥—А—Г–њ–њ–µ —В–Є–Њ—В—А–Њ–њ–Є—П вАУ –љ–∞ 149 –Љ–ї. –Ґ–∞–Ї–ґ–µ –≤ –њ–Њ–ї—М–Ј—Г —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—Л–ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –њ–Є–Ї–Њ–≤–Њ–≥–Њ –њ–Њ–і—К–µ–Љ–∞ –Ю–§–Т1 (282 –Љ–ї –њ—А–Њ—В–Є–≤ 256 –Љ–ї) –Є —Б—А–µ–і–љ–µ–≤–Ј–≤–µ—И–µ–љ–љ–Њ–≥–Њ –Ю–§–Т1 –≤ –њ–µ—А–≤—Л–µ 6 —З (206 –Љ–ї –њ—А–Њ—В–Є–≤ 180 –Љ–ї) [8].
–Т–Є–ї–∞–љ—В–µ—А–Њ–ї –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –Ї–ї–∞—Б—Б—Г –Ф–Ф–С–Р. –Х–≥–Њ —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї ќ≤2-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–∞–Љ –≤—Л—И–µ, —З–µ–Љ —Г —Д–Њ—А–Љ–Њ—В–µ—А–Њ–ї–∞, –Є–љ–і–∞–Ї–∞—В–µ—А–Њ–ї–∞ –Є —Б–∞–ї—М–±—Г—В–∞–Љ–Њ–ї–∞ [27]. –£ –Ј–і–Њ—А–Њ–≤—Л—Е –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–µ–≤ –њ–Њ—Б–ї–µ –Є–љ–≥–∞–ї—П—Ж–Є–Є –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–∞ —Б—А–µ–і–љ—П—П Cmax –і–Њ—Б—В–Є–≥–∞–ї–∞—Б—М —З–µ—А–µ–Ј 5вАУ15 –Љ–Є–љ. –Р–±—Б–Њ–ї—О—В–љ–∞—П –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–∞ –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 27% —Б —Г—З–µ—В–Њ–Љ –≤–µ—Б—М–Љ–∞ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—Б–∞—Б—Л–≤–∞–љ–Є—П –≤–µ—Й–µ—Б—В–≤–∞ –≤ –њ–Њ–ї–Њ—Б—В–Є —А—В–∞. –Я–Њ—Б–ї–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е –Є–љ–≥–∞–ї—П—Ж–Є–є –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–∞ —З–µ—А–µ–Ј 6 –і–љ–µ–є –і–Њ—Б—В–Є–≥–∞–ї–Њ—Б—М —А–∞–≤–љ–Њ–≤–µ—Б–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б 2,4-–Ї—А–∞—В–љ—Л–Љ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ–Љ [17]. –Т 4-–љ–µ–і–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Hanania et al., –≤–Ї–ї—О—З–∞–≤—И–µ–Љ 602 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –•–Ю–С–Ы, –≤ –≥—А—Г–њ–њ–∞—Е –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–∞ (25 –Є 50 –Љ–Ї–≥/—Б—Г—В) –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ю–§–Т1 –љ–∞ 137 –Є 165 –Љ–ї –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ (—А<0,001). –Я–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Н–ї–µ–Ї—В—А–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞–Љ–Љ—Л, —Г—А–Њ–≤–љ–µ–є –≥–ї—О–Ї–Њ–Ј—Л –Є –Ї–∞–ї–Є—П –Ї—А–Њ–≤–Є –љ–µ –Њ—В–Љ–µ—З–∞–ї–Є—Б—М [15].
–Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П —Б –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ –њ–Њ–Ї–∞–Ј–∞–ї–∞ —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы –≤ —Б–µ—А–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (—В–∞–±–ї. 2).
–Ґ–∞–Ї, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Celli et al., –≤–Ї–ї—О—З–Є–≤—И–µ–Љ 1493 –њ–∞—Ж–Є–µ–љ—В–∞ —Б –•–Ю–С–Ы, –Ї–∞–Ї –Ї–∞–ґ–і—Л–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –≤ –Њ—В–і–µ–ї—М–љ–Њ—Б—В–Є, —В–∞–Ї –Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П —Б –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ 125 –Љ–Ї–≥/25 –Љ–Ї–≥ –њ–Њ–Ї–∞–Ј–∞–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –њ–µ—А–µ–і –њ–ї–∞—Ж–µ–±–Њ –≤ –њ—А–Є—А–Њ—Б—В–µ –Ю–§–Т1, —А–µ–і—Г–Ї—Ж–Є–Є –Њ–і—Л—И–Ї–Є, —Г–ї—Г—З—И–µ–љ–Є–Є –Њ–±—Й–µ–є —Б–∞–Љ–Њ–Њ—Ж–µ–љ–Ї–Є –Ј–і–Њ—А–Њ–≤—М—П, —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —А–µ–Љ–Є—Б—Б–Є–Є. –Э–∞–Є–±–Њ–ї–µ–µ —Г—Б–њ–µ—И–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П —Б –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ. –Я—А–Є —Н—В–Њ–Љ —З–∞—Б—В–Њ—В–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —Б–µ—А—М–µ–Ј–љ—Л—Е –Э–ѓ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є, —Б–Њ—Б—В–∞–≤–Є–≤ –≤ –≥—А—Г–њ–њ–∞—Е —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П/–≤–Є–ї–∞–љ—В–µ—А–Њ–ї–∞ –Є –њ–ї–∞—Ж–µ–±–Њ –њ–Њ 6%, –∞ –≤ –≥—А—Г–њ–њ–∞—Е –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є вАУ –њ–Њ 5%. –Я–Њ—Е–Њ–ґ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤ —Б—А–∞–≤–љ–Є–Љ–Њ–Љ –њ–Њ –і–Є–Ј–∞–є–љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л Donohue et al. [9]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ –Њ–±–Њ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б—А–µ–і–љ–µ–≤–Ј–≤–µ—И–µ–љ–љ—Л–є –њ—А–Є—А–Њ—Б—В –Ю–§–Т1 –≤ –њ–µ—А–≤—Л–µ 6 —З –њ–Њ—Б–ї–µ –Є–љ–≥–∞–ї—П—Ж–Є–Є —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П —Б –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ –њ—А–µ–≤—Л—И–∞–ї —В–∞–Ї–Њ–≤–Њ–є —Г –њ–ї–∞—Ж–µ–±–Њ –љ–∞ 287 –Є 242 –Љ–ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [6].
–Т –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ –Љ—Г–ї—М—В–Є—Ж–µ–љ—В—А–Њ–≤–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤ –њ–∞—А–∞–ї–ї–µ–ї—М–љ—Л—Е –≥—А—Г–њ–њ–∞—Е —Г 843 –±–Њ–ї—М–љ—Л—Е –•–Ю–С–Ы –≤ —В–µ—З–µ–љ–Є–µ 24 –љ–µ–і. —Б—А–∞–≤–љ–Є–≤–∞–ї–Є—Б—М –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –≤–Є–ї–∞–љ—В–µ—А–Њ–ї / —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—А–Њ–Љ–Є–і –≤ –≤—Л—Б–Њ–Ї–Њ–є –Є –љ–Є–Ј–Ї–Њ–є –і–Њ–Ј–∞—Е (25 –Љ–Ї–≥ / 125 –Љ–Ї–≥ –Є 25 –Љ–Ї–≥ / 62,5 –Љ–Ї–≥ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ) —Б –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є —В–Є–Њ—В—А–Њ–њ–Є–µ–Љ (18 –Љ–Ї–≥/—Б—Г—В) –Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ (25 –Љ–Ї–≥/—Б—Г—В). –У—А—Г–њ–њ—Л –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ–Ї–∞–Ј–∞–ї–Є –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–є –њ—А–Є—А–Њ—Б—В –Ю–§–Т1 –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є —В–Є–Њ—В—А–Њ–њ–Є—П: 1-—П –≥—А—Г–њ–њ–∞ вАУ –љ–∞ 88 –Љ–ї (0,036вАУ1,4 –ї, —А=0,001), –∞ 2-—П вАУ –љ–∞ 90 –Љ–ї (0,039вАУ0,142 –ї, —А=0,0006). –Э–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –≤ —Б–Є–Љ–њ—В–Њ–Љ–∞—Е, —Б–∞–Љ–Њ–Њ—Ж–µ–љ–Ї–µ —Б–Њ—Б—В–Њ—П–љ–Є—П –Ј–і–Њ—А–Њ–≤—М—П –Є —А–Є—Б–Ї–µ —А–∞–Ј–≤–Є—В–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є–є –Љ–µ–ґ–і—Г –≤—Б–µ–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є [8].
–Т –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є (n=869) —Б–Њ —Б—Е–Њ–і–љ—Л–Љ –і–Є–Ј–∞–є–љ–Њ–Љ, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –њ–Њ–і–≥—А—Г–њ–њ–∞ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ –±—Л–ї–∞ –Ј–∞–Љ–µ–љ–µ–љ–∞ –љ–∞ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є–µ–Љ (125 –Љ–Ї–≥/—Б—Г—В), –Ј–љ–∞—З–Є–Љ–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –≤ –≥—А—Г–њ–њ–∞—Е —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П/–≤–Є–ї–∞–љ—В–µ—А–Њ–ї–∞ –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ –њ–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О —Б—А–µ–і–љ–µ–≤–Ј–≤–µ—И–µ–љ–љ–Њ–≥–Њ –Ю–§–Т1 –≤ –њ–µ—А–≤—Л–µ 6 —З –њ–Њ—Б–ї–µ –Є–љ–≥–∞–ї—П—Ж–Є–Є: –љ–∞ 101 –Љ–ї –Є 96 –Љ–ї (—А<0,0001) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є —В–Є–Њ—В—А–Њ–њ–Є–µ–Љ –Є –љ–∞ 76 –Є 70 –Љ–ї (—А<0,001) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є–µ–Љ. –Т —Н—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —В–∞–Ї–ґ–µ –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –≤ –њ—А–Њ—Д–Є–ї–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –≤–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е [8].
M.R. Maleki-Yazdi —Г 905 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы —Б—А–∞–≤–љ–Є–ї —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –≤–Є–ї–∞–љ—В–µ—А–Њ–ї / —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—А–Њ–Љ–Є–і –≤ –і–Њ–Ј–µ 25 –Љ–Ї–≥ / 62,5 –Љ–Ї–≥ —Б –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є —В–Є–Њ—В—А–Њ–њ–Є–µ–Љ (18 –Љ–Ї–≥). –Ъ–∞–Ї —Б—А–µ–і–љ–µ–≤–Ј–≤–µ—И–µ–љ–љ—Л–є –њ—А–Є—А–Њ—Б—В –Ю–§–Т1 –≤ –њ–µ—А–≤—Л–µ 6 —З –њ–Њ—Б–ї–µ –Є–љ–≥–∞–ї—П—Ж–Є–Є, —В–∞–Ї –Є –њ—А–Є—А–Њ—Б—В –Ї –Є—Б—Е–Њ–і–љ–Њ–Љ—Г —Г—А–Њ–≤–љ—О –Ю–§–Т1 –њ–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є–µ–Љ/–≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ вАУ –љ–∞ 105 –Є 112 –Љ–ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (—А<0,001). –Ґ–∞–Ї–ґ–µ –≤ –≥—А—Г–њ–њ–µ —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ (–љ–∞ 2,1 –±–∞–ї–ї–∞) —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–Њ –Њ–У–°–У –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤—Л–Љ –≤ –≥—А—Г–њ–њ–µ —В–Є–Њ—В—А–Њ–њ–Є—П. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є, –Ї–Њ—В–Њ—А–Њ–µ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–∞–Ї —А–∞–Ј–љ–Є—Ж–∞ –≤ 4 –±–∞–ї–ї–∞ –њ–Њ –Њ–У–°–У –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ–Њ–є, –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ —Г 53% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ, –њ—А–Є–љ–Є–Љ–∞–≤—И–µ–є —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є–є/–≤–Є–ї–∞–љ—В–µ—А–Њ–ї, –Є —Г 46% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ —В–Є–Њ—В—А–Њ–њ–Є—П (—А=0,022) [18].
–С–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—А–Њ–Љ–Є–і–∞ —Б –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Њ–±—К—П—Б–љ—П–µ—В—Б—П –µ–µ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є: –≤–Њ-–њ–µ—А–≤—Л—Е, –Њ–±–∞ –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –≤–µ—Й–µ—Б—В–≤–∞ –љ–µ –Є–Љ–µ—О—В –љ–Є–Ї–∞–Ї–Є—Е —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–є, –∞ –≤–Њ-–≤—В–Њ—А—Л—Е, –њ—А–Є –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤ –≤–Є–і–µ —Б—Г—Е–Њ–≥–Њ –њ–Њ—А–Њ—И–Ї–∞ –Њ–љ–Є –Њ—З–µ–љ—М –њ–ї–Њ—Е–Њ –≤—Б–∞—Б—Л–≤–∞—О—В—Б—П, —З—В–Њ —Б–≤–Њ–і–Є—В –Ї –Љ–Є–љ–Є–Љ—Г–Љ—Г –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ —Б–Є—Б—В–µ–Љ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л.
–Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–∞ –Ј–і–Њ—А–Њ–≤—Л—Е –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–∞—Е –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —Е–Њ—А–Њ—И–∞—П –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞. –¶–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ —Б–Њ—Б—В–Њ—П–љ–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ–Њ–Ї–∞–Ј–∞–ї —Б—А–µ–і–љ–µ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є (–І–°–°) –љ–∞ 4,8 (0,6вАУ9,1) —Г–і./–Љ–Є–љ –±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П [16].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–∞ / —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—А–Њ–Љ–Є–і–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы –±—Л–ї–∞ –љ–∞–Є–±–Њ–ї–µ–µ –њ–Њ–ї–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–∞ J.F. Donohue –≤ 52-–љ–µ–і–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є (n=562). –Я–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 3 –≥—А—Г–њ–њ—Л: 1-—П –≥—А—Г–њ–њ–∞ вАУ —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є–є/–≤–Є–ї–∞–љ—В–µ—А–Њ–ї 125 –Љ–Ї–≥ / 25 –Љ–Ї–≥; 2-—П –≥—А—Г–њ–њ–∞ вАУ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є–µ–Љ 125 –Љ–Ї–≥/—Б—Г—В –Є 3-—П –≥—А—Г–њ–њ–∞ вАУ –њ–ї–∞—Ж–µ–±–Њ (—В–∞–±–ї. 2). –°–µ—А—М–µ–Ј–љ—Л–µ –Э–ѓ –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л —Г 6, 7 –Є 6% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Э–ѓ —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л (–≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –І–°–°) –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Г 15, 22 –Є 23% –±–Њ–ї—М–љ—Л—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Я—А–Њ—З–Є–µ –Э–ѓ вАУ —Г 8, 9 –Є 12% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [10]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —З–∞—Б—В–Њ—В–∞ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є–µ–Љ —Б –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ –±—Л–ї–∞ –љ–µ —В–Њ–ї—М–Ї–Њ —Б—А–∞–≤–љ–Є–Љ–∞, –љ–Њ –і–∞–ґ–µ –і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–∞ —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —Б–љ–Є–ґ–µ–љ–Є—О –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ.
–Я–Њ —Б–Њ–≤–Њ–Ї—Г–њ–љ—Л–Љ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ –Є –≤ –†–Њ—Б—Б–Є–Є –і–ї—П –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Њ–і–Њ–±—А–µ–љ –≤–Є–ї–∞–љ—В–µ—А–Њ–ї / —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—А–Њ–Љ–Є–і –≤ –і–Њ–Ј–µ 25 –Љ–Ї–≥ / 62,5 –Љ–Ї–≥.
–Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –≤–Є–ї–∞–љ—В–µ—А–Њ–ї / —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—А–Њ–Љ–Є–і –≤—Л–њ—Г—Б–Ї–∞–µ—В—Б—П –њ–Њ–і —В–Њ—А–≥–Њ–≤—Л–Љ –љ–∞–Є–Љ–µ–љ–Њ–≤–∞–љ–Є–µ–Љ –Р–љ–Њ—А–Њ –≠–ї–ї–Є–њ—В–∞¬Ѓ. –Т—В–Њ—А–∞—П —З–∞—Б—В—М –љ–∞–Ј–≤–∞–љ–Є—П (–≠–ї–ї–Є–њ—В–∞) –Њ–±–Њ–Ј–љ–∞—З–∞–µ—В –љ–Њ–≤—Л–є –њ–Њ—А–Њ—И–Ї–Њ–≤—Л–є –Љ—Г–ї—М—В–Є–і–Њ–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –Є–љ–≥–∞–ї—П—В–Њ—А. –Ш–љ–≥–∞–ї—П—В–Њ—А —Б–Њ–і–µ—А–ґ–Є—В 2 —Б—В—А–Є–њ–∞: –Њ–і–Є–љ вАУ —Б —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є–µ–Љ, –і—А—Г–≥–Њ–є вАУ —Б –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ. –Ъ–∞–ґ–і—Л–є —Б—В—А–Є–њ —Б–Њ—Б—В–Њ–Є—В –Є–Ј 30 —А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —П—З–µ–µ–Ї, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е —А–∞–Ј–Њ–≤—Г—О –і–Њ–Ј—Г. –Ґ–∞–Ї–∞—П –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–±–µ–ґ–∞—В—М –≥–Є–і—А–∞—В–∞—Ж–Є–Є —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ, –∞ —В–∞–Ї–ґ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ —Г–і–Њ–±–љ–∞ –≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–∞–њ—Б—Г–ї—М–љ—Л–Љ–Є –Є–љ–≥–∞–ї—П—В–Њ—А–∞–Љ–Є, –≤ –Ї–Њ—В–Њ—А—Л–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–µ—А–µ–і –Ї–∞–ґ–і–Њ–є –Є–љ–≥–∞–ї—П—Ж–Є–µ–є –Ј–∞–Ї–ї–∞–і—Л–≤–∞—В—М –Њ—В–і–µ–ї—М–љ—Л–µ –Ї–∞–њ—Б—Г–ї—Л.
–Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –≤—Б–µ–≥–Њ –≤—Л—И–µ–Є–Ј–ї–Њ–ґ–µ–љ–љ–Њ–≥–Њ –Љ–Њ–ґ–љ–Њ —Б–і–µ–ї–∞—В—М –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ —Б–Њ—З–µ—В–∞–љ–Є–µ —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—А–Њ–Љ–Є–і–∞ —Б –≤–Є–ї–∞–љ—В–µ—А–Њ–ї–Њ–Љ —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –±—А–Њ–љ—Е–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–∞—О—Й–Є–Љ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї—Г –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Д—Г–љ–Ї—Ж–Є–Є –≤–љ–µ—И–љ–µ–≥–Њ –і—Л—Е–∞–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б—В—А–∞–і–∞—О—Й–Є—Е –•–Ю–С–Ы. –Э–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —З—В–Њ–±—Л –±–Њ–ї–µ–µ —В–Њ—З–љ–Њ –Њ—Ж–µ–љ–Є—В—М –≤–ї–Є—П–љ–Є–µ —Н—В–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –љ–∞ —З–∞—Б—В–Њ—В—Г –Њ–±–Њ—Б—В—А–µ–љ–Є–є –Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є, –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М, –Њ–і–љ–∞–Ї–Њ –і–∞–љ–љ—Л–µ –Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ –њ–µ—А–µ–і –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є —В–Є–Њ—В—А–Њ–њ–Є–µ–Љ, –њ–Њ–Ї–∞–Ј–∞–љ–љ—Л–µ –≤ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—О—В –≤—Л–±–Њ—А –≤ –њ–Њ–ї—М–Ј—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–∞, —Б–Њ–і–µ—А–ґ–∞—Й–µ–≥–Њ —Г–Љ–µ–Ї–ї–Є–і–Є–љ–Є—П –±—А–Њ–Љ–Є–і –Є –≤–Є–ї–∞–љ—В–µ—А–Њ–ї, –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л –Т –њ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є GOLD, –∞ —В–∞–Ї–ґ–µ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –і–ї—П –њ–Њ–і–≥—А—Г–њ–њ C1 –Є D1.



–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Afonso A.S., Verhamme K.M., Sturkenboom M.C., Brusselle G.G. COPD in the general population: prevalence, incidence and survival // Respir Med. 2011. Vol. 105 (12). –†. 1872вАУ1884.
2. √Бgh T., Inotai A., M√©sz√°ros √Б. Factors associated with medication adherence in patients with chronic obstructive pulmonary disease // Respiration. 2011. Vol. 82 (4). –†. 328вАУ334.
3. Bourke D., Warlry A. The steady state and rebreathing methods compared during morphine administration in humans // J Physiol. 1989. Vol. 419. –†. 509вАУ517.
4. Cazzola M., Molimard M. The scientific rationale for combining long-acting ќ≤2-agonists and muscarinic antagonists in COPD // Pulm Pharmacol Ther. 2010. Vol. 23 (4). –†. 257вАУ267.
5. Celli B., Benditt J., Albert R. Chronic Obstructive Pulmonary Disease // Comprehensive Respiratory Medicine. 1999. Vol. 37. –†. 1вАУ37.
6. Celli B., Crater G., Kilbride S. et al. Once вАУ Daily Umeclidinium/Vilanterol 125/25 ќЉg Therapy in COPD. A Randomized, Controlled Study // Chest. 2014. Vol. 145 (5). –†. 981вАУ991.
7. Chapman K.R., Mannino D.M., Soriano J.B. et al. Epidemiology and costs of chronic obstructive pulmonary disease // Eur Resp J. 2006. Vol. 27 (1). –†. 188вАУ207.
8. Decramer M., Anzueto A., Kerwin E. et al. Efficacy and safety of umeclidinium plus vilanterol versus tiotropium, vilanterol, or umeclidinium monotherapies over 24 weeks in patients with chronic obstructive pulmonary disease: results from two multicentre, blinded, randomised controlled trials // Lancet Respir Med. 2014. Vol. 2 (6). –†. 472вАУ486.
9. Donohue J.F., Anzueto A., Brooks J., Mehta R., Kalberg C., Crater G. A randomized, double-blind dose-ranging study of the novel LAMA GSK573719 in patients with COPD // Respir Med. 2012 Jul. Vol. 106 (7). –†. 970вАУ979.
10. Donohue J.F., Niewoehner D., Brooks J., OвАЩDell D., Church A. Safety and tolerability of once-daily umeclidinium/vilanterol 125/25 mcg and umeclidinium 125 mcg in patients with chronic obstructive pulmonary disease: results from a 52-week, randomized, double-blind, placebo-controlled study // Respir Res. 2014. Vol. 15. –†. 78.
11. Fletcher M.J., Upton J., Taylor-Fishwick J., Buist S.A., Jenkins C., Hutton J., Barnes N., van der Molen T., Walsh J.W., Jones P., Walker S. COPD uncovered: an international survey on the impact of chronic obstructive pulmonary disease [COPD] on a working age population // BMC Public Health. 2011. Vol. 11. –†. 612.
12. Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease. NHLBI/WHO workshop report updated 2015.
13. Gross N.G. Anticholinergic therapy in chronic obstructive pulmonary disease. London: Franclin Scientific, 1993.
14. Guyatt G.H., Townsend M., Pugsley S.O., Keller J.L., Short H.D., Taylor D.W. et al. Bronchodilators in chronic airflow limitation. Effects on airway function, exercise capacity, and quality of life // Am Rev Respir Dis. 1987. Vol. 135 (5). –†. 1069вАУ1074.
15. Hanania N.A., Feldman G., Zachgo W. et al. The efficacy and safety of the novel long-acting ќ≤2 agonist vilanterol in patients with COPD: a randomized placebo-controlled trial // Chest. 2012. Vol. 142 (1). –†. 119вАУ127.
16. Kelleher D.L., Mehta R.S., Jean-Francois B.M. et al. Safety, tolerability, pharmacodynamics and pharmacokinetics of umeclidinium and vilanterol alone and in combination: a randomized crossover trial // PloS One. 2012. Vol. 7 (12). e50716.
17. Kempsford R., Norris V., Siederer S. Vilanterol trifenatate, a novel inhaled long-acting beta2 adrenoceptor agonist, is well tolerated in healthy subjects and demonstrates prolonged bronchodilation in subjects with asthma and COPD // Pulm Pharmacol Ther. 2013. Vol. 26 (2). –†. 256вАУ264.
18. Maleki-Yazdi M.R., Kaelin T., Richard N., Zvarich M., Church A. Efficacy and safety of umeclidinium/vilanterol 62.5/25 mcg and tiotropium 18 mcg in chronic obstructive pulmonary disease: results of a 24-week, randomized, controlled trial // Respir Med. 2014. Vol. 108 (12). –†. 1752вАУ1760.
19. McKay S.E., Howie C.A., Thomson A.H., Whiting B., Addis G.J. Value of theophylline treatment in patients handicapped by chronic obstructive lung disease // Thorax. 1993. Vol. 48 (3). –†. 227вАУ232.
20. Meurs H. A new perspective on muscarinic receptor antagonism in obstructive airway disease // Curr Opin Pharmacol. 2013. Vol. 13. –†. 316вАУ323.
21. Meurs H., Dekkers B.G., Maarsingh H., Halayko A.J., Zaagsma J., Gosens R. Muscarinic receptors on airway mesenchymal cells: novel findings for an ancient target // Pulm Pharmacol Ther. 2013. Vol. 26 (1). –†. 145вАУ155.
22. Murciano D., Auclair M.H., Pariente R., Aubier M. A randomized, controlled trial of theophylline in patients with severe chronic obstructive pulmonary disease // N Engl J Med. 1989. Vol. 320 (23). –†. 1521вАУ1525.
23. Nelson H.S. Beta-adrenergic bronchodilators // N Engl J Med. 1995. Vol. 333. –†. 499вАУ506.
24. Ng T.P., Niti M., Tan W.C., Cao Z., Ong K.C., Eng P. Depressive symptoms and chronic obstructive pulmonary disease: effect on mortality, hospital readmission, symptom burden, functional status, and quality of life // Arch Intern Med. 2007. Vol. 167 (1). –†. 60вАУ67.
25. Peto R., Lopez A.D., Boreham J., Thun M., Heath C.Jr. Mortality from tobacco in developed countries: indirect estimation from national vital statistics // Lancet. 1992. Vol. 339. –†. 1268вАУ1278.
26. Price D., Lee A.J., Sims E.J. et al. Characteristics of patients preferring once-daily controller therapy for asthma and COPD: a retrospective cohort study // Prim Care Respir J. 2013. Vol. 22 (2). –†. 161вАУ168.
27. Procopiou P.A., Barrett V.J., Bevan N.J. et al. Synthesis and structure-activity relationships of long-acting beta2 adrenergic receptor agonists incorporating metabolic inactivation: an antedrug approach // J Med Chem. 2010. Vol. 53 (11). –†. 4522вАУ4530.
28. Salpenter S.R., Buckley N.S., Salpenter E.E. Meta-analiysis: anticholinergics, but not b2-agonists, reduce severe exacerbations and respiratory mortality in COPD // J Gen Intern Med. 2006. Vol. 21. –†. 1011вАУ1019.
29. Siafakas N.M., Vermeire P., Pride N.B., Paoletti P., Gibson J., Howard P., Yernault J.C., Decramer M., Higenbottam T., Postma D.S., Rees J. on behalf of the Task Force. Optimal assessment and management of chronic obstructive pulmonary disease (COPD). A consensus statement of the European Respiratory Society (ERS) // Eur Respir J. 1995. Vol. 8. –†. 1398вАУ1420.
30. Tal-Singer R., Cahn A., Mehta R. et al. Initial assessment of single and repeat doses of inhaled umeclidinium in patients with chronic obstructive pulmonary disease: two randomised studies // Eur J Pharmacol. 2013. Vol. 701 (1вАУ3). –†. 40вАУ48.
31. Trivedi R., Richard N., Mehta R., Church A. Umeclidinium in patients with COPD: a randomised, placebo-controlled study // Eur Respir J. 2014. Vol. 43 (1). –†. 72вАУ81.
32. Van Noord J.A., Aumann J.L., Janssens E. et al. Comparison of tiotropium once daily, formoterol twice daily and both combined once daily in patients with COPD // Eur Respir J. 2005. Vol. 26 (2). –†. 214вАУ222.
33. Viegi G., Pistelli F., Sherrill D.L. et al. Definition, epidemiology and natural history of COPD // EurRespir J. 2007. Vol. 30. –†. 993вАУ1013.
34. Zhou Y., Wang X., Zeng X., Qiu R., Xie J., Liu S., Zheng J., Zhong N., Ran P. Positive benefits of theophylline in a randomized, double-blind, parallel!group, placebo controlled study of low-dose, slow-release theophylline in the treatment of COPD for 1 year // Respirology. 2006. Vol. 11 (5). –†. 603вАУ610.
35. Donohue J.F., Maleki-Yazdi M.R., Kilbride S., Mehta R., Kalberg C., Church A. Efficacy and safety of once-daily umeclidinium/vilanterol 62.5/25 mcg in COPD // Respir Med. 2013 Oct. Vol. 107 (10) P. 1538вАУ1546.
–Я—Г–±–ї–Є–Ї–∞—Ж–Є—П –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–∞ –њ—А–Є —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є
–њ–Њ–і–і–µ—А–ґ–Ї–µ –Ї–Њ–Љ–њ–∞–љ–Є–Є ¬Ђ–У–ї–∞–Ї—Б–Њ–°–Љ–Є—В–Ъ–ї—П–є–љ¬ї.
RU/UCV/0015/15 05.10.2015












