–Я–љ–µ–≤–Љ–Њ–љ–Є—П вАУ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–µ –Є –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П –њ–ї–Њ—Е–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ–Љ–Њ–µ –≤ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ. –Ґ–Њ–ї—М–Ї–Њ —Г 1/3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є –њ—А–∞–≤–Є–ї—М–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –њ—А–Є –Њ–±—А–∞—Й–µ–љ–Є–Є –Ї –≤—А–∞—З—Г, –Є–Ј –љ–Є—Е –ї–Є—И—М —Г 35% –≤ –њ–µ—А–≤—Л–µ 3 –і–љ—П –±–Њ–ї–µ–Ј–љ–Є [1]. –Ь–µ–ґ–і—Г —В–µ–Љ —А–∞–љ–љ—П—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –Є —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ –љ–∞—З–∞—В–Њ–µ –ї–µ—З–µ–љ–Є–µ –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Њ–њ—А–µ–і–µ–ї—П—О—В —В–µ—З–µ–љ–Є–µ –Є –њ—А–Њ–≥–љ–Њ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–†–µ—И–µ–љ–Є–µ –Њ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞ –Є–ї–Є –ї–µ—З–µ–љ–Є–Є –µ–≥–Њ –≤ –і–Њ–Љ–∞—И–љ–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е вАУ –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ, –њ—А–Є–љ–Є–Љ–∞–µ–Љ–Њ–µ –≤—А–∞—З–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–є –±–Њ–ї–µ–Ј–љ–Є. –≠—В–Њ —А–µ—И–µ–љ–Є–µ –Є–Љ–µ–µ—В –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–µ –Њ—В–љ–Њ—И–µ–љ–Є–µ –Ї –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—О –Љ–µ—Б—В–∞ (–њ–Њ–ї–Є–Ї–ї–Є–љ–Є–Ї–∞ –Є–ї–Є —Б—В–∞—Ж–Є–Њ–љ–∞—А), –Њ—Ж–µ–љ–Ї–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤—Л–±–Њ—А—Г –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є —Б—В–Њ–Є–Љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П.
–Э–µ–Љ–∞–ї–Њ–≤–∞–ґ–µ–љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Є —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є–є —А–µ–Ј—Г–ї—М—В–∞—В –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–≥–Њ –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –љ–µ—В—П–ґ–µ–ї–Њ–є –Т–Я. –Э–∞ —Б–µ–≥–Њ–і–љ—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞ –њ–µ—А–µ–і –њ–Њ–ї–Є–Ї–ї–Є–љ–Є–Ї–Њ–є –і–ї—П –±–Њ–ї—М–љ—Л—Е —Б –љ–µ—В—П–ґ–µ–ї–Њ–є –Т–Я –і–Њ–≤–Њ–ї—М–љ–Њ —Н—Д–µ–Љ–µ—А–љ—Л. –°—В–∞—Ж–Є–Њ–љ–∞—А—Л –Ј–∞—З–∞—Б—В—Г—О –љ–µ –Љ–Њ–≥—Г—В –њ—А–µ–і–ї–Њ–ґ–Є—В—М —Г—Б–ї–Њ–≤–Є—П –њ—А–µ–±—Л–≤–∞–љ–Є—П –ї—Г—З—И–µ –і–Њ–Љ–∞—И–љ–Є—Е, –∞ —Б–Ї—Г—З–µ–љ–љ–Њ—Б—В—М –≤ –њ–∞–ї–∞—В–∞—Е, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –Њ—Б–µ–љ–љ–µ-–Ј–Є–Љ–љ–Є–є –њ–µ—А–Є–Њ–і, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—О –Є–љ—Д–µ–Ї—Ж–Є–Є –Є —А–∞–Ј–≤–Є—В–Є—О –љ–Њ–Ј–Њ–Ї–Њ–Љ–Є–∞–ї—М–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є.
–¶–µ–ї—М –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є: –њ—А–µ–і—Б—В–∞–≤–Є—В—М –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є –Є –Ї—А–Є—В–µ—А–Є–Є —В—П–ґ–µ—Б—В–Є –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –≤ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е, –∞ —В–∞–Ї–ґ–µ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М –Ј–љ–∞—З–µ–љ–Є–µ –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –њ—А–Є –љ–µ—В—П–ґ–µ–ї–Њ–Љ –Є —В—П–ґ–µ–ї–Њ–Љ —В–µ—З–µ–љ–Є–Є.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞
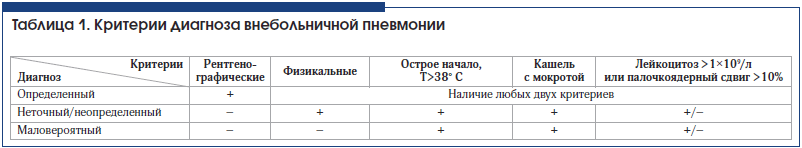
–Ф–Є–∞–≥–љ–Њ–Ј –Т–Я —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е, –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ –Є –і–∞–љ–љ—Л—Е —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є.–Ю—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Т–Я –≤ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е —П–≤–ї—П—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –Є–ї–Є –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ 2 –Є–Ј –љ–Є—Е:
вАҐ –Њ—Б—В—А–Њ–µ –љ–∞—З–∞–ї–Њ, —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —В–µ–ї–∞ вЙ•38,0¬∞ –°;
вАҐ –Ї–∞—И–µ–ї—М —Б –Љ–Њ–Ї—А–Њ—В–Њ–є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –Љ–∞–ї–Њ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Л–є;
вАҐ —Д–Є–Ј–Є–Ї–∞–ї—М–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є –≤ –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є (–Ї—А–µ–њ–Є—В–∞—Ж–Є—П, —Е—А–Є–њ—Л, –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–µ –і—Л—Е–∞–љ–Є–µ, –њ—А–Є—В—Г–њ–ї–µ–љ–Є–µ –њ—А–Є –њ–µ—А–Ї—Г—Б—Б–Є–Є).
–Ф–Є–∞–≥–љ–Њ–Ј –Т–Я –±–Њ–ї–µ–µ –≤–µ—А–Њ—П—В–µ–љ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Г –±–Њ–ї—М–љ–Њ–≥–Њ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є–љ—Д–µ–Ї—Ж–Є–Є –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є.
–Ф–Є–∞–≥–љ–Њ–Ј –Т–Я —П–≤–ї—П–µ—В—Б—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ (–Ї–∞—В–µ–≥–Њ—А–Є—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Р) –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Г –±–Њ–ї—М–љ–Њ–≥–Њ —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–є –Њ—З–∞–≥–Њ–≤–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є –Є –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ 2-—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Є–Ј —З–Є—Б–ї–∞ —Б–ї–µ–і—Г—О—Й–Є—Е:
вАҐ –Њ—Б—В—А–∞—П –ї–Є—Е–Њ—А–∞–і–Ї–∞ –≤ –љ–∞—З–∞–ї–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (—В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —В–µ–ї–∞ >38,0¬∞ –°);
вАҐ –Ї–∞—И–µ–ї—М —Б –Љ–Њ–Ї—А–Њ—В–Њ–є;
вАҐ —Д–Є–Ј–Є–Ї–∞–ї—М–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –њ–љ–µ–≤–Љ–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є (—Д–Њ–Ї—Г—Б –Ї—А–µ–њ–Є—В–∞—Ж–Є–Є –Є/–Є–ї–Є –Љ–µ–ї–Ї–Њ–њ—Г–Ј—Л—А—З–∞—В—Л–µ —Е—А–Є–њ—Л, –ґ–µ—Б—В–Ї–Њ–µ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–µ –і—Л—Е–∞–љ–Є–µ, —Г–Ї–Њ—А–Њ—З–µ–љ–Є–µ –њ–µ—А–Ї—Г—В–Њ—А–љ–Њ–≥–Њ –Ј–≤—Г–Ї–∞);
вАҐ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј >10,0√Ч109/–ї –Є/–Є–ї–Є –њ–∞–ї–Њ—З–Ї–Њ—П–і–µ—А–љ—Л–є —Б–і–≤–Є–≥ (>10%).
–Ф–Є–∞–≥–љ–Њ–Ј –Т–Я –љ–µ—В–Њ—З–љ—Л–є/–љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є (–Ї–∞—В–µ–≥–Њ—А–Є—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Р) –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Є–ї–Є –љ–µ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –Њ—З–∞–≥–Њ–≤–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є –≤ –ї–µ–≥–Ї–Є—Е (—А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞—Д–Є—П –Є–ї–Є –Ї—А—Г–њ–љ–Њ–Ї–∞–і—А–Њ–≤–∞—П —Д–ї—О–Њ—А–Њ–≥—А–∞—Д–Є—П –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є). –Я—А–Є —Н—В–Њ–Љ –і–Є–∞–≥–љ–Њ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—Б–љ–Њ–≤—Л–≤–∞–µ—В—Б—П –љ–∞ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–Љ–љ–µ–Ј–µ, –ґ–∞–ї–Њ–±–∞—Е –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –ї–Њ–Ї–∞–ї—М–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–∞—Е.
–Ф–Є–∞–≥–љ–Њ–Ј –Т–Я –Љ–∞–ї–Њ–≤–µ—А–Њ—П—В–µ–љ (–Ї–∞—В–µ–≥–Њ—А–Є—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ—Б—В–Є –Р), –µ—Б–ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–∞ —Б –ї–Є—Е–Њ—А–∞–і–Ї–Њ–є, –Ї–∞—И–ї–µ–Љ, –Њ–і—Л—И–Ї–Њ–є, –Њ—В–і–µ–ї–µ–љ–Є–µ–Љ –Љ–Њ–Ї—А–Њ—В—Л –Є/–Є–ї–Є –±–Њ–ї—М—О –≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–µ —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ–і–Њ—Б—В—Г–њ–љ–Њ –Є –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–∞—П –ї–Њ–Ї–∞–ї—М–љ–∞—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞.
–Ъ—А–Є—В–µ—А–Є–Є –і–Є–∞–≥–љ–Њ–Ј–∞ –Т–Я –Њ—В—А–∞–ґ–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1 [2].
–†–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞. –Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Т–Я –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ–≥–і–∞ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–µ –Њ—З–∞–≥–Њ–≤–Њ-–Є–љ—Д–Є–ї—М—В—А–∞—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –ї–µ–≥–Ї–Є—Е –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –љ–Є–ґ–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є. –Ш–Ј–Љ–µ–љ–µ–љ–Є—П –љ–∞ —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞–Љ–Љ–µ –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є (—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є, –љ–∞–ї–Є—З–Є–µ –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ–ї–µ–≤—А–∞–ї—М–љ–Њ–≥–Њ –≤—Л–њ–Њ—В–∞, –њ–Њ–ї–Њ—Б—В–Є –і–µ—Б—В—А—Г–Ї—Ж–Є–Є) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–Њ–є –Љ–Њ–≥—Г—В —Б–ї—Г–ґ–Є—В—М –Њ—А–Є–µ–љ—В–Є—А–Њ–Љ –і–ї—П –≤—Л–±–Њ—А–∞ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Я–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є:
–∞) –Њ—З–µ–≤–Є–і–љ–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ –Т–Я, –љ–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –ї–µ–≥–Ї–Є—Е –љ–∞ —А–µ–љ—В–≥–µ–љ–Њ–≥—А–∞–Љ–Љ–µ;
–±) –≤—Л—П–≤–ї–µ–љ–Є–µ –љ–µ—В–Є–њ–Є—З–љ—Л—Е —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Г –±–Њ–ї—М–љ–Њ–≥–Њ —Б –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є (–Њ–±—В—Г—А–∞—Ж–Є–Њ–љ–љ—Л–є –∞—В–µ–ї–µ–Ї—В–∞–Ј, –Є–љ—Д–∞—А–Ї—В –ї–µ–≥–Ї–Њ–≥–Њ –љ–∞ –њ–Њ—З–≤–µ —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Є –ї–µ–≥–Њ—З–љ–Њ–є –∞—А—В–µ—А–Є–Є, –∞–±—Б—Ж–µ—Б—Б –ї–µ–≥–Ї–Њ–≥–Њ –Є –і—А.);
–≤) —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–µ –Є–љ—Д–Є–ї—М—В—А–∞—В–Є–≤–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —В–Њ–є –ґ–µ –і–Њ–ї–µ –ї–µ–≥–Ї–Њ–≥–Њ (—Б–µ–≥–Љ–µ–љ—В–µ), —З—В–Њ –Є –≤ –њ—А–µ–і—Л–і—Г—Й–µ–Љ —Н–њ–Є–Ј–Њ–і–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є–ї–Є –њ—А–Є –Ј–∞—В—П–ґ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є (—Б–≤—Л—И–µ 4-—Е –љ–µ–і–µ–ї—М).
–§–Є–Ј–Є–Ї–∞–ї—М–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Ш–љ—Д–Њ—А–Љ–∞—Ж–Є—П, –њ–Њ–ї—Г—З–∞–µ–Љ–∞—П –њ—А–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞, –Ј–∞–≤–Є—Б–Є—В –Њ—В –Љ–љ–Њ–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –≤–Ї–ї—О—З–∞—П —Б—В–µ–њ–µ–љ—М —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –њ–љ–µ–≤–Љ–Њ–љ–Є—З–µ—Б–Ї–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є, –≤–Њ–Ј—А–∞—Б—В, –љ–∞–ї–Є—З–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Я—А–Є–Љ–µ—А–љ–Њ —Г 20% –±–Њ–ї—М–љ—Л—Е –Њ–±—К–µ–Ї—В–Є–≤–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –Т–Я –Љ–Њ–≥—Г—В –Њ—В–ї–Є—З–∞—В—М—Б—П –Њ—В —В–Є–њ–Є—З–љ—Л—Е –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞—В—М –≤–Њ–≤—Б–µ.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є. –Ґ–∞–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –Т–Я, –Ї–∞–Ї –Њ—Б—В—А–∞—П –ї–Є—Е–Њ—А–∞–і–Ї–∞, –±–Њ–ї—М –≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–µ –Є —В. –і., –≤ –љ–∞—З–∞–ї–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Љ–Њ–≥—Г—В –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞—В—М, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –Њ—Б–ї–∞–±–ї–µ–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –њ–Њ–ґ–Є–ї—Л—Е. –Я—А–Є–Љ–µ—А–љ–Њ —Г –Ї–∞–ґ–і–Њ–≥–Њ 4-–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ —Б—В–∞—А—И–µ 65 –ї–µ—В –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –ї–Є—Е–Њ—А–∞–і–Ї–∞, –∞ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј –Њ—В–Љ–µ—З–∞–µ—В—Б—П –ї–Є—И—М —Г 50вАУ70%. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В—М—О, —Б–ї–∞–±–Њ—Б—В—М—О, —В–Њ—И–љ–Њ—В–Њ–є, –∞–љ–Њ—А–µ–Ї—Б–Є–µ–є, –±–Њ–ї—П–Љ–Є –≤ –ґ–Є–≤–Њ—В–µ, –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Б–Њ–Ј–љ–∞–љ–Є—П. –Э–µ—А–µ–і–Ї–Њ –Т–Я –і–µ–±—О—В–Є—А—Г–µ—В —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Я—А–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є–Є –љ–∞ –њ–љ–µ–≤–Љ–Њ–љ–Є—О –≤—А–∞—З –Њ–њ—А–µ–і–µ–ї—П–µ—В:
вАҐ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є;
вАҐ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О. –Я—А–Њ–≤–µ–і–µ–љ–Є–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є (–ї—Г—З–µ–≤—Л—Е –Є/–Є–ї–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е) –љ–µ –і–Њ–ї–ґ–љ–Њ –≤–ї–Є—П—В—М –љ–∞ –≤—А–µ–Љ—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–Ю—Ж–µ–љ–Ї–∞ —В—П–ґ–µ—Б—В–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞ —Б –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є
–Я—А–Є –њ—А–Є–љ—П—В–Є–Є —А–µ—И–µ–љ–Є—П –Њ –Љ–µ—Б—В–µ –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Т–Я —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Њ—Ж–µ–љ–Ї–∞ –њ–Њ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —И–Ї–∞–ї–µ Confusion-Respiratoryrate-Bloodpressure-65 (CRBвАУ65) [3] –Є/–Є–ї–Є –Ї—А–Є—В–µ—А–Є—П–Љ —Б–Є–љ–і—А–Њ–Љ–∞ —Б–Є—Б—В–µ–Љ–љ–Њ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є (–°–Т–†) [4].–®–Ї–∞–ї–∞ –Њ—Ж–µ–љ–Ї–Є —В—П–ґ–µ—Б—В–Є CRB-65 (1 –±–∞–ї–ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ї–∞–ґ–і–Њ–Љ—Г –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–µ–Љ—Г –њ—А–Є–Ј–љ–∞–Ї—Г):
вАҐ –љ–∞—А—Г—И–µ–љ–Є–µ —Б–Њ–Ј–љ–∞–љ–Є—П;
вАҐ –І–Ф вЙ•30 –≤ –Љ–Є–љ—Г—В—Г;
вАҐ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ (—Б–Є—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Р–Ф <90 –Є–ї–Є –і–Є–∞—Б—В–Њ–ї–Є—З–µ—Б–Ї–Њ–µ –Р–Ф вЙ§60 –Љ–Љ —А—В. —Б—В.);
вАҐ –≤–Њ–Ј—А–∞—Б—В вЙ•65 –ї–µ—В.
–°–Є–љ–і—А–Њ–Љ –°–Т–† –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є –Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–∞–Ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Њ—В–≤–µ—В –љ–∞ –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П, –Є–Љ–µ—О—Й–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–µ –Є–ї–Є –љ–µ–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–µ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є–µ.
–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б–Є–љ–і—А–Њ–Љ–∞ –°–Т–† —П–≤–ї—П–µ—В—Б—П –љ–∞–ї–Є—З–Є–µ 2-—Е –Є–ї–Є –±–Њ–ї–µ–µ –Є–Ј —Б–ї–µ–і—Г—О—Й–Є—Е –Ї—А–Є—В–µ—А–Є–µ–≤ [4, 5]:
вАҐ —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —В–µ–ї–∞ >38¬∞ C –Є–ї–Є <36¬∞ C;вАҐ —З–∞—Б—В–Њ—В–∞ —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є (–І–°–°) >90 —Г–і/–Љ–Є–љ;
вАҐ –І–Ф >20 –≤ –Љ–Є–љ—Г—В—Г –Є–ї–Є —Г—А–Њ–≤–µ–љ—М PaCO2 (–љ–∞–њ—А—П–ґ–µ–љ–Є–µ —Г–≥–ї–µ–Ї–Є—Б–ї–Њ–≥–Њ –≥–∞–Ј–∞ –≤ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –Ї—А–Њ–≤–Є) <32 –Љ–Љ —А—В. —Б—В.;
вАҐ —З–Є—Б–ї–Њ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є (>12√Ч109/–ї –Є–ї–Є <4√Ч109/–ї –Є–ї–Є >10% –њ–∞–ї–Њ—З–Ї–Њ—П–і–µ—А–љ—Л—Е —Д–Њ—А–Љ).
–°—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О –њ–Њ–і–ї–µ–ґ–∞—В:
вАҐ –±–Њ–ї—М–љ—Л–µ –Т–Я –Є–ї–Є —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –Т–Я, –Є–Љ–µ—О—Й–Є–µ –њ–Њ —И–Ї–∞–ї–µ CRB-65 1 –±–∞–ї–ї –Є –±–Њ–ї–µ–µ –Є/–Є–ї–Є —Б–Є–љ–і—А–Њ–Љ –°–Т–† (–≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А—Г—О—В—Б—П –≤ —Н–Ї—Б—В—А–µ–љ–љ–Њ–Љ –њ–Њ—А—П–і–Ї–µ –≤ –Ї—А—Г–≥–ї–Њ—Б—Г—В–Њ—З–љ—Л–є —Б—В–∞—Ж–Є–Њ–љ–∞—А);вАҐ –њ–∞—Ж–Є–µ–љ—В—Л —Б –Т–Я –Є–ї–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –Т–Я —Б –Њ—Ж–µ–љ–Ї–Њ–є —В—П–ґ–µ—Б—В–Є –њ–Њ CRB-65 0 –±–∞–ї–ї–Њ–≤, –љ–µ –Є–Љ–µ—О—Й–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ —Б–Є–љ–і—А–Њ–Љ–∞ –°–Т–† (–њ—А–Є –љ–∞–ї–Є—З–Є–Є —Б–Њ—Ж–Є–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Є–ї–Є –ґ–µ–ї–∞–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞ –Љ–Њ–≥—Г—В –±—Л—В—М –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ –Ї—А—Г–≥–ї–Њ—Б—Г—В–Њ—З–љ—Л–є –Є–ї–Є –і–љ–µ–≤–љ–Њ–є —Б—В–∞—Ж–Є–Њ–љ–∞—А);
вАҐ –њ–∞—Ж–Є–µ–љ—В—Л —Б—В–∞—А—И–µ 65 –ї–µ—В —Б–Њ —Б–ї–µ–і—Г—О—Й–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є (—Б–Њ—Б—В–Њ—П–љ–Є—П–Љ–Є), –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Т–Я:
вАУ —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ–∞—П –±–Њ–ї–µ–Ј–љ—М –ї–µ–≥–Ї–Є—Е (–•–Ю–С–Ы), —В—П–ґ–µ–ї–∞—П –±—А–Њ–љ—Е–Є–∞–ї—М–љ–∞—П –∞—Б—В–Љ–∞, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В –Є–ї–Є —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М;
вАУ –њ—А–µ–і—Л–і—Г—Й–∞—П –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є—П –≥–Њ–і –љ–∞–Ј–∞–і;
вАУ –њ–Њ—Б—В–Њ—П–љ–љ—Л–є –њ—А–Є–µ–Љ —Б–Є—Б—В–µ–Љ–љ—Л—Е –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤;
вАУ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –≤ –њ—А–µ–і—Л–і—Г—Й–µ–Љ –Љ–µ—Б—П—Ж–µ;
вАУ –Њ–±—Й–µ–µ –љ–µ–і–Њ–Љ–Њ–≥–∞–љ–Є–µ;
вАУ —Б–њ—Г—В–∞–љ–љ–Њ—Б—В—М/–Њ—Б–ї–∞–±–ї–µ–љ–Є–µ —Б–Њ–Ј–љ–∞–љ–Є—П;
вАУ –І–°–°>100 –≤ –Љ–Є–љ—Г—В—Г, —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —В–µ–ї–∞ >38¬∞ –°, –І–Ф>30 –≤ –Љ–Є–љ—Г—В—Г, –Р–Ф<90/60 –Љ–Љ —А—В. —Б—В.
–Ф–ї—П –≤—Б–µ—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –≥—А—Г–њ–њ —Б –Т–Я –љ–∞–ї–Є—З–Є–µ —Б–µ—А—М–µ–Ј–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є, —В–∞–Ї–Є—Е –Ї–∞–Ї –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, –њ–µ—З–µ–љ–Њ—З–љ–∞—П –Є –њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Є –і—А—Г–≥–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤–ї–Є—П—О—Й–Є–µ –љ–∞ –Є–Љ–Љ—Г–љ–Њ–Ї–Њ–Љ–њ–µ—В–µ–љ—В–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ, —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В —А–Є—Б–Ї –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Р–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О –њ–Њ–і–ї–µ–ґ–∞—В –±–Њ–ї—М–љ—Л–µ –Т–Я —Б –љ–Є–Ј–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞:
вАҐ –≤–Њ–Ј—А–∞—Б—В –і–Њ 65 –ї–µ—В;
вАҐ —Б–Њ—Е—А–∞–љ–µ–љ–љ—Л–є –Є–љ—В–µ–ї–ї–µ–Ї—В—Г–∞–ї—М–љ—Л–є —Б—В–∞—В—Г—Б;
вАҐ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ї–ї–Є–љ–Є–Ї–Њ-–∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є—Е —Г–Ї–∞–Ј–∞–љ–Є–є –љ–∞ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Ј–∞—Б—В–Њ–є–љ—Г—О —Б–µ—А–і–µ—З–љ—Г—О –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Г—О –њ–∞—В–Њ–ї–Њ–≥–Є—О, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ—З–µ–Ї –Є –њ–µ—З–µ–љ–Є;
вАҐ –І–ФвЙ§20 –≤ –Љ–Є–љ—Г—В—Г;
вАҐ –І–°–°вЙ§90 –≤ –Љ–Є–љ—Г—В—Г;
вАҐ —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —В–µ–ї–∞ >35,0¬∞ –° –Є вЙ§38,3¬∞ –°;
вАҐ –Р–Ф —Б–Є—Б—В. >90 –Љ–Љ —А—В. —Б—В.;
вАҐ –њ—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є –љ–µ –±–Њ–ї–µ–µ –Њ–і–љ–Њ–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –ї–µ–≥–Ї–Њ–≥–Њ;
вАҐ —Б —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л–Љ–Є –±—Л—В–Њ–≤—Л–Љ–Є –Є –Љ–∞—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є —Г—Б–ї–Њ–≤–Є—П–Љ–Є;
вАҐ –њ—А–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є;
вАҐ —Б–Њ–≥–ї–∞—Б–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –љ–∞ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ.
–Ы–µ—З–µ–љ–Є–µ
–Ф–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є —П–≤–ї—П—О—В—Б—П –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –љ–∞—Г—З–љ–Њ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Т–Я. –°–Њ–≥–ї–∞—Б–љ–Њ –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ, –ї–µ—З–µ–љ–Є—О –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Т–Я, –±–Њ–ї—М–љ—Л–µ —Б –Т–Я —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 4 –≥—А—Г–њ–њ—Л —Б —Г—З–µ—В–Њ–Љ —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є –і–∞–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є [3]. –Т –Ї–∞–ґ–і–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е –Т–Я –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞–Є–±–Њ–ї–µ–µ –≤–µ—А–Њ—П—В–љ—Л–є —Б–њ–µ–Ї—В—А –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Є –њ–µ—А–µ—З–µ–љ—М –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [6].–Ь–∞–Ї—А–Њ–ї–Є–і–љ—Л–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є –Ј–∞–љ–Є–Љ–∞—О—В –Њ–і–љ–Њ –Є–Ј –≤–µ–і—Г—Й–Є—Е –Љ–µ—Б—В –≤ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Т–Я —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є. –Я–Њ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ –Љ–∞–Ї—А–Њ–ї–Є–і—Л –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —В–Ї–∞–љ–µ–≤—Л–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ. –Ъ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –љ–∞–Ј–љ–∞—З–∞–µ–Љ—Л—Е –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Т–Я –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (–±–µ—В–∞-–ї–∞–Ї—В–∞–Љ–Њ–≤ –Є –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤) –Њ—В–љ–Њ—Б–Є—В—Б—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –Ї –±–Њ–ї—М—И–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –Њ—З–∞–≥–µ –Є–љ—Д–µ–Ї—Ж–Є–Є, —З–µ–Љ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є (—В–∞–±–ї. 2) [7].

–£—Б–њ–µ—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є –Ј–∞–≤–Є—Б–Є—В –Њ—В –њ—А–∞–≤–Є–ї—М–љ–Њ –≤—Л–±—А–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є –µ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П, —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞ –Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –њ–∞—В–Њ–≥–µ–љ–∞ –Ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–Љ—Г –њ—А–µ–њ–∞—А–∞—В—Г, –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –Є –±–Є–Њ—Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ—Б—В–Є. –Я–Њ—Б–ї–µ–і–љ–µ–µ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –≥–µ–љ–µ—А–Є—З–µ—Б–Ї–Є–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ, —Б—В–Њ–ї—М —И–Є—А–Њ–Ї–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–Љ –љ–∞ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–Љ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —А—Л–љ–Ї–µ. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є –Њ–і–љ–Њ–≥–Њ –Є–Ј —И–Є—А–Њ–Ї–Њ–њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —А—Л–љ–Ї–µ –Љ–∞–Ї—А–Њ–ї–Є–і–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ вАУ –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Є –µ–≥–Њ –≥–µ–љ–µ—А–Є–Ї–Њ–≤ (–њ—А–Њ–≤–µ—А–µ–љ–Њ –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –љ–∞ –Ј–і–Њ—А–Њ–≤—Л—Е –Љ—Л—И–∞—Е) –і–∞–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 3 [8].
![–Ґ–∞–±–ї–Є—Ж–∞ 3. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Є –µ–≥–Њ –≥–µ–љ–µ—А–Є–Ї–Њ–≤ [8] –Ґ–∞–±–ї–Є—Ж–∞ 3. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Є –µ–≥–Њ –≥–µ–љ–µ—А–Є–Ї–Њ–≤ [8]](/upload/medialibrary/69e/232-3.png)
–°—А–∞–≤–љ–µ–љ–Є–µ –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Є –≥–µ–љ–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –і–µ–є—Б—В–≤–Є—П –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥–µ–љ–µ—А–Є—З–µ—Б–Ї–Є–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤ —В–Ї–∞–љ–Є –ї–µ–≥–Ї–Њ–≥–Њ, —З—В–Њ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М –њ—А–Є –≤—Л–±–Њ—А–µ –њ—А–µ–њ–∞—А–∞—В–∞.
–Ю—В–ї–Є—З–Є—В–µ–ї—М–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Њ—В –і—А—Г–≥–Є—Е –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ —П–≤–ї—П–µ—В—Б—П –µ–≥–Њ –љ–µ —В–Њ–ї—М–Ї–Њ –±–∞–Ї—В–µ—А–Є–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є–µ, –љ–Њ –Є –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞. –С–∞–Ї—В–µ—А–Є—Ж–Є–і–љ—Л–є —Н—Д—Д–µ–Ї—В –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –±–ї–∞–≥–Њ–і–∞—А—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ —Б–Њ–Ј–і–∞–≤–∞—В—М –Њ—З–µ–љ—М –±–Њ–ї—М—И–Є–µ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є, –≥—Г–±–Є—В–µ–ї—М–љ—Л–µ –і–ї—П –Љ–љ–Њ–≥–Є—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤–љ—Г—В—А–Є –Ї–ї–µ—В–Њ–Ї [9]. –Р–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –њ—А–Њ—П–≤–ї—П–µ—В –њ–Њ—Б—В–∞–љ—В–Є–±–Є–Њ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Є —Н—Д—Д–µ–Ї—В –њ–Њ—Б—В–∞–љ—В–Є–±–Є–Њ—В–Є—З–µ—Б–Ї–Њ–є —Б—Г–±–Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є –њ–Њ–і–∞–≤–ї—П—О—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–Њ—В–Є–≤ —В–∞–Ї–Є—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –Ї–∞–Ї Streptococcus pyogenes, Streptococcus pneumoniae, Haemophilus influenzae, Legionella pneumophila. –Р–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ вАУ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–є –Љ–∞–Ї—А–Њ–ї–Є–і —Б –њ—А–Є—А–Њ–і–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є H. influenza; –Є –њ–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–Њ—Б—В–∞–љ—В–Є–±–Є–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е, –≤—Л–Ј–≤–∞–љ–љ—Л—Е H. influenzae –Є L. Pneumophila, –Њ–љ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ [10, 11].
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Є –і—А—Г–≥–Є–µ –Љ–∞–Ї—А–Њ–ї–Є–і—Л –Њ–±–ї–∞–і–∞—О—В –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–Љ –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –£–љ–Є–Ї–∞–ї—М–љ–Њ—Б—В—М –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –Ї–∞–Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞, –Њ–±–ї–∞–і–∞—О—Й–µ–≥–Њ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ, –љ–Њ –Є –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–Љ —Б–≤–Њ–є—Б—В–≤–Њ–Љ, –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–∞ —Б –Њ—Б–Њ–±—Л–Љ —Б—В—А–Њ–µ–љ–Є–µ–Љ –Љ–Њ–ї–µ–Ї—Г–ї—Л. –Я–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ—Г —Б—В—А–Њ–µ–љ–Є—О –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ —П–≤–ї—П–µ—В—Б—П 15-—З–ї–µ–љ–љ—Л–Љ –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–Љ –Є –µ–≥–Њ –Ї–Њ—А–µ–љ–љ–Њ–µ –Њ—В–ї–Є—З–Є–µ –Њ—В ¬Ђ–Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е¬ї 14-—З–ї–µ–љ–љ—Л—Е –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ —Б–Њ—Б—В–Њ–Є—В –≤ —В–Њ–Љ, —З—В–Њ –≤ —Б–Њ—Б—В–∞–≤ –µ–≥–Њ –Љ–Њ–ї–µ–Ї—Г–ї—Л –≤—Е–Њ–і–Є—В –∞—В–Њ–Љ –∞–Ј–Њ—В–∞. –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –љ–∞ –Ј–і–Њ—А–Њ–≤—Л—Е –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–∞—Е, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–љ–Є–Љ–∞–ї–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –≤ –і–Њ–Ј–µ 500 –Љ–≥/—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 3-—Е –і–љ–µ–є, –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ 2-—Д–∞–Ј–љ–Њ–µ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ [12]. –Я–µ—А–≤–∞—П —Д–∞–Ј–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –±—Л—Б—В—А–Њ–є, –љ–Њ –њ—А–µ—Е–Њ–і—П—Й–µ–є —Б—В–Є–Љ—Г–ї—П—Ж–Є–µ–є –і–µ–≥—А–∞–љ—Г–ї—П—Ж–Є–Є –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Є —Г—Б–Є–ї–µ–љ–Є–µ–Љ –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤–Ј—А—Л–≤–∞, —З—В–Њ –Њ–њ—В–Є–Љ–Є–Ј–Є—А—Г–µ—В –Ј–∞—Й–Є—В–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Є –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Т—В–Њ—А–∞—П —Д–∞–Ј–∞ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –љ–∞—З–Є–љ–∞–µ—В—Б—П –њ–Њ–Ј–і–љ–µ–µ –Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—Ж–Є–Є –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞-8 –Є —Г—Б–Є–ї–µ–љ–Є–µ–Љ –∞–њ–Њ–њ—В–Њ–Ј–∞ –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є. –° –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ —Б–≤—П–Ј–∞–љ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≥–Є–њ–µ—А—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–µ–є –±—А–Њ–љ—Е–Њ–ї–µ–≥–Њ—З–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є [13]. –Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ—Л –ї—Г—З—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —В–µ—А–∞–њ–Є–Є –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –Т–Я –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞, —З—В–Њ –≤–µ—А–Њ—П—В–љ–µ–µ –≤—Б–µ–≥–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –Є—Е –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Э–∞–њ—А–Є–Љ–µ—А, –Ї–∞–Ї –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є, —В–∞–Ї –Є –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–µ —Б–µ–њ—Б–Є—Б–∞, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є —А–∞–Ј–≤–Є—В–Є–µ –Љ–∞–Ї—А–Њ–ї–Є–і-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –∞–і–≥–µ–Ј–Є–Є –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤, –Є—Е –і–µ–∞–Ї—В–Є–≤–∞—Ж–Є—О –Є —Б–љ–Є–ґ–µ–љ–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ [14, 15]. –Х—Й–µ –Њ–і–љ–Њ–є —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П –µ–≥–Њ –∞–љ—В–Є—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ —В–∞–Ї–ґ–µ –≤–љ–Њ—Б–Є—В —Б–≤–Њ–є –≤–Ї–ї–∞–і –≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞. –Р–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ in vitro –њ–Њ–Ї–∞–Ј–∞–ї —Б–µ–±—П –љ–∞–Є–±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ—Л–Љ –Є–Ј –≥—А—Г–њ–њ—Л –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–Њ–і–∞–≤–ї–µ–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –Є –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е —В–Њ–Ї—Б–Є–љ–Њ–≤, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Њ–љ —Б–љ–Є–ґ–∞–µ—В —Б–Є–љ—В–µ–Ј –њ–љ–µ–≤–Љ–Њ–ї–Є–Ј–Є–љ–∞ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞–Љ–Є, –≤–Ї–ї—О—З–∞—П –≤—Л—Б–Њ–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–µ —И—В–∞–Љ–Љ—Л [16, 17].
–Т–∞–ґ–љ—Л–Љ —Г—Б–ї–Њ–≤–Є–µ–Љ –њ—А–Є –≤—Л–±–Њ—А–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ –≤—Л—Б—В—Г–њ–∞—О—В –Њ–ґ–Є–і–∞–µ–Љ–∞—П —З–∞—Б—В–Њ—В–∞ –Є —В—П–ґ–µ—Б—В—М –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є. –Р–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –њ—А–Њ—Д–Є–ї–µ–Љ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є. –І–∞—Й–µ –і—А—Г–≥–Є—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –њ—А–Є –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –љ–∞–±–ї—О–і–∞—О—В—Б—П —А–µ–∞–Ї—Ж–Є–Є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (<12%). –Ю–љ–Є –Њ–±—Л—З–љ–Њ —Б–ї–∞–±–Њ –≤—Л—А–∞–ґ–µ–љ—Л –Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ —В—А–µ–±—Г—О—В –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞. –Я—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ—Б—В—М –≤ –Љ–µ—Б—В–µ –≤–µ–љ–µ–њ—Г–љ–Ї—Ж–Є–Є –Є –њ–Њ—Б—В–Є–љ—Д—Г–Ј–Є–Њ–љ–љ—Л–є —Д–ї–µ–±–Є—В —А–µ–≥–Є—Б—В—А–Є—А—Г—О—В –≤ 6,5% –Є 3% —Б–ї—Г—З–∞–µ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [13]. –°—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —А–µ–ґ–µ (<3%) –≤—Б—В—А–µ—З–∞—О—В—Б—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є—П, —В—А–µ–±—Г—О—Й–Є–µ –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞: —Б—Л–њ—М, —Г–њ–Њ—А–љ–∞—П –і–Є–∞—А–µ—П, —В–Њ—И–љ–Њ—В–∞ –Є —А–≤–Њ—В–∞, –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є —Ж–Є—В–Њ–ї–Є–Ј–∞ –Є —Е–Њ–ї–µ—Б—В–∞–Ј–∞, –±–Њ–ї–Є –≤ –ґ–Є–≤–Њ—В–µ –Є —Б–Њ–љ–ї–Є–≤–Њ—Б—В—М. –Ь–µ—В–∞–∞–љ–∞–ї–Є–Ј –њ–Њ–Ї–∞–Ј–∞–ї –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–є —А–∞–Ј–љ–Є—Ж—Л –њ–Њ —З–∞—Б—В–Њ—В–µ —А–∞–Ј–≤–Є—В–Є—П –і–Є–∞—А–µ–Є, —В–Њ—И–љ–Њ—В—Л, –±–Њ–ї–Є, —Б–љ–Є–ґ–µ–љ–Є—П –∞–њ–њ–µ—В–Є—В–∞ –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Є –њ–ї–∞—Ж–µ–±–Њ [18]. –Ъ—А–∞–є–љ–µ —А–µ–і–Ї–Њ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ –љ–∞–±–ї—О–і–∞—О—В—Б—П –Є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є [19]. –•–∞—А–∞–Ї—В–µ—А–љ–Њ–є —З–µ—А—В–Њ–є –њ–Њ—Б–ї–µ–і–љ–Є—Е –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ —П–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–Є–µ –≤ –Њ—В–і–∞–ї–µ–љ–љ—Л–µ —Б—А–Њ–Ї–Є –њ–Њ—Б–ї–µ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, —З—В–Њ —В—А–µ–±—Г–µ—В 3вАУ4-–љ–µ–і–µ–ї—М–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Ј–∞ –±–Њ–ї—М–љ—Л–Љ. –Ь–∞–Ї—А–Њ–ї–Є–і—Л, –≤ —В. —З. –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –Љ–Њ–≥—Г—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –Є–Ј–Љ–µ–љ–µ–љ–Є—О –±–Є–Њ—Ж–µ–љ–Њ–Ј–∞ –Ї–Є—И–µ—З–љ–Є–Ї–∞. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Н—В–Њ –њ—А–Є–Њ–±—А–µ—В–∞–µ—В –≤ –Њ—З–µ–љ—М —А–µ–і–Ї–Є—Е —Б–ї—Г—З–∞—П—Е –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є –і–Є–∞—А–µ–Є, –≤—Л–Ј–≤–∞–љ–љ–Њ–є Clostridium difficile, –≤–∞–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Є–ї–Є –Њ—А–∞–ї—М–љ–Њ–≥–Њ –Ї–∞–љ–і–Є–і–Њ–Ј–∞ [19]. –Э–µ—Б–Ї–Њ–ї—М–Ї–Њ —З–∞—Й–µ –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –≤ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј–∞—Е. –Ю–і–љ–∞–Ї–Њ –і–∞–ґ–µ –њ—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є 4,0 –≥ —А–∞—Б—В–≤–Њ—А–∞ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ —З–∞—Б—В–Њ—В–∞ –±–Њ–ї–µ–є –≤ –ґ–Є–≤–Њ—В–µ –Є —В–Њ—И–љ–Њ—В—Л –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 0,5%.
–Ю—Ж–µ–љ–Є–≤–∞—П –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–∞–Ј–≤–Є—В–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є, —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ–± –Є—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є. –І–∞—Б—В–Њ—В–∞ —А–∞–Ј–≤–Є—В–Є—П –ґ–Є–Ј–љ–µ—Г–≥—А–Њ–ґ–∞—О—Й–Є—Е –∞—А–Є—В–Љ–Є–є –њ—А–Є –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –љ–Є–Ј–Ї–∞ –Є –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 1 —Б–ї—Г—З–∞—П –љ–∞ 100 000 –љ–∞–Ј–љ–∞—З–µ–љ–Є–є [20]. –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ Poluzzi E. et al., –Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є H. Svanstrom et al. –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ —Б—А–µ–і–Є –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞–Є–Љ–µ–љ—М—И–Є–є –∞—А–Є—В–Љ–Њ–≥–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В [12, 21]. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є (–ґ–µ–љ—Б–Ї–Є–є –њ–Њ–ї, —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–µ—А–і—Ж–∞, –±—А–∞–і–Є–Ї–∞—А–і–Є—П, –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М, —Н–ї–µ–Ї—В—А–Њ–ї–Є—В–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П, –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П, –њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В, –њ–µ—З–µ–љ–Њ—З–љ–∞—П –Є–ї–Є –њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М) –Є –Є—Е –∞–і–µ–Ї–≤–∞—В–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –њ–Њ–Ј–≤–Њ–ї—П—В –µ—Й–µ –±–Њ–ї—М—И–µ –њ–Њ–≤—Л—Б–Є—В—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ [22]. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є, —В–Њ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–љ–Њ–≥–Є–Љ–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Њ—В–ї–Є—З–∞–µ—В –љ–∞–Є–Љ–µ–љ—М—И–∞—П —З–∞—Б—В–Њ—В–∞ –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є, –≤ —В. —З. –Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ–Є (вЙ§0,06: 100 000) [23, 24]. –Т —Н—В–Њ–є —Б–≤—П–Ј–Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П–µ–Љ–Њ–µ –Љ–љ–µ–љ–Є–µ –Њ –≥–µ–њ–∞—В–Њ- –Є –Ї–∞—А–і–Є–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ (–∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞) –љ–µ–і–Њ–њ—Г—Б—В–Є–Љ—Л, —В. –Ї. —Н—В–Њ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –Є–Ј–±—Л—В–Њ—З–љ–Њ–Љ—Г –њ–Њ—В—А–µ–±–ї–µ–љ–Є—О –і—А—Г–≥–Є—Е –Ї–ї–∞—Б—Б–Њ–≤ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –Є —А–Њ—Б—В—Г —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ [25].
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –њ—А–µ–њ–∞—А–∞—В—Г –і–Њ—Б—В–Њ–є–љ–Њ–µ –Љ–µ—Б—В–Њ –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е –Т–Я. –°–Њ–≥–ї–∞—Б–љ–Њ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л–Љ –Є –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ, —Г –≤–Ј—А–Њ—Б–ї—Л—Е –±–Њ–ї—М–љ—Л—Е —Б –Т–Я –љ–µ—В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Є –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –±–µ—В–∞-–ї–∞–Ї—В–∞–Љ–љ—Л–Љ–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є [2, 6, 26, 27].
–Я–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞, –њ—А–Є –љ–µ—В—П–ґ–µ–ї–Њ–Љ —В–µ—З–µ–љ–Є–Є –Т–Я —П–≤–ї—П—О—В—Б—П [2, 6, 26]:
вАҐ –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ –љ–∞ ¬Ђ–∞—В–Є–њ–Є—З–љ—Г—О¬ї —Н—В–Є–Њ–ї–Њ–≥–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (Mycoplasma pneumoniae, Chlamydia pneumonia–µ, Legionella spp.);
вАҐ –∞–ї–ї–µ—А–≥–Є—П –љ–∞ ќ≤-–ї–∞–Ї—В–∞–Љ—Л;
вАҐ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Н—Д—Д–µ–Ї—В–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є ќ≤-–ї–∞–Ї—В–∞–Љ–∞–Љ–Є.
–Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –Т–Я, –≤–Ї–ї—О—З–∞—О—Й–∞—П –Љ–∞–Ї—А–Њ–ї–Є–і—Л, –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –њ—А–Є –љ–µ—В—П–ґ–µ–ї–Њ–Љ —В–µ—З–µ–љ–Є–Є –Т–Я —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –Є–ї–Є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 3 –Љ–µ—Б. –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ вЙ•2 –і–љ–µ–є. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–∞–Ї—А–Њ–ї–Є–і—Л –љ–∞—Е–Њ–і—П—В —Г –±–Њ–ї—М–љ—Л—Е —Б –Т–Я, —В—А–µ–±—Г—О—Й–Є—Е –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –Њ—В–і–µ–ї–µ–љ–Є–µ —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є –Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є [6, 26, 27]. –Т —Н—В–Њ–Љ –∞—Б–њ–µ–Ї—В–µ –Љ–∞–Ї—А–Њ–ї–Є–і—Л —Б–ї–µ–і—Г–µ—В —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤–∞ ¬Ђ–њ—А–Є–Ї—А—Л—В–Є—П¬ї –Њ—В –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є, –љ–Њ –Є –Ї–∞–Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї —Б –њ–Њ—В–µ–љ—Ж–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Н—Д—Д–µ–Ї—В–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ [28]. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —В—П–ґ–µ–ї–Њ–є –Т–Я —П–≤–ї—П–µ—В—Б—П —Б–Њ—З–µ—В–∞–љ–Є–µ —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–≤ III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –Є –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤, –њ—А–Є—З–µ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Н—В–Є—Е 2-—Е –Ї–ї–∞—Б—Б–Њ–≤ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—В–∞—А—В–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є. –Ґ–Њ–ї—М–Ї–Њ –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–Њ–Ї—А–∞—Й–∞–µ—В—Б—П –њ—А–µ–±—Л–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є —А–µ–∞–љ–Є–Љ–∞—Ж–Є–Є –Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є [29].
–Т –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ—Ж–µ–љ–µ–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Ж–µ—Д—В—А–Є–∞–Ї—Б–Њ–љ–Њ–Љ –Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ –Є —В–Њ–≥–Њ –ґ–µ —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–∞ III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –Є –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б—В–∞—А—И–µ 65 –ї–µ—В —Б —В—П–ґ–µ–ї–Њ–є –Т–Я (n=603) [30]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –љ–∞ 2,1 –і–љ—П (p<0,01) –Є –ї–µ—В–∞–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –≤ 1,9 —А–∞–Ј–∞ (3,7% –њ—А–Њ—В–Є–≤ 7,3%; —А<0,05) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–Љ –љ–∞–Ј–љ–∞—З–∞–ї—Б—П —Ж–µ—Д—В—А–Є–∞–Ї—Б–Њ–љ –Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –Є –±–Њ–ї—М–љ—Л—Е, –ї–µ—З–Є–≤—И–Є—Е—Б—П —Ж–µ—Д—В—А–Є–∞–Ї—Б–Њ–љ–Њ–Љ –Є –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ [31].
–Ч–љ–∞—З–µ–љ–Є–µ –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б —В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є, –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ–Є –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±–Ј–Њ—А–∞ –Є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞, –≤–Ї–ї—О—З–∞–≤—И–µ–≥–Њ 9850 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 58 –і–Њ 78 –ї–µ—В —Б –Т–Я, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤ –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є [31]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є c –±–µ—В–∞-–ї–∞–Ї—В–∞–Љ–љ—Л–Љ–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є —Б–≤—П–Ј–∞–љ–Њ —Б–Њ –Ј–љ–∞—З–Є–Љ—Л–Љ 18% –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–Љ –Є 3% –∞–±—Б–Њ–ї—О—В–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –і—А—Г–≥–Є–Љ–Є —А–µ–ґ–Є–Љ–∞–Љ–Є –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –љ–µ —Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ–Є –Љ–∞–Ї—А–Њ–ї–Є–і–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (–Њ—В–љ–Њ—И–µ–љ–Є–µ —И–∞–љ—Б–Њ–≤ (–Ю–®) 0,75; 95% –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї (–Ф–Ш) 0,58вАУ0,96; —А=0,02) [31]. C—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П –Њ—Ж–µ–љ–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ—Л—Е —В—П–ґ–µ–ї–Њ–є –Т–Я, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –±–µ—В–∞-–ї–∞–Ї—В–∞–Љ—Л –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ–Є –Є –±–µ—В–∞-–ї–∞–Ї—В–∞–Љ—Л –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ–Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ–Є (–†–§–•), –њ–Њ–Ї–∞–Ј–∞–ї–∞ —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Б—Е–µ–Љ, –≤–Ї–ї—О—З–∞—О—Й–Є—Е –Љ–∞–Ї—А–Њ–ї–Є–і–љ—Л–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є (20% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –ї–µ—З–Є–ї–Є—Б—М –±–µ—В–∞-–ї–∞–Ї—В–∞–Љ–∞–Љ–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ–Є –Є 23% –±–Њ–ї—М–љ—Л—Е –њ–Њ–ї—Г—З–∞–ї–Є –±–µ—В–∞-–ї–∞–Ї—В–∞–Љ—Л –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –†–§–• (–Ю–® 0,83; 95% –Ф–Ш 0,67вАУ1,03; —А=0,09)), —З—В–Њ –і–∞–µ—В –њ—А–∞–≤–Њ –≤—Л–±–Њ—А–∞ –ї–µ—З–∞—Й–µ–Љ—Г –≤—А–∞—З—Г –њ—А–Є –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е —В—П–ґ–µ–ї–Њ–є –Т–Я –Љ–µ–ґ–і—Г –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ–Є (–∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Є–ї–Є –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ) –Є –†–§–•, –љ–∞–Ј–љ–∞—З–∞–µ–Љ—Л–Љ–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–∞–Љ–Є III –њ–Њ–Ї–Њ–ї–µ–љ–Є—П [31].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –Њ–і–љ–Њ –Є–Ј –≤–µ–і—Г—Й–Є—Е –Љ–µ—Б—В –≤ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Т–Я –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–Љ –Љ–∞–Ї—А–Њ–ї–Є–і–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –њ–љ–µ–≤–Љ–Њ–љ–Є–Є.












