Врачебные ошибки могут быть нескольких видов. 1. Диагностические, т.е. связанные с постановкой диагноза. 2. Лечебно–тактические: сюда входят ошибки в выборе методов исследования и в оценке их результатов. 3. Лечебно–технические: это неполное обследование больного и ошибки диагностических или лечебных манипуляций. 4. Организационные: сюда включаются неправильная организация рабочего места и лечебного процесса. 5. Ошибки ведения медицинской документации. 6. Ошибки поведения медицинского персонала.
Практически все виды вышеперечисленных ошибок совершаются врачом на различных этапах курации больных внебольничной пневмонией (ВП) – заболеванием потенциально курабельным, но тем не менее являющимся причиной летального исхода у 5–30% заболевших. По данным ВОЗ, пневмония занимает 4–е место в структуре причин смертности. В США ежегодно регистрируют от 5 до 6 млн случаев этого заболевания у взрослых. По данным официальной статистики по РФ, формирующейся на основании анализа отчетов лечебных учреждений, заболеваемость ВП среди взрослых несколько превышает 400 тыс. случаев, что скорее всего значительно ниже реальной заболеваемости. Согласно расчетным данным, ежегодно в РФ возникает не менее 1,5 млн случаев ВП, хотя вполне вероятно, что это тоже далеко от истинной ситуации.
Основные ошибки ведения пациентов с пневмонией могут быть сведены к следующим:
– диагностика и верификация пневмонии;
– оценка тяжести заболевания;
– выбор антибактериального препарата;
– оценка эффективности назначенного антибактериального препарата;
– коррекция антибактериальной терапии;
– длительность антибактериальной терапии;
– полипрагмазия при лечении больных пневмонией.
Диагностика и верификация пневмонии
Уже при первом контакте с больным врача подстерегают опасности совершения ошибок, связанных с диагностикой пневмонии в качестве основной нозологической формы. По мнению академика РАМН проф. А.Г. Чучалина, «процент врачебных ошибок в России очень высок, более 30%. Так, например, из 1,5 млн заболеваний пневмонией диагностируется не более 500 тыс. Причин тому несколько, в том числе и полное отсутствие в стране системы контроля качества оказания врачебной помощи».
Диагностика ВП основывается на умении врача своевременно выявлять и правильно трактовать ряд признаков, являющихся критериями и составляющих так называемый золотой стандарт диагностики ВП – кашель, лихорадка (свыше 3 суток), клинические признаки легочного инфильтрата, лейкоцитоз, рентгенологические признаки легочного инфильтрата. Поскольку последние два признака не могут быть оценены при первичном осмотре, то, по мнению экспертов Британского торакального общества, для своевременной диагностики ВП может быть достаточно трех других признаков. Несмотря на, казалось бы, однозначность и доступность вышеуказанных диагностических критериев диагностика ВП, прежде всего в системе первичного звена (врач–терапевт), остается в настоящее время несовершенной. Около 30% случаев пневмонии диагностируются поздно или вообще не диагностируются. Причины поздней или ошибочной диагностики ВП можно условно разделить на объективные и субъективные. Так, несвоевременное обращение больного к врачу в силу различных причин может быть одной из причин поздней диагностики. С другой стороны, возможно атипичное течение пневмонии, при котором на первый план выступает внелегочная симптоматика, признаки декомпенсации сопутствующей патологии (сердечная недостаточность, сахарный диабет и др.). Такие ситуации нередко встречаются у лиц пожилого и старческого возраста, а также у больных, страдающих различными хроническими заболеваниями. Однако основным источником ошибок в диагностике ВП является недостаточная компетентность врача, которая сказывается в несовершенстве умения и навыков выявления клинических признаков (перкуторных, аускультативных) легочного инфильтрата, неправильной трактовке выявленных симптомов, затянувшемся обследовании больного. Основными дифференциально–диагностическими проблемами остаются заболевания с синдромно сходной симптоматикой (туберкулез, опухолевые заболевания, пневмониты неинфекционной природы, интерстициальные заболевания легких, ТЭЛА и некоторые другие). Невыполнение рекомендаций, возведенных в ранг стандартов диагностики пневмонии, само по себе считается ошибкой (лечебно–технические ошибки в виде неполного обследования больного по И.В. Давыдовскому). К таким диагностическим стандартам относится рентгенологическое исследование грудной клетки у больных с подозрением на пневмонию до начала лечения. Между тем анализ качества диагностики пневмонии в различных регионах России свидетельствует о том, что данное исследование проводилось лишь у незначительного количества больных до начала антибактериальной терапии (АТ) [1]. К этой же категории ошибок на этапе диагностики заболевания относится отсутствие бактериологического исследования мокроты и крови у госпитализированных больных пневмонией.
Таким образом, врачи не всегда следуют имеющимся клиническим рекомендациям по диагностике пневмонии, что может быть обусловлено недостаточным знакомством или вообще незнанием и игнорированием таковых.
Оценка тяжести ВП и принятие решения о месте лечения больного
Ошибки в определении тяжести ВП не позволяют адекватно оценить прогноз заболевания у больного и обосновать тактику лечения. Прежде всего, тяжесть пневмонии определяет место пребывания пациента с ВП (амбулаторное или стационарное лечение). Более того, в случае необходимости госпитализации степень тяжести заболевания позволяет врачу принять решение о переводе больного в ОРИТ. Общепринятыми показаниями для госпитализации больных ВП являются наличие дыхательной недостаточности, декомпенсация сопутствующей патологии (сердечная недостаточность, сахарный диабет и др.), невозможность обеспечить адекватное лечение и уход в домашних условиях
Тяжесть пневмонии является одним из клинических ориентиров для выбора антибактериального препарата (АП), адекватного данной ситуации. Практически все рекомендации по антибактериальной терапии ВП приводятся с учетом тяжести течения заболевания.
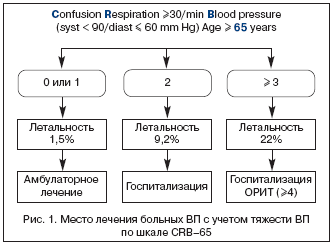
Предложены различные системы–шкалы, позволяющие оценить тяжесть пневмонии (РОRT, PSI, CURB, CURB–65). Некоторые шкалы громоздки, трудны для быстрой оценки и принятия решения. Наиболее практически приемлемой для оценки тяжести ВП можно считать шкалу СURB–65 (Confusion – спутанность, Urea – уровень мочевины в крови, Respiration – число дыханий/мин. – >30/мин., Blood pressure – артериальное давление: систолическое ≤90 мм рт. ст., диастолическое ≤60 мм рт. ст. Age >65 лет), однако она требует определения показателя мочевины в крови, что практически малореально в условиях первичного врачебного звена. С учетом этого можно использовать шкалу CRB–65, позволяющую прогнозировать летальность и, следовательно, определять показания к госпитализации либо в общетерапевтические отделения, либо в ОРИТ (рис. 1).
Антибактериальная терапия внебольничной пневмонии
Пожалуй, на этапе принятия решения о назначении АТ больным пневмонией совершается наибольшее число ошибок, касающихся различных аспектов АТ. К таким ошибкам относятся:
– своевременность начала АТ;
– выбор АП (доза, режим дозирования, путь введения и др.);
– оценка первоначальной эффективности АП;
– необходимость коррекции АТ;
– длительность АТ.
Сроки начала АТ пневмонии являются одним из факторов, влияющих на конечные результаты лечения. Особенно важным является как можно более раннее назначение АП больным пожилого и старческого возраста в связи с более тяжелым течением пневмонии и худшим прогнозом. Показано, что смертность в первые 30 дней среди больных тяжелой пневмонией в возрасте старше 65 лет, у которых АТ была начата в первые 8 ч с момента поступления, была значительно ниже по сравнению с больными, которым антибиотик назначался в более поздние сроки [2]. В другом исследовании отмечено значительное снижение смертности среди больных пневмонией, госпитализированных в отделение интенсивной терапии, у которых АТ начиналась в течение 4 ч с момента поступления по сравнении с более поздним началом лечения [3]
Несвоевременное начало АТ у госпитализированных больных ВП было отмечено при анализе качества ведения больных ВП в некоторых регионах России [1].
Выбор АП. Наиболее важным и ответственным решением, от которого во многом зависит эффективность лечения и исход заболевания, является выбор первоначального АП.
Между тем обращает на себя внимание частое несоответствие стартового АП принятым клиническим рекомендациям, составляющее, по некоторым данным, 22,8%, а также недостаточная суточная доза АП (18,6%) или неадекватный режим дозирования (5,6%) [4]. По данным НИИ АХ СГМУ (2007), у 85% больных тяжелой ВП стартовый АП не соответствовал клиническим рекомендациям, внутривенное введение АП назначалось только в 59% случаев, а у большинства пациентов (68%) АТ проводилась в режиме монотерапии. Несмотря на достаточную осведомленность врачей о препаратах выбора при лечении ВП в реальной амбулаторной практике назначение АП не всегда соответствует современным рекомендациям (высокая частота назначения ципрофлоксацина, цефазолина, парентеральных цефалоспоринов III поколения, «увлечение» макролидами в ущерб b–лактамам). Если для врача основными критериями выбора АП является эффективность и удобный режим приема, то для пациентов это эффективность и возможность перорального приема [1].
Ошибочным следует считать назначение больным ВП следующих АП:
• цефалоспорины I поколения;
• аминогликозиды (гентамицин);
• ранние фторхинолоны (ципрофлоксацин);
• тетрациклины (высокий уровень устойчивости);
• ко–тримоксазол (высокий уровень устойчивости, побочные эффекты);
• ампициллин внутрь (низкая биодоступность);
• ампиокс;
• клиндамицин.
Тем не менее, по данным Л.В. Юдиной [4], цефалоспорины I поколения при лечении ВП назначались 12,4% больным, фторхинолоны II поколения (главным образом ципрофлоксацин) – 17,4%, аминогликозиды – 7,4%, ко–тримоксазол – 6,6%, рифампицин и доксициклин – по 4,1%, линкомицин – 1,7%
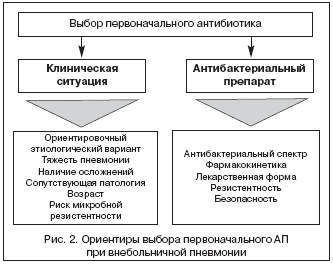
В подавляющем большинстве случаев врач принимает решение о выборе первоначального антибиотика, не имея данных о характере возбудителя пневмонии, а зачастую и перспектив получения таких данных. С учетом этого АТ носит не целенаправленный, а эмпирический характер, в чем должен отдавать себе отчет врач, курирующий больного ВП. В реальной клинической практике выбор первоначального АП для лечения больных ВП должен определяться, с одной стороны, клинической ситуацией, а с другой – свойствами самого АП (рис. 2).
При амбулаторном ведении больных ВП, согласно рекомендациям Российского респираторного общества, следует выделять две группы пациентов:
1–я группа – больные в возрасте до 60 лет без сопутствующей патологии;
2–я группа – больные старше 60 лет с наличием различной сопутствующей патологии (ХОБЛ, сахарный диабет, хроническая алкогольная интоксикация и др.), которая с одной стороны может определять этиологический вариант (риск наличия грамотрицательной флоры) ВП, а с другой – прогноз заболевания. У больных этой группы выше риск антибиотикорезистентности микроорганизмов (пенициллинорезистентность S. pneumoniae, выработка b–лактамаз грамнегативными микроорганизмами).
Больным 1–й группы рекомендовано назначение внутрь амоксициллина или макролидов с оптимальной фармакокинетикой (азитромицин, кларитромицин). Макролиды предпочтительнее при непереносимости β–лактамных антибиотиков или при подозрении на ВП, вызванную атипичными микроорганизмами (микоплазма, хламидия). В качестве альтернативных АП у этой группы больных возможно назначение внутрь респираторных фторхинолонов (Таваник, моксифлоксацин, гемифлоксацин). Несмотря на неактивность аминопенициллинов в отношении атипичных возбудителей, клинические исследования не выявили различия в эффективности между аминопенициллинами, различными макролидами и респираторными фторхинолонами [5].
Больным 2–й группы также рекомендуется АТ внутрь с использованием защищенных пенициллинов (амоксициллин/клавуланат, амоксициллин/сульбактам), комбинация защищенных пенициллинов с макролидами или респираторные фторхинолоны в режиме монотерапии. Преимущество парентерального введения АП в амбулаторном лечении ВП не доказано.
Госпитализированным больным с более тяжелым течением заболевания следует назначать АП парентерально. Общепринято применение β–лактамов (амоксициллин, защищенные пенициллины, цефалоспорины II–III поколений) в сочетании с макролидами (азитромицин, кларитромицин). Летальность при внебольничных пневмониях, особенно среди больных пожилого возраста, ниже при назначении комбинированной терапии цефалоспоринами II–III поколения в сочетании с макролидами по сравнению с монотерапией цефалоспоринами III поколения. Доказано, что комбинированная АТ β–лактамами и макролидами улучшает прогноз больных ВП, сокращает сроки пребывания в стационаре, что делает оправданной подобную комбинацию [6]. Альтернативными АП могут быть респираторные фторхинолоны (левофлоксацин – Таваник, моксифлоксацин). Имеются данные о том, что Таваник в режиме монотерапии оказывает клинический и бактериологический эффект, сравнимый с комбинацией β–лактамов и макролидов [7–9].
В одном из последних метаанализов сравнивалась эффективность комбинированной АТ β–лактамами и макролидами с респираторными фторхинолонами (Таваник) в режиме монотерапии [10]. Анализу были подвергнуты результаты 23 рандомизированных контролируемых исследований, включивших 7885 больных. По результатам проведенного метаанализа было установлена более высокая клиническая эффективность респираторных фторхинолонов по сравнению с комбинированной АТ больных тяжелой ВП. В то же время при лечении пациентов с нетяжелой пневмонией респираторные фторхинолоны не имели преимуществ перед комбинированной АТ. Если у госпитализированных больных (тяжелая ВП) при приеме респираторных фторхинолонов внутрь не отмечено различий между двумя исследуемыми группами, то при внутривенном введении респираторные фторхинолоны оказывали более выраженный клинический и бактериологический эффект по сравнению с комбинацией β–лактамов и макролидов. Кроме того, по результатам метаанализа, побочные эффекты, особенно со стороны желудочно–кишечного тракта, регистрировались достоверно реже. Следует отметить, что в большинстве исследований, включенных в метаанализ, левофлоксацин (Таваник) применялся в суточной дозе 500 мг.
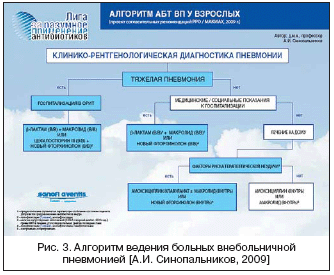
На рисунке 3 представлен алгоритм АТ больных ВП в соответствии с последними рекомендациями Российского респираторного общества и МАКМАХ.
Дозирование АП. Нередко встречаются ошибки в выборе дозы назначенного АП без учета тяжести пневмонии. В недостаточной суточной дозе АП назначался у 18,6% больных ВП [11].
Стандартные дозы β–лактамов и других АП у больных тяжелой ВП могут оказаться недостаточно эффективными. Наличие признаков сепсиса и септического шока при тяжелой ВП требует назначения более высоких доз β–лактамов (амоксициллин/клавуланат 1,2–2,4 г 2–3 раза/сут.; цефотаксим 2–3 г 2–3 раза/сут.) или Таваника (500 мг/сут.). При тяжелой ВП дозирование АП имеет свои особенности в отношении как суточных доз, так и кратности введения. Предпочтительным путем введения АП у данной категории пациентов является внутривенное введение.
Путь введения АП определяется многими факторами, в том числе тяжестью пневмонии, состоянием больного, фармакокинетической характеристикой АП и др. Если в целом ряде ситуаций при инфекциях нижних дыхательных путей парентеральный путь введения не имеет альтернативы (нарушение сознания, стволовые расстройства с нарушением глотания, патология кишечника и др.), то в остальных случаях парентеральная АТ требует определенных показаний и должна быть обоснованной, а не произвольной. При достижении клинического эффекта от парентеральной АТ рекомендуется переход на оральную форму того же или сходного по антимикробному спектру другого антибиотика (ступенчатая терапия). Критериями для перехода с парентерального на оральный путь введения антибиотиков следует считать нормальные показатели температуры на протяжении 2–кратного измерения за последние 16 ч, нормальное количество лейкоцитов или тенденция к нормализации, субъективное улучшение (уменьшение кашля, одышки), стабилизация показателей дыхания и гемодинамики, отсутствие признаков нарушения всасывания [12]. Оптимальными сроками перехода с парентеральной на оральную терапию являются 48–72 ч. Для обеспечения комплайентности следует отдавать предпочтение антибиотикам с высокой биодоступностью и удобным режимом дозирования (1–2 раза/сут.). Таким требованиям отвечают современные респираторные фторхинолоны (Таваник, моксифлоксацин).
В то же время ошибочным является назначение АП внутрь с целью «облегчить и упростить» лечение как для больного, так и для среднего медперсонала без учета конкретной клинической ситуации и фармакокинетики АП. У больных с тяжелой пневмонией это может стать одной из причин недостаточного эффекта или вообще неэффективности лечения. Не следует назначать АП внутрь при тяжелых пневмониях, особенно препараты с низкой биодоступностью (ампициллин, цефуроксим аксетил), что не позволяет достигать оптимальной концентрации АП в крови. В то же время у больных нетяжелой ВП при отсутствии осложнений и фоновой патологии допустима оральная АТ. В подобных ситуациях парентеральный путь введения АП оказывается не только необоснованным, но и более дорогостоящим.
Оценка эффективности первоначального АП. При амбулаторном ведении больного ВП обязательной является оценка эффективности и переносимости назначенного АП (правило второго визита) через 48–72 ч. АТ внебольничной пневмонии следует считать неэффективной, если отсутствуют признаки клинической стабилизации, которыми считаются:
– температура – < 37,8 °С
– ЧСС <100 уд./ мин.
– систолическое АД >90 мм рт. ст.
– ЧД < 24 /мин.
– Sa02 > 90%
При анализе ведения больных ВП приходится нередко сталкиваться с такими ошибками, когда больной продолжает получать назначенный АП в течение недели и более, несмотря на отсутствие очевидного клинического эффекта. Необоснованно длительная АТ при отсутствии эффекта и необходимость смены АП наблюдалась у 20,6% [11]. Ошибочность подобной практики имеет немало негативных последствий. Во–первых, затягивается назначение другого, более адекватного АП, что способствует прогрессированию легочного воспаления (особенно важно при тяжелых пневмониях, у больных с сопутствующей патологией), развитию осложнений, удлинению сроков лечения. Кроме того, повышается риск возникновения побочных (токсических) эффектов АТ, развития антибиотикорезистентности. Не следует игнорировать и значение негативного влияния неэффективности проводимой терапии на больного и его родственников, влекущего за собой утрату доверия к врачу и потерю комплайенса. Очевидна и неэкономичность такой ошибочной тактики АТ (напрасный расход неэффективного АП, задержка пребывания больного в стационаре, дополнительные затраты на лечение токсических эффектов и др.).
При отсутствии эффекта в указанные сроки следует пересмотреть тактику АТ (замена амоксициллина на Таваник или добавление последнего к β–лактамному АП) или решить вопрос о госпитализации пациента.
Коррекция АТ. Наряду с серией ошибок при оценке эффективности АП встречаются ошибки при коррекции АТ, т.е. смене одного АП на другой. При отсутствии данных микробиологического исследования принцип выбора АП остается тем же самым, т.е. ориентировка на клиническую ситуацию с учетом, однако, неэффективности первоначального АП и других дополнительных признаков. Отсутствие эффекта от первоначального АП в известной степени должно быть дополнительным ориентиром, позволяющим обосновать выбор второго АП. Так, отсутствие эффекта от β–лактамных АП (пенициллины, цефалоспорины) у больного ВП позволяет предполагать или делает более вероятным предположение о легионелезной или микоплазменной пневмонии (с учетом, разумеется, других признаков). В свою очередь, это делает обоснованным назначение АП из группы макролидов (азитромицин, кларитромицин и др.) или респираторных фторхинолонов (Таваник, моксифлоксацин).
Во избежание ошибок при коррекции АТ следует иметь в виду возможные причины неэффективности АП, к которым относятся:
– неправильный диагноз (туберкулез, опухоль, отек легких и др.);
– наличие осложнений (легочные, внелегочные);
– тяжелая сопутствующая и фоновая патология;
– неадекватный первоначальный АП;
– неадекватный режим дозирования АП;
– антибиотикорезистентность;
– поздно начатая АТ.
Длительность АТ. По различным данным, необоснованно длительная антибиотикотерапия проводится у 11,5% [11]. Согласно рекомендациям IDSA/ATS (2007), больной ВП должен лечиться как минимум в течение 5 дней (уровень доказательности I), лихорадка должна стойко отсутствовать в течение 48–72 ч, при этом не должно быть более 1 признака клинической нестабильности (уровень доказательности II). При высокой вероятности «атипичной» пневмонии рекомендуется более продолжительная АТ, до 14 дней, хотя имеются данные об эффективности и более коротких курсов в подобных клинико–эпидемиологических ситуациях. Наличие таких признаков, как астения, субфебрилитет, неполное рентгенологическое разрешение пневмонии, отсутствие полного рентгенологического разрешения пневмонии и нормализации показателей СОЭ не должны являться показанием для продолжения АТ и тем более для назначения другого АП.
Полипрагмазия. Среди большинства врачей укоренилось ошибочное мнение о необходимости назначения больным ВП наряду с АП различных лекарственных средств (антигистаминные, иммуномодуляторы, витамины, НПВП, противогрибковые препараты и др.). Подобная полипрагмазия не имеет достаточной доказательной основы, а только лишь удорожает лечение и повышает риск побочных эффектов лекарственного лечения.
Так, например, одной из распространенных ошибок при проведении АТ пневмонии является назначение одновременно с АП противогрибковых средств с целью как профилактики грибковых осложнений, так и «лечения» кандидоза в случаях обнаружения в полости рта грибков из рода Сandida. Обычно назначается нистатин внутрь, что трудно объяснимо с позиций его фармакокинетики: этот АП обладает весьма низкой биодоступностью и практически не всасывается из ЖКТ. Действие нистатина в основном местное. Кроме того, врач при назначении нистатина ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза и факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.). В свое время Б.Е. Вотчал писал: «…кандидамикоз – это не грибки, а болезнь, т.е. должны быть не только грибки в мазке, но и симптомы кандидамикоза».
Учет различных клинических ситуаций. В повседневной клинической практике при назначении любого медикаментозного средства, в том числе и АП, приходиться учитывать многочисленные факторы конкретной клинической ситуации (возраст, сопутствующая патология, прием других медикаментов и т.д.), определяющей тактику АТ и ее особенности. Недоучет всех факторов и неадекватная оценка особенностей данной ситуации влечет за собой ошибки в АТ, наиболее часто встречающиеся при следующих ситуациях:
• возраст больных (дети, старики);
• беременность;
• тяжелая сопутствующая патология с функциональными нарушениями различных органов и систем;
• медикаментозная терапия сопутствующих заболеваний;
• аллергические реакции на различные АП.
Ошибочно назначение беременным фторхинолонов, клиндамицина, метронидазола для лечения пневмонии. Кроме того, с осторожностью должны назначаться аминогликозиды, ванкомицин, имипенем.
Наличие сопутствующей патологии в ряде случаев создает сложности в проведении АТ, что может приводить и к ошибкам в выборе АП, его дозировки, путях введения, длительности АТ и т.д. При этом в основе ошибок может лежать либо невыявление сопутствующей патологии, либо ее недооценка в отношении токсического влияния АП, либо, наконец, недостаточное знание фармакокинетических особенностей выбранного АП. При наличии у больного почечной недостаточности следует отдавать предпочтение выбору АП с преимущественно внепочечным выведением (цефоперазон) или с двойным путем элиминации (ципрофлоксацин). Ошибочно назначение потенциально нефротоксичных АП (аминогликозиты, карбапенемы) без корректировки дозы у больных с сопутствующей почечной недостаточностью. Опасно также в подобных ситуациях сочетание АП, обладающих нефротоксическими свойствами (аминогликозиды и цефалоспорины, за исключением цефоперазона).
Особенно следует учитывать наличие сопутствующей, нередко множественной патологии с функциональными нарушениями органов и систем у больных пожилого и старческого возраста. Возрастное снижение показателей клубочковой фильтрации наряду с высокой частотой нефроангиосклероза у пожилых должны быть одним из факторов, влияющих на выбор АП, что, к сожалению, не всегда учитывается в клинической практике.
При наличии достоверно установленной гиперчувствительности к пенициллину ошибочно назначение других b–лактамных АП (цефалоспорины, карбаменемы). Альтернативными АП могут быть фторхинолоны, макролиды. Однако следует иметь в виду, что нередко за «аллергию на антибиотики» принимаются реакции другого происхождения (сосудистые, вегетативные и др.), в связи с чем следует критически оценивать указания больных на такую «непереносимость» и более тщательно анализировать имеющуюся ситуацию. Вместе с тем опасны внутрикожные пробы на АП, поскольку существует такая же опасность тяжелых анафилактических реакций.
По данным исследования С.А. Рачиной и соавт. [1] об индикаторах качества ведения больных ВП, основные ошибки ведения госпитализированных больных ВП сводятся к следующим:
• рентгенологическое исследование позже 24 ч с момента поступления;
• отсутствие бактериологического исследования мокроты и крови (при тяжелых ВП) до назначения АП;
• задержка начала АТ более 8 ч с момента верификации диагноза;
• несоответствие режима АТ национальным рекомендациям;
• недостаточное использование режима ступенчатой терапии;
• отсутствие профилактики у пациентов из группы риска.
Современная ситуация, свидетельствующая об ошибках диагностики и ведения больных ВП, обусловлена многими причинами, и прежде всего недостаточным следованием клиническим рекомендациям (КР). Основными барьерами на пути внедрения КР по ведению больных ВП в практику врача–терапевта являются следующие [13]:
• недостаточная осведомленность врачей о существовании КР;
• недостаточное знакомство и знания КР;
• консервативность клинического менталитета врача;
• отсутствие у врачей мотивации;
• невозможность контроля преимущества следования КР в лечении больных ВП;
• неуверенность в улучшении исходов ВП в случаях следования КР.
В то же время следование КР способствуют повышению эффективности лечения и благоприятному исходу заболевания, а также уменьшают риск принятия ошибочных решений при ведении больных ВП. Имеются доказательные данные о том, что, если врач следует клиническим рекомендациям, доля неэффективной терапии уменьшается на 35–40%, а вероятность летального исхода – на 45% [14]. Таким образом, основными реальными путями, которые позволят избежать или по крайней мере минимизировать ошибки ведения больных ВП является строгое следование КР. С учетом этого первоочередной задачей органов здравоохранения и постдипломного обучения следует считать внедрение КР в практику врачей первичного звена здравоохранения, и прежде всего врачей–терапевтов [15].