–Ъ–Є—И–µ—З–љ—Л–µ, –Ї–Њ–ґ–љ—Л–µ, –Ї–∞—А–і–Є–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ, –Љ–Њ—З–µ–њ–Њ–ї–Њ–≤—Л–µ –Є –і—А—Г–≥–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–Є—З–Є–љ–љ–Њ-—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ —Б–≤—П–Ј–∞–љ—Л —Б –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –Љ–µ—Б—В–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –Ї–Є—И–µ—З–љ–Њ–є –Ї–∞–Ї –і–µ–њ–Њ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –≤ —В–µ–ї–µ —З–µ–ї–Њ–≤–µ–Ї–∞ [21].
–Ъ–Њ–љ—Ж–µ–њ—Ж–Є—П –Љ–Њ–љ–Њ—Н—В–Є–Њ–ї–Њ–≥–Є—З–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П, –і–µ–ї–µ–љ–Є–µ –Љ–Є–Ї—А–Њ–±–Њ–≤ –љ–∞ –њ–∞—В–Њ–≥–µ–љ–љ—Л–µ –Є –љ–µ–њ–∞—В–Њ–≥–µ–љ–љ—Л–µ –і–Њ–ї–ґ–љ—Л –±—Л—В—М –њ–µ—А–µ—Б–Љ–Њ—В—А–µ–љ—Л –≤ —Б–≤–µ—В–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Т—Б–µ –Љ–Є–Ї—А–Њ–±—Л, –Њ–±–Є—В–∞—О—Й–Є–µ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ—А–µ–±—Л–≤–∞—О—В –≤ —Н—В–Є—Е –і–≤—Г—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е.
–Ы—О–±–Њ–є –Є–Ј –љ–Є—Е –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Є—З–Є–љ–Њ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤. –Ф–Њ–ї–ґ–љ–∞ –±—Л—В—М –њ–µ—А–µ—Б–Љ–Њ—В—А–µ–љ–∞ –Є –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є. –Х–µ —Д—Г–љ–і–∞–Љ–µ–љ—В – –Љ–Є–Ї—А–Њ–±–љ–∞—П –Љ–Њ–љ–Њ—Н—В–Є–Њ–ї–Њ–≥–Є—З–љ–Њ—Б—В—М –Є —А–µ–Ј–Є—Б—В–µ–љ—В–Њ—Б—В—М —И—В–∞–Љ–Љ–Њ–≤ –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ –≤ –Љ–Њ–љ–Њ–Ї—Г–ї—М—В—Г—А–µ in vitro – –љ–µ –∞–і–µ–Ї–≤–∞—В–љ—Л —Д–Њ—А–Љ–µ —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є—П –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ —Б–Њ–Њ–±—Й–µ—Б—В–≤–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ –≤ –љ–Њ—А–Љ–µ –Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є [18].
–Ь–Є–Ї—А–Њ—Д–ї–Њ—А–∞ –≥–ї–Њ—В–Ї–Є –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ–∞ –Є –≤–∞—А–Є–∞–±–µ–ї—М–љ–∞, –≤ –љ–Њ—А–Љ–µ —Б—Е–Њ–і–љ–∞ —Б –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–Њ–є –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–≥–Њ —В—А–∞–Ї—В–Њ–≤. –Т –µ–µ —Б–Њ—Б—В–∞–≤–µ —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї—О–і–µ–є –њ–Њ—Б—В–Њ—П–љ–љ–Њ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В β-–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–µ –Є –љ–µ–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–µ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є, –Љ–Є–Ї—А–Њ–Ї–Њ–Ї–Ї–Є, —Н–њ–Є–і–µ—А–Љ–∞–ї—М–љ—Л–є —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї, –љ–µ–є—Б—Б–µ—А–Є–Є, –і–Є—Д—В–µ—А–Њ–Є–і—Л, –њ—Б–µ–≤–і–Њ–і–Є—Д—В–µ—А–Є–є–љ—Л–µ –±–∞–Ї—В–µ—А–Є–Є, –≤–µ–є–ї–Њ–љ–µ–ї–ї—Л, –±–∞–Ї—В–µ—А–Њ–Є–і—Л, –∞–Ї—В–Є–љ–Њ–Љ–Є—Ж–µ—В—Л, —Б–∞–њ—А–Њ—Д–Є—В–Є—З–µ—Б–Ї–Є–µ —В—А–µ–њ–Њ–љ–µ–Љ—Л, –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ—Л. –Ъ —Д–∞–Ї—Г–ї—М—В–∞—В–Є–≤–љ—Л–Љ –Њ–±–Є—В–∞—В–µ–ї—П–Љ –≥–ї–Њ—В–Ї–Є –Њ—В–љ–Њ—Б—П—В –Ј–Њ–ї–Њ—В–Є—Б—В—Л–є —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї, β-–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–є —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї, –Ї–ї–µ–±—Б–Є–µ–ї–ї—Г –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –Є –і—А—Г–≥–Є–µ —Н–љ—В–µ—А–Њ–±–∞–Ї—В–µ—А–Є–Є, –Ї–∞–љ–і–Є–і—Л, –љ–Њ–Ї–∞—А–і–Є–Є, –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–Њ—Д–Є–ї—М–љ—Г—О –њ–∞–ї–Њ—З–Ї—Г [7]. –Я–Њ—Б—В–Њ—П–љ–љ—Л–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л –Њ—В–љ–Њ—Б—П—В—Б—П –Ї –Ї–Њ–Љ–Љ–µ–љ—Б–∞–ї–∞–Љ, –Є—Е —Б–њ–µ–Ї—В—А —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї—Б—П –±–ї–∞–≥–Њ–і–∞—А—П —Н–≤–Њ–ї—О—Ж–Є–Њ–љ–љ–Њ —Б–ї–Њ–ґ–Є–≤—И–Є–Љ—Б—П –Њ—В–љ–Њ—И–µ–љ–Є—П–Љ —Б–Є–Љ–±–Є–Њ–Ј–∞ –Є –∞–љ—В–∞–≥–Њ–љ–Є–Ј–Љ–∞ –Љ–µ–ґ–і—Г —Б–∞–Љ–Є–Љ–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ–Є –Є –Є—Е –≤–Ј–∞–Є–Љ–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П–Љ–Є —Б –Љ–∞–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–Љ.
–Т –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ –љ–∞—Е–Њ–і–Є—В—Б—П –±–Њ–ї—М—И–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Є–і–Њ–≤ –±–∞–Ї—В–µ—А–Є–є, —З–µ–Љ –≤ –Њ—Б—В–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–∞—Е –Ц–Ъ–Ґ, –Є —Н—В–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ, –њ–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–љ—Л—Е –∞–≤—В–Њ—А–Њ–≤, —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В 160 –і–Њ 300 –≤–Є–і–Њ–≤. –≠—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —В–µ–Љ, —З—В–Њ –±–∞–Ї—В–µ—А–Є–Є –њ–Њ–њ–∞–і–∞—О—В –≤ –њ–Њ–ї–Њ—Б—В—М —А—В–∞ —Б –≤–Њ–Ј–і—Г—Е–Њ–Љ, –≤–Њ–і–Њ–є, –њ–Є—Й–µ–є (—В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ —В—А–∞–љ–Ј–Є—В–љ—Л–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л, –≤—А–µ–Љ—П –њ—А–µ–±—Л–≤–∞–љ–Є—П –Ї–Њ—В–Њ—А—Л—Е —В–∞–Љ –Њ–≥—А–∞–љ–Є—З–µ–љ–Њ). –Ч–і–µ—Б—М —А–µ—З—М –Є–і–µ—В –Њ —А–µ–Ј–Є–і–µ–љ—В–љ–Њ–є (–њ–Њ—Б—В–Њ—П–љ–љ–Њ–є) –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–µ, –Њ–±—А–∞–Ј—Г—О—Й–µ–є –і–Њ–≤–Њ–ї—М–љ–Њ —Б–ї–Њ–ґ–љ—Г—О –Є —Б—В–∞–±–Є–ї—М–љ—Г—О —Н–Ї–Њ—Б–Є—Б—В–µ–Љ—Г –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ –Є –≥–ї–Њ—В–Ї–Є. –Ґ–∞–Ї–Њ–≤—Л–Љ–Є —П–≤–ї—П—О—В—Б—П –њ–Њ—З—В–Є 30 –Љ–Є–Ї—А–Њ–±–љ—Л—Е –≤–Є–і–Њ–≤. –†–Њ–ї—М –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –і–∞–ї–µ–Ї–Њ –љ–µ –Њ–і–љ–Њ–Ј–љ–∞—З–љ–∞: —Б –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Њ–љ–Є —Г—З–∞—Б—В–≤—Г—О—В –≤ –њ–µ—А–µ–≤–∞—А–Є–≤–∞–љ–Є–Є –њ–Є—Й–Є, –Њ–Ї–∞–Ј—Л–≤–∞—О—В –±–Њ–ї—М—И–Њ–µ –њ–Њ–Ј–Є—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Є–Љ–Љ—Г–љ–љ—Г—О —Б–Є—Б—В–µ–Љ—Г, –±—Г–і—Г—З–Є –Љ–Њ—Й–љ—Л–Љ–Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–∞–Љ–Є –њ–∞—В–Њ–≥–µ–љ–љ–Њ–є —Д–ї–Њ—А—Л; —Б –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Њ–љ–Є —П–≤–ї—П—О—В—Б—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є –Є –≥–ї–∞–≤–љ—Л–Љ–Є –≤–Є–љ–Њ–≤–љ–Є–Ї–∞–Љ–Є –Њ—Б–љ–Њ–≤–љ—Л—Е —Б—В–Њ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Т —А–∞–Ј–≤–Є—В–Є–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≥–ї–Њ—В–Ї–Є –Є –љ–µ–±–љ—Л—Е –Љ–Є–љ–і–∞–ї–Є–љ –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –Є–≥—А–∞—О—В –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л, –≤–µ–≥–µ—В–Є—А—Г—О—Й–Є–µ –љ–∞ —Б–ї–Є–Ј–Є—Б—В—Л—Е —А–Њ—В–Њ–≤–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Є –≥–ї–Њ—В–Ї–Є: –∞—Н—А–Њ–±–љ—Л–µ, –∞ —В–∞–Ї–ґ–µ —Д–∞–Ї—Г–ї—М—В–∞—В–Є–≤–љ—Л–µ –Є –Њ–±–ї–Є–≥–∞—В–љ—Л–µ –∞–љ–∞—Н—А–Њ–±–љ—Л–µ (–≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –Є –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ). –Ч–љ–∞—З–µ–љ–Є–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –≤ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —В–Њ–љ–Ј–Є–ї–ї–Њ-—Д–∞—А–Є–љ–≥–µ–∞–ї—М–љ–Њ–є –Ј–Њ–љ—Л –Њ—З–µ–љ—М –≤–µ–ї–Є–Ї–Њ. –Ъ–ї—О—З–µ–≤—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є –≤ —А–∞–Ј–≤–Є—В–Є–Є –≥–љ–Њ–є–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П —П–≤–ї—П—О—В—Б—П –љ–∞—А—Г—И–µ–љ–Є–µ —Б–Є–Љ–±–Є–Њ–Ј–∞ –Љ–µ–ґ–і—Г –Љ–∞–Ї—А–Њ- –Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ–Є, –њ—А–Є–Њ–±—А–µ—В–µ–љ–Є–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ–Є –њ–∞—В–Њ–≥–µ–љ–љ—Л—Е —Б–≤–Њ–є—Б—В–≤. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ —З–Є—Б–ї–∞ –Љ–Є–Ї—А–Њ–±–љ—Л—Е —В–µ–ї, –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ –Є—Е –Є–љ–≤–∞–Ј–Є–≤–љ–Њ—Б—В–Є, –≤—Л—А–∞–±–Њ—В–Ї–∞ —Н–Ї–Ј–Њ- –Є —Н–љ–і–Њ—Д–µ—А–Љ–µ–љ—В–Њ–≤, –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—З–∞–≥–∞ –Є –µ–≥–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—О [3, 6].
–Т—Б–ї–µ–і—Б—В–≤–Є–µ —В–∞–Ї–Њ–≥–Њ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–Є—П –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –≤–Њ–Ј–љ–Є–Ї–∞—О—В –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –і–ї—П –њ–µ—А–µ–і–∞—З–Є –і–µ—В–µ—А–Љ–Є–љ–∞–љ—В —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, –Є –≤ –Ї–∞—З–µ—Б—В–≤–µ —А–µ–Ј–µ—А–≤—Г–∞—А–∞ –±—Г–і–µ—В –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –≤—Л—Б—В—Г–њ–∞—В—М –љ–Њ—А–Љ–∞–ї—М–љ–∞—П –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–∞ —З–µ–ї–Њ–≤–µ–Ї–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Љ–µ–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Њ–±–Љ–µ–љ–∞ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–µ–є –Љ–µ–ґ–і—Г –±–∞–Ї—В–µ—А–Є—П–Љ–Є –Є–Ј –Љ–Њ—З–µ–њ–Њ–ї–Њ–≤—Л—Е –њ—Г—В–µ–є –Є –њ–Њ–ї–Њ—Б—В–Є —А—В–∞. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї–∞–Ї —Б–Є—Б—В–µ–Љ–љ—Л—Е, —В–∞–Ї –Є —В–Њ–њ–Є—З–µ—Б–Ї–Є—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –≤ —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Њ–љ–Є –љ–µ –њ–Њ–Ї–∞–Ј–∞–љ—Л, –≤–љ–Њ—Б–Є—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–є –≤–Ї–ї–∞–і –≤ —Н—В–Њ—В –њ—А–Њ—Ж–µ—Б—Б –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—О –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ [7, 21].
–Ч–∞—З–∞—Б—В—Г—О, –њ–µ—А–µ—Б—В—А–∞—Е–Њ–≤—Л–≤–∞—П—Б—М, –≤—А–∞—З–Є –љ–∞–Ј–љ–∞—З–∞—О—В –њ—А–Є –њ—А–Њ—Б—В—Г–і–µ –Є –≥—А–Є–њ–њ–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ –±–µ—Б–њ–Њ–ї–µ–Ј–љ—Л –і–ї—П –ї–µ—З–µ–љ–Є—П –≤–Є—А—Г—Б–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞—Е –Є—Е –љ–∞–Ј–љ–∞—З–∞–ї–Є 1/3 —З–∞—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –≤ 64% –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –ї–Є–±–Њ –±—Л–ї–Њ –љ–µ –љ—Г–ґ–љ–Њ, –ї–Є–±–Њ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Є –і–Њ–Ј–Є—А–Њ–≤–Ї–Є [15]. –Р–љ—В–Є–±–Є–Њ—В–Є–Ї–Є —Г–±–Є–≤–∞—О—В –Ї–∞–Ї –њ–ї–Њ—Е–Є–µ, —В–∞–Ї –Є —Е–Њ—А–Њ—И–Є–µ –±–∞–Ї—В–µ—А–Є–Є, –њ–Њ–Ј–≤–Њ–ї—П—П –њ—А–Є —Н—В–Њ–Љ —А–∞–Ј–Љ–љ–Њ–ґ–∞—В—М—Б—П –і—А—Г–≥–Є–Љ –њ–ї–Њ—Е–Є–Љ –±–∞–Ї—В–µ—А–Є—П–Љ, —Г—Б—В–Њ–є—З–Є–≤—Л–Љ –Ї –Є—Е –і–µ–є—Б—В–≤–Є—О.
–°–Њ–≥–ї–∞—Б–љ–Њ –Њ–њ—А–Њ—Б–∞–Љ, 95% –≤—А–∞—З–µ–є –љ–∞–Ј–љ–∞—З–∞—О—В –і–µ—В—П–Љ —Б –њ—А–Њ—Б—В—Г–і–Њ–є –Њ–і–љ–Њ –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–µ–Ї–∞—А—Б—В–≤, –Є –Њ–Ї–Њ–ї–Њ 60% —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ – –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є. –І–∞—Б—В–Њ—В–∞ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–∞. –Ю–і–љ–Њ –Є–Ј –Њ—Д–Є—Ж–Є–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ 4% –і–µ—В–µ–є, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ, –Є 29% –і–µ—В–µ–є, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ, —Б—В—А–∞–і–∞–ї–Є –Њ—В –њ–Њ–љ–Њ—Б–∞, —А–≤–Њ—В—Л –Є —Б—Л–њ–Є. –≠—В–Є —Н—Д—Д–µ–Ї—В—Л –љ–µ –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —Б–µ—А—М–µ–Ј–љ—Л–Љ, –љ–Њ –≤ —Б—А–µ–і–љ–µ–Љ —Г 2% –і–µ—В–µ–є, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є, —А–∞–Ј–≤–Є–≤–∞–ї–Є—Б—М —В—П–ґ–µ–ї—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є [11].
–Э–µ—А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —З—А–µ–≤–∞—В–Њ —Г–≥—А–Њ–ґ–∞—О—Й–Є–Љ–Є –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П–Љ–Є: 1) –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –≤ –Њ–±—Й–µ—Б—В–≤–µ –љ–Њ–≤—Л—Е –≤–Є–і–Њ–≤ —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ –±–∞–Ї—В–µ—А–Є–є; 2) –њ–∞—Ж–Є–µ–љ—В, –і–ї–Є—В–µ–ї—М–љ–Њ –Є –±–µ—Б—Б–Є—Б—В–µ–Љ–љ–Њ —Г–њ–Њ—В—А–µ–±–ї—П—О—Й–Є–є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є, –≤–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –ґ–µ—А—В–≤–Њ–є –±–∞–Ї—В–µ—А–Є–є, —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї –ї—О–±—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–∞–Љ.
–Х—Б–ї–Є –Љ—Л –љ–µ –љ–∞—З–љ–µ–Љ –Њ—Б—В–Њ—А–Њ–ґ–љ–µ–µ –Њ—В–љ–Њ—Б–Є—В—М—Б—П –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї–љ–Є—В—М—Б—П –њ—А–Њ—А–Њ—З–µ—Б—В–≤–Њ —Г—З–µ–љ–Њ–≥–Њ-—Е–Є–Љ–Є–Ї–∞, –ї–∞—Г—А–µ–∞—В–∞ –Э–Њ–±–µ–ї–µ–≤—Б–Ї–Њ–є –њ—А–µ–Љ–Є–Є, –њ—А–Њ—Д–µ—Б—Б–Њ—А–∞ –Є–Ј –У–∞—А–≤–∞—А–і–∞ –£–Њ–ї—В–µ—А–∞ –У–Є–ї–±–µ—А—В–∞: «–Ь–Њ–ґ–µ—В –љ–∞—Б—В–∞—В—М –≤—А–µ–Љ—П, –Ї–Њ–≥–і–∞ 80% –Є–љ—Д–µ–Ї—Ж–Є–є –±—Г–і—Г—В —Г—Б—В–Њ–є—З–Є–≤—Л –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ».
–Ч–ї–Њ—Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –љ–µ —В–Њ–ї—М–Ї–Њ –Ї –љ–∞—А—Г—И–µ–љ–Є—О –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–є —Д–ї–Њ—А—Л –Ї–Є—И–µ—З–љ–Є–Ї–∞, –љ–Њ –Є –Ї –±–Њ–ї–µ–µ —Б–µ—А—М–µ–Ј–љ—Л–Љ –њ—А–Њ–±–ї–µ–Љ–∞–Љ. –Э–µ–і–∞–≤–љ–Њ —Г—З–µ–љ—Л–µ –Є–Ј –Ъ–∞–љ–∞–і—Л –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –±–Њ–ї—М—И–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –њ—А–Њ—В–Є–≤–Њ–Љ–Є–Ї—А–Њ–±–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ї–Є—И–µ—З–љ–Є–Ї–∞, –≤–Ї–ї—О—З–∞—П –≤ —В.—З. —П–Ј–≤–µ–љ–љ—Л–є –Ї–Њ–ї–Є—В –Є –±–Њ–ї–µ–Ј–љ—М –Ъ—А–Њ–љ–∞. «–Ф–µ–ї–Њ –≤ —В–Њ–Љ, —З—В–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є —Б–∞–Љ–Є –њ–Њ —Б–µ–±–µ –љ–µ –≤—Л–Ј—Л–≤–∞—О—В –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Ї–Є—И–µ—З–љ–Є–Ї–∞, —В–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –љ–∞—А—Г—И–µ–љ–Є—П —Д–ї–Њ—А—Л –Љ–Њ–≥—Г—В –±—Л—В—М –≤–µ—Б—М–Љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ–Є», – —В–∞–Ї –Њ–±—К—П—Б–љ—П—О—В –∞–≤—В–Њ—А—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–Ј —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ –Ь–∞–љ–Є—В–Њ–±—Л, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є, —З—В–Њ 12% –ї—О–і–µ–є, –Ї–Њ—В–Њ—А—Л–Љ —Б—В–∞–≤—П—В –і–Є–∞–≥–љ–Њ–Ј «—П–Ј–≤–µ–љ–љ—Л–є –Ї–Њ–ї–Є—В» –Є–ї–Є «–±–Њ–ї–µ–Ј–љ—М –Ъ—А–Њ–љ–∞», –њ—А–Є–љ–Є–Љ–∞–ї–Є –±–Њ–ї–µ–µ 3-—Е –≤–Є–і–Њ–≤ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 2 –≥–Њ–і–∞. –°—А–µ–і–Є —В–µ—Е, —Г –Ї–Њ–≥–Њ –љ–µ –±—Л–ї–Њ –њ—А–Њ–±–ї–µ–Љ —Б –Ї–Є—И–µ—З–љ–Є–Ї–Њ–Љ, –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є –≤ —В–∞–Ї–Є—Е –і–Њ–Ј–∞—Е –њ—А–Є–љ–Є–Љ–∞–ї–Є 7%. –Я–Њ–ї—Г—З–∞–µ—В—Б—П, —З—В–Њ –µ—Б–ї–Є —Б—З–Є—В–∞—В—М –њ—А–Є—З–Є–љ–Њ–є —А–∞–Ј–≤–Є—В–Є—П –±–Њ–ї–µ–Ј–љ–µ–є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є, —В–Њ –љ–∞ –Ї–∞–ґ–і—Л–µ 20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–њ–Є—Б–∞–ї–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є, –њ—А–Є—Е–Њ–і–Є—В—Б—П 1 –љ–Њ–≤—Л–є —Б–ї—Г—З–∞–є —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –Ї–Њ–ї–Є—В–∞ –Є–ї–Є –±–Њ–ї–µ–Ј–љ–Є –Ъ—А–Њ–љ–∞. –Т —Ж–µ–ї–Њ–Љ, –њ–Њ –і–∞–љ–љ—Л–Љ –∞–≤—В–Њ—А–Њ–≤, —Г —В–µ—Е, –Ї—В–Њ —З–∞—Б—В–Њ –ї–µ—З–Є—В—Б—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є, —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 50%. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –њ—А–Є—З–Є–љ–Њ–є –Є—Е —А–∞–Ј–≤–Є—В–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М –≥–Є–њ–µ—А—А–µ–∞–Ї—Ж–Є—П –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–∞ –≤–Є—А—Г—Б—Л –Є–ї–Є –±–∞–Ї—В–µ—А–Є–Є –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ. –Т—Б–µ –±–Њ–ї—М—И–µ –љ–∞—Г—З–љ—Л—Е –і–∞–љ–љ—Л—Е —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ —В–Њ, —З—В–Њ –љ–∞—А—Г—И–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –±–∞–ї–∞–љ—Б–∞ –Є —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ—А–Є—З–Є–љ–Њ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ц–Ъ–Ґ [22].
–Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –Њ–±—Л—З–љ–Њ —Б–Њ–≥–ї–∞—И–∞—О—В—Б—П —Б —В–µ–Љ, —З—В–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –≤—Л–њ–Є—Б—Л–≤–∞–µ–Љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –њ–Њ–і–∞–≤–ї—П—О—В –Є–Љ–Љ—Г–љ–љ—Г—О —Б–Є—Б—В–µ–Љ—Г (–њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –≤—А–∞—З–Є —З–∞—Б—В–Њ –Є–≥–љ–Њ—А–Є—А—Г—О—В —Н—В–Њ—В —Д–∞–Ї—В, –њ—А–Є–≤–Њ–і–Є–Љ—Л–є –≤ —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е). –Ґ–Њ–Ї—Б–Є—З–љ—Л–є —Н—Д—Д–µ–Ї—В —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —З–∞—Б—В–Њ –Њ—Б–ї–∞–±–ї—П–µ—В –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Њ—А–≥–∞–љ—Л (—Й–Є—В–Њ–≤–Є–і–љ—Г—О –ґ–µ–ї–µ–Ј—Г, —Б–µ–ї–µ–Ј–µ–љ–Ї—Г, –њ–µ—З–µ–љ—М, –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Є), –љ–∞–Є–±–Њ–ї–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ –і–ї—П –Њ—В—А–∞–ґ–µ–љ–Є—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –≤—А–µ–і–Њ–љ–Њ—Б–љ—Л—Е –Љ–Є–Ї—А–Њ–±–Њ–≤. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –≤—Л–Љ–Є—А–∞–љ–Є–µ –Љ–Є–Ї—А–Њ–±–Њ–≤ –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–∞—Б—В–Њ–ї—М–Ї–Њ –±—Л—Б—В—А—Л–Љ, —З—В–Њ –Њ—А–≥–∞–љ–Є–Ј–Љ –љ–µ—Б–њ–Њ—Б–Њ–±–µ–љ –≤—Л—А–∞–±–Њ—В–∞—В—М –њ—А–Њ–≥—А–∞–Љ–Љ—Г –њ—А–Њ—В–Є–≤–Њ–і–µ–є—Б—В–≤–Є—П –Љ–Є–Ї—А–Њ–±–∞–Љ, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Б–Њ–Ј–і–∞–µ—В—Б—П –±–Њ–ї—М—И–∞—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є.
–≠—В–Њ –љ–∞–Є–±–Њ–ї–µ–µ –Њ—З–µ–≤–Є–і–љ–Њ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Њ—Б—В—А–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Є—В–∞, –≤—Л–Ј–≤–∞–љ–љ–Њ–≥–Њ β-–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–Љ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–Љ. –Р–љ—В–Є–±–Є–Њ—В–Є–Ї–Є –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –≤—А–∞—З–∞–Љ–Є –њ–Њ —В—А–∞–і–Є—Ж–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ —А–∞–љ–љ–µ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –ї–Є–Љ—Д–Њ–Є–і–љ—Г—О —В–Ї–∞–љ—М –Љ–Є–љ–і–∞–ї–Є–љ —Б —Ж–µ–ї—М—О –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –≤—Л—А–∞–±–∞—В—Л–≤–∞–љ–Є–µ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є –∞–љ—В–Є—В–µ–ї, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –≤ —А–µ–і–Ї–Є—Е —Б–ї—Г—З–∞—П—Е (–Љ–µ–љ–µ–µ —З–µ–Љ 1 –Є–Ј 200) –љ–∞–љ–µ—Б—В–Є –≤—А–µ–і —Б–µ—А–і—Ж—Г –Є –њ–Њ—З–Ї–∞–Љ. –Ю–і–љ–∞–Ї–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ –≤ –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Г—О –Є–Љ–Љ—Г–љ–љ—Г—О —А–µ–∞–Ї—Ж–Є—О –Љ–Њ–ґ–µ—В –Њ—Б—В–∞–≤–Є—В—М –њ–∞—Ж–Є–µ–љ—В–∞ –±–µ–Ј–Ј–∞—Й–Є—В–љ—Л–Љ –њ–µ—А–µ–і –њ–Њ–≤—В–Њ—А–љ–Њ–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–µ–є.
–Р–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—П –љ–∞ –њ–∞—В–Њ–≥–µ–љ—Л, —Б–ї–Є—И–Ї–Њ–Љ —З–∞—Б—В–Њ —А–∞–Ј—А—Г—И–∞—О—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –≤–Є–і—Л –±–∞–Ї—В–µ—А–Є–є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ –і–ї—П –љ–∞—И–µ–≥–Њ –Ј–і–Њ—А–Њ–≤—М—П. –Ы–∞–Ї—В–Њ–±–∞—Ж–Є–ї–ї—Г—Б –∞—Ж–Є–і–Њ—Д–Є–ї—Г—Б –Є –±–Є—Д–Є–і–Њ–±–∞–Ї—В–µ—А–Є—Г–Љ –±–Є—Д–Є–і—Г—Б (–њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–µ –≤ –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–Љ –Є —Г—А–Њ–≥–µ–љ–Є—В–∞–ї—М–љ–Њ–Љ —В—А–∞–Ї—В–∞—Е) – —Н—В–Њ 2 –Є–Ј, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, 20 –Є–ї–Є –±–Њ–ї–µ–µ —В–∞–Ї–Є—Е –њ–Њ–ї–µ–Ј–љ—Л—Е –Љ–Є–Ї—А–Њ–±–Њ–≤. –Ю–љ–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–ї—П –њ—А–∞–≤–Є–ї—М–љ–Њ–≥–Њ –њ–Є—Й–µ–≤–∞—А–µ–љ–Є—П, —Г—Б–≤–Њ–µ–љ–Є—П, –і–µ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є, –≤—Л—А–∞–±–Њ—В–Ї–Є –≤–Є—В–∞–Љ–Є–љ–Њ–≤, –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞ —Е–Њ–ї–µ—Б—В–µ—А–Њ–ї–Њ–Љ –Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А–∞–Ї–∞.
–≠—В–Є –њ—А–Њ–±–Є–Њ—В–Є—З–µ—Б–Ї–Є–µ –Ї—Г–ї—М—В—Г—А—Л —В–∞–Ї–ґ–µ –≤—Л—А–∞–±–∞—В—Л–≤–∞—О—В –љ–∞—В—Г—А–∞–ї—М–љ—Л–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є –Є —Б–Є–ї—М–љ—Л–µ –∞–љ—В–Є–≥—А–Є–±–Ї–Њ–≤—Л–µ —Н–љ–Ј–Є–Љ—Л; –≤ –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–Љ —В—А–∞–Ї—В–µ –Њ–љ–Є —П–≤–ї—П—О—В—Б—П –љ–∞—И–µ–є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–µ–є –Њ–±–Њ—А–Њ–љ—Л –њ—А–Њ—В–Є–≤ –≤—А–µ–і–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є, –і—А–Њ–ґ–ґ–µ–є –Є –≤–Є—А—Г—Б–Њ–≤. –Ъ–Њ–≥–і–∞ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є –Њ—Б–ї–∞–±–ї—П—О—В –Є–ї–Є —А–∞–Ј—А—Г—И–∞—О—В —Н—В–Є —Б–Є–Љ–±–Є–Њ—В–Є—З–µ—Б–Ї–Є–µ –±–∞–Ї—В–µ—А–Є–Є, —Б –±–Њ–ї—М—И–Њ–є –і–Њ–ї–µ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –њ–Њ—Б–ї–µ–і—Г—О—В —Г—Б—В–Њ–є—З–Є–≤—Л–µ –і—А–Њ–ґ–ґ–µ–≤—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є –Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–є –і–Є—Б–±–∞–ї–∞–љ—Б.
–°–µ–є—З–∞—Б —Г—З–µ–љ—Л–µ –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ —Б–Љ–µ—А—В–µ–ї—М–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –±–∞–Ї—В–µ—А–Є–є, –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ–≤–Њ—Б–њ—А–Є–Є–Љ—З–Є–≤—Л—Е –Ї –Ї–∞–ґ–і–Њ–Љ—Г –Є–Ј–≤–µ—Б—В–љ–Њ–Љ—Г –∞–љ—В–Є–±–Є–Њ—В–Є–Ї—Г. –Э–∞–њ—А–Є–Љ–µ—А, —И—В–∞–Љ–Љ St. aureus, –љ–µ–≤–Њ—Б–њ—А–Є–Є–Љ—З–Є–≤—Л–є –Ї –≤–∞–љ–Ї–Њ–Љ–Є—Ж–Є–љ—Г (–Њ–і–љ–Њ–Љ—Г –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –Љ–Њ—Й–љ—Л—Е –Є–Ј –Ї–Њ–≥–і–∞-–ї–Є–±–Њ –≤—Л—А–∞–±–Њ—В–∞–љ–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤), –њ–Њ–ї—Г—З–Є–ї –Њ—З–µ–љ—М –±–Њ–ї—М—И—Г—О –і—Г—А–љ—Г—О —Б–ї–∞–≤—Г –Ї–∞–Ї «–њ–Њ–µ–і–∞—О—Й–∞—П –њ–ї–Њ—В—М –±–∞–Ї—В–µ—А–Є—П», –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–∞—П –Ј–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б–Љ–µ—А—В–µ–є –≤ –°–®–Р –Є –Х–≤—А–Њ–њ–µ. –≠—В–∞ –±–∞–Ї—В–µ—А–Є—П –љ–∞—Б—В–Њ–ї—М–Ї–Њ –∞–≥—А–µ—Б—Б–Є–≤–љ–∞, —З—В–Њ —Б–Љ–µ—А—В—М –Љ–Њ–ґ–µ—В –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В—М —З–µ—А–µ–Ј –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–љ–µ–є –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –≤—Б–µ —Г—Б–Є–ї–Є—П –Љ–µ–і–Є—Ж–Є–љ—Л [6].
–Ш–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≥–ї–Њ—В–Ї–Є – —В–Њ–љ–Ј–Є–ї–ї–Є—В—Л –Є —В–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В—Л – —Н—В–Њ –±–Њ–ї—М—И–∞—П –≥—А—Г–њ–њ–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ —Н—В–Є–Њ–ї–Њ–≥–Є–Є, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ, –∞ —В–∞–Ї–ґ–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є –њ–∞—В–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ. –Ю–±—К–µ–і–Є–љ—П—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –Ј–і–µ—Б—М —П–≤–ї—П—О—В—Б—П –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л [6].
–Я—А–Є –њ–Њ—Б–µ–≤–µ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В—Б—П –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л, –≤ –љ–Њ—А–Љ–µ –ґ–Є–≤—Г—Й–Є–µ –±–µ–Ј –њ—А–Њ—П–≤–ї–µ–љ–Є—П –∞–≥—А–µ—Б—Б–Є–Є –Є –≤—А–µ–і–∞ –і–ї—П –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Ъ –љ–Є–Љ –Њ—В–љ–Њ—Б—П—В: –љ–µ–њ–∞—В–Њ–≥–µ–љ–љ—Л–µ –љ–µ–є—Б—Б–µ—А–Є–Є – Neisseria s—Аp. (–Ї—А–Њ–Љ–µ N. meningitidis); –і–Є—Д—В–µ—А–Њ–Є–і—Л; –Ј–µ–ї–µ–љ—П—Й–Є–µ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є – Streptococcus gr. viridans; —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї —Н–њ–Є–і–µ—А–Љ–∞–ї—М–љ—Л–є – S. –µpidermidis; Corynebacterium spp. (–Ї—А–Њ–Љ–µ C. diphtheriae); Candida spp.; Haemophilis spp.; Actinomyces spp. –Є —А—П–і –і—А—Г–≥–Є—Е. –Ъ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Л—П–≤–ї—П–µ–Љ—Л–Љ —Г—Б–ї–Њ–≤–љ–Њ-–њ–∞—В–Њ–≥–µ–љ–љ—Л–Љ –Є –њ–∞—В–Њ–≥–µ–љ–љ—Л–Љ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ –Њ—В–љ–Њ—Б—П—В: Streptococcus pyogenes, Staphylococcus aureus, Streptococcus pneumoniae, Haemophilus influenzae, –≥—А–Є–±—Л —А–Њ–і–∞ –Ї–∞–љ–і–Є–і–∞, –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ —Н–љ—В–µ—А–Њ–±–∞–Ї—В–µ—А–Є–Є.
–Ш–Љ–µ–µ—В—Б—П –њ—А—П–Љ–∞—П –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –љ–µ–њ–∞—В–Њ–≥–µ–љ–љ–Њ–є —Д–ї–Њ—А—Л –Є/–Є–ї–Є –Њ–њ–њ–Њ—А—В—Г–љ–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ (–Њ—В –Њ—А—А–Њrtonus – —Г–і–Њ–±–љ—Л–є). –Ю–њ–њ–Њ—А—В—Г–љ–Є—Б—В–Є—З–µ—Б–Ї–Є–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л –∞–Ї—В–Є–≤–Є—А—Г—О—В—Б—П –≤ —Г—Б–ї–Њ–≤–Є—П—Е, —Г–і–Њ–±–љ—Л—Е –і–ї—П –љ–Є—Е, – –њ—А–Є –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е. –Ъ–Њ–≥–і–∞ –Љ–µ—Б—В–љ—Л–µ –Є–ї–Є —Б–Є—Б—В–µ–Љ–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –љ–∞—А—Г—И–µ–љ—Л, —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Њ—А–∞–ї—М–љ—Л–є –Ї–∞–љ–і–Є–і–Њ–Ј, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–є –і—А–Њ–ґ–ґ–µ–њ–Њ–і–Њ–±–љ—Л–Љ–Є –≥—А–Є–±–∞–Љ–Є, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є –≤–Њ —А—В—Г —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї—О–і–µ–є.
–°–∞–Љ—Г—О –±–Њ–ї—М—И—Г—О –≥—А—Г–њ–њ—Г –њ–Њ—Б—В–Њ—П–љ–љ–Њ –Њ–±–Є—В–∞—О—Й–Є—Е –≤ –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ –±–∞–Ї—В–µ—А–Є–є —Б–Њ—Б—В–∞–≤–ї—П—О—В –Ї–Њ–Ї–Ї–Є – 85–90% –Њ—В –≤—Б–µ—Е –≤–Є–і–Њ–≤. –Ю–љ–Є –Њ–±–ї–∞–і–∞—О—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, —А–∞–Ј–ї–∞–≥–∞—О—В —Г–≥–ї–µ–≤–Њ–і—Л, —А–∞—Б—Й–µ–њ–ї—П—О—В –±–µ–ї–Ї–Є —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–µ—А–Њ–≤–Њ–і–Њ—А–Њ–і–∞.
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Њ–±–Є—В–∞—В–µ–ї—П–Љ–Є –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ —П–≤–ї—П—О—В—Б—П —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є: S. mutans, S. mitis, S. sanguis. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е – —Д–∞–Ї—Г–ї—М—В–∞—В–Є–≤–љ—Л–µ –∞–љ–∞—Н—А–Њ–±—Л, –љ–Њ –≤—Б—В—А–µ—З–∞—О—В—Б—П –Є –Њ–±–ї–Є–≥–∞—В–љ—Л–µ –∞–љ–∞—Н—А–Њ–±—Л (–њ–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є). –Ю–±–ї–∞–і–∞—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є —Б–±—А–∞–ґ–Є–≤–∞—О—В —Г–≥–ї–µ–≤–Њ–і—Л –њ–Њ —В–Є–њ—Г –Љ–Њ–ї–Њ—З–љ–Њ–Ї–Є—Б–ї–Њ–≥–Њ –±—А–Њ–ґ–µ–љ–Є—П —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Љ–Њ–ї–Њ—З–љ–Њ–є –Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і—А—Г–≥–Є—Е –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є—Е –Ї–Є—Б–ї–Њ—В. –Ъ–Є—Б–ї–Њ—В—Л, –њ—А–Њ–і—Г—Ж–Є—А—Г–µ–Љ—Л–µ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–∞–Љ–Є, –њ–Њ–і–∞–≤–ї—П—О—В —А–Њ—Б—В –љ–µ–Ї–Њ—В–Њ—А—Л—Е –≥–љ–Є–ї–Њ—Б—В–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –њ–Њ–њ–∞–і–∞—О—Й–Є—Е –≤ –њ–Њ–ї–Њ—Б—В—М —А—В–∞ –Є–Ј –≤–љ–µ—И–љ–µ–є —Б—А–µ–і—Л. –Т –Ј—Г–±–љ–Њ–Љ –љ–∞–ї–µ—В–µ –Є –љ–∞ –і–µ—Б–љ–∞—Е –Ј–і–Њ—А–Њ–≤—Л—Е –ї—О–і–µ–є –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В —В–∞–Ї–ґ–µ —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Є: St. epidermidis, –Є–љ–Њ–≥–і–∞ St. –∞ureus [19].
–Т–µ—А—Е–љ–Є–µ –Њ—В–і–µ–ї—Л –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –љ–µ—Б—Г—В –Њ—Б–Њ–±–µ–љ–љ–Њ –≤—Л—Б–Њ–Ї—Г—О –Љ–Є–Ї—А–Њ–±–љ—Г—О –љ–∞–≥—А—Г–Ј–Ї—Г, —В.–Ї. –Њ–љ–Є –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є –њ—А–Є—Б–њ–Њ—Б–Њ–±–ї–µ–љ—Л –і–ї—П –Њ—Б–∞–ґ–і–µ–љ–Є—П –±–∞–Ї—В–µ—А–Є–є –Є–Ј –≤–і—Л—Е–∞–µ–Љ–Њ–≥–Њ –≤–Њ–Ј–і—Г—Е–∞. –Я–Њ–Љ–Є–Љ–Њ –Њ–±—Л—З–љ—Л—Е –љ–µ–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є—Е –Є –Ј–µ–ї–µ–љ—П—Й–Є—Е —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤, –љ–µ–њ–∞—В–Њ–≥–µ–љ–љ—Л—Е –љ–µ–є—Б—Б–µ—А–Є–є, —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤ –Є —Н–љ—В–µ—А–Њ–±–∞–Ї—В–µ—А–Є–є –≤ –љ–Њ—Б–Њ–≥–ї–Њ—В–Ї–µ –Љ–Њ–ґ–љ–Њ –Њ–±–љ–∞—А—Г–ґ–Є—В—М –Љ–µ–љ–Є–љ–≥–Њ–Ї–Њ–Ї–Ї–Є, –њ–Є–Њ–≥–µ–љ–љ—Л–µ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є, –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Є –Є –±–Њ—А–і–µ—В–µ–ї–ї—Л. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Г–Ї–∞–Ј–∞–љ–љ—Л–µ –Њ—В–і–µ–ї—Л —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –Њ–±—Л—З–љ–Њ —Б—В–µ—А–Є–ї—М–љ—Л –Є –Ї–Њ–ї–Њ–љ–Є–Ј–Є—А—Г—О—В—Б—П –≤ —В–µ—З–µ–љ–Є–µ 2–3 —Б—Г—В. –Я–Њ –Љ–µ—А–µ —Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–Є—П –Ј–∞—Й–Є—В–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –љ–Њ—Б–Є—В–µ–ї—М—Б—В–≤–∞ –њ–∞—В–Њ–≥–µ–љ–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є —Б–љ–Є–ґ–∞–µ—В—Б—П, –Є –Є—Е —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ —А–µ–і–Ї–Њ –≤—Л–і–µ–ї—П—О—В —Г–ґ–µ —Г –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤.
–Э–∞ —Б–Њ—Б—В–∞–≤ –Љ–Є–Ї—А–Њ–±–љ—Л—Е —Б–Њ–Њ–±—Й–µ—Б—В–≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ–ї–Њ—Б—В–µ–є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤–ї–Є—П—О—В —Б–∞–Љ—Л–µ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л: —З–Є—Б—В–Њ—В–∞ –≤–і—Л—Е–∞–µ–Љ–Њ–≥–Њ –≤–Њ–Ј–і—Г—Е–∞, –љ–∞–ї–Є—З–Є–µ –њ—Л–ї–Є, —Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Ј–∞–≥—А—П–Ј–љ–µ–љ–Є–є. –Ю–і–љ–∞–Ї–Њ –љ–∞–Є–±–Њ–ї—М—И–µ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ–∞—В–Њ–≥–µ–љ–µ–Ј –Ї–Њ—В–Њ—А—Л—Е –≤–Ї–ї—О—З–∞–µ—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Д–Є–Ј–Є–Ї–Њ-—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–µ–є, –Є –њ—А–Є–µ–Љ –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–°—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є –≥—А—Г–њ–њ—Л A (S. pyogenes) –Є–Љ–µ—О—В –Љ–љ–Њ–≥–Њ –≤–Є—А—Г–ї–µ–љ—В–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –≤–Ї–ї—О—З–∞—П –∞–љ—В–Є—Д–∞–≥–Њ—Ж–Є—В–∞—А–љ—Л–є –Ь––њ—А–Њ—В–µ–Є–љ –Є —В–Њ–љ–Ї—Г—О –Ї–∞–њ—Б—Г–ї—Г –Є–Ј –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –∞ —В–∞–Ї–ґ–µ –≥—А—Г–њ–њ—Г –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л—Е —В–Њ–Ї—Б–Є–љ–Њ–≤ –Є —Д–µ—А–Љ–µ–љ—В–Њ–≤, –≤ —В.—З. –њ–Є—А–Њ–≥–µ–љ–љ—Л–є —В–Њ–Ї—Б–Є–љ, —Б—В—А–µ–њ—В–Њ–ї–Є–Ј–Є–љ, —Б—В—А–µ–њ—В–Њ–Ї–Є–љ–∞–Ј—Г –Є –Ф–Э–Ъ-–∞–Ј—Л; –Њ–±—Л—З–љ–Њ –≤—Л–Ј—Л–≤–∞—О—В —Д–∞—А–Є–љ–≥–Є—В, –Є–љ—Д–µ–Ї—Ж–Є—О –Ї–Њ–ґ–Є –Є –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ–µ–є, —А–µ–ґ–µ – –њ–љ–µ–≤–Љ–Њ–љ–Є—О –Є –њ–Њ—Б–ї–µ—А–Њ–і–Њ–≤–Њ–є —Б–µ–њ—Б–Є—Б, –њ–Њ—Б—В–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П —А–µ–≤–Љ–∞—В–Є–Ј–Љ–∞ –Є –Њ—Б—В—А—Л–є –≥–ї–Њ–Љ–µ—А—Г–ї–Њ–љ–µ—Д—А–Є—В. –Ґ–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В – –Њ–±—Л—З–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П —Г –≤–Ј—А–Њ—Б–ї—Л—Е –Є –і–µ—В–µ–є —Б—В–∞—А—И–µ 3 –ї–µ—В, –Њ–љ–∞ –і–∞–µ—В 20–40% –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ —Н–Ї—Б—Б—Г–і–∞—В–Є–≤–љ—Л—Е —Д–∞—А–Є–љ–≥–Є—В–Њ–≤, –њ–µ—А–µ–і–∞–µ—В—Б—П –Њ—В —З–µ–ї–Њ–≤–µ–Ї–∞ –Ї —З–µ–ї–Њ–≤–µ–Ї—Г —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ –њ—Г—В–µ–Љ, –љ–Њ –Љ–Њ–ґ–µ—В –њ–µ—А–µ–і–∞–≤–∞—В—М—Б—П –Є —Б –њ–Є—Й–µ–є. –Я–Њ—Б–ї–µ –Є–љ–Ї—Г–±–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –≤ 14 —Б—Г—В –њ–Њ—П–≤–ї—П—О—В—Б—П –±–Њ–ї—М –≤ –≥–Њ—А–ї–µ, –ї–Є—Е–Њ—А–∞–і–Ї–∞, –Њ–Ј–љ–Њ–±, –њ–ї–Њ—Е–Њ–µ —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є–µ, –Є–љ–Њ–≥–і–∞ —В–Њ—И–љ–Њ—В–∞, —А–≤–Њ—В–∞ –Є –±–Њ–ї—М –≤ –ґ–Є–≤–Њ—В–µ. –°–Є–Љ–њ—В–Њ–Љ—Л –≤–µ—Б—М–Љ–∞ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л, –≤–∞—А—М–Є—А—Г—П –Њ—В –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л—Е –і–Њ —П—А–Ї–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Љ–Є–љ–і–∞–ї–Є–љ, –≥–љ–Њ–є–љ—Л–є –љ–∞–ї–µ—В –Њ—В–Љ–µ—З–∞–µ—В—Б—П –љ–∞ –Љ–Є–љ–і–∞–ї–Є–љ–∞—Е –Є –Ј–∞–і–љ–µ–є —Б—В–µ–љ–Ї–µ –≥–ї–Њ—В–Ї–Є, —И–µ–є–љ—Л–µ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ —Г–Ј–ї—Л —Г–≤–µ–ї–Є—З–µ–љ—Л –Є –±–Њ–ї–µ–Ј–љ–µ–љ–љ—Л. –Ю–±—Л—З–љ–Њ –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–є —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤—Л–є —Д–∞—А–Є–љ–≥–Є—В –і–ї–Є—В—Б—П 3–5 –і–љ–µ–є. –У–љ–Њ–є–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П, –љ–µ—З–∞—Б—В—Л–µ –Є–Ј-–Ј–∞ —И–Є—А–Њ–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –≤–Ї–ї—О—З–∞—О—В –Њ—Б—В—А—Л–є —Б—А–µ–і–љ–Є–є –Њ—В–Є—В, —Б–Є–љ—Г—Б–Є—В, –њ–µ—А–Є—В–Њ–љ–Ј–Є–ї–ї—П—А–љ—Л–є –Є–ї–Є –Ј–∞–≥–ї–Њ—В–Њ—З–љ—Л–є –∞–±—Б—Ж–µ—Б—Б, –Љ–µ–љ–Є–љ–≥–Є—В, –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –ї–µ–≥–Ї–Є—Е, –±–∞–Ї—В–µ—А–Є–µ–Љ–Є—О, —Н–љ–і–Њ–Ї–∞—А–і–Є—В [1, 2, 14].
–Т –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –Њ—Б—В—А–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В–∞ —Г—З–∞—Б—В–≤—Г—О—В –Ї–∞–Ї –≤–Є—А—Г—Б—Л (—А–Є–љ–Њ–≤–Є—А—Г—Б—Л, —А–Њ—В–∞–≤–Є—А—Г—Б—Л, –≤–Є—А—Г—Б—Л –њ–∞—А–∞–≥—А–Є–њ–њ–∞, –≤–Є—А—Г—Б—Л –Ъ–Њ–Ї—Б–∞–Ї–Є), —В–∞–Ї –Є –±–∞–Ї—В–µ—А–Є–Є (—Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є –≥—А—Г–њ–њ –Р, C, G, —Б—В–∞—Д–Є–ї–ї–Њ–Ї–Њ–Ї–Ї–Є, –љ–µ–є—Б—Б–µ—А–Є–Є, –Ї–Њ—А–Є–љ–µ–±–∞–Ї—В–µ—А–Є–Є, —Б–њ–Є—А–Њ—Е–µ—В—Л, –ї–Є—Б—В–µ—А–Є–Є). –°—А–µ–і–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –њ—А–Є—А–Њ–і—Л –љ–∞–Є–±–Њ–ї—М—И–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В β-–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–Љ—Г —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї—Г –≥—А—Г–њ–њ—Л –Р (–С–У–°–Р) (S. pyogenes), –≤—Б—В—А–µ—З–∞—О—Й–µ–Љ—Г—Б—П –≤ 5–30% —Б–ї—Г—З–∞–µ–≤ –Њ—Б—В—А–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В–∞ –Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В–∞ [9]. –†–µ–ґ–µ –Њ—Б—В—А—Л–є —В–Њ–љ–Ј–Є–ї–ї–Є—В –≤—Л–Ј—Л–≤–∞—О—В –≤–Є—А—Г—Б—Л, —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є –≥—А—Г–њ–њ C –Є G, Arcanobacterium haemolyticum, Neisseria gonorrhoeae, Corynebacterium diphtheria–µ (–і–Є—Д—В–µ—А–Є—П), –∞–љ–∞—Н—А–Њ–±—Л –Є —Б–њ–Є—А–Њ—Е–µ—В—Л (–∞–љ–≥–Є–љ–∞ –°–Є–Љ–∞–љ–Њ–≤—Б–Ї–Њ–≥–Њ – –Я–ї–∞—Г—В–∞ – –Т–µ–љ—Б–∞–љ–∞), –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ – –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ—Л –Є —Е–ї–∞–Љ–Є–і–Є–Є [2].
–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–µ–є –±–Њ–ї–µ–Ј–љ–µ–є 10-–≥–Њ –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ –≤—Л–і–µ–ї—П—О—В —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤—Л–є —Д–∞—А–Є–љ–≥–Є—В (J02.0) –Є —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤—Л–є —В–Њ–љ–Ј–Є–ї–ї–Є—В (J03.0). –Т –Ј–∞—А—Г–±–µ–ґ–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≤–Ј–∞–Є–Љ–Њ–Ј–∞–Љ–µ–љ—П–µ–Љ—Л–µ —В–µ—А–Љ–Є–љ—Л «—В–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В» –Є «—Д–∞—А–Є–љ–≥–Є—В». –Т –†–Њ—Б—Б–Є–Є –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —В–µ—А–Љ–Є–љ «—Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤—Л–є —В–Њ–љ–Ј–Є–ї–ї–Є—В», –њ–Њ–і –Ї–Њ—В–Њ—А—Л–Љ –њ–Њ–љ–Є–Љ–∞–µ—В—Б—П —В–Њ–љ–Ј–Є–ї–ї–Є—В (–∞–љ–≥–Є–љ–∞) –Є–ї–Є —Д–∞—А–Є–љ–≥–Є—В, –≤—Л–Ј–≤–∞–љ–љ—Л–є –С–У–°–Р, –Ї–Њ—В–Њ—А—Л–є –њ–µ—А–µ–і–∞–µ—В—Б—П –≤–Њ–Ј–і—Г—И–љ–Њ-–Ї–∞–њ–µ–ї—М–љ—Л–Љ –њ—Г—В–µ–Љ. –Ш—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є–Є —П–≤–ї—П—О—В—Б—П –±–Њ–ї—М–љ—Л–µ –Є, —А–µ–ґ–µ, –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л–µ –љ–Њ—Б–Є—В–µ–ї–Є. –Ш–љ–Ї—Г–±–∞—Ж–Є–Њ–љ–љ—Л–є –њ–µ—А–Є–Њ–і –њ—А–Є –Њ—Б—В—А–Њ–Љ –С–У–°–Р-—В–Њ–љ–Ј–Є–ї–ї–Є—В–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —З–∞—Б–Њ–≤ –і–Њ 2–4 –і–љ–µ–є. –•–Њ—В—П –Њ—Б—В—А—Л–є —В–Њ–љ–Ј–Є–ї–ї–Є—В —Б—З–Є—В–∞–µ—В—Б—П –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ, —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤—Г—О –∞–љ–≥–Є–љ—Г –Љ–Њ–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Ї–∞–Ї –Њ–±–Њ—Б—В—А–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Є—В–∞ (–•–Ґ).
«–Ч–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ» –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П β-–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–∞ –≤ –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ —Б —Ж–µ–ї—М—О –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —П–≤–ї—П–µ—В—Б—П –°—В—А–µ–њ—В–∞—В–µ—Б—В. –І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –і–∞–љ–љ–Њ–≥–Њ —В–µ—Б—В–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В, –њ–Њ –і–∞–љ–љ—Л–Љ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, 97,3% [19], –∞ —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М – 95,3%. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —В–µ—Б—В–Њ–≤—Л–µ —Б–Є—Б—В–µ–Љ—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ–Њ–ї—Г—З–∞—В—М —А–µ–Ј—Г–ї—М—В–∞—В —З–µ—А–µ–Ј 15–20 –Љ–Є–љ. —Б –≤—Л—Б–Њ–Ї–Њ–є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О (95–100%), –љ–Њ –Љ–µ–љ—М—И–µ–є, —З–µ–Љ –њ—А–Є –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О (60–95%). –≠–Ї—Б–њ—А–µ—Б—Б-–Љ–µ—В–Њ–і—Л –і–Њ–њ–Њ–ї–љ—П—О—В, –љ–Њ –љ–µ –Ј–∞–Љ–µ–љ—П—О—В –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ—Л–є –Љ–µ—В–Њ–і. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —В–Њ–ї—М–Ї–Њ –њ—А–Є –≤—Л–і–µ–ї–µ–љ–Є–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –Љ–Њ–ґ–љ–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М –µ–≥–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ [16, 17].
–Э–∞ –њ–µ—А–≤–Њ–Љ –Љ–µ—Б—В–µ –≤ –љ–µ—А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ —Б—В–Њ–Є—В –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є—Е –њ—А–Є –Њ—Б—В—А–Њ–є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–є –≤–Є—А—Г—Б–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є (–Ю–†–Т–Ш) —Б —Ж–µ–ї—М—О –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Ь–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є –Њ—И–Є–±–Њ—З–љ–Њ—Б—В—М –і–∞–љ–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П. –Ґ–∞–Ї, –≤ –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б —Ж–µ–ї—М—О –Њ–њ—А–µ–і–µ–ї–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В–∞ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Њ—Б—В—А–Њ–≥–Њ —Б—А–µ–і–љ–µ–≥–Њ –Њ—В–Є—В–∞ (–Ю–°–Ю) —Г –і–µ—В–µ–є —Б –Њ—Б—В—А—Л–Љ–Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ–Є –≤–Є—А—Г—Б–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –Њ—В–љ–Њ—Б—П—Й–Є—Е—Б—П –Ї –≥—А—Г–њ–њ–µ –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Ю–°–Ю. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 203 —А–µ–±–µ–љ–Ї–∞ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 3 –Љ–µ—Б. –і–Њ 3 –ї–µ—В —Б –Ю–†–Т–Ш –Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ –Ю–°–Ю –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ. –Я–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ. –І–∞—Б—В–Њ—В–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ю–°–Ю –≤ –≥—А—Г–њ–њ–µ –і–µ—В–µ–є, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –њ–ї–∞—Ж–µ–±–Њ, –Є –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В, –±—Л–ї–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–є (p=0,288) [22]. –°—Е–Њ–ґ–Є–µ –і–∞–љ–љ—Л–µ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –≤ –†–Њ—Б—Б–Є–Є. –Я—А–Є–µ–Љ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –Ю–†–Т–Ш –љ–µ —Б–љ–Є–Ј–Є–ї —З–∞—Б—В–Њ—В—Г –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–љ–µ–≤–Љ–Њ–љ–Є–Є, –Њ–і–љ–∞–Ї–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –±–∞–Ї—В–µ—А–Є–Є –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ, –≤—Л–Ј–≤–∞–≤—И–Є–Љ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ, –±—Л–ї–∞ —Б–љ–Є–ґ–µ–љ–∞ [2].
–Т –†–Њ—Б—Б–Є–Є –њ—А–Њ–±–ї–µ–Љ–∞ –љ–µ—А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –Њ—Б–ї–Њ–ґ–љ—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –Є—Е –±–µ–Ј—А–µ—Ж–µ–њ—В—Г—А–љ–Њ–≥–Њ –њ—А–Є–Њ–±—А–µ—В–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –і–ї—П —Б–∞–Љ–Њ–ї–µ—З–µ–љ–Є—П. –Я–Њ–ї—М–Ј–∞ –Њ—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –њ—А–Є —Д–∞—А–Є–љ–≥–Є—В–µ –≤–µ—Б—М–Љ–∞ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞. –°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞, —Г 90% –±–Њ–ї—М–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ—Л –Є—Б—З–µ–Ј–∞—О—В –≤ —В–µ—З–µ–љ–Є–µ 1 –љ–µ–і. –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –њ—А–Є–µ–Љ–∞ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤. –Р–љ—В–Є–±–Є–Њ—В–Є–Ї–Є –Љ–Њ–≥—Г—В —Б–Њ–Ї—А–∞—Й–∞—В—М –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Љ–µ–љ–µ–µ —З–µ–Љ –љ–∞ 1 —Б—Г—В. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Њ–±—А–∞—Й–µ–љ–Є—П –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–µ —Г—З—А–µ–ґ–і–µ–љ–Є–µ –њ–Њ –њ–Њ–≤–Њ–і—Г —Д–∞—А–Є–љ–≥–Є—В–∞ —Г –ї–Є—Ж, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є, –≤—Л—И–µ, —З–µ–Љ —Г –љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Є—Е. –Я—А–Є —Н—В–Њ–Љ —Б–ї–µ–і—Г–µ—В –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —П–≤–ї—П—О—В—Б—П –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ —В–Њ–Ї—Б–Є—З–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ–Њ–є –Є –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—В –і–Њ 25–30% –≤—Б–µ—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ [2].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–Є—Б—В–µ–Љ–љ–∞—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –њ–Њ–Ї–∞–Ј–∞–љ–∞ —В–Њ–ї—М–Ї–Њ –њ—А–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є —Д–∞—А–Є–љ–≥–Є—В–∞. –°–Њ–≥–ї–∞—Б–љ–Њ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є —Д–∞—А–Є–љ–≥–Є—В–∞ —Б–ї–µ–і—Г—О—Й–Є–µ: –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –Љ–Є–љ–і–∞–ї–Є–љ, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —И–µ–є–љ—Л—Е –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤, –ї–Є—Е–Њ—А–∞–і–Ї–∞ –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ї–∞—И–ї—П. –Х—Б–ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–∞ –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –≤—Б–µ 4 –Ї—А–Є—В–µ—А–Є—П, —В–Њ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –Љ–Њ–ґ–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Є. –Э–∞–ї–Є—З–Є–µ –і–≤—Г—Е –Є–ї–Є —В—А–µ—Е –Є–Ј –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ + –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —В–µ—Б—В –љ–∞ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї –≥—А—Г–њ–њ—Л –Р —П–≤–ї—П—О—В—Б—П –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤. –Я–∞—Ж–Є–µ–љ—В–∞–Љ, —Г –Ї–Њ—В–Њ—А—Л—Е –Њ—В–Љ–µ—З–µ–љ –Њ–і–Є–љ –Є–Ј —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ –Є–ї–Є –љ–µ –±—Л–ї–Њ –љ–Є –Њ–і–љ–Њ–≥–Њ, –љ–µ —В—А–µ–±—Г—О—В—Б—П –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–∞ —В–µ—Б—В–∞ –љ–∞ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤—Л–є –∞–љ—В–Є–≥–µ–љ –Є –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
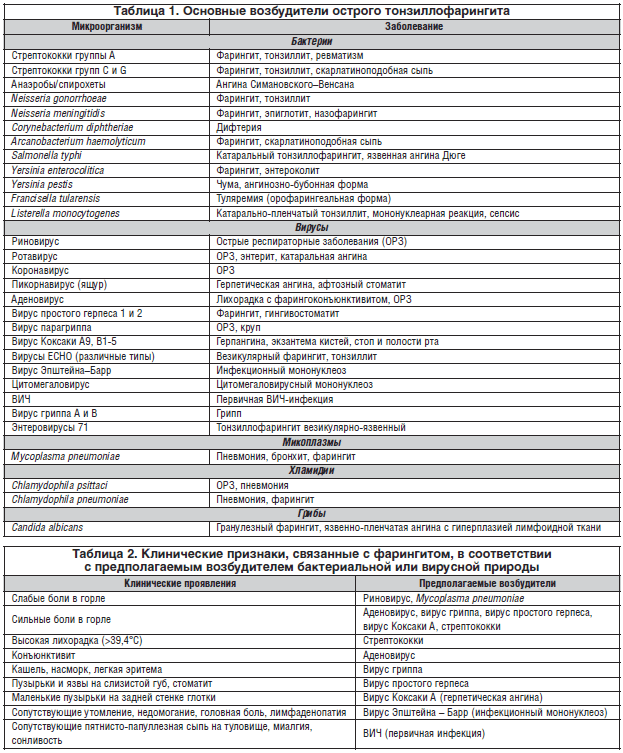
–Т –Њ—Б–љ–Њ–≤–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –•–Ґ –ї–µ–ґ–Є—В –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–∞—П —А–µ–∞–Ї—Ж–Є—П, —А–∞–Ј–≤–Є–≤–∞—О—Й–∞—П—Б—П –Њ–±—Л—З–љ–Њ –љ–∞ —Д–Њ–љ–µ –Ю–†–Т–Ш. –Т–Є—А—Г—Б–љ–Њ–µ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–µ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є —П–≤–ї—П–µ—В—Б—П –њ–µ—А–≤–Њ–є —Д–∞–Ј–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я—А–Є–Љ–µ—А–љ–Њ 70% –•–Ґ –≤—Л–Ј—Л–≤–∞—О—В—Б—П –≤–Є—А—Г—Б–∞–Љ–Є (—А–Є–љ–Њ–≤–Є—А—Г—Б—Л, –Ї–Њ—А–Њ–љ–∞–≤–Є—А—Г—Б—Л, —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–є —Б–Є–љ—Ж–Є—В–Є–∞–ї—М–љ—Л–є –≤–Є—А—Г—Б, –∞–і–µ–љ–Њ–≤–Є—А—Г—Б, –≤–Є—А—Г—Б—Л –≥—А–Є–њ–њ–∞ –Є –њ–∞—А–∞–≥—А–Є–њ–њ–∞), —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –љ–∞–Є–±–Њ–ї–µ–µ —В–Є–њ–Є—З–љ—Л–Љ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–Љ —П–≤–ї—П—О—В—Б—П —А–Є–љ–Њ–≤–Є—А—Г—Б—Л. –Ю—Б–љ–Њ–≤–љ—Л–Љ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–Љ –∞–љ–≥–Є–љ –Є –•–Ґ —Б—З–Є—В–∞–µ—В—Б—П β-–≥–µ–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–є —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї –≥—А—Г–њ–њ—Л –Р (–С–У–°–Р): 15–30% —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г –і–µ—В–µ–є –Є 5–17% —Б–ї—Г—З–∞–µ–≤ —Г –≤–Ј—А–Њ—Б–ї—Л—Е; –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —А–µ–і–Ї–Њ (<5%) —Д–∞—А–Є–љ–≥–Є—В –Љ–Њ–≥—Г—В –≤—Л–Ј—Л–≤–∞—В—М —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Є –≥—А—Г–њ–њ C –Є G [2, 7]. –£ –і–µ—В–µ–є –Љ–Њ–ї–Њ–ґ–µ 15 –ї–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –∞–љ–≥–Є–љ—Л —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Њ—Б–Њ–±–µ–љ–љ–Њ –≤—Л—Б–Њ–Ї–∞. –С–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —Д–ї–Њ—А–∞ –Ј–∞–і–љ–µ–є —Б—В–µ–љ–Ї–Є –≥–ї–Њ—В–Ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П–Љ–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ [5, 20]. –Т–∞–ґ–љ–Њ –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –Њ—Б—В—А—Л–є —Д–∞—А–Є–љ–≥–Є—В –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–µ—А–≤—Л–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ —В–∞–Ї–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ї–∞–Ї –Ї–Њ—А—М, —Б–Ї–∞—А–ї–∞—В–Є–љ–∞, –Ї–Њ—А–µ–≤–∞—П –Ї—А–∞—Б–љ—Г—Е–∞ (—В–∞–±–ї. 1, 2).
–Ш–Љ–µ–µ—В—Б—П –±–Њ–ї—М—И–Њ–є –∞—А—Б–µ–љ–∞–ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Д–Њ—А–Љ –Љ–µ—Б—В–љ—Л—Е –∞–љ—В–Є—Б–µ–њ—В–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П —Д–∞—А–Є–љ–≥–Є—В–∞: –њ–Њ–ї–Њ—Б–Ї–∞–љ–Є—П, —Б–њ—А–µ–Є, –∞—Н—А–Њ–Ј–Њ–ї–Є –Є–ї–Є —В–∞–±–ї–µ—В–Ї–Є –і–ї—П —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є—П.
–Ы–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–∞—П —Д–Њ—А–Љ–∞ —В–∞–±–ї–µ—В–Ї–Є –і–ї—П —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є—П –Њ–±–ї–∞–і–∞–µ—В —А—П–і–Њ–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –њ–µ—А–µ–і –њ–Њ–ї–Њ—Б–Ї–∞–љ–Є—П–Љ–Є –Є —Б–њ—А–µ—П–Љ–Є:
– –і–µ–є—Б—В–≤—Г—О—Й–µ–µ –≤–µ—Й–µ—Б—В–≤–Њ —А–∞—Б–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤ —В–Ї–∞–љ—П—Е –≥–ї–Њ—В–Ї–Є –±–Њ–ї–µ–µ —А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ, –≤–Ї–ї—О—З–∞—П —Г—З–∞—Б—В–Ї–Є, –љ–µ–і–Њ—Б—В—Г–њ–љ—Л–µ –і–ї—П —Б–њ—А–µ–µ–≤ –Є —А–∞—Б—В–≤–Њ—А–Њ–≤ –і–ї—П –њ–Њ–ї–Њ—Б–Ї–∞–љ–Є—П;
– –і–µ–є—Б—В–≤—Г—О—Й–µ–µ –≤–µ—Й–µ—Б—В–≤–Њ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤ —В–Ї–∞–љ—П—Е –≥–ї–Њ—В–Ї–Є –і–Њ–ї—М—И–µ, —З—В–Њ –і–∞–µ—В –±–Њ–ї—М—И–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –і–ї—П –ї–µ—З–µ–±–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П;
– –њ—А–Є —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є–Є –≤ –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ –≤—Л—А–∞–±–∞—В—Л–≤–∞–µ—В—Б—П –ї–Є–Ј–Њ—Ж–Є–Љ, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–є –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–µ –Є –∞–љ—В–Є—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–є —А–µ–≥–µ–љ–µ—А–∞—Ж–Є—О —В–Ї–∞–љ–µ–є.
–Ъ–Њ –≤—Б–µ–Љ —Н—В–Є–Љ —Б—А–µ–і—Б—В–≤–∞–Љ –њ—А–µ–і—К—П–≤–ї—П—О—В—Б—П –Њ–±—Й–Є–µ —В—А–µ–±–Њ–≤–∞–љ–Є—П: —И–Є—А–Њ–Ї–Є–є —Б–њ–µ–Ї—В—А –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, –љ–Є–Ј–Ї–∞—П —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М, –≥–Є–њ–Њ–∞–ї–ї–µ—А–≥–µ–љ–љ–Њ—Б—В—М, —Е–Њ—А–Њ—И–Є–µ –Њ—А–≥–∞–љ–Њ–ї–µ–њ—В–Є—З–µ—Б–Ї–Є–µ –Ї–∞—З–µ—Б—В–≤–∞. –Ю–і–љ–∞–Ї–Њ –≥–ї–∞–≤–љ—Л–Љ –њ—А–Є –±–Њ–ї–µ–≤–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ —П–≤–ї—П–µ—В—Б—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –Њ—В–µ–Ї–∞ –Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –±—Л—Б—В—А–Њ–Љ—Г —А–∞–Ј—А–µ—И–µ–љ–Є—О –Њ—Б–љ–Њ–≤–љ–Њ–є –ґ–∞–ї–Њ–±—Л – –±–Њ–ї–Є –≤ –≥–Њ—А–ї–µ [5, 10].
–Т—Л—А–∞–ґ–µ–љ–љ—Л–є –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ –њ—А–Є –Њ—Б—В—А–Њ–Љ —Д–∞—А–Є–љ–≥–Є—В–µ –Њ–±—К—П—Б–љ—П–µ—В—Б—П –±–Њ–≥–∞—В—Б—В–≤–Њ–Љ –Є–љ–љ–µ—А–≤–∞—Ж–Є–Є –≥–ї–Њ—В–Ї–Є [8, 15]. –У–ї–Њ—В–Ї–∞ –њ–Њ–ї—Г—З–∞–µ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Г—О, –і–≤–Є–≥–∞—В–µ–ї—М–љ—Г—О –Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Г—О –Є–љ–љ–µ—А–≤–∞—Ж–Є—О –Є–Ј –≥–ї–Њ—В–Њ—З–љ–Њ–≥–Њ —Б–њ–ї–µ—В–µ–љ–Є—П, —А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–µ–≥–Њ—Б—П –љ–∞ –љ–∞—А—Г–ґ–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б—А–µ–і–љ–µ–≥–Њ —Б—Д–Є–љ–Ї—В–µ—А–∞ –≥–ї–Њ—В–Ї–Є –њ–Њ–і —Й–µ—З–љ–Њ-–≥–ї–Њ—В–Њ—З–љ–Њ–є —Д–∞—Б—Ж–Є–µ–є. –≠—В–Њ —Б–њ–ї–µ—В–µ–љ–Є–µ —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –Ј–∞ —Б—З–µ—В –≤–µ—В–≤–µ–є —П–Ј—Л–Ї–Њ–≥–ї–Њ—В–Њ—З–љ–Њ–≥–Њ –Є –±–ї—Г–ґ–і–∞—О—Й–µ–≥–Њ –љ–µ—А–≤–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –≤–Њ–ї–Њ–Ї–Њ–љ –≤–µ—А—Е–љ–µ–≥–Њ —И–µ–є–љ–Њ–≥–Њ –≥–∞–љ–≥–ї–Є—П. –І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–∞—П –Є–љ–љ–µ—А–≤–∞—Ж–Є—П –≥–ї–Њ—В–Ї–Є –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —П–Ј—Л–Ї–Њ–≥–ї–Њ—В–Њ—З–љ—Л–Љ –љ–µ—А–≤–Њ–Љ, –Њ–і–љ–∞–Ї–Њ –≤ –Њ–±–ї–∞—Б—В–Є –≥–ї–Њ—В–Њ—З–љ—Л—Е —Г—Б—В—М–µ–≤ —Б–ї—Г—Е–Њ–≤—Л—Е —В—А—Г–± –Є–Љ–µ—О—В—Б—П –љ–µ—А–≤–љ—Л–µ —Б–≤—П–Ј–Є —Б–Њ –≤—В–Њ—А–Њ–є –≤–µ—В–≤—М—О —В—А–Њ–є–љ–Є—З–љ–Њ–≥–Њ –љ–µ—А–≤–∞. –Т –Є–љ–љ–µ—А–≤–∞—Ж–Є–Є –≥–Њ—А—В–∞–љ–Њ–≥–ї–Њ—В–Ї–Є —В–∞–Ї–ґ–µ –њ—А–Є–љ–Є–Љ–∞–µ—В —Г—З–∞—Б—В–Є–µ –≤–µ—А—Е–љ–Є–є –≥–Њ—А—В–∞–љ–љ—Л–є –љ–µ—А–≤ – –≤–µ—В–≤—М –±–ї—Г–ґ–і–∞—О—Й–µ–≥–Њ –љ–µ—А–≤–∞. –С–Њ–≥–∞—В—Б—В–≤–Њ –љ–µ—А–≤–љ—Л—Е —Б–≤—П–Ј–µ–є –Њ–±—К—П—Б–љ—П–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є—А—А–∞–і–Є–∞—Ж–Є–Є –±–Њ–ї–Є –њ—А–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –≥–ї–Њ—В–Ї–Є –≤ —Г—Е–Њ, –љ–Є–ґ–љ—О—О —З–µ–ї—О—Б—В—М –Є —В.–і. –Ґ–∞–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ, –Ї–∞–Ї –±–Њ–ї—М –≤ –≥–Њ—А–ї–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В –Љ–љ–Њ–≥–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≥–ї–Њ—В–Ї–Є, –≥–Њ—А—В–∞–љ–Є, –љ–Њ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Є –і—А—Г–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Њ—А–≥–∞–љ–Њ–≤ –Є —Б–Є—Б—В–µ–Љ [15].
–Т —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —Б—В–∞—А—В–Њ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –љ–µ–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В–∞ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —В–Њ–њ–Є—З–µ—Б–Ї–Є–µ –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–Э–Я–Т–Я) –і–ї—П –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤ –≥–ї–Њ—В–Ї–µ. –Ю–±—Й–µ–Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –Є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –≥—А—Г–њ–њ—Л –Э–Я–Т–Я —Б–≤—П–Ј–∞–љ–Њ —Б —Г–≥–љ–µ—В–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–µ—А–Љ–µ–љ—В–∞ —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л (–¶–Ю–У). –°—Г—Й–µ—Б—В–≤—Г—О—В 2 —Д–Њ—А–Љ—Л –¶–Ю–У: –Ї–Њ–љ—Б—В–Є—В—Г—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П (–¶–Ю–У-1), –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Ї–Њ—В–Њ—А–Њ–є –Њ–±—А–∞–Ј—Г—О—В—Б—П «–≥–Њ–Љ–µ–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є–µ» –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ—Л (I2, –Х2, —В—А–Њ–Љ–±–Њ–Ї—Б–∞–љ –Р2); –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П (–¶–Ю–У-2), –њ–Њ—П–≤–ї—П—О—Й–∞—П—Б—П —В–Њ–ї—М–Ї–Њ –њ—А–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–Є –Є —В–∞–Ї–ґ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—О—Й–∞—П —Б–Є–љ—В–µ–Ј –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤, –љ–Њ «–њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е», –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є—Е –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ. –Ш–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ –¶–Ю–У-2 –Њ–±—К—П—Б–љ—П—О—В—Б—П –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –Є –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–Є–µ –¶–Ю–У-1 —Б–Њ–Ј–і–∞–µ—В –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Є –і–ї—П –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є—Е –њ–Њ–±–Њ—З–љ—Л—Е –і–µ–є—Б—В–≤–Є–є.
–І—В–Њ–±—Л –Є–Ј–±–µ–ґ–∞—В—М —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Э–Я–Т–Я –Є –њ—А–Є —Н—В–Њ–Љ –Њ–±–µ—Б–њ–µ—З–Є—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Л–є –Ї–Њ–љ—В–∞–Ї—В –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ —Б–Њ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ –Є –≥–ї–Њ—В–Ї–Є, —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л –Э–Я–Т–Я –≤ –≤–Є–і–µ —В–∞–±–ї–µ—В–Њ–Ї –і–ї—П —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є—П —Б —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –љ–Є–Ј–Ї–Є—Е –і–Њ–Ј –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –≤ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Д–Њ—А–Љ–µ. –Я—А–Є–Љ–µ—А–Њ–Љ —В–∞–Ї–Њ–є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Д–Њ—А–Љ—Л –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –Э–Я–Т–Я –Љ–µ—Б—В–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –і–ї—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –±–Њ–ї–µ–є –≤ –≥–Њ—А–ї–µ —Д–ї—Г—А–±–Є–њ—А–Њ—Д–µ–љ –њ–Њ 8,75 –Љ–≥ –≤ –≤–Є–і–µ —В–∞–±–ї–µ—В–Њ–Ї –і–ї—П —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є—П – –°—В—А–µ–њ—Б–Є–ї—Б® –Ш–љ—В–µ–љ—Б–Є–≤. –С—Г–і—Г—З–Є –Э–Я–Т–Я, –Њ–±–ї–∞–і–∞—О—Й–Є–Љ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –°—В—А–µ–њ—Б–Є–ї—Б® –Ш–љ—В–µ–љ—Б–Є–≤ –і–µ–є—Б—В–≤—Г–µ—В –љ–∞ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –µ–≥–Њ —Н—В–Є–Њ–ї–Њ–≥–Є–Є (–≤–Є—А—Г—Б—Л –Є–ї–Є –±–∞–Ї—В–µ—А–Є–Є).
–Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞ –°—В—А–µ–њ—Б–Є–ї—Б® –Ш–љ—В–µ–љ—Б–Є–≤ —П–≤–ї—П—О—В—Б—П:
– —Г–љ–Є–Ї–∞–ї—М–љ–∞—П —Д–Њ—А–Љ—Г–ї–∞ —Б –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –і–ї—П –Љ–µ—Б—В–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і–Њ–Ј–Њ–є —Д–ї—Г—А–±–Є–њ—А–Њ—Д–µ–љ–∞ 8,75 –Љ–≥*;
– –±—Л—Б—В—А–Њ–µ –і–µ–є—Б—В–≤–Є–µ (–љ–∞—З–∞–ї–Њ –і–µ–є—Б—В–≤–Є—П – —З–µ—А–µ–Ј 2 –Љ–Є–љ., –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ – —З–µ—А–µ–Ј 15 –Љ–Є–љ.), –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М – –±–Њ–ї–µ–µ 3 —З;
– —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—В–µ—З–љ–Њ—Б—В–Є —В–Ї–∞–љ–µ–є –≥–ї–Њ—В–Ї–Є –Є –Њ–±–ї–µ–≥—З–µ–љ–Є–µ –≥–ї–Њ—В–∞–љ–Є—П –љ–∞ —Б—А–Њ–Ї –і–Њ 4–6 —З;
– —Г–і–Њ–±–љ–∞—П —Д–Њ—А–Љ–∞ —В–∞–±–ї–µ—В–Ї–Є –і–ї—П —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є—П.
–Я—А–µ–њ–∞—А–∞—В —Б–ї–µ–і—Г–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —Г –≤–Ј—А–Њ—Б–ї—Л—Е –Є –і–µ—В–µ–є —Б—В–∞—А—И–µ 12 –ї–µ—В –њ–Њ 1 —В–∞–±–ї–µ—В–Ї–µ –і–ї—П —А–∞—Б—Б–∞—Б—Л–≤–∞–љ–Є—П –Ї–∞–ґ–і—Л–µ 2–3 —З –і–Њ –Њ–±–ї–µ–≥—З–µ–љ–Є—П –±–Њ–ї–Є. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —Б—Г—В–Њ—З–љ–∞—П –і–Њ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 5 —В–∞–±–ї–µ—В–Њ–Ї. –Ш—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —А–∞—Б—Б–∞—Б—Л–≤–∞—В—М –і–Њ –њ–Њ–ї–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П. –Т–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ –Ї—Г–Љ—Г–ї—П—Ж–Є–Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –љ–µ —Б–ї–µ–і—Г–µ—В –њ—А–Є–Љ–µ–љ—П—В—М –°—В—А–µ–њ—Б–Є–ї—Б® –Ш–љ—В–µ–љ—Б–Є–≤ –±–Њ–ї–µ–µ 3-—Е —Б—Г—В.
–Ш–Љ–µ–љ–љ–Њ —В–Њ–њ–Є—З–µ—Б–Ї–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Э–Я–Т–Я –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ј–∞ —Б—З–µ—В –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Є —Е–Њ—А–Њ—И–µ–≥–Њ —В–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Њ—Б—В—А—Л—Е —В–Њ–љ–Ј–Є–ї–ї–Њ—Д–∞—А–Є–љ–≥–Є—В–Њ–≤ –і–Њ–ї–ґ–љ–∞ –Њ—Б–љ–Њ–≤—Л–≤–∞—В—М—Б—П –љ–∞ —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤—Л—Е –Љ–µ—В–Њ–і–Є–Ї–∞—Е, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –љ–∞ –≤—Л—П–≤–ї–µ–љ–Є–Є –∞–љ—В–Є–≥–µ–љ–∞ –Ї –С–°–У–Р (—Б–Є—Б—В–µ–Љ–∞ –°—В—А–µ–њ—В–∞—В–µ—Б—В) –і–ї—П —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Б–Є—Б—В–µ–Љ–љ–Њ–є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ь–µ—Б—В–љ–∞—П —В–µ—А–∞–њ–Є—П –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –љ–∞–њ—А–∞–≤–ї–µ–љ–∞ –љ–∞ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї—Г—О –ї–Є–Ї–≤–Є–і–∞—Ж–Є—О –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –Њ—В–µ–Ї–∞ –≤ –њ–Њ–ї–Њ—Б—В–Є –≥–ї–Њ—В–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ –≤—Л–Ј—Л–≤–∞—О—В –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ, –њ—Г—В–µ–Љ —В–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Э–Я–Т–Я —Б –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –≤–µ—Й–µ—Б—В–≤–∞ (–њ—А–µ–њ–∞—А–∞—В –°—В—А–µ–њ—Б–Є–ї—Б® –Ш–љ—В–µ–љ—Б–Є–≤).
* –Я–Њ –і–∞–љ–љ—Л–Љ IMS Health –Њ—В 15 –Љ–∞—А—В–∞ 2013 –≥. –°—В—А–µ–њ—Б–Є–ї—Б® –Ш–љ—В–µ–љ—Б–Є–≤ —П–≤–ї—П–µ—В—Б—П –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –Њ—В –±–Њ–ї–Є –≤ –≥–Њ—А–ї–µ —Б —Д–ї—Г—А–±–Є–њ—А–Њ—Д–µ–љ–Њ–Љ, –Њ–±—А–∞—Й–∞—О—Й–Є–Љ—Б—П –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є–Є –†–§.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –С–Њ–є–Ї–Њ–≤–∞ –Э.–≠. –Ю—Б—В—А—Л–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≥–ї–Њ—В–Ї–Є –Є –≥–Њ—А—В–∞–љ–Є // Consilium medicum. 2000. –Ґ. 2. вДЦ 8. –°. 332–337.
2. –У–∞—А–∞—Й–µ–љ–Ї–Њ –Ґ.–Ш. –Ь–∞–Ї—А–Њ–ї–Є–і—Л –≤ —В–µ—А–∞–њ–Є–Є –Њ—Б—В—А–Њ–≥–Њ —В–Њ–љ–Ј–Є–ї–ї–Є—В–∞ –Є –µ–≥–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Г –і–µ—В–µ–є // –†–Ь–Ц.. 2001. –Ґ. 9. вДЦ 19. –°. 8126.
3. –У—А–∞—Д—Б–Ї–∞—П –Э.–Р. –Ъ–Њ—А—А–µ–Ї—Ж–Є—П –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –і–Є—Б–±–∞–ї–∞–љ—Б–∞ –≥–ї–Њ—В–Ї–Є –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е —Д–∞—А–Є–љ–≥–Є—В–∞—Е // –Э–Њ–≤–Њ—Б—В–Є –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А–Є–љ–≥–Њ–ї–Њ–≥–Є–Є –Є –ї–Њ–≥–Њ–њ–∞—В–Њ–ї–Њ–≥–Є–Є. 2002. вДЦ 1. –°. 6–8.
4. –Ф–≤–Њ—А–µ—Ж–Ї–Є–є –Ы.–Ш., –ѓ–Ї–Њ–≤–ї–µ–≤ –°.–Т. –Ю—И–Є–±–Ї–Є –≤ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –≤ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ // –Ы–µ—З–∞—Й–Є–є –≤—А–∞—З. 2003. вДЦ 8. –°. 34–37.
5. –Х–≥–Њ—А–Њ–≤–∞ –Ю.–Р. –¶–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–µ—Б—В–љ—Л—Е –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–є –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є // –§–∞—А–Љ–∞—В–µ–Ї–∞. 2006. вДЦ 5. –°. 107–109.
6. –Ш–Ј–≤–Є–љ –Р.–Ш., –Ъ–∞—В–∞–µ–≤–∞ –Ы.–Т. –Ь–Є–Ї—А–Њ–±–љ—Л–є –њ–µ–є–Ј–∞–ґ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –≤ –љ–Њ—А–Љ–µ –Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Ь., 2009. 138 —Б.
7. –Ъ–Њ–Ј–ї–Њ–≤ –†.–°. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—П // –Р–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–∞—П —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П. 2006. –Ґ. 8 (1). –°. 33–47.
8. –Ъ—Г–Ї—Г—И–Ї–Є–љ –Ь.–Ы. –Я–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –±–Њ–ї–µ–≤—Л—Е —Б–Є–љ–і—А–Њ–Љ–Њ–≤ // –С–Њ–ї—М. 2003. вДЦ 1. –°. 5–12.
9. –Ы–Њ–њ–∞—В–Є–љ –Р.–°. –Ы–µ—З–µ–љ–Є–µ –Њ—Б—В—А–Њ–≥–Њ –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Д–∞—А–Є–љ–≥–Є—В–∞ // –†–Ь–Ц. 2001. –Ґ. 9. вДЦ 16–17. –°. 765–769.
10. –Ы–Њ–њ–∞—В–Є–љ –Р.–°. –Ь–µ—Б—В–љ—Л–µ –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –≤ –ї–µ—З–µ–љ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–є –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є // –Ъ–Р–•. 2000. –Ґ. 2. вДЦ 2.
11. –Ы—Г—З—И–µ–≤–∞ –Ѓ.–Т., –Ш–Ј–Њ—В–Њ–≤–∞ –У.–Э. –Ь–µ—Б—В–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–Є —Д–∞—А–Є–љ–≥–Є—В–µ // –†–Ь–Ц. 2011. –Ґ. 19. вДЦ 6 (400). –°. 420–426.
12. –Ь–∞–≥–Њ–Љ–µ–і–Њ–≤ –Ь.–Ь., –Ъ—А—О–Ї–Њ–≤ –Р.–Ш., –£–Ј–і–µ–љ–љ–Є–Ї–Њ–≤ –Р.–Р. –°—В—А–µ–њ—Б–Є–ї—Б –њ–ї—О—Б –≤ –ї–µ—З–µ–љ–Є–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≥–ї–Њ—В–Ї–Є // –Т–µ—Б—В–љ–Є–Ї –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А–Є–љ–≥–Њ–ї–Њ–≥–Є–Є. 1999. вДЦ 1. –°. 51–52.
13. –Ю–≤—З–Є–љ–љ–Є–Ї–Њ–≤ –Ѓ.–Ь., –Ы–µ–≤–Є–љ –Р.–Ь., –§–Є—В–Є–ї–µ–≤ –°.–С. –Ь–µ—Б—В–љ–∞—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –≤ –ї–µ—З–µ–љ–Є–Є –Њ—Б—В—А—Л—Е —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є // –Ы–µ—З–∞—Й–Є–є –≤—А–∞—З. 2000. вДЦ 4. –°. 2–5.
14. –Я–ї—Г–ґ–љ–Є–Ї–Њ–≤ –Ь.–°., –Я–∞–љ–Њ–≤–∞ –Э.–Т., –Ы–µ–≤–Є–љ –Ь.–ѓ., –Ы–∞–≤—А–µ–љ–Њ–≤–∞ –У.–Т., –Р—Д–∞–љ–∞—Б—М–µ–≤–∞ –Ш.–Р. –§–∞—А–Є–љ–≥–Є—В (–Ї–ї–Є–љ–Є–Ї–Њ-–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л –Є –Ї—А–Є–Њ—Е–Є—А—Г—А–≥–Є—П) / –њ–Њ–і —А–µ–і. –Ь.–°. –Я–ї—Г–ґ–љ–Є–Ї–Њ–≤–∞. –°–Я–±.: –Ф–Є–∞–ї–Њ–≥, 2006. 120 —Б.
15. –†—П–±–Њ–≤–∞ –Ь.–Р. –С–Њ–ї—М –≤ –≥–Њ—А–ї–µ — –≤—Б–µ–≥–і–∞ –ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є? // –°–њ—А–∞–≤–Њ—З–љ–Є–Ї –њ–Њ–ї–Є–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤—А–∞—З–∞. 2010. вДЦ 1. –°. 32–37.
16. –®–њ—Л–љ–µ–≤ –Ъ.–Т., –Ъ—А–µ—З–Є–Ї–Њ–≤ –Т.–Р. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ–Њ–і—Е–Њ–і—Л –Ї –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–≥–Њ —Д–∞—А–Є–љ–≥–Є—В–∞ // –Ъ–Ь–Р–•. 2007. –Ґ. 9 (1). –°. 20–33.
17. Alan L. Acute pharyngitis: etiology and diagnosis // Pediatrics. 1996. –†. 949–954.
18. Dewhirst F.E., Chen T., Izard J. et al. The Human Oral Microbiome // Journ. Bacteriol. 2010. Vol. 192. N. 19. P. 5002–5017.
19. Lasseter G.M., McNulty C.A., Richard Hobbs F.D. In vitro evaluation of five rapid antigen detection tests for group A beta-haemolytic streptococcal sore throat infections // Fam Pract. 2009 Dec. Vol. 26 (6). –†. 437–444.
20. Pechera J.C. Clinical presentation of pharyngitis. Acute bacterial pharyngitis. Cambridge Publications, 1994.
21. The Human Oral Microbiome Database: a web accessible resource for investigating oral microbe taxonomic and genomic information // Chen T., Yu W.H., Izard J. et al. Database. Vol. 2010. Article ID baq13, doi:10/database/baq013.
22. Steele R.W., Kearns G.L. –Рntimicrobial therapy for pediatric patients // Pediatric Clinics of
North America. 1989. Oct. Vol. 36. N. 5. P. 1321–1349.












