–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–∞–ї–Є—З–Є–µ –Њ–±—Й–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞, –і–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ –Љ–Њ–Љ–µ–љ—В–∞ –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е –Ї—А—Г–≥–∞—Е –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–ї–∞—Б—М –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П –≤–Ј–∞–Є–Љ–Њ–Є—Б–Ї–ї—О—З–µ–љ–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б–µ—А–і—Ж–∞ (–Ш–С–°) –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –ї–µ–≥–Ї–Є—Е, —Е–Њ—В—П –±—Л–ї–∞ –і–∞–≤–љ–Њ –Є –≥–ї—Г–±–Њ–Ї–Њ –Є–Ј—Г—З–µ–љ–∞ —А–Њ–ї—М —В–∞–±–∞–Ї–Њ–Ї—Г—А–µ–љ–Є—П –≤ —Н—В–Є–Њ–њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Н—В–Є—Е –±–Њ–ї–µ–Ј–љ–µ–є [3, 5]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є INTERHEART, –љ–∞–њ—А–Є–Љ–µ—А, –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤—В–Њ—А—Л–Љ –њ–Њ –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ш–С–° —П–≤–ї—П–µ—В—Б—П –Ї—Г—А–µ–љ–Є–µ, —Г—Б—В—Г–њ–∞—П —В–Њ–ї—М–Ї–Њ –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є–Є [39]. –Ґ–∞–±–∞–Ї–Њ–Ї—Г—А–µ–љ–Є–µ – –Њ—Б–љ–Њ–≤–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Д–∞–Ї—В–Њ—А, –і–ї—П –Ї–Њ—В–Њ—А–Њ–≥–Њ –і–Њ–Ї–∞–Ј–∞–љ–∞ –њ—А—П–Љ–∞—П —Б–≤—П–Ј—М —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –•–Ю–С–Ы [12]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ–і–Є–љ –Є —В–Њ—В –ґ–µ —Д–∞–Ї—В–Њ—А —П–≤–ї—П–µ—В—Б—П –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–Љ –≤ —А–∞–Ј–≤–Є—В–Є–Є 2-—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –љ–∞–Ї–Њ–њ–ї–µ–љ–љ—Л–µ –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –Љ–Њ–Љ–µ–љ—В—Г –і–∞–љ–љ—Л–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В –≥–Њ–≤–Њ—А–Є—В—М –Њ —В–Њ–Љ, —З—В–Њ –Ш–С–° –Ї–Њ–Љ–Њ—А–±–Є–і–љ–∞ –•–Ю–С–Ы –і–∞–ґ–µ –±–µ–Ј –∞–љ–∞–Љ–љ–µ–Ј–∞ –Ї—Г—А–µ–љ–Є—П, –Є –љ–∞–ї–Є—З–Є–µ –њ–Њ—Б–ї–µ–і–љ–µ–є –Љ–Њ–ґ–љ–Њ —А–∞—Б—Ж–µ–љ–Є–≤–∞—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ —Д–∞–Ї—В–Њ—А–∞ —А–Є—Б–Ї–∞ –Ї–∞–Ї –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –Ш–С–°, —В–∞–Ї –Є –і–ї—П –µ–µ –њ—А–Њ–≥–љ–Њ–Ј–∞.
–Т –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б —Г—З–∞—Б—В–Є–µ–Љ 1861 –њ–∞—Ж–Є–µ–љ—В–∞ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —А–Є—Б–Ї —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–Є–Ј–Ї–Є–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Њ–±—К–µ–Љ–∞ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤—Л–і–Њ—Е–∞ –Ј–∞ 1 —Б (–Ю–§–Т1) –±—Л–ї –±–Њ–ї–µ–µ —З–µ–Љ –≤–і–≤–Њ–µ –≤—Л—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –Ю–§–Т1, –њ—А–Є —Н—В–Њ–Љ –Њ–љ –љ–µ –Ј–∞–≤–Є—Б–µ–ї –Њ—В —Б—В–∞—В—Г—Б–∞ –Ї—Г—А–µ–љ–Є—П [29]. –Я–Њ—Е–Њ–ґ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –≤ –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–Љ –Є –У–Њ—В–µ–љ–±—Г—А–≥—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е [23, 30]. Jousilahti et al. –љ–∞ –±–Њ–ї—М—И–Њ–є –≤—Л–±–Њ—А–Ї–µ (19 444 –њ–∞—Ж–Є–µ–љ—В–∞) –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ —Б—А–Њ–Ї–µ –љ–∞–±–ї—О–і–µ–љ–Є—П (13 –ї–µ—В) –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –±—А–Њ–љ—Е–Є—В —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –Ш–С–° –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –љ–∞–ї–Є—З–Є—П –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞ [15].
D. Sin, S. Man, –Њ–±–Њ–±—Й–∞—П –і–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Г–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Ю–§–Т1 –љ–∞ 10% —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–∞ 28%, –∞ –љ–µ—Д–∞—В–∞–ї—М–љ—Л—Е –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е —Б–Њ–±—Л—В–Є–є – –љ–∞ 20% [28]. –Ю—Б–Њ–±—Г—О –Њ–±–µ—Б–њ–Њ–Ї–Њ–µ–љ–љ–Њ—Б—В—М –њ–Њ–і–Њ–±–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤—Л–Ј—Л–≤–∞—О—В –≤ —Б–ї—Г—З–∞—П—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –±–∞–Ј–Є—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ш–С–°, –Ї–Њ—В–Њ—А–∞—П, –Ї–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –і–Њ–ї–ґ–љ–∞ –≤–Ї–ї—О—З–∞—В—М β-–±–ї–Њ–Ї–∞—В–Њ—А—Л [11], —В. –Ї. –Є—Е –і–ї–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–Њ–ґ–µ—В —Г—Е—Г–і—И–∞—В—М –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Д—Г–љ–Ї—Ж–Є–Є –≤–љ–µ—И–љ–µ–≥–Њ –і—Л—Е–∞–љ–Є—П, –∞ –Ј–љ–∞—З–Є—В, –Є —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–є —А–Є—Б–Ї. –Т —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Stefan et al. –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —В–µ—А–∞–њ–Є—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –°–°–° —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ–Є –Є –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ–Є –±–ї–Њ–Ї–∞—В–Њ—А–∞–Љ–Є, –±—Л–ї–Њ —З–µ—В–Ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ 2-–є –≥—А—Г–њ–њ—Л –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–ї —А–Є—Б–Ї –њ–Њ–≤—В–Њ—А–љ–Њ–є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –≤ –±–ї–Є–ґ–∞–є—И–Є–µ 30 –і–љ–µ–є [31].
–Ы.–Ш. –Ъ–Њ–Ј–ї–Њ–≤–∞ –Є —Б–Њ–∞–≤—В. –≤ –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є, —З—В–Њ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –і—Л—Е–∞–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–є β-–±–ї–Њ–Ї–∞—В–Њ—А –∞—В–µ–љ–Њ–ї–Њ–ї, –±—Л–ї–Є –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–ї–Є –±—Л—Б—В—А–µ–µ, –љ–µ–ґ–µ–ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –љ–Є–Ї–∞–Ї–Є—Е β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤. –°—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –Є —Б—А–µ–і–љ–µ–≥–Њ–і–Є—З–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—Б–љ–Њ–≤–љ—Л—Е —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤: –Ю–§–Т1 –Є –ґ–Є–Ј–љ–µ–љ–љ–Њ–є –µ–Љ–Ї–Њ—Б—В–Є –ї–µ–≥–Ї–Є—Е, —А–∞–љ—М—И–µ –≤—Л—П–≤–ї—П–ї–Є—Б—М –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –Љ–µ–ї–Ї–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є: —Н–Ї—Б–њ–Є—А–∞—В–Њ—А–љ—Л–є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–є –Ї–Њ–ї–ї–∞–њ—Б –Є —А–∞–љ–љ–µ–µ —Н–Ї—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–µ –Ј–∞–Ї—А—Л—В–Є–µ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є. –£–Ї–∞–Ј–∞–љ–љ—Л–µ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –њ—А–Њ—П–≤–ї—П–ї–Є—Б—М –≤ —А–∞–Ј–ї–Є—З–љ—Л–µ –≤—А–µ–Љ–µ–љ–љ—Л–µ –њ–µ—А–Є–Њ–і—Л – –Њ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–љ–µ–є –і–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –ї–µ—В –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ [1].
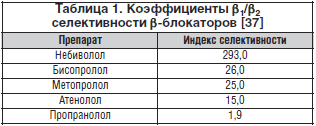
–°—Г—Й–µ—Б—В–≤—Г–µ—В –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–∞—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М, —З—В–Њ —Б—В–Њ–ї—М –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л –Є–Ј-–Ј–∞ —В–Њ–≥–Њ, —З—В–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –∞—В–µ–љ–Њ–ї–Њ–ї, –Є–Љ–µ—О—Й–Є–є –љ–µ–≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Ї–∞—А–і–Є–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є (—В–∞–±–ї. 1). –С–Њ–ї–µ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –±–ї–Њ–Ї–∞—В–Њ—А—Л —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–Є—И–µ–љ—Л –њ–Њ–і–Њ–±–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є –і–∞–ґ–µ, –љ–∞–Њ–±–Њ—А–Њ—В, —Б–љ–Є–ґ–∞—О—В —Г—А–Њ–≤–µ–љ—М –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–Є –•–Ю–С–Ы. –≠—В–Њ –љ–∞—И–ї–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е [10, 20]. –Ю–і–љ–∞–Ї–Њ –љ–µ–±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–Њ–і–Њ–±–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–∞ –љ–µ–±–Њ–ї—М—И–Є—Е –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б—З–Є—В–∞—В—М –і–∞–љ–љ—Л–є –≤–Њ–њ—А–Њ—Б –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ—А–Њ—А–∞–±–Њ—В–∞–љ–љ—Л–Љ –Є –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В —Б–Њ–±–ї—О–і–µ–љ–Є–µ –љ–∞—Б—В–Њ—А–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤.
–Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –љ–Њ–≤—Л–µ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В –Ј–љ–∞—З–Є–Љ—Г—О —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ –∞—Н—А–Њ–њ–Њ–ї–ї—О—В–∞–љ—В–Њ–≤ –љ–∞ –і—Л—Е–∞—В–µ–ї—М–љ—Л–µ –њ—Г—В–Є –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ [19]. –Ю—Б–љ–Њ–≤–Њ–є –і–ї—П –њ–Њ–і–Њ–±–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ—Б–ї—Г–ґ–Є–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –Љ–Њ–і–µ–ї—П—Е. Suwa et al. –≤ —В–µ—З–µ–љ–Є–µ 4 –љ–µ–і. –њ–Њ–і–≤–µ—А–≥–∞–ї–Є –Ї—А–Њ–ї–Є–Ї–Њ–≤ —Б –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–µ–є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О –∞—Н—А–Њ–њ–Њ–ї–ї—О—В–∞–љ—В–Њ–≤, –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л—Е —В–µ–Љ, –Ї–Њ—В–Њ—А—Л–µ –Њ—В–Љ–µ—З–∞—О—В—Б—П –≤ –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ—Л—Е –≥–Њ—А–Њ–і–∞—Е. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є, –≤ –Ї–Њ—В–Њ—А–Њ–є –Ї—А–Њ–ї–Є–Ї–Є –њ–Њ–і–≤–µ—А–≥–∞–ї–Є—Б—М –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О –њ–∞—А–Њ–≤ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –±—Л–ї –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ —А–Њ—Б—В –Њ–±—К–µ–Љ–∞ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –±–ї—П—И–µ–Ї –≤ –Ї–Њ—А–Њ–љ–∞—А–љ—Л—Е –∞—А—В–µ—А–Є—П—Е –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 71%. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –њ—А–Є–Ј–љ–∞–Ї–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ —В–Ї–∞–љ–Є –ї–µ–≥–Ї–Є—Е –Є —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞, –њ—А–Є—З–µ–Љ –Њ–±—К–µ–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –±–ї—П—И–µ–Ї –±—Л–ї –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї–µ–љ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [33]. –Т–∞–ґ–љ–Њ –Є —В–Њ, —З—В–Њ –±–ї—П—И–Ї–Є —Г –Ї—А–Њ–ї–Є–Ї–Њ–≤ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–є –≥—А—Г–њ–њ–µ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є (–Є—Б—В–Њ–љ—З–µ–љ–Є–µ –њ–Њ–Ї—А—Л—И–Ї–Є, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Њ–±—К–µ–Љ–∞ –ї–Є–њ–Є–і–љ–Њ–≥–Њ —П–і—А–∞, –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ —А–µ–∞–Ї—Ж–Є–Є –≤ –±–ї—П—И–Ї–µ), —З—В–Њ –≤ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г—Б—Г–≥—Г–±–ї—П–µ—В —А–Є—Б–Ї —А–∞–Ј—А—Л–≤–∞ –±–ї—П—И–Ї–Є —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–Ј–∞. –≠—В–Є –і–∞–љ–љ—Л–µ –±—Л–ї–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ—Л –Є —Г–≥–ї—Г–±–ї–µ–љ—Л Sun et al. [32]. –Т —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –њ–Њ 6 —З –≤ –і–µ–љ—М –Њ–љ–Є –њ–Њ–і–≤–µ—А–≥–∞–ї–Є –Љ–µ–ї–Ї–Њ–і–Є—Б–њ–µ—А—Б–љ–Њ –∞—Н—А–Њ–Ј–Њ–ї—М–љ–Њ–Љ—Г (2,5 –Љ–Ї–Љ) –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О –Љ—Л—И–µ–є, –љ–µ –Є–Љ–µ–≤—И–Є—Е –≥–Є–њ–µ—А—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є–Є. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –Ј–љ–∞—З–Є–Љ—Л–µ –њ—А–Є–Ј–љ–∞–Ї–Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Њ–±—К–µ–Љ–∞ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –±–ї—П—И–µ–Ї –≤ –±—А—О—И–љ–Њ–є –∞–Њ—А—В–µ.
–°—В–Њ–ї—М —А–∞–Ј–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Є –°–°–Ч, –Њ–±—К–µ–і–Є–љ–µ–љ–љ—Л—Е –ї–Є—И—М —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є –Ї–∞–Ї —В–Њ—З–Ї–Њ–є –њ—А–Є–ї–Њ–ґ–µ–љ–Є—П, –Ј–∞—Б—В–∞–≤–Є–ї–Є –≤–µ—Б—В–Є –њ–Њ–Є—Б–Ї –≤ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є —В–∞–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –ї–µ–≥–Ї–Є—Е, –Ї–Њ—В–Њ—А—Л–є –Љ–Њ–≥ –±—Л –≤—Л–Ј—Л–≤–∞—В—М –Є —Б–Є—Б—В–µ–Љ–љ—Л–є –Њ—В–≤–µ—В. –Ю –љ–∞–ї–Є—З–Є–Є —Б–Є—Б—В–µ–Љ–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ—А–Є –•–Ю–С–Ы –њ–Є—Б–∞–ї–Є –Љ–љ–Њ–≥–Є–µ –∞–≤—В–Њ—А—Л, –∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В—Л —Б —Б–Њ—З–µ—В–∞–љ–Є–µ–Љ –Ш–С–° –Є –•–Ю–С–Ы –Є–Љ–µ—О—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї—М—И—Г—О –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, —Г –Ї–Њ—В–Њ—А—Л—Е –•–Ю–С–Ы –љ–µ –Њ—В–Љ–µ—З–∞–ї–∞—Б—М.
–С—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ –і–∞–љ–љ—Л—Е –Њ —Б–≤—П–Ј–Є —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П —Б —А–Є—Б–Ї–Њ–Љ –°–°–Ч. –Э–∞–њ—А–Є–Љ–µ—А, Thomsen et al. –њ—А–Њ–≤–µ—А–Є–ї–Є –±–∞–Ј–Њ–≤—Л–є —Г—А–Њ–≤–µ–љ—М –°-—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ (–°–†–С), —Д–Є–±—А–Є–љ–Њ–≥–µ–љ–∞ –Є –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ —Г 8656 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы. –Ч–∞—В–µ–Љ –њ—А–Њ–≤–µ–ї–Є –Љ—Г–ї—М—В–Є—Д–∞–Ї—В–Њ—А–љ—Л–є –∞–љ–∞–ї–Є–Ј —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –≤ —В–µ—З–µ–љ–Є–µ 5 –ї–µ—В —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ –і—А—Г–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –С—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –≤—Б–µ—Е 3-—Е —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ (–°–†–С >3 –Љ–≥/–ї, —Д–Є–±—А–Є–љ–Њ–≥–µ–љ >14 –Љ–Ї–Љ–Њ–ї—М/–ї, –ї–µ–є–Ї–Њ—Ж–Є—В—Л >9x109/–ї) 5-–ї–µ—В–љ–Є–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ш–С–° –±—Л–ї –њ–Њ–≤—Л—И–µ–љ –≤ 2,19 —А–∞–Ј–∞, –Є–љ—Д–∞—А–Ї—В–∞ –Љ–Є–Њ–Ї–∞—А–і–∞ (–Ш–Ь) – –≤ 2,32 —А–∞–Ј–∞, —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–°–Э) – –≤ 2,63 —А–∞–Ј–∞ [35].
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ј–∞—Б—В–∞–≤–ї—П—О—В –Ј–∞–і—Г–Љ–∞—В—М—Б—П –Њ —В–Њ–Љ, —З—В–Њ —В–∞–Ї–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –≤–µ—Й–µ–є –Љ–Њ–ґ–љ–Њ —А–∞—Б—Ж–µ–љ–Є–≤–∞—В—М –Є–Љ–µ–љ–љ–Њ –Ї–∞–Ї —Б–Є–љ—В—А–Њ–њ–Є—О, –∞ –љ–µ –њ—А–Њ—Б—В–Њ–є –љ–∞–±–Њ—А –±–Њ–ї–µ–Ј–љ–µ–є, –Њ–±—К–µ–і–Є–љ–µ–љ–љ—Л—Е –Њ–і–љ–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞. –Э–∞–Ї–Њ–њ–ї–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –≤—Л–і–≤–Є–љ—Г—В—М –ї–Њ–≥–Є—З–љ—Г—О –Є –≤–Ј–≤–µ—И–µ–љ–љ—Г—О —В–µ–Њ—А–Є—О —Б–≤—П–Ј–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В—П—Е —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–µ (—А–Є—Б. 1).
–†–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л–µ –≤–љ–µ—И–љ–Є–µ –∞–≥–µ–љ—В—Л (—В–∞–±–∞—З–љ—Л–є –і—Л–Љ, –∞—Н—А–Њ–њ–Њ–ї–ї—О—В–∞–љ—В—Л, –≤–Є—А—Г—Б—Л –Є –±–∞–Ї—В–µ—А–Є–Є) –Ј–∞–њ—Г—Б–Ї–∞—О—В –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—В –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –≤ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В—П—Е, –Њ–њ–Њ—Б—А–µ–і—Г–µ–Љ—Л–є –Љ–∞–Ї—А–Њ—Д–∞–≥–∞–Љ–Є –Є –љ–µ–є—В—А–Њ—Д–Є–ї–∞–Љ–Є —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –Љ–љ–Њ–ґ–µ—Б—В–≤–∞ –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ —В—А–∞–љ—Б–ї–Њ—Ж–Є—А—Г—О—В—Б—П –Є –≤ —Б–Є—Б—В–µ–Љ–љ—Л–є –Ї—А–Њ–≤–Њ—В–Њ–Ї [16]. –І–∞—Б—В—М –Є–Ј –љ–Є—Е (—Д–∞–Ї—В–Њ—А –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є-α, –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ (–Ш–Ы) -6, –Ш–Ы-1β) –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—В –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –љ–∞ —Б–Њ—Б—Г–і–Є—Б—В—Г—О —Б—В–µ–љ–Ї—Г. –Ю–љ–Є –ґ–µ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Ш–Ы-8 –Є –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–∞—А–љ–Њ-–Љ–∞–Ї—А–Њ—Д–∞–≥–∞–ї—М–љ—Л–Љ –Ї–Њ–ї–Њ–љ–Є–µ—Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В –Ї–Њ—Б—В–љ—Л–є –Љ–Њ–Ј–≥, —Г–≤–µ–ї–Є—З–Є–≤–∞—П –≤—Л–±—А–Њ—Б –≤ —В–Њ–Ї –Ї—А–Њ–≤–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–Њ–≤ –Є –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Ш–Ы-1β –Є –Ш–Ы-6 —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–Њ –≤ –њ–µ—З–µ–љ–Є –±–µ–ї–Ї–Њ–≤ «–Њ—Б—В—А–Њ–є —Д–∞–Ј—Л» (–љ–∞–њ—А–Є–Љ–µ—А, –°–†–С) –Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤ (—Д–Є–±—А–Є–љ–Њ–≥–µ–љ, —Д–∞–Ї—В–Њ—А VIII) [21]. –Ґ–∞–Ї–Њ–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б —Н—Д—Д–µ–Ї—В–Њ–≤ —П–≤–ї—П–µ—В—Б—П –Є–і–µ–∞–ї—М–љ—Л–Љ –і–ї—П –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є —А–Њ—Б—В–∞ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–Є, –∞ –≤ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–µ – –Є –і–ї—П –µ–µ –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є (—А–Є—Б. 2). –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–µ—В —Б–µ–±—П —Б–∞–Љ, —В. –Ї. –ї–µ–є–Ї–Њ—Ж–Є—В—Л, –≤—Л–±—А–Њ—И–µ–љ–љ—Л–µ –≤ —В–Њ–Ї –Ї—А–Њ–≤–Є –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Ї–Њ—Б—В–љ—Л–Љ –Љ–Њ–Ј–≥–Њ–Љ, –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —Е–µ–Љ–Њ–∞—В—В—А–∞–Ї—В–∞–љ—В–Њ–≤ (–Ш–Ы-8 –і–ї—П –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Є –Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ—Л–є —Е–µ–Љ–Њ–∞—В—В—А–∞–Ї—В–∞–љ—В–љ—Л–є –њ—А–Њ—В–µ–Є–љ-1 –і–ї—П –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤) –њ–µ—А–µ–Љ–µ—Й–∞—О—В—Б—П –≤ –≤–Њ—Б–њ–∞–ї–µ–љ–љ—Л–µ —В–Ї–∞–љ–Є, –Ј–∞–њ—Г—Б–Ї–∞—П –љ–Њ–≤—Л–є –≤–Є—В–Њ–Ї –њ–Њ—А–Њ—З–љ–Њ–≥–Њ –Ї—А—Г–≥–∞. –Я–Њ–љ–Є–Љ–∞–љ–Є–µ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Њ—Б–љ–Њ–≤—Л –њ—А–Њ—Ж–µ—Б—Б–∞ —А–∞–Ј–≤–Є—В–Є—П –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –њ—А–Є –•–Ю–С–Ы –Є–Љ–њ–ї–µ–Љ–µ–љ—В–Є—А–Њ–≤–∞–ї–Њ—Б—М –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г: —Г–ґ–µ –њ–Њ–ї—Г—З–µ–љ—Л –њ–Њ–Ј–Є—В–Є–≤–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ —Б–љ–Є–ґ–µ–љ–Є—О —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы –Ј–∞ —Б—З–µ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Б—В–∞—В–Є–љ–Њ–≤ [26] –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, –Є–љ–≥–Є–±–Є—В–Њ—А–∞ —Д–Њ—Б—Д–Њ–і–Є—Н—Б—В–µ—А–∞–Ј—Л-4 – —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ [38].
–†–∞–Ј–≤–Є—В–Є–µ –Њ—Б—В—А—Л—Е —Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы —Б–≤—П–Ј–∞–љ–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б –Њ–±–Њ—Б—В—А–µ–љ–Є–µ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –ї–µ–≥–Ї–Є—Е, –Ї–Њ—В–Њ—А–Њ–µ –≤—Л–Ј—Л–≤–∞–µ—В –Є–ї–Є —Г—Б–Є–ї–Є–≤–∞–µ—В —Б–Є—Б—В–µ–Љ–љ—Л–є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –∞–Ї—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –Ј–∞–њ—Г—Б–Ї–∞–µ—В –њ—А–Њ—Ж–µ—Б—Б—Л –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ї–Є–њ–Є–і–Њ–≤ –Є –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤, —З—В–Њ –≤–µ–і–µ—В –Ї –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—О —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—О —З–Є—Б–ї–∞ –њ–µ–љ–Є—Б—В—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–µ. –≠—В–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –µ–µ —А–Њ—Б—В–Њ–Љ –Є –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ–Љ –і–∞–≤–ї–µ–љ–Є—П –љ–∞ –њ–Њ–Ї—А—Л—И–Ї—Г. –Р–Ї—В–Є–≤–Є–Ј–∞—Ж–Є—П –Љ–∞—В—А–Є–Ї—Б–љ—Л—Е –Љ–µ—В–∞–ї–ї–Њ–њ—А–Њ—В–µ–Є–љ–∞–Ј –≤ –±–ї—П—И–Ї–µ –≤–µ–і–µ—В –Ї –і–µ—Б—В—А—Г–Ї—Ж–Є–Є –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –Є –Є—Б—В–Њ–љ—З–µ–љ–Є—О –њ–Њ–Ї—А—Л—И–Ї–Є (–љ–µ—Б—В–∞–±–Є–ї—М–љ–∞—П –±–ї—П—И–Ї–∞) [18]. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –∞–Ї—В–Є–≤–∞—Ж–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є —Г—Б–Є–ї–Є–≤–∞–µ—В —Б–Є—Б—В–µ–Љ–љ—Л–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –Њ—В–≤–µ—В, —Г–≤–µ–ї–Є—З–Є–≤–∞—П –≤ —В–Њ–Ї–µ –Ї—А–Њ–≤–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤, –±–µ–ї–Ї–Њ–≤ –Њ—Б—В—А–Њ–є —Д–∞–Ј—Л, –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–≤ –Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤. –Ю–љ–Є, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –Є—Б—В–Њ–љ—З–µ–љ–Є—О –њ–Њ–Ї—А—Л—И–Ї–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–Є, –∞ —В–∞–Ї–ґ–µ —Г—Б–Є–ї–µ–љ–Є—О —Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є (–њ–Њ–≤—Л—И–µ–љ–Є–µ –≤—Л—А–∞–±–Њ—В–Ї–Є —Н–љ–і–Њ—В–µ–ї–Є–љ–∞-1 –Є —Б–љ–Є–ґ–µ–љ–Є–µ –≤—Л—А–∞–±–Њ—В–Ї–Є —Н–љ–і–Њ—В–µ–ї–Є–є—А–∞—Б—Б–ї–∞–±–ї—П—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞) [16]. –Я–Њ–і–Њ–±–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П —А–µ–Ј–Ї–Њ —Г–Љ–µ–љ—М—И–∞–µ—В –і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ—Л–µ —А–µ–Ј–µ—А–≤—Л –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ —А—Г—Б–ї–∞. –Ш—В–Њ–≥–Њ–Љ —В–∞–Ї–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —П–≤–ї—П–µ—В—Б—П –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —А–µ–Ј–µ—А–≤–∞, —З—В–Њ –≤–µ–і–µ—В –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ш–С–°, –∞ –Ї–∞–Ї –Љ–∞–Ї—Б–Є–Љ—Г–Љ – –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П (—А–∞–Ј—А—Л–≤ –њ–Њ–Ї—А—Л—И–Ї–Є) –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–ї—П—И–Ї–Є –Є —А–∞–Ј–≤–Є—В–Є–µ –Њ—Б—В—А–Њ–≥–Њ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–Ј–∞ [6], –≤ –∞–±—Б–Њ–ї—О—В–љ–Њ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–Є–≤–Њ–і—П—Й–µ–≥–Њ –Ї —А–∞–Ј–≤–Є—В–Є—О –Ш–Ь (—А–Є—Б. 2). –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ —П–≤–ї—П—О—В—Б—П –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–µ –љ–∞ —Д–Њ–љ–µ –Њ–±–Њ—Б—В—А–µ–љ–Є—П –•–Ю–С–Ы –љ–∞—А—Г—И–µ–љ–Є—П –≥–∞–Ј–Њ–≤–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –Ї—А–Њ–≤–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Б–Њ—З–µ—В–∞–љ–Є–Є –≥–Є–њ–Њ–Ї—Б–µ–Љ–Є–Є –Є –≥–Є–њ–µ—А–Ї–∞–њ–љ–Є–Є.
–Э–∞–Є–±–Њ–ї–µ–µ –≤–µ—А–Њ—П—В–љ—Л–є –њ–µ—А–Є–Њ–і —А–∞–Ј–≤–Є—В–Є—П —Д–∞—В–∞–ї—М–љ—Л—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–Є –•–Ю–С–Ы – –њ–µ—А–≤—Л–µ 5 –і–љ–µ–є [9]. –≠—В–Њ –і–Є–Ї—В—Г–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —В—Й–∞—В–µ–ї—М–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Ј–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–Љ, –∞ —В–∞–Ї–ґ–µ –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –њ—А–Њ–≥—А–∞–Љ–Љ—Г –ї–µ—З–µ–љ–Є—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є-–љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, —Б—В–∞—В–Є–љ—Л, –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞).
–Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Њ—В–Љ–µ—З–∞–µ—В—Б—П –Є –Њ–±—А–∞—В–љ–∞—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М, –∞ –Є–Љ–µ–љ–љ–Њ –≤–ї–Є—П–љ–Є–µ –°–°–Ч –љ–∞ —А–∞–Ј–≤–Є—В–Є–µ –Њ–±–Њ—Б—В—А–µ–љ–Є–є –•–Ю–С–Ы. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М —З–∞—Б—В–Њ—В–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–є –љ–µ —В–Њ–ї—М–Ї–Њ –≤–ї–Є—П–µ—В –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є, –љ–Њ –Є –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Њ–њ—А–µ–і–µ–ї—П–µ—В –њ—А–Њ–≥–љ–Њ–Ј –і–ї—П —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [7]. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ Lung Health Study [2], –њ—А–Є—З–Є–љ–Њ–є –Њ–±–Њ—Б—В—А–µ–љ–Є—П –•–Ю–С–Ы, —В—А–µ–±—Г—О—Й–µ–≥–Њ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є, –±–Њ–ї–µ–µ —З–µ–Љ –≤ 40% —Б–ї—Г—З–∞–µ–≤ —П–≤–Є–ї–∞—Б—М –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П –°–°–Ч, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –њ–Њ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ –њ—А–Є—З–Є–љ–∞–Љ –±—Л–ї–Њ —В–Њ–ї—М–Ї–Њ 14% –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є.
–Э–∞–Є–±–Њ–ї–µ–µ –і—А–∞–Љ–∞—В–Є—З–љ–Њ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Б–Є—В—Г–∞—Ж–Є—П –≤ —Б–ї—Г—З–∞–µ –љ–∞–ї–Є—З–Є—П –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞ —Б–µ—А–і—Ж–∞. –Ґ–∞–Ї, –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–∞—П –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Њ—З–µ—В–∞–љ–Є–µ–Љ —В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –•–Ю–С–Ы –Є –∞—А–Є—В–Љ–Є–Є –њ—А–µ–≤—Л—И–∞–µ—В 30%, –∞ —Г —В–∞–Ї–Є—Е –ґ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–Њ –±–µ–Ј –∞—А–Є—В–Љ–Є–Є – 8% [13]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В, —З—В–Њ –∞—А–Є—В–Љ–Є–Є –њ–Њ–≤—Л—И–∞—О—В –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –ї–µ–≥–Ї–Є—Е, –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л—Е –Њ—Б—В—А–Њ–є –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О [14]. –Ю—Б–Њ–±–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤—Л–і–µ–ї–Є—В—М –≤—Л—Б–Њ–Ї—Г—О –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —А–∞–Ј–≤–Є—В–Є—П —П—В—А–Њ–≥–µ–љ–љ–Њ-–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –∞—А–Є—В–Љ–Є–є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–Є—А—Г—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ш β2-–∞–≥–Њ–љ–Є—Б—В—Л, –Є –њ—А–µ–њ–∞—А–∞—В—Л –∞–Љ–Є–љ–Њ—Д–Є–ї–ї–Є–љ–∞, –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–µ –Ь-—Е–Њ–ї–Є–љ–Њ–ї–Є—В–Є–Ї–Є (–њ–Њ—Б–ї–µ–і–љ–Є–µ, –њ—А–∞–≤–і–∞, –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є) –≤—Л–Ј—Л–≤–∞—О—В —В–∞—Е–Є–Ї–∞—А–і–Є—О –Є –µ—Й–µ –±–Њ–ї—М—И–µ —Г—Б—Г–≥—Г–±–ї—П—О—В –Љ–Є–Њ–Ї–∞—А–і–Є–∞–ї—М–љ—Л–є –і–Є—Б–±–∞–ї–∞–љ—Б –і–Њ—Б—В–∞–≤–Ї–Є –Є –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –Ї–Є—Б–ї–Њ—А–Њ–і–∞, —З—В–Њ –Љ–Њ–ґ–µ—В —А–µ–Ј—Г–ї—М—В–Є—А–Њ–≤–∞—В—М—Б—П –≤ –≤–Є–і–µ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л—Е (–≤ —В. —З. –Є —Д–∞—В–∞–ї—М–љ—Л—Е) –љ–∞—А—Г—И–µ–љ–Є–є —А–Є—В–Љ–∞.
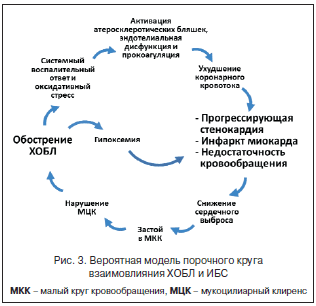
–Т—Б–µ –≤—Л—И–µ—Б–Ї–∞–Ј–∞–љ–љ–Њ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–Њ–Ј–і–∞—В—М –≤–µ—А–Њ—П—В–љ—Г—О –Ї–∞—А—В–Є–љ—Г —Б–≤–Њ–µ–Њ–±—А–∞–Ј–љ–Њ–≥–Њ –њ–Њ—А–Њ—З–љ–Њ–≥–Њ –Ї—А—Г–≥–∞ –≤–Ј–∞–Є–Љ–љ–Њ–є –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В–Є –•–Ю–С–Ы –Є –Ш–С–°. –Ю–±–Њ—Б—В—А–µ–љ–Є–µ –•–Ю–С–Ы, –≤—Л–Ј—Л–≤–∞—П —Б–Є—Б—В–µ–Љ–љ—Л–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –Њ—В–≤–µ—В –Є –Њ–Ї—Б–Є–і–∞—В–Є–≤–љ—Л–є —Б—В—А–µ—Б—Б, –≤–µ–і–µ—В –Ї —Г—Е—Г–і—И–µ–љ–Є—О –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞, –≤ –Њ—Б–љ–Њ–≤–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –ї–µ–ґ–Є—В —Б—А–∞–Ј—Г –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤: —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Њ–±—К–µ–Љ–∞ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –±–ї—П—И–µ–Ї –Є –Є—Е –і–µ—Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П, –Њ—Б—В—А—Л–є –Ї–Њ—А–Њ–љ–∞—А–љ—Л–є –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–Ј, —Б–љ–Є–ґ–µ–љ–Є–µ –≤—Л—А–∞–±–Њ—В–Ї–Є —Н–љ–і–Њ–≥–µ–љ–љ—Л—Е –≤–∞–Ј–Њ–і–Є–ї–∞—В–Є—А—Г—О—Й–Є—Е –∞–≥–µ–љ—В–Њ–≤, —Г—Е—Г–і—И–µ–љ–Є–µ —А–µ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ –Ї—А–Њ–≤–Є. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, —Б–љ–Є–ґ–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ–≥–Њ –≤—Л–±—А–Њ—Б–∞ –љ–∞ —Д–Њ–љ–µ —Г—Б—Г–≥—Г–±–ї—П—О—Й–µ–є—Б—П –Є—И–µ–Љ–Є–Є –њ—А–Є–≤–Њ–і–Є—В –Ї –Ј–∞—Б—В–Њ—О –≤ –Љ–∞–ї–Њ–Љ –Ї—А—Г–≥–µ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, —З—В–Њ –љ–∞—А—Г—И–∞–µ—В –љ–Њ—А–Љ–∞–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Љ—Г–Ї–Њ—Ж–Є–ї–Є–∞—А–љ–Њ–≥–Њ –Ї–ї–Є—А–µ–љ—Б–∞ (–Ь–¶–Ъ). –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М –љ–∞—А—Г—И–µ–љ–Є–µ –Ь–¶–Ъ —Б–њ–Њ—Б–Њ–±–љ–Њ –њ—А–Є–≤–Њ–і–Є—В—М –Ї –Њ–±–Њ—Б—В—А–µ–љ–Є—О –•–Ю–С–Ы –Ї–∞–Ї –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Г—Б–Є–ї–µ–љ–Є—П –Њ–±—Б—В—А—Г–Ї—Ж–Є–Є, —В–∞–Ї –Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Д–ї–Њ—А—Л [34], –Ї–Њ—В–Њ—А–Њ–є –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ —З–Є—Б–ї–µ —Б–ї—Г—З–∞–µ–≤ —Г —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ї–Њ–љ—В–∞–Љ–Є–љ–Є—А–Њ–≤–∞–љ–∞ —Б–ї–Є–Ј–Є—Б—В–∞—П –Њ–±–Њ–ї–Њ—З–Ї–∞ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞ (—А–Є—Б. 3).
–Ф–∞–љ–љ–∞—П —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–∞—П –Љ–Њ–і–µ–ї—М –≤–Ј–∞–Є–Љ–Њ–≤–ї–Є—П–љ–Є—П –•–Ю–С–Ы –Є –Ш–С–° –ї–Њ–≥–Є—З–љ–Њ –Њ–±—К—П—Б–љ—П–µ—В —А–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–љ–Њ–ґ–µ—Б—В–≤–∞ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—Й–Є—Е –≤–Ј–∞–Є–Љ–љ–Њ–µ —Г—Б—Г–≥—Г–±–ї–µ–љ–Є–µ —В–µ—З–µ–љ–Є—П —Н—В–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –Њ—В –љ–Є—Е. Berger et al. –њ—А–Є 3-–ї–µ—В–љ–µ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є –Ј–∞ 4284 –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є —Б –Ш–С–° —Г–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–∞—П —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы —Б–Њ—Б—В–∞–≤–Є–ї–∞ 21% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б 9% —Б—А–µ–і–Є —В–µ—Е, —Г –Ї–Њ–≥–Њ –•–Ю–С–Ы –љ–µ –±—Л–ї–Њ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–∞–ї–Є—З–Є–µ –•–Ю–С–Ы –±—Л–ї–Њ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –і–≤—Г–Ї—А–∞—В–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –≤ –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–є –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–µ [4]. Curkendall et al., –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–≤ –і–∞–љ–љ—Л–µ 11 493 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы, –њ—А–Є—И–ї–Є –Ї –≤—Л–≤–Њ–і—Г, —З—В–Њ –Њ–љ–Є –Є–Љ–µ–ї–Є –±–Њ–ї—М—И–Є–є (–≤ 2–4 —А–∞–Ј–∞) —А–Є—Б–Ї —Б–Љ–µ—А—В–Є –Њ—В –°–°–Ч –њ—А–Њ—В–Є–≤ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л—Е –і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –≥—А—Г–њ–њ, –љ–µ –Є–Љ–µ—О—Й–Є—Е –•–Ю–С–Ы. –Ю—Б–Њ–±–µ–љ–љ–Њ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ —А–Є—Б–Ї–∞ –Ј–∞—Б—В–Њ–є–љ–Њ–є –°–Э, –∞—А–Є—В–Љ–Є–є –Є –Ш–Ь [8].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Є–Љ–њ–ї–µ–Љ–µ–љ—В–∞—Ж–Є—П –њ–Њ–љ–Є–Љ–∞–љ–Є—П —Б–Є–љ—В—А–Њ–њ–Є–Є –•–Ю–С–Ы –Є –Ш–С–° –Ї—А–∞–є–љ–µ –≤–∞–ґ–љ–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П —Г–ї—Г—З—И–µ–љ–Є—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б —Ж–µ–ї—М—О –≤—Л—П–≤–ї–µ–љ–Є—П –≤—Л—Б–Њ–Ї–Њ–≤–µ—А–Њ—П—В–љ–Њ–≥–Њ –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–Њ –Є –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –Є –ї–µ—З–µ–±–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ —Д–∞—В–∞–ї—М–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є, –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –њ—А–Њ–≥—А–∞–Љ–Љ–∞–Љ –ї–µ—З–µ–љ–Є—П. –°—А–µ–і–Є –љ–Є—Е: –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б—В–∞—В–Є–љ–Њ–≤ –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—А–Њ–≤–љ—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–µ–Љ–Є–Є [26], —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –њ—А–Њ—В–Є–≤–Њ–≥—А–Є–њ–њ–Њ–Ј–љ–∞—П –≤–∞–Ї—Ж–Є–љ–∞—Ж–Є—П [25], –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е β-–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ [27], —В—Й–∞—В–µ–ї—М–љ–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –Ј–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А–Њ–≤, –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ї –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ—Г II —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –•–Ю–С–Ы, –Ш–С–° –Є –Ј–∞—Б—В–Њ–є–љ–Њ–є –°–Э [17].
![–†–Є—Б. 1. –Я–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Љ–Њ–і–µ–ї—М —Б–≤—П–Ј–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –ї–µ–≥–Ї–Є—Е —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є (–∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–Њ –њ–Њ Van Eeden et al.) [36]](/data/articles/Image/t22/n5/389-2.gif)
![–†–Є—Б. 2. –Я–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Љ–Њ–і–µ–ї—М —Б–≤—П–Ј–Є –Њ—Б—В—А–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –ї–µ–≥–Ї–Є—Е —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Њ—Б—В—А—Л—Е –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є (–∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–Њ –њ–Њ Van Eeden et al.) [36]](/data/articles/Image/t22/n5/389-3.gif)