Существенная роль в возникновении хронического воспаления в верхнечелюстном синусе принадлежит заболеваниям зубов верхней челюсти. Одонтогенный гайморит (ОГ), по сути, является осложнением, которое возникает в результате распространения патологического процесса из периапикального очага хронической инфекции в области премоляров или моляров верхней челюсти (периодонтиты, периоститы, остеомиелиты, нагноившиеся радикулярные кисты, имеются также указания о возможности возникновения гайморита при абсцедирующей форме пародонтита). Больные одонтогенным гайморитом поступают на лечение как в стоматологические, так и оториноларингологические стационары. По данным стоматологов, одонтогенный гайморит обнаруживается у 12–50% больных хроническим синуситом. По наблюдениям оториноларингологов, частота одонтогенного гайморита колеблется в среднем от 2 до 25%, причем его открытая (перфоративная) форма составляет 41,2–77,2%. Такие разноречивые данные обусловлены не истинным соотношением одонтогенных и риногенных гайморитов, а спецификой обследования больных в стационарах различного профиля. Диагностика одонтогенного гайморита затруднена и требует синергизма в работе оториноларингологической и стоматологической служб. Заболе¬вания зубов верхней челюсти, протекающие практически бессимптомно, как правило, не расцениваются как причина синусита. К сожалению, врачи стоматологи и оториноларингологи часто недооценивают причинно–следственную связь между патологией верхнечелюстного синуса с заболеваниями и аномалиями развития зубов, что приводит к диагностическим ошибкам и рецидивирующему течению заболевания. Лечение одонтогенного гайморита должно быть комплексным и во всех случаях включать санацию очага инфекции.
Сложность консервативного лечения одонтогенного гайморита заключается в том, что воспалительный процесс в верхнечелюстной пазухе, развившийся в результате длительного периапикального воспаления зубов верхней челюсти, принимает первично хронический характер и в большинстве случаев требует хирургического лечения, объем которого зависит как от эндоскопической картины, так и функционального состояния слизистой оболочки. Консервативное лечение эффективно лишь при экссудативной форме воспаления.
Антибактериальная терапия одонтогенного верхнечелюстного синусита носит эмпирический характер и опирается на данные об основных возбудителях и их чувствительности к антимикробному препарату в регионе. Также учитывается тот факт, что вследствие высокой частоты распространенности микробных ассоциаций существенно повышается риск встречаемости b–лактомазопродуцирующих штаммов. В этой связи антибиотикотерапия одонтогенного гайморита сводится к выбору между защищенными пенициллинами и респираторными фторхинолонами.
Целью нашего исследования явилось изучение возможностей повышения эффективности лечения одонтогенного гайморита.
За последний год нами наблюдалось 32 пациента, страдающих одонтогенным гайморитом и находившихся на стационарном лечении в ЛОР–отделении Московской клинической больницы им. С.П. Боткина – 13 мужчин и 19 женщин (средний возраст – 38 лет).
Диагноз одонтогенного синусита устанавливался на основании жалоб, данных анамнеза, объективного осмотра (синусоскопии, эндоскопического исследования полости носа, ороскопия), результатов рентгенологического исследования (обзорная рентгенография, панорамная зонография и КТ околоносовых пазух). Все пациенты были консультированы стоматологом. У всех больных была отмечена легкая и среднетяжелая степень течения заболевания.
«Причинными» зубами явились: I моляр – 19 пациентов, II моляр – 9 пациентов, II премоляр – 4 пациента. В одном случае имело место сочетание патологии II премоляра и I моляра (таб. 1).
Среди обследованных 4 человека имели открытую (перфоративную) форму одонтогенного гайморита: 3 – антроальвеолярное сообщение с верхнечелюстной пазухой вследствие удаления I моляра, 1 – II моляра (рис. 1).
Группа с закрытой формой одонтогенным гайморитом составила 28 человек, при этом в четырех случаях процесс был связан с наличием пломбировочного материала в верхнечелюстном синусе. Экссудативная форма была зарегистрирована у 9 пациентов (рис. 2).
По результатам обследования оперативное лечение было паказано 19 пациентам с закрытой формой одонтогенного гайморита, 14 из них от предложенной операции отказались.
В результате проведенных бактериологиче¬ских исследований у 17 больных с одонтогенным гайморитом в пунктате верхнечелю¬стной пазухи обнаружены ассоциации анаэробов и аэ¬робов. Изолированные культуры аэробов и анаэробов получены в 3 и 7 случаях соответственно. В 5 исследованиях роста флоры не получено (рис. 3).
Аэробная флора была представлена Streptococcus spp., Staphylococcus aureus, Haemophilus influenzae, Pseudomonas aeruginosa. Анаэробная – грампозитивными кокками (Streptococcus spp.), Veillonella spp., Prevotella spp., Peptostreptococcus spp, Fusobacterium spp. (табл. 2).
Консервативное лечение включало в себя антибактериальную терапию защищенными пенициллинами, пункции (промывание) гайморовой пазухи с введением физиологического раствора, местное применение деконгестантов. Все пациенты были консультированы стоматологом, санация одонтогенного очага инфекции проводилась на 3–4–е сутки после начала консервативной терапии.
В своей работе мы сравнили эффективность проведения системной антибактериальной терапии одонтогенного гайморита амоксициллин/сульбактамом, который недавно появился на рынке России, и давно используемым в ЛОР–практике амоксициллин/клавуланатом. Оба препарата относятся к группе защищенных пенициллинов.
Трифамокс ИБЛ® (амоксициллин/сульбактам) – противомикробное средство из группы пенициллинов (зарегистрирован осенью 2005 г. в России (Трифамокс ИБЛ®, Лабораториос Багo С.А., Аргентина)), обладает широким спектром бактерицидного действия в отношении аэробных грамположительных бактерий (включая штаммы, продуцирующие b–лактамазы): Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Streptococcus pyogenes, Streptococcus anthracis, Streptococcus pneumoniae, Streptococcus viridans, Enterococcus faecalis, Corynebacterium spp., Listeria monocytogenes; анаэробных грамположительных бактерий: Clostridium spp., Peptococcus spp., Peptostreptococcus spp.; аэробных грамотрицательных бактерий (включая штаммы, продуцирующие b–лактамазы): Escherichia coli, Proteus mirabilis, Proteus vulgaris, Klebsiella spp., Salmonella spp., Shigella spp., Bordetella pertussis, Yersinia enterocolitica, Gardnerella vaginalis, Neisseria meningitidis, Neisseria gonorrhoeae, Moraxella catarrhalis, Haemophilus influenzae, Haemophilus ducreyi, Yersinia multocida, Campylobacter jejuni, Acinetobacter spp.; анаэробных грамотрицательных бактерий (включая штаммы, продуцирующие b–лактамазы): Bacteroides spp., включая Bacteroides fragilis.
Амоксициллин действует бактерицидно, угнетая синтез бактериальной стенки. Сульбактам является стабильным необратимым ингибитором b–лактамаз, выделяемых микроорганизмами, устойчивыми к b–лактамным антибиотикам. Сульбактам расширяет спектр активности препарата в отношении устойчивых штаммов, не изменяя активности амоксициллина в отношении чувствительных штаммов, образуя комплексы с пенициллин–связывающими белками бактерий, проявляет синергизм при одновременном применении с b–лактамными антибиотиками. Собственной клинически значимой антибактериальной активностью сульбактам не обладает (за исключением Neisseriaceae и Acinetobacter).
Препарат выпускается как в таблетированной, так и в инъекционной форме, что очень удобно при проведении ступенчатой терапии. При приеме во внутрь препарат имеет большой объем распределения и достигает высоких концентраций в тканях и жидкостях организма, особенно в слизистой оболочке верхних дыхательных путей. По скорости развития бактерицидного действия амоксициллин/сульбактам значительно опережает другие антибактериальные препараты, т. к. обладает значительно большей, чем клавуланат или тазобактам, устойчивостью к изменениям рН раствора, а с практической точки зрения это означает, что в условиях реального инфекционного процесса, протекающего со значительными вариациями кислотности среды, сульбактам способен активнее проникать в ткани, чем другие ингибиторы b–лактамаз.
В нашей работе пациенты, которым проводилось только консервативное лечение в зависимости от проводимой антибактериальной терапии, были разделены на 2 группы (основную и контрольную), сходные по полу, возрасту и характеру процесса в верхнечелюстных пазухах и зубочелюстной области. В основную группу вошли пациенты, получавшие амоксициллин/сульбактам, в контрольной группе антибактериальная терапия проводилась амоксициллин/клавуланатом (табл. 3). Все пациенты получали антибиотик в сравнимых дозировках по амоксициллину (500 мг х 3 раза в сутки per os).
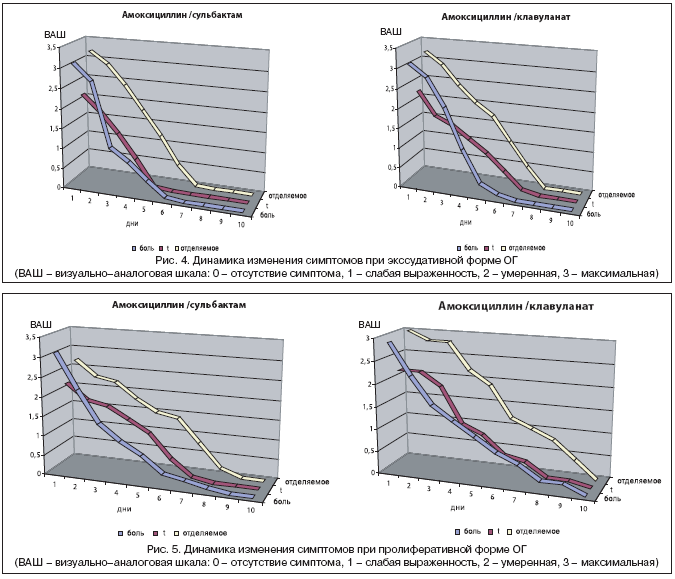
По результатам проведенного консервативного лечения была отмечена выраженная положительная динамика основных клинических симптомов заболевания к 7–м суткам в обеих группах больных с экссудативной формой одонтогенного синусита (рис. 4, 5). У пациентов с гнойно–полипозным поражением верхнечелюстной пазухи, получавших амоксициллин/сульбактам, ремиссия была достигнута на 8–е сутки, а в контрольной группе на 9–е.
Антимикробная эффективность и высокая чувствительность микроорганизмов к препаратам подтверждены данными микробиологического исследования в динамике.
Таким образом, амоксициллин/сульбактам не уступает традиционным защищенным пенициллинам, клиническая эффективность которых проверена временем, а также имеет ряд преимуществ:
1. Сульбактам более устойчив к изменениям рН, благодаря чему способен активнее проникать в воспаленные ткани.
2. Высокая толерантность сульбактама к колебаниям рН позволяет вводить его внутримышечно.
3. Сульбактам более устойчив к большинству плазмидных и хромосомных b–лактамаз I типа.
4. Амоксициллин/сульбактам более удобен для проведения ступенчатой терапии, так как имеет, помимо пероральной, форму для внутримышечного и внутривенного введения.
В заключение следует отметить, что амоксициллин/сульбактам является эффективным препаратом в лечении одонтогенных синуситов и может быть рекомендован в качестве стартовой терапии при хроническом верхнечелюстном синусите. Оптимальный выбор антибактериальных средств для лечения одонтогенных процессов в верхнечелюстном синусе уменьшает сроки лечения.


Литература
1. Анютин Р.Г., Лузина В.В, Романов И.А. Дифференцированное хирургическое лечение одонтогенного гайморита: Матер, III съезда стоматологической ассоциации (общероссийский) – М., 1996.
2. Плужников М.С. Консервативные и хирургические методы в ринологии – С.–Пб., 2005
3. Тимофеев А.А. Руководство по челестно–лицевой хирургии и хирургической стоматологии – К., 2004.
4. Сидоренко С.В., Яковлев С.В. Бета–лактамные антибиотики. Русский медицинский журнал, 1997; 5 (21): 1367–81.
5. Яковлев С.В. Амоксициллин/сульбактам – новые возможности преодоления антибиотикорезистентности. Русский медицинский журнал 2005, том 13, № 21, с. 1418–22
6. Ambler PR. The structure of beta–lactamases. Philos Trans R Soc Lond Ser B 1980;289:321–31.
7. Bush K, Jacoby GA, Medeiros AA. A functional classification scheme for beta–lactamases and its correlation with molecular structure. Antimicrob Agents Chemother 1995;39:1211–33.
8. Pensotti C. et al. Meta–analisis sobre la actividad in vitro e in vivo. Efficacia y tolerancia de la combinacion amoxicillina, sulbactam en humanos. La Prensa Medica Argentina 1998;85(4):515–22.












