–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –љ–µ–Њ—В—К–µ–Љ–ї–µ–Љ–Њ–є —З–∞—Б—В—М—О –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є —Б—В–∞–љ–Њ–≤—П—В—Б—П —Б–Њ–≥–ї–∞—Б–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –≤–µ–і–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е —Б —В–µ–Љ –Є–ї–Є –Є–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ / –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ. –Я–Њ–њ—Г–ї—П—А–љ–Њ—Б—В—М —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –Њ–±—К—П—Б–љ—П–µ—В—Б—П —В–µ–Љ, —З—В–Њ –Њ–љ–Є –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є –±–Њ–ї–µ–µ –Є–ї–Є –Љ–µ–љ–µ–µ —Г–і–∞—З–љ—Л–є —Б–Є–љ—В–µ–Ј –Њ–≥—А–Њ–Љ–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –≤ —А–∞–Љ–Ї–∞—Е –Њ–і–љ–Њ–≥–Њ –і–Њ–Ї—Г–Љ–µ–љ—В–∞. –Т—А–∞—З —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –і–µ—В–∞–ї—М–љ—Л–є, –љ–∞–Ї–Њ–њ–ї–µ–љ–љ—Л–є –≥–Њ–і–∞–Љ–Є –Є –і–µ—Б—П—В–Є–ї–µ—В–Є—П–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Є –љ–∞—Г—З–љ—Л–є –Њ–њ—Л—В. –° –Љ–Њ–Љ–µ–љ—В–∞ —Б–≤–Њ–µ–≥–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–Є—П –Њ–љ–Є —Б—В–∞–љ–Њ–≤—П—В—Б—П —Б–≤–Њ–µ–Њ–±—А–∞–Ј–љ—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ –Њ–Ї–∞–Ј–∞–љ–Є—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є. –Ш –≤ —Б—В–∞–љ–і–∞—А—В–Є–Ј–∞—Ж–Є–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П (–±–µ–Ј —Г—В—А–∞—В—Л –≤—А–∞—З–Њ–Љ —А–∞–Ј—Г–Љ–љ–Њ–є –∞–≤—В–Њ–љ–Њ–Љ–Є–Є –≤ –Ї–∞–ґ–і–Њ–Љ –Њ—В–і–µ–ї—М–љ–Њ–Љ —Б–ї—Г—З–∞–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П), –њ–Њ–Ј–≤–Њ–ї—П—О—Й–µ–є –Њ–њ—В–Є–Љ–Є–Ј–Є—А–Њ–≤–∞—В—М –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–µ –ї–µ—З–µ–±–љ—Л–µ –њ–Њ–і—Е–Њ–і—Л –Є –±–Њ–ї–µ–µ —Н–Ї–Њ–љ–Њ–Љ–љ–Њ —А–∞—Б—Е–Њ–і–Њ–≤–∞—В—М —А–µ—Б—Г—А—Б—Л –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П, —Б–ї–µ–і—Г–µ—В –≤–Є–і–µ—В—М –Њ—Б–љ–Њ–≤–љ—Г—О –≤—Л–≥–Њ–і—Г –њ–Њ–і–Њ–±–љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є.
–≠—В–Є–Њ–ї–Њ–≥–Є—П –Т–Я –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ —Б–≤—П–Ј–∞–љ–∞ —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–Њ–є «–љ–µ—Б—В–µ—А–Є–ї—М–љ—Л—Е» –Њ—В–і–µ–ї–Њ–≤ –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є (–њ–Њ–ї–Њ—Б—В–Є —А—В–∞, –љ–Њ—Б–∞, —А–Њ—В–Њ- –Є –љ–Њ—Б–Њ–≥–ї–Њ—В–Ї–Є). –Ш–Ј –Љ–љ–Њ–ґ–µ—Б—В–≤–∞ –≤–Є–і–Њ–≤ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –Ї–Њ–ї–Њ–љ–Є–Ј–Є—А—Г—О—Й–Є—Е –≤–µ—А—Е–љ–Є–µ –і—Л—Е–∞—В–µ–ї—М–љ—Л–µ –њ—Г—В–Є, –ї–Є—И—М –љ–µ–Ї–Њ—В–Њ—А—Л–µ, –Њ–±–ї–∞–і–∞—О—Й–Є–µ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –≤–Є—А—Г–ї–µ–љ—В–љ–Њ—Б—В—М—О, —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–Є –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –≤ —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–µ –Њ—В–і–µ–ї—Л –ї–µ–≥–Ї–Є—Е –≤—Л–Ј–≤–∞—В—М –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Г—О —А–µ–∞–Ї—Ж–Є—О –і–∞–ґ–µ –њ—А–Є –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є—П—Е –Ј–∞—Й–Є—В–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤.
–Ґ–Є–њ–Є—З–љ—Л–µ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–Є –Т–Я:
- Streptococcus pneumoniae – –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ –Ї–Њ–Ї–Ї–Є, —Б–∞–Љ—Л–µ —З–∞—Б—В—Л–µ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–Є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –≤–Њ –≤—Б–µ—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –≥—А—Г–њ–њ–∞—Е (30% –Є –±–Њ–ї–µ–µ –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤);
- Haemophilus influenzae – –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –њ–∞–ї–Њ—З–Ї–Є, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л–µ –Ј–∞ —А–∞–Ј–≤–Є—В–Є–µ –њ–љ–µ–≤–Љ–Њ–љ–Є–Є —Г 5–18% –≤–Ј—А–Њ—Б–ї—Л—Е, —З–∞—Й–µ —Г –Ї—Г—А–Є–ї—М—Й–Є–Ї–Њ–≤ –Є –±–Њ–ї—М–љ—Л—Е —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ –±—А–Њ–љ—Е–Є—В–Њ–Љ;
- Moraxella (Branhamella) catarrhalis – –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –Ї–Њ–Ї–Ї–Њ–±–∞—Ж–Є–ї–ї—Л, –љ–µ–∞–Ї—В—Г–∞–ї—М–љ—Л–є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—М –њ–љ–µ–≤–Љ–Њ–љ–Є–Є (—Г 1–2% –±–Њ–ї—М–љ—Л—Е), –Є–Љ–µ–µ—В —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Г –±–Њ–ї—М–љ—Л—Е —Б —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ—Л–Љ –±—А–Њ–љ—Е–Є—В–Њ–Љ.
–°—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Т–Я –Є–Љ–µ—О—В —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ –∞—В–Є–њ–Є—З–љ—Л–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л, –љ–∞ –і–Њ–ї—О –Ї–Њ—В–Њ—А—Л—Е –≤ —Б—Г–Љ–Љ–µ –њ—А–Є—Е–Њ–і–Є—В—Б—П –Њ—В 8 –і–Њ 30% —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П:
- Mycoplasma pneumoniae – –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ, –ї–Є—И–µ–љ–љ—Л–є –≤–љ–µ—И–љ–µ–є –Љ–µ–Љ–±—А–∞–љ—Л, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –µ–≥–Њ –њ—А–Є—А–Њ–і–љ—Г—О —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М –Ї β-–ї–∞–Ї—В–∞–Љ–љ—Л–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ, –і–ї—П –љ–µ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–љ–∞ —В–µ—Б–љ–∞—П –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П —Б –Љ–µ–Љ–±—А–∞–љ–Њ–є —Н—Г–Ї–∞—А–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї (–Љ–µ–Љ–±—А–∞–љ–Њ—В—А–Њ–њ–љ—Л–є –њ–∞—В–Њ–≥–µ–љ), –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–∞—П –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П;
- Chlamydia pneumoniae – –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ, —П–≤–ї—П—О—Й–Є–є—Б—П –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–Љ –њ–∞—А–∞–Ј–Є—В–Њ–Љ, –±–ї–Є–Ј–Ї–Є–Љ –њ–Њ —Б—В—А–Њ–µ–љ–Є—О –Ї –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–Љ –±–∞–Ї—В–µ—А–Є—П–Љ; –≤—Л–Ј—Л–≤–∞–µ—В –њ–љ–µ–≤–Љ–Њ–љ–Є—О –≤ 2–8% —Б–ї—Г—З–∞–µ–≤, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ—В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П. –Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –љ–∞–Ї–∞–њ–ї–Є–≤–∞—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ —З–∞—Б—В–Њ–Љ –≤—Л–і–µ–ї–µ–љ–Є–Є —Н—В–Њ–≥–Њ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —Б –і—А—Г–≥–Є–Љ–Є «–ї–µ–≥–Њ—З–љ—Л–Љ–Є» –њ–∞—В–Њ–≥–µ–љ–∞–Љ–Є;
- Legionella pneumophila – –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л —А–Њ–і–∞ Legionella – –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ –њ–∞–ї–Њ—З–Ї–Є, —П–≤–ї—П—О—Й–Є–µ—Б—П –Њ–±–ї–Є–≥–∞—В–љ—Л–Љ–Є –њ–∞—В–Њ–≥–µ–љ–∞–Љ–Є. Legionella spp. – –љ–µ—З–∞—Б—В—Л–є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—М –Т–Я (2–10%). –Ю–і–љ–∞–Ї–Њ –ї–µ–≥–Є–Њ–љ–µ–ї–ї–µ–Ј–љ–∞—П –њ–љ–µ–≤–Љ–Њ–љ–Є—П –Ј–∞–љ–Є–Љ–∞–µ—В 2-–µ –Љ–µ—Б—В–Њ (–њ–Њ—Б–ї–µ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–є) –њ–Њ —З–∞—Б—В–Њ—В–µ —Б–Љ–µ—А—В–µ–ї—М–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Ю—Б–љ–Њ–≤–љ–Њ–є —Б–њ–Њ—Б–Њ–± –Ј–∞—А–∞–ґ–µ–љ–Є—П –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ–Є –њ—А–Є –Т–Я – —Н—В–Њ –∞—Б–њ–Є—А–∞—Ж–Є—П —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є. –Ь–Є–Ї—А–Њ–∞—Б–њ–Є—А–∞—Ж–Є—П —Б–µ–Ї—А–µ—В–∞ —А–Њ—В–Њ–≥–ї–Њ—В–Ї–Є – —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Д–µ–љ–Њ–Љ–µ–љ, –љ–∞–±–ї—О–і–∞—О—Й–Є–є—Б—П —Г 70% –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–Њ –≤—А–µ–Љ—П —Б–љ–∞. –Ю–і–љ–∞–Ї–Њ —Б–ї–∞–ґ–µ–љ–љ–∞—П —А–∞–±–Њ—В–∞ –Љ—Г–Ї–Њ—Ж–Є–ї–Є–∞—А–љ–Њ–≥–Њ –Ї–ї–Є—А–µ–љ—Б–∞ –љ–∞—А—П–і—Г —Б –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–Љ —Б–µ–Ї—А–µ—В–µ –ї–∞–Ї—В–Њ—Д–µ—А—А–Є–љ–∞, –ї–Є–Ј–Њ—Ж–Є–Љ–∞, –Є–љ—В–µ—А—Д–µ—А–Њ–љ–∞ –Є —Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ –Ї–ї–∞—Б—Б–∞ –Р –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –∞–і–≥–µ–Ј–Є–Є –Є –Ї–Њ–ї–Њ–љ–Є–Ј–∞—Ж–Є–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ—Г —А–∞–Ј–≤–Є—В–Є—О –Т–Я.
–Я–Њ–і –Т–Я —Б–ї–µ–і—Г–µ—В –њ–Њ–љ–Є–Љ–∞—В—М –Њ—Б—В—А–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –≤–Њ–Ј–љ–Є–Ї—И–µ–µ –≤–Њ –≤–љ–µ–±–Њ–ї—М–љ–Є—З–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е (—В. –µ. –≤–љ–µ —Б—В–∞—Ж–Є–Њ–љ–∞—А–∞ –Є–ї–Є –њ–Њ–Ј–і–љ–µ–µ 4-—Е –љ–µ–і. –њ–Њ—Б–ї–µ –≤—Л–њ–Є—Б–Ї–Є –Є–Ј –љ–µ–≥–Њ, –Є–ї–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–µ –≤ –њ–µ—А–≤—Л–µ 48 —З –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є, –Є–ї–Є —А–∞–Ј–≤–Є–≤—И–µ–µ—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–∞, –љ–µ –љ–∞—Е–Њ–і–Є–≤—И–µ–≥–Њ—Б—П –≤ –і–Њ–Љ–∞—Е —Б–µ—Б—В—А–Є–љ—Б–Ї–Њ–≥–Њ —Г—Е–Њ–і–∞ / –Њ—В–і–µ–ї–µ–љ–Є—П—Е –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П ≥14 —Б—Г—В), —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–µ–µ—Б—П —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є–Є –љ–Є–ґ–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є (–ї–Є—Е–Њ—А–∞–і–Ї–∞, –Ї–∞—И–µ–ї—М, –≤—Л–і–µ–ї–µ–љ–Є–µ –Љ–Њ–Ї—А–Њ—В—Л, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –≥–љ–Њ–є–љ–Њ–є, –±–Њ–ї—М –≤ –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–µ, –Њ–і—Л—И–Ї–∞) –Є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є «—Б–≤–µ–ґ–Є—Е» –Њ—З–∞–≥–Њ–≤–Њ-–Є–љ—Д–Є–ї—М—В—А–∞—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –ї–µ–≥–Ї–Є—Е –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Њ—З–µ–≤–Є–і–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Л [3]. –Ш—Б—Е–Њ–і—П –Є–Ј –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Л –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ –љ–µ—В.
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Ї—А—Г–њ–љ—Л—Е –Љ—Г–ї—М—В–Є—Ж–µ–љ—В—А–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л—Е –љ–∞ –њ—А–Є–љ—Ж–Є–њ–∞—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л, –±—Л–ї–Њ —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤, –Њ—Б–љ–Њ–≤—Л–≤–∞—П—Б—М –љ–∞ –∞–љ–∞–ї–Є–Ј–µ –Ї–ї–Є–љ–Є–Ї–Њ-—А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–µ —Г–і–∞–µ—В—Б—П —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ—Б—В—М—О –≤—Л—Б–Ї–∞–Ј–∞—В—М—Б—П –Њ –≤–µ—А–Њ—П—В–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Т–Я. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, —А–∞–Ј–і–µ–ї–µ–љ–Є–µ –Т–Я –љ–∞ «—В–Є–њ–Є—З–љ—Г—О» (–љ–∞–њ—А–Є–Љ–µ—А, –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤—Г—О) –Є «–∞—В–Є–њ–Є—З–љ—Г—О» (–Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ–µ–љ–љ—Г—О –Є–ї–Є —Е–ї–∞–Љ–Є–і–Є–є–љ—Г—О) –ї–Є—И–µ–љ–Њ –Њ—Б–Њ–±–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П, —В. –Ї. –љ–µ –≤–ї–Є—П–µ—В –љ–∞ –≤—Л–±–Њ—А —Б—В–∞—А—В–Њ–≤–Њ–≥–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ –і–ї—П —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є. –Ю–і–љ–∞–Ї–Њ –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Т–Я, —В–∞–Ї–Є–µ –Ї–∞–Ї: –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –њ–Њ–ї–Њ—Б—В–µ–є –і–µ—Б—В—А—Г–Ї—Ж–Є–Є –≤ –ї–µ–≥–Ї–Є—Е –љ–µ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –і–ї—П –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–є, –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ–µ–љ–љ–Њ–є –Є —Е–ї–∞–Љ–Є–і–Є–є–љ–Њ–є –њ–љ–µ–≤–Љ–Њ–љ–Є–є, –∞ —Б–Ї–Њ—А–µ–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –≤ –њ–Њ–ї—М–Ј—Г —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, –∞—Н—А–Њ–±–љ—Л—Е –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е —Н–љ—В–µ—А–Њ–±–∞–Ї—В–µ—А–Є–є –Є –∞–љ–∞—Н—А–Њ–±–Њ–≤; —А–µ—В–Є–Ї—Г–ї–Њ–љ–Њ–і—Г–ї—П—А–љ–∞—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—П –≤ –±–∞–Ј–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–∞—Е –ї–µ–≥–Ї–Є—Е —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –і–ї—П –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ–µ–љ–љ–Њ–є –Т–Я (–Њ–љ–∞ –≤ 20% —Б–ї—Г—З–∞–µ–≤ –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П –Њ—З–∞–≥–Њ–≤–Њ-—Б–ї–Є–≤–љ–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–µ–є –≤ –њ—А–Њ–µ–Ї—Ж–Є–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Б–µ–≥–Љ–µ–љ—В–Њ–≤ –Є–ї–Є –і–Њ–ї–Є).
–Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–Љ –Т–Я —Г –≤–Ј—А–Њ—Б–ї—Л—Е –Њ—Б—В–∞–µ—В—Б—П –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї (30,5% —Б–ї—Г—З–∞–µ–≤), —А–µ–ґ–µ —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –∞–≥–µ–љ—В–∞–Љ–Є —П–≤–ї—П—О—В—Б—П –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ—Л (–Њ—В 12,5 –і–Њ 20–30%), —Е–ї–∞–Љ–Є–і–Є–Є (–Њ—В 2–8 –і–Њ 12,5%) –Є–ї–Є –≥–µ–Љ–Њ—Д–Є–ї—М–љ–∞—П –њ–∞–ї–Њ—З–Ї–∞. –£ –ї–Є—Ж –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ–љ–µ–≤–Љ–Њ–љ–Є–Є —З–∞—Й–µ –≤—Л–Ј—Л–≤–∞—О—В—Б—П –Љ–Њ–љ–Њ–Ї—Г–ї—М—В—Г—А–Њ–є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П (–Њ–±—Л—З–љ–Њ S. pneumoniae), –∞ —Г –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є –Є–ї–Є –±–Њ–ї—М–љ—Л—Е —Б —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ – –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П–Љ–Є –±–∞–Ї—В–µ—А–Є–є, –Ј–∞—З–∞—Б—В—Г—О –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–Љ–Є —Б–Њ—З–µ—В–∞–љ–Є–µ–Љ –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е –Є –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ (—В–∞–±–ї. 1) [5].
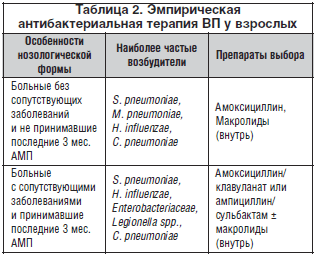
–Э–∞—З–∞–ї—М–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –Т–Я –љ–Њ—Б–Є—В —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Є–є —Е–∞—А–∞–Ї—В–µ—А. –Ф–ї—П –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є–Є –≤—Л–±–Њ—А–∞ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ —Б–Њ–Ј–і–∞—О—В—Б—П –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–µ –Є –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –∞–ї–≥–Њ—А–Є—В–Љ—Л, —Г—З–Є—В—Л–≤–∞—О—Й–Є–µ —А–∞–Ј–ї–Є—З–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л, –Ї–Њ—В–Њ—А—Л–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г—О—Й–µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Н—В–Є–Њ–ї–Њ–≥–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П: –≤–Њ–Ј—А–∞—Б—В, —Б—В–µ–њ–µ–љ—М —В—П–ґ–µ—Б—В–Є –Т–Я –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й—Г—О –њ–∞—В–Њ–ї–Њ–≥–Є—О (—В–∞–±–ї. 2).
–°—Г—Й–µ—Б—В–≤—Г–µ—В –љ–µ–Ї–Њ—В–Њ—А–∞—П —А–∞–Ј–љ–Є—Ж–∞ –≤ –њ–Њ–і—Е–Њ–і–∞—Е –Ї –ї–µ—З–µ–љ–Є—О –Т–Я –ї–µ–≥–Ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –Љ–µ–ґ–і—Г –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є–Љ–Є –Є –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є–Љ–Є —А–µ–≥–ї–∞–Љ–µ–љ—В–Є—А—Г—О—Й–Є–Љ–Є —Б—В—А—Г–Ї—В—Г—А–∞–Љ–Є. –Т –°–®–Р –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –і–ї—П –ї–µ—З–µ–љ–Є—П –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е –±–Њ–ї—М–љ—Л—Е —П–≤–ї—П—О—В—Б—П –і–Њ–Ї—Б–Є—Ж–Є–Ї–ї–Є–љ, –Љ–∞–Ї—А–Њ–ї–Є–і—Л –Є «—А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–µ» —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—Л (–ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ, –Љ–Њ–Ї—Б–Є—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ –Є –і—А.). –Т –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е –Є —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—Л–±–Њ—А–∞ —П–≤–ї—П—О—В—Б—П –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Л. –Э–µ –Є—Б–Ї–ї—О—З–∞–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і—А—Г–≥–Є—Е –≥—А—Г–њ–њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤), –љ–Њ —В–Њ–ї—М–Ї–Њ –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–µ –∞—В–Є–њ–Є—З–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –≤ —А–µ–≥–Є–Њ–љ–µ –Є–ї–Є –њ—А–Є –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ (—В–∞–±–ї. 3).
–†–∞—Б—Ж–≤–µ—В –Њ—В–Ї—А—Л—В–Є–є –љ–Њ–≤—Л—Е –Ї–ї–∞—Б—Б–Њ–≤ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –њ—А–Є—И–µ–ї—Б—П –љ–∞ 1950–1960-–µ –≥–≥. –Ъ–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ —З–µ–ї–Њ–≤–µ—З–µ—Б—В–≤–Њ –≤—Л–Є–≥—А—Л–≤–∞–µ—В –≤ —Н—В–Њ–є –љ–µ–≤–Є–і–Є–Љ–Њ–є –њ–µ—А–Љ–∞–љ–µ–љ—В–љ–Њ–є –±–Њ—А—М–±–µ, —Е–Њ—В—П –µ–µ –і–Њ–ї–≥–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –Њ–њ—А–µ–і–µ–ї–Є–ї—Б—П –µ—Й–µ –і–Њ –њ–µ—А–≤–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –∞ –Є–Љ–µ–љ–љ–Њ —Б –Њ—В–Ї—А—Л—В–Є–µ–Љ —Г –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ [6]. –®–Є—А–Њ–Ї–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ —Б—А–µ–і–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –Ј–∞—Б—В–∞–≤–Є–ї–Њ —Б–Њ–Ј–і–∞–≤–∞—В—М –љ–Њ–≤—Л–µ –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ —Д–Њ—А–Љ—Л –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤. –Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ–Њ–є –Ј–∞—Й–Є—В—Л –Њ—В –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ —П–≤–ї—П–µ—В—Б—П –≤—Л—А–∞–±–Њ—В–Ї–∞ —Д–µ—А–Љ–µ–љ—В–Њ–≤, —Б–њ–Њ—Б–Њ–±–љ—Л—Е —А–∞–Ј—А—Г—И–∞—В—М –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Г—О —Б—В—А—Г–Ї—В—Г—А—Г –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –∞–≥–µ–љ—В–∞, –ї–Є—И–∞—П –µ–≥–Њ —Б–≤–Њ–Є—Е —Б–≤–Њ–є—Б—В–≤. –°—А–µ–і–Є –Є–љ–∞–Ї—В–Є–≤–Є—А—Г—О—Й–Є—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ –Є–Ј–≤–µ—Б—В–љ—Л —В—А–∞–љ—Б—Д–µ—А–∞–Ј—Л, —Н—Б—В–µ—А–∞–Ј—Л –Є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–Є –≥–Є–і—А–Њ–ї–∞–Ј – β-–ї–∞–Ї—В–∞–Љ–∞–Ј—Л [1]. –Ш–Љ–µ–љ–љ–Њ –≤—Л—А–∞–±–Њ—В–Ї–∞ β-–ї–∞–Ї—В–∞–Љ–∞–Ј, –Ї–∞—В–∞–ї–Є–Ј–Є—А—Г—О—Й–Є—Е —А–∞—Б—Й–µ–њ–ї–µ–љ–Є–µ
β-–ї–∞–Ї—В–∞–Љ–љ–Њ–≥–Њ –Ї–Њ–ї—М—Ж–∞ —Г –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤, —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–≤ –Є –і—А—Г–≥–Є—Е β-–ї–∞–Ї—В–∞–Љ–Њ–≤ (–Љ–Њ–љ–Њ–±–∞–Ї—В–∞–Љ–Њ–≤, –Ї–∞—А–±–∞–њ–µ–љ–µ–Љ–Њ–≤ –Є —В. –і.), —П–≤–ї—П–µ—В—Б—П —Б–∞–Љ—Л–Љ —З–∞—Б—В—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї β-–ї–∞–Ї—В–∞–Љ–љ—Л–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ —Г –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е –Є –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, S. aureus, H. influenzae, M. catarrhalis, E. coli, K. pneumoniae –Є –і—А.) [4, 13]. –≠—В–Њ—В –Љ–µ—Е–∞–љ–Є–Ј–Љ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –Њ–Ї–∞–Ј–∞–ї—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ, —З—В–Њ –њ—А–Є–≤–µ–ї–Њ –Ї —Н–≤–Њ–ї—О—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—О β-–ї–∞–Ї—В–∞–Љ–Њ–≤ –љ–µ —В–Њ–ї—М–Ї–Њ –њ–Њ –њ—Г—В–Є —А–∞—Б—И–Є—А–µ–љ–Є—П —Б–њ–µ–Ї—В—А–∞ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є —Г–ї—Г—З—И–µ–љ–Є—П —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї, –љ–Њ –Є –њ–Њ –њ—Г—В–Є –њ—А–µ–Њ–і–Њ–ї–µ–љ–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є. –Я–Њ—Н—В–Њ–Љ—Г –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ–і–љ–Њ–≥–Њ –Є–Ј —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е —Б–њ–Њ—Б–Њ–±–Њ–≤ –±–Њ—А—М–±—Л —Б —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –±—Л–ї–Њ –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞—В—М β-–ї–∞–Ї—В–∞–Љ–љ—Л–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є —Б –Ї–∞–Ї–Є–Љ-–ї–Є–±–Њ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ β-–ї–∞–Ї—В–∞–Љ–∞–Ј.
–Ґ–∞–Ї –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ–Њ—П–≤–Є–ї–∞—Б—М –≥—А—Г–њ–њ–∞ –Ј–∞—Й–Є—Й–µ–љ–љ—Л—Е (–Є–ї–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е) β-–ї–∞–Ї—В–∞–Љ–Њ–≤. –°—А–µ–і–Є –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ β-–ї–∞–Ї—В–∞–Љ–∞–Ј –љ–∞–Є–±–Њ–ї—М—И–µ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–Њ–ї—Г—З–Є–ї–Є –Ї–ї–∞–≤—Г–ї–∞–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞, —Б—Г–ї—М–±–∞–Ї—В–∞–Љ –Є —В–∞–Ј–Њ–±–∞–Ї—В–∞–Љ. –Ш—Б—В–Њ—А–Є—З–µ—Б–Ї–Є –њ–µ—А–≤—Л–Љ –∞–љ—В–Є-β-–ї–∞–Ї—В–∞–Љ–∞–Ј–љ—Л–Љ –∞–≥–µ–љ—В–Њ–Љ –±—Л–ї–∞ –Ї–ї–∞–≤—Г–ї–∞–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞, –њ–Њ–ї—Г—З–µ–љ–љ–∞—П –≤ –љ–∞—З–∞–ї–µ 1970-—Е –≥–≥. –Є–Ј –Ї—Г–ї—М—В—Г—А—Л –≥—А–Є–±–Ї–∞ Streptomyces clavuligerus –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –њ—А–Њ–і—Г—Ж–Є—А–Њ–≤–∞—В—М –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л β-–ї–∞–Ї—В–∞–Љ–∞–Ј—Л [9].
–Я—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ –≤ —Н—В–Њ –ґ–µ –≤—А–µ–Љ—П (1972) –±–ї–∞–≥–Њ–і–∞—А—П —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–є —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –њ–Њ–ї—Г—Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞ —Б –≤—Л—Б–Њ–Ї–Њ–є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О –њ—А–Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –њ—А–Є–µ–Љ–µ –њ–Њ—П–≤–Є–ї—Б—П –љ–Њ–≤—Л–є –њ—А–µ–њ–∞—А–∞—В –≥—А—Г–њ–њ—Л –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ – –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ. –Х–≥–Њ –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ –Њ–±–ї–∞–і–∞–ї –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О –ї–Є—И—М –≤ 40%, –Ї–Њ—В–Њ—А–∞—П –µ—Й–µ –Є —Б–љ–Є–ґ–∞–ї–∞—Б—М –њ—А–Є –њ—А–Є–µ–Љ–µ –њ–Є—Й–Є. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –њ–µ—А–µ–і –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ–Њ–Љ –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–≤—И–Є—Е –љ–∞ —В–Њ—В –Љ–Њ–Љ–µ–љ—В —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ–Њ–≤ –Њ–њ—А–µ–і–µ–ї–Є–ї–Є –≤—Л–±–Њ—А –і–ї—П —Б–Њ–Ј–і–∞–љ–Є—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Є–љ–≥–Є–±–Є—В–Њ—А–∞
β-–ї–∞–Ї—В–∞–Љ–∞–Ј –Є β-–ї–∞–Ї—В–∞–Љ–љ–Њ–≥–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ [11]. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Б–Њ—З–µ—В–∞–љ–Є—П –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –Є –Ї–ї–∞–≤—Г–ї–∞–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–Р/–Ъ–Ъ) –і–ї—П –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –µ—Й–µ –њ—А–Є —А–µ–≥–Є—Б—В—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е.
–Т—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –љ–µ–Ј–∞—Й–Є—Й–µ–љ–љ—Л–Љ –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ –њ–Њ–Ї–∞–Ј–∞–ї–Є H. influenzae –Є M. catarrhalis. –Ґ–∞–Ї, —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М H. influenzae –Ї –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–∞—П –њ—А–Њ–і—Г–Ї—Ж–Є–µ–є –њ–ї–∞–Ј–Љ–Є–і–љ—Л—Е β-–ї–∞–Ї—В–∞–Љ–∞–Ј, —Б–Њ—Б—В–∞–≤–ї—П–µ—В –≤ —Б—А–µ–і–љ–µ–Љ 16,9%, –∞ M. catarrhalis – 92,1% [14].
–Ъ–Њ–љ–µ—З–љ–Њ, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–≥–Є–Њ–љ–∞—Е –Љ–Є—А–∞ –Љ–Њ–ґ–µ—В —Б–Є–ї—М–љ–Њ –Њ—В–ї–Є—З–∞—В—М—Б—П: –њ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П Alexander Project, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ-—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ–≥–Њ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–∞ –≤–∞—А—М–Є—А—Г–µ—В –Њ—В 0 –і–Њ 56%, –∞ —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ H. influenzae – –Њ—В 4,2 –і–Њ 29,6% [14]. –°–Њ—Б—В–Њ—П–љ–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Њ—Б–љ–Њ–≤–љ—Л—Е —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤ –≤ –†–Њ—Б—Б–Є–Є –≤ 1999–2005 –≥–≥. –±—Л–ї–Њ –Є–Ј—Г—З–µ–љ–Њ –≤ —Е–Њ–і–µ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Я–µ–У–Р–°–I –Є –Я–µ–У–Р–°–II. –°–Њ–≥–ї–∞—Б–љ–Њ –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –і–∞–љ–љ—Л–Љ, —З–∞—Б—В–Њ—В–∞ –≤—Л–і–µ–ї–µ–љ–Є—П –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤, –љ–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Г, –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 10% [4]. –°–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є H. influenzae – —В–Њ–ї—М–Ї–Њ 4,7% —И—В–∞–Љ–Љ–Њ–≤ H. influenzae, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Я–µ–У–Р–°–II –≤ 2003–2005 –≥–≥., –Њ–Ї–∞–Ј–∞–ї–Є—Б—М —Г—Б—В–Њ–є—З–Є–≤—Л–Љ–Є –Ї –њ–Њ–ї—Г—Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Љ. –Ю–і–љ–∞–Ї–Њ –Љ–љ–Њ–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є —Б—З–Є—В–∞—О—В, —З—В–Њ –њ–Њ –Љ–µ—А–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –љ–µ–Ј–∞—Й–Є—Й–µ–љ–љ—Л—Е –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ —Г—А–Њ–≤–µ–љ—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –Ї –љ–Є–Љ –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –±—Г–і–µ—В –≤–Њ–Ј—А–∞—Б—В–∞—В—М.
–° —Н—В–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Њ—Б–Њ–±—Г—О —А–Њ–ї—М –њ—А–Є–Њ–±—А–µ—В–∞–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ј–∞—Й–Є—Й–µ–љ–љ—Л—Е –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ –њ—А–Є –Ш–Э–Ф–Я. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є —Г–Ї–∞–Ј–∞–љ–љ—Л–µ —А–∞–љ–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –Р/–Ъ–Ъ –Њ—Б–љ–Њ–≤–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Ш–Э–Ф–Я –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Б —В–µ—З–µ–љ–Є–µ–Љ –≤—А–µ–Љ–µ–љ–Є, –Є –њ—А–µ–њ–∞—А–∞—В —Б–Њ—Е—А–∞–љ—П–µ—В —Б–≤–Њ—О –≤—Л—Б–Њ–Ї—Г—О –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М. –Ґ–∞–Ї, –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Ї –Р/–Ъ–Ъ —И—В–∞–Љ–Љ–Њ–≤ S. pneumoniae, –њ–Њ –і–∞–љ–љ—Л–Љ Alexander Project, —Б–Њ—Б—В–∞–≤–Є–ї–Њ 95,5% (–љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤—Л—И–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —В–Њ–ї—М–Ї–Њ —Г —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤), H. influenzae – 99,6%, –∞ M. catarrhalis – 100% [14]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –Я–µ–У–Р–° –≤ –†–Њ—Б—Б–Є–Є —В–Њ–ї—М–Ї–Њ 0,5% —И—В–∞–Љ–Љ–Њ–≤ S. pneumoniae –±—Л–ї–Є —Г—Б—В–Њ–є—З–Є–≤—Л –Ї –Р/–Ъ–Ъ, —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –ґ–µ —И—В–∞–Љ–Љ–Њ–≤ H. influenzae –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –љ–µ –±—Л–ї–Њ [4].
–®–Є—А–Њ–Ї–Є–є —Б–њ–µ–Ї—В—А –і–µ–є—Б—В–≤–Є—П, –≤–Ї–ї—О—З–∞—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е –Є –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, —Б –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ–Љ –≤—Л—Б–Њ–Ї–Є—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –≤ –Ї—А–Њ–≤–Є –Є –Љ–Њ–Ї—А–Њ—В–µ, –љ–Є–Ј–Ї–Њ–є —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Б—В—Г–њ–µ–љ—З–∞—В–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤—Л–±–Њ—А–∞ –і–ї—П —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Ш–Э–Ф–Я.
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Р/–Ъ–Ъ –њ—А–Є –Ш–Э–Ф–Я –±—Л–ї–∞ –і–Њ–Ї–∞–Ј–∞–љ–∞ –Љ–љ–Њ–≥–Є–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ–Є, –і–∞–ґ–µ –њ—А–Є —В—П–ґ–µ–ї–Њ–Љ —В–µ—З–µ–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б —Г—З–∞—Б—В–Є–µ–Љ 50 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–љ–µ–≤–Љ–Њ–љ–Є–µ–є —В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П, —В—А–µ–±—Г—О—Й–µ–є –≤–µ–і–µ–љ–Є—П –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤ 76% —Б–ї—Г—З–∞–µ–≤ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –Р/–Ъ–Ъ [12].
–Р–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В—Г –Њ—В–≤–µ–і–µ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –Љ–µ—Б—В–Њ –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е —Б—Е–µ–Љ–∞—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є –Т–Я —Г –≤–Ј—А–Њ—Б–ї—Л—Е [10]. –Ш–Љ–µ–љ–љ–Њ –Р/–Ъ–Ъ (–Я–∞–љ–Ї–ї–∞–≤) –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Ї–ї–∞—Б—Б –Ј–∞—Й–Є—Й–µ–љ–љ—Л—Е –∞–Љ–Є–љ–Њ–њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤ –≤ —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ–Њ –≤–µ–і–µ–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Т–Я. –Я–∞–љ–Ї–ї–∞–≤ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ –≤ —Б–ї—Г—З–∞—П—Е –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–Љ–µ—О—Й–Є—Е —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞, —В–∞–Ї–Є–µ –Ї–∞–Ї –≤–Њ–Ј—А–∞—Б—В —Б—В–∞—А—И–µ 60 –ї–µ—В –Є/–Є–ї–Є –љ–∞–ї–Є—З–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (—Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –±—А–Њ–љ—Е–Є—В/–•–Ю–С–Ы, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, –Ј–∞—Б—В–Њ–є–љ–∞—П —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–µ—З–µ–љ–Є). –Ш–Љ–µ–љ–љ–Њ —Г —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –љ–∞–ї–Є—З–Є—П –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ-—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е S. pneumoniae, H. influenzae, S. aureus –Є –±–∞–Ї—В–µ—А–Є–є —Б–µ–Љ–µ–є—Б—В–≤–∞ Enterobacteriaceae [2].
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Р/–Ъ–Ъ —Б –і—А—Г–≥–Є–Љ–Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є –∞–≥–µ–љ—В–∞–Љ–Є –і–ї—П –ї–µ—З–µ–љ–Є—П –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞–ї–Є –≤—Л—Б–Њ–Ї—Г—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –Є –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Р/–Ъ–Ъ. –Ґ–∞–Ї, –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ –Є —Б–њ–∞—А—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–Њ–Љ –њ—А–Є –њ–љ–µ–≤–Љ–Њ–љ–Є–Є —Б—А–µ–і–љ–µ—В—П–ґ–µ–ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П —Г—Б–њ–µ—Е –±—Л–ї –і–Њ—Б—В–Є–≥–љ—Г—В —Г 87% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –Р/–Ъ–Ъ [15]. –Р/–Ъ–Ъ –љ–µ —Г—Б—В—Г–њ–∞–µ—В –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –љ–Њ–≤—Л–Љ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –∞–≥–µ–љ—В–∞–Љ. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Bonvehi et al. –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —З–∞—Б—В–Њ—В–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤—Л–Ј–і–Њ—А–Њ–≤–ї–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Т–Я –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ, –њ—А–Є–љ–Є–Љ–∞–≤—И–µ–є –Р/–Ъ–Ъ (93%), –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є, –њ—А–Є–љ–Є–Љ–∞–≤—И–µ–є –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ (91%) [8]. –Я–Њ —Б–≤–Њ–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Т–Я –Р/–Ъ–Ъ –љ–µ —Г—Б—В—Г–њ–∞–µ—В —В–∞–Ї–ґ–µ –Є —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л–Љ —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞–Љ.
–Ю–і–љ–∞–Ї–Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–Є –∞—В–Є–њ–Є—З–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є –љ–µ –њ–Њ–і–і–∞—О—В—Б—П –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О β-–ї–∞–Ї—В–∞–Љ–љ—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, —З—В–Њ –Њ–±—К—П—Б–љ—П–µ—В –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Н—Д—Д–µ–Ї—В–∞ –Њ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞. –Э–∞–Є–±–Њ–ї—М—И–µ–є –њ—А–Є—А–Њ–і–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –і–ї—П –ї–µ—З–µ–љ–Є—П –Т–Я, –≤—Л–Ј–≤–∞–љ–љ—Л—Е –∞—В–Є–њ–Є—З–љ—Л–Љ–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є, –Њ–±–ї–∞–і–∞—О—В –Љ–∞–Ї—А–Њ–ї–Є–і—Л, —Н—В–Њ –њ—А–µ–њ–∞—А–∞—В—Л –≤—Л–±–Њ—А–∞. –Ю–і–љ–∞–Ї–Њ –≤ –†–Њ—Б—Б–Є–Є –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –Љ–µ–љ—М—И–µ, —З–µ–Љ –≤ –Х–≤—А–Њ–њ–µ –Є–ї–Є –°–µ–≤–µ—А–љ–Њ–є –Р–Љ–µ—А–Є–Ї–µ.
–°—А–µ–і–Є –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –Њ—Б–Њ–±–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П –Ј–∞—Б–ї—Г–ґ–Є–≤–∞–µ—В –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ (15-—З–ї–µ–љ–љ—Л–є –њ–Њ–ї—Г—Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–є –Љ–∞–Ї—А–Њ–ї–Є–і-–∞–Ј–∞–ї–Є–і). –Я—А–µ–њ–∞—А–∞—В –±—Л—Б—В—А–Њ –∞–±—Б–Њ—А–±–Є—А—Г–µ—В—Б—П –Є–Ј –Ц–Ъ–Ґ, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –µ–≥–Њ —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М—О –≤ –Ї–Є—Б–ї–Њ–є —Б—А–µ–і–µ –Є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О, —Е–Њ—А–Њ—И–Њ –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤ –і—Л—Е–∞—В–µ–ї—М–љ—Л–µ –њ—Г—В–Є. –Р–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ (–•–µ–Љ–Њ–Љ–Є—Ж–Є–љ), –Ї–∞–Ї –Є –≤—Б–µ –Љ–∞–Ї—А–Њ–ї–Є–і—Л, –љ–∞—А—Г—И–∞–µ—В —Б–Є–љ—В–µ–Ј –±–µ–ї–Ї–∞ —А–Є–±–Њ—Б–Њ–Љ–∞–Љ–Є –Љ–Є–Ї—А–Њ–±–љ–Њ–є –Ї–ї–µ—В–Ї–Є. –Р–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤–љ—Г—В—А—М –Ї–ї–µ—В–Њ–Ї, —Б–Њ–Ј–і–∞–≤–∞—П —В–∞–Љ –≤—Л—Б–Њ–Ї–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–є, –≤—Л–Ј–≤–∞–љ–љ—Л—Е –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–Љ–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є.
–Р–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Њ–±–ї–∞–і–∞–µ—В —Г–љ–Є–Ї–∞–ї—М–љ—Л–Љ–Є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ–Є – –≤—Л—Б–Њ–Ї–Њ–є —Б—В–µ–њ–µ–љ—М—О –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –≤ —В–Ї–∞–љ—П—Е (–≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–∞—П –і–µ–њ–Њ–Ј–Є—Ж–Є—П), –њ—А–µ–≤—Л—И–∞—О—Й–µ–є —Г—А–Њ–≤–љ–Є –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –≤ 10–100 —А–∞–Ј. –Ф–∞–љ–љ–Њ–µ —Б–≤–Њ–є—Б—В–≤–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О –њ—А–µ–њ–∞—А–∞—В–∞. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤ –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞, —А–∞–Ј–ї–Є—З–Є–є –≤ —Г—А–Њ–≤–љ—П—Е –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –Є –≤ –ї–µ–≥–Њ—З–љ–Њ–є —В–Ї–∞–љ–Є —Г –Ї–Њ—В–Њ—А–Њ–≥–Њ –љ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П. –С–ї–∞–≥–Њ–і–∞—А—П –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—О –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –≤ —Д–∞–≥–Њ—Ж–Є—В–∞—Е –њ—А–µ–њ–∞—А–∞—В —А–∞—Б–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤ –Њ—З–∞–≥–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ –≤ –Њ—З–∞–≥–µ –Є–љ—Д–µ–Ї—Ж–Є–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ, —З–µ–Љ –≤ –Ј–і–Њ—А–Њ–≤—Л—Е —В–Ї–∞–љ—П—Е.
–Р–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ —Б –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Њ–љ–љ–Њ-–Ј–∞–≤–Є—Б–Є–Љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О. –°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –љ–∞–Ї–∞–њ–ї–Є–≤–∞—В—М—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –ї–Є–Ј–Њ—Б–Њ–Љ–∞—Е –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–∞ –і–ї—П —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Д–∞–≥–Њ—Ж–Є—В—Л –і–Њ—Б—В–∞–≤–ї—П—О—В –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –≤ –Љ–µ—Б—В–∞ –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є, –≥–і–µ –Њ–љ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–µ—В—Б—П –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —Д–∞–≥–Њ—Ж–Є—В–Њ–Ј–∞. –Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –≤ –Њ—З–∞–≥–∞—Е –Є–љ—Д–µ–Ї—Ж–Є–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ, —З–µ–Љ –≤ –Ј–і–Њ—А–Њ–≤—Л—Е —В–Ї–∞–љ—П—Е (–≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 24–34%) –Є –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б–Њ —Б—В–µ–њ–µ–љ—М—О –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—В–µ–Ї–∞. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –≤—Л—Б–Њ–Ї—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –≤ —Д–∞–≥–Њ—Ж–Є—В–∞—Е, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –Є—Е —Д—Г–љ–Ї—Ж–Є—О.
–≠—В–Њ–Љ—Г —Г–љ–Є–Ї–∞–ї—М–љ–Њ–Љ—Г –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—О –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ –њ—А–Є—Б—Г—Й–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–∞—П —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М. –Ф–µ–є—Б—В–≤—Г–µ—В –і–ї–Є—В–µ–ї—М–љ–Њ (–Ґ1/2 = 2–4 —Б—Г—В) —Б –љ–∞–ї–Є—З–Є–µ–Љ –њ–Њ—Б—В–∞–љ—В–Є–±–Є–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ (–њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–є –≤ –Њ—З–∞–≥–µ –Є–љ—Д–µ–Ї—Ж–Є–Є –≤ —В–µ—З–µ–љ–Є–µ 3–5 –і–љ–µ–є –њ–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞) –њ—А–Њ—В–Є–≤ S. pyogenes, S. pneumoniae, H. influenzae, L. pneumophila, –њ—А–Є—З–µ–Љ –њ–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–Њ—Б—В–∞–љ—В–Є–±–Є–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї H. influenzae, L. pneumophila –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ—Г—О –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М –•–µ–Љ–Њ–Љ–Є—Ж–Є–љ–∞ –≤ —В–µ—А–∞–њ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є – —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М 3–5-–і–љ–µ–≤–љ—Л—Е –Ї—Г—А—Б–Њ–≤ –ї–µ—З–µ–љ–Є—П. –І–µ—А–µ–Ј –≥–µ–Љ–∞—В–Њ—Н–љ—Ж–µ—Д–∞–ї–Є—З–µ—Б–Ї–Є–є –±–∞—А—М–µ—А –љ–µ –њ—А–Њ–љ–Є–Ї–∞–µ—В. –≠–ї–Є–Љ–Є–љ–∞—Ж–Є—П —А–µ–љ–∞–ї—М–љ–∞—П –≤ –љ–µ–Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–Љ –≤–Є–і–µ –Є —Б –ґ–µ–ї—З—М—О. –Я—А–Є –њ–Њ—З–µ—З–љ–Њ–є –Є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–µ—А–Є–Њ–і–∞ –њ–Њ–ї—Г—Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П. –Я—А–µ–њ–∞—А–∞—В –љ–µ –≤–ї–Є—П–µ—В –љ–∞ –Љ–Є–Ї—А–Њ—Б–Њ–Љ–∞–ї—М–љ—Г—О —Б–Є—Б—В–µ–Љ—Г –њ–µ—З–µ–љ–Є (—Ж–Є—В–Њ—Е—А–Њ–Љ –†450), —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –љ–µ –≤–Њ–Ј–љ–Є–Ї–∞—О—В —Б–≤–Њ–є—Б—В–≤–µ–љ–љ—Л–µ –і–∞–љ–љ–Њ–Љ—Г –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—О —А–µ–∞–Ї—Ж–Є–Є.
–Р–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ (–•–µ–Љ–Њ–Љ–Є—Ж–Є–љ) —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤ –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ—Л—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е –≤ –Њ—З–∞–≥–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ
5–7 –і–љ–µ–є –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –њ–Њ—Б–ї–µ–і–љ–µ–є –і–Њ–Ј—Л, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —А–∞–Ј—А–∞–±–Њ—В–∞—В—М –Ї–Њ—А–Њ—В–Ї–Є–µ (3- –Є 5-–і–љ–µ–≤–љ—Л–µ) –Ї—Г—А—Б—Л –ї–µ—З–µ–љ–Є—П –Є –њ—А–Є–Љ–µ–љ—П—В—М –њ—А–µ–њ–∞—А–∞—В 1 —А./—Б—Г—В. –Ъ–Њ—А–Њ—В–Ї–Є–µ –Ї—Г—А—Б—Л –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є —Г–і–Њ–±–љ—Л –Є —В–µ–Љ, —З—В–Њ —Г–Љ–µ–љ—М—И–∞—О—В –Ј–∞—В—А–∞—В—Л –љ–∞ –ї–µ—З–µ–љ–Є–µ. –Я—А–Є–µ–Љ —Б –њ–Є—Й–µ–є —Б–љ–Є–ґ–∞–µ—В –≤—Б–∞—Б—Л–≤–∞–µ–Љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞, –њ–Њ—Н—В–Њ–Љ—Г –µ–≥–Њ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Є–љ–Є–Љ–∞—В—М –Ј–∞ 1 —З –Є–ї–Є –љ–µ –Љ–µ–љ–µ–µ —З–µ–Љ —З–µ—А–µ–Ј 2 —З –њ–Њ—Б–ї–µ –µ–і—Л. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –µ—Б—В—М –і–∞–љ–љ—Л–µ, —З—В–Њ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Д–Њ—А–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –≤–Є–і–µ —Б—Г—Б–њ–µ–љ–Ј–Є–Є –Є —В–∞–±–ї–µ—В–Њ–Ї –њ–Њ 0,5 –≥ –љ–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є [17].
–•–µ–Љ–Њ–Љ–Є—Ж–Є–љ –Њ–±–ї–∞–і–∞–µ—В –≤—Л—Б–Њ–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ—А–Њ—В–Є–≤ –њ–љ–µ–≤–Љ–Њ–Ї–Њ–Ї–Ї–Њ–≤ –Є –і—А—Г–≥–Є—Е —Б—В—А–µ–њ—В–Њ–Ї–Њ–Ї–Ї–Њ–≤, –Љ–µ—В–Є—Ж–Є–ї–ї–Є–љ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–Њ–≤, –≥–Њ–љ–Њ–Ї–Њ–Ї–Ї–Њ–≤, –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –∞—В–Є–њ–Є—З–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є, M. catarrhalis, –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –і—А—Г–≥–Є–µ –Љ–∞–Ї—А–Њ–ї–Є–і—Л –њ–Њ –і–µ–є—Б—В–≤–Є—О –љ–∞ –≥–µ–Љ–Њ—Д–Є–ї—М–љ—Г—О –њ–∞–ї–Њ—З–Ї—Г. –°—А–µ–і–Є –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ —В–Њ–ї—М–Ї–Њ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Є –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Є–Љ–µ—О—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є –Є–љ—Д–µ–Ї—Ж–Є—П—Е, –≤—Л–Ј–≤–∞–љ–љ—Л—Е –≥–µ–Љ–Њ—Д–Є–ї—М–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Њ–є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –і—А—Г–≥–Є—Е –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤ —Б—З–Є—В–∞–µ—В—Б—П –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л–Љ –≤ —Б–Є–ї—Г –Њ—В—Б—Г—В—Б—В–≤–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї H. influenzae. –Э–∞–њ—А–Є–Љ–µ—А, –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ –љ–µ–Љ–љ–Њ–≥–Њ –њ–Њ–і–∞–≤–ї—П–µ—В —Д—Г–љ–Ї—Ж–Є—О –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤, –њ–Њ—Н—В–Њ–Љ—Г –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤–љ—Г—В—А–Є –Ї–ї–µ—В–Њ–Ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–Є–ґ–µ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –њ—А–Є –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ–Њ–ґ–µ—В –љ–µ —Б–Њ—З–µ—В–∞—В—М—Б—П —Б –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є, —В. –µ. —Н—А–∞–і–Є–Ї–∞—Ж–Є–µ–є H. influenzae, —З—В–Њ —В—А–µ–±—Г–µ—В –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П.
–•–µ–Љ–Њ–Љ–Є—Ж–Є–љ –Њ–±–ї–∞–і–∞–µ—В –њ–Њ—Б—В–∞–љ—В–Є–±–Є–Њ—В–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, –њ–Њ–і –Ї–Њ—В–Њ—А—Л–Љ –њ–Њ–љ–Є–Љ–∞—О—В —Б—В–Њ–є–Ї–Њ–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ —А–Њ—Б—В–∞ –±–∞–Ї—В–µ—А–Є–є –њ–Њ—Б–ї–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –љ–Є—Е –Р–Ь–Я. –Ш–љ—В–µ—А–µ—Б–љ—Л–Љ–Є –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В—Б—П –і–∞–љ–љ—Л–µ –њ–Њ –Њ—А–≥–∞–љ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–Љ —Б–≤–Њ–є—Б—В–≤–∞–Љ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–µ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, –Њ—В—З–∞—Б—В–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –∞–Ј–∞–ї–Є–і–Њ–≤ –Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ [4]. –Ґ–∞–Ї, –≤ –љ–µ–і–∞–≤–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є X.R. Zhang et al. (2007) [18] –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Њ–±–ї–∞–і–∞–µ—В –±—А–Њ–љ—Е–Њ–ї–µ–≥–Њ—З–љ—Л–Љ–Є –њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –њ—А–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П—Е, –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–Є–≥–∞—А–µ—В–љ—Л–Љ –і—Л–Љ–Њ–Љ. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, —В–∞–±–∞—З–љ—Л–є –і—Л–Љ –≤—Л–Ј—Л–≤–∞–µ—В –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –∞–ї—М–≤–µ–Њ–ї–Њ—Ж–Є—В–Њ–≤ II —В–Є–њ–∞, –∞–Ї—В–Є–≤–Є—А—Г–µ—В –љ—Г–Ї–ї–µ–∞—А–љ—Л–є —Д–∞–Ї—В–Њ—А –Ї–∞–њ–њ–∞-–Т, –њ–Њ–≤—Л—И–∞–µ—В —Г—А–Њ–≤–µ–љ—М —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є. –£–Ї–∞–Ј–∞–љ–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Г–і–∞–µ—В—Б—П –Є–Ј–±–µ–ґ–∞—В—М –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ (–•–µ–Љ–Њ–Љ–Є—Ж–Є–љ), —З—В–Њ, –љ–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, –і–Њ–±–∞–≤–ї—П–µ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤ –і–∞–љ–љ–Њ–≥–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ –≤ —В–µ—А–∞–њ–Є–Є –±—А–Њ–љ—Е–Њ–ї–µ–≥–Њ—З–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Њ—Б—В–∞–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л—Е –Р–Ь–Я –≤ —В–µ—А–∞–њ–Є–Є –∞—В–Є–њ–Є—З–љ–Њ–є (–Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ–µ–љ–љ–Њ–є, –ї–µ–≥–Є–Њ–љ–µ–ї–ї–µ–Ј–љ–Њ–є) –њ–љ–µ–≤–Љ–Њ–љ–Є–Є [7]. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –Ї–∞–Ї –≤—Л–≥–Њ–і–љ—Л–Љ —Б–њ–µ–Ї—В—А–Њ–Љ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, —В–∞–Ї –Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –њ—А–µ–њ–∞—А–∞—В–∞ (–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –ї–µ–≥–Њ—З–љ–∞—П –і–µ–њ–Њ–Ј–Є—Ж–Є—П), —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –Є –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є.
–Т —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞, –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Ж–µ—Д—Г—А–Њ–Ї—Б–Є–Љ–∞ —Б —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ –Є–ї–Є –Р/–Ъ–Ъ –њ—А–Є –Т–Я —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –Њ–і–Є–љ–∞–Ї–Њ–≤–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –љ–Њ –њ—А–Є –ї—Г—З—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Є –Љ–µ–љ—М—И–µ–є —З–∞—Б—В–Њ—В–µ –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є (12%). –Т –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Ж–µ—Д—Г—А–Њ–Ї—Б–Є–Љ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ, —З–∞—Б—В–Њ—В–∞ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 48% (–Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –і–Є—Б–њ–µ–њ—Б–Є—З–µ—Б–Ї–Є–є —Б–Є–Љ–њ—В–Њ–Љ–Њ–Ї–Њ–Љ–њ–ї–µ–Ї—Б). –Я—А–Є —Д–∞—А–Љ–∞–Ї–Њ—Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ –Є–ї–Є —Б–Њ—З–µ—В–∞–љ–Є–µ–Љ —Ж–µ—Д—Г—А–Њ–Ї—Б–Є–Љ–∞ —Б —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ –≤ —А–µ–ґ–Є–Љ–∞—Е «—Б—В—Г–њ–µ–љ—З–∞—В–Њ–є» —В–µ—А–∞–њ–Є–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–∞—П —Б—В–Њ–Є–Љ–Њ—Б—В—М –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ –Є —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–µ–є. –Я—А–Є —Н—В–Њ–Љ –љ–µ —Г—З—В–µ–љ—Л –Ј–∞—В—А–∞—В—Л –љ–∞ –ї–µ—З–µ–љ–Є–µ –≤–Њ–Ј–љ–Є–Ї—И–Є—Е –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П —Б—В–Њ–Є–Љ–Њ—Б—В—М –Ї–Њ–є–Ї–Њ-–і–љ—П –Є —В—А—Г–і–Њ–Ј–∞—В—А–∞—В –њ–µ—А—Б–Њ–љ–∞–ї–∞ –≤ —Б—А–∞–≤–љ–Є–≤–∞–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е, –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П —Г–і–Њ–±—Б—В–≤–∞ —А–µ–ґ–Є–Љ–Њ–≤ –ї–µ—З–µ–љ–Є—П –Є –Њ–±—Й–µ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –ї–µ—З–µ–±–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ–±—Й–Є–Љ –і–Є–Ј–∞–є–љ–Њ–Љ –ї–µ—З–µ–љ–Є—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–µ–є —Ж–µ—Д—Г—А–Њ–Ї—Б–Є–Љ–∞ —Б —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–Њ–Љ.
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ —Е–Њ—А–Њ—И–Њ –Ј–∞—А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї —Б–µ–±—П –Є –≤ –њ–µ–і–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ: –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є F. Marra [16] –њ–Њ–Ї–∞–Ј–∞–љ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ —Г –і–µ—В–µ–є –≤ –Ъ–∞–љ–∞–і–µ. –Р–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ –Њ—Б—В–∞–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ —Г –і–µ—В–µ–є –≤ —В–µ—А–∞–њ–Є–Є —Е–ї–∞–Љ–Є–і–Є–є–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є (–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Є—В–∞), –њ—А–Є–≤–Њ–і—П –Ї –±—Л—Б—В—А–Њ–є —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П. –Т–∞–ґ–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –њ—А–µ–њ–∞—А–∞—В–∞ —П–≤–ї—П–µ—В—Б—П —В–Њ, —З—В–Њ, —Б–Њ–≥–ї–∞—Б–љ–Њ CDC-2006, –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є (–≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –і—А—Г–≥–Є—Е –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤).
–С–Њ–ї–µ–µ —З–µ–Љ 20-–ї–µ—В–љ–Є–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –µ–≥–Њ –њ–Њ–Є—Б—В–Є–љ–µ –≤—Б–µ–Љ–Є—А–љ–Њ–Љ –њ—А–Є–Ј–љ–∞–љ–Є–Є. –Ю—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П —В–∞–Ї–Њ–є –њ–Њ–њ—Г–ї—П—А–љ–Њ—Б—В–Є –Є –≤–Њ—Б—В—А–µ–±–Њ–≤–∞–љ–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ—Б–ї—Г–ґ–Є–ї–∞ –і–Њ–Ї–∞–Ј–∞–љ–љ–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –њ—А–Є –±—А–Њ–љ—Е–Њ–ї–µ–≥–Њ—З–љ—Л—Е –Є –і—А—Г–≥–Є—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е –љ–∞—А—П–і—Г —Б –µ–≥–Њ –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ–Є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, —Г–і–Њ–±–љ—Л–Љ —А–µ–ґ–Є–Љ–Њ–Љ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –Є —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О.