–ü—Ä–ĺ–Ī–Ľ–Ķ–ľ—č –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ–ĺ–Ļ (–Ď–ź) –Ĺ–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć –ĺ—Ā—ā–į—é—ā—Ā—Ź –≤ —Ü–Ķ–Ĺ—ā—Ä–Ķ –≤–Ĺ–ł–ľ–į–Ĺ–ł—Ź –Ņ—Ä–į–ļ—ā–ł–ļ—É—é—Č–ł—Ö –≤—Ä–į—á–Ķ–Ļ, —Ą–į—Ä–ľ–į—Ü–Ķ–≤—ā–ĺ–≤, —ć–Ņ–ł–ī–Ķ–ľ–ł–ĺ–Ľ–ĺ–≥–ĺ–≤, —ć–ļ–ĺ–Ĺ–ĺ–ľ–ł—Ā—ā–ĺ–≤. –Ď–ź —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ĺ–ī–Ĺ–ł–ľ –ł–∑ —Ā–į–ľ—č—Ö —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ—č—Ö —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ. –ö–į–ļ —Ā–≤–ł–ī–Ķ—ā–Ķ–Ľ—Ć—Ā—ā–≤—É—é—ā –Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ—č–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź, –ĺ–ļ–ĺ–Ľ–ĺ 5% –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź –∑–Ķ–ľ–Ĺ–ĺ–≥–ĺ —ą–į—Ä–į —Ā—ā—Ä–į–ī–į—é—ā –ĺ—ā –į—Ā—ā–ľ—č. –í –Ĺ–Ķ–ļ–ĺ—ā–ĺ—Ä—č—Ö —Ä–Ķ–≥–ł–ĺ–Ĺ–į—Ö —ć—ā–ĺ—ā –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –≤—č—ą–Ķ. –Ď–ź –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ —É—Ö—É–ī—ą–į–Ķ—ā –ļ–į—á–Ķ—Ā—ā–≤–ĺ –∂–ł–∑–Ĺ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ĺ–ĺ –ł –ľ–ĺ–∂–Ķ—ā –Ņ—Ä–ł–≤–Ķ—Ā—ā–ł –ļ —Ā–ľ–Ķ—Ä—ā–Ķ–Ľ—Ć–Ĺ–ĺ–ľ—É –ł—Ā—Ö–ĺ–ī—É. –í 2008 –≥. –ł–∑ 57 –ľ–Ľ–Ĺ —Ā–ľ–Ķ—Ä—ā–Ķ–Ļ 36 –ľ–Ľ–Ĺ (63%) –Ņ—Ä–ł—ą–Ľ–ĺ—Ā—Ć –Ĺ–į –ī–ĺ–Ľ—é –Ĺ–Ķ–ł–Ĺ—Ą–Ķ–ļ—Ü–ł–ĺ–Ĺ–Ĺ—č—Ö —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ, –≤–ļ–Ľ—é—á–į—Ź —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ —Ä–Ķ—Ā–Ņ–ł—Ä–į—ā–ĺ—Ä–Ĺ—č–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź [1].
–í —Ā—Ä–Ķ–ī–Ĺ–Ķ–ľ —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ď–ź –≤ –ľ–ł—Ä–Ķ –ļ–ĺ–Ľ–Ķ–Ī–Ľ–Ķ—ā—Ā—Ź –≤ –Ņ—Ä–Ķ–ī–Ķ–Ľ–į—Ö 1–18%. –ü–ĺ –†–ĺ—Ā—Ā–ł–ł —ć—ā–ĺ—ā –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā 5,6–7,3% –ī–Ľ—Ź –≤–∑—Ä–ĺ—Ā–Ľ–ĺ–≥–ĺ –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ł 5,6–12,1% —É –ī–Ķ—ā–Ķ–Ļ. –Ē–Ķ–Ī—é—ā –Ď–ź –≤ –≤–ĺ–∑—Ä–į—Ā—ā–Ķ –ī–ĺ 14 –Ľ–Ķ—ā –Ņ–ĺ—á—ā–ł –≤ 2 —Ä–į–∑–į –≤—č—ą–Ķ —É –ľ–į–Ľ—Ć—á–ł–ļ–ĺ–≤, —á–Ķ–ľ —É –ī–Ķ–≤–ĺ—á–Ķ–ļ [2]. –í –ľ–ł—Ä–Ķ —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć —ā–Ķ–ļ—É—Č–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ —Ā–≤–ł—Ā—ā—Ź—Č–Ķ–≥–ĺ –ī—č—Ö–į–Ĺ–ł—Ź —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā—Ā—Ź –Ĺ–į 0,03% –≤ –≥–ĺ–ī —É –ī–Ķ—ā–Ķ–Ļ 13–14 –Ľ–Ķ—ā –ł —É–ľ–Ķ–Ĺ—Ć—ą–į–Ķ—ā—Ā—Ź –Ĺ–į 0,07% –≤ –≥–ĺ–ī —É –ī–Ķ—ā–Ķ–Ļ 6–7 –Ľ–Ķ—ā. –í –≥. –ú–ĺ—Ā–ļ–≤–Ķ –≤ –Ņ–Ķ—Ä–ł–ĺ–ī —Ā 1993 –Ņ–ĺ 2002 –≥. –∑–į—Ą–ł–ļ—Ā–ł—Ä–ĺ–≤–į–Ĺ —Ä–ĺ—Ā—ā –Ņ–ĺ—á—ā–ł –≤ 2,5 —Ä–į–∑–į —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —ā–Ķ–ļ—É—Č–ł—Ö –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ –Ď–ź, –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –Ĺ–ĺ—á–Ĺ—č—Ö —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–≤ [3].
–Ě–į–Ľ–ł—á–ł–Ķ –Ď–ź –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –≤–Ľ–ł—Ź–Ķ—ā –Ĺ–į –ļ–į—á–Ķ—Ā—ā–≤–ĺ –∂–ł–∑–Ĺ–ł –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö. –í –∑–į–≤–ł—Ā–ł–ľ–ĺ—Ā—ā–ł –ĺ—ā –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –į—Ā—ā–ľ—č –ł–∑–ľ–Ķ–Ĺ—Ź–Ķ—ā—Ā—Ź –ł –Ņ—Ä–ł–≤—č—á–Ĺ—č–Ļ —Ä–ł—ā–ľ –ł—Ö –∂–ł–∑–Ĺ–ł. –í –Ņ–Ķ—Ä–ł–ĺ–ī –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł—Ź –ł–Ľ–ł –Ņ—Ä–ł –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–ł –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –Ĺ–į–ī –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ–ľ —Ā–Ĺ–ł–∂–į—é—ā—Ā—Ź —Ą–ł–∑–ł—á–Ķ—Ā–ļ–į—Ź –ł —É–ľ—Ā—ā–≤–Ķ–Ĺ–Ĺ–į—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į, —á–į—Ā—ā–ĺ—ā–į –∑–į–Ĺ—Ź—ā–ł–Ļ —Ā–Ņ–ĺ—Ä—ā–ĺ–ľ, —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā—Ā—Ź —á–ł—Ā–Ľ–ĺ –ī–Ĺ–Ķ–Ļ –Ĺ–Ķ—ā—Ä—É–ī–ĺ—Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā–ł –ł–Ľ–ł –Ņ—Ä–ĺ–Ņ—É—Ā–ļ–ĺ–≤ –∑–į–Ĺ—Ź—ā–ł–Ļ –≤ —ą–ļ–ĺ–Ľ–Ķ, —á—ā–ĺ –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ĺ—ā—Ä–į–∂–į–Ķ—ā—Ā—Ź –Ĺ–į –Ņ–ĺ–≤—Ā–Ķ–ī–Ĺ–Ķ–≤–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –ł –ī–Ķ—ā–Ķ–Ļ, –ł –≤–∑—Ä–ĺ—Ā–Ľ—č—Ö. –Ď–ĺ–Ľ–Ķ–Ķ —ā–ĺ–≥–ĺ, —ć—ā–ĺ –Ĺ–į–ļ–Ľ–į–ī—č–≤–į–Ķ—ā –ĺ—ā–Ņ–Ķ—á–į—ā–ĺ–ļ –ł –Ĺ–į –Ņ—Ā–ł—Ö–ł—á–Ķ—Ā–ļ–ĺ–Ķ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł–Ķ –Ī–ĺ–Ľ–Ķ—é—Č–ł—Ö, –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –ī–Ķ—ā–Ķ–Ļ. –°—ā—Ä–į—Ö –Ņ–Ķ—Ä–Ķ–ī –≤–ĺ–∑–Ĺ–ł–ļ–Ĺ–ĺ–≤–Ķ–Ĺ–ł–Ķ–ľ –Ī—Ä–ĺ–Ĺ—Ö–ĺ—Ā–Ņ–į–∑–ľ–į –ľ–ĺ–∂–Ķ—ā –Ņ–ĺ—Ā–Ľ—É–∂–ł—ā—Ć –Ņ—Ä–ł—á–ł–Ĺ–ĺ–Ļ –ĺ—ā–ļ–į–∑–į –ĺ—ā –∑–į–Ĺ—Ź—ā–ł–Ļ –Ľ—é–Ī–ł–ľ—č–ľ –ī–Ķ–Ľ–ĺ–ľ –ł–Ľ–ł –Ľ—é–Ī–ł–ľ—č–ľ –≤–ł–ī–ĺ–ľ —Ā–Ņ–ĺ—Ä—ā–į, –į —ā–į–ļ–∂–Ķ, –∑–į—á–į—Ā—ā—É—é –Ĺ–Ķ–ĺ–Ņ—Ä–į–≤–ī–į–Ĺ–Ĺ–ĺ, —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā —á–į—Ā—ā–ĺ—ā—É –Ņ—Ä–ł–Ķ–ľ–į –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –Ĺ–Ķ–ĺ—ā–Ľ–ĺ–∂–Ĺ–ĺ–Ļ –Ņ–ĺ–ľ–ĺ—Č–ł. –í —Ā–≤—Ź–∑–ł —Ā —ć—ā–ł–ľ –≥–Ľ–į–≤–Ĺ–į—Ź –∑–į–ī–į—á–į –≤—Ä–į—á–į – —Ā–≤–ĺ–Ķ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ –ł –Ņ—Ä–į–≤–ł–Ľ—Ć–Ĺ–ĺ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—Ä–ĺ–≤–į—ā—Ć –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–ł—ā—Ć –Ķ–≥–ĺ —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ, —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć —ā—Ź–∂–Ķ—Ā—ā–ł —ā–Ķ—á–Ķ–Ĺ–ł—Ź –ł –Ņ–ĺ–ī–ĺ–Ī—Ä–į—ā—Ć —ā–į–ļ—É—é —ā–Ķ—Ä–į–Ņ–ł—é, –ļ–ĺ—ā–ĺ—Ä–į—Ź –Ņ–ĺ–ľ–ĺ–∂–Ķ—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā—É –∂–ł—ā—Ć —Ā –į—Ā—ā–ľ–ĺ–Ļ, –Ĺ–Ķ –ĺ—ā–ļ–į–∑—č–≤–į—Ź—Ā—Ć –ĺ—ā –Ņ—Ä–ł–≤—č—á–Ĺ–ĺ–≥–ĺ –ĺ–Ī—Ä–į–∑–į –∂–ł–∑–Ĺ–ł.
–ß–į—Ā—ā—č–Ķ –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł—Ź –ł –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ—č–Ļ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć –Ď–ź –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ —É—Ö—É–ī—ą–į—é—ā –ļ–į—á–Ķ—Ā—ā–≤–ĺ –∂–ł–∑–Ĺ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ĺ–ĺ –ł —É–≤–Ķ–Ľ–ł—á–ł–≤–į—é—ā —ć–ļ–ĺ–Ĺ–ĺ–ľ–ł—á–Ķ—Ā–ļ–ł–Ķ –∑–į—ā—Ä–į—ā—č (—Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ĺ–ĺ–Ķ –ł –į–ľ–Ī—É–Ľ–į—ā–ĺ—Ä–Ĺ–ĺ–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ, –ī–ĺ–Ņ–ĺ–Ľ–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ –Ī–ĺ–Ľ—Ć–Ĺ–ł—á–Ĺ—č–Ķ –Ľ–ł—Ā—ā—č). –ü–ĺ—ć—ā–ĺ–ľ—É –∑–į–ī–į—á–Ķ–Ļ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ–Ķ–Ļ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ä–į–∑—Ä–į–Ī–ĺ—ā–ļ–į –Ĺ–ĺ–≤—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤, —É–Ľ—É—á—ą–į—é—Č–ł—Ö –ļ–į—á–Ķ—Ā—ā–≤–ĺ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –Ď–ź.
–Ě–Ķ–ľ–Ĺ–ĺ–≥–ĺ –ł—Ā—ā–ĺ—Ä–ł–ł
–ě–ī–Ĺ–ł–ľ –ł–∑ –Ņ–Ķ—Ä–≤—č—Ö —É—á–Ķ–Ĺ—č—Ö, –ĺ–Ņ–ł—Ā–į–≤—ą–ł—Ö –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –į—Ā—ā–ľ—č, –Ī—č–Ľ –ď–ł–Ņ–Ņ–ĺ–ļ—Ä–į—ā (460–377 –≥–≥. –ī–ĺ –Ĺ.—ć.), –≤–Ņ–Ķ—Ä–≤—č–Ķ –≤–≤–Ķ–ī—ą–ł–Ļ —ć—ā–ĺ—ā —ā–Ķ—Ä–ľ–ł–Ĺ –≤–ĺ –≤—Ä–į—á–Ķ–Ī–Ĺ—č–Ļ –ĺ–Ī–ł—Ö–ĺ–ī. –í —ā—Ä—É–ī–į—Ö «–ĺ –≤–Ĺ—É—ā—Ä–Ķ–Ĺ–Ĺ–ł—Ö —Ā—ā—Ä–į–ī–į–Ĺ–ł—Ź—Ö» –≥–ĺ–≤–ĺ—Ä–ł—ā—Ā—Ź, —á—ā–ĺ –Ņ—Ä–ł—Ā—ā—É–Ņ—č –į—Ā—ā–ľ—č –Ĺ–ĺ—Ā—Ź—ā —Ā–Ņ–į—Ā—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —Ö–į—Ä–į–ļ—ā–Ķ—Ä, —Ā—Ä–Ķ–ī–ł –Ņ—Ä–ł—á–ł–Ĺ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł – —Ö–ĺ–Ľ–ĺ–ī –ł —Ā—č—Ä–ĺ—Ā—ā—Ć. –ü–ĺ–∑–ī–Ĺ–Ķ–Ķ –ź—Ä–Ķ—ā–Ķ–Ļ (III–II –≤–≤. –ī–ĺ –Ĺ.—ć.) –≤—č–ī–Ķ–Ľ–ł–Ľ 2 —Ą–ĺ—Ä–ľ—č –į—Ā—ā–ľ—č: —Ā–Ķ—Ä–ī–Ķ—á–Ĺ—É—é –ł –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ—É—é. –†–į–Ī–ĺ—ā–į–ľ–ł –ź—Ä–Ķ—ā–Ķ—Ź –ł –ď–į–Ľ–Ķ–Ĺ–į, –Ņ–ĺ–Ņ—č—ā–į–≤—ą–ł—Ö—Ā—Ź —ć–ļ—Ā–Ņ–Ķ—Ä–ł–ľ–Ķ–Ĺ—ā–į–Ľ—Ć–Ĺ–ĺ –ł–∑—É—á–ł—ā—Ć –Ņ—Ä–ł—á–ł–Ĺ—É –≤–ĺ–∑–Ĺ–ł–ļ–Ĺ–ĺ–≤–Ķ–Ĺ–ł—Ź –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ—É—ā–Ķ–Ļ, –∑–į–≤–Ķ—Ä—ą–ł–Ľ–ĺ—Ā—Ć –ł–∑—É—á–Ķ–Ĺ–ł–Ķ –Ď–ź –≤ –į–Ĺ—ā–ł—á–Ĺ—č–Ļ –Ņ–Ķ—Ä–ł–ĺ–ī –ľ–Ķ–ī–ł—Ü–ł–Ĺ—č. –í–ĺ–∑–ĺ–Ī–Ĺ–ĺ–≤–ł–Ľ–ĺ—Ā—Ć –ł–∑—É—á–Ķ–Ĺ–ł–Ķ –Ď–ź –≤ —ć–Ņ–ĺ—Ö—É –í–ĺ–∑—Ä–ĺ–∂–ī–Ķ–Ĺ–ł—Ź. –í —ć—ā–ĺ –≤—Ä–Ķ–ľ—Ź –ł–∑–≤–Ķ—Ā—ā–Ĺ—č–ľ –Ī—č–Ľ–ĺ –ł–ľ—Ź –ł—ā–į–Ľ—Ć—Ź–Ĺ—Ā–ļ–ĺ–≥–ĺ –≤—Ä–į—á–į –Ē–∂–Ķ—Ä–ĺ–Ľ–į–ľ–ĺ –ö–į—Ä–ī–į–Ĺ–ĺ (1501–1576), –≤—č–Ľ–Ķ—á–ł–≤—ą–Ķ–≥–ĺ –ĺ—ā –Ď–ź –į–Ĺ–≥–Ľ–ł–Ļ—Ā–ļ–ĺ–≥–ĺ –Ķ–Ņ–ł—Ā–ļ–ĺ–Ņ–į. –ö–į—Ä–ī–į–Ĺ–ĺ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–ĺ–≤–į–Ľ –ī–ł–Ķ—ā—É, —Ą–ł–∑–ł—á–Ķ—Ā–ļ–ł–Ķ —É–Ņ—Ä–į–∂–Ĺ–Ķ–Ĺ–ł—Ź –ł –∑–į–ľ–Ķ–Ĺ—É –Ņ—É—Ö–ĺ–≤–ĺ–Ļ –Ņ–Ķ—Ä–ł–Ĺ—č, –Ĺ–į –ļ–ĺ—ā–ĺ—Ä–ĺ–Ļ —Ā–Ņ–į–Ľ –Ķ–Ņ–ł—Ā–ļ–ĺ–Ņ [1, 4].
–Ď–ĺ–Ľ—Ć—ą–ĺ–Ļ –≤–ļ–Ľ–į–ī –≤ –ł–∑—É—á–Ķ–Ĺ–ł–Ķ –į—Ā—ā–ľ—č –≤–Ĺ–Ķ—Ā –Ī–Ķ–Ľ—Ć–≥–ł–Ļ—Ā–ļ–ł–Ļ –≤—Ä–į—á –ď–Ķ–Ľ—Ć–ľ–ĺ–Ĺ—ā (1577–1644), –≤–Ņ–Ķ—Ä–≤—č–Ķ –ĺ–Ņ–ł—Ā–į–≤—ą–ł–Ļ –Ņ—Ä–ł—Ā—ā—É–Ņ—č —É–ī—É—ą—Ć—Ź, –≤–ĺ–∑–Ĺ–ł–ļ–į—é—Č–ł–Ķ –Ņ—Ä–ł –≤–ī—č—Ö–į–Ĺ–ł–ł –ī–ĺ–ľ–į—ą–Ĺ–Ķ–Ļ –Ņ—č–Ľ–ł –ł —É–Ņ–ĺ—ā—Ä–Ķ–Ī–Ľ–Ķ–Ĺ–ł–ł –≤ –Ņ–ł—Č—É —Ä—č–Ī—č. –ě–Ĺ —ā–į–ļ–∂–Ķ –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–ł–Ľ, —á—ā–ĺ –Ņ—Ä–ł—á–ł–Ĺ—É —Ä–į–∑–≤–ł—ā–ł—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į –Ĺ—É–∂–Ĺ–ĺ –ł—Ā–ļ–į—ā—Ć –≤ –Ī—Ä–ĺ–Ĺ—Ö–į—Ö. –Ę–ĺ–Ľ—Ć–ļ–ĺ —á–Ķ—Ä–Ķ–∑ 100 –Ľ–Ķ—ā –Ķ–≥–ĺ –ľ—č—Ā–Ľ—Ć –Ĺ–į—ą–Ľ–į –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–Ķ–Ĺ–ł–Ķ –≤ —Ä–į–Ī–ĺ—ā–į—Ö –•–į–Ĺ—ā–Ķ—Ä–į (1750). –Ď–ź –ļ–į–ļ —Ā–į–ľ–ĺ—Ā—ā–ĺ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ –≤—č–ī–Ķ–Ľ–ł–Ľ–ł –≤–ĺ 2-–Ļ –Ņ–ĺ–Ľ–ĺ–≤–ł–Ĺ–Ķ XVII –≤. (Wills, 1682). –ė–∑-–∑–į –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł—Ź –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–ł–Ļ –ĺ –Ņ—Ä–ł—Ä–ĺ–ī–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ķ–Ķ –Ĺ–į–∑–≤–į–Ľ–ł —ć—Ā—Ā–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ–ĺ–Ļ.
–Ě–Ķ–ľ–į–Ľ—č–Ļ –≤–ļ–Ľ–į–ī –≤ –ł–∑—É—á–Ķ–Ĺ–ł–Ķ –Ď–ź –≤–Ĺ–Ķ—Ā–Ľ–ł –ł —Ä–ĺ—Ā—Ā–ł–Ļ—Ā–ļ–ł–Ķ —É—á–Ķ–Ĺ—č–Ķ: –ú.–ü. –ú—É–ī—Ä–ĺ–≤ (1826), –ď.–ė. –°–ĺ–ļ–ĺ–Ľ—Ć—Ā–ļ–ł–Ļ (1838), –ļ–ĺ—ā–ĺ—Ä–ĺ–ľ—É –Ņ—Ä–ł–Ĺ–į–ī–Ľ–Ķ–∂–ł—ā –ļ–Ľ–į—Ā—Ā–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ĺ–Ņ–ł—Ā–į–Ĺ–ł–Ķ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–≤ –Ď–ź, –°.–ü. –Ď–ĺ—ā–ļ–ł–Ĺ (1887), –ĺ–Ņ–ł—Ā–į–≤—ą–ł–Ļ –ļ–į—ā–į—Ä–į–Ľ—Ć–Ĺ—É—é –ł —Ä–Ķ—Ą–Ľ–Ķ–ļ—ā–ĺ—Ä–Ĺ—É—é –į—Ā—ā–ľ—É, –ź. –†–ĺ–ī–ĺ—Ā—Ā–ļ–ł–Ļ (1863), –≤—č–ī–Ķ–Ľ–ł–≤—ą–ł–Ļ –ł–ī–ł–ĺ–Ņ–į—ā–ł—á–Ķ—Ā–ļ—É—é –į—Ā—ā–ľ—É.
–Ę—Ä—É—Ā—Ā–ĺ (1862), –†–ĺ–ľ–Ī–Ķ—Ä–≥, –Ď–ł—Ä–ľ–Ķ—Ä –ĺ–Ī–ĺ—Ā–Ĺ–ĺ–≤–į–Ľ–ł –ļ–ĺ–Ĺ–≤—É–Ľ—Ć—Ā–ł–≤–Ĺ—č–Ļ (–Ī—Ä–ĺ–Ĺ—Ö–ĺ—Ā–Ņ–į—Ā—ā–ł—á–Ķ—Ā–ļ–ł–Ļ) –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ —É–ī—É—ą—Ć—Ź. –Ę—Ä–į—É–Ī–Ķ –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–į–≥–į–Ľ, —á—ā–ĺ –≤ –ĺ—Ā–Ĺ–ĺ–≤–Ķ –Ď–ź –Ľ–Ķ–∂–ł—ā –ĺ—Ā—ā—Ä—č–Ļ –ļ–į—ā–į—Ä –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤. –í —Ā–Ľ–Ķ–ī—É—é—Č–Ķ–ľ –≤–Ķ–ļ–Ķ —ć—ā–ĺ –Ņ–ĺ–Ĺ—Ź—ā–ł–Ķ –Ľ–Ķ–≥–Ľ–ĺ –≤ –ĺ—Ā–Ĺ–ĺ–≤—É –ö–ĺ–Ĺ—Ā–Ķ–Ĺ—Ā—É—Ā–į –ļ—Ä—É–Ņ–Ĺ–Ķ–Ļ—ą–ł—Ö —ć–ļ—Ā–Ņ–Ķ—Ä—ā–ĺ–≤ –í–ě–ó –≤ –Ď–Ķ—ā–Ķ—Ā–ī–Ķ (1992) –ł –Ď—Ä—é—Ā—Ā–Ķ–Ľ–Ķ (1992), –ĺ—Ü–Ķ–Ĺ–ł–≤—ą–ł—Ö –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł–Ķ —Ā–Ľ–ł–∑–ł—Ā—ā—č—Ö –ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ—É—ā–Ķ–Ļ –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –≥–Ľ–į–≤–Ĺ–ĺ–≥–ĺ –∑–≤–Ķ–Ĺ–į –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑–į —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –≥–ł–Ņ–Ķ—Ä—Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤.
–í –Ĺ–į—á–į–Ľ–Ķ XX –≤. —É–∂–Ķ –Ņ–ĺ—Ź–≤–ł–Ľ–ł—Ā—Ć —Ä–Ķ—Ą–Ľ–Ķ–ļ—ā–ĺ—Ä–Ĺ–į—Ź, –ł–Ĺ—ā–ĺ–ļ—Ā–ł–ļ–į—Ü–ł–ĺ–Ĺ–Ĺ–į—Ź –ł –į–Ĺ–į—Ą–ł–Ľ–į–ļ—ā–ł—á–Ķ—Ā–ļ–į—Ź —ā–Ķ–ĺ—Ä–ł–ł –Ď–ź. –õ–Ķ–Ļ–ī–Ķ–Ĺ (–Ķ—Č–Ķ –≤ 1868 –≥.) –ĺ–Ņ–ł—Ā–į–Ľ –ĺ—ā–ļ—Ä—č—ā—č–Ķ –ł–ľ –ļ—Ä–ł—Ā—ā–į–Ľ–Ľ—č (–®–į—Ä–ļ–ĺ – –õ–Ķ–Ļ–ī–Ķ–Ĺ–į) –ł –≤—č—Ā–ļ–į–∑–į–Ľ –ł–ī–Ķ—é, —á—ā–ĺ –ĺ–Ĺ–ł –≤—č–∑—č–≤–į—é—ā –ľ–Ķ—Ö–į–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ —Ä–į–∑–ī—Ä–į–∂–Ķ–Ĺ–ł–Ķ –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤, –į –ö—É—Ä—ą–ľ–į–Ĺ —Ā–≤—Ź–∑—č–≤–į–Ľ –Ĺ–į–Ļ–ī–Ķ–Ĺ–Ĺ—č–Ķ –ł–ľ —Ā—ā—Ä–į–Ĺ–Ĺ—č–Ķ —Ā–Ņ–ł—Ä–į–Ľ–ł (—Ā–Ņ–ł—Ä–į–Ľ–ł –ö—É—Ä—ą–ľ–į–Ĺ–į) —Ā –∑–į–ļ—É–Ņ–ĺ—Ä–ļ–ĺ–Ļ –ľ–Ķ–Ľ–ļ–ł—Ö –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤. –°—É—Č–Ķ—Ā—ā–≤–ĺ–≤–į–Ľ –Ķ—Č–Ķ —Ä—Ź–ī –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł–Ļ, —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č—Ö —Ā –≤–Ľ–ł—Ź–Ĺ–ł–Ķ–ľ –Ĺ–Ķ–≤—Ä–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —Ą–ĺ–Ĺ–į, –Ņ–į—Ä–į–∑–ł—ā–į—Ä–Ĺ—č—Ö –ł–Ĺ—Ą–Ķ–ļ—Ü–ł–Ļ, —Ä–Ķ—Ą–Ľ–Ķ–ļ—ā–ĺ—Ä–Ĺ—č–ľ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ĺ–ľ —Ä–į–∑–≤–ł—ā–ł—Ź –Ī—Ä–ĺ–Ĺ—Ö–ĺ—Ā–Ņ–į–∑–ľ–į. –ė –≤—Ā–Ķ-—ā–į–ļ–ł –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–ĺ —É—á–Ķ–Ĺ—č—Ö —Ā–ļ–Ľ–ĺ–Ĺ—Ź–Ľ–ł—Ā—Ć –ļ —ā–Ķ–ĺ—Ä–ł–ł —Ā–Ņ–į—Ā—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ď–ź, –Ņ–ĺ–ī—á–Ķ—Ä–ļ–ł–≤–į—Ź –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ —Ā–Ľ–ł–∑–ł—Ā—ā—č—Ö –ĺ–Ī–ĺ–Ľ–ĺ—á–Ķ–ļ –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ —Ä–Ķ—Ą–Ľ–Ķ–ļ—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ —Ä–į–∑–ī—Ä–į–∂–Ķ–Ĺ–ł—Ź –≤–į–≥—É—Ā–į [1, 4].
–ö–į–ļ —É–∂–Ķ –≥–ĺ–≤–ĺ—Ä–ł–Ľ–ĺ—Ā—Ć, –Ĺ–Ķ–ľ–į–Ľ–į—Ź —Ä–ĺ–Ľ—Ć –≤ —Ä–į–∑–≤–ł—ā–ł–ł –ł–∑—É—á–Ķ–Ĺ–ł—Ź –Ď–ź –Ņ—Ä–ł–Ĺ–į–ī–Ľ–Ķ–∂–ł—ā —Ä–ĺ—Ā—Ā–ł–Ļ—Ā–ļ–ł–ľ —É—á–Ķ–Ĺ—č–ľ. –ź.–Ē. –ź–ī–ĺ –ł –ü.–ö. –Ď—É–Ľ–į—ā–ĺ–≤ (1969) –≤—č–ī–≤–ł–Ĺ—É–Ľ–ł –Ņ–ĺ—Ā—ā—É–Ľ–į—ā, —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ļ–ĺ—ā–ĺ—Ä–ĺ–ľ—É –Ď–ź —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ā–į–ľ–ĺ—Ā—ā–ĺ—Ź—ā–Ķ–Ľ—Ć–Ĺ—č–ľ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä—É—é—Č–ł–ľ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ–ľ –ł–Ĺ—Ą–Ķ–ļ—Ü–ł–ĺ–Ĺ–Ĺ–ĺ–Ļ –ł –Ĺ–Ķ–ł–Ĺ—Ą–Ķ–ļ—Ü–ł–ĺ–Ĺ–Ĺ–ĺ–Ļ (–į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ĺ–Ļ) —ć—ā–ł–ĺ–Ľ–ĺ–≥–ł–ł. –í –ĺ—Ā–Ĺ–ĺ–≤–Ķ –Ď–ź –Ľ–Ķ–∂–ł—ā —Ā–Ķ–Ĺ—Ā–ł–Ī–ł–Ľ–ł–∑–į—Ü–ł—Ź, –į –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č–ľ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–ľ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —É–ī—É—ą—Ć–Ķ –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –Ī—Ä–ĺ–Ĺ—Ö–ĺ—Ā–Ņ–į–∑–ľ–į, –≥–ł–Ņ–Ķ—Ä—Ā–Ķ–ļ—Ä–Ķ—Ü–ł–ł –ł –ĺ—ā–Ķ–ļ–į —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤. –ė–ľ–ł –Ī—č–Ľ–į –Ņ—Ä–Ķ–ī–Ľ–ĺ–∂–Ķ–Ĺ–į –ļ–Ľ–ł–Ĺ–ł–ļ–ĺ-–Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–į—Ź –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł—Ź –Ď–ź. –°–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ —ć—ā–ĺ–Ļ –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł–ł –≤—č–ī–Ķ–Ľ—Ź–Ľ–ł –Ņ—Ä–Ķ–ī–į—Ā—ā–ľ—É, –į—Ā—ā–ľ—É 1-–Ļ —Ā—ā–į–ī–ł–ł —Ā —Ä–į–∑–Ľ–ł—á–Ĺ—č–ľ–ł —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ź–ľ–ł —ā—Ź–∂–Ķ—Ā—ā–ł –ł 2-–Ļ —Ā—ā–į–ī–ł–ł, —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į—é—Č—É—é—Ā—Ź –Ĺ–Ķ–ĺ–Ī—Ä–į—ā–ł–ľ—č–ľ–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź–ľ–ł –Ľ–Ķ–≥–ĺ—á–Ĺ–ĺ–Ļ —ā–ļ–į–Ĺ–ł, –≤–ĺ–∑–Ĺ–ł–ļ—ą–ł–ľ–ł –Ĺ–į —Ą–ĺ–Ĺ–Ķ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ —Ā –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ–ł–Ķ–ľ —Ü–Ķ–Ľ–ĺ—Ā—ā–Ĺ–ĺ—Ā—ā–ł —ā–ļ–į–Ĺ–Ķ–Ļ –Ľ–Ķ–≥–ļ–ĺ–≥–ĺ. –ď.–Ď. –§–Ķ–ī–ĺ—Ā–Ķ–Ķ–≤ (1984) –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ –Ď–ź –ļ–į–ļ —Ā–į–ľ–ĺ—Ā—ā–ĺ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä—É—é—Č–Ķ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ, –≤ –ĺ—Ā–Ĺ–ĺ–≤–Ķ –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑–į –ļ–ĺ—ā–ĺ—Ä–ĺ–≥–ĺ –Ľ–Ķ–∂–ł—ā –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–Ĺ–į—Ź —Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤, –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ–į—Ź —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ł–ľ–ľ—É–Ĺ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–ľ–ł (—Ā–Ķ–Ĺ—Ā–ł–Ī–ł–Ľ–ł–∑–į—Ü–ł—Ź –ł –į–Ľ–Ľ–Ķ—Ä–≥–ł—Ź) –ł–Ľ–ł/–ł –Ĺ–Ķ—Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ–į–ľ–ł, –į –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č–ľ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–ľ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ņ—Ä–ł—Ā—ā—É–Ņ —É–ī—É—ą—Ć—Ź –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –Ī—Ä–ĺ–Ĺ—Ö–ĺ—Ā–Ņ–į–∑–ľ–į, –≥–ł–Ņ–Ķ—Ä—Ā–Ķ–ļ—Ä–Ķ—Ü–ł–ł —Ā–Ľ–ł–∑–ł –ł –ĺ—ā–Ķ–ļ–į —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤. –ė–ľ –Ī—č–Ľ–į –Ņ—Ä–Ķ–ī–Ľ–ĺ–∂–Ķ–Ĺ–į –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł—Ź –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ–ĺ–≤, —ā—Ź–∂–Ķ—Ā—ā–ł –ł —Ą–į–∑—č –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź. –Ę–Ķ–ĺ—Ä–ł–ł —Ä–į–∑–≤–ł—ā–ł—Ź –Ď–ź, –≤—č–ī–≤–ł–Ĺ—É—ā—č–Ķ –ź.–Ē. –ź–ī–ĺ –ł –ď.–Ď. –§–Ķ–ī–ĺ—Ā–Ķ–Ķ–≤—č–ľ, –ī–ĺ —Ā–ł—Ö –Ņ–ĺ—Ä –Ĺ–Ķ —É—ā—Ä–į—ā–ł–Ľ–ł –į–ļ—ā—É–į–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł [1, 4].
–ó–į–≤–ł—Ā–ł–ľ–ĺ—Ā—ā—Ć –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö
–ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–Ķ–Ļ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ—č –ĺ—ā —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–≤ –ł —ć–Ĺ–ī–ĺ—ā–ł–Ņ–ĺ–≤
–Ě–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć –Ď–ź —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į—é—ā –ļ–į–ļ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ –ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ—É—ā–Ķ–Ļ, –≤ –ĺ—Ā–Ĺ–ĺ–≤–Ķ –ļ–ĺ—ā–ĺ—Ä–ĺ–≥–ĺ –Ľ–Ķ–∂–į—ā –≥–ł–Ņ–Ķ—Ä—Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤, –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł–Ķ –ł –ĺ–Ī—Ā—ā—Ä—É–ļ—Ü–ł—Ź –ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ—É—ā–Ķ–Ļ, –ĺ–Ī—Ä–į—ā–ł–ľ–į—Ź —Ā–Ņ–ĺ–Ĺ—ā–į–Ĺ–Ĺ–ĺ –ł–Ľ–ł –Ņ–ĺ–ī –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–≤. –≠—ā–ĺ —Ā–Ľ–ĺ–∂–Ĺ–ĺ–Ķ, –ľ–Ĺ–ĺ–≥–ĺ–ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–Ĺ–ĺ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ —ā–į–ļ–∂–Ķ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É–Ķ—ā—Ā—Ź —Ä–į–∑–Ľ–ł—á–Ĺ—č–ľ–ł —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–į–ľ–ł. –§–Ķ–Ĺ–ĺ—ā–ł–Ņ–ł—á–Ķ—Ā–ļ–į—Ź —Ä–į–∑–Ĺ–ł—Ü–į –ĺ—ā—Ä–į–∂–į–Ķ—ā—Ā—Ź –Ĺ–į —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ķ –Ķ—Ā—ā–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź, —ā—Ź–∂–Ķ—Ā—ā–ł, —Ä–ł—Ā–ļ–Ķ –Ĺ–Ķ–∂–Ķ–Ľ–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –ł—Ā—Ö–ĺ–ī–ĺ–≤ –ł –ĺ—ā–≤–Ķ—ā–Ķ –Ĺ–į –Ņ—Ä–ĺ–≤–ĺ–ī–ł–ľ—É—é —ā–Ķ—Ä–į–Ņ–ł—é [2, 5].
–í –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā –≤–ĺ–≤–Ľ–Ķ–ļ–į–Ķ—ā—Ā—Ź –ľ–Ĺ–ĺ–∂–Ķ—Ā—ā–≤–ĺ –ļ–Ľ–Ķ—ā–ĺ–ļ: —ā—É—á–Ĺ—č–Ķ –ļ–Ľ–Ķ—ā–ļ–ł, —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ—č, –Ę-–Ľ–ł–ľ—Ą–ĺ—Ü–ł—ā—č (Th2), –ľ–į–ļ—Ä–ĺ—Ą–į–≥–ł, –Ĺ–Ķ–Ļ—ā—Ä–ĺ—Ą–ł–Ľ—č, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –į–ļ—ā–ł–≤–ł—Ä—É—é—ā—Ā—Ź –ł –≤—č—Ä–į–Ī–į—ā—č–≤–į—é—ā –ľ–Ķ–ī–ł–į—ā–ĺ—Ä—č –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź. –Ě–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć –ł–∑–≤–Ķ—Ā—ā–Ĺ–ĺ –Ī–ĺ–Ľ–Ķ–Ķ 100 —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö –ľ–Ķ–ī–ł–į—ā–ĺ—Ä–ĺ–≤ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź, —Ā—Ä–Ķ–ī–ł –ļ–ĺ—ā–ĺ—Ä—č—Ö –≤—č–ī–Ķ–Ľ—Ź—é—ā —Ö–Ķ–ľ–ĺ–ļ–ł–Ĺ—č, —Ü–ł—Ā—ā–Ķ–ł–Ĺ–ł–Ľ–ĺ–≤—č–Ķ –Ľ–Ķ–Ļ–ļ–ĺ—ā—Ä–ł–Ķ–Ĺ—č, —Ü–ł—ā–ĺ–ļ–ł–Ĺ—č, –≥–ł—Ā—ā–į–ľ–ł–Ĺ, –ĺ–ļ–ł—Ā—Ć –į–∑–ĺ—ā–į, –Ņ—Ä–ĺ—Ā—ā–į–≥–Ľ–į–Ĺ–ī–ł–Ĺ D2. –í —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į –ł –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –ľ–Ķ–ī–ł–į—ā–ĺ—Ä–ĺ–≤ –≤–ĺ–∑–Ĺ–ł–ļ–į—é—ā –≥–ł–Ņ–Ķ—Ä–Ņ–Ľ–į–∑–ł—Ź –Ī–ĺ–ļ–į–Ľ–ĺ–≤–ł–ī–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ –ł –Ī–ĺ–ļ–į–Ľ–ĺ–≤–ł–ī–Ĺ—č—Ö –∂–Ķ–Ľ–Ķ–∑ –Ņ–ĺ–ī—Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–≥–ĺ —Ā–Ľ–ĺ—Ź, –≥–ł–Ņ–Ķ—Ä–Ņ–Ľ–į–∑–ł—Ź –ł –≥–ł–Ņ–Ķ—Ä—ā—Ä–ĺ—Ą–ł—Ź –≥–Ľ–į–ī–ļ–ĺ–Ļ –ľ—É—Ā–ļ—É–Ľ–į—ā—É—Ä—č, —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –≤–į—Ā–ļ—É–Ľ—Ź—Ä–ł–∑–į—Ü–ł–ł –Ņ–ĺ–ī—Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–≥–ĺ —Ā–Ľ–ĺ—Ź, –Ĺ–į–ļ–ĺ–Ņ–Ľ–Ķ–Ĺ–ł–Ķ –ļ–ĺ–Ľ–Ľ–į–≥–Ķ–Ĺ–į –≤ –∑–ĺ–Ĺ–į—Ö, —Ä–į—Ā–Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ—č—Ö –Ĺ–ł–∂–Ķ –Ī–į–∑–į–Ľ—Ć–Ĺ–ĺ–Ļ –ľ–Ķ–ľ–Ī—Ä–į–Ĺ—č, –ł —Ā—É–Ī—ć–Ņ–ł—ā–Ķ–Ľ–ł–į–Ľ—Ć–Ĺ—č–Ļ —Ą–ł–Ī—Ä–ĺ–∑ [1, 6]. –†–į–∑–≤–ł–≤–į–Ķ—ā—Ā—Ź –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–į—Ź –≥–ł–Ņ–Ķ—Ä—Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć, –Ņ—Ä–ł–≤–ĺ–ī—Ź—Č–į—Ź –ļ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ–ĺ–Ļ —á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤ –≤ –ĺ—ā–≤–Ķ—ā –Ĺ–į —ā—Ä–ł–≥–≥–Ķ—Ä–Ĺ–ĺ–Ķ –≤–ĺ–∑–ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ.
–ź—Ā—ā–ľ—É —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į—é—ā –ļ–į–ļ –≥–Ķ—ā–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ, —á–Ķ–ľ –ĺ–Ī—ä—Ź—Ā–Ĺ—Ź—é—ā —Ä–į–∑–Ľ–ł—á–ł–Ķ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö —Ą–ĺ—Ä–ľ, —Ā—ā–Ķ–Ņ–Ķ–Ĺ–Ķ–Ļ —ā—Ź–∂–Ķ—Ā—ā–ł, —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł –ĺ—ā–≤–Ķ—ā–į –Ĺ–į –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź–Ķ–ľ—É—é —ā–Ķ—Ä–į–Ņ–ł—é. –Ě–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –į—Ā—ā–ľ—č –Ņ—Ä–ĺ–≤–ĺ–ī—Ź—ā –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–≤, –≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ł –Ī–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –ľ–į—Ä–ļ–Ķ—Ä–ĺ–≤. –ě–ī–Ĺ–į–ļ–ĺ –Ķ–ī–ł–Ĺ–ĺ–≥–ĺ –≤–∑–≥–Ľ—Ź–ī–į –Ĺ–į –ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ –į—Ā—ā–ľ—č –Ņ–ĺ —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–į–ľ –ī–ĺ —Ā–ł—Ö –Ņ–ĺ—Ä –Ĺ–Ķ—ā. –ü—Ä–ł –ī–Ķ–Ľ–Ķ–Ĺ–ł–ł —É—á–ł—ā—č–≤–į—é—ā –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –ł –ľ–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł—Ā—ā–ł–ļ–ł, –∑–Ĺ–į—á–ł–ľ—č–Ķ —ā—Ä–ł–≥–≥–Ķ—Ä—č, –ĺ—ā–≤–Ķ—ā –Ĺ–į —ā–Ķ—Ä–į–Ņ–ł—é, –Ĺ–į–Ľ–ł—á–ł–Ķ —Ā–ĺ–Ņ—É—ā—Ā—ā–≤—É—é—Č–Ķ–Ļ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł. –ü—Ä–ł –ĺ—Ü–Ķ–Ĺ–ļ–Ķ –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –ł —ā—Ź–∂–Ķ—Ā—ā–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –≤—č–ī–Ķ–Ľ—Ź—é—ā –į—Ā—ā–ľ—É —Ā —Ä–į–Ĺ–Ĺ–ł–ľ –ī–Ķ–Ī—é—ā–ĺ–ľ (—Ā –ī–Ķ—ā—Ā–ļ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į) –ł —Ā –Ņ–ĺ–∑–ī–Ĺ–ł–ľ, –į—Ā—ā–ľ—É —Ā —á–į—Ā—ā—č–ľ–ł –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł—Ź–ľ–ł, —Ā —Ą–ł–ļ—Ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ –ĺ–Ī—Ā—ā—Ä—É–ļ—Ü–ł–Ķ–Ļ, –į—Ā—ā–ľ—É —ā—Ź–∂–Ķ–Ľ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź. –Ę–į–ļ–∂–Ķ –≤—č–ī–Ķ–Ľ—Ź—é—ā –į—Ā—ā–ľ—É –į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ—É—é, –ĺ–Ī—Ä–į—Č–į—Ź –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ –Ĺ–į –ļ–Ľ—é—á–Ķ–≤—É—é —Ä–ĺ–Ľ—Ć IgE-–∑–į–≤–ł—Ā–ł–ľ–ĺ–Ļ –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ä–Ķ–į–ļ—Ü–ł–ł –≤ –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑–Ķ —ć—ā–ĺ–≥–ĺ —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–į, –ł –Ĺ–Ķ–į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ—É—é, –≤ —Ä–į–∑–≤–ł—ā–ł–ł –ļ–ĺ—ā–ĺ—Ä–ĺ–Ļ —É—á–į—Ā—ā–≤—É—é—ā –ł–Ĺ—č–Ķ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ—č. –ě—Ü–Ķ–Ĺ–ł–≤–į—Ź —ā—Ä–ł–≥–≥–Ķ—Ä—č, –≤–Ľ–ł—Ź—é—Č–ł–Ķ –Ĺ–į —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –į—Ā—ā–ľ—č, –≤—č–ī–Ķ–Ľ—Ź—é—ā –≤–ł—Ä—É—Ā-–ł–Ĺ–ī—É—Ü–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—É—é, —á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ—É—é –ļ –į—Ü–Ķ—ā–ł–Ľ—Ā–į–Ľ–ł—Ü–ł–Ľ–ĺ–≤–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā–Ķ, –į—Ā—ā–ľ—É —Ą–ł–∑–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —É—Ā–ł–Ľ–ł—Ź, –į—Ā—ā–ľ—É, –į—Ā—Ā–ĺ—Ü–ł–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—É—é —Ā –ļ—É—Ä–Ķ–Ĺ–ł–Ķ–ľ, –ĺ–∂–ł—Ä–Ķ–Ĺ–ł–Ķ–ľ, –≥–į—Ā—ā—Ä–ĺ—ć–∑–ĺ—Ą–į–≥–Ķ–į–Ľ—Ć–Ĺ—č–ľ —Ä–Ķ—Ą–Ľ—é–ļ—Ā–ĺ–ľ, –į—Ā—ā–ľ—É —Ā –Ĺ–ĺ—á–Ĺ—č–ľ –ĺ–Ī—Ā—ā—Ä—É–ļ—ā–ł–≤–Ĺ—č–ľ –į–Ņ–Ĺ–ĺ—ć. –£ –ĺ–ī–Ĺ–ĺ–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –ľ–ĺ–∂–Ĺ–ĺ –Ĺ–į–Ī–Ľ—é–ī–į—ā—Ć —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł–Ķ —Ä–į–∑–Ĺ—č—Ö —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–≤, –ļ—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, —Ā–ĺ –≤—Ä–Ķ–ľ–Ķ–Ĺ–Ķ–ľ –ĺ–ī–ł–Ĺ —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ –ľ–ĺ–∂–Ķ—ā –Ņ–Ķ—Ä–Ķ—Ö–ĺ–ī–ł—ā—Ć –≤ –ī—Ä—É–≥–ĺ–Ļ. –ó–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –Ĺ–į —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –ł —ā—Ä–į–Ĺ—Ā—Ą–ĺ—Ä–ľ–į—Ü–ł—é —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–≤ –ĺ–ļ–į–∑—č–≤–į—é—ā –Ņ—Ā–ł—Ö–ł—á–Ķ—Ā–ļ–ł–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į (—Ą–ĺ–Ī–ł—á–Ķ—Ā–ļ–ł–Ķ, –ł–Ņ–ĺ—Ö–ĺ–Ĺ–ī—Ä–ł—á–Ķ—Ā–ļ–ł–Ķ, –ł—Ā—ā–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł–Ķ, –ī–Ķ–Ņ—Ä–Ķ—Ā—Ā–ł–≤–Ĺ—č–Ķ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź), –ļ–ĺ—ā–ĺ—Ä—č–Ķ —ā–į–ļ–∂–Ķ –ľ–ĺ–≥—É—ā —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤–ĺ–≤–į—ā—Ć —Ä–į–∑–≤–ł—ā–ł—é —Ä–Ķ–∑–ł—Ā—ā–Ķ–Ĺ—ā–Ĺ–ĺ—Ā—ā–ł –ļ –Ľ–Ķ—á–Ķ–Ĺ–ł—é –ł–Ľ–ł —ā–ĺ—Ä–Ņ–ł–ī–Ĺ–ĺ–ľ—É —ā–Ķ—á–Ķ–Ĺ–ł—é –Ď–ź [1, 7].
–Ě–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł –≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤, —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É—é—Č–ł—Ö —Ä–į–∑–≤–ł—ā–ł—é –į—Ā—ā–ľ—č, –Ņ—Ä–ĺ–≤–ĺ–ī—Ź—ā –≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ –Ņ–ĺ —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–į–ľ. –°—Ä–Ķ–ī–ł –ł–∑–≤–Ķ—Ā—ā–Ĺ—č—Ö –Ĺ–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć –ļ–į–ļ –ľ–ł–Ĺ–ł–ľ—É–ľ 50 –≥–Ķ–Ĺ–ĺ–≤ –≤—č–ī–Ķ–Ľ—Ź—é—ā –≥–Ľ–į–≤–Ĺ—č–Ķ –≥–Ķ–Ĺ—č, –≥–Ķ–Ĺ—č-–ľ–ĺ–ī–ł—Ą–ł–ļ–į—ā–ĺ—Ä—č –ł –≥–Ķ–Ĺ—č-–ļ–į–Ĺ–ī–ł–ī–į—ā—č [8–10]. –í—č–ī–Ķ–Ľ–Ķ–Ĺ—č –≥–Ķ–Ĺ—č, –ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ –∑–į —Ä–į–∑–≤–ł—ā–ł–Ķ –į—ā–ĺ–Ņ–ł–ł, –≥–ł–Ņ–Ķ—Ä—Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź—é—Č–ł–Ķ —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć –ĺ—ā–≤–Ķ—ā–į –Ĺ–į —ā–Ķ—Ä–į–Ņ–ł—é. –í—č–ī–Ķ–Ľ–Ķ–Ĺ—č —Ö—Ä–ĺ–ľ–ĺ—Ā–ĺ–ľ–Ĺ—č–Ķ —Ä–Ķ–≥–ł–ĺ–Ĺ—č, —ā–į–ļ–ł–Ķ –ļ–į–ļ 6p22.3–p21.1, –ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ –∑–į —Ä–į–∑–≤–ł—ā–ł–Ķ –≥–ł–Ņ–Ķ—Ä—Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤, 5q11.2–q14.3 –ł 6pter–p22.3, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź—é—Č–ł–Ķ –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł—é –ĺ–Ī—Č–Ķ–≥–ĺ IgE, 3p22.1–q22.1 –ł 17p12–q24.3, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź—é—Č–ł–Ķ –Ņ–ĺ–Ľ–ĺ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –ļ–ĺ–∂–Ĺ—č–Ļ —ā–Ķ—Ā—ā [8, 11]. –Ě–ĺ –Ņ—Ä–Ķ–ĺ–Ī–Ľ–į–ī–į—é—Č–Ķ–Ļ –į—Ā—Ā–ĺ—Ü–ł–į—Ü–ł–ł —Ā—Ä–Ķ–ī–ł –≤—č–ī–Ķ–Ľ–Ķ–Ĺ–Ĺ—č—Ö —Ä–Ķ–≥–ł–ĺ–Ĺ–ĺ–≤ –Ĺ–Ķ—ā. –í–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ, —ć—ā–ł–ľ –ĺ–Ī—ä—Ź—Ā–Ĺ—Ź—é—ā—Ā—Ź –≥–Ķ—ā–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ł –≤–į—Ä–ł–į–Ī–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć —ā–Ķ—á–Ķ–Ĺ–ł—Ź.
–ď–Ķ–Ĺ—č, –ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ –∑–į —Ä–į–∑–≤–ł—ā–ł–Ķ –į—ā–ĺ–Ņ–ł–ł –ł–Ľ–ł –≥—É–ľ–ĺ—Ä–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ł–ľ–ľ—É–Ĺ–Ĺ–ĺ–≥–ĺ –ĺ—ā–≤–Ķ—ā–į, –Ľ–ĺ–ļ–į–Ľ–ł–∑–ĺ–≤–į–Ĺ—č –≤ —É—á–į—Ā—ā–ļ–į—Ö —Ö—Ä–ĺ–ľ–ĺ—Ā–ĺ–ľ—č 5q24–33 –ł —Ā–ĺ–ī–Ķ—Ä–∂–į—ā –ļ–Ľ–į—Ā—ā–Ķ—Ä —Ā–Ķ–ľ–Ķ–Ļ—Ā—ā–≤–į –≥–Ķ–Ĺ–ĺ–≤ —Ü–ł—ā–ĺ–ļ–ł–Ĺ–ĺ–≤ (–ł–Ĺ—ā–Ķ—Ä–Ľ–Ķ–Ļ–ļ–ł–Ĺ-4 (IL-4), IL-5, IL-13, IL-3, GM-CSF), –ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ļ –∑–į —Ä–į–∑–≤–ł—ā–ł–Ķ IgE-–ĺ–Ņ–ĺ—Ā—Ä–Ķ–ī–ĺ–≤–į–Ĺ–Ĺ—č—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ –Ĺ–Ķ–ľ–Ķ–ī–Ľ–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —ā–ł–Ņ–į [8, 12]. H. Mitsuyasu et al. –Ī—č–Ľ–ĺ –ī–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ĺ –ĺ –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–Ĺ–ĺ–ľ –≤–į—Ä–ł–į–Ĺ—ā–Ķ –≥–Ķ–Ĺ–į Ile50Val IL-4Rα —Ü–Ķ–Ņ–ł, –Ĺ–į–Ľ–ł—á–ł–Ķ –ļ–ĺ—ā–ĺ—Ä–ĺ–≥–ĺ –Ņ–ĺ–≤—č—ą–į–Ķ—ā —Ā–ł–Ĺ—ā–Ķ–∑ IgE –ł —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ĺ–ī–Ĺ–ł–ľ –ł–∑ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź—é—Č–ł—Ö –Ĺ–į—Ā–Ľ–Ķ–ī—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ –≤–ĺ–∑–Ĺ–ł–ļ–Ĺ–ĺ–≤–Ķ–Ĺ–ł—Ź –į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ą–ĺ—Ä–ľ—č –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź. –ó–į–ľ–Ķ–Ĺ–į –ĺ–ī–Ĺ–ĺ–≥–ĺ –į–ľ–ł–Ĺ–ĺ–ļ–ł—Ā–Ľ–ĺ—ā–Ĺ–ĺ–≥–ĺ –ĺ—Ā—ā–į—ā–ļ–į (–ł–∑–ĺ–Ľ–Ķ–Ļ—Ü–ł–Ĺ–į –Ľ–Ķ–Ļ—Ü–ł–Ĺ–ĺ–ľ –≤ –Ņ–ĺ–∑–ł—Ü–ł–ł 181) –≤ –≥–Ķ–Ĺ–Ķ, –ļ–ĺ–ī–ł—Ä—É—é—Č–Ķ–ľ β–—Ā—É–Ī—ä–Ķ–ī–ł–Ĺ–ł—Ü—É –≤—č—Ā–ĺ–ļ–ĺ–į—Ą—Ą–ł–Ĺ–Ĺ–ĺ–≥–ĺ —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–į –ļ IgE (FcεRI β), –≤ 17% —Ā–Ľ—É—á–į–Ķ–≤ –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ —Ä–į–∑–≤–ł—ā–ł—é –Ď–ź [13]. –Ě–ĺ –Ņ–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ –Ņ–ĺ–ī–ĺ–Ī–Ĺ—č—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ, –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–Ĺ—č—Ö –≤ –ė—ā–į–Ľ–ł–ł –ł –Į–Ņ–ĺ–Ĺ–ł–ł, —ā–į–ļ–ĺ–Ļ –∑–į–ļ–ĺ–Ĺ–ĺ–ľ–Ķ—Ä–Ĺ–ĺ—Ā—ā–ł –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ –Ĺ–Ķ –Ī—č–Ľ–ĺ. –ü—Ä–ĺ–ī—É–ļ—ā ADRβ2 (–≥–Ķ–Ĺ–į β2-–į–ī—Ä–Ķ–Ĺ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–į; 11q13) –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ–ł—Ä—É–Ķ—ā –Ľ–į–Ī–ł–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤. –Ē–ĺ–ļ–į–∑–į–Ĺ–ĺ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ–į –≥–Ķ–Ĺ–į ADRβ2 (Arg16Gly –ł Glu27Gln), –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź—é—Č–Ķ–≥–ĺ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ—É—é –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ—Ā—ā—Ć —Ä–į–∑–≤–ł—ā–ł—Ź —ā—Ź–∂–Ķ–Ľ–ĺ–Ļ –Ď–ź. –£ –≥–ĺ–ľ–ĺ–∑–ł–≥–ĺ—ā–Ĺ—č—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā —ā–į–ļ–ł–ľ –≤–į—Ä–ł–į–Ĺ—ā–ĺ–ľ –≥–Ķ–Ĺ–į –Ī—č—Ā—ā—Ä–ĺ —ā–Ķ—Ä—Ź–Ķ—ā—Ā—Ź —á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –ļ β2––į–≥–ĺ–Ĺ–ł—Ā—ā–į–ľ –ł —ā—Ä–Ķ–Ī—É–Ķ—ā—Ā—Ź –Ņ–Ķ—Ä–Ķ—Ö–ĺ–ī –Ĺ–į –≥–ĺ—Ä–ľ–ĺ–Ĺ–į–Ľ—Ć–Ĺ—É—é —ā–Ķ—Ä–į–Ņ–ł—é. –ü—Ä–ł—á–Ķ–ľ –≥–Ķ–Ĺ —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–į IL-4 (IL4RA) –ł –≥–Ķ–Ĺ, –ļ–ĺ–ī–ł—Ä—É—é—Č–ł–Ļ β-—Ā—É–Ī—ä–Ķ–ī–ł–Ĺ–ł—Ü—É –≤—č—Ā–ĺ–ļ–ĺ–į—Ą—Ą–ł–Ĺ–Ĺ–ĺ–≥–ĺ —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–į –ļ IgE (FcεRI β), –ľ–ĺ–≥—É—ā –Ī—č—ā—Ć –ĺ—ā–Ĺ–Ķ—Ā–Ķ–Ĺ—č –ļ –≥–Ķ–Ĺ–į–ľ –į—ā–ĺ–Ņ–ł–ł, –į –≥–Ķ–Ĺ ADRβ2 – –ļ –≥–Ķ–Ĺ–į–ľ –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –≥–ł–Ņ–Ķ—Ä—Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł [14]. –í–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö –≥–Ķ–Ĺ–ĺ–≤ –į—ā–ĺ–Ņ–ł–ł –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ—ā —Ö–į—Ä–į–ļ—ā–Ķ—Ä —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ď–ź. –Ě–į–Ľ–ł—á–ł–Ķ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –≥–Ķ–Ĺ–ĺ–≤, –ļ–ĺ–ī–ł—Ä—É—é—Č–ł—Ö IL-13 –ł IL-4RA (–ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č—Ö –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ Th2 –ĺ—ā–≤–Ķ—ā–į), —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –Ď–ź –Ī–ĺ–Ľ–Ķ–Ķ —á–Ķ–ľ –≤ 2,5 —Ä–į–∑–į –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ–ł, –ł–ľ–Ķ—é—Č–ł–ľ–ł —ā–ĺ–Ľ—Ć–ļ–ĺ 1 –≥–Ķ–Ĺ.
–Ě–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć –≤—č—Ā–ļ–į–∑–į–Ĺ–ĺ –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ –ĺ–Ī –į—É—ā–ĺ–ł–ľ–ľ—É–Ĺ–Ĺ–ĺ–ľ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ķ —Ä–į–∑–≤–ł—ā–ł—Ź —ć–Ĺ–ī–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ–Ļ –į—Ā—ā–ľ—č. –°—á–ł—ā–į—é—ā, —á—ā–ĺ –Ķ–Ķ —Ä–į–∑–≤–ł—ā–ł–Ķ –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ –Ĺ–į–Ľ–ł—á–ł–Ķ–ľ –į—É—ā–ĺ–į–Ĺ—ā–ł—ā–Ķ–Ľ –ļ —ć–Ņ–ł—ā–Ķ–Ľ–ł–į–Ľ—Ć–Ĺ–ĺ–ľ—É –į–Ĺ—ā–ł–≥–Ķ–Ĺ—É –ł –ī–Ķ—Ą–ł—Ü–ł—ā–ĺ–ľ –į–Ĺ—ā–ł–ĺ–ļ—Ā–ł–ī–į–Ĺ—ā–Ĺ–ĺ–Ļ —Ā–ł—Ā—ā–Ķ–ľ—č. –°–≤–ĺ–Ī–ĺ–ī–Ĺ—č–Ķ —Ä–į–ī–ł–ļ–į–Ľ—č —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ—č –Ņ—Ä–Ķ–≤—Ä–į—Č–į—ā—Ć –ľ–į–ļ—Ä–ĺ–ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—č –≤ –į—É—ā–ĺ–į–Ĺ—ā–ł–≥–Ķ–Ĺ—č, –≤ –ĺ—ā–≤–Ķ—ā –Ĺ–į –ļ–ĺ—ā–ĺ—Ä—č–Ķ –≤—č—Ä–į–Ī–į—ā—č–≤–į—é—ā—Ā—Ź —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–ł–Ķ –į—É—ā–ĺ–į–Ĺ—ā–ł—ā–Ķ–Ľ–į [15]. –Ě–Ķ–ī–į–≤–Ĺ–ĺ –ĺ–Ņ–ł—Ā–į–Ĺ–į —Ā—É–Ī–Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł—Ź T-—Ö–Ķ–Ľ–Ņ–Ķ—Ä–ĺ–≤, –Ĺ–į–∑–≤–į–Ĺ–Ĺ–į—Ź Th17, –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–į—Ź –∑–į —Ä–į–∑–≤–ł—ā–ł–Ķ –į—É—ā–ĺ–ł–ľ–ľ—É–Ĺ–Ĺ—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ. –£ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ď–ź –≤ —Ā–Ľ—é–Ĺ–Ķ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ—ā—Ā—Ź –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł IL-17, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —ć—Ą—Ą–Ķ–ļ—ā–ĺ—Ä–Ĺ—č–ľ —Ü–ł—ā–ĺ–ļ–ł–Ĺ–ĺ–ľ, –Ņ—Ä–ĺ–ī—É—Ü–ł—Ä—É–Ķ–ľ—č–ľ Th17 –ļ–Ľ–Ķ—ā–ļ–į–ľ–ł [15]. –í 2009 –≥. –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ—č –Ĺ–ĺ–≤—č–Ķ –≥–Ķ–Ĺ—č –≤–ĺ—Ā–Ņ—Ä–ł–ł–ľ—á–ł–≤–ĺ—Ā—ā–ł –ļ –Ď–ź, –Ĺ–Ķ —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č–Ķ —Ā –ł–ľ–ľ—É–Ĺ–Ĺ–ĺ–Ļ —Ā–ł—Ā—ā–Ķ–ľ–ĺ–Ļ. –ü–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ –≥–Ķ–Ĺ–ĺ–≤ —Ö–ł—ā–ł–Ĺ–į–∑—č –ł —Ö–ł—ā–ł–Ĺ–į–∑–ĺ–Ņ–ĺ–ī–ĺ–Ī–Ĺ—č—Ö –Ī–Ķ–Ľ–ļ–ĺ–≤ CHIT1, CHIA, CHI3L1 —Ā–ĺ—á–Ķ—ā–į–Ķ—ā—Ā—Ź —Ā —Ä–ł—Ā–ļ–ĺ–ľ –Ď–ź.
–ě—ā–Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –Ĺ–Ķ–ī–į–≤–Ĺ–ĺ –Ī—č–Ľ –ĺ—Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑–ĺ–≤–į–Ĺ –Ņ–Ķ—Ä–≤—č–Ļ –Ņ–ĺ–∑–ł—Ü–ł–ĺ–Ĺ–Ĺ–ĺ –ļ–Ľ–ĺ–Ĺ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–Ļ –≥–Ķ–Ĺ –į—Ā—ā–ľ—č ADAM33 –Ĺ–į —Ö—Ä–ĺ–ľ–ĺ—Ā–ĺ–ľ–Ķ 20p13. –ź–Ĺ–į–Ľ–ł–∑ 135 –ĺ–ī–Ĺ–ĺ–Ĺ—É–ļ–Ľ–Ķ–ĺ—ā–ł–ī–Ĺ—č—Ö –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ–ĺ–≤ –≤ 23 –ł–∑ –Ĺ–ł—Ö –Ņ–ĺ–ļ–į–∑–į–Ľ –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—É—é –į—Ā—Ā–ĺ—Ü–ł–į—Ü–ł—é –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź —Ā –≤–į—Ä–ł–į–Ĺ—ā–ĺ–ľ –≥–Ķ–Ĺ–į ADAM33, –ļ–ĺ—ā–ĺ—Ä—č–Ļ –ļ–ĺ–ī–ł—Ä—É–Ķ—ā –ľ–Ķ—ā–į–Ľ–Ľ–ĺ–Ņ—Ä–ĺ—ā–Ķ–į–∑—É, –ł–≥—Ä–į—é—Č—É—é –≤–į–∂–Ĺ—É—é —Ä–ĺ–Ľ—Ć –≤ —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–ł—Ä–ĺ–≤–į–Ĺ–ł–ł –≥–Ľ–į–ī–ļ–ł—Ö –ľ—č—ą—Ü –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤ –ł —Ą–ł–Ī—Ä–ĺ–Ī–Ľ–į—Ā—ā–ĺ–≤ –Ľ–Ķ–≥–ļ–ĺ–≥–ĺ. –í –Ľ–ĺ–ļ—É—Ā–Ķ —Ö—Ä–ĺ–ľ–ĺ—Ā–ĺ–ľ—č 1q31 –≤ 2010 –≥. –Ī—č–Ľ –ł–ī–Ķ–Ĺ—ā–ł—Ą–ł—Ü–ł—Ä–ĺ–≤–į–Ĺ –≥–Ķ–Ĺ DENND1B, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ä—É–Ķ—ā—Ā—Ź –Ĺ–į—ā—É—Ä–į–Ľ—Ć–Ĺ—č–ľ–ł –ļ–ł–Ľ–Ľ–Ķ—Ä–į–ľ–ł –ł –ī–Ķ–Ĺ–ī—Ä–ł—ā–Ĺ—č–ľ–ł –ļ–Ľ–Ķ—ā–ļ–į–ľ–ł, –ļ–ĺ–ī–ł—Ä—É–Ķ—ā –Ī–Ķ–Ľ–ĺ–ļ, –≤–∑–į–ł–ľ–ĺ–ī–Ķ–Ļ—Ā—ā–≤—É—é—Č–ł–Ļ —Ā —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–ľ —Ą–į–ļ—ā–ĺ—Ä–į –Ĺ–Ķ–ļ—Ä–ĺ–∑–į –ĺ–Ņ—É—Ö–ĺ–Ľ–ł, –ł —Ā–≤—Ź–∑–į–Ĺ —Ā —Ä–į–∑–≤–ł—ā–ł–Ķ–ľ –Ď–ź.
–í —Ä–į–∑–≤–ł—ā–ł–ł –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į –Ņ—Ä–ł –Ď–ź –Ņ—Ä–ł–Ĺ–ł–ľ–į—é—ā —É—á–į—Ā—ā–ł–Ķ –Ī–Ķ–Ľ–ļ–ĺ–≤—č–Ķ –Ņ—Ä–ĺ–ī—É–ļ—ā—č –≥–Ķ–Ĺ–ĺ–≤ —Ā–ł—Ā—ā–Ķ–ľ—č –ī–Ķ—ā–ĺ–ļ—Ā–ł–ļ–į—Ü–ł–ł –ļ—Ā–Ķ–Ĺ–ĺ–Ī–ł–ĺ—ā–ł–ļ–ĺ–≤, —ā–į–ļ –Ĺ–į–∑—č–≤–į–Ķ–ľ—č–Ķ –≥–Ķ–Ĺ—č-–ľ–ĺ–ī–ł—Ą–ł–ļ–į—ā–ĺ—Ä—č (GSTM1, GSTT1, CYP2E1, NAT2, SLC11A1) [16]. –ė.–°. –°–į—Ä–ī–į—Ä—Ź–Ĺ–ĺ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ—č —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–ł—á–Ķ—Ā–ļ–ł–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ď–ź –Ņ—Ä–ł –į–Ľ–Ľ–Ķ–Ľ—Ć–Ĺ–ĺ–ľ –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ–Ķ –≥–Ķ–Ĺ–ĺ–≤ –≥–Ľ—É—ā–į—ā–ł–ĺ–Ĺ-S-—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑—č –Ę1 (GSTT1), –≥–Ľ—É—ā–į—ā–ł–ĺ–Ĺ-S-—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑—č –ú1 (GSTM1), –į–Ĺ–≥–ł–ĺ—ā–Ķ–Ĺ–∑–ł–Ĺ–Ņ—Ä–Ķ–≤—Ä–į—Č–į—é—Č–Ķ–≥–ĺ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–į (ACE), —ć–Ĺ–ī–ĺ—ā–Ķ–Ľ–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ā–ł–Ĺ—ā–į–∑—č –ĺ–ļ—Ā–ł–ī–į –į–∑–ĺ—ā–į (eNOS). –Ē–ĺ–ļ–į–∑–į–Ĺ–ĺ, —á—ā–ĺ –į—Ā—Ā–ĺ—Ü–ł–į—Ü–ł—Ź –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–≤ GSTT1GSTM1 –≤ 5 —Ä–į–∑ —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –Ď–ź —É –ī–Ķ—ā–Ķ–Ļ –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā –ĺ–Ī—Č–Ķ–Ļ –Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–Ķ–Ļ. –ü—Ä–ł –Ĺ–į–Ľ–ł—á–ł–ł —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ –į–ļ—ā–ł–≤–Ĺ–ĺ–≥–ĺ –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–į GSTT1+GSTM1+ –≤ –į—Ā—Ā–ĺ—Ü–ł–į—Ü–ł–ł —Ā –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ–ĺ–ľ II –Ņ–ĺ –≥–Ķ–Ĺ—É –ź–°–ē —É –ī–Ķ—ā–Ķ–Ļ —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –Ď–ź —Ā–Ĺ–ł–∂–į–Ķ—ā—Ā—Ź –≤ 7 —Ä–į–∑, —á—ā–ĺ –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā —Ā—á–ł—ā–į—ā—Ć –ī–į–Ĺ–Ĺ—É—é –į—Ā—Ā–ĺ—Ü–ł–į—Ü–ł—é –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–≤ –Ņ—Ä–ĺ—ā–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–Ļ [17].
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź, –ļ–į–ļ —É–∂–Ķ —É–Ņ–ĺ–ľ–ł–Ĺ–į–Ľ–ĺ—Ā—Ć, –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź—é—ā –ĺ–Ī—ä—Ź—Ā–Ĺ–ł—ā—Ć –≤–į—Ä–ł–į—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł, —Ä–į–∑–Ľ–ł—á–Ĺ—É—é —á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –ļ —ā–Ķ—Ä–į–Ņ–ł–ł. –ě–ī–Ĺ–į–ļ–ĺ –ī–Ľ—Ź –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ī–Ķ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł —ć—ā–ł –ī–į–Ĺ–Ĺ—č–Ķ –Ĺ–Ķ –ł–ľ–Ķ—é—ā —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź. –Ď–ĺ–Ľ–Ķ–Ķ –∑–Ĺ–į—á–ł–ľ—č–ľ –≤ –ī–į–Ĺ–Ĺ–ĺ–ľ —Ā–Ľ—É—á–į–Ķ –Ī—É–ī–Ķ—ā –ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ –Ņ–ĺ —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–į–ľ –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł –Ī–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–Ķ–Ļ. –ü—Ä–ł —ć—ā–ĺ–ľ –ĺ—Ü–Ķ–Ĺ–ł–≤–į—é—ā—Ā—Ź –Ņ—Ä–Ķ–ĺ–Ī–Ľ–į–ī–į—é—Č–ł–Ļ —ā–ł–Ņ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź, –Ī–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ľ–į—Ä–ļ–Ķ—Ä—č. –Ę–į–ļ, –≤—č–ī–Ķ–Ľ—Ź—é—ā —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ—Ć–Ĺ—č–Ļ, –į–≥—Ä–į–Ĺ—É–Ľ–ĺ—Ü–ł—ā–į—Ä–Ĺ—č–Ļ (–Ņ—Ä–ł –ļ–ĺ—ā–ĺ—Ä–ĺ–ľ –≤—č–ī–Ķ–Ľ—Ź—é—ā—Ā—Ź —ā–ĺ–Ľ—Ć–ļ–ĺ —Ä–Ķ–∑–ł–ī–Ķ–Ĺ—ā–Ĺ—č–Ķ –ļ–Ľ–Ķ—ā–ļ–ł) –ł —Ā–ľ–Ķ—ą–į–Ĺ–Ĺ—č–Ļ –Ņ–ĺ–ī—ā–ł–Ņ—č.
–Ě–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –ł–∑—É—á–Ķ–Ĺ–Ĺ—č–ľ –Ĺ–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ—Ć–Ĺ—č–Ļ —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ. –ě–Ĺ –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł —É 50% –≤–∑—Ä–ĺ—Ā–Ľ—č—Ö, —Ā—ā—Ä–į–ī–į—é—Č–ł—Ö –Ď–ź. –Ę–į–ļ–ĺ–Ļ —ā–ł–Ņ —Ā–≤—Ź–∑–į–Ĺ —Ā —Ä–į–∑–≤–ł—ā–ł–Ķ–ľ —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ—Ć–Ĺ–ĺ–Ļ –ł–Ĺ—Ą–ł–Ľ—Ć—ā—Ä–į—Ü–ł–ł –≤ –ĺ—á–į–≥–Ķ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź, –į–ļ—ā–ł–≤–į—Ü–ł–Ķ–Ļ —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ–ĺ–≤ –ł –≤—č–Ī—Ä–ĺ—Ā–ĺ–ľ –ľ–Ķ–ī–ł–į—ā–ĺ—Ä–ĺ–≤. –ß–į—Č–Ķ –≤—Ā–Ķ–≥–ĺ —ā–į–ļ–ĺ–Ļ —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź –Ņ—Ä–ł —Ä–į–∑–≤–ł—ā–ł–ł –į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ď–ź, –į—Ā—Ā–ĺ—Ü–ł–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ —Ā –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–ľ —Ä–ł–Ĺ–ł—ā–ĺ–ľ, –į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ł–ľ –ī–Ķ—Ä–ľ–į—ā–ł—ā–ĺ–ľ. –ė–∑-–∑–į —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł T-reg –ļ–Ľ–Ķ—ā–ĺ–ļ –Ņ—Ä–Ķ–ĺ–Ī–Ľ–į–ī–į–Ķ—ā Th2-–į—Ā—Ā–ĺ—Ü–ł–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–Ļ –ĺ—ā–≤–Ķ—ā [18]. –≠—ā–ĺ —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į–Ķ—ā—Ā—Ź –Ņ—Ä–ĺ–ī—É–ļ—Ü–ł–Ķ–Ļ IL-4, IL-13, IL–5, IL-6, IL-10, —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–ł—Ö –Ľ–ł–≥–į–Ĺ–ī CD40, —á—ā–ĺ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ņ—É—Ā–ļ–ĺ–≤—č–ľ –ľ–ĺ–ľ–Ķ–Ĺ—ā–ĺ–ľ –ī–Ľ—Ź –Ĺ–į—á–į–Ľ–į —Ā–ł–Ĺ—ā–Ķ–∑–į IgE –í––ļ–Ľ–Ķ—ā–ļ–į–ľ–ł. –ě–Ī—č—á–Ĺ–ĺ –Ņ—Ä–ł —ć—ā–ĺ–ľ –Ĺ–į–Ī–Ľ—é–ī–į—é—ā—Ā—Ź –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ–ł–Ķ —ć–Ņ–ł—ā–Ķ–Ľ–ł—Ź, –≥–ł–Ņ–Ķ—Ä—ā—Ä–ĺ—Ą–ł—Ź –≥–Ľ–į–ī–ļ–ĺ–Ļ –ľ—É—Ā–ļ—É–Ľ–į—ā—É—Ä—č, –≥–ł–Ņ–Ķ—Ä–Ņ–Ľ–į–∑–ł—Ź –Ī–ĺ–ļ–į–Ľ–ĺ–≤–ł–ī–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ. –Ď–ł–ĺ–ľ–į—Ä–ļ–Ķ—Ä–į–ľ–ł —ā–į–ļ–ĺ–≥–ĺ —ā–ł–Ņ–į —Ā—á–ł—ā–į—é—ā—Ā—Ź —É—Ä–ĺ–≤–Ķ–Ĺ—Ć —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ–ł–ł –ļ—Ä–ĺ–≤–ł, –Ņ–Ķ—Ä–ł–ĺ—Ā—ā–ł–Ĺ (—É—á–į—Ā—ā–≤—É–Ķ—ā –≤ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į—Ö –į–ī–≥–Ķ–∑–ł–ł –ł –ľ–ł–≥—Ä–į—Ü–ł–ł —ć–Ņ–ł—ā–Ķ–Ľ–ł–į–Ľ—Ć–Ĺ—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ), —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –ĺ–ļ—Ā–ł–ī–į –į–∑–ĺ—ā–į –≤ –≤—č–ī—č—Ö–į–Ķ–ľ–ĺ–ľ –≤–ĺ–∑–ī—É—Ö–Ķ. –ü–į—Ü–ł–Ķ–Ĺ—ā—č —Ā —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ—Ć–Ĺ—č–ľ —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–ľ —Ö–ĺ—Ä–ĺ—ą–ĺ –ĺ—ā–≤–Ķ—á–į—é—ā –Ĺ–į —ā–Ķ—Ä–į–Ņ–ł—é –ļ–ĺ—Ä—ā–ł–ļ–ĺ—Ā—ā–Ķ—Ä–ĺ–ł–ī–į–ľ–ł, —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –į—Ā—ā–ľ—č –≤ –ī–į–Ĺ–Ĺ–ĺ–ľ —Ā–Ľ—É—á–į–Ķ —Ā—á–ł—ā–į–Ķ—ā—Ā—Ź –Ī–ĺ–Ľ–Ķ–Ķ –Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č–ľ [1].
–Ě–į —Ä–į–∑–≤–ł—ā–ł–Ķ –Ď–ź –≤–Ľ–ł—Ź—é—ā –Ņ—Ä–ł—á–ł–Ĺ–Ĺ—č–Ķ –ł –ł–Ĺ–ł—Ü–ł–ł—Ä—É—é—Č–ł–Ķ —Ą–į–ļ—ā–ĺ—Ä—č. –ď–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —Ą–į–ļ—ā–ĺ—Ä –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ—ā –Ĺ–į—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ—č–Ķ, –ļ–ĺ–Ĺ—Ā—ā–ł—ā—É—Ü–ł–ĺ–Ĺ–Ĺ—č–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł, –Ņ–ĺ–Ľ–ĺ–≤—É—é –Ņ—Ä–ł–Ĺ–į–ī–Ľ–Ķ–∂–Ĺ–ĺ—Ā—ā—Ć, —Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ—É—ā–Ķ–Ļ, –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ł–ľ–ľ—É–Ĺ–Ĺ–ĺ–≥–ĺ –ĺ—ā–≤–Ķ—ā–į –Ĺ–į –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–į. –≠–ļ–∑–ĺ–≥–Ķ–Ĺ–Ĺ—č–Ķ —Ą–į–ļ—ā–ĺ—Ä—č —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É—é—ā —Ä–Ķ–į–Ľ–ł–∑–į—Ü–ł–ł –≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ņ—Ä–Ķ–ī—Ä–į—Ā–Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –ļ —Ä–į–∑–≤–ł—ā–ł—é –Ď–ź, –ļ –Ĺ–ł–ľ –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā—Ā—Ź –Ņ–ĺ—Ā—ā–ĺ—Ź–Ĺ–Ĺ—č–Ļ –ļ–ĺ–Ĺ—ā–į–ļ—ā —Ā –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–į–ľ–ł –ł –Ņ–ĺ–Ľ–Ľ—é—ā–į–Ĺ—ā–į–ľ–ł, —á–į—Ā—ā—č–Ķ –ĺ—Ā—ā—Ä—č–Ķ —Ä–Ķ—Ā–Ņ–ł—Ä–į—ā–ĺ—Ä–Ĺ—č–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, —Ā–ĺ–Ņ—É—ā—Ā—ā–≤—É—é—Č–į—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—Ź –Ņ–ł—Č–Ķ–≤–į—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –ł —ć–Ĺ–ī–ĺ–ļ—Ä–ł–Ĺ–Ĺ–ĺ–Ļ —Ā–ł—Ā—ā–Ķ–ľ, —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ-—ć–ļ–ĺ–Ĺ–ĺ–ľ–ł—á–Ķ—Ā–ļ–ł–Ļ —Ā—ā–į—ā—É—Ā. –Ē–Ľ—Ź –į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ď–ź –Ņ—Ä–ł—á–ł–Ĺ–Ĺ–ĺ-–∑–Ĺ–į—á–ł–ľ—č–ľ–ł –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–į–ľ–ł —Ź–≤–Ľ—Ź—é—ā—Ā—Ź –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā—č –ī–ĺ–ľ–į—ą–Ĺ–Ķ–Ļ –Ņ—č–Ľ–ł, –≤ —ā.—á. –ļ–Ľ–Ķ—Č–ł —Ä–ĺ–ī–į –Ē–Ķ—Ä–ľ–į—ā–ĺ—Ą–į–≥–ĺ–ł–ī–Ķ—Ā, –ł–Ĺ—Ā–Ķ–ļ—ā–Ĺ—č–Ķ –ł –≥—Ä–ł–Ī–ļ–ĺ–≤—č–Ķ –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ—č, —ć–Ņ–ł–ī–Ķ—Ä–ľ–ł—Ā –ł —Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ—č–Ķ –≤—č–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –∂–ł–≤–ĺ—ā–Ĺ—č—Ö, –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ—č –Ņ—č–Ľ—Ć—Ü—č —Ä–į—Ā—ā–Ķ–Ĺ–ł–Ļ, –Ņ–ł—Č–Ķ–≤—č–Ķ –ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ—č.
–Ē–Ľ—Ź —É–Ľ—É—á—ą–Ķ–Ĺ–ł—Ź –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –Ď–ź –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ –ł—Ā–ļ–Ľ—é—á–ł—ā—Ć –ļ–ĺ–Ĺ—ā–į–ļ—ā —Ā –Ņ—Ä–ł—á–ł–Ĺ–Ĺ—č–ľ –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–ĺ–ľ. –Ě–ĺ –Ķ—Ā–Ľ–ł –ľ–ĺ–∂–Ĺ–ĺ –ĺ–≥—Ä–į–Ĺ–ł—á–ł—ā—Ć –ļ–ĺ–Ĺ—ā–į–ļ—ā —Ā –∂–ł–≤–ĺ—ā–Ĺ—č–ľ–ł, –ł—Ā–ļ–Ľ—é—á–ł—ā—Ć –ł–∑ –Ņ–ł—Č–ł –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–Ĺ—č–Ķ –Ņ—Ä–ĺ–ī—É–ļ—ā—č –ł –Ņ—Ä–ł–Ķ–ľ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤, —ā–ĺ –ł—Ā–ļ–Ľ—é—á–ł—ā—Ć –ł–∑ –ĺ–Ī—č—á–Ĺ–ĺ–Ļ –∂–ł–∑–Ĺ–ł –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –į—ć—Ä–ĺ–į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–ĺ–≤ –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł –Ĺ–Ķ–≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ.
–ē–ī–ł–Ĺ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł –ĺ–Ī–ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–Ĺ—č–ľ –ľ–Ķ—ā–ĺ–ī–ĺ–ľ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź IgE-–∑–į–≤–ł—Ā–ł–ľ—č—Ö –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ –Ĺ–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ—Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–į—Ź –ł–ľ–ľ—É–Ĺ–ĺ—ā–Ķ—Ä–į–Ņ–ł—Ź (–ź–°–ė–Ę). –Ē–Ķ–Ļ—Ā—ā–≤–ł–Ķ –Ķ–Ķ –ĺ—Ä–ł–Ķ–Ĺ—ā–ł—Ä–ĺ–≤–į–Ĺ–ĺ –Ĺ–Ķ –Ĺ–į —Ā–ł–ľ–Ņ—ā–ĺ–ľ—č –į–Ľ–Ľ–Ķ—Ä–≥–ł–ł, –į –Ĺ–į –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑ —Ā–į–ľ–ĺ–≥–ĺ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź. –ü—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ –ź–°–ė–Ę –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ –Ņ–Ķ—Ä–Ķ–ļ–Ľ—é—á–Ķ–Ĺ–ł—é –ł–ľ–ľ—É–Ĺ–Ĺ–ĺ–≥–ĺ –ĺ—ā–≤–Ķ—ā–į —Ā –Ņ–ĺ–≤—Ä–Ķ–∂–ī–į—é—Č–Ķ–≥–ĺ –Ĺ–į –∑–į—Č–ł—ā–Ĺ—č–Ļ –ĺ—ā–≤–Ķ—ā, –≤—č—Ä–į–Ī–į—ā—č–≤–į–Ķ—ā—Ā—Ź —ā–ĺ–Ľ–Ķ—Ä–į–Ĺ—ā–Ĺ–ĺ—Ā—ā—Ć –Ę-–Ľ–ł–ľ—Ą–ĺ—Ü–ł—ā–ĺ–≤. –ź–°–ė–Ę –≤–Ľ–ł—Ź–Ķ—ā –Ĺ–į –≤—Ā–Ķ —ć—ā–į–Ņ—č —Ä–į–∑–≤–ł—ā–ł—Ź –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ĺ—ā–≤–Ķ—ā–į, –≤ —ā.—á. –ł –Ĺ–į –ł–ľ–ľ—É–Ĺ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ—É—é —Ą–į–∑—É, —á—ā–ĺ –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ –Ņ–Ķ—Ä–Ķ–ļ–Ľ—é—á–Ķ–Ĺ–ł—é –ł–ľ–ľ—É–Ĺ–Ĺ–ĺ–≥–ĺ –ĺ—ā–≤–Ķ—ā–į —Ā Th2 –Ĺ–į Th1 —ā–ł–Ņ, —ā–ĺ—Ä–ľ–ĺ–∑—Ź –ļ–į–ļ —Ä–į–Ĺ–Ĺ—é—é, —ā–į–ļ –ł –Ņ–ĺ–∑–ī–Ĺ—é—é —Ą–į–∑—č –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ĺ—ā–≤–Ķ—ā–į. –ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ —Ä–į–∑–Ĺ—č—Ö –į–≤—ā–ĺ—Ä–ĺ–≤, –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ź–°–ė–Ę –ī–ĺ—Ā—ā–ł–≥–į–Ķ—ā—Ā—Ź –≤ 70–90% —Ā–Ľ—É—á–į–Ķ–≤. –£ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ĺ—ā–ľ–Ķ—á–į—é—ā—Ā—Ź —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–≤ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā–ł –≤ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į—Ö. –ź–°–ė–Ę –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é —ā–ļ–į–Ĺ–Ķ–≤–ĺ–Ļ –ł –ĺ—Ä–≥–į–Ĺ–Ĺ–ĺ–Ļ —á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –ļ –≤–ĺ–∑–ī–Ķ–Ļ—Ā—ā–≤–ł—é –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–į, –Ĺ–Ķ—Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–ĺ–Ļ –≥–ł–Ņ–Ķ—Ä—Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł —ā–ļ–į–Ĺ–Ķ–Ļ, —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł—é –ī—Ä—É–≥–ł—Ö –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–≤ –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź. –ü–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č–Ļ —ć—Ą—Ą–Ķ–ļ—ā —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ķ—ā—Ā—Ź –Ĺ–į –Ņ—Ä–ĺ—ā—Ź–∂–Ķ–Ĺ–ł–ł –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ł—Ö –Ľ–Ķ—ā. –ü—Ä–ł–Ĺ—Ü–ł–Ņ–ł–į–Ľ—Ć–Ĺ—č–ľ –ĺ—ā–Ľ–ł—á–ł–Ķ–ľ –ĺ—ā —Ą–į—Ä–ľ–į–ļ–ĺ—ā–Ķ—Ä–į–Ņ–ł–ł —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —ā–į–ļ–∂–Ķ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ —Ā—Ä–į–∑—É –Ĺ–į –≤—Ā–Ķ –∑–≤–Ķ–Ĺ—Ć—Ź –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź [1, 29].
–†–į–∑–≤–ł—ā–ł–Ķ –Ĺ–Ķ—ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ—č –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ –Ĺ–Ķ–Ļ—ā—Ä–ĺ—Ą–ł–Ľ—Ć–Ĺ—č–ľ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł–Ķ–ľ. –°—É—Č–Ķ—Ā—ā–≤—É–Ķ—ā –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ, —á—ā–ĺ –ĺ–Ĺ–į —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ–ľ –Ī–į–ļ—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –ļ–ĺ–Ľ–ĺ–Ĺ–ł–∑–į—Ü–ł–ł –ł–Ľ–ł —Ā–≤—Ź–∑–į–Ĺ–į —Ā –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ –ł–Ĺ—Ą–Ķ–ļ—Ü–ł–ł –ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ—É—ā–Ķ–Ļ, —ā—Ä–ł–≥–≥–Ķ—Ä–ĺ–≤ (—ā–į–Ī–į—á–Ĺ—č–Ļ –ī—č–ľ, –Ĺ–Ķ–≤—Ä–ĺ–≥–Ķ–Ĺ–Ĺ—č–Ļ —Ą–ĺ–Ĺ –ł —ā.–ī.). –Ę–į–ļ–ĺ–Ļ —ā–ł–Ņ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź –į—Ā—Ā–ĺ—Ü–ł–ł—Ä—É–Ķ—ā—Ā—Ź —Ā –Ņ—Ä–ĺ–ī—É–ļ—Ü–ł–Ķ–Ļ –Ĺ–Ķ–Ļ—ā—Ä–ĺ—Ą–ł–Ľ–į–ľ–ł —ć–Ľ–į—Ā—ā–į–∑—č, α1-–į–Ĺ—ā–ł—ā—Ä–ł–Ņ—Ā–ł–Ĺ–į, IL-8, IL-17. –ö –Ī–ł–ĺ–ľ–į—Ä–ļ–Ķ—Ä–į–ľ —ć—ā–ĺ–≥–ĺ —ā–ł–Ņ–į –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā –ł–Ĺ–ī—É–ļ—Ü–ł—é NO-—Ā–ł–Ĺ—ā–į–∑—č, —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –ī–ł–ľ–Ķ—ā–ł–Ľ–į—Ä–≥–ł–Ĺ–ł–Ĺ–į –≤ –ļ—Ä–ĺ–≤–ł. –Ē–Ľ—Ź —ā–į–ļ–ĺ–≥–ĺ —ā–ł–Ņ–į —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–ĺ –Ī–ĺ–Ľ–Ķ–Ķ –į–≥—Ä–Ķ—Ā—Ā–ł–≤–Ĺ–ĺ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ď–ź, —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į—é—Č–Ķ–Ķ—Ā—Ź –ī–Ķ—Ā—ā—Ä—É–ļ—Ü–ł–Ķ–Ļ —ā–ļ–į–Ĺ–Ķ–Ļ –ł –Ĺ–ł–∑–ļ–ł–ľ –ĺ—ā–≤–Ķ—ā–ĺ–ľ –Ĺ–į –≥–ĺ—Ä–ľ–ĺ–Ĺ–į–Ľ—Ć–Ĺ—É—é —ā–Ķ—Ä–į–Ņ–ł—é [1, 19–21]. –í –ī–į–Ĺ–Ĺ–ĺ–ľ —Ā–Ľ—É—á–į–Ķ –ī–Ľ—Ź —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ—Ä–Ķ–ī–Ņ–ĺ—á—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ł—Ā–Ņ–ĺ–Ľ—Ć–∑—É—é—ā –ļ–ĺ–ľ–Ī–ł–Ĺ–į—Ü–ł–ł –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ—č—Ö –≥–Ľ—é–ļ–ĺ–ļ–ĺ—Ä—ā–ł–ļ–ĺ—Ā—ā–Ķ—Ä–ĺ–ł–ī–ĺ–≤ (–ė–ď–ö–°) —Ā –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ—č–ľ–ł β2-–į–≥–ĺ–Ĺ–ł—Ā—ā–į–ľ–ł –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź, —á—ā–ĺ –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā —É–Ľ—É—á—ą–ł—ā—Ć –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć –Ď–ź, —Ą—É–Ĺ–ļ—Ü–ł—é –Ľ–Ķ–≥–ļ–ł—Ö, —Ā–Ĺ–ł–∑–ł—ā—Ć –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā—Ć –≤ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į—Ö –Ņ–Ķ—Ä–≤–ĺ–Ļ –Ņ–ĺ–ľ–ĺ—Č–ł. –Ę–į–ļ–∂–Ķ –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—é—ā –ļ–ĺ–ľ–Ī–ł–Ĺ–į—Ü–ł—é –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –ľ–į–ļ—Ä–ĺ–Ľ–ł–ī–į–ľ–ł –ł —Ā–ł—Ā—ā–Ķ–ľ–Ĺ–ĺ–≥–ĺ –ľ–Ķ—ā–ł–Ľ–Ņ—Ä–Ķ–ī–Ĺ–ł–∑–ĺ–Ľ–ĺ–Ĺ–į. –Ę–į–ļ –ī–ĺ—Ā—ā–ł–≥–į–Ķ—ā—Ā—Ź —Ā—ā–Ķ—Ä–ĺ–ł–ī—Ā–Ī–Ķ—Ä–Ķ–≥–į—é—Č–ł–Ļ —ć—Ą—Ą–Ķ–ļ—ā, –Ĺ–ĺ –Ņ—Ä–ł—á–ł–Ĺ–ĺ–Ļ –Ķ–≥–ĺ –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć –∑–į–ľ–Ķ–ī–Ľ–Ķ–Ĺ–Ĺ—č–Ļ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ –≥–Ľ—é–ļ–ĺ–ļ–ĺ—Ä—ā–ł–ļ–ĺ—Ā—ā–Ķ—Ä–ĺ–ł–ī–ĺ–≤ (–ď–ö–°) –Ņ–ĺ–ī –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ –ľ–į–ļ—Ä–ĺ–Ľ–ł–ī–į, —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ, —ā–į–ļ–į—Ź –ļ–ĺ–ľ–Ī–ł–Ĺ–į—Ü–ł—Ź –≤—Ä—Ź–ī –Ľ–ł –Ņ—Ä–ł–≤–Ķ–ī–Ķ—ā –ļ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é –Ĺ–Ķ–∂–Ķ–Ľ–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤ –ď–ö–° [7].
–†–į–Ĺ–Ķ–Ķ —Ā—á–ł—ā–į–Ľ–ĺ—Ā—Ć, —á—ā–ĺ –Ď–ź —Ä–į–∑–≤–ł–≤–į–Ķ—ā—Ā—Ź –≤ –ļ—Ä—É–Ņ–Ĺ—č—Ö –ł —Ā—Ä–Ķ–ī–Ĺ–ł—Ö –Ī—Ä–ĺ–Ĺ—Ö–į—Ö, –ĺ–ī–Ĺ–į–ļ–ĺ –≤ –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–Ķ–Ķ –≤—Ä–Ķ–ľ—Ź –Ī—č–Ľ–į –Ņ–Ķ—Ä–Ķ—Ā–ľ–ĺ—ā—Ä–Ķ–Ĺ–į —Ä–ĺ–Ľ—Ć –ľ–Ķ–Ľ–ļ–ł—Ö –ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ—É—ā–Ķ–Ļ. –Ě–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ—č –ī–į–Ĺ–Ĺ—č–Ķ, –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į—é—Č–ł–Ķ —Ä–ĺ–Ľ—Ć –ī–ł—Ā—ā–į–Ľ—Ć–Ĺ—č—Ö –ĺ—ā–ī–Ķ–Ľ–ĺ–≤ –≤ —Ä–į–∑–≤–ł—ā–ł–ł –Ď–ź. –ö –Ĺ–ł–ľ –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā—Ā—Ź –Ī—Ä–ĺ–Ĺ—Ö–ł —Ā –≤–Ĺ—É—ā—Ä–Ķ–Ĺ–Ĺ–ł–ľ –ī–ł–į–ľ–Ķ—ā—Ä–ĺ–ľ –ľ–Ķ–Ĺ–Ķ–Ķ 2 –ľ–ľ, 9–23 –≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł–ł, –ł—Ö —Ā—ā–Ķ–Ĺ–ļ–į –Ĺ–Ķ —Ā–ĺ–ī–Ķ—Ä–∂–ł—ā —Ö—Ä—Ź—Č–Ķ–≤–ĺ–Ļ —ā–ļ–į–Ĺ–ł, –ĺ–Ī—Č–į—Ź –Ņ–Ľ–ĺ—Č–į–ī—Ć –ľ—č—ą–Ķ—á–Ĺ–ĺ–Ļ —ā–ļ–į–Ĺ–ł –Ĺ–Ķ –Ņ—Ä–Ķ–≤—č—ą–į–Ķ—ā 20% –ĺ—ā –ĺ–Ī—Č–Ķ–≥–ĺ –Ņ–Ķ—Ä–ł–ľ–Ķ—ā—Ä–į –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ā—ā–Ķ–Ĺ–ļ–ł. –Ě–į—á–ł–Ĺ–į—Ź —Ā 8-–≥–ĺ —É—Ä–ĺ–≤–Ĺ—Ź –≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł–ł –Ĺ–į–Ī–Ľ—é–ī–į–Ķ—ā—Ā—Ź –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ —Ä–ĺ—Ā—ā –Ņ–Ľ–ĺ—Č–į–ī–ł —Ā—É–ľ–ľ–į—Ä–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ā–≤–Ķ—ā–į –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤. –ö 20-–Ļ –≥–Ķ–Ĺ–Ķ—Ä–į—Ü–ł–ł –ĺ–Ĺ —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā —É–∂–Ķ 1743 —Ā–ľ2. –í –Ī—Ä–ĺ–Ĺ—Ö–į—Ö –ľ–Ķ–Ľ–ļ–ĺ–≥–ĺ –ļ–į–Ľ–ł–Ī—Ä–į –Ĺ–į–Ī–Ľ—é–ī–į–Ķ—ā—Ā—Ź –ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–ł–Ķ —Ā–ļ–ĺ—Ä–ĺ—Ā—ā–ł –≤–ĺ–∑–ī—É—ą–Ĺ–ĺ–≥–ĺ –Ņ–ĺ—ā–ĺ–ļ–į, —á—ā–ĺ –ĺ–Ī—ä—Ź—Ā–Ĺ—Ź–Ķ—ā –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –Ņ—Ä–ł –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–ł —Ā–Ņ–ł—Ä–ĺ–ľ–Ķ—ā—Ä–ł–ł. –ö–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–≤ –ĺ–Ī—Ā—ā—Ä—É–ļ—Ü–ł–ł –≤ –Ī—Ä–ĺ–Ĺ—Ö–į—Ö –ľ–Ķ–Ľ–ļ–ĺ–≥–ĺ –ļ–į–Ľ–ł–Ī—Ä–į –ĺ–Ī–Ĺ–į—Ä—É–∂–ł—ā—Ć –Ĺ–Ķ —É–ī–į–Ķ—ā—Ā—Ź, –ĺ–ī–Ĺ–į–ļ–ĺ –Ņ—Ä–ł –ĺ—Ü–Ķ–Ĺ–ļ–Ķ –Ī–ł–ĺ–Ņ—ā–į—ā–ĺ–≤ —É–ľ–Ķ—Ä—ą–ł—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ī—č–Ľ–ł –Ĺ–į–Ļ–ī–Ķ–Ĺ—č –Ņ—Ä–ł–∑–Ĺ–į–ļ–ł –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ–ł—Ź –≤ –ľ–Ķ–Ľ–ļ–ł—Ö –Ī—Ä–ĺ–Ĺ—Ö–į—Ö, —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ—č–Ķ –ī–Ľ—Ź –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ–ł—Ź —Ā—ā–Ķ–Ĺ–ĺ–ļ –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤ –ļ—Ä—É–Ņ–Ĺ–ĺ–≥–ĺ –ł —Ā—Ä–Ķ–ī–Ĺ–Ķ–≥–ĺ –ļ–į–Ľ–ł–Ī—Ä–į, –ł –į–ļ—ā–ł–≤–Ĺ–į—Ź —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ–ł—Ź. –°—ā—Ä—É–ļ—ā—É—Ä–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –≤ –Ĺ–ł–∂–Ĺ–ł—Ö –ĺ—ā–ī–Ķ–Ľ–į—Ö –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤, –≤–ĺ–∑–Ĺ–ł–ļ—ą–ł–Ķ –≤ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ —Ä–į–∑–≤–ł–≤—ą–Ķ–≥–ĺ—Ā—Ź –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź, —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤–ĺ–≤–į–Ľ–ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é —ć–Ľ–į—Ā—ā–ł—á–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ–≥–ĺ—á–Ĺ–ĺ–Ļ —ā–ļ–į–Ĺ–ł –ł —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—é –≤–ĺ–∑–ī—É—ą–Ĺ—č—Ö –Ľ–ĺ–≤—É—ą–Ķ–ļ. –ü—Ä–ł –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–ł —ā—Ä–į–Ĺ—Ā–Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ī–ł–ĺ–Ņ—Ā–ł–ł in vivo —ā–į–ļ–∂–Ķ –Ī—č–Ľ–ĺ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ĺ –Ĺ–į–Ľ–ł—á–ł–Ķ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ—č—Ö –ī–Ľ—Ź Th2-–ĺ—ā–≤–Ķ—ā–į –ļ–Ľ–Ķ—ā–ĺ–ļ (—ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ—č, –ľ–į–ļ—Ä–ĺ—Ą–į–≥–ł, —ā—É—á–Ĺ—č–Ķ –ļ–Ľ–Ķ—ā–ļ–ł), –Ņ—Ä–ł—á–Ķ–ľ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā —ā—Ź–∂–Ķ–Ľ–ĺ–Ļ –į—Ā—ā–ľ–ĺ–Ļ –ľ–Ķ–Ľ–ļ–ł–Ķ –Ī—Ä–ĺ–Ĺ—Ö–ł –Ī—č–Ľ–ł –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ—č –Ī–ĺ–Ľ—Ć—ą–Ķ, —á–Ķ–ľ –Ī—Ä–ĺ–Ĺ—Ö–ł —Ā—Ä–Ķ–ī–Ĺ–Ķ–≥–ĺ –ł –ļ—Ä—É–Ņ–Ĺ–ĺ–≥–ĺ –ļ–į–Ľ–ł–Ī—Ä–ĺ–≤. –£—Ä–ĺ–≤–Ķ–Ĺ—Ć —ć–ĺ–∑–ł–Ĺ–ĺ—Ą–ł–Ľ–ł–ł –≤ —ā–ļ–į–Ĺ—Ź—Ö –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č—Ö –Ī–ł–ĺ–Ņ—ā–į—ā–ĺ–≤ —ā–į–ļ–∂–Ķ –Ī—č–Ľ –≤—č—ą–Ķ, —á—ā–ĺ —Ā–≤–ł–ī–Ķ—ā–Ķ–Ľ—Ć—Ā—ā–≤—É–Ķ—ā –ĺ –Ī–ĺ–Ľ–Ķ–Ķ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ–ľ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł–ł –≤ –ī–ł—Ā—ā–į–Ľ—Ć–Ĺ—č—Ö –ĺ—ā–ī–Ķ–Ľ–į—Ö. Wenzel et al. –Ņ—Ä–ł –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –Ī–ł–ĺ–Ņ—ā–į—ā–ĺ–≤, –≤–∑—Ź—ā—č—Ö —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā–ĺ —Ā—ā–Ķ—Ä–ĺ–ł–ī–ĺ—Ä–Ķ–∑–ł—Ā—ā–Ķ–Ĺ—ā–Ĺ–ĺ–Ļ –į—Ā—ā–ľ–ĺ–Ļ, –ĺ–Ņ–ł—Ā–į–Ľ–ł –Ī–ĺ–Ľ–Ķ–Ķ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ–Ķ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł–Ķ –≤ –Ī—Ä–ĺ–Ĺ—Ö–į—Ö –ľ–į–Ľ–ĺ–≥–ĺ –ļ–į–Ľ–ł–Ī—Ä–į.
–Ě–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł —ć—ā–ł—Ö –ī–į–Ĺ–Ĺ—č—Ö –ľ–ĺ–∂–Ĺ–ĺ –∑–į–ļ–Ľ—é—á–ł—ā—Ć, —á—ā–ĺ –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā –≤ –ľ–Ķ–Ľ–ļ–ł—Ö –Ī—Ä–ĺ–Ĺ—Ö–į—Ö –ĺ–ļ–į–∑—č–≤–į–Ķ—ā —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ķ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –Ĺ–į —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ď–ź –ł —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É–Ķ—ā—Ā—Ź –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ –ĺ–Ī—Ā—ā—Ä—É–ļ—Ü–ł–Ķ–Ļ –ł —É–Ņ–Ľ–ĺ—ā–Ĺ–Ķ–Ĺ–ł–Ķ–ľ –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ā—ā–Ķ–Ĺ–ļ–ł –∑–į —Ā—á–Ķ—ā –ĺ—ā–Ķ–ļ–į, –Ĺ–ĺ –ł —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ–ľ —ā–į–ļ –Ĺ–į–∑—č–≤–į–Ķ–ľ—č—Ö –≤–ĺ–∑–ī—É—ą–Ĺ—č—Ö –Ľ–ĺ–≤—É—ą–Ķ–ļ [24].
–°–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č–Ķ –≤–∑–≥–Ľ—Ź–ī—č –Ĺ–į —ā–Ķ—Ä–į–Ņ–ł—é –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ—č
–ź–ľ–Ķ—Ä–ł–ļ–į–Ĺ—Ā–ļ–ĺ–Ķ –ĺ–Ī—Č–Ķ—Ā—ā–≤–ĺ –Ņ—É–Ľ—Ć–ľ–ĺ–Ĺ–ĺ–Ľ–ĺ–≥–ĺ–≤ –ł –ē–≤—Ä–ĺ–Ņ–Ķ–Ļ—Ā–ļ–ĺ–Ķ —Ä–Ķ—Ā–Ņ–ł—Ä–į—ā–ĺ—Ä–Ĺ–ĺ–Ķ –ĺ–Ī—Č–Ķ—Ā—ā–≤–ĺ —Ä–į–∑—Ä–į–Ī–ĺ—ā–į–Ľ–ł —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł–ł, –≤–ļ–Ľ—é—á–į—é—Č–ł–Ķ –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –≤–į–∂–Ĺ—č–Ķ –ľ–ĺ–ľ–Ķ–Ĺ—ā—č, –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ—č–Ķ –ī–Ľ—Ź –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –Ĺ–į–ī –į—Ā—ā–ľ–ĺ–Ļ. –í–ĺ-–Ņ–Ķ—Ä–≤—č—Ö, –≤—Ā–Ķ–ľ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī—É–Ķ—ā—Ā—Ź –Ņ—Ä–ĺ—Ö–ĺ–ī–ł—ā—Ć –į–Ĺ–ļ–Ķ—ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –ł –≤–Ķ—Ā—ā–ł –ī–Ĺ–Ķ–≤–Ĺ–ł–ļ —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į—ā–ł–ļ–ł –ī–Ľ—Ź –ĺ—Ü–Ķ–Ĺ–ļ–ł —ā—Ź–∂–Ķ—Ā—ā–ł –į—Ā—ā–ľ—č –≤ –ľ–ĺ–ľ–Ķ–Ĺ—ā –Ņ–ĺ–ī–Ī–ĺ—Ä–į —ā–Ķ—Ä–į–Ņ–ł–ł –ł –ĺ—Ā—É—Č–Ķ—Ā—ā–≤–Ľ–Ķ–Ĺ–ł—Ź –ī–į–Ľ—Ć–Ĺ–Ķ–Ļ—ą–Ķ–≥–ĺ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ĺ–≤–ĺ–ī–ł–ľ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź. –í—ā–ĺ—Ä—č–ľ –Ī–į–∑–ĺ–≤—č–ľ –ľ–ĺ–ľ–Ķ–Ĺ—ā–ĺ–ľ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ā–ĺ–Ī–Ľ—é–ī–Ķ–Ĺ–ł–Ķ –≤—č–Ī—Ä–į–Ĺ–Ĺ–ĺ–Ļ —Ā—Ö–Ķ–ľ—č —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–ľ – —ā–ĺ–Ľ—Ć–ļ–ĺ –≤—č—Ā–ĺ–ļ–ł–Ļ —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –ļ –Ľ–Ķ—á–Ķ–Ĺ–ł—é –Ņ–ĺ–∑–≤–ĺ–Ľ–ł—ā –ī–ĺ—Ā—ā–ł—á—Ć –ĺ–∂–ł–ī–į–Ķ–ľ—č—Ö —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤. –í-—ā—Ä–Ķ—ā—Ć–ł—Ö, –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ –Ņ–ĺ–ī–ĺ–Ī—Ä–į—ā—Ć –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā –ī–Ľ—Ź –ļ–į–∂–ī–ĺ–≥–ĺ –ļ–ĺ–Ĺ–ļ—Ä–Ķ—ā–Ĺ–ĺ–≥–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į. –£ –Ĺ–Ķ–ļ–ĺ—ā–ĺ—Ä—č—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ĺ–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į –ĺ–Ņ—ā–ł–ľ–į–Ľ—Ć–Ĺ—č–Ķ –ī–ĺ–∑—č –Ņ–ĺ–Ľ—É—á–į–Ķ–ľ–ĺ–Ļ –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł, —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –Ĺ–į–ī –Ď–ź –ĺ—Ā—ā–į–Ķ—ā—Ā—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ—č–ľ, –ł —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ķ—ā—Ā—Ź –≤—č—Ā–ĺ–ļ–ł–Ļ —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł—Ź. –í –ĺ–Ī—Č–Ķ–Ļ –Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ł —ā–į–ļ–ł–Ķ –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č –≤—Ā—ā—Ä–Ķ—á–į—é—ā—Ā—Ź –≤ 5–10% —Ā–Ľ—É—á–į–Ķ–≤ —Ā—Ä–Ķ–ī–ł –≤—Ā–Ķ—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –į—Ā—ā–ľ–ĺ–Ļ. –í —ć—ā–ĺ–ľ —Ā–Ľ—É—á–į–Ķ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –Ņ—Ä–ĺ–≤–Ķ—Ā—ā–ł —Ą–Ķ–Ĺ–ĺ—ā–ł–Ņ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –į—Ā—ā–ľ—č —Ā —É—á–Ķ—ā–ĺ–ľ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–į –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź, –į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā—ā–į—ā—É—Ā–į –ī–Ľ—Ź –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–ł—Ź –ī–ĺ–Ņ–ĺ–Ľ–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –ł–Ĺ—Ą–ĺ—Ä–ľ–į—Ü–ł–ł –ł –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł –Ņ—Ä–ĺ–≤–ĺ–ī–ł–ľ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź [1].
–°–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł—Ź–ľ GINA (–Ņ–Ķ—Ä–Ķ—Ā–ľ–ĺ—ā—Ä 2011 –≥.), –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –Ī–į–∑–ł—Ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ď–ź –ł—Ā–Ņ–ĺ–Ľ—Ć–∑—É—é—ā —Ā–Ľ–Ķ–ī—É—é—Č–ł–Ķ –≥—Ä—É–Ņ–Ņ—č –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤: –ļ–ĺ—Ä—ā–ł–ļ–ĺ—Ā—ā–Ķ—Ä–ĺ–ł–ī—č (—Ā–ł—Ā—ā–Ķ–ľ–Ĺ—č–Ķ –ł –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ—č–Ķ), –į–Ĺ—ā–ł–Ľ–Ķ–Ļ–ļ–ĺ—ā—Ä–ł–Ķ–Ĺ–ĺ–≤—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č, β2-–į–≥–ĺ–Ĺ–ł—Ā—ā—č –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź, –ļ–ĺ–ľ–Ī–ł–Ĺ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č, —ā–Ķ–ĺ—Ą–ł–Ľ–Ľ–ł–Ĺ—č –Ņ—Ä–ĺ–Ľ–ĺ–Ĺ–≥–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–≥–ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź. –ü—Ä–Ķ–Ņ–į—Ä–į—ā—č –Ņ–Ķ—Ä–≤–ĺ–Ļ –Ņ–ĺ–ľ–ĺ—Č–ł –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—é—ā—Ā—Ź —Ā–ł—ā—É–į—Ü–ł–ĺ–Ĺ–Ĺ–ĺ –ł –Ņ—Ä–Ķ–ī–Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ—č –ī–Ľ—Ź —É—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–ł—Ź –≤–ĺ–∑–Ĺ–ł–ļ—ą–Ķ–≥–ĺ –Ī—Ä–ĺ–Ĺ—Ö–ĺ—Ā–Ņ–į–∑–ľ–į. –ö –Ĺ–ł–ľ –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā—Ā—Ź –ļ–ĺ—Ä–ĺ—ā–ļ–ĺ–ī–Ķ–Ļ—Ā—ā–≤—É—é—Č–ł–Ķ β2-–į–≥–ĺ–Ĺ–ł—Ā—ā—č, –į–Ĺ—ā–ł—Ö–ĺ–Ľ–ł–Ĺ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č, —ā–Ķ–ĺ—Ą–ł–Ľ–Ľ–ł–Ĺ –ļ–ĺ—Ä–ĺ—ā–ļ–ĺ–≥–ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź.
–ü—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–ĺ–ľ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ–ĺ–Ļ —Ą–ĺ—Ä–ľ—č –ī–ĺ—Ā—ā–į–≤–ļ–ł —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ–Ņ–į–ī–į–Ĺ–ł—Ź –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –Ĺ–Ķ–Ņ–ĺ—Ā—Ä–Ķ–ī—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –≤ –ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ –Ņ—É—ā–ł, —á—ā–ĺ –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –ī–ĺ—Ā—ā–ł—á—Ć –Ī–ĺ–Ľ–Ķ–Ķ –≤—č—Ā–ĺ–ļ–ĺ–Ļ –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –≤–Ķ—Č–Ķ—Ā—ā–≤–į –Ĺ–į –Ņ–ĺ–≤–Ķ—Ä—Ö–Ĺ–ĺ—Ā—ā–ł –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤ –ł —É–ľ–Ķ–Ĺ—Ć—ą–į–Ķ—ā —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć —Ä–ł—Ā–ļ–į –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —Ā–ł—Ā—ā–Ķ–ľ–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤. –ė–Ĺ–≥–į–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ—č –≤ –≤–ł–ī–Ķ –ī–ĺ–∑–ł—Ä—É—é—Č–ł—Ö –į—ć—Ä–ĺ–∑–ĺ–Ľ–Ķ–Ļ, –Ņ–ĺ—Ä–ĺ—ą–ļ–ĺ–≤—č—Ö –ł–Ĺ–≥–į–Ľ—Ź—ā–ĺ—Ä–ĺ–≤, —Ä–į—Ā—ā–≤–ĺ—Ä–ĺ–≤ –ī–Ľ—Ź –Ĺ–Ķ–Ī—É–Ľ–į–Ļ–∑–Ķ—Ä–į, –ł–Ĺ–≥–į–Ľ—Ź—ā–ĺ—Ä–ĺ–≤ —ā–ł–Ņ–į «s–ĺftmist» –Ī–Ķ–∑ –Ņ—Ä–ĺ–Ņ–Ķ–Ľ–Ľ–Ķ–Ĺ—ā–ĺ–≤, —Ā–ĺ–∑–ī–į—é—Č–ł—Ö –ľ–Ķ–ī–Ľ–Ķ–Ĺ–Ĺ–ĺ –Ņ–Ķ—Ä–Ķ–ľ–Ķ—Č–į—é—Č–Ķ–Ķ—Ā—Ź –ł –ī–ĺ–Ľ–≥–ĺ —Ā–ĺ—Ö—Ä–į–Ĺ—Ź—é—Č–Ķ–Ķ—Ā—Ź «–ĺ–Ī–Ľ–į—á–ļ–ĺ» –ľ–Ķ–Ľ–ļ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č—Ö —á–į—Ā—ā–ł—Ü. –†–į–∑–Ĺ—č–Ķ –ł–Ĺ–≥–į–Ľ—Ź—ā–ĺ—Ä—č —Ä–į–∑–Ľ–ł—á–į—é—ā—Ā—Ź –Ņ–ĺ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –ī–ĺ—Ā—ā–į–≤–ļ–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —Ā—Ä–Ķ–ī—Ā—ā–≤–į –≤ –Ĺ–ł–∂–Ĺ–ł–Ķ –ĺ—ā–ī–Ķ–Ľ—č –ī—č—Ö–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ—É—ā–Ķ–Ļ. –≠—ā–ĺ –∑–į–≤–ł—Ā–ł—ā –ĺ—ā —ā–ł–Ņ–į –ł–Ĺ–≥–į–Ľ—Ź—ā–ĺ—Ä–į, —Ą–ĺ—Ä–ľ—č –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ —Ā—Ä–Ķ–ī—Ā—ā–≤–į, —Ā–ļ–ĺ—Ä–ĺ—Ā—ā–ł –Ņ–ĺ–ī–į—á–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į, —Ä–į–∑–ľ–Ķ—Ä–ĺ–≤ —á–į—Ā—ā–ł—Ü, —É–ī–ĺ–Ī—Ā—ā–≤–į –ł –Ņ—Ä–ĺ—Ā—ā–ĺ—ā—č –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł—Ź [7].
–í –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ķ –≤—Ä–Ķ–ľ—Ź «–∑–ĺ–Ľ–ĺ—ā—č–ľ —Ā—ā–į–Ĺ–ī–į—Ä—ā–ĺ–ľ» –Ņ–ĺ–ī–ī–Ķ—Ä–∂–ł–≤–į—é—Č–Ķ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ď–ź —Ā—á–ł—ā–į—é—ā –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –≥—Ä—É–Ņ–Ņ—č –ė–ď–ö–°. –ě–Ĺ–ł —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ —Ā–Ĺ–ł–∂–į—é—ā –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –ł –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–≤ –Ď–ź, –Ĺ–ĺ—Ä–ľ–į–Ľ–ł–∑—É—é—ā —Ą—É–Ĺ–ļ—Ü–ł—é –Ľ–Ķ–≥–ļ–ł—Ö –∑–į —Ā—á–Ķ—ā —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł—Ź –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –≥–ł–Ņ–Ķ—Ä—Ä–Ķ–į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –ł –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į –≤ –Ī—Ä–ĺ–Ĺ—Ö–į—Ö, —Ā–Ĺ–ł–∂–į—é—ā —á–į—Ā—ā–ĺ—ā—É –≤–ĺ–∑–ľ–ĺ–∂–Ĺ—č—Ö –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł–Ļ, —É–Ľ—É—á—ą–į—é—ā –ļ–į—á–Ķ—Ā—ā–≤–ĺ –∂–ł–∑–Ĺ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤. –ď–ö–°-—Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä—č –Ĺ–į—Ö–ĺ–ī—Ź—ā—Ā—Ź –≤ —Ü–ł—ā–ĺ–Ņ–Ľ–į–∑–ľ–Ķ –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł –≤—Ā–Ķ—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ –ĺ—Ä–≥–į–Ĺ–ł–∑–ľ–į. –ė–ď–ö–° –ĺ–Ī–Ľ–į–ī–į—é—ā –≤—č—Ā–ĺ–ļ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć—é —Ā—Ä–ĺ–ī—Ā—ā–≤–į –ļ —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–į–ľ, —á—ā–ĺ –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–ł–≤–į–Ķ—ā –≤—č—Ā–ĺ–ļ—É—é –Ņ—Ä–ĺ—ā–ł–≤–ĺ–≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—É—é –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ł –Ĺ–Ķ–Ī–ĺ–Ľ—Ć—ą–ĺ–Ķ —Ā–ł—Ā—ā–Ķ–ľ–Ĺ–ĺ–Ķ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ. –Ę–į–ļ–∂–Ķ –ĺ–Ĺ–ł –ĺ–Ī–Ľ–į–ī–į—é—ā –≤—č—Ā–ĺ–ļ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć—é –Ľ–ł–Ņ–ĺ—Ą–ł–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł, —á—ā–ĺ —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā –Ľ—É—á—ą–Ķ–ľ—É –Ņ—Ä–ĺ–Ĺ–ł–ļ–Ĺ–ĺ–≤–Ķ–Ĺ–ł—é –≤ –ľ–Ķ–ľ–Ī—Ä–į–Ĺ—É –ļ–Ľ–Ķ—ā–ļ–ł. –ě–Ī—ä–Ķ–ľ –Ņ—Ä–ł–Ĺ–ł–ľ–į–Ķ–ľ–ĺ–Ļ –ī–ĺ–∑—č, —Ä–į–∑–ľ–Ķ—Ä –≤–ī—č—Ö–į–Ķ–ľ—č—Ö —á–į—Ā—ā–ł—Ü, –≤–ł–ī –ł–Ĺ–≥–į–Ľ—Ź—ā–ĺ—Ä–į –Ĺ–į–Ņ—Ä—Ź–ľ—É—é –≤–Ľ–ł—Ź—é—ā –Ĺ–į —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –ł –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ—Ä–ł –Ņ–ĺ–ī–Ī–ĺ—Ä–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –Ĺ—É–∂–Ĺ–ĺ —É—á–ł—ā—č–≤–į—ā—Ć –ļ–į–ļ –Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–ĺ—Ā—ā—Ć, —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ł —É–ī–ĺ–Ī—Ā—ā–≤–ĺ –Ķ–≥–ĺ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź, —ā–į–ļ –ł –Ķ–≥–ĺ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –Ĺ–į –≤—Ā–Ķ –ĺ—ā–ī–Ķ–Ľ—č –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–Ķ—Ä–Ķ–≤–į.
–ü–ĺ —Ä–į–∑–ľ–Ķ—Ä–į–ľ —á–į—Ā—ā–ł—Ü –≤—č–ī–Ķ–Ľ—Ź—é—ā –ļ—Ä—É–Ņ–Ĺ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č–Ķ –ł –ľ–Ķ–Ľ–ļ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č–Ķ –į—ć—Ä–ĺ–∑–ĺ–Ľ–ł. –ö—Ä—É–Ņ–Ĺ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č–Ķ –į—ć—Ä–ĺ–∑–ĺ–Ľ–ł, –Ņ–ĺ–Ņ–į–ī–į—Ź –≤ –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ķ –ī–Ķ—Ä–Ķ–≤–ĺ, –ĺ–ļ–į–∑—č–≤–į—é—ā —Ā–≤–ĺ–Ķ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –Ĺ–į —É—Ä–ĺ–≤–Ĺ–Ķ –ļ—Ä—É–Ņ–Ĺ—č—Ö –ł —Ā—Ä–Ķ–ī–Ĺ–ł—Ö –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤. –Ď–ĺ–Ľ—Ć—ą–ĺ–Ļ –Ņ—Ä–ĺ—Ü–Ķ–Ĺ—ā –ľ–Ķ–Ľ–ļ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č—Ö —á–į—Ā—ā–ł—Ü –ī–ĺ—Ā—ā–ł–≥–į–Ķ—ā –ľ–Ķ–Ľ–ļ–ĺ–ļ–į–Ľ–ł–Ī–Ķ—Ä–Ĺ—č—Ö –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤, —Ä–ĺ–Ľ—Ć –ļ–ĺ—ā–ĺ—Ä—č—Ö –≤ —Ä–į–∑–≤–ł—ā–ł–ł –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź –ł —ā–Ķ—á–Ķ–Ĺ–ł—Ź –į—Ā—ā–ľ—č –Ĺ–Ķ–ĺ—Ā–Ņ–ĺ—Ä–ł–ľ–į. –í —ā–ĺ—ā –ľ–ĺ–ľ–Ķ–Ĺ—ā, –ļ–ĺ–≥–ī–į –Ņ—Ä–ĺ—ā–ł–≤–ĺ–≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ —ć—Ą—Ą–Ķ–ļ—ā –ė–ď–ö–° –ĺ–ļ–į–∑—č–≤–į–Ķ—ā –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –Ĺ–į –≤–Ķ—Ä—Ö–Ĺ–ł–Ķ –ł —Ā—Ä–Ķ–ī–Ĺ–ł–Ķ –ĺ—ā–ī–Ķ–Ľ—č –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–Ķ—Ä–Ķ–≤–į, –≤ –ī–ł—Ā—ā–į–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–į—é—ā—Ā—Ź —Ä–į–∑–≤–ł—ā–ł–Ķ –Ņ–Ķ—Ä—Ā–ł—Ā—ā–ł—Ä—É—é—Č–Ķ–≥–ĺ –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į –ł —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –≤–ĺ–∑–ī—É—ą–Ĺ—č—Ö –Ľ–ĺ–≤—É—ą–Ķ–ļ [7, 25, 26].
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, —Ä–į—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ—č–ľ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ —ć–ļ—Ā—ā—Ä–į–ľ–Ķ–Ľ–ļ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č—Ö —á–į—Ā—ā–ł—Ü –ī–Ľ—Ź –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –Ĺ–į –≤—Ā–Ķ—Ö —É—Ä–ĺ–≤–Ĺ—Ź—Ö –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–Ķ—Ä–Ķ–≤–į. –í —ā–į–ļ–ĺ–ľ —Ā–Ľ—É—á–į–Ķ –Ņ—Ä–Ķ–ī–Ņ–ĺ—á—ā–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ —Ä–į–∑–ľ–Ķ—Ä–ĺ–ľ —á–į—Ā—ā–ł—Ü —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź 1–5 –ľ–ļ–ľ –ī–Ľ—Ź –≤–∑—Ä–ĺ—Ā–Ľ—č—Ö –ł 1,1–3 –ľ–ļ–ľ –ī–Ľ—Ź –ī–Ķ—ā–Ķ–Ļ, —á—ā–ĺ —Ā–ī–Ķ–Ľ–į–Ķ—ā —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ —á–į—Ā—ā–ł—Ü –≤ –Ī—Ä–ĺ–Ĺ—Ö–į—Ö –Ĺ–į –≤—Ā–Ķ—Ö —É—Ä–ĺ–≤–Ĺ—Ź—Ö —Ä–į–≤–Ĺ–ĺ–ľ–Ķ—Ä–Ĺ—č–ľ. –≠—Ą—Ą–Ķ–ļ—ā –ĺ—ā –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –∑–į–≤–ł—Ā–ł—ā –ĺ—ā –Ņ—Ä–ĺ—Ü–Ķ–Ĺ—ā–Ĺ–ĺ–≥–ĺ —Ā–ĺ–ī–Ķ—Ä–∂–į–Ĺ–ł—Ź –ī–ĺ—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ—č—Ö –≤ –Ľ–Ķ–≥–ļ–ł–Ķ —á–į—Ā—ā–ł—Ü –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į. –° 1987 –≥. —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ľ–Ķ–∂–ī—É–Ĺ–į—Ä–ĺ–ī–Ĺ–ĺ–ľ—É —Ā–ĺ–≥–Ľ–į—ą–Ķ–Ĺ–ł—é –ĺ —Ā–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–ł–ł –ĺ–∑–ĺ–Ĺ–ĺ–≤–ĺ–≥–ĺ —Ā–Ľ–ĺ—Ź –ó–Ķ–ľ–Ľ–ł –≤—Ā–Ķ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī–ł—ā–Ķ–Ľ–ł –ī–ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö –į—ć—Ä–ĺ–∑–ĺ–Ľ—Ć–Ĺ—č—Ö –ł–Ĺ–≥–į–Ľ—Ź—ā–ĺ—Ä–ĺ–≤ (–Ē–ź–ė) –Ņ–Ķ—Ä–Ķ—ą–Ľ–ł –Ĺ–į –Ī–Ķ—Ā—Ą—Ä–Ķ–ĺ–Ĺ–ĺ–≤—É—é —Ą–ĺ—Ä–ľ—É –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į. –í –ļ–į—á–Ķ—Ā—ā–≤–Ķ –Ĺ–ĺ–≤–ĺ–≥–ĺ –Ņ—Ä–ĺ–Ņ–Ķ–Ľ–Ľ–Ķ–Ĺ—ā–į –ł—Ā–Ņ–ĺ–Ľ—Ć–∑—É–Ķ—ā—Ā—Ź –Ĺ–ĺ—Ä—Ą–Ľ—É—Ä–į–Ĺ (–≥–ł–ī—Ä–ĺ—Ą—ā–ĺ—Ä–į–Ľ–ļ–į–Ĺ (–ď–§–ź) 134–į). –Ě–į —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź—ą–Ĺ–ł–Ļ –ī–Ķ–Ĺ—Ć —ć—ā–ł–ľ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł—Ā—ā–ł–ļ–į–ľ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤—É–Ķ—ā –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī, –ļ–ĺ—ā–ĺ—Ä—č–Ļ —ā–į–ļ–∂–Ķ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī–ł—ā—Ā—Ź –≤ —Ą–ĺ—Ä–ľ–Ķ –Ē–ź–ė, —Ā–ĺ–ī–Ķ—Ä–∂–ł—ā –ď–§–ź, —Ä–į–∑–ľ–Ķ—Ä —á–į—Ā—ā–ł—Ü – 1,1–2,1 –ľ–ļ–ľ (—ć–ļ—Ā—ā—Ä–į–ľ–Ķ–Ľ–ļ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č–Ķ —á–į—Ā—ā–ł—Ü—č) [24–26].
–¶–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī: –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–į
—ć–ļ—Ā—ā—Ä–į–ľ–Ķ–Ľ–ļ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä–Ĺ–ĺ–≥–ĺ –į—ć—Ä–ĺ–∑–ĺ–Ľ—Ź
–¶–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī (–ź–Ľ—Ć–≤–Ķ—Ā–ļ–ĺ®) – –Ĺ–Ķ–≥–į–Ľ–ĺ–≥–Ķ–Ĺ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–Ļ –ė–ď–ö–°, —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ņ—Ä–ĺ–Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–ĺ–ľ, –Ņ–ĺ–ī –ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ —ć—Ā—ā–Ķ—Ä–į–∑ –≤ —ā–ļ–į–Ĺ–ł –Ľ–Ķ–≥–ļ–ł—Ö –Ņ—Ä–Ķ–≤—Ä–į—Č–į–Ķ—ā—Ā—Ź –≤ –į–ļ—ā–ł–≤–Ĺ—É—é —Ą–ĺ—Ä–ľ—É – –ī–Ķ–∑—Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī. –Ē–Ķ–∑—Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī –ł–ľ–Ķ–Ķ—ā –≤ 100 —Ä–į–∑ –Ī–ĺ–Ľ—Ć—ą–Ķ–Ķ —Ā—Ä–ĺ–ī—Ā—ā–≤–ĺ –ļ –≥–Ľ—é–ļ–ĺ–ļ–ĺ—Ä—ā–ł–ļ–ĺ–ł–ī–Ĺ—č–ľ —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–į–ľ, —á–Ķ–ľ —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī. –ě–Ī—Ä–į—ā–ł–ľ–į—Ź –ļ–ĺ–Ĺ—ä—é–≥–į—Ü–ł—Ź –ī–Ķ–∑—Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į —Ā –≤—č—Ā–ĺ–ļ–ĺ–Ľ–ł–Ņ–ĺ—Ą–ł–Ľ—Ć–Ĺ—č–ľ–ł –∂–ł—Ä–Ĺ—č–ľ–ł –ļ–ł—Ā–Ľ–ĺ—ā–į–ľ–ł –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–ł–≤–į–Ķ—ā —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –ī–Ķ–Ņ–ĺ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –≤ –Ľ–Ķ–≥–ĺ—á–Ĺ–ĺ–Ļ —ā–ļ–į–Ĺ–ł –ł –Ņ–ĺ–ī–ī–Ķ—Ä–∂–į–Ĺ–ł–Ķ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–Ļ –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł –Ĺ–į –Ņ—Ä–ĺ—ā—Ź–∂–Ķ–Ĺ–ł–ł 24 —á, —á—ā–ĺ –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—ā—Ć –ź–Ľ—Ć–≤–Ķ—Ā–ļ–ĺ® 1 —Ä./—Ā—É—ā. –ú–ĺ–Ľ–Ķ–ļ—É–Ľ–į –į–ļ—ā–ł–≤–Ĺ–ĺ–≥–ĺ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—ā–į —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É–Ķ—ā—Ā—Ź –≤—č—Ā–ĺ–ļ–ĺ–Ļ –į—Ą—Ą–ł–Ĺ–Ĺ–ĺ—Ā—ā—Ć—é, –Ī—č—Ā—ā—Ä–ĺ–Ļ –į—Ā—Ā–ĺ—Ü–ł–į—Ü–ł–Ķ–Ļ –ł –ľ–Ķ–ī–Ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –ī–ł—Ā—Ā–ĺ—Ü–ł–į—Ü–ł–Ķ–Ļ —Ā –≥–Ľ—é–ļ–ĺ–ļ–ĺ—Ä—ā–ł–ļ–ĺ—Ā—ā–Ķ—Ä–ĺ–ł–ī–Ĺ—č–ľ–ł —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–į–ľ–ł [8, 27].
T.W. de Vries et al. –Ī—č–Ľ–ĺ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ĺ —Ā—Ä–į–≤–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ —Ä–į–∑–Ĺ—č—Ö –ė–ď–ö–° —Ā —Ä–į–∑–Ĺ—č–ľ–ł —Ä–į–∑–ľ–Ķ—Ä–ĺ–ľ —á–į—Ā—ā–ł—Ü –ł –ī–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ–ľ–ĺ–Ļ –ī–ĺ–∑–ĺ–Ļ. –Ē–Ľ—Ź —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–ł —Ą–Ľ—É—ā–ł–ļ–į–∑–ĺ–Ĺ–į –Ņ—Ä–ĺ–Ņ–ł–ĺ–Ĺ–į—ā 125 –ľ–ļ–≥, –Ī—É–ī–Ķ—Ā–ĺ–Ĺ–ł–ī 200 –ľ–ļ–≥, –Ī–Ķ–ļ–Ľ–ĺ–ľ–Ķ—ā–į–∑–ĺ–Ĺ 100 –ľ–ļ–≥ (–Ņ—Ä–ĺ–Ņ–Ķ–Ľ–Ľ–Ķ–Ĺ—ā –ď–§–ź), —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī 160 –ľ–ļ–≥ (–Ņ—Ä–ĺ–Ņ–Ķ–Ľ–Ľ–Ķ–Ĺ—ā –ď–§–ź). –°—Ä–Ķ–ī–Ĺ–ł–Ļ –į—ć—Ä–ĺ–ī–ł–Ĺ–į–ľ–ł—á–Ķ—Ā–ļ–ł–Ļ —Ä–į–∑–ľ–Ķ—Ä —á–į—Ā—ā–ł—Ü –Ī—É–ī–Ķ—Ā–ĺ–Ĺ–ł–ī–į —Ā–ĺ—Ā—ā–į–≤–ł–Ľ 3,5 –ľ–ļ–ľ, —Ą–Ľ—É—ā–ł–ļ–į–∑–ĺ–Ĺ–į –Ņ—Ä–ĺ–Ņ–ł–ĺ–Ĺ–į—ā–į – 2,8 –ľ–ļ–ľ, –Ī–Ķ–ļ–Ľ–ĺ–ľ–Ķ—ā–į–∑–ĺ–Ĺ–į –ł —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į – 1,9 –ľ–ļ–ľ. –í–Ľ–į–∂–Ĺ–ĺ—Ā—ā—Ć –ĺ–ļ—Ä—É–∂–į—é—Č–Ķ–≥–ĺ –≤–ĺ–∑–ī—É—Ö–į –ł —Ā–ļ–ĺ—Ä–ĺ—Ā—ā—Ć –ł–Ĺ—Ā–Ņ–ł—Ä–į—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –Ņ–ĺ—ā–ĺ–ļ–į –Ĺ–Ķ –ĺ–ļ–į–∑—č–≤–į–Ľ–ł –∑–Ĺ–į—á–ł–ľ–ĺ–≥–ĺ –≤–Ľ–ł—Ź–Ĺ–ł—Ź –Ĺ–į —Ä–į–∑–ľ–Ķ—Ä —á–į—Ā—ā–ł—Ü. –¶–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī –ł –Ī–Ķ–ļ–Ľ–ĺ–ľ–Ķ—ā–į–∑–ĺ–Ĺ (–ď–§–ź) –ł–ľ–Ķ–Ľ–ł —Ā–į–ľ—É—é –Ī–ĺ–Ľ—Ć—ą—É—é —Ą—Ä–į–ļ—Ü–ł—é –ľ–Ķ–Ľ–ļ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č—Ö —á–į—Ā—ā–ł—Ü —Ä–į–∑–ľ–Ķ—Ä–ĺ–ľ –ĺ—ā 1,1 –ī–ĺ 3,1 –ľ–ļ–ľ. –¶–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ĺ–Ķ–į–ļ—ā–ł–≤–Ĺ—č–ľ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—ā–ĺ–ľ, –Ķ–≥–ĺ –ĺ—Ä–į–Ľ—Ć–Ĺ–į—Ź –Ī–ł–ĺ–ī–ĺ—Ā—ā—É–Ņ–Ĺ–ĺ—Ā—ā—Ć –Ī–Ľ–ł–∑–ļ–į –ļ –Ĺ—É–Ľ—é, –∑–į —Ā—á–Ķ—ā —ć—ā–ĺ–≥–ĺ —Ā–Ĺ–ł–∂–į–Ķ—ā—Ā—Ź —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –ĺ—Ä–ĺ—Ą–į—Ä–ł–Ĺ–≥–Ķ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ļ–į–Ĺ–ī–ł–ī–ĺ–∑–į [28].
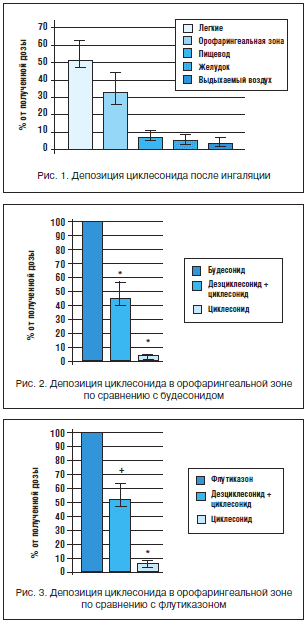
–ú–Ĺ–ĺ–≥–ĺ—á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—č–ľ–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź–ľ–ł –Ī—č–Ľ–ĺ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–Ķ–Ĺ–ĺ, —á—ā–ĺ –Ĺ–į —Ą–ĺ–Ĺ–Ķ –≤—č—Ā–ĺ–ļ–ĺ–Ļ –Ľ–Ķ–≥–ĺ—á–Ĺ–ĺ–Ļ –ī–Ķ–Ņ–ĺ–∑–ł—Ü–ł–ł —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į (–ĺ–ļ–ĺ–Ľ–ĺ 55%) –Ĺ–į–Ī–Ľ—é–ī–į–Ķ—ā—Ā—Ź –Ĺ–ł–∑–ļ–į—Ź –ī–Ķ–Ņ–ĺ–∑–ł—Ü–ł—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ–≥–ĺ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—ā–į –≤ –≤–Ķ—Ä—Ö–Ĺ–Ķ–Ļ –ĺ—Ä–ĺ—Ą–į—Ä–ł–Ĺ–≥–Ķ–į–Ľ—Ć–Ĺ–ĺ–Ļ –∑–ĺ–Ĺ–Ķ – –≤ 2 —Ä–į–∑–į –ľ–Ķ–Ĺ—Ć—ą–Ķ, —á–Ķ–ľ —É –Ī—É–ī–Ķ—Ā–ĺ–Ĺ–ł–ī–į (—Ä–ł—Ā. 1–3).
–ü—Ä–ł –ĺ—Ü–Ķ–Ĺ–ļ–Ķ –ī–Ķ–Ņ–ĺ–∑–ł—Ü–ł–ĺ–Ĺ–Ĺ—č—Ö —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł—Ā—ā–ł–ļ —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į –≤ –Ľ–Ķ–≥–ļ–ł—Ö, –ĺ—Ä–ĺ—Ą–į—Ä–ł–Ĺ–≥–Ķ–į–Ľ—Ć–Ĺ–ĺ–Ļ –∑–ĺ–Ĺ–Ķ, –Ņ–ł—Č–Ķ–≤–ĺ–ī–Ķ, –∂–Ķ–Ľ—É–ī–ļ–Ķ –ł –≤—č–ī—č—Ö–į–Ķ–ľ–ĺ–ľ –≤–ĺ–∑–ī—É—Ö–Ķ –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–į—Ź –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł—Ź –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –Ņ–ĺ—Ā–Ľ–Ķ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ł 320 –ľ–ļ–≥ –Ĺ–į–Ī–Ľ—é–ī–į–Ľ–į—Ā—Ć –≤ –Ľ–Ķ–≥–ĺ—á–Ĺ–ĺ–Ļ —ā–ļ–į–Ĺ–ł [Newman et al., 2004]. –ě—Ü–Ķ–Ĺ–ļ—É –ĺ—Ä–ĺ—Ą–į—Ä–ł–Ĺ–≥–Ķ–į–Ľ—Ć–Ĺ–ĺ–Ļ –ī–Ķ–Ņ–ĺ–∑–ł—Ü–ł–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –Ī—É–ī–Ķ—Ā–ĺ–Ĺ–ł–ī–į, —Ą–Ľ—É—ā–ł–ļ–į–∑–ĺ–Ĺ–į –Ņ—Ä–ĺ–Ņ–ł–ĺ–Ĺ–į—ā–į, —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į –ł –ī–Ķ–∑—Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į –≤ –ī–ĺ–∑–Ķ 800 –ľ–ļ–≥ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ł –≤ —Ö–ĺ–ī–Ķ —Ä–į–Ĺ–ī–ĺ–ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–≥–ĺ –ĺ—ā–ļ—Ä—č—ā–ĺ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ĺ–į 18 –∑–ī–ĺ—Ä–ĺ–≤—č—Ö –≤–ĺ–Ľ–ĺ–Ĺ—ā–Ķ—Ä–į—Ö. –í –Ņ–Ķ—Ä–≤—č–Ļ —á–į—Ā –Ņ–ĺ—Ā–Ľ–Ķ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ł —Ā–į–ľ–į—Ź –Ĺ–ł–∑–ļ–į—Ź –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł—Ź –Ī—č–Ľ–į –∑–į—Ą–ł–ļ—Ā–ł—Ä–ĺ–≤–į–Ĺ–į –Ņ–ĺ—Ā–Ľ–Ķ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ł —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į –ł –Ķ–≥–ĺ –į–ļ—ā–ł–≤–Ĺ–ĺ–≥–ĺ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—ā–į [30].
–¶–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī –ł –Ķ–≥–ĺ –į–ļ—ā–ł–≤–Ĺ—č–Ļ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—ā –ī–Ķ–∑—Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī –Ņ—Ä–ł –Ņ–ĺ–Ņ–į–ī–į–Ĺ–ł–ł –≤ —Ā–ł—Ā—ā–Ķ–ľ–Ĺ—č–Ļ –ļ—Ä–ĺ–≤–ĺ—ā–ĺ–ļ –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł –Ņ–ĺ–Ľ–Ĺ–ĺ—Ā—ā—Ć—é —Ā–≤—Ź–∑—č–≤–į—é—ā—Ā—Ź —Ā –Ī–Ķ–Ľ–ļ–į–ľ–ł –Ņ–Ľ–į–∑–ľ—č –ļ—Ä–ĺ–≤–ł (98–99%). –í –Ņ–Ķ—á–Ķ–Ĺ–ł –ī–Ķ–∑—Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī –ł–Ĺ–į–ļ—ā–ł–≤–ł—Ä—É–Ķ—ā—Ā—Ź —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–ľ CYP3A4 —Ā–ł—Ā—ā–Ķ–ľ—č —Ü–ł—ā–ĺ—Ö—Ä–ĺ–ľ–į P450 –ī–ĺ –≥–ł–ī—Ä–ĺ–ļ—Ā–ł–Ľ–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö –Ĺ–Ķ–į–ļ—ā–ł–≤–Ĺ—č—Ö –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—ā–ĺ–≤. –¶–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī –ł –ī–Ķ–∑—Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī –ł–ľ–Ķ—é—ā —Ā–į–ľ—č–Ļ –Ī—č—Ā—ā—Ä—č–Ļ —Ā—Ä–Ķ–ī–ł –ė–ď–ö–° –ļ–Ľ–ł—Ä–Ķ–Ĺ—Ā (152 –ł 228 –Ľ/—á —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ), –Ķ–≥–ĺ –≤–Ķ–Ľ–ł—á–ł–Ĺ–į —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ—Ä–Ķ–≤—č—ą–į–Ķ—ā —Ā–ļ–ĺ—Ä–ĺ—Ā—ā—Ć –Ņ–Ķ—á–Ķ–Ĺ–ĺ—á–Ĺ–ĺ–≥–ĺ –ļ—Ä–ĺ–≤–ĺ—ā–ĺ–ļ–į –ł –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–ł–≤–į–Ķ—ā –≤—č—Ā–ĺ–ļ–ł–Ļ –Ņ—Ä–ĺ—Ą–ł–Ľ—Ć –Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–ĺ—Ā—ā–ł.
–¶–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī, –ĺ—ā–Ľ–ł—á–į—é—Č–ł–Ļ—Ā—Ź –≤—č—Ā–ĺ–ļ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć—é –Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–ĺ—Ā—ā–ł –ł —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł, –ĺ–Ī–Ľ–į–ī–į–Ķ—ā —Ä—Ź–ī–ĺ–ľ –Ī–Ķ—Ā—Ā–Ņ–ĺ—Ä–Ĺ—č—Ö –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤. –ü—Ä–Ķ–∂–ī–Ķ –≤—Ā–Ķ–≥–ĺ —ć—ā–ĺ —ć–ļ—Ā—ā—Ä–į–ľ–Ķ–Ľ–ļ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č–Ļ —Ä–į–∑–ľ–Ķ—Ä —á–į—Ā—ā–ł—Ü, –≤—č—Ā–ĺ–ļ–į—Ź –Ľ–Ķ–≥–ĺ—á–Ĺ–į—Ź –ī–Ķ–Ņ–ĺ–∑–ł—Ü–ł—Ź —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į –ł –Ņ–ĺ–ī–ī–Ķ—Ä–∂–į–Ĺ–ł–Ķ —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–Ļ –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –Ĺ–į –Ņ—Ä–ĺ—ā—Ź–∂–Ķ–Ĺ–ł–ł 24 —á. –° –ī—Ä—É–≥–ĺ–Ļ —Ā—ā–ĺ—Ä–ĺ–Ĺ—č, —ć—ā–ĺ –Ĺ–ł–∑–ļ–į—Ź –ĺ—Ä–į–Ľ—Ć–Ĺ–į—Ź –Ī–ł–ĺ–ī–ĺ—Ā—ā—É–Ņ–Ĺ–ĺ—Ā—ā—Ć (–∑–į —Ā—á–Ķ—ā —á–Ķ–≥–ĺ —Ā–Ĺ–ł–∂–į–Ķ—ā—Ā—Ź —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –Ņ–ĺ–Ī–ĺ—á–Ĺ—č—Ö —ć—Ą—Ą–Ķ–ļ—ā–ĺ–≤ –≤ —Ä–ĺ—ā–ĺ–≤–ĺ–Ļ –Ņ–ĺ–Ľ–ĺ—Ā—ā–ł), –Ĺ–ł–∑–ļ–ł–Ļ —É—Ä–ĺ–≤–Ķ–Ĺ—Ć —Ā–≤–ĺ–Ī–ĺ–ī–Ĺ–ĺ–Ļ —Ą—Ä–į–ļ—Ü–ł–ł –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į –≤ –Ņ–Ľ–į–∑–ľ–Ķ –ļ—Ä–ĺ–≤–ł –ł –Ī—č—Ā—ā—Ä—č–Ļ –ļ–Ľ–ł—Ä–Ķ–Ĺ—Ā. –Ē–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –Ņ–Ķ—Ä—Ā–ł—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į –≤ —ā–ļ–į–Ĺ—Ź—Ö –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–ł–≤–į–Ķ—ā –Ī–ĺ–Ľ—Ć—ą—É—é –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –Ķ–≥–ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź –ł –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć –ĺ–ī–Ĺ–ĺ–ļ—Ä–į—ā–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –≤ —Ā—É—ā–ļ–ł, —á—ā–ĺ —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ–ĺ–≤—č—ą–į–Ķ—ā –ļ–ĺ–ľ–Ņ–Ľ–į–Ķ–Ĺ—ā–Ĺ–ĺ—Ā—ā—Ć –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –ļ –ī–į–Ĺ–Ĺ–ĺ–ľ—É –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—É [8, 24–26].
–ö–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –Ņ—Ä–ł–ľ–Ķ—Ä –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į
–ü–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –õ., 60 –Ľ–Ķ—ā, –≤ —Ā–Ķ–Ĺ—ā—Ź–Ī—Ä–Ķ 2012 –≥. –ĺ–Ī—Ä–į—ā–ł–Ľ–į—Ā—Ć —Ā –∂–į–Ľ–ĺ–Ī–į–ľ–ł –Ĺ–į –ĺ–ī—č—ą–ļ—É, –Ņ—Ä–ł—Ā—ā—É–Ņ—č —É–ī—É—ą—Ć—Ź, –∑–į—ā—Ä—É–ī–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ķ –ī—č—Ö–į–Ĺ–ł–Ķ, —Ā—É—Ö–ĺ–Ļ –Ņ—Ä–ł—Ā—ā—É–Ņ–ĺ–ĺ–Ī—Ä–į–∑–Ĺ—č–Ļ –ļ–į—ą–Ķ–Ľ—Ć, —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į—é—Č–ł–Ļ—Ā—Ź –ī–ł—Ā—ā–į–Ĺ—ā–Ĺ—č–ľ–ł —Ö—Ä–ł–Ņ–į–ľ–ł. –ö—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, –ĺ–Ĺ–į –Ņ—Ä–Ķ–ī—ä—Ź–≤–Ľ—Ź–Ľ–į –∂–į–Ľ–ĺ–Ī—č –Ĺ–į –∑—É–ī –Ĺ–ĺ—Ā–į –ł –≥–Ľ–į–∑, —á–ł—Ö–į–Ĺ–ł–Ķ, —Ä–ł–Ĺ–ĺ—Ä–Ķ—é, –∑–į–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ĺ–ĺ—Ā–į –≤ –Ľ–Ķ—ā–Ĺ–ł–Ļ –Ņ–Ķ—Ä–ł–ĺ–ī (–ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–į –ł –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–Ķ–Ĺ–į —Ā–Ķ–Ĺ—Ā–ł–Ī–ł–Ľ–ł–∑–į—Ü–ł—Ź –ļ –Ņ—č–Ľ—Ć—Ü–Ķ —Ā–ĺ—Ä–Ĺ—č—Ö —ā—Ä–į–≤). –ü–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –Ņ–ĺ—Ā—ā–ĺ—Ź–Ĺ–Ĺ–ĺ –Ņ—Ä–ĺ–∂–ł–≤–į–Ķ—ā –≤ –°—ā–į–≤—Ä–ĺ–Ņ–ĺ–Ľ—Ć—Ā–ļ–ĺ–ľ –ļ—Ä–į–Ķ, —Ä–į–Ī–ĺ—ā–į–Ķ—ā –ľ–į—Ā—Ā–į–∂–ł—Ā—ā–ĺ–ľ, –Ĺ–ł–ļ–ĺ–≥–ī–į –Ĺ–Ķ –ļ—É—Ä–ł–Ľ–į. –°–ł–ľ–Ņ—ā–ĺ–ľ—č —Ä–ł–Ĺ–ĺ–ļ–ĺ–Ĺ—ä—é–Ĺ–ļ—ā–ł–≤–ł—ā–į –ĺ—ā–ľ–Ķ—á–į–Ķ—ā —Ā –ī–Ķ—ā—Ā—ā–≤–į. –í –≤–ĺ–∑—Ä–į—Ā—ā–Ķ 20 –Ľ–Ķ—ā –ĺ–Ī—Ä–į—Č–į–Ľ–į—Ā—Ć –∑–į –ļ–ĺ–Ĺ—Ā—É–Ľ—Ć—ā–į—Ü–ł–Ķ–Ļ –ļ –į–Ľ–Ľ–Ķ—Ä–≥–ĺ–Ľ–ĺ–≥—É. –ü—Ä–ł—Ā—ā—É–Ņ—č —É–ī—É—ą—Ć—Ź –≤ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–Ķ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –Ĺ–Ķ –ĺ—ā–ľ–Ķ—á–į–Ľ–į, —Ö–ĺ—ā—Ź –Ņ—Ä–ł–Ĺ–ł–ľ–į–Ľ–į –į–Ĺ—ā–ł–≥–ł—Ā—ā–į–ľ–ł–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –ł —Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ —Ā–ł—ā—É–į—Ü–ł–ĺ–Ĺ–Ĺ–ĺ –Ņ—Ä–ł –ĺ—Č—É—Č–Ķ–Ĺ–ł–ł –∑–į—ā—Ä—É–ī–Ĺ–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ī—č—Ö–į–Ĺ–ł—Ź (–Ĺ–Ķ —á–į—Č–Ķ 1 —Ä./–ľ–Ķ—Ā.), —á–į—Č–Ķ –≤ –Ľ–Ķ—ā–Ĺ–Ķ–Ķ –≤—Ä–Ķ–ľ—Ź (–ī–ĺ 1 —Ä–į–∑–į –Ķ–∂–Ķ–Ĺ–Ķ–ī–Ķ–Ľ—Ć–Ĺ–ĺ), –Ď–ź –Ĺ–Ķ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–į, –Ņ—Ä–ĺ—ā–ł–≤–ĺ–į—Ā—ā–ľ–į—ā–ł—á–Ķ—Ā–ļ—É—é —ā–Ķ—Ä–į–Ņ–ł—é —Ä–į–Ĺ–Ķ–Ķ –Ĺ–Ķ –Ņ–ĺ–Ľ—É—á–į–Ľ–į. –ė–∑ –į–Ĺ–į–ľ–Ĺ–Ķ–∑–į –≤—č—Ź—Ā–Ĺ–Ķ–Ĺ–ĺ, —á—ā–ĺ —Ā–ł–ľ–Ņ—ā–ĺ–ľ—č —Ä–ł–Ĺ–ĺ–ļ–ĺ–Ĺ—ä—é–Ĺ–ļ—ā–ł–≤–ł—ā–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –ĺ—ā–ľ–Ķ—á–į–Ķ—ā –≤ –į–≤–≥—É—Ā—ā–Ķ, —Ā–Ķ–Ĺ—ā—Ź–Ī—Ä–Ķ. –ź–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ –Ņ—Ä–ł –ļ–ĺ–Ĺ—ā–į–ļ—ā–Ķ —Ā –Ņ—č–Ľ—Ć—é, —ą–Ķ—Ä—Ā—ā—Ć—é –∂–ł–≤–ĺ—ā–Ĺ—č—Ö –Ĺ–Ķ—ā. –ź–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł –Ĺ–į –≤–į–ļ—Ü–ł–Ĺ—č, –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā—č, –Ņ–ł—Č–Ķ–≤—č–Ķ –Ņ—Ä–ĺ–ī—É–ļ—ā—č –ĺ—ā—Ä–ł—Ü–į–Ķ—ā. –ü–Ķ—Ä–ł–ĺ–ī–ł—á–Ķ—Ā–ļ–ł –Ņ—Ä–ł —Ą–ł–∑–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ĺ–į–≥—Ä—É–∑–ļ–Ķ (–Ņ–ĺ–ī—ä–Ķ–ľ –Ņ–ĺ –Ľ–Ķ—Ā—ā–Ĺ–ł—Ü–Ķ –Ĺ–į 3-–Ļ —ć—ā–į–∂) –≤–ĺ–∑–Ĺ–ł–ļ–į—é—ā –ĺ–ī—č—ą–ļ–į –ł –∑–į—ā—Ä—É–ī–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ķ –ī—č—Ö–į–Ĺ–ł–Ķ. –°–Ķ–ľ–Ķ–Ļ–Ĺ—č–Ļ –į–Ĺ–į–ľ–Ĺ–Ķ–∑ –Ĺ–Ķ –ĺ—ā—Ź–≥–ĺ—Č–Ķ–Ĺ. –£ —Ā—č–Ĺ–į –ĺ—ā–ľ–Ķ—á–į—é—ā—Ā—Ź —Ā–ł–ľ–Ņ—ā–ĺ–ľ—č –Ņ–ĺ–Ľ–Ľ–ł–Ĺ–ĺ–∑–į, –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ĺ–Ķ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ĺ—Ā—Ć. –ė–∑ —Ā–ĺ–Ņ—É—ā—Ā—ā–≤—É—é—Č–Ķ–Ļ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł: —Ā–į—Ö–į—Ä–Ĺ—č–Ļ –ī–ł–į–Ī–Ķ—ā 2-–≥–ĺ —ā–ł–Ņ–į, –Ņ–ĺ –Ņ–ĺ–≤–ĺ–ī—É –ļ–ĺ—ā–ĺ—Ä–ĺ–≥–ĺ —Ā–ĺ–Ī–Ľ—é–ī–į–Ķ—ā –ī–ł–Ķ—ā—É –≤ —Ä–į–ľ–ļ–į—Ö —Ā—ā–ĺ–Ľ–į ‚ĄĖ 9, —Ą–į—Ä–ľ–į–ļ–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ĺ–į –ľ–ĺ–ľ–Ķ–Ĺ—ā –ĺ—Ā–ľ–ĺ—ā—Ä–į –Ĺ–Ķ—ā. –ė–Ĺ–ī–Ķ–ļ—Ā –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į = 26 –ļ–≥/–ľ2.
–ě–ļ–ĺ–Ľ–ĺ –≥–ĺ–ī–į –Ĺ–į–∑–į–ī —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–ł —É—á–į—Ā—ā–ł–Ľ–ł—Ā—Ć –Ņ—Ä–ł—Ā—ā—É–Ņ—č —Ā—É—Ö–ĺ–≥–ĺ –ļ–į—ą–Ľ—Ź, –ĺ–ī—č—ą–ļ–ł, –≤–ĺ–∑—Ä–ĺ—Ā–Ľ–į –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā—Ć –≤ —Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ–Ķ –ī–ĺ 0–1 —Ä./–Ĺ–Ķ–ī. –≤ –ī–Ĺ–Ķ–≤–Ĺ–ĺ–Ķ –≤—Ä–Ķ–ľ—Ź. –í –Ĺ–į—á–į–Ľ–Ķ –į–≤–≥—É—Ā—ā–į 2012 –≥. –Ĺ–į—á–į–Ľ–ĺ—Ā—Ć –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł–Ķ, —Ä–į–∑–≤–ł–Ľ–ł—Ā—Ć —Ā–ł–ľ–Ņ—ā–ĺ–ľ—č —Ä–ł–Ĺ–ĺ–ļ–ĺ–Ĺ—ä—é–Ĺ–ļ—ā–ł–≤–ł—ā–į, –≤–Ņ–Ķ—Ä–≤—č–Ķ –Ņ–ĺ—Ź–≤–ł–Ľ–ł—Ā—Ć –Ņ—Ä–ł—Ā—ā—É–Ņ—č —É–ī—É—ą—Ć—Ź. –ü–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –ĺ–Ī—Ä–į—ā–ł–Ľ–į—Ā—Ć –ļ –≤—Ä–į—á—É –Ņ–ĺ –ľ–Ķ—Ā—ā—É –∂–ł—ā–Ķ–Ľ—Ć—Ā—ā–≤–į. –°–ĺ —Ā–Ľ–ĺ–≤ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–ł –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ —Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ, –ī–Ķ–ļ—Ā–į–ľ–Ķ—ā–į–∑–ĺ–Ĺ 4 –ľ–≥ –≤/–≤ –ļ–į–Ņ–Ķ–Ľ—Ć–Ĺ–ĺ –ī–≤–į–∂–ī—č, –į–Ĺ—ā–ł–≥–ł—Ā—ā–į–ľ–ł–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č —Ā–ł—ā—É–į—Ü–ł–ĺ–Ĺ–Ĺ–ĺ. –ü–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –ĺ—ā–ľ–Ķ—á–į–Ľ–į —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ, –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ĺ–Ķ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ĺ—Ā—Ć, –Ī–į–∑–ł—Ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ĺ –Ĺ–Ķ –Ī—č–Ľ–ĺ. –°–ĺ 2––Ļ –Ņ–ĺ–Ľ–ĺ–≤–ł–Ĺ—č –į–≤–≥—É—Ā—ā–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –ĺ—ā–ľ–Ķ—á–į–Ľ–į –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ–ĺ–Ķ —É—Ö—É–ī—ą–Ķ–Ĺ–ł–Ķ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź, –Ĺ–į—Ä–į—Ā—ā–į–Ĺ–ł–Ķ –ĺ–ī—č—ą–ļ–ł, —á–į—Ā—ā—č–Ķ —ć–Ņ–ł–∑–ĺ–ī—č —Ā—É—Ö–ĺ–≥–ĺ –Ņ—Ä–ł—Ā—ā—É–Ņ–ĺ–ĺ–Ī—Ä–į–∑–Ĺ–ĺ–≥–ĺ –ļ–į—ą–Ľ—Ź, —á–į—Ā—ā—č–Ķ –Ņ—Ä–ł—Ā—ā—É–Ņ—č —É–ī—É—ą—Ć—Ź –≤ –ī–Ĺ–Ķ–≤–Ĺ–ĺ–Ķ –ł –Ĺ–ĺ—á–Ĺ–ĺ–Ķ –≤—Ä–Ķ–ľ—Ź. –ü–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā—Ć –≤ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł—Ź—Ö —Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ–į –≤–ĺ–∑—Ä–ĺ—Ā–Ľ–į –ī–ĺ 2–3 —Ä./—Ā—É—ā.
–Ě–į –ľ–ĺ–ľ–Ķ–Ĺ—ā –ĺ—Ā–ľ–ĺ—ā—Ä–į —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł–Ķ —É–ī–ĺ–≤–Ľ–Ķ—ā–≤–ĺ—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ, —Ā–ĺ–∑–Ĺ–į–Ĺ–ł–Ķ —Ź—Ā–Ĺ–ĺ–Ķ, –Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ –į–ļ—ā–ł–≤–Ĺ–ĺ–Ķ, –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ –≤–ĺ–∑–Ī—É–∂–ī–Ķ–Ĺ–į. –ö–ĺ–∂–Ĺ—č–Ķ –Ņ–ĺ–ļ—Ä–ĺ–≤—č –Ī–Ľ–Ķ–ī–Ĺ–ĺ-—Ä–ĺ–∑–ĺ–≤–ĺ–≥–ĺ —Ü–≤–Ķ—ā–į, —á–ł—Ā—ā—č–Ķ. –Ě–ĺ—Ā–ĺ–≤–ĺ–Ķ –ī—č—Ö–į–Ĺ–ł–Ķ –∑–į—ā—Ä—É–ī–Ĺ–Ķ–Ĺ–ĺ —Ā –ĺ–Ī–Ķ–ł—Ö —Ā—ā–ĺ—Ä–ĺ–Ĺ, –ĺ–ī—č—ą–ļ–į (–ß–Ē–Ē –ī–ĺ 23/–ľ–ł–Ĺ). –ü—Ä–ł –į—É—Ā–ļ—É–Ľ—Ć—ā–į—Ü–ł–ł –ī—č—Ö–į–Ĺ–ł–Ķ –≤–Ķ–∑–ł–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ–Ķ, –ĺ—Ā–Ľ–į–Ī–Ľ–Ķ–Ĺ–ĺ –≤ –Ĺ–ł–∂–Ĺ–ł—Ö –ĺ—ā–ī–Ķ–Ľ–į—Ö, –Ņ—Ä–ĺ—Ā–Ľ—É—ą–ł–≤–į—é—ā—Ā—Ź —Ā—É—Ö–ł–Ķ —Ä–į–∑–Ĺ–ĺ–ļ–į–Ľ–ł–Ī–Ķ—Ä–Ĺ—č–Ķ —Ö—Ä–ł–Ņ—č –Ņ–ĺ –≤—Ā–Ķ–ľ –Ľ–Ķ–≥–ĺ—á–Ĺ—č–ľ –Ņ–ĺ–Ľ—Ź–ľ. –Ę–ĺ–Ĺ—č —Ā–Ķ—Ä–ī—Ü–į —Ź—Ā–Ĺ—č–Ķ, —Ä–ł—ā–ľ–ł—á–Ĺ—č–Ķ, –ź–Ē 125/80 –ľ–ľ —Ä—ā. —Ā—ā. –Ė–ł–≤–ĺ—ā –ľ—Ź–≥–ļ–ł–Ļ, –Ī–Ķ–∑–Ī–ĺ–Ľ–Ķ–∑–Ĺ–Ķ–Ĺ–Ĺ—č–Ļ –Ņ—Ä–ł –Ņ–į–Ľ—Ć–Ņ–į—Ü–ł–ł. –ü—Ä–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł —Ą—É–Ĺ–ļ—Ü–ł–ł –≤–Ĺ–Ķ—ą–Ĺ–Ķ–≥–ĺ –ī—č—Ö–į–Ĺ–ł—Ź –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ –Ľ–Ķ–≥–ĺ—á–Ĺ–ĺ–Ļ –≤–Ķ–Ĺ—ā–ł–Ľ—Ź—Ü–ł–ł 1 —Ā—ā. –Ņ–ĺ –ĺ–Ī—Ā—ā—Ä—É–ļ—ā–ł–≤–Ĺ–ĺ–ľ—É —ā–ł–Ņ—É, —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ú–°–≠–ü –≤ –Ņ–Ķ—Ä–ł—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł—Ö –ĺ—ā–ī–Ķ–Ľ–į—Ö, –ĺ—ā–≤–Ķ—ā–į –Ĺ–į –ö–Ē–Ď–ź –Ĺ–Ķ—ā – –Ņ—Ä–ł—Ä–ĺ—Ā—ā –ě–§–í1 –Ņ–ĺ—Ā–Ľ–Ķ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ł —Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ–į 400 –ľ–ļ–≥ —Ā–ĺ—Ā—ā–į–≤–ł–Ľ 11%: –Ė–ē–õ – 3,03 –Ľ, –ě–§–í1 – 2,10 –Ľ, –ł–Ĺ–ī–Ķ–ļ—Ā –Ę–ł—Ą—Ą–Ĺ–ĺ – 69,34%, –ú–ě–°75 – 3,94 –Ľ/—Ā, –ú–ě–°50 – 1,89 –Ľ/—Ā, –ú–ě–°25 – 0,27 –Ľ/—Ā. –ü–ĺ—Ā–Ľ–Ķ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ł —Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ–ĺ–ľ: –Ė–ē–õ – 3,04 –Ľ, –ě–§–í1 – 2,31 –Ľ, –ł–Ĺ–ī–Ķ–ļ—Ā –Ę–ł—Ą—Ą–Ĺ–ĺ – 76,03%, –ú–ě–°75 – 4,69 –Ľ/—Ā, –ú–ě–°50 – 2,92 –Ľ/—Ā, –ú–ě–°25 – 0,56 –Ľ/—Ā.
–ü–į—Ü–ł–Ķ–Ĺ—ā–ļ–Ķ –Ņ–ĺ—Ā—ā–į–≤–Ľ–Ķ–Ĺ –ī–ł–į–≥–Ĺ–ĺ–∑: –Ď–ź, –į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–į—Ź —Ą–ĺ—Ä–ľ–į, —Ā—Ä–Ķ–ī–Ĺ–Ķ—ā—Ź–∂–Ķ–Ľ–ĺ–Ķ –Ĺ–Ķ–ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ–ł—Ä—É–Ķ–ľ–ĺ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ. –ź–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ļ —Ä–ł–Ĺ–ł—ā, –ļ–ĺ–Ĺ—ä—é–Ĺ–ļ—ā–ł–≤–ł—ā, –Ņ–Ķ—Ä—Ā–ł—Ā—ā–ł—Ä—É—é—Č–Ķ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ, –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł–Ķ. –°–Ķ–Ĺ—Ā–ł–Ī–ł–Ľ–ł–∑–į—Ü–ł—Ź –ļ –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ—É –Ņ—č–Ľ—Ć—Ü—č —Ā–ĺ—Ä–Ĺ—č—Ö —ā—Ä–į–≤. –Ē–Ľ—Ź –ļ—É–Ņ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ 3-–ī–Ĺ–Ķ–≤–Ĺ—č–Ļ –ļ—É—Ä—Ā –ď–ö–° —Ā–ł—Ā—ā–Ķ–ľ–Ĺ–ĺ–≥–ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź. –í –ļ–į—á–Ķ—Ā—ā–≤–Ķ –Ī–į–∑–ł—Ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī (–ź–Ľ—Ć–≤–Ķ—Ā–ļ–ĺ) 160 –ľ–ļ–≥ –Ņ–ĺ 1 –ī–ĺ–∑–Ķ 2 —Ä./—Ā—É—ā, –ö–Ē–Ď–ź (—Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ, —Ą–Ķ–Ĺ–ĺ—ā–Ķ—Ä–ĺ–Ľ) –Ņ–ĺ 2 –ī–ĺ–∑—č –Ņ–Ķ—Ä–Ķ–ī –ź–Ľ—Ć–≤–Ķ—Ā–ļ–ĺ –ł –Ņ–ĺ –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā–ł, —Ā—É–ľ–ľ–į—Ä–Ĺ–ĺ –Ĺ–Ķ –Ī–ĺ–Ľ–Ķ–Ķ 8 –ī–ĺ–∑/—Ā—É—ā, –į–Ĺ—ā–ł–≥–ł—Ā—ā–į–ľ–ł–Ĺ–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č, –ł–Ĺ—ā—Ä–į–Ĺ–į–∑–į–Ľ—Ć–Ĺ—č–Ķ —Ā—ā–Ķ—Ä–ĺ–ł–ī—č, –ľ—É–ļ–ĺ–Ľ–ł—ā–ł–ļ–ł. –í –ļ–į—á–Ķ—Ā—ā–≤–Ķ –Ņ–Ľ–į–Ĺ–ĺ–≤–ĺ–≥–ĺ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ĺ: –į–Ĺ–į–Ľ–ł–∑ –ļ—Ä–ĺ–≤–ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ, —Ä–Ķ–Ĺ—ā–≥–Ķ–Ĺ–ĺ–≥—Ä–į—Ą–ł—Ź –ĺ—Ä–≥–į–Ĺ–ĺ–≤ –≥—Ä—É–ī–Ĺ–ĺ–Ļ –ļ–Ľ–Ķ—ā–ļ–ł, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ķ—Ā–ļ–ł—Ö IgE, —Ā–Ņ–ł—Ä–ĺ–ľ–Ķ—ā—Ä–ł—Ź —á–Ķ—Ä–Ķ–∑ 3 –ī–Ĺ—Ź.
–ü—Ä–ł –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –≤ –į–Ĺ–į–Ľ–ł–∑–Ķ –ļ—Ä–ĺ–≤–ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł –∑–Ĺ–į—á–ł–ľ—č—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –Ĺ–Ķ –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ. –Ě–į —Ä–Ķ–Ĺ—ā–≥–Ķ–Ĺ–ĺ–≥—Ä–į—Ą–ł–ł –ĺ—Ä–≥–į–Ĺ–ĺ–≤ –≥—Ä—É–ī–Ĺ–ĺ–Ļ –ļ–Ľ–Ķ—ā–ļ–ł –Ľ–Ķ–≥–ĺ—á–Ĺ—č–Ķ –Ņ–ĺ–Ľ—Ź –Ī–Ķ–∑ —Ā–≤–Ķ–∂–ł—Ö –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö —ā–Ķ–Ĺ–Ķ–Ļ. –õ–Ķ–≥–ĺ—á–Ĺ–ĺ–Ļ —Ä–ł—Ā—É–Ĺ–ĺ–ļ —É—Ā–ł–Ľ–Ķ–Ĺ –≤ –Ņ—Ä–ł–ļ–ĺ—Ä–Ĺ–Ķ–≤—č—Ö –∑–ĺ–Ĺ–į—Ö –∑–į —Ā—á–Ķ—ā —Ā–ĺ—Ā—É–ī–ł—Ā—ā–ĺ–≥–ĺ –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–į, –ļ–ĺ—Ä–Ĺ–ł —ā—Ź–∂–ł—Ā—ā—č–Ķ –≤–ĺ –≤—Ā–Ķ—Ö –ĺ—ā–ī–Ķ–Ľ–į—Ö, –ī–ł—Ą—Ą—É–∑–Ĺ–ĺ –ī–ł—Ą—Ą–Ķ—Ä–Ķ–Ĺ—Ü–ł—Ä—É—é—ā—Ā—Ź. –ź–ĺ—Ä—ā–į –Ĺ–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–į, —ā–Ķ–Ĺ—Ć —Ā–Ķ—Ä–ī—Ü–į –Ĺ–Ķ–∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ä–į—Ā—ą–ł—Ä–Ķ–Ĺ–į –≤–Ľ–Ķ–≤–ĺ.
–Ě–į 3-–Ļ –ī–Ķ–Ĺ—Ć –ĺ—ā –Ĺ–į—á–į–Ľ–į –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –ĺ—ā–ľ–Ķ—á–į–Ľ–į –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ —Ā–į–ľ–ĺ—á—É–≤—Ā—ā–≤–ł—Ź –Ĺ–į —Ą–ĺ–Ĺ–Ķ –Ņ–ĺ–Ľ—É—á–į–Ķ–ľ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł, –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā—Ć –≤ —Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ–Ķ —Ā–ĺ–ļ—Ä–į—ā–ł–Ľ–į—Ā—Ć –ī–ĺ 0–1 —Ä./—Ā—É—ā –≤ –ī–Ĺ–Ķ–≤–Ĺ–ĺ–Ķ –≤—Ä–Ķ–ľ—Ź, —É–Ľ—É—á—ą–ł–Ľ–ĺ—Ā—Ć –Ĺ–ĺ—Ā–ĺ–≤–ĺ–Ķ –ī—č—Ö–į–Ĺ–ł–Ķ, –ĺ–ī—č—ą–ļ–ł, —Ā—É—Ö–ĺ–≥–ĺ –ļ–į—ą–Ľ—Ź –ł –ī–ł—Ā—ā–į–Ĺ—ā–Ĺ—č—Ö —Ö—Ä–ł–Ņ–ĺ–≤ –Ĺ–Ķ—ā. –ü—Ä–ł –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ–ĺ–ľ –Ņ—Ä–ł–Ķ–ľ–Ķ –Ĺ–į 7-–Ļ –ī–Ķ–Ĺ—Ć –ĺ—ā –Ĺ–į—á–į–Ľ–į —ā–Ķ—Ä–į–Ņ–ł–ł –į—É—Ā–ļ—É–Ľ—Ć—ā–į—ā–ł–≤–Ĺ–ĺ –ī—č—Ö–į–Ĺ–ł–Ķ –≤–Ķ–∑–ł–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ–Ķ, –Ņ—Ä–ĺ–≤–ĺ–ī–ł—ā—Ā—Ź –≤–ĺ –≤—Ā–Ķ –ĺ—ā–ī–Ķ–Ľ—č, —Ö—Ä–ł–Ņ–ĺ–≤ –Ĺ–Ķ—ā, –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā–ł –≤ –ö–Ē–Ď–ź –Ĺ–Ķ—ā. –ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ –§–í–Ē: –Ė–ē–õ – 2,68 –Ľ, –ě–§–í1 – 2,26 –Ľ, –ł–Ĺ–ī–Ķ–ļ—Ā –Ę–ł—Ą—Ą–Ĺ–ĺ – 80,03%, –ú–ě–°75 – 5,28 –Ľ/—Ā, –ú–ě–°50 – 3,60 –Ľ/—Ā, –ú–ě–°25 – 1,30 –Ľ/—Ā. –ü–ĺ—Ā–Ľ–Ķ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ł —Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ–į 400 –ľ–ļ–≥: –Ė–ē–õ – 2,72 –Ľ, –ě–§–í1 – 2,28 –Ľ, –ł–Ĺ–ī–Ķ–ļ—Ā –Ę–ł—Ą—Ą–Ĺ–ĺ – 86,7%, –ú–ě–°75 – 5,35 –Ľ/—Ā, –ú–ě–°50 – 3,71 –Ľ/—Ā, –ú–ě–°25 – 1,4 –Ľ/—Ā.
–ü–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –Ĺ–į—Ö–ĺ–ī–ł–Ľ–į—Ā—Ć –Ĺ–į –Ī–į–∑–ł—Ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–ĺ–ľ 160 –ľ–ļ–≥ 2 —Ä./—Ā—É—ā, –ö–Ē–Ď–õ –Ņ–ĺ –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā–ł, –ł–Ĺ—ā—Ä–į–Ĺ–į–∑–į–Ľ—Ć–Ĺ—č–Ķ —Ā—ā–Ķ—Ä–ĺ–ł–ī—č –≤ –Ņ–Ľ–į–Ĺ–ĺ–≤–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 3-—Ö –ľ–Ķ—Ā. –ó–į—ā–Ķ–ľ –ĺ–Ī—ä–Ķ–ľ –Ī–į–∑–ł—Ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ī—č–Ľ —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ –ī–ĺ 1 –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ł —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į –≤ —Ā—É—ā–ļ–ł. –ü–ĺ—Ā–ļ–ĺ–Ľ—Ć–ļ—É —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ľ—Ā—Ź –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć –Ď–ź (–Ĺ–Ķ –Ī—č–Ľ–ĺ —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–≤ –Ď–ź, –Ĺ–Ķ –≤–ĺ–∑–Ĺ–ł–ļ–į–Ľ–į –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā—Ć –≤ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł—Ź—Ö —Ā–į–Ľ—Ć–Ī—É—ā–į–ľ–ĺ–Ľ–į, –ü–°–í —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ľ–į—Ā—Ć –Ĺ–į —Ā—ā–į–Ī–ł–Ľ—Ć–Ĺ–ĺ –≤—č—Ā–ĺ–ļ–ĺ–ľ —É—Ä–ĺ–≤–Ĺ–Ķ), –į —ā–į–ļ–∂–Ķ –ĺ—ā—Ā—É—ā—Ā—ā–≤–ĺ–≤–į–Ľ –ļ–ĺ–Ĺ—ā–į–ļ—ā —Ā –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–ĺ–ľ (–≤–Ĺ–Ķ —Ā–Ķ–∑–ĺ–Ĺ–į —Ü–≤–Ķ—ā–Ķ–Ĺ–ł—Ź —Ā–ĺ—Ä–Ĺ—č—Ö —ā—Ä–į–≤), –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ—É –≤ –ľ–į—Ä—ā–Ķ 2013 –≥. –Ņ–Ķ—Ä–Ķ–≤–Ķ–Ľ–ł –Ĺ–į –Ņ—Ä–ł–Ķ–ľ –ö–Ē–Ď–ź –Ņ–ĺ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā–ł, –Ņ–ĺ–Ľ–Ĺ–ĺ—Ā—ā—Ć—é –ł—Ā–ļ–Ľ—é—á–ł–≤ –Ī–į–∑–ł—Ā–Ĺ—É—é —ā–Ķ—Ä–į–Ņ–ł—é. –Ē–ĺ –ł—é–Ľ—Ź 2013 –≥. —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ľ—Ā—Ź –Ņ–ĺ–Ľ–Ĺ—č–Ļ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć –Ď–ź, –Ĺ–ĺ —É—á–ł—ā—č–≤–į—Ź –Ĺ–į—Ā—ā—É–Ņ–Ľ–Ķ–Ĺ–ł–Ķ —Ā–Ķ–∑–ĺ–Ĺ–į –Ņ—č–Ľ–Ķ–Ĺ–ł—Ź —Ā–ĺ—Ä–Ĺ—č—Ö —ā—Ä–į–≤ –≤ –°—ā–į–≤—Ä–ĺ–Ņ–ĺ–Ľ—Ć—Ā–ļ–ĺ–ľ –ļ—Ä–į–Ķ, –Ņ—Ä–ł–Ķ–ľ —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī–į –Ī—č–Ľ –≤–ĺ–∑–ĺ–Ī–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ –≤ –ī–ĺ–∑–Ķ 160 –ľ–ļ–≥/—Ā—É—ā. –Ę–į–ļ–∂–Ķ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–ĺ–≤–į–Ĺ–ĺ –≤–ĺ–∑–ĺ–Ī–Ĺ–ĺ–≤–ł—ā—Ć –Ņ–Ľ–į–Ĺ–ĺ–≤—č–Ļ –Ņ—Ä–ł–Ķ–ľ –ł–Ĺ—ā—Ä–į–Ĺ–į–∑–į–Ľ—Ć–Ĺ—č—Ö –ď–ö–°.
–Ď–Ľ–į–≥–ĺ–ī–į—Ä—Ź –Ņ–ĺ–ī–ĺ–Ī—Ä–į–Ĺ–Ĺ–ĺ–Ļ —ā–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ –Ī–į–∑–ł—Ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–į —Ā–Ķ–∑–ĺ–Ĺ —Ü–≤–Ķ—ā–Ķ–Ĺ–ł—Ź —Ā–ĺ—Ä–Ĺ—č—Ö —ā—Ä–į–≤ 2013 –≥. –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā–Ľ–į —Ö–ĺ—Ä–ĺ—ą–ĺ, –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł—Ź –Ď–ź –Ĺ–Ķ –Ī—č–Ľ–ĺ, –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā–ł –≤ –ö–Ē–Ď–õ –Ĺ–Ķ –≤–ĺ–∑–Ĺ–ł–ļ–į–Ľ–ĺ. –ó–į ~3 –ľ–Ķ—Ā. —Ü–≤–Ķ—ā–Ķ–Ĺ–ł—Ź —Ā–ĺ—Ä–Ĺ—č—Ö —ā—Ä–į–≤ –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ —Ä–į–∑ –≤–ĺ–∑–Ĺ–ł–ļ–į–Ľ–į –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā—Ć –≤ –į–Ĺ—ā–ł–≥–ł—Ā—ā–į–ľ–ł–Ĺ–Ĺ—č—Ö —Ā—Ä–Ķ–ī—Ā—ā–≤–į—Ö –≤ —Ā–≤—Ź–∑–ł —Ā —Ä–į–∑–≤–ł—ā–ł–Ķ–ľ –≥–Ľ–į–∑–Ĺ—č—Ö —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–≤.
–£—á–ł—ā—č–≤–į—Ź —Ā—ā–į–Ī–ł–Ľ—Ć–Ĺ—č–Ļ —ć—Ą—Ą–Ķ–ļ—ā –ĺ—ā –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź, –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ļ–į –≤ –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ķ –≤—Ä–Ķ–ľ—Ź —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į–Ķ—ā—Ā—Ź –ļ–į–ļ –ļ–į–Ĺ–ī–ł–ī–į—ā –Ĺ–į –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ –ź–°–ė–Ę –Ņ—Ä–ł—á–ł–Ĺ–Ĺ–ĺ-–∑–Ĺ–į—á–ł–ľ—č–ľ–ł –į–Ľ–Ľ–Ķ—Ä–≥–Ķ–Ĺ–į–ľ–ł, –Ĺ–į—á–į—ā—Ć –ļ–ĺ—ā–ĺ—Ä—É—é –Ņ–Ľ–į–Ĺ–ł—Ä—É–Ķ—ā—Ā—Ź –≤ –Ĺ–ĺ—Ź–Ī—Ä–Ķ – –ī–Ķ–ļ–į–Ī—Ä–Ķ 2013 –≥. –Ņ—Ä–ł –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–ł –Ņ—Ä–ĺ—ā–ł–≤–ĺ–Ņ–ĺ–ļ–į–∑–į–Ĺ–ł–Ļ.
–ó–į–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ķ
–Ď–ź —ā—Ä–Ķ–Ī—É–Ķ—ā –Ņ—Ä–ł—Ā—ā–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –≤–Ĺ–ł–ľ–į–Ĺ–ł—Ź –ł —ā—Č–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ł–Ĺ–ī–ł–≤–ł–ī—É–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ–ĺ–ī—Ö–ĺ–ī–į –ļ –Ņ–ĺ–ī–Ī–ĺ—Ä—É —ā–Ķ—Ä–į–Ņ–ł–ł. –ē–∂–Ķ–≥–ĺ–ī–Ĺ–ĺ —Ā–ĺ–≤–Ķ—Ä—ą–Ķ–Ĺ—Ā—ā–≤—É—é—ā—Ā—Ź –ľ–Ķ—ā–ĺ–ī—č –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł –ł –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł —Ą–į—Ä–ľ–į–ļ–ĺ—ā–Ķ—Ä–į–Ņ–ł–ł. –Ě–į—Ä—Ź–ī—É —Ā —ć—ā–ł–ľ, –ĺ—Ā–Ĺ–ĺ–≤—č–≤–į—Ź—Ā—Ć –Ĺ–į –Ĺ–ĺ–≤—č—Ö –∑–Ĺ–į–Ĺ–ł—Ź—Ö, –ľ–Ķ–Ĺ—Ź–Ķ—ā—Ā—Ź –Ņ–ĺ–ī—Ö–ĺ–ī –ļ –≤—č–Ī–ĺ—Ä—É –Ņ—Ä–ĺ—ā–ł–≤–ĺ–į—Ā—ā–ľ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –ł —ā–į–ļ—ā–ł–ļ–ł –≤–Ķ–ī–Ķ–Ĺ–ł—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤. –ü—Ä–ł –Ď–ź –≤ –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā –≤–ĺ–≤–Ľ–Ķ–ļ–į—é—ā—Ā—Ź –≤—Ā–Ķ –ĺ—ā–ī–Ķ–Ľ—č –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–Ķ—Ä–Ķ–≤–į, –Ņ–ĺ—ć—ā–ĺ–ľ—É –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ —ā–į–ļ–ĺ–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ, –ļ–ĺ—ā–ĺ—Ä–ĺ–Ķ –Ņ—Ä–ł–≤–Ķ–ī–Ķ—ā –ļ –≤–ĺ—Ā—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ł—é –≤ —ā.—á. –ī–ł—Ā—ā–į–Ľ—Ć–Ĺ—č—Ö –ĺ—ā–ī–Ķ–Ľ–ĺ–≤ –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤. –≠—ā–ł–ľ —ā—Ä–Ķ–Ī–ĺ–≤–į–Ĺ–ł—Ź–ľ –ĺ—ā–≤–Ķ—á–į–Ķ—ā —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č–Ļ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ—č–Ļ –≥–Ľ—é–ļ–ĺ–ļ–ĺ—Ä—ā–ł–ļ–ĺ—Ā—ā–Ķ—Ä–ĺ–ł–ī —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī (–ź–Ľ—Ć–≤–Ķ—Ā–ļ–ĺ). –ě–Ĺ –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—é –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź –Ĺ–į –≤—Ā–Ķ—Ö —É—Ä–ĺ–≤–Ĺ—Ź—Ö –Ī—Ä–ĺ–Ĺ—Ö–ĺ–≤, –Ĺ–ĺ –ł –ĺ—ā–≤–Ķ—á–į–Ķ—ā —ā—Ä–Ķ–Ī–ĺ–≤–į–Ĺ–ł—Ź–ľ —É–ī–ĺ–Ī—Ā—ā–≤–į –ł –Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–ĺ—Ā—ā–ł —É –ī–Ķ—ā–Ķ–Ļ –ł –≤–∑—Ä–ĺ—Ā–Ľ—č—Ö, –Ņ—Ä–Ķ–ī—ä—Ź–≤–Ľ—Ź–Ķ–ľ—č–ľ –ļ —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č–ľ –Ņ—Ä–ĺ—ā–ł–≤–ĺ–į—Ā—ā–ľ–į—ā–ł—á–Ķ—Ā–ļ–ł–ľ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ.
–õ–ł—ā–Ķ—Ä–į—ā—É—Ä–į
1. Cezmi A. Akdis, Ioana Agache. Global Atlas of asthma // European Academy of Allergy and Clinical Immunology. 2013
2. –ź–Ľ–Ľ–Ķ—Ä–≥–ĺ–Ľ–ĺ–≥–ł—Ź –ł –ł–ľ–ľ—É–Ĺ–ĺ–Ľ–ĺ–≥–ł—Ź. –Ě–į—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ķ —Ä—É–ļ–ĺ–≤–ĺ–ī—Ā—ā–≤–ĺ / –Ņ–ĺ–ī —Ä–Ķ–ī. –į–ļ–į–ī. –†–ź–Ě –ł –†–ź–ú–Ě –†.–ú. –•–į–ł—ā–ĺ–≤–į, –Ņ—Ä–ĺ—Ą. –Ě.–ė. –ė–Ľ—Ć–ł–Ĺ–ĺ–Ļ. –ú.: –ď–≠–ě–Ę–ź–†-–ú–Ķ–ī–ł–į, 2009. 649 —Ā.
3. –Ě–į—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–į—Ź –Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ–į «–Ď—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–į—Ź –į—Ā—ā–ľ–į —É –ī–Ķ—ā–Ķ–Ļ. –°—ā—Ä–į—ā–Ķ–≥–ł—Ź –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –ł –Ņ—Ä–ĺ—Ą–ł–Ľ–į–ļ—ā–ł–ļ–į». –†–ĺ—Ā—Ā–ł–Ļ—Ā–ļ–ĺ–Ķ —Ä–Ķ—Ā–Ņ–ł—Ä–į—ā–ĺ—Ä–Ĺ–ĺ–Ķ –ĺ–Ī—Č–Ķ—Ā—ā–≤–ĺ. –ú., 2008.
4. –í–ĺ–Ľ–ļ–ĺ–≤ –í.–Ę., –°—ā—Ä–Ķ–Ľ–ł—Ā –ź.–ö. –Ď—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–į—Ź –į—Ā—ā–ľ–į. –ú–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–į—Ź –ļ–ĺ–Ĺ—Ü–Ķ–Ņ—Ü–ł—Ź, –Ĺ–ĺ–≤–ĺ–Ķ –≤ –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑–Ķ –ł –Ľ–Ķ—á–Ķ–Ĺ–ł–ł. –Ę–ĺ–ľ—Ā–ļ: –°–ł–Ī. –ľ–Ķ–ī.—É–Ĺ-—ā, 1996. 586 —Ā.
5. –ö—É—Ä–Ī–į—á–Ķ–≤–į –ě.–ú. –Ď—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–į—Ź –į—Ā—ā–ľ–į. –ß—ā–ĺ –ľ–ĺ–∂–Ĺ–ĺ —Ā–ī–Ķ–Ľ–į—ā—Ć –ī–Ľ—Ź –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź // –ü—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–į—Ź –ľ–Ķ–ī–ł—Ü–ł–Ĺ–į. 2012. 09. ‚ĄĖ 6 (61) .
6. Global Initiative for Asthma (GINA Report). Global Strategy for Asthma Management and Prevention. Update 2011.
7. –ö—É—Ä–Ī–į—á–Ķ–≤–į –ě.–ú., –ü–į–≤–Ľ–ĺ–≤–į –ö.–°. –§–Ķ–Ĺ–ĺ—ā–ł–Ņ—č –ł —ć–Ĺ–ī–ĺ—ā–ł–Ņ—č –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ—č: –ĺ—ā –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑–į –ł –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ—č –ī–ĺ –≤—č–Ī–ĺ—Ä–į —ā–Ķ—Ä–į–Ņ–ł–ł // –†–ź–Ė. 2013. ‚ĄĖ 1. –°. 15–21.
8. –§—Ä–Ķ–Ļ–ī–ł–Ĺ –ú.–Ď., –ü—É–∑—č—Ä–Ķ–≤ –í.–ü., –ě–≥–ĺ—Ä–ĺ–ī–ĺ–≤–į –õ.–ú., –ö–ĺ–Ī—Ź–ļ–ĺ–≤–į –ě.–°., –ö—É–Ľ–ľ–į–Ĺ–į–ļ–ĺ–≤–į –ė.–ú. –ü–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ –≥–Ķ–Ĺ–ĺ–≤ –ł–Ĺ—ā–Ķ—Ä–Ľ–Ķ–Ļ–ļ–ł–Ĺ–ĺ–≤ –ł –ł—Ö —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–≤: –Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ–į—Ź —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –ł —Ā–≤—Ź–∑—Ć —Ā –į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ–ĺ–Ļ // –ď–Ķ–Ĺ–Ķ—ā–ł–ļ–į. 2002. –Ę. 38. ‚ĄĖ 12. –°. 1710–1718.
9. –Ē–Ķ–Ľ—Ź–≥–ł–Ĺ –í.–ú., –ź—Ä–į–ļ—á–Ķ–Ķ–≤–į –ē.–ē., –£—Ä–į–∑–Ī–į–≥–į–ľ–Ī–Ķ—ā–ĺ–≤ –ź., –Ď—É–ī—á–į–Ĺ–ĺ–≤ –ģ.–ė. –ď–Ķ–Ĺ–Ķ—ā–ł–ļ–į –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ—č –ł –į—ā–ĺ–Ņ–ł–ł // –ú–Ķ–ī–ł—Ü–ł–Ĺ—Ā–ļ–ł–Ļ —Ā–ĺ–≤–Ķ—ā. 2012. ‚ĄĖ 5. –°. 33–39.
10. Denham S., Koppelman G, Blakey J. et al. Meta-analysis of genome-wide linkage studies of asthma and related traits // Respir. Research. 2008. Vol. 9. ‚ĄĖ 1. –†. 1–38.
11. –§—Ä–Ķ–Ļ–ī–ł–Ĺ –ú.–Ď., –ě–≥–ĺ—Ä–ĺ–ī–ĺ–≤–į –õ.–ú., –ü—É–∑—č—Ä–Ķ–≤ –í.–ü. –í–ļ–Ľ–į–ī –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ–į –≥–Ķ–Ĺ–ĺ–≤ –ł–Ĺ—ā–Ķ—Ä–Ľ–Ķ–Ļ–ļ–ł–Ĺ–ĺ–≤ –≤ –ł–∑–ľ–Ķ–Ĺ—á–ł–≤–ĺ—Ā—ā—Ć –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ —Ä–ł—Ā–ļ–į –į—ā–ĺ–Ņ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ—č // –ú–Ķ–ī. –≥–Ķ–Ĺ–Ķ—ā–ł–ļ–į. 2003. –Ę. 2. ‚ĄĖ 3. –°. 130–135.
12. Mitsuyasu H., Izuhara K., Mao X.-Q. et al. Ile50Val variants or IL4Ra upregulatesIgE synthesis and associates with atopic asthma // Nat. genet. 1998. Vol. 19. –†. 119–120.
13. Wechsler M., Lehman E., Lazarus S. et al. National Heart, Lung and Blood Institute's Asthma Clinical Research Network. beta-Adrenergic receptor polymorphisms and response to salmeterol // American Journal Respir. Crit. Care Medicine. 2006. Vol. 173. –†. 519–526.
14. Weaver C., Hatton R., Mangan P., Harrington L. IL-17 family cytokines and the expanding diversity of effector T cell lineages // Annual Review Immunology. 2007. Vol. 25. P. 821–852.
15. Van Eerdewegh P., Little R., Dupuis J. et al. Association of the ADAM33 gene with asthma and bronchial hyperresponsiveness // Nature. 2002. Vol. 418. P. 426–430.
16. –°–į—Ä–ī–į—Ä—Ź–Ĺ –ė.–°. –§–Ķ–Ĺ–ĺ—ā–ł–Ņ–ł—á–Ķ—Ā–ļ–ł–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ—č —É –ī–Ķ—ā–Ķ–Ļ –Ņ—Ä–ł —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö –į–Ľ–Ľ–Ķ–Ľ—Ć–Ĺ—č—Ö –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ–į—Ö –≥–Ķ–Ĺ–ĺ–≤ «–Ņ—Ä–Ķ–ī—Ä–į—Ā–Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł» (GST–Ę1, GST–ú1, ACE, eNOS): –ź–≤—ā–ĺ—Ä–Ķ—Ą. –ī–ł—Ā—Ā. ... –ļ–į–Ĺ–ī. –ľ–Ķ–ī. –Ĺ–į—É–ļ. –°–ü–Ī., 2009. 22 —Ā.
17. Dehzad N., Bopp T., Reuter S., Klein M., Martin H., Ulges A. et al. Regulatory T cells more effectively suppress Th1-induced airway inflammation compared with Th2 // J Immunol. 2011. Vol. 186. P. 238–244.
18. Wang F., He X.Y., Baines K.J., Gunawardhana L.P., Simpson J.L., Li F. et al. Different inflammatory phenotypes in adults and children with acute asthma // EurRespir J. 2011. Vol. 38. P. 567–574.
19. Drews A.C., Pizzichini M.M., Pizzichini E., Pereira M.U., Pitrez P.M., Jones M.H. et al. Neutrophilic airway inflammation is a main feature of induced sputum in nonatopic asthmatic children // Allergy. 2009. Vol. 64. P. 1597–1601.
20. Douwes J., Gibson P., Pekkanen J., Pearce N. Non-eosinophilic asthma: importance and possible mechanisms // Thorax. 2002. Vol. 57. P. 643–648.
21. Ronmark E., Andersson C., Nystrom L., Forsberg B., Jarvholm B., Lundback B. Obesityincreases the risk of incident asthma among adults // EurRespir J. 2005. Vol. 25. P. 282–288.
22. Shaaban R., Zureik M., Soussan D., Neukirch C., Heinrich J., Sunyer J. et al. Rhinitis and onset of asthma: a longitudinal population-based study // Lancet. 2008. Vol. 372. –†. 1049–1057.
23. –ź—Ä—Ö–ł–Ņ–ĺ–≤ –í.–í., –ź—Ä—Ö–ł–Ņ–ĺ–≤–į –Ē.–ē. –ü—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ķ –≥–Ľ—é–ļ–ĺ–ļ–ĺ—Ä—ā–ł–ļ–ĺ—Ā—ā–Ķ—Ä–ĺ–ł–ī–ĺ–≤ –≤ –≤–ł–ī–Ķ –ľ–Ķ–Ľ–ļ–ĺ–ī–ł—Ā–Ņ–Ķ—Ä—Ā–Ĺ—č—Ö –į—ć—Ä–ĺ–∑–ĺ–Ľ–Ķ–Ļ: –≤ —Ą–ĺ–ļ—É—Ā–Ķ —Ü–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī // –≠—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–į—Ź —Ą–į—Ä–ľ–į–ļ–ĺ—ā–Ķ—Ä–į–Ņ–ł—Ź. 2012. ‚ĄĖ 2.
24. –Ě–Ķ–Ĺ–į—ą–Ķ–≤–į –Ě.–ú. –¶–ł–ļ–Ľ–Ķ—Ā–ĺ–Ĺ–ł–ī (–ź–Ľ—Ć–≤–Ķ—Ā–ļ–ĺ) – –Ĺ–ĺ–≤—č–Ļ –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ—č–Ļ –≥–Ľ—é–ļ–ĺ–ļ–ĺ—Ä—ā–ł–ļ–ĺ—Ā—ā–Ķ—Ä–ĺ–ł–ī –ī–Ľ—Ź –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –Ī—Ä–ĺ–Ĺ—Ö–ł–į–Ľ—Ć–Ĺ–ĺ–Ļ –į—Ā—ā–ľ—č // –≠—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–į—Ź —Ą–į—Ä–ľ–į–ļ–ĺ—ā–Ķ—Ä–į–Ņ–ł—Ź. 2012. ‚ĄĖ 2. –†–Ķ–Ņ—Ä–ł–Ĺ—ā.
25. –ö—É—Ä–Ī–į—á–Ķ–≤–į –ě.–ú., –ü–į–≤–Ľ–ĺ–≤–į –ö.–°. –í–ĺ–Ņ—Ä–ĺ—Ā—č –Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–ĺ—Ā—ā–ł –ł–Ĺ–≥–į–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ—č—Ö –≥–Ľ—é–ļ–ĺ–ļ–ĺ—Ä—ā–ł–ļ–ĺ—Ā—ā–Ķ—Ä–ĺ–ł–ī–ĺ–≤ //–ź—Ā—ā–ľ–į –ł –į–Ľ–Ľ–Ķ—Ä–≥–ł—Ź. 2012. ‚ĄĖ 2 (61).
26. De Vries T.W., Rottier B.L., Gjaltema D. et al. Comparative in vitro evaluation of four corticosteroid metered dose inhalers: Consistency of delivered dose and particle size distribution // Resp Med. 2009. Vol. 103. ‚ĄĖ 8. P. 1167–1173.
27. Bateman E.D., Linnhof A.E., Homik L. et al. Comparison of twice-dailyinhaled ciclesonide and fluticasone propionate in patients withmoderate-to-severe persistent asthma // PulmPharmacol Ther. 2008. Vol. 21. ‚ĄĖ 2. –†. 264–275.
28. –ź–Ľ–Ľ–Ķ—Ä–≥–ĺ–Ľ–ĺ–≥–ł—Ź –ł –ł–ľ–ľ—É–Ĺ–ĺ–Ľ–ĺ–≥–ł—Ź. –Ě–į—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ķ —Ä—É–ļ–ĺ–≤–ĺ–ī—Ā—ā–≤–ĺ. –ú.: –ď–≠–ě–Ę–ź–†-–ú–Ķ–ī–ł–į, 2009. 649 —Ā.
29. Dahl R. // Ther Clin Risk Manag. 2006. 03.Vol. 2(1). –†. 25–38.











