Введение
Хроническая обструктивная болезнь легких (ХОБЛ) и бронхиальная астма (БА) — хронические заболевания, широко распространенные в общей популяции. В настоящее время продолжаются научные исследования, посвященные изучению взаимосвязи этих двух заболеваний [1–3]. Эозинофильное и нейтрофильное воспаление рассматриваются в качестве центрального звена патогенеза и клинических особенностей БА и ХОБЛ [4]. Одни авторы предполагают, что тяжесть течения БА связана с преобладанием эозинофильного воспаления, другие рассматривают роль нейтрофилов в формировании тяжелого течения заболевания, что может быть ассоциировано со снижением чувствительности к противовоспалительным эффектам глюкокортикостероидов. Вместе с тем в рекомендациях Глобальной Инициативы для хронической обструктивной болезни легких (Global Initiative for Chronic Obstructive Lung Disease, GOLD) 2019 г. [5] обсуждается роль эозинофилов в формировании воспаления при ХОБЛ и рассматриваются новые подходы к ведению больных, основанные на уровне эозинофилов в периферической крови и частоте обострений [6].
В настоящее время доказано, что избыток протеиназ в легочной ткани, а также инициация окислительного стресса являются ведущими механизмами формирования воспаления при ХОБЛ. Роль нейтрофилов в потенцировании оксидативного стресса и регуляции воспаления связана, в частности, с таким ферментом, как миелопероксидаза (МПО) [7, 8]. МПО участвует в элиминации микроорганизмов, персистирующих в нейтрофилах и моноцитах, в формировании высокореактивных прооксидантов в пределах фагосомы [9–11] и играет важную роль в обеспечении эффективности клеточного ответа [12–13].
В настоящее время широко обсуждается вопрос о том, что хроническое воспаление дыхательных путей и инициация оксидативного стресса играют главенствующую роль в патогенезе бронхообструктивных заболеваний [14]. Большой интерес вызывает изучение системного воспаления с целью выявления возможных биомаркеров. Так, в докладе, опубликованном Европейским агентством по лекарственным средствам, отмечается, что биомаркеры занимают важное место в разработке современных лекарственных средств и переходе лечения от старого принципа «один размер для всех» к новому — «специфичный препарат в правильной дозе для определенного состояния» [15].
Настоящее исследование является продолжением нашей работы, опубликованной ранее [16]. В доступной литературе нет достаточных данных о роли МПО в формировании воспаления и оксидативного стресса при сочетании БА и ХОБЛ у одного человека, что и послужило поводом к дальнейшему продолжению исследования.
Цель исследования
Изучение показателей системного воспаления в периферической крови и местного воспаления в дыхательных путях и выявление их возможных взаимосвязей с клинико-функциональными параметрами у больных БА в сочетании с ХОБЛ.
Задачи
Изучить содержание провоспалительных (ИЛ-1β, ИЛ-8) и противовоспалительного (ИЛ-10) цитокинов, МПО, С-реактивного белка (СРБ) в периферической крови у больных БА, ХОБЛ, а также при их сочетании.
Выявить специфику клеточного состава индуцированной мокроты у больных БА, ХОБЛ и БА в сочетании с ХОБЛ.
Оценить содержание оксида азота (NO) в выдыхаемом воздухе при БА, ХОБЛ, а также при их сочетании.
Выявить возможные взаимосвязи между клинико-функциональными параметрами и показателями системного воспаления, а также исследовать ассоциацию уровня NO и параметров клеточного профиля индуцированной мокроты.
Материал и методы исследования
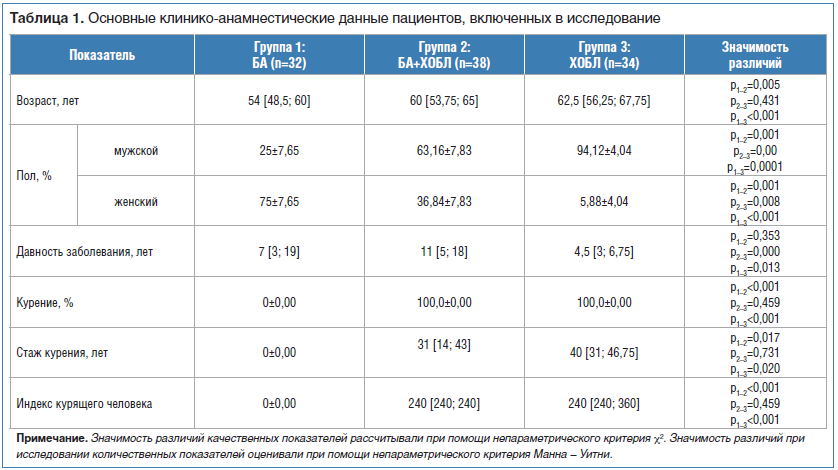
В настоящее исследование включены 144 человека: 1-ю группу составили больные с БА аллергического генеза тяжелого течения (n=32); во 2-ю группу вошли больные с сочетанием БА и ХОБЛ (n=38); 3-ю группу составили больные ХОБЛ тяжелого течения, соответствующего критериям GOLD 3 (n=34); в контрольную группу (n=40) вошли практически здоровые добровольцы со средним возрастом 48 [41; 58] лет.
Основные клинико-анамнестические данные пациентов трех групп представлены в таблице 1.
Критерии включения
Пациенты обоих полов в возрасте от 40 до 75 лет; отсутствие острых респираторных заболеваний в течение предыдущего месяца; объем форсированного выдоха за 1-ю секунду (ОФВ1) до применения бронходилататора ≥30% и <80% от должного значения; письменное информированное согласие на участие в исследовании.
Критерии невключения
Наличие в анамнезе хронических заболеваний легких, кроме астмы и ХОБЛ, сахарного диабета 1 типа, неконтролируемого сахарного диабета 2 типа, гастроэзофагеальной рефлюксной болезни, инфаркта миокарда в течение предшествующих 12 мес., злокачественных новообразований, тяжелой почечной и печеночной недостаточности, злоупотребления алкоголем, курения (у больных БА), а также беременные и кормящие грудью женщины.
Для постановки диагноза сочетания БА и ХОБЛ у пациента должны были присутствовать два главных критерия или один главный и два малых критерия. Главные критерии: значимое увеличение ОФВ1 >400 мл и >15% (подтверждение обратимой бронхиальной обструкции), эозинофилия мокроты или ранее диагностированная БА. Малые критерии: повышение сывороточного иммуноглобулина Е (IgE), атопия в анамнезе, прирост
ОФВ1 >200 мл и >12% в двух измерениях и более [17,18].
Исследование функции внешнего дыхания (ФВД) проводили на базе отделения функциональной диагностики КГБУЗ «Краевая клиническая больница». Оценка параметров ФВД проводилась при помощи спирографии с регистрацией показателя «поток-объем» на аппарате общей плетизмографии (Erich Jaeger, Германия) c компьютерной спирометрией в соответствии с критериями Американского торакального и Европейского респираторного обществ до и после ингаляции бронхолитического препарата (сальбутамола) [19].
Индуцированную мокроту получали путем последовательной ингаляции 3, 4 и 5% гипертонического раствора хлорида натрия через ультразвуковой небулайзер (OMRON NE-U-17, Япония) сеансами по 5 мин под контролем ФВД с последующим подсчетом не менее 400 клеток в 100 полях зрения. Индуцированную мокроту оценивали по общепринятой методике не позднее 2 ч после ее выделения. Полученное количество клеток выражали в процентах. На основании полученных результатов определяли 4 клеточных фенотипа: 1) эозинофильный (≥3% эозинофилов); 2) нейтрофильный (≥61% нейтрофилов); 3) смешанный (≥3% эозинофилов, ≥61% нейтрофилов); 4) малогранулоцитарный (эозинофилов <3%, нейтрофилов <61%) [16].
Определение NO в выдыхаемом воздухе проводилось с помощью аппарата NО Breаth (ppb).
Определение в плазме периферической крови интерлейкинов ИЛ-1β, ИЛ-10, ИЛ-8 и МПО выполнено на базе иммунологической лаборатории КГБУЗ «Краевая клиническая больница». Их содержание в плазме крови определялось методом иммуноферментного анализа на полуавтоматическом иммуноферментном анализаторе Multiskan Fc (Termo Fisher Scientific, Финляндия) с использованием коммерческого набора Cloud-Clone Corp. (№ SES134Hu).
Уровень СРБ в плазме крови исследовали с помощью метода кинетики фиксированного времени путем фотометрического измерения реакции антиген-антитело между антителами к человеческому СРБ, иммобилизованными на полистироловых частицах.
Статистическая обработка результатов
Результаты обработаны с помощью пакета прикладных программ Statistica 7.0 for Windows. Количественные значения представлены в виде медианы (Ме) и интерквартильного интервала (Q1 и Q3), где Q1 — 25-й процентиль, Q3 — 75-й процентиль. Качественные переменные описаны абсолютными значениями и в виде процентных долей и их стандартных ошибок. При сравнительном анализе групп по количественным признакам использовали непараметрический U-критерий Манна — Уитни (не зафиксировано нормальное распределение выборок, определяемое по методу Колмогорова — Смирнова и критерию Шапиро — Уилка). Для оценки связи признаков применен корреляционный анализ с расчетом корреляции по методу Спирмена. Различия считались статистически значимыми при р<0,05.
Результаты и их обсуждение
Основные клинико-функциональные показатели больных БА, ХОБЛ и БА в сочетании с ХОБЛ были изучены и опубликованы нами ранее [14]. Согласно полученным данным в группе больных БА в сочетании с ХОБЛ регистрировалось наибольшее количество ночных и дневных симптомов, а также наибольшая частота использования короткодействующих β2-агонистов в течение суток. Данные медицинской документации показали, что пациенты этой группы имели более частые обострения и госпитализации в стационар в течение года.
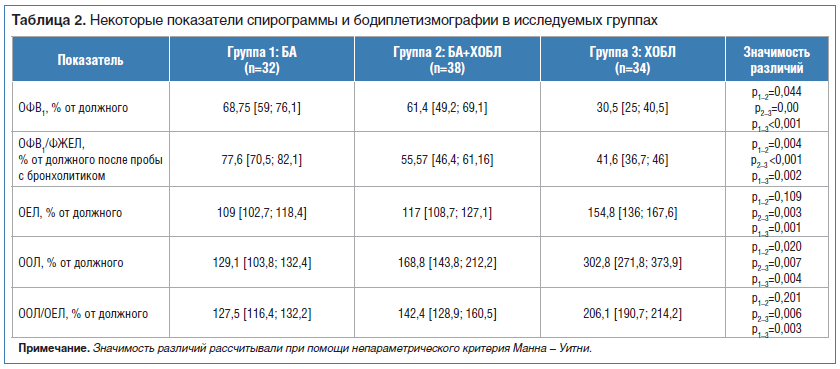
По результатам спирометрии во всех группах регистрировались нарушения бронхиальной проходимости, более тяжелые изменения зарегистрированы у больных ХОБЛ (табл. 2). При анализе показателей бодиплетизмографии отмечено увеличение общей емкости легких (ОЕЛ), остаточного объема легких (ООЛ) и отношения ООЛ/ОЕЛ во всех группах по сравнению с референсными значениями. Наиболее значимые отклонения прослеживаются у больных ХОБЛ (см. табл. 2).
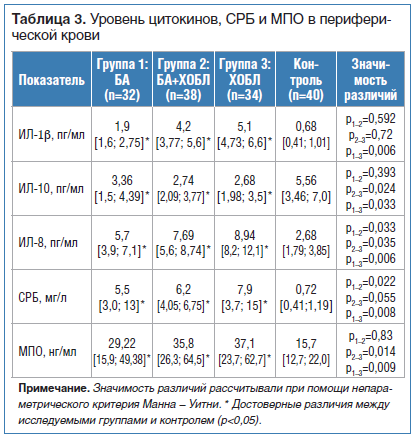
Во всех группах наблюдалось увеличение содержания ИЛ-8, ИЛ-1β, МПО, СРБ в плазме крови (табл. 3). Необходимо отметить, что уровень ИЛ-8 был значимо выше в группах больных БА в сочетании с ХОБЛ и при изолированной ХОБЛ в сравнении с показателями больных БА (р<0,05). В группе больных с тяжелым течением ХОБЛ регистрировалась наиболее высокая концентрация ИЛ-1β, в то время как уровень противовоспалительного цитокина ИЛ-10 был ниже, чем в других группах.
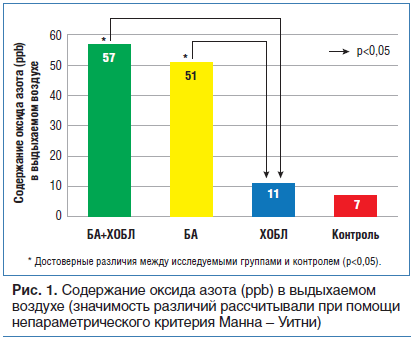
В настоящее время продолжает активно изучаться содержание уровня NO в выдыхаемом воздухе при различных обструктивных заболеваниях легких. Уровень NO в выдыхаемом воздухе был сравнительно выше при сочетанной патологии (р=0,001) и при изолированной тяжелой БА по сравнению с показателями при тяжелой ХОБЛ (р<0,003) (рис.1).
Одним из наиболее важных диагностических методов, используемых в клинике легочных заболеваний, является исследование мокроты. В настоящее время большую распространенность получило исследование индуцированной мокроты [20, 21].
При оценке клеточного состава индуцированной мокроты в группе больных тяжелой аллергической БА в 52% случаев регистрировался эозинофильный биофенотип воспаления, у 13% — малогранулоцитарный, в 27% и 7% случаев — смешанный и нейтрофильный. При ХОБЛ в 65% случаев регистрировался нейтрофильный биофенотип, в 35% — малогранулоцитарный. При сочетанной патологии в большем проценте случаев (51%) встречался смешанный (эозинофильно-нейтрофильный) биофенотип воспаления. В 29% случаев наблюдался малогранулоцитарный, у 11% пациентов регистрировался эозинофильный и у 9% — нейтрофильный биофенотип воспаления.
Результаты проведенного корреляционного анализа свидетельствуют о взаимосвязи клинико-функциональных параметров и показателей про- и противовоспалительных цитокинов. В группе больных БА в сочетании с ХОБЛ выявлена положительная корреляционная связь между содержанием СРБ в плазме крови и частотой госпитализаций (r=0,55; p=0,025), между концентрацией ИЛ-8 и количеством обострений (r=0,735; p=0,004); между уровнем ИЛ-8 в крови и содержанием нейтрофилов в индуцированной мокроте (r=0,8; р<0,001). Кроме того, отмечена взаимосвязь между маркерами системного воспаления и показателями ФВД. Так, показана отрицательная корреляционная связь между ОФВ1 и содержанием ИЛ-8 в крови (r=-0,6; р=0,030); уровнем СРБ и ФЖЕЛ (r=-0,9; р=0,037). Также в этой группе пациентов прослеживается положительная корреляционная связь между уровнем МПО в периферической крови и содержанием NO в выдыхаемом воздухе (r=0,60; р=0,001). Такая связь может быть объяснена следующими патофизиологическими механизмами: во-первых, NO является донором для гемовой группы МПО, а во-вторых, NO может служить физиологическим субстратом МПО, т. к. он является продуктом цитокин-индуцибельной NO-синтазы (iNOS), которая содержится в нейтрофилах [9].
Таким образом, проведенный анализ свидетельствует о том, что сочетание БА и ХОБЛ характеризуется клиническими, функциональными и лабораторными особенностями. Полученные нами данные о преобладании смешанного биофенотипа воспаления в дыхательных путях при сочетании БА и ХОБЛ частично объясняют неэффективность фармакотерапии, что приводит к более частым обострениям и госпитализациям, снижению показателей ФВД, развитию гиперинфляции. Необходимо проведение дальнейших исследований. В частности, особый интерес представляют разработка лечебных программ и выбор наиболее оптимальных схем лечения.
Выводы
При БА, ХОБЛ и их сочетании отмечается дисбаланс провоспалительных (ИЛ-1β, ИЛ-8) и противовоспалительного (ИЛ-10) цитокинов в периферической крови с преобладанием первых. Универсальным индикатором системного воспаления для всех групп является СРБ, повышенный уровень которого в периферической крови связан с составом индуцированной мокроты, а также уровнем цитокинов и МПО.
При сочетании БА и ХОБЛ отмечается повышение уровня NO в выдыхаемом воздухе и МПО в периферической крови, что ассоциировано с выраженностью бронхиальной обструкции и свидетельствует о развитии и инициации оксидативного и нитрозативного стрессов.
При анализе биофенотипов индуцированной мокроты можно отметить, что при изолированной тяжелой БА преобладает эозинофильный тип, при ХОБЛ (GOLD 3) в большем проценте случаев отмечается нейтрофильный биофенотип воспаления, в то время как при сочетании БА и ХОБЛ в 51% случаев встречается смешанный тип воспаления, в 29% — малогранулоцитарный, в 11% — эозинофильный, и лишь у 9% пациентов отмечается нейтрофильный паттерн воспаления.
Результаты проведенного корреляционного анализа свидетельствуют о наличии связи клинико-функциональных параметров с уровнем про- и противовоспалительных цитокинов у больных БА в сочетании с ХОБЛ.












