По современным представлениям человеческий организм является определенной экологической нишей для множества разнообразных микроорганизмов, которые в норме формируют своего рода различные биотопы, являющиеся достаточно сложными системами, сформировавшимися в процессе эволюции и со временем приобретшие определенную устойчивость применительно к особенностям макроорганизма. Биотопы отличаются не только многокомпонентностью, но и количественным разнообразием входящих в них представителей микрофлоры [1].
Постоянство бактериальной аутомикрофлоры организма человека позволяет рассматривать бактерий, существующих преимущественно в четырех локализациях – на коже и слизистой полости рта, кишечника, половых органов – как своеобразный прокариотический орган. Причем изменения в одном из биотопов могут приводить к нарушениям в других.
Формирование микрофлоры биотопов организма, и в первую очередь кожи и кишечника, происходит уже с самого рождения ребенка при прохождении по родовым путям. В дальнейшем на формирование влияет много факторов: состав микрофлоры биотопов матери, вид вскармливания, а затем и характер питания, состояние соматического здоровья ребенка и состояние окружающей среды [2,3].
Из всех биотопов организма наибольшая численность и видовое разнообразие бактерий отмечается в биотопе кишечника: так, на площади в 200 м2 обитает 1012–1014 бактерий, может встречаться до 450 видов различных микроорганизмов, общая масса которых доходит до 5% массы самого кишечника [4,5]. При этом в разных отделах кишечника количество и состав микроорганизмов биоценоза различен. В тонком кишечнике микробов меньше – это преимущественно лактобациллы, стрептококки и вейлонеллы, в толстом кишечнике их больше, причем преобладают кишечные палочки и анаэробные бактерии. Многочисленные микроорганизмы обеспечивают такие важные функции, как выработка ферментов, участвующих в метаболизме белков, липидов, жиров, нуклеиновых и желчных кислот, формирование механизмов иммунной защиты, поддержание гомеостаза организма, продукция биологически активных веществ и витаминов, детоксикация эндогенных и экзогенных субстратов и многие другие.
Микрофлора кишечника условно подразделяется на защитную, сапрофитную и оппортунистическую (условно–патогенную). Защитная микрофлора наиболее многочисленная (до 95%) и в основном представлена лактобактериями, бифидобактериями и кишечной палочкой с нормальными ферментативными свойствами. Именно они обеспечивают постоянство микрофлоры за счет колониальной резистентности. Так, бифидобактерии, лактобактерии выделяют молочную, уксусную кислоты, другие вещества, обладающие избирательным антимикробным действием. Кислая среда, обусловленная жизнедеятельностью этих микроорганизмов, препятствует проникновению и закреплению на слизистой патологических микробов, не свойственных данному биотопу. Помимо этого, бифидобактерии стимулируют клеточное звено иммунитета и участвуют в синтезе иммуноглобулинов. Данные бактерии являются естественными биосорбентами и способны накапливать значительное количество соединений тяжелых металлов, фенолов, формальдегидов и других токсичных веществ [6,7]. Однако в соответствии с современными воззрениями, скорее всего, недостаточное количество лактобактерий является основным отягчающим фактором при атопическом дерматите. Именно лактобактерии в значительной степени снижают всасывание аллергенов в кишечнике и стимулируют синтез иммуноглобулинов класса А, которые, особенно в раннем детском возрасте, являются основными антителами против пищевых аллергенов [8,9].
Сапрофитная микрофлора кишечника представлена эпидермальным и сапрофитным стафилококками, энтерококками и другими микроорганизмами, основной функцией которых является утилизация конечных продуктов метаболизма макроорганизма [5].
Оппортунистическая микрофлора может быть представлена различными микроорганизмами (β–гемолитический стрептококк, золотистый стафилококк, спороносные анаэробы, грамотрицательные энтерококки, грибы рода Candida), которые при определенных условиях вызывают патологический процесс [5].
Таким образом, в кишечном микробиоценозе, как в единой системе, существуют корреляционные связи между различными видами бактерий. Нарушение колонизационной резистентности кишечника, связанное с изменением состава постоянной микрофлоры, способствует колонизации патогенными и условно–патогенными бактериями, нарушению основных функций, что и приводит к формированию дисбиоза [Мельникова, 1997; Билимова, 2000; Белова с соавт., 2004; Cammarota, Ogava, 1998].
Согласно существующему в России медицинскому стандарту оказания специализированной помощи при патологии желудочно–кишечного тракта (ЖКТ) дисбиоз кишечника рассматривается, как своеобразный клинико–лабораторный синдром, который характеризуется изменением качественного и/или количественного состава аутомикрофлоры, с возможной транслокацией микроорганизмов в несвойственные для них биотопы; при этом данные изменения могут сопровождаться клиническими симптомами поражения кишечника. В широком понимании дисбиоз является проявлением общего нарушения в различных микробиотах организма, которое приводит к нарушению функционирования микробиот и сопровождается определенными симптомами, ассоциированными с различными патологическими состояниями [5,10,11].
При развитии дисбиоза защитная микрофлора кишечника перестает выполнять свои функции в достаточной степени, что приводит к формированию патологических состояний либо усугублению течения имеющейся соматической патологии [12,13]. Ассоциированные с дисбиозом заболевания в зависимости от преобладания механизмов, отягчающих течение болезни, условно подразделяются на 4 группы:
• заболевания органов пищеварения,
• гнойно–воспалительные заболевания,
• аллергические заболевания,
• заболевания, связанные с нарушением обмена веществ (метаболизма).
В многочисленных исследованиях показано, что нарушение биоценотических взаимоотношений между патогенными бактериями и нормальной кишечной микробиотой является одним из важнейших факторов, влияющих на развитие и течение ряда хронических дерматозов, особенно аллергических заболеваний кожи. А.А. Воробьев, Л.О. Иноземцева, Ю.В. Несвижский (1996), R.J. De Vos, W.A. De Boer, F.D. Haas (1995) считают, что возникновение кожных заболеваний в определенной мере связано с нарушением микроэкологического баланса кишечника. В частности, у 80–95% больных атопическим дерматитом отмечается дисбиоз кишечника, при этом наряду с дефицитом лактобактерий и бифидобактерий наблюдается избыточный рост Staphilococcus aureus, E. coli с измененными свойствами, грибов рода Candida. Наличие патогенной микрофлоры вызывает аутосенсибилизацию организма с развитием иммуно–аллергических реакций в основном по IgE–зависимому типу. Помимо этого, определенные штаммы Staphilococcus aureus выделяют токсины, которые выступают в роли суперантигенов, способных активировать до 10% лимфоцитов. В то же время отмечается усиление пищевой сенсибилизации из–за нарушений барьерной функции кишечника. Безусловно, все эти факторы в значительной степени утяжеляют течение АтД, приводят к хронизации процесса. Это подтверждается многочисленными исследованиями, в результате которых выявлена корреляция между степенью выраженности дисбиоза и тяжестью клинических проявлений АтД, а также данными о повышении эффективности проводимого лечения при целенаправленном воздействии на микрофлору кишечника [14,15]. Кроме прямого влияния дисбиоза на сенсибилизацию организма при атопическом дерматите, в настоящее время доказано опосредованное влияние на состав аутомикрофлоры кожи у больных АтД [16].
Безусловно, рациональные схемы лечения атопического дерматита должны включать методы детоксикации (в частности, энтеросорбции) и использование препаратов, восстанавливающих и поддерживающих нормальную микрофлору кишечника. Энтеросорбция является неинвазивным методом детоксикации и направлена на выведение из организма различных эндогенных и экзогенных аллергенов, токсинов, патогенных микроорганизмов и продуктов их жизнедеятельности. Известно, что на фоне проведения энтеросорбционных мероприятий происходит повышение функциональной активности клеточного и гуморального иммунитета, ускоряется регресс объективных и субъективных симптомов АтД [17,18]. Существенным является и то, что сорбенты позволяют снизить медикаментозную нагрузку, а в ряде случаев и обходиться без них.
Требования к современным энтеросорбентам следующие: высокие сорбционные свойства (емкость); отсутствие токсических свойств и системной фармакокинетики; атравматичность для слизистых оболочек ЖКТ; хорошая эвакуаторная способность; высокая комплаентность [19]. Механизм процесса энтеросорбции зависит от двух факторов – характеристик сорбента и структуры подлежащих сорбции веществ. Сорбенты могут отличаться по ряду признаков: лекарственная форма, физические свойства и химическая структура. Одними из самых эффективных сорбентов являются природные органические на основе пищевых волокон, такие как лигнин, который не усваивается в пищеварительной системе человека и полностью ферментируется кишечными бактериями. Важнейшее свойство лигнина – высокая сорбционная активность.
Вместе с тем большой интерес представляет развитие относительно нового направления в лечении атопического дерматита – включение в комплекс терапевтических мероприятий пребиотиков, выделенных из естественных источников и обладающих определенными регулирующими свойствами в отношении функционирования биотопа кишечника. В отличие от пробиотиков, которые поставляют необходимые бактерии извне, пребиотики выступают в качестве питательной среды для развития собственной нормальной микрофлоры организма, что способствует более быстрому и устойчивому восстановлению нормальной аутомикрофлоры кишечника [20,21]. Как правило, в качестве пребиотиков используют вещества, содержащие бифидогенные факторы, стимулирующие рост и развитие полезных бактерий. Таким веществом, в частности, является лактулоза – синтетический стереоизомер молочного сахара – лактозы.
Таким образом, на сегодняшний день идеальным сочетанием можно считать комбинированные лекарственные средства, содержащие пребиотик и адсорбент. Таким средством является препарат Лактофильтрум®, включаюший сорбент и пребиотик. В качестве сорбента препарат содержит растительный компонент – лигнин, который обладает неспецифическим дезинтоксикационным действием. За счет большой площади поверхности и развитой системы пор обладает высокой сорбционной емкостью и таким образом способен выводить из организма токсины, аллергены и патогенные микроорганизмы. В качестве пребиотика выступает лактулоза, положительное влияние которой на микрофлору кишечника обусловлено целым рядом фармакологических свойств. Так, продукты бактериального метаболизма лактулозы сдвигают pH среды в толстой кишке в кислую сторону, что приводит к подавлению размножения патогенных микроорганизмов и угнетению процессов гниения. Помимо этого, являясь пищевым субстратом для бактерий, лактулоза стимулирует рост собственных бифидобактерий и лактобактерий в толстом кишечнике, а это, в свою очередь, восстанавливает, нарушенные функции биотопа кишечника. Активные составляющие препарата не инактивируются в агрессивных средах желудка и двенадцатиперстной кишки, что обеспечивает 100%–ю доставку непосредственно к месту действия. Лактофильтрум® производится из компонентов природного происхождения в таблетированной форме и удобен в применении. Препарат зарекомендовал себя как высоко безопасный, который практически не имеет противопоказаний к применению и побочных эффектов [22,23].
В клинических условиях под нашим наблюдением находилось 40 пациентов (средний возраст 18,9±2,3 года, продолжительность заболевания 11,4±2,7лет) с диагностированным по основным критериям атопическим дерматитом в стадии обострения. У большинства пациентов АтД носил распространенный характер – ДИШС (Дерматологический индекс шкалы симптомов) составил 18,2±2,3 балла, что соответствует среднетяжелому течению АтД. В зависимости от проводимого лечения пациенты были разделены на 2 сопоставимые по всем параметрам группы. В основную группу вошли 20 больных, которые получали препарат Лактофильтрум® по 2 таблетки 3 раза в сутки на протяжении 21 дня и фармакотерапию, соответствующую стандартам при данной патологии. Пациенты 2 группы (20 человек) получали традиционную медикаментозную терапию.
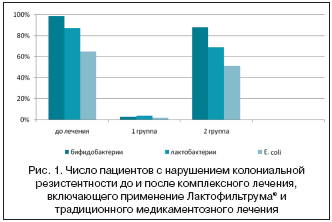
До лечения у 97,5% пациентов был диагностирован дисбиоз кишечника, причем у 52,5% пациентов он протекал с клиническими симптомами (метеоризм, усиление перистальтики, нарушение стула, дискомфортные субъективные ощущения). После комплексного лечения в основной группе у 95% пациентов отмечалась нормализация содержания лактобактерий, бифидобактрий и E. coli. Такая же тенденция наблюдалась и в отношении клинических симптомов дисбиоза. В группе сравнения достоверно значимых изменений количественного содержания лактобактерий, бифидобактрий и E. coli не отмечалось (рис.1).
Под влиянием комплексного лечения (1 группа) через 3 недели общие проявления всех объективных симптомов заболевания сохранялись в среднем лишь у 10% больных, в то время как в группе сравнения они были выражены в 54% случаев (рис. 2).
К концу лечения индекс ДИШС, отражающий тяжесть течения АтД, в основной группе снизился на 84%, в группе сравнения лишь на 53%.
Анализ выраженности зуда с использованием опросника Behavioral rating scores (BRS) показал выраженное отрицательное влияние зуда на повседневную деятельность пациентов с АтД. Так, до лечения в 1–й группе значение BRS составило 7,1±0,4 баллов, во 2–й группе – 6,8±0,5 баллов. Уже через 1 неделю от начала лечения в 1–й группе отмечался более выраженный регресс субъективной симптоматики: снижение BRS на 55%, во 2–й группе – на 26%. К концу лечения в 1–й группе значение BRS составило 0,4±0,1 балла. В контрольной группе к концу лечения индекс снизился лишь на 58% (рис. 3). Эти данные находились в соответствии с показателями биохимических маркеров зуда (табл. 1).
Как видно из приведенных в таблице данных, после комплексной терапии, включающей применение Лактофильтрума® отмечалось восстановление повышенных в исходном состоянии показателей серотонина и гистамина до нормальных значений – 0,81±0,32 и 0,87±0,13 (р<0,001) соответственно. Во 2 группе также наблюдалась позитивная, достоверно значимая динамика показателей гистамина (снижение уровня в 1,5 раза) и серотонина (снижение уровня в 1,6 раза), однако значения этих показателей все еще превышали нормальные.
В процессе лечения с улучшением клинической картины заболевания пропорционально улучшались и показатели качества жизни (рис. 4).
В результате анализа полученных данных, более выраженная положительная динамика дерматологического индекса качества жизни (ДИКЖ), особенно в первые дни терапии, была отмечена у пациентов 1 группы. Так, в первую неделю параметры ДИКЖ улучшились на 30% в 1 группе и лишь на 8% во 2 группе (рис. 5). К концу курса лечения ДИКЖ улучшился на 87 и 54% соответственно.
Таким образом, по оценке самими пациентами эффективности и комфортности проводимого лечения, метод, включающий применение Лактофильтрума®, является наиболее эффективным.
Выводы
1. Нарушение колониальной резистентости кишечника, приводящее к повышенной эндотоксинемии, аллергизации и нарушению гомеостаза, может отразиться на состоянии кожи и течении атопического дерматита.
2. Представители нормальной микрофлоры биоты кишечника выполняют физиологически важную функцию поддержания постоянства внутренней среды организма, принимают участие в формировании иммунобиологической реактивности макроорганизма. Нарушение нормоценоза способствует хронизации патологических процессов (в частности, атопического дерматита).
3. Включение препарата Лактофильтрум® в комплекс терапии больных АтД приводит к более быстрому и выраженному регрессу кожных высыпаний и субъективных ощущений, нормализации функции биотопа кишечника, что в конечном итоге способствует значительному улучшению качества жизни. Препарат не токсичен, не вызывает побочных эффектов, обладает высокой комплаентностью.





Литература
1. Ришко Е.Ю. Аутомикрофлора кожи в области биологически активных точек как индикатор здоровья пациентов с бронхо–легочной патологией и критерий оценки эффективности их иглорефлексотерапии . Автореф. …канд.м.н.,М.–2005.–24с.
2. Yang Y. W., Tsai C. L., Lu C. Y. Exclusive breastfeeding and incident atopic dermatitis in childhood: a systematic review and meta–analysis of rospective cohort studies // The British Journal of Dermatology. 2009; 161 (2): 373–383.
3. Шендеров Б.А. Медицинская микробная экология и функциональное питание. Т.III. Пробиотики и функциональное питание. М.–Грант.–2001.–208с.
4. Дисбиоз кишечника: руководство по диагностике и лечению. Под редакцией Е.И. Ткаченок, А.Н. Суворова. СПб:Спецлит.–2007.– 238с.
5. Овсянников Д.Ю. Дисбактериоз кишечника у детей: этиология, клиническое значение, диагностические критерии, современные методы коррекции.– //Педиатрия.–2011.–2.–С.10–19.
6. Беюл Е.А., Куваева И.Б. Клиническая медицина.–1986.–11.–С.37–44.
7. Летцель Х., Хергет Х. Управление симбиозом (лечение больных дисбиозом). Перев. с нем.–М.–2009.– 42с.
8. Новокшонов А. А., Соколова Н. В., Бережкова Т. В., Сахарова А. А. Клиническая эффективность нового энтеросорбента в комплексной терапии острых кишечных инфекций вирусной этиологии у детей // Лечащий Врач. 2009, № 7,– C.78–80.
9. Копанев Ю.А., Соколов А.Л. Дисбактериоз кишечника: микробиологические, иммунологические, клинические, микрологические аспекты.–М.–2002.– 147с.
10. Николаев В. Г. Энтеросорбция: состояние вопроса и перспективы на будущее // Вестник проблем биологии и медицины. 2007. № 4, С.7–17.
11. Ратникова Л. И., Пермитина. Энтеросорбция в лечении интоксикационного синдрома // Материалы III Ежегодного Всероссийского Конгресса по инфекционным болезням. Москва, 28–30 марта 2011.–.306–307.
12. Учайкин В.Ф., Новокшонов А.А., Соколова Н.В., Бережкова Т.В. Энтеросорбция – роль энтеросорбентов в комплексной терапии острой и хронической гастроэнтерологической патологии. Пособие для врачей. М., 2008.–24с.
13. Боткина А.С., Бельмер С.В. Дерматологические проявления заболеваний ЖКТ. Материалы XIV Конгресса детских гастроэнтерологов России. М.,–2007.
14. Плаксина И. А. Распространенность и клинико–иммунологические особенности течения атопического дерматита, сопровождающегося дисбиозом кишечника. Автореф. дисс. … к.м.н. Краснодар, 2007.–21с.
15. Тучков Д. Ю. Синдром диареи при атопическом дерматите у детей раннего возраста. Автореф. дисс. … к.м.н. Оренбург, 2004.–20с.
16. Фокина Р. А. Особенности течения атопического дерматита в условиях Якутии у детей и подростков в сравнительном аспекте //Дальневосточный медицинский журнал. Приложение 4. 2007,–С. 18–19.
17. Нагорная Н.В., Лимаренко М.П. Энтеросорбция в педиатрической практике: выбор оптимального сорбента//Медицина сегодня. 2010; 11–12.– С.331–332.
18. Применение метода энтеросорбции в практической медицине//Сборник клинических исследований препаратов Фильтрум–СТИ и Лактофильтрум. Часть III: Аллергология. Дерматология. Нефрология. Профессиональная патология. Наркология. М., 2006. –24с.
19. Ревякина В.А. Энтеросорбенты в комплексной терапии атопического дерматита у детей//Эффективная фармакотерапия в дерматовенерологии и дерматокосметологии. 2010; №2:С.14–16.
20. Ishida Y., Nakamura F., Kanzato H. et al. Clinical effects ofacidophilus strain L–92 on perennial allergic rhinitis: a double–blind, placebo–controlled study. J. Dairy Sci.2005; 88: 527–533.
21. Galdeano C. M., Perdigton G. The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity. Clin. Vacc. Immunol. 2006; 13: 219–226.
22. Калюжная Л.Д., Милорава Т.Т., Турик Н.В. и др. Новый пребиотик в комплексной терапии атопического дерматита у детей. Применение метода энтеросорбции // Искусство лечения. 2006; 10(36).
23. Снарская Е.С.Коррекция эндотоксемии при атопическом дерматите у детей препаратом Лактофильтрум. //Педиатрия.–2011.–2.– С.36–40.












