Накопленные на сегодняшний день данные свидетельствуют о том, что состав микрофлоры ЖКТ во многом определяется характером питания. К примеру, у людей, придерживающихся типичной, обедненной клетчаткой, западной диеты, кишечная микрофлора характеризуется снижением популяции лакто– и бифидобактерий, что сопровождается удлинением времени прохождения содержимого по кишечнику [8]. В то же время при росте численности кишечной микрофлоры, составляющей основную часть кишечного содержимого и фекальных масс, наблюдается сокращение времени кишечного транзита [8–11]. Эти наблюдения подтолкнули исследователей к изучению возможностей целенаправленного изменения кишечной микрофлоры с целью нормализации времени кишечного транзита и, соответственно, улучшения состояния здоровья и самочувствия.
Группой ученых под руководством S. Meance в 2003 г. было проведено рандомизированное открытое контролируемое исследование, основной целью которого была оценка влияния потребления кисломолочного продукта, содержащего пробиотический штамм B. animalis DN–173 010, на время прохождения содержимого по кишечнику у пожилых людей, а также определить длительность сохранения этого эффекта [12]. Указанный штамм B. animalis DN–173 010 (коммерческое название ActiRegularis) используется в производстве продуктов марки «Активиа» (компания «Данон», Россия), является одним из наиболее изученных среди штаммов пробиотиков, входящих в состав кисломолочных продуктов «функционального» питания [13–22].
В исследовании, проводившемся в медицинском центре в Триесте (Италия), приняли участие 200 здоровых добровольцев в возрасте от 50 до 75 лет. До начала исследования все пациенты прошли общеклиническое и нутрициологическое обследование, а также было изучено время транзита пища по ЖКТ (два последовательных замера методом цветных меток с недельным интервалом при условии соблюдения рекомендуемой диеты). Участники были рандомизированы на две группы по 100 человек в соответствии со временем транзита – среднее время прохождения (СВП, 40–50 ч) и замедленное время прохождения (ЗВП, > 50 ч). К критериям исключения относились любые состояния, приводящие к нарушению функции ЖКТ, например болезнь Крона, целиакия, холецистэктомия, серьезные заболевания печени/почек, онкологические заболевания ЖКТ, аллергия на молочные продукты и прием антибиотиков в течение предыдущих 3 мес.
Для обеспечения чистоты исследования всем участникам были даны рекомендации по диете, которые они выполняли в течение 1 недели до начала и всего срока приема исследуемого продукта. Количество пробиотических бактерий В. ActiRegularis в одной порции (125 мл) исследуемого продукта, представленного на рынке под торговой маркой Активиа, составило 2,6х108 КОЕ/г.
В соответствии с дизайном исследования, все участники были случайным образом распределены по двум группам (А и В). После вводного периода (1 неделя) пациенты группы А получали по 1 порции исследуемого продукта ежедневно в течение 2 недель с последующим 6–недельным периодом наблюдения. Участники группы В не подвергались активному диетическому вмешательству в течение контрольного 4–недельного периода, следовавшего за вводным (это позволило оценить стабильность времени прохождения кишечного содержимого на фоне рекомендуемой диеты, но без активного вмешательства в нее). По окончании этого периода они получали 2 порции исследуемого продукта ежедневно в течение 14 суток с последующим 6–недельным периодом наблюдения. Для контроля правильности соблюдения протокола исследования каждые 3 дня проводился опрос и подсчет количества оставшегося продукта в холодильниках участников.
Для определения времени транзита по ЖКТ была использована методика, разработанная Институтом по исследованию и изучению питания и пищевых технологий в Италии, которая заключалась в измерении времени, прошедшего от момента приема внутрь до появления в фекалиях двух красителей–маркеров – угольного (черного) и кармина (красного). Среднее время транзита рассчитывалось как среднее от 3 замеров, причем маркеры принимались внутрь 3 дня подряд. Среднее время транзита по ЖКТ на фоне соблюдения диетических рекомендаций, но без употребления исследуемого продукта составило 46,4±2,4 ч. в СВП–группе и 68,0±9,1 ч. в ЗВП–группе. В течение 4 недель, предшествовавших началу приема продукта в группе В, параметры кишечного транзита существенно не изменились и составили 46,4±2,4 и 46,4±2,4 ч на 2–й и 4–й неделе соответственно у лиц с СВП и 68,0±9,1 и 68,2±9,2 ч – у пациентов с замедленным транзитом.
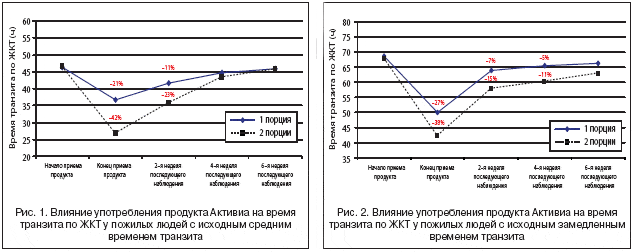
Употребление продукта Активиа значительно сокращало время транзита как в СВП–, так и в ЗВП–группе. У лиц со средним временем транзита на фоне употребления одной порции продукта в день (группа A) достоверно сокращалось среднее время транзита по ЖКТ на 20,5% (p<0,05, парный тест Стьюдента) по сравнению с исходными значениями, а также с группой B до начала употребления продукта (рис. 1). В группе B, участники которой получали по 2 порции (250 г) Активиа в сутки, сокращение времени прохождения содержимого по ЖКТ было значительно более выраженным – на 42,2% (с 46,5 до 26,9 ч после 14 суток употребления продукта). Аналогично статистически достоверное сокращение времени наблюдалось и в ЗВП–группе – на 27,2% по сравнению с исходной величиной (p<0,05, парный тест Стьюдента) на фоне употребления одной порции продукта (группа A) и на 38,1% по сравнению с исходной величиной (p<0,05, парный тест Стьюдента) на фоне двух порций в день (группа B) (рис. 2).
Важно отметить, что положительное влияние продукта Активиа на время транзита по ЖКТ сохранялось в период последующего наблюдения в обеих группах в срок от 2 до 6 недель (рис. 1 и 2). У лиц со средним временем транзита влияние продукта на время прохождения содержимого по кишечнику все еще ощущалось спустя 4 недели; данный показатель вернулся к исходному уровню после 6 недель наблюдения. В группе А пациентов со средним временем транзита спустя 2 и 4 недели после употребления Активиа сокращение указанного показателя составляло 10,2 и 3,5% соответственно и возвращалось к исходному уровню к 6 недели наблюдения. В группе В на фоне ежедневного употребления двух порций кисломолочного продукта, обогащенного B. ActiRegularis, время транзита оставалось сниженным на 23,2, 6,9 и 1,9% на 2–й, 4–й и 6–й неделе периода последующего наблюдения соответственно (рис. 1).
В группе участников с замедленным временем транзита время прохождения содержимого по ЖКТ оставалось достоверно сниженным после 2 недель периода наблюдения у лиц, ежедневно потребляющих 125 г продукта (сокращение на 6,8, 4,5 и 3,5% соответственно на 2–й, 4–й и 6–й неделе) (рис. 2). Аналогичное, но более сильное сокращение времени транзита (на 14,7, 11,2 и 7,4% соответственно в срок 2, 4 и 6 недель) в периоде последующего наблюдения было выявлено у пациентов, ежедневно потребляющих по 250 г продукта.
Оценивая полученные группой исследователей результаты, необходимо отметить ряд важных моментов, касающихся дизайна исследования и методики оценки транзита содержимого по ЖКТ. К возможным недостаткам представленной работы можно было бы отнести отсутствие плацебо в качестве продукта сравнения. Однако нужно учитывать, что в исследованиях по изучению эффективности продуктов «функционального» питания важно доказать не только активность основного функционального компонента (применительно к изучавшемуся продукту Активиа это пробиотический штамм Bifidobacterium ActiRegularis), но и продукта в целом. Нереалистично было бы предполагать, что какой–либо продукт мог бы выступить в роли плацебо, так как любой пищевой продукт оказывает влияние на функцию кишечника и время прохождения содержимого по нему. С другой стороны, стабильность показателей транзита по ЖКТ до начала употребления вышеуказанного продукта свидетельствует о том, что выявленное достоверное сокращение времени транзита обусловлено употреблением именно этого продукта. В данном контексте отсутствие плацебо нельзя считать ограничивающим фактором в оценке полученных результатов.
Интересен выбор контингента участников исследования, а именно лиц пожилого возраста. Как известно, старение может сопровождаться замедлением кишечной моторики, а изменение повседневных привычек, в частности ограничение физической активности, уменьшение потребления жидкости и продуктов, богатых клетчаткой, может еще больше осложнить проблему запора [23]. В этой связи поиск эффективных, безопасных и в тоже время доступных способов нормализации работы ЖКТ является особо актуальным для этой группы населения. Еще великий русский ученый И.И. Мечников связывал возможность продления жизни с улучшением состава кишечной микрофлоры путем включения в повседневное питание кисломолочных продуктов. В ряде работ, посвященных изучению влияния пробиотиков на транзит содержимого по ЖКТ, исследователям не удалось убедительно продемонстрировать их положительный эффект. Основными причинами неудач явились недостаточное число участников исследования, гетерогенность обследуемого контингента, а также значительный разброс значений времени кишечного транзита, как между разными участниками исследования, так и у одних и тех же индивидуумов в разных замерах. Методы, используемые в настоящем исследовании, а также 4–недельный период наблюдения, предшествовавший диетическому вмешательству, в группе B дал возможность оценить стабильность показателя времени продвижения кишечного содержимого у участников исследования до того, как было начато активное вмешательство. Результаты свидетельствуют о том, что как индивидуальные, так и средние значения времени продвижения кишечного содержимого в каждой популяции были стабильны в течение периода наблюдения, и что индивидуальные колебания значений данного параметра у лиц со стабильным образом жизни не настолько вариабельны, как было принято считать. Stephens с соавт. писал, что сроки продвижения кишечного содержимого у лиц, придерживающихся сходной диеты, со временем могут существенно варьировать [24]. Однородность изучаемой популяции и стабильность времени продвижения кишечного содержимого свидетельствует о том, что две изучаемые популяции действительно являлись истинными СВП– и ЗВП–группами и отмеченные изменения времени продвижения кишечного содержимого были обусловлены именно влиянием исследуемого продукта.
Не менее важны данные о стабильности полученного эффекта нормализации кишечного транзита, предполагаемым механизмом которого может быть модификация кишечного микробного пейзажа на фоне увеличения концентрации бифидобактерий в кишечнике, а также состава ее метаболитов, таких как короткоцепочечные жирные кислоты [7,8,25,26]. Это дает основания предполагать, что после первичной стимуляции оптимизированный процесс прохождения содержимого по кишечнику улучшает состав кишечной микрофлоры, которая в свою очередь стимулирует кишечный транзит, т.е. формируется саморегулирующаяся петля. Также было показано, что изменение активности фекальных ферментов, индуцированное употреблением в пищу пробиотиков, может сохраняться до 3 недель после прекращения их приема [26].
Таким образом, в исследовании S. Meance с соавт. продемонстрировано, что употребление кисломолочного продукта Активиа на основе пробиотического штамма B. animalis DN–173 010 ежедневно в течение 2 недель оказывает дозозависимый эффект – сокращение времени транзита пищи по ЖКТ у пожилых людей, в первую очередь у лиц с замедленным транзитом. В целом полученные результаты позволяют отвести продукту Активиа важную роль в поддержании здорового состояния ЖКТ, а возможно и в лечении ряда патологических состояний пищеварительной системы, обусловленных замедленным временем прохождения содержимого по кишечнику.
Литература
1. Armitage E, Drummond HE, Wilson DC, Ghosh S. Increasing incidence of both juvenile–onset Crohn’s disease and ulcerative colitis in Scotland. Eur J Gastroenterol Hepatol 2001; 13: 1439–47.
2. Loftus EV Jr, Sandborn WJ. Epidemiology of inflammatory bowel disease. Gastroenterol Clin North Am 2002; 31: 1– 20.
3. Williams RD, Olmsted WH. The effect of cellulose, hemi–cellulose and lignin on the weight of the stool: a contribution to the study of laxation in man. J Nutr 1936; 11: 433– 49.
4. McLean Baird I, Walters RL, Davies PS, et al. The effects of two dietary fiber supplements on gastrointestinal transit, stool weight and frequency and bacterial flora and fecal bile acids in normal subjects. Metabolism 1977; 26: 117–28.
5. Eastwood MA, Kirkpatrick JR, Mitchell WD, et al. Effects of dietary supplements of wheat bran and cellulose on faeces and bowel function. BMJ 1973; 4: 392–5.
6. Bellisle F, Diplock AT, Hornstra G, et al. Functional food science in Europe. Br J Nutr 1998; 80 (Suppl 1).
7. FAO/WHO. Energy and protein requirements. Report of a joint FAO/WHO Ad Hoc Expert Committee. FAO Nutrition Meet ings Report Series No. 52, 1973. Rome: FAO, 1993.
8. Abrams GD, Bishop JE. Effect of normal microbial flora on gastrointestinal motility. Proc Soc Exp Biol Med 1967; 126: 301–4.
9. Sacquet E, Gamier H, Raibaud P. Etude de la vitesse de transit intestinal chez le rat axenique, holoxenique caectomise. CR Seances Soc Biol Fil 1970; 164: 532–7.
10. Boriello SP. Bacteria and gastrointestinal secretion and motility. Scand J Gastroenterol 1984; 19: 115–21.
11. Falk PG, Hooper LV, Midtvedt T, Gordon JI. Creating and maintaining the gastrointestinal ecosystem. Microbiol Mol Biol Rev 1998; 62: 1157–70.
12. Meance S, et al. Recent advance in the use of functional foods: Effect of the commercial fermented milk with Bifidobacterium animalis strain DN–173 010 and yogurt strains on gut transit time in the elderly. Microb Ecology Health Dis, 2003; 15: 15–22
13. Pochart P, Marteau P, Bouhnik Y, et al. Survival of Bifido bacteria ingested via fermented milk during their passage through the human small intestine: an in vivo study using intestinal perfusion. Am J Clin Nutr 1992; 55: 78–80.
14. Berrada N, Lemeland JF, Laroche G, et al. Bifidobacterium from fermented milks: survival during gastric transit. J Dairy Sci 1991; 74: 409–13.
15. Bouvier M, Meance S, Bouley C, et al. Effects of consumption of a milk fermented by a Probiotic strain Bifidobacterium animalis DN–173 010 on colonic transport times in healthy humans. Bioscience Микрофлора 2001; 20: 43–8.
16. Duez H, Pelletier C, Cools S, et al. A colony immunoblotting method for quantitative detection of a Bifidobacterium animalis Probiotic strain in human faeces. J Appl Microbiol 2000; 88: 1019–27.
17. Moreau MC, Bisetti N, Dubuquoy C. Immunomodulating properties of a strain of Bifidobacterium used as Probiotic on the fecal and cellular intestinal IgA antirotavirus responses in mice. In: Sadler MJ, Saltmarsh M, eds. Functional Foods – The Consumer, the Products, and the Evidence. Cambridge, 1998: 47–51.
18. Abdelali H, Cassand P, Soussotte V, et al. Antimutagenicity of components of dairy products. Mut Res 1995; 331: 133– 41.
19. Grimaud JC, Bouvier M, Marteau P, et al. Effect of Bifido bacterium fermented milk (Bio strain) on the colonic transit time in healthy humans. Gastroenterology 1995; 108(Suppl 4): A728.
20. Meance S, Cayuela C, Turchet P, et al. A fermented milk with a Bifidobacterium strain DN–173 010 shortened oro– fecal gut transit time in elderly. Microb Ecol Health Dis 2001; 13: 217–22.
21. Marteau P, Cuillerier E, Meance S, et al. Bifidobacterium animalis strain DN–173 010 shortens the colonic transit time in healthy women: a double–blind randomized, controlled study. Aliment Pharmacol Ther 2002; 16: 587–93,
22. Pathmakanthan S, Meance S, Edwards CA. Probiotics: A review of human studies to date and methodological ap proaches. Microb Ecol Health Dis 2000; Suppl 2: 10–30.
23. Read NW Aging and the colon. In: Bianchi L, Holt P, James OFW, eds. vol. 49, Lancaster, UK: MTP Press, 1987: 331–40.
24. Stephens AM, Wiggins HS, Cummings JH. Effect of changing transit time on colonic microbial metabolism in man. Gut 1987; 28: 601–9.
25. Cummings JH. The large intestine in nutrition and disease. Institute Danone Bruzelles, Belgium. Danohe Chair Mono graph 1997 (ISBN 2–930151–02–1).
26. Goldin BR, Gorbach SH. The effect of milk and lactobacillus feeding on human intestinal bacterial enzyme activity. Am J Clin Nutr 1984; 39: 1046–9.












