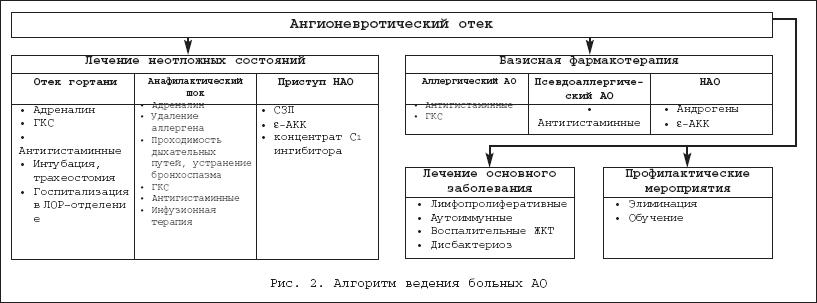
Ангионевротический отек (АО) – локальный отек дермы, подкожной клетчатки и слизистых, возникающий вследствие многих причин и реализующийся различными механизмами. Этиологические причины и механизмы развития АО могут быть самыми различными, поэтому целесообразно в названии указывать механизм развития отека. Квинке первым описал в 1882 г. наследственный ангионевротический отек, патогенез которого (связь с дефектом системы комплемента) был определен только в 1963 году. Ввиду преобладания случаев развития отека аллергической природы обычно под термином ангионевротический отек подразумевают именно аллергический ангионевротический отек, которому можно дать еще одно определение – гигантская крапивница. При установлении комплементзависимого механизма развития АО сейчас предпочитают пользоваться термином наследственный ангионевротический отек (НАО). В 1972 г. описана еще одна разновидность отека, определяемая как «приобретенный ангионевротический отек», связанный с различными лимфопролиферативными и аутоиммунными заболеваниями, нарушающими работу системы комплемента (СК). Возникновение АО отека хотя бы раз в жизни отмечают до 10% населения. В половине всех случаев АО отмечается сочетание с крапивницей, которую можно определить, как ограниченный участок отека и гиперемии дермы с неровными границами, возможным слиянием и образованием волдырей. Лишь в 20% случаев отмечается четко изолированный АО. Классификация I . Аллергический АО (гигантская крапивница). II . Псевдоаллергический отек (неспецифическая гистаминолиберация). III . Комплементзависимые отеки. 1. Наследственный АО (НАО): a) НАО с количественным недостатком С1–ингибитора (НАО – I типа); b) НАО с функциональным недостатком С1–ингибитора (НАО – II типа). 2. Приобретенный АО a) иммунокомплексный (ПАО – I типа); b) аутоиммунный (ПАО – II типа); c) при введении препаратов, активирующих СК. IV . Идиопатический АО. I . Наиболее часто в повседневной клинической практике встречается аллергический АО . До 80% причин АО – развитие аллергической реакции I типа – реагиновый (IgE – зависимый тип), при котором происходит выброс медиаторов (преимущественно гистамина,а также простагландинов, лейкотриенов, брадикинина, фактора активации тромбоцитов и других) из тучных клеток и базофилов при взаимодействии аллергена и расположенного на этих клетках IgE. Медиаторы вызывают вазодилатацию, повышение сосудистой проницаемости и клеточную инфильтрацию, что клинически и проявляется отеком ткани. К развитию аллергического АО могут приводить различные факторы: – лекарства (антибиотики, сульфаниламиды, витамины группы В, плазма, иммуноглобулины); – пищевые продукты (рыба, ракообразные, молоко, яйца, орехи, бобовые, томаты, цитрусовые, косточковые, клубника, шоколад, сыр); – некоторые биологически активные добавки («китайский чай», средства народной медицины, содержащие высокоаллергенные продукты животного и растительного происхождения); – яд жалящих насекомых (пчелы, осы, шершни); – латекс (перчатки, презервативы, резиновые мочевые катетеры, интубационные трубки, внутривенные катетеры); – эпидермальные аллергены – слюна, перхоть кошек, собак, других теплокровных; – косметические средства. Для аллергических отеков характерны: четкая связь воздействия аллергена и развития реакции, острое начало – обычно реакция развивается через 15–30 минут после контакта с аллергеном, быстрое развитие отека, сочетание с крапивницей. Отек характерного вида – обычно это плотный, асимметричный, безболезненный отек, может быть бледно–розового цвета и не отличаться от неизмененной кожи. Локализуется преимущественно в местах с хорошо развитой подкожно–жировой клетчаткой (на лице это чаще всего губы, веки, в ротовой полости – мягкое небо, язык, миндалины). Вовлечение слизистой дыхательной системы (отек гортани, трахеи, бронхов) особенно опасно из–за угрозы развития асфиксии. У больных возникает чувство тяжести, напряжения, першения в горле. Ранним симптомом отека гортани является охриплость голоса, далее возникают нарушения глотания и затруднение дыхания. Возможно развитие АО как начала генерализованной анафилактической реакции – анафилактического шока, которая проявляется генерализованным зудом, крапивницей, слезотечением, чиханием, бронхоспазмом, отеком языка, гортани, глотки, охриплостью, гиперсекрецией слизи в бронхах, тошнотой, рвотой, схваткообразной болью в животе, поносом, тахикардией, артериальной гипотонией, нарушением сердечного ритма, развитием острой сердечно–сосудистой недостаточности, судорог, остановки дыхания, комы. При этом смерть наступает от отека гортани и нарушения сердечного ритма. II . Клинические проявления псевдоаллергического отека во многом сходны с аллергическим, однако выделение медиаторов аллергии происходит неиммунным путем. При таком механизме развития отека важную роль играют пищевые продукты и медикаменты, изменяющие метаболизм медиаторов, образование избытка лейкотриенов, брадикинина, дисбактериоз, а именно: – миорелаксанты (тиопентал, тубокурарин), опиаты, антибиотики, рентгеноконтрастные вещества, местные анестетики, плазмозаменители, плазма, альбумин, протамин непосредственно воздействуют на тучные клетки, повышают уровень гистамина в крови; – рыба, сыр, копчености, вино, пиво, шоколад, орехи, ягоды (клубника, малина), цитрусовые содержат большое количество гистамина в своем составе; – НПВП, пищевые добавки тартразин, салицилаты, сульфиты, нитраты приводят к образованию избытка лейкотриенов D4, C4, E4, обладающих значительной сосудорасширяющей и хемотаксической активностью; – прием ингибиторов АПФ является довольно частой причиной развития АО (от 4 до 8% всех АО) за счет накопления брадикинина, увеличивающего сосудистую проницаемость [1]. Отмечено, что 0,1–0,7% всех пациентов, принимавших иАПФ, имели эпизод АО [2]. Развитие отека возможно как через несколько дней, так и лет после начала приема препаратов. Часто при приеме иАПФ АО развивается у людей, имевших в анамнезе АО любого другого генеза. Отмечено, что при одновременном приеме иАПФ и антибиотиков, местных анестетиков повышается риск возникновения АО; – при дисбактериозе кишечника отмечается повышение концентрации в крови гистамина и других биологически активных аминов как вследствие их повышенного образования, так и за счет резко увеличивающейся проницаемости воспаленной кишечной стенки [3,4]. III . Среди комплементзависимых причин АО выделяют: 1. Довольно редкий наследственный ангионевротический отек – наследственный дефект системы комплемента (СК), при котором нарушается продукция С1–ингибитора (уровень его снижен или он функционально малоактивен), ограничивающего активацию системы комплемента (СК) по классическому пути. В норме активация СК, возникающая при присоединении иммунного комплекса с C1q компонентом СК, самоограничивается регуляторным белком – С1–ингибитором. При НАО не ограничена продукция компонентов активации СК (С4а, С2b, C3a, C5a – анафилотоксины), обладающих высокой хемотаксической, кининогенной, сосудорасширяющей активностью. С1–ингибитор в нормальных условиях также ограничивает активацию свертывающей системы крови (взаимодействует с плазмином, фактором Хагемана, кининогеном, калликреином). Отмена супрессивного влияния приводит к накоплению большого количества кининов, в частности, брадикинина. Накапливаясь в избыточном количестве, кинины приводят к расширению, повышению проницаемости сосудов микроциркуляторного русла, интерстициальному отеку, набуханию коллагеновых волокон, сглаживанию сосочков дермы, что клинически проявляется отеком. Для НАОхарактерно появление рецидивирующих плотных, не зудящих асимметричных отеков после травм (даже минимальных), экстракции зубов, психического или физического перенапряжения, переохлаждения. Часто приступ НАО возникает во время респираторных или иных инфекций, менструации. При НАО крапивницы нет. Возможно возникновение кольцевидной эритемы за несколько часов до появления отека. Отек очень плотный, при надавливании не образуется ямки, сопровождается чувством распирания, жжения. Отек развивается в течение нескольких часов, может оставаться до 2–х суток. Участки отека четко отграничены от здоровой кожи. Обычно фиксированной локализации. При НАО часто вовлекаются слизистые. До 25% больных НАО погибают от отека гортани. При вовлечении слизистой пищевода отмечается дисфагия, слизистой желудка – тошнота, рвота, слизистой кишечника – боли в животе, клиника кишечной непроходимости. Вовлечение в отек ЖКТ обычно проявляется клиникой острого живота. При отеке слизистой мочевого пузыря возникает дизурия, анурия. Также возможно вовлечение в отек мозговых оболочек, слизистой внутреннего уха, что проявляется тошнотой, рвотой, головокружением, появлением менингеальных симптомов. Наследственный дефект данной патологии идентифицирован. Выявлены 2 типа НАО. При первом, наследуемом аутосомно–доминантно с неполной пенентрантностью, уровень С1–ингибитора снижен (ниже 30% от нормы – 180 мг/л). Первый тип составляет примерно 85% НАО. У больных – гетерозигот НАО I типа экспрессия информационной РНК с дефектного гена отсутствует, нормальный аллельный ген обеспечивает синтез С1–ингибитора на низком уровне. Гомозиготы не выживают. Вследствие повышенного расхода снижены также С2, С4 компоненты. Во время приступа они не определяются вовсе. При II типе отмечается функциональная неполноценность и быстрый распад дефектно синтезируемого белка С1–ингибитора. При этом его уровень может быть высоким, С2 и С4 компоненты также снижены. 2. Псевдонаследственный ангионевротический отек (приобретенный ангионевротический отек) наблюдается при аутоиммунных и лимфопролиферативных заболеваниях, опухолях желудка, кишечника, легких, печени, матки, яичников [5]. Связан с образованием иммунных комплексов при лимфопролиферации, которые в избыточном количестве активируют СК, приводя к выработке большого количества анафилотоксинов (ПАО I типа). Семейный анамнез у таких пациентов отрицательный. Иногда такой ангионевротический отек является первым клиническим проявлением лейкоза. Отмечены случаи развития злокачественных лимфопролиферативных заболеваний через 7 лет после развития первых атак приобретенного АО. Характеризуется снижением уровней C1q, С2, С4 компонентов, С1–ингибитора. При II типе приобретенного отека обнаруживаются аутоантитела к С1–ингибитору, блокирующие его функцию [6]. Характерно также снижение уровней C1q, С2, С4 компонентов, однако С1–ингибитор количественно не снижен. Клинические проявления приобретенного АО такие же, как и при НАО. При обследовании больных необходимо исключение опухолевого процесса, в том числе лимфопролиферативных заболеваний, выявление аутоантител к различным органам и тканям [7]. 3. Отмечена возможность развития ангионевротического отека при введении некоторых лекарственных средств (декстраны и рентгеноконтрастные вещества). Они вызывают активацию системы комплемента альтернативным путем. Диагностика В диагностике АО аллергического генеза важное место занимает специфическая аллергодиагностика , направленная на выявление причинного аллергена. Используют данные аллергологического анамнеза, кожного тестирования, провокационных проб, лабораторное тестирование. При изучении анамнеза заболевания выясняют связь развития отеков с приемом пищевых продуктов и добавок, лекарств, укусами насекомых, воздействием латекса, использованием определенных косметических средств, а также контактами с животными. Подтверждающималлергический характер заболевания является выявление атопических заболеваний у больного и его кровных родственников – аллергического риноконъюнктивита, атопической бронхиальной астмы, атопического дерматита. Для выявления виновного пищевого аллергена используют анализ пищевого дневника, в котором пациент указывает все съеденные продукты, характер их обработки, количество, время и характер развития аллергических симптомов (крапивница, ангионевротический отек, обострение атопического дерматита, бронхиальной астмы и аллергического ринита, оральная аллергия, гастроинтестинальная диспепсия), эффективность принимаемых для купирования аллергии средств. Обычно удается установить или предположить значимый аллерген или группу аллергенов, выявить перекрестно реагирующие аллергены. Выявленный аллерген исключается из диеты больного, что улучшает течение атопических заболеваний. Эффективность элиминационной диеты подтверждает этиологическую значимость исключенных пищевых аллергенов. Возможно проведение провокационного теста, когда на фоне строгой элиминационной диеты вводится предположительно значимый аллерген. Обострение заболевания указывает на роль вводимого аллергена. Провокационные пробы противопоказаны, если ангионевротический отек развился в составе общей генерализованной реакции – анафилактического шока. Для лекарственной аллергии характерно развитие аллергической реакции на второе и последующее введение препарата. Развитие реакции на второй неделе использования нового косметического средства характерно для аллергии на его компоненты. Аллергический характер АО подтверждается также положительными кожными пробами и повышенным уровнем специфических IgE. Дифференциальный диагноз Дифференциальный диагноз при ангионевротическом отеке необходимо проводить с наиболее распространенными в терапевтической практике отеками – сердечная недостаточность, нефротический синдром, гипотиреоз. АО обычно асимметричен, поэтому особенно важна дифференциальная диагностика со всеми другими состояниями, вызывающими локальный асимметричный отек ткани (рис. 1): – воспалительный отек, возникающий при фурункулезе, остром гландулярном хейлите, роже, целлюлите, тромбофлебите, лимфангиите, абсцессе, флегмоне. Эти состояния сопровождаются выраженными общими симптомами (токсический синдром и лихорадка). Из местных особенностей – гнойный процесс, резкая боль, гиперемия места поражения; – токсические отеки – укусы ядовитых змей, животных, насекомых – хорошо распознаются на основе анамнеза. Местно обычно заметен след от укуса; – мягкие лимфатические отеки (лимфедема) в начальной стадии первичной или вторичной слоновости характеризуются появлением, усилением при длительном стоянии, в жаркую погоду, уменьшаются в положении лежа; они тестоватой консистенции, при надавливании оставляют ямку, кожа не изменена, легко смещается. При развитии слоновости происходит уплотнение дистальных отделов конечности, утолщение кожи, она плохо смещается, ямка при надавливании не остается. В этой стадии важное значение имеет анамнез – длительное существование отека, постепенное нарастание его, выяснение возможных причин развития вторичной слоновости (перенесенный лимфангиит, лимфаденит, рецидивы рожи, пиодермии, ожоги, лучевая терапия, сдавление лимфатических сосудов рубцами); – лимфостаз в области губ приводит к развитию гранулематозного хейлита Мишера, при котором наряду с хроническим отеком губ отмечается увеличение языка, парез лицевого нерва; – при синдроме верхней полой вены возникают отек, цианоз лица, шеи, верхней половины туловища и рук, усиливающийся при наклоне вперед, телеангиоэктазии, носовые, пищеводные, трахеальные кровотечения, осиплость голоса, связанная с отеком голосовых связок; – после удаления у женщин молочной железы возможно развитие постмастэктомического отека руки, возникающего в результате лимфоблока и нарушения венозного оттока. Для уточнения механизма используют прямую и непрямую лимфографию, флебографию, функциональную флебоманометрию. На втором этапе дифференциального диагноза необходимо установить механизм и причину развития АО. Это важно для выбора патогенетического лечения. Особенности разных видов АО представлены в таблице 1. Лечение Лечение включает купирование неотложных состояний. Консервативная фармакотерапия проводится исходя из определенной формы АО. Тактика лечения, представленная в терапевтическом алгоритме (рис. 2), определяется возможным развитием при аллергическом АО отека гортани и анафилактического шока. При отеке гортани парентерально вводится адреналин, глюкокортикостероиды, антигистаминные средства. Местно проводятся ингаляции сосудосуживающих р–ров (0,1% адреналин, 5% эфедрин, нафазолин), ? –стимуляторы. При неэффективности консервативной терапиинеобходима срочная госпитализация в ЛОР–отделение, проведение интубации, трахеостомии, коникотомии. При анафилактическом шоке проводят следующие мероприятия: по возможности прекращают поступление в кровоток аллергена; обеспечивают проходимость дыхательных путей (воздуховод, интубация, трахеостомия, коникотомия), устраняют бронхоспазм (ингаляционные ? 2–адреностимуляторы – через небулайзер, теофиллин); при гипоксии проводят ингаляцию чистым кислородом, ИВЛ. Закрытый массаж сердца при остановке. Парентерально обязательно вводят прессорные амины (адреналин, норадреналин, допамин). Активно используют патогенетические средства – глюкокортикоиды, антигистаминные препараты, проводится инфузионная терапия. При отсутствии признаков генерализованой аллергической реакции и отека гортани проводят консервативную терапию. В лечении аллергического отека используются элиминационная терапия, фармакотерапия, образовательные программы. Элиминационная терапия предусматривает ограничение контакта больного с причиннозначимыми аллергенами. При развитии отека Квинке, связанного с лекарственной и пищевой аллергией, на 3–5 дней назначают лечебное голодание, прием внутрь энтеросорбентов, слабительное, очистительные клизмы, после чего индивидуально подбирается элиминационная диета, в которой полностью исключается из рациона «виновный» пищевой продукт, а также облигатные аллергены. Ограничивают прием НПВП, при всех видах отека запрещают прием ингибиторов АПФ. Для профилактики инсектной аллергии рекомендуют меры уменьшения риска контакта с насекомыми. Фармакотерапия аллергического отека включает использование антигистаминных препаратов , реже (при развитии анафилактических реакций и отека гортани) возникает необходимость в использовании адреналина, ГКС. Существуют антигистаминные препараты 3–х поколений. Препараты первого поколения с низкой селективностью к H1–рецептору и 4–12–часовой активностью – наиболее изученные, имеющие длительный стаж применения для купирования различных аллергических состояний. Обладают целым рядом нежелательных свойств: – требуют многократного приема; – оказывают седативное, холинолитическое, гипотензивное действие; – стимулируют аппетит, вызывают расстройства ЖКТ; – через 10–14 дней приема развивается тахифилаксия, требующая смены препарата. Преимуществом этого поколения Н1–блокаторов является наличие парентеральных форм для купирования острых аллергических реакций. Препараты второго поколения лишены недостатков первого поколения Н1–блокаторов: – не проникают через ГЭБ, вследствие чего отсутствует седативный и снотворный эффект; – обладают высокой селективностью к Н1–рецепторам, отсутствует холинолитическая и адренолитическая способность; – быстро и хорошо всасываются из желудка и кишечника, что обеспечивает быстрое начало действия – через 1/2–1 час после приема (за исключением астемизола); – отсутствует связь абсорбции препарата с приемом пищи (возможен прием в любое время); – обладают неконкурентным механизмом связью с рецептором, что обеспечивает прочную связь с ним и высокую продолжительность действия препарата – 18–24 часа. Требуют только однократного приема (за исключением акривастина); – отсутствует тахифилаксия, возможен длительный, более 6 мес. прием препарата. Однако некоторые препараты 2–го поколения (терфенадин и астемизол) обладают кардиотоксическим действием – вызывают удлинение интервала QT на ЭКГ, приводят к возникновению веретенообразной желудочковой тахикардии (синдром пируэта), фибрилляции желудочков. Это действие проявляется при передозировке препарата, угнетении его печеночного метаболизма – при циррозе печени, приеме противогрибковых препаратов – азолов (кетоконазола, итраконазола), антибиотиков – макролидов (эритромицин), грейпфрутового сока. В России терфенадин и астемизол уже не применяются. Н1–блокатором 2–го поколения с наиболее высокой противомедиаторной активностью является лоратадин, хорошо зарекомендовавший себя в практике лечения различных аллергических заболеваний, в том числе и аллергического АО. Применяется у взрослых и детей от 12 лет по 1 таб. в сутки. Эффект проявляется через 30 мин. после приема и сохраняется на протяжении 24 ч. Не обладает тропностью к H1–рецепторам ЦНС (отсутствует седативный эффект), не проявляет антихолинергических и антисеротониновых свойств. Не влияет на психомоторные функции, психические и умственные способности. Обладает слабым сродством к ? –адренергическим и мускариновым рецепторам и, как следствие, практически не вызывает седативного и антихолинэргического эффекта. Из побочных эффектов крайне редко могут появляться: головная боль, утомляемость, кашель, головокружение, тошнота, сердцебиение, повышение аппетита. Препараты третьего поколения – фексофенадин и дезлоратадин являются активными метаболитами препаратов второго поколения – соответственно терфенадина и лоратадина. Кроме высокой активности в блокаде H1–рецепторов, у этих препаратов описаны другие антимедиаторные свойства. Так, многочисленные исследования in vitro (главным образом на клетках человека) и in vivo показали, что, помимо антигистаминной активности, дезлоратадин (Эриус) оказывает противоаллергическое и противовоспалительное действие. В этих исследованиях установлено, что Эриус подавляет каскад различных реакций, которые лежат в основе развития аллергического воспаления, а именно выделение провоспалительных цитокинов, продукцию супероксидного аниона, адгезию и хемотаксис эозинофилов и др. Эриус не проникает через гематоэнцефалический барьер. При его применении в рекомендуемой дозе 5 мг частота сонливости не превышала таковую в группе плацебо. Также применение препарата не сопровождалось статистически или клинически значимыми изменениями со стороны сердечно–сосудистой системы. Дезлоратадин начинает определяться в плазме в течение 30 мин после приема, а его максимальная концентрация достигается в период от 2 до 6 часов. Период полувыведения составляет от 20 до 30 часов (в среднем 27 ч). В исследовании с однократным приемом дезлоратадина в дозе 7,5 мг пища (жирный высококалорийный завтрак) не оказывала влияния на его распределение. В клинических исследованиях характер и частота нежелательных эффектов при применении Эриусабыли в целом сопоставимы с таковыми при применении плацебо. Сведения об антигистаминных препаратах приведены в таблице 2. Образовательные программы для больных , перенесших аллергический АО, проводятся с целью обучения элиминационой терапии (установление для больного индивидуальной гипоаллергенной диеты, перекрестнореагирующих аллергенов, профилактика укусов насекомых, заполнение карточек, браслетов больных аллергией, в которых указаны возможные провоцирующие аллергены). Больного информируют о применяемых при АО лекарственных средствах, указывается на их преимущества и недостатки, подробно разбирается «план действий» в неотложных ситуациях, выдается противошоковый набор. При псевдоаллергическом АО первое место занимают антигистаминные препараты, также важна коррекция воспалительных заболеваний пищеварительного тракта и дисбактериоза – проводится соответствующая терапия. Для лечения острого приступа НАО используется свежезамороженная плазма (содержит С1–ингибитор), ? –АКК . Имеются данные об успешном применении за рубежом концентрата С1–ингибитора, транексамовой кислоты (аналог ? –АКК), апротинина (ингибитор протеаз). Основу лечения при НАО составляет профилактическое постоянное назначение андрогенных гормонов (даназол), усиливающих выработку С1–ингибитора. При противопоказаниях к назначению андрогенов используют ? –АКК per os . При приобретенном АО на первом месте стоит лечение состояний, вызвавших активацию комплемента. Если их не удалось установить или лечение не прерывало атак АО, используют андрогены (одни или в сочетании с глюкокортикостероидами).