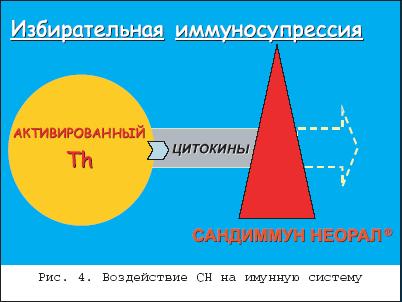
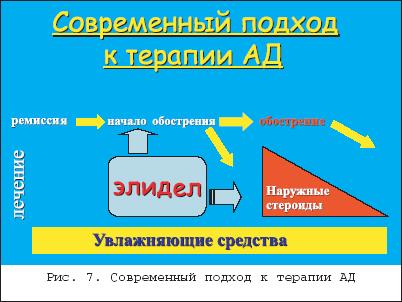
Атопический дерматит (АД) – это один из самых частых и проблематичных дерматозов, заболеваемость которым в мире, по разным данным, может составлять до 5% населения. Начинаясь в раннем детстве, примерно в половине случаев он может протекать долгие годы, то обостряясь, то затихая с характерной сезонной зависимостью. Различные клинические проявления в разных возрастных фазах АД составляют мозаичность его клинической картины при разнообразии факторов, вызывающих обострения, и что едва ли не самое главное – приводят к формированию атопической личности с выраженным в ряде случаев психосоматическим компонентом. Все это в целом лежит в основе известных и постоянных трудностей в лечении больных АД. По единодушному мнению отечественных и зарубежных исследователей, в основе этиопатогенеза атопического дерматита лежит генетическая предрасположеннность к его развитию , которая в различные моменты жизни больного реализуется через разнообразные триггерные механизмы и факторы. Эта предрасположенность, касающаяся прежде всего функционирования иммунной системы, визуализируется в основном сниженной Т–супрессией, которая обеспечивает гиперактивность Т–хелперов, имеющих тенденцию дифференцироваться при антигенном раздражении больше в сторону Т–хелперов второго типа, которые в итоге приводят к одному из основных признаков атопии – гиперпродукции IgE–антител (рис. 1). Все это в целом лежит в основе формирования в коже при антигенном воздействии экзогенного и эндогенного происхождения воспалительной реакции иммунного типа с типичными клиническими характеристиками. Основные особенности функционирования иммунной системы атопических больных лежат на уровне дифференцировки субпопуляций Т–лимфоцитов. Доказано, что антигенная стимуляция Th0 при АД приводит к дифференцировке их больше в сторону Th2 с их характерным цитокиновым профилем, обеспечивая продукцию аллергенспецифических антител, в частности, IgE. У «неатопиков» та же самая антигенная стимуляция обеспечивает сбалансированную дифференцировку в Th1 и Th2. Необходимо иметь в виду, что процесс переключения в пользу Th2, и соответственнок B–клеточной стимуляции, имеет место в центральных иммунологических органах, таких как лимфоидная ткань, и находится под влиянием генетического контроля. Принято считать, что аллергенспецифические Th0, Th1 и Th2 также могут быть обнаружены в периферической крови, как и в случае с аллергенспецифическим IgE. Т–клетки формируют основной состав воспалительного инфильтрата при АД, особенно выраженного в сосочковом слое дермы. Кроме того, рецепторы IgE антител выражены на клеточных мембранах дендритических клеток, и принято считать, что IgE–несущие дендритические клетки приводят к распознаванию антигена. Показано, что на ранних стадиях формирования очага воспаления при атопическом дерматите имеет место экспансия или инфильтрация Th2, в то время как позже доминирующими становятся Th1. Оба эти клона стимулируются IgE–несущими и антиген–распознающими дендритическими клетками, что, как полагают, приводит к сложному цитокиново–медиаторному воздействию, реализующемуся этими клетками, и соответственно – к воспалению и зуду, которые являются основными клиническими характеристиками атопического дерматита [4]. Вместе с тем в настоящее время многими исследователями выделяется подгруппа больных атопическим дерматитом, имеющих клинические проявления, которые укладываются в клинические представления об атопическом дерматите, но не связанные с гиперчувствительностью к аэро– и пищевым аллергенам и обнаруживают нормальные или почти нормальные уровни сывороточных IgE–антител. В анамнезе таких больных отсутствуют указания на другие атопические заболевания, такие как аллергическая астма и риноконъюнктивит. По аналогии с двумя типами бронхиальной астмы – экзогенной и эндогенной – были предложены эти термины и для атопического дерматита, причем эндогенный тип атопического дерматита встречается реже и его частота колеблется от 10 до 40%. Среди иммунологических различий между этими двумя группами, было, в частности, показано сниженное количество в коже Т–клеток, способных продуцировать IL–13 при эндогенном типе. В настоящее время предлагается называть эти два типа атопического дерматита, как IgE–ассоциированный и IgE–неассоциированный атопический дерматит . Такая классификация представляет собой не только академический интерес. С одной стороны, в каждой возрастной группе в связи с этим по–разному организовывается аллергологическое ведение больных, с другой стороны, это может иметь значение для долговременного прогноза в связи с небольшим риском развития атопических респираторных заболеваний в группе с низким уровнем IgE–антител [9]. Начинаясь клинически по большей части на первом году жизни, атопический дерматит примерно в половине случаев заканчивает свое развитие с угасанием всей клинической симптоматики в течение первых 3–х лет жизни. Такое его течение можно назвать абортивным . В тех же случаях, когда имеется выраженная наследственная предрасположенность к атопическим и аллергическим реакциям, заболевание может развиваться долгие годы с формированием типичных клинических критериев Rajka и других признаков атопии, что может быть классифицировано, как классическое течение атопического дерматита. Однако и при таком длительном течении кожная клиническая симптоматика, как известно, постепенно угасает и полностью исчезает в подавляющем большинстве случаев к 40–45 годам жизни. В результате проведенного специального комплекса клинико–анамнестических и катамнестических исследований глубиной до 10 лет нам удалось разработать косвенные прогностические критерии , с помощью которых можно уже на первом году жизни с определенной долей уверенности прогнозировать развитие заболевания по абортивному или классическому типу. Как оказалось, вероятность прогноза развития классического атопического дерматита составит около 90%, если (I) первые кожные проявления заболевания появились у ребенка во второй половине первого года жизни или чуть позже, если при этом (II) имело место быть некачественное грудное вскармливание (позднее прикладывание к груди после родов, раннее отлучение от груди, раннее введение прикорма или вообще искусственное вскармливание) и если к тому же (III) имеется отягощенный семейный атопический анамнез [1]. Клиническая картина АД, с одной стороны достаточно полиморфна, с другой – в большинстве случаев типична. Еще в начале 80–х годов прошлого века были разработаны две группы диагностических критериев АД взрослых, признанные сегодня как критерии Rajka, по имени автора, предложившего их (рис. 2 и 3). Ведущие признаки встречаются практически у всех больных АД, вспомогательные – с большой частотой, но не обязательно у каждого больного. Современные лечебные подходы к атопическому дерматиту разнообразны как по механизмам действия препаратов и методов, так и по скорости наступления терапевтического эффекта. Это предоставляет врачу возможность выбора конкретного метода лечения для конкретного больного в зависимости от индивидуальной выраженности клинической симптоматики. Сегодня терапевтические возможности при АД еще весьма далеки от цели этиотропной направленности на конкретные механизмы генетической предрасположенности и находятся лишь на уровне патогенетического воздействия в лучшем случае, а в большинстве своем носят преимущественно симптоматический характер. Поэтому проблема совершенствования лечения больных этим заболеванием всегдаоставалась и, по–видимому, еще долго будет оставаться весьма актуальной. На практике основными утилитарными целями лечения конкретного больного АД всегда остаются следующие: – устранение или ослабление зуда; – купирование воспалительной реакции в коже; – по возможности, длительное поддержание полученного терапевтического эффекта. Для достижения этих целей в распоряжении дерматолога имеется большой набор средств и методов как системного, так и наружного терапевтического воздействия. Сюда относятся в первую очередь различные антигистаминные средства всех поколений, предоставляющие возможность выбора по индивидуальным показаниям (хлоропирамин, клемастин, кетотифен, лоратадин, дезлоратадин). Назначают антигистамины обычно курсами, продолжительностью 10–15 дней, при необходимости повторными и/или со сменой препаратов при необходимости. Нередко при АД назначают седативные средства, выбор которых зависит от выраженности у больного психосоматического компонента и должен происходить с участием психоневролога. В тяжелых случаях в составе системной терапии могут применяться кортикостероиды , среди которых особой популярностью у отечественных дерматологов пользуется бетаметазон, как более безопасный по сравнению с энтеральными глюкокортикоидами, удобный в практическом применении и с элементами ургентной терапевтической направленности. У части больных АД эффективным оказывается применение UVА и UVB–лучей, а в особо тяжелых случаях экстракорпоральной детоксикации в виде плазмафереза. Особо следует остановиться на терапии упорных формах АД, рефрактерных ко многим другим видам лечения, когда больной теряет надежду на успех терапии вообще. В подобных случаях последнее время все чаще и чаще применяется имунносупрессивный препарат циклоспорин А или Сандиммун Неорал (СН). Впервые примененный в трансплантологии, циклоспорин быстро обнаружил свою клиническую эффективность при некоторых заболеваниях кожи, где в основе патогенеза лежат Т–клеточно опосредованные воспалительные реакции. Это коснулось и атопического дерматита. Главным в механизме терапевтического эффекта СН является подавление активности Т–клеток и снижение их антигенной чувствительности в основном за счет блокирования интерлейкинового механизма. Проникая внутрь клетки, СН связывается с семейством рецепторов под названием циклофилины, которые относятся к иммунофилинам. В итоге через сложные механизмы подавления транскрипции цитокинов активированных Т–клеток наблюдается снижение уровней IL–3, IL–4, ? –IFN, TNF– ? . Кроме того, воздействие СН на В–клетки также подавляет продукцию TNF– ? на их поверхности. Аналогичное снижение IL–3 и IL–4 имеет место и при обработке циклоспорином тучных клеток, а в активированных моноцитах подавляется продукция IL–6. Эти экспериментальные данные доказывают непосредственное подавляющее воздействие СН на цитокиновую продукцию не только Т–клеток, но и других классов иммуноцитов во время иммунного ответа [5]. С другой стороны, СН не оказывает ингибирующего воздействия на Т–супрессоры. Более того, в некоторых экспериментальных системах демонстрируется повышение иммуносупрессивной активности Т–супрессоров под его влиянием. Таким образом, это воздействие СН на иммунную систему в целом может быть охарактеризовано, как избирательная иммуносупрессия (рис. 4). Будучи таким избирательным иммуносупрессором, СН, как следствие, свободен от многих побочных явлений, свойственных классическим цитостатикам и кортикостероидам, и в первую очередь он не подавляет функцию коры надпочечников и костного мозга, не изменяет защиту к вторичной инфекции и не вызывает зависимости. При назначении иммуносупрессивной терапии вообще обычно принимают во внимание четыре основных критерия: тяжесть заболевания, возможную токсичность выбираемого препарата, его относительную эффективность и индивидуальные особенности больного с точки зрения переносимости лечения и сопутствующих заболеваний. Здесь важно помнить, что главным критерием выбора при решении вопроса о назначении циклоспориновой терапии при АД является именно тяжесть и упорство заболевания к другим видам терапии. Первые сообщения о применении СН при АД у взрослых относятся к 1987 г. В последующие годы накопилось огромное число свидетельств в пользу высокой клинической эффективности СН как у взрослых больных АД, так и у детей, как в открытых исследованиях, так и в плацебо–контролируемых двойных слепых методах, как по ближайшим результатам, так и в отдаленные сроки наблюдения. В наших исследованиях [1] находилось 87 больных АД: 60 взрослых в возрасте от 19 до 31 года и 27 детей предпубертатного и пубертатного возраста (9–13 лет). У всех больных АД имел классическую форму, отвечая основным критериям классификации Rajka. Общей клинической особенностью всех больных былаособая резистентность кожного процесса к ранее проводимой классической терапии, а у взрослых, в ряде случаев, и к системным кортикостероидам. Именно резистентные формы заболевания и явились основным показанием к применению нами СН при АД. В группе взрослых больных СН назначали в виде раствора или капсул для приема внутрь по схеме стартовой дозы в 3–5 мг/кг веса в сутки, разделенной пополам для утреннего и вечернего приема. Через неделю от начала лечения в зависимости от динамики клинической картины у каждого больного дозу подбирали либо в сторону повышения, либо понижения для получения нужного терапевтического эффекта с последующим ее постепенным снижением при сохранении положительной клинической динамики. В итоге средняя групповая доза составила 1–2 мг/кг/сутки, а продолжительность курса лечения колебалась от 5 до 7 недель. В группе детей начальная доза Неорала была 5 мг/кг/день, по мере улучшения состояния больного ее постепенно снижали, в ряде случаев до 2 мг/кг/день, при сохранении терапевтического эффекта. Среднесуточная доза составила, таким образом, 3 мг/кг при общей продолжительности лечения от 4 до 6 недель. Несколько более высокие дозы СН у детей связаны с более интенсивными процессами метаболизации у детей вообще, что было показано еще в ранних работах по изучению концентрации СН в крови. Какой–либо другой системной терапии больные обеих групп не получали. Местно, по показаниям, разрешалось применение стероидных мазей, предпочтительно нефторированных, в основном для противозудного эффекта и для смазывания выраженных участков воспаления на открытых участках тела. Каждые две недели больным проводили контроль сывороточного креатинина и регулярно измеряли артериальное давление. Эффективность действия СН оценивали по трем параметрам. Первым параметром была динамика основных клинических проявлений заболевания, определяемая с помощью Дерматологического индекса шкалы симптомов (ДИШС). Индексировали 9 основных клинических проявлений заболевания: эритему, отек, мокнутье, лихенификацию, папулы, сухость, шелушение, трещины и зуд, оценка которых осуществлялась по 4–балльной шкалеот 0 до 3. Сумма всех индексов и ялялась показателем ДИШС на данный момент времени. По нашим предварительным данным при сравнении со SCORAD ДИШС является более чувствительным и лабильным методом оценки динамики клинических симптомов , т.к позволяет не учитывать степень распространенности процесса. Вторым параметром оценки был Дерматологический индекс качества жизни (ДИКЖ) – русифицированная версия индекса Finlay – DLQI, позволяющий оценивать снижение качества жизни дерматологического больного под давлением имеющихся кожных объективных и субъективных симптомов заболевания, развивающихся в данный отрезок времени. Оценка производится с помощью ответов самих больных на 10 вопросов специальной анкеты, касающихся основных сторон жизни и деятельности человека. На каждый вопрос больной выбирает один из четырех предлагаемых ответов, за которыми закреплены индексы от 0 до 3. Чем выше суммарный индекс из 10 ответов, тем «ниже качество жизни». И, наконец, третьим параметром была оценка необходимости применения местных кортикостероидных средств в виде мазей или кремов с точки зрения частоты смазывания и количества используемой мази в процентах к исходной потребности. Оценка состояния больных по всем параметрам проводилась до начала терапии и после окончания лечения. При клиническом наблюдении за больными, получавшими СН, оказалось, что наиболее выраженной динамика угасания симптомов заболевания наблюдалась в первую неделю приема препарата. Так, ощущение зуда в первые 5–7 дней ослабевало на 50–70% у большинства больных. Заметное угасание эритематозного компонента воспаления имело место к 7–10–му дню. Это позволяло осуществлять снижение дозы Неорала на 0,5–1 мг/кг/день. Явления лихенификации и папулезные элементы подвергались регрессу более замедленно, и их уплощение и рассасывание становились заметными спустя 2–3 недели от начала терапии. В дальнейшем динамика процесса улучшения состояния больных становилась в целом все более «пологой». В результате лечения в группе взрослых больных общий клинический эффект в виде клинической ремиссии и значительного улучшения составил 60,7% и улучшение наблюдалось у 32,1%. Показатель ДИКЖ снизился с 19,3±1,1 перед началом терапии до 4,1±0,5 (р<0,001) после ее окончания; ДИШС упал к концу лечения с 18,7±0,9 до 5,2±0,65 (р<0,001), а необходимость в местных стероидах уменьшилась до 10% (фото 1 и 2). В группе детей из 25 больных у 19 достигнуты клиническая ремиссия или значительное улучшение. Показатель ДИКЖ улучшился с 23,6±1,5 до 5,0±0,7 (р<0,001); ДИШС – соответственно с 16,7±0,8 до 3,1±0,5 (р<0,001), а потребность в местных стероидах снизилась до 12%. Таким образом, многолетний зарубежный и отечественный опыт применения СН показывает, что он является безопасным, эффективным и хорошо переносимым методом лечения с невыраженными дозозависимыми побочными эффектами и может быть рекомендован в качестве метода выбора при тяжелых, распространенных, упорныхк другим видам системной терапии формах атопического дерматита как у взрослых, так и у детей. Среди всех существующих сегодня наружных методов терапии АД первое место по результативности и скорости наступления клинического эффекта принадлежит как по мнению врачей, так и самих пациентов кортикостероидным средствам. Наиболее популярными среди отечественных дерматологов сегодня признаны мази, содержащие флуметазон, триамцинолон, бетаметазон + клотримазон + гентомицин, мометазон, метилпреднизолон. Последние два препарата относятся к нефторированным и обладают меньшим риском побочных действий. Назначаемые обычно в виде кремов или мазей наружные стероиды быстро обеспечивают противозудный и противовоспалительный эффект, что полностью соответствует ожидаемому достижению ближайших целей лечения, упомянутых выше. К назначению стероидов при АД чаще всего прибегают при развитии обострения с целью его быстрого купирования и при наступлении улучшения прекращают их применение. Такая тактика получила название «кризисной» терапии (рис. 5), и ее существование оправдано в попытке вовсе избежать развития известных побочных эффектов стероидных препаратов (рис. 6). Риск развития этих нежелательных эффектов стероидов и одновременно неизбежность «хронического» характера терапевтических мероприятий при АД вообще привели к необходимости разработки других наружных средств, не уступающих по эффективности стероидам и свободных от их побочных эффектов. Ими стали современные иммуномодуляторы с избирательным иммуносупрессивным действием из класса макролидов. К таковым относится пимекролимус , или Элидел (Эл), являющийся клеточно–селективным ингибитором кальциневрина и принадлежащий к классу аскомициновых макролактамов. Особая структура молекулы придает веществу липофильные свойства, что обусловливает его высокое сродство к коже и кожную селективность противовоспалительного действия. Пимекролимус при наружном применении специфично связывается с цитозольным рецептором, макрофилином–12, и ингибирует кальцийзависимую фосфатазу кальциневрин, необходимую для транслокации нуклеарного фактора активированных Т–лимфоцитов в ядро. В результате, блокируя транскрипцию ранних цитокинов, он подавляет активацию Т–лимфоцитов в коже. В частности, в наномолярныхконцентрациях Эл ингибирует синтез в человеческих Т–лимфоцитах IL–2, IL–3, IL–4, IL–8, IL–10, INF– ? , TNF– ? и пролиферацию Т–лимфоцитов в ответ на стимуляцию Т–клеточных рецепторов. Это вещество также препятствует высвобождению из активированных тучных клеток таких медиаторов воспаления, как гистамин, триптаза, TNF– ? [3]. Следует отметить, что в отличие от пимекролимуса кортикостероиды не обладают клеточно–селективным механизмом действия, что и приводит к развитию их известных побочных эффектов. Угнетение синтеза коллагена кортикостероидами вызывает атрофию кожи, а воздействие на клетки Лангерганса приводит к изменению местных механизмов иммунного ответа. Тогда как Эл благодаря строгой селективности действия практически не влияет на местные и системные иммунологические реакции , рост кератиноцитов, фибробластов и эндотелиальных клеток. Кроме того, in vitro после взаимодействия с комплексом антиген/IgE пимекролимус предотвращает антиген/IgE–опосредованное высвобождение цитокинов и медиаторов воспаления из тучных клеток. Скорость прохождении Эл через кожу в 60–110 раз меньше, чем у кортикостероидов, что и лежит в основе его выраженного местного действия [8]. В первых клинических исследованиях Эл назначали при рецидивах АД в качестве терапии первого выбора. При успешном купировании обострения кортикостероиды не применяли вообще, и только при усилении симптомов обострения, по показаниям, больного временно переводили на наружные кортикостероиды. Таким образом, в качестве альтернативы «кризисному» лечению появился совершенно новый подход к терапии АД, который заключается в раннем назначении Эл при первых признаках обострения, что позволяет прервать его дальнейшее развитие. И лишь в случаях упорного развития симптомов воспаления может быть начато применение стероидных средств (рис. 7). Результаты первых исследований показали, что Эл эффективно контролирует симптомы острого состояния (зуд, эритема, отек) у младенцев и детей, больных АД: значительное угасание симптомов наблюдалось уже в течение первой недели терапии, причем этот эффект сохранялся на протяжении последующих 6 недель исследования, а снижение зуда и улучшение сна наступало через 2–3 дня от начала терапии. У взрослых к 3 дню терапии наблюдалось достоверное уменьшение зуда, значительное снижение потребности в кортикостероидах и количества эпизодов обострения в течение 6 месяцев исследования, по сравнению с традиционной терапией [7]. Основной результат исследования сводится к тому, что Эл эффективно контролирует развитие воспаления при АД у большей части больных , в значительной степени уменьшая или полностью отменяя потребность в кортикостероидах. По сравнению с контролем Эл в большей степени обеспечивал поддерживающий эффект на протяжении 12 месяцев. Мета–аналитическая оценка результатов исследований, посвященных пимекролимусу, которые были представлены на 10–м Европейском конгрессе дерматологов, обнаруживает всю широту и глубинуэтих исследований. В целом под наблюдением разных авторов находилось 2039 больных атопическим дерматитом от младенческого возраста до взрослых, страдающих как легкими, так и тяжелыми формами заболевания. Изучались эффективность и безопасность Элидела, качество жизни больных, вошедших в исследование, кратковременное и продолжительное применение препарата, как при обычном нанесении, так и под окклюзию и другие параметры [6]. По результатам этого метаанализа можно заключить, что при раннем применении с момента появления первых симптомов АД у всех категорий больных Эл является единственным не содержащим кортикостероидов кремом с клинически доказанной способностью вызывать абортивное течение обострений и улучшать долгосрочный контроль заболевания. Элидел хорошо переносится взрослыми, детьми и младенцами с 3–х месячного возраста даже при аппликациях на чувствительные области лица и шеи. Он не влияет на структуру кожи и, в отличие от кортикостероидов, не вызывает ее атрофии. Благодаря кожно–селективными свойствам Эл, его концентрация в крови очень низка даже при применении на значительной площади поверхности тела. Крем Элидел обладает благоприятным профилем безопасности: во всех исследованиях не было зарегистрировано системных побочных эффектов у больных, леченных в течение 1 года. Редко отмечаются такие кожные инфекции как импетиго, простой герпес, контагиозный моллюск, кожные папилломы и фурункулы. В рамках дальнейшего изучения эффективности Элидела под нашим наблюдением находилось 27 пациентов (15 мужчин и 12 женщин) в возрасте от 16 до 34 лет, страдающих средней и легкой степени тяжести АД, включая атопическую экзему кистей [2]. Все пациенты отмечали начало заболевания в детстве, волнообразное течение процесса, а также снижение частоты и силы рецидивов с возрастом. Клиническая картина у всех больных соответствовала известным критериям Rajka. Крем Элидел (1% пимекролимус) наносили легким втиранием в очаги поражения два раза в сутки (утром и вечером). В остальное время больным разрешалось использовать индифферентные увлажняющие и питательные кремы, а по показаниям назначались антигистаминные средства. Лечение продолжалось до исчезновения симптомов заболевания на исследуемых участках или максимально в течение трех недель. Контроль эффективности осуществляли еженедельно по трем стандартным индексам: SCORAD , EASI и ДИШС. К 3–5 дню терапии все пациенты отметили уменьшение зуда (на 47–89%), через 7–10 дней у большинства больных заметно уменьшались объективные симптомы воспаления в виде эритемы и лихенификации. После окончания терапии индексы SCORAD, EASI и ДИШС редуцировали в среднем на 54,3%, 47,2% и 68,7% соответственно, что соответствует понятиям частичной ремиссии и значительного улучшения (фото 3, 4). Каких–либо побочных действий препарата на протяжении всего срока исследования отмечено не было. Таким образом, по данным литературы и нашим собственным, крем Элидел эффективно и быстро подавляет острые симптомы АД (средней и легкой степеней тяжести) у взрослых больных и не уступает в этом кортикостероидам, превосходя их по малому риску развития нежелательных побочных эффектов. В случае применения пимекролимуса при появлении первых симптомов рецидива заболевания, он предотвращает развитие обострения и улучшает качество жизни больных. В заключение необходимо сказать, что современные достижения клинической иммунологии позволяют специалистам более углубленно понять иммунопатогенетические механизмы атопического дерматита, что в свою очередь, приводит к разработке новых, все более целенаправленных патогенетических методов лечения этого заболевания, а также к совершенствованию и большей эффективности современных терапевтических подходов к АД.