В настоящее время накоплен огромный опыт эффективного лечения СД, что позволяет значительно улучшить качество жизни пациентов с этим заболеванием как в краткосрочной, так и в долгосрочной перспективе.
Результаты многоцентровых международных исследований, опубликованные за последние 20 лет, позволили определить целевые уровни показателей углеводного обмена для большинства пациентов, что не означает, тем не менее, что эти стандартные показатели пригодны для всех без исключения больных (табл. 1).
Разработка алгоритма лечения СД, определяющего выбор сахароснижающего препарата и дальнейшую тактику ведения больного, является чрезвычайно актуальной задачей современной диабетологии.
Одним из наиболее признанных международных алгоритмов лечения СД 2 типа является совместный алгоритм ADA (Американской диабетологической ассоциации) и EASD (Европейской ассоциации по изучению диабета), предложенный в 2006 г. и измененный в 2009 г. [3,4]. В этом документе предлагается следующая терапия СД 2 типа: терапия 1–го ряда – с наиболее доказанным терапевтическим эффектом и терапия 2–го ряда – с меньшим уровнем доказанности. Целью сахароснижающей терапии является достижение и поддержание уровня HbA1c<7%.
Терапия 1–го ряда: применение метформина и активное изменение образа жизни являются первыми базовыми мероприятиями при установлении диагноза СД 2 типа. Если это лечение не приводит к достижению поставленной цели по снижению гликемии в течение 2–3 мес. после инициации терапии (т.е. уровень НbА1с>7%), то следует добавить второй сахароснижающий препарат: либо препарат сульфонилмочевины (ПСМ), либо инсулин (предпочтителен у лиц с HbA1c>8,5% или при наличии симптомов выраженной гипергликемии). Если же сочетанное применение метформина, ПСМ/базального инсулина и изменение образа жизни не приводят к достижению цели, то должна быть начата или интенсифицирована инсулинотерапия.
Терапия 2–го ряда: дополнительно к метформину и модификации образа жизни предлагается назначать тиазолидиндион (пиоглитазон) либо агонист рецепторов ГПП–1 (эксенатид). Если на фоне терапии препаратами 2–го ряда через 3 мес. целевой уровень HbA1c не достигается, то возможно или добавление препаратов ПСМ, или переход на базис–болюсную инсулинотерапию.
Подобный подход во многом базируется на современном понимании патофизиологических механизмов развития СД. Хорошо известно, что в основе развития СД 2 типа лежат три основных эндокринных дефекта: нарушение секреции инсулина, инсулинорезистентность жировой и мышечной тканей и инсулинорезистентность печени. Резистентность к инсулину может уменьшаться в результате снижения веса и/или под влиянием лекарственных препаратов, однако она редко восстанавливается до нормальной. Секреция инсулина у этих больных неполноценна и недостаточна для того, чтобы компенсировать инсулинорезистентность [5]. Уже в момент установления диагноза СД 2 типа функционирует лишь 50% β–клеток, и в дальнейшем секреция инсулина продолжает снижаться на 5–6% в год.
Таким образом, подавляющему большинству пациентов с СД 2 типа уже на ранних этапах заболевания требуется применение препаратов, влияющих на секрецию инсулина. К таковым традиционно относят ПСМ, меглитиниды, а также новые классы – инкретиномиметики и ингибиторы дипептидилпептидазы–4 (ДПП–4). Однако если для ПСМ накоплен более чем 50–летний опыт применения, то долгосрочные эффекты и безопасность инкретиномиметиков и ингибиторов ДПП–4 требуют дальнейшего анализа.
Принимая во внимание недостатки алгоритма ADA/EASD 2009 г., а именно:
• отсутствует персонифицированный подход к лечению пациентов;
• не учитывается исходный уровень HbА1c при назначении стартовой терапии;
• ограничен выбор сахароснижающей терапии в дебюте заболевания;
• предлагается высокий темп интенсификации терапии в дебюте заболевания (каждые 2–3 мес.);
• не определено место препаратов инкретинового ряда;
совет экспертов Российской ассоциации эндокринологов (РАЭ) представил для обсуждения Консенсус по инициации и интенсификации сахароснижающей терапии СД 2 типа [6], взяв за основу модель алгоритма ААСЕ/АСЕ 2010 г. [7].
В представленном проекте алгоритма РАЭ главный акцент сделан на индивидуальный подход к лечению пациента, безопасность и эффективность лечения. По мнению экспертов РАЭ, эти параметры являются гораздо более важными, чем стоимость препарата или длительность его использования в клинической практике.
При выборе индивидуального целевого уровня HbA1c следует учитывать:
• возраст пациента;
• ожидаемую продолжительность жизни;
• наличие тяжелых осложнений;
• риск развития тяжелых гипогликемий.
Согласно представленному Консенсусу, при выборе стартовой сахароснижающей терапии следует учитывать исходный уровень HbA1c. Препаратами первого ряда для начала лечения при уровне HbA1c 6,5–7,5% являются метформин, ингибиторы ДПП–4, агонисты рецепторов глюкагоноподобного пептида–1 (ГПП–1).
В качестве альтернативных препаратов для начала лечения в особых случаях могут быть использованы ПСМ, глиниды, тиазолидиндионы, ингибиторы альфа–глюкозидазы. ПСМ не рекомендуются для применения в качестве препаратов первого ряда при исходном HbA1c 6,5–7,5% в связи с наличием таких побочных действий, как риск развития гипогликемий и прибавка массы тела. Назначение этих препаратов может быть оправдано только при отсутствии избыточной массы тела или ожирения (что свидетельствует в пользу сниженной секреции инсулина у конкретного пациента), при наличии непереносимости или противопоказаний к применению препаратов с низким риском гипогликемии. Из препаратов ПСМ предпочтительно назначение гликлазида МВ или глимепирида. Препарат глибенкламид не рекомендуется в качестве стартового сахароснижающего средства, поскольку ассоциирован с наиболее высоким риском гипогликемий [8].
При исходном уровне HbA1c 7,6–9,0% сразу с момента диагностики СД 2 типа целесообразным является назначение комбинации двух сахароснижающих препаратов, воздействующих на разные механизмы развития заболевания: инсулинорезистентность и секрецию инсулина. К наиболее рациональным комбинациям относятся сочетания метформина и препаратов, стимулирующих секрецию инсулина: ингибиторов ДПП–4, агонистов ГПП–1, ПСМ или глинидов. У больных с выраженной декомпенсацией углеводного обмена (при HbA1c >8,5%) предпочтение отдается комбинации метформина с ПСМ или с инсулином.
При исходном уровне HbA1c>9,0% лечение СД 2 типа должно начинаться с инсулинотерапии. Режимы инсулинотерапии могут быть различными, в том числе возможны комбинации инсулина продленного действия с пероральными сахароснижающими препаратами (ПССП), в том числе и с ПСМ. Если в течение 6 мес. инсулинотерапии достигнуты индивидуальные цели гликемического контроля или уровень HbA1c снизился более чем на 1,5%, то возможен переход на комбинацию двух или трех ПССП с отменой инсулина.
Таким образом, препараты ПСМ на сегодняшний день остаются одним из основных классов сахароснижающих препаратов и могут быть рекомендованы при разной степени декомпенсации углеводного обмена как в виде монотерапии, так и в комбинации с метформином, инсулином и с инкретинами.
«Патофизиологические механизмы, лежащие в основе сахарного диабета, продолжают быть предметом дискуссии, однако очевидно, что это заболевание сопровождается количественными и качественными нарушениями секреции инсулина. Производные сульфонилмочевины останутся в обозримом будущем противодиабетическими препаратами первого выбора», – пишет G. Crepaldi, определяя важное место ПСМ в лечении СД 2 типа.
В настоящее время выделяют три поколения ПСМ. К первому поколению относится хлорпропамид, который в России давно не используется. Характеристика препаратов представлена в таблице 2.
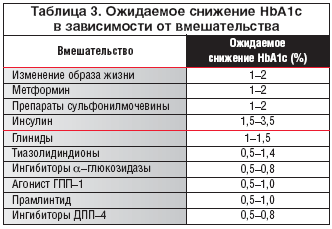
Сахароснижающий эффект ПСМ обусловлен стимуляцией секреции инсулина. ПСМ эффективны только тогда, когда имеется достаточное количество функционально активных β–клеток. Их стимулирующее влияние на секрецию и высвобождение инсулина усиливается в присутствии глюкозы. Эффективность ПСМ и других сахароснижающих препаратов при монотерапии представлена в таблице 3.
Мишенью для действия ПСМ являются АТФ–чувствительные калиевые каналы (КATP каналы). Данные структуры представляют собой октамерный комплекс [9,10], образованный из двух белковых субъединиц, одна из которых является рецептором к сульфонилмочевине (sulfonylurea receptor SUR (SUR1 или SUR2)), вторая – формирующая пору субъединица Kir 6.х (Kir 6.1 или Kir 6.2). Субъединица SUR1 выполняет регуляторную функцию по отношению к субъединице Kir 6.2. Именно она вступает в соединение с ПСМ. Субъединица Kir 6.х формирует в клеточной мембране пору для селективного переноса ионов калия, и с этой субъединицей связывается АТФ при закрытии калиевого канала. Обеспечивая изменение мембранного потенциала, КATP каналы участвуют в регуляции обменных процессов в разных тканях, включая β–клетки, сердце, скелетные мышцы, гладкомышечную ткань сосудов, ткань мозга. КATP каналы имеют тканевую специфичность, что зависит от структуры и молекулярной массы составляющих субъединиц, что, в свою очередь, определяет электрофизиологические свойства тканей и их реакцию на различные факторы и лекарственные препараты [11]. В β–клетке КATP каналы состоят из субъединиц Kir 6,2 и SUR1, в миокарде КATP каналы включают субъединицы Kir 6.2 и SUR2А, в гладкомышечных клетках сосудов – Kir 6.1 и SUR2В. Исследования на грызунах выявили важную роль КATP каналов в качестве метаболических сенсоров при возникновении таких метаболических стрессов, как гипергликемия, гипогликемия, ишемия и гипоксия.
В сердце активация КATP каналов во время ишемии способствует уменьшению повреждения миокарда. Данный феномен называют ишемическим прекондиционированием. В стенке сосудов КATP каналы участвуют в регуляции мышечного тонуса и играют важную роль в регуляции артериального давления. В коронарных артериях КATP каналы участвуют в вазодилатации в ответ на ишемию. КATP каналы (Kir 6.2 /SUR1) гипоталамуса принимают участие в регуляции секреции глюкагона в ответ на гипогликемию, а также в регуляции продукции глюкозы печенью.
В β–клетках КATP каналы регулируют индуцируемую глюкозой секрецию инсулина. Попадание глюкозы внутрь клетки и ее метаболизм приводят к увеличению концентрации ATФ, что, в свою очередь, вызывает закрытие КATP каналов, деполяризацию мембраны β–клетки и открытие вольтаж–зависимых кальциевых каналов. Увеличение внутриклеточного кальция является пусковым моментом для экзоцитоза гранул инсулина.
ПСМ стимулируют высвобождение инсулина также путем прямого связывания с SUR субъединицей и закрытия КATP каналов.
Однако все ПСМ имеют определенные недостатки большей или меньшей степени выраженности, которые не позволяют во всех случаях добиваться стойкой компенсации диабета и нормализации показателей углеводного обмена как на протяжении длительного времени, так и на протяжении суток. Последнее связано с тем, что пик действия любого ПСМ и изменение постпрандиальной гипергликемии не совпадают по времени. Это приводит, с одной стороны, к недостаточному снижению уровня глюкозы в крови, а с другой – к развитию гипогликемии различной степени выраженности после приема пищи, особенно в случае ее недостаточного количества или пропуска. Кроме того, длительное применение ПСМ приводит к истощению функции β–клеток поджелудочной железы, что сопровождается ухудшением компенсации СД.
Во второй половине 1990–х гг. для лечения СД 2 типа был предложен Амарил (глимепирид) – оригинальный ПСМ третьего поколения. Это первый из всех ПСМ, обладающий истинным пролонгированным действием (не за счет изменения скорости высвобождения из капсулы или таблетки) и низкой терапевтической дозой.
Поскольку глимепирид является ПСМ, его действие осуществляется через связывание с рецептором сульфонилмочевины на поверхности β–клетки. Однако в противоположность другим препаратам глимепирид взаимодействует с частью рецептора сульфонилмочевины, обозначаемым SURX и имеющим молекулярный вес 65 кДа [12]. Для идентификации участков связывания использовали меченые радиоактивной меткой препараты – глимепирид и глибенкламид. Ассоциацию с рецептором и диссоциацию оценивали по фотоаффинности. В качестве субстрата брали культуру интактных мембран β–клеток. В результате было установлено, что меченый глибенкламид связывался с белком мембраны с молекулярным весом 140 кДа, тогда как меченый глимепирид – с белком с молекулярным весом 65 кДа. На основании полученных данных было установлено, что связывание и высвобождение глимепирида из связи со своим рецептором происходит иначе, чем у глибенкламида, – оба процесса протекают быстрее. Модель этого связывания предложена Muller G. (2000) [13].
Глимепирид обладает рядом уникальных и очень полезных свойств. Этот препарат обеспечивает оптимальный контроль гликемии в течение суток при однократном утреннем приеме, при этом уровень инсулинемии значительно ниже, чем при использовании других производных сульфонилмочевины.
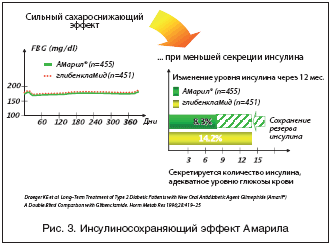
При изучении in vitro и in vivo влияния глимепирида, глипизида, глибенкламида и гликлазида на уровень глюкозы крови и секрецию инсулина в течение 36 ч после приема перечисленных препаратов было установлено, что глимепирид в дозе 90 мкг/кг вызывал максимальное снижение содержания глюкозы в крови при минимальной секреции инсулина; глипизид в дозе 180 мкг/кг обладал самой низкой сахароснижающей активностью и вызывал максимальное увеличение секреции инсулина; глибенкламид в дозе 90 мкг/кг и гликлазид в дозе 1,8 мг/кг занимали промежуточное положение между двумя экстремальными показателями. Кривые динамики концентрации инсулина и глюкозы в крови при применении указанных ПСМ были практически идентичными. Однако при определении коэффициента (среднее увеличение уровня инсулина в плазме к среднему снижению содержания глюкозы в крови) эти показатели оказались неодинаковыми: глимепирид – 0,03; гликлазид – 0,07; глипизид – 0,11 и глибенкламид – 0,16. Это различие было следствием более низкой секреции инсулина: у глимепирида средний уровень инсулина в плазме составил 0,6 мкЕД/мл, у гликлазида – 1,3; у глипизида – 1,6 и глибенкламида – 3,3 мкЕД/мл [13]. Наименьшее стимулирующее влияние глимепирида на секрецию инсулина обеспечивает меньший риск развития гипогликемии. Риск гипогликемий при приеме глимепирида также достоверно ниже, чем при приеме глибенкламида (рис. 1).
Интересным является тот факт, что глимепирид не вызывает прибавки массы тела и способствует ее снижению, тогда как увеличение массы тела и частые гипогликемии являются основными побочными эффектами у других сульфониламидных препаратов (рис. 2).
Изучение фармакокинетики глимепирида показало, что для него характерны (3):
• быстрое и полное всасывание;
• 100–процентная биодоступность;
• период полувыведения – 8 ч, что дает возможность контролировать гликемию в течение суток;
• двойной путь выведения: 58% – через почки и 35% – через ЖКТ;
• метаболиты неактивны.
Важным свойством глимепирида является возможность его однократного приема утром, независимо от приемов пищи. Это качество значительно увеличивает комплаентность, что во многом определяет успех терапии. Кроме того, установлено, что однократный прием 6 мг глимепирида так же эффективно влияет на секрецию инсулина и С–пептида, как двукратный прием 3 мг этого препарата [14]. Прием пищи существенным образом не влияет на абсорбцию препарата, только незначительно снижает ее скорость. Максимальная концентрация в плазме достигается примерно через 2,5 ч после перорального применения.
Глимепирид выпускается в четырех различных дозировках: 1 мг, 2 мг, 3 мг, 4 мг, что позволяет подобрать максимально эффективную дозу для каждого пациента.
Глимепирид является одним из немногих ПСМ, чье экстрапанкреатическое действие доказано. Как показали исследования на изолированных кардиомиоцитах крысы, периферический сахароснижающий эффект глимепирида обусловлен его влиянием на экспрессию глюкозных транспортеров (ГЛЮТ1 и ГЛЮТ4 на 164% и 148% соответственно), что сопровождалось увеличением поглощения глюкозы в сердечной мышце [15].
В работах Draeger K.E. c cоавт. (1996) [16] было показано, что глимепирид снижает уровень гликемии так же эффективно, как глибенкламид. Однако уровень инсулина при этом оказался значительно ниже (рис. 3). Из полученных данных был сделан важный вывод, что глимепирид обладает инсулинсберегающим действием.
Глимепирид препятствует образованию глюкозы в печени, повышая внутриклеточную концентрацию фруктозо–2,6–дифосфата, который, в свою очередь, ингибирует глюконеогенез.
Глимепирид оказывает значительно меньшее воздействие на сердечно–сосудистую систему, чем традиционные ПСМ – глибенкламид, гликлазид или глипизид. Было изучено влияние связывания глимепирида с КATP калиевыми каналами кардиомиоцитов и гладкомышечных клеток. В норме КATP калиевые каналы кардиомиоцита закрыты. В условиях ишемии происходит приоткрытие калиевых каналов, и ионы калия выходят из клетки. Увеличивается электрический потенциал мембраны и ограничивается приток ионов Са. Наступает расслабление мышц. Это приводит в итоге к более экономному расходованию высокоэнергетических фосфатов кардиомиоцитами в условиях ишемии.
Этот процесс называется ишемическим прекондиционированием, или ишемической предподготовкой. Ее физиологический смысл заключается в том, что в условиях ишемии сердце само себя защищает от инфаркта. Ишемическая предподготовка возникает при автоматическом открытии КATP зависимых каналов сердца во время кратковременного эпизода мягкой ишемии миокарда. Блокада КATP каналов сердца препаратами может стать пагубной для миокарда в состоянии ишемии за счет подавления ишемической предподготовки. Ряд препаратов, производных СМ (глибенкламид и толбутамид), связываются с КATP зависимыми каналами как β–клетки, так и кардиомиоцита. По этой причине глибенкламид упраздняет кардиопротективный эффект ишемической предподготовки за счет закрытия калиевых каналов [17,18].
Глимепирид связывается с другим рецептором на β–клетке, не влияя на прекондиционирование миокарда. Эти данные были получены в клиническом исследовании Klepzig H. с соавт. (1999). Трем группам пациентов проводилось 3 дилатации коронарных артерий путем инфляции баллона для имитации ишемии. Затем вводили препараты – Амарил, глибенкламид или плацебо. Оценивали по ЭКГ депрессию сегмента ST в максимальных и средних его значениях. Оказалось, что глимепирид вызывал уменьшение депрессии сегмента ST на 34% (плацебо – на 35%), что позволило сделать вывод об отсутствии его влияния на ишемическую предподготовку. Глимепирид также снижал максимальную депрессию сегмента ST (показатель ишемии) на 33% (плацебо – на 40%), в то же время эффект глибенкламида был незначительным (рис. 4).
Сердечно–сосудистые осложнения – основная причина смерти у больных СД. Инфаркт миокарда (ИМ) является одной из самых опасных причин, т.к. влечет за собой и высокий риск внезапной смерти, и последующее снижение сократительной функции миокарда, т.е. развитие сердечной недостаточности. В связи с этим важным является вопрос безопасности того или иного вида длительной сахароснижающей терапии в отношении влияния на сердечно–сосудистую систему, риск развития ИМ и его исходов. Данные проведенных многолетних исследований не выявили преимуществ какой–либо группы препаратов и являются противоречивыми.
Первые проспективные многолетние исследования (UGDP – University Groop Diabetes Program Study, UKPDS – United Kingdom Prospective Diabetes Study) не дали внятного ответа в отношении влияния препаратов сульфонилмочевины на развитие макрососудистых осложнений. Вместе с этим в исследовании UKPDS было впервые установлено, что терапия метформином способствует снижению риска сосудистых осложнений на 32%, смертности от диабета – на 42%, общей смертности – на 36% и снижает риск развития ИМ на 39%. Таким образом, было доказано преимущество терапии метформином в сравнении с терапией глибенкламидом, хлорпропамидом и инсулином.
С целью анализа взаимосвязи предшествующего лечения ПСМ и исходов ИМ был проведен анализ регистра пациентов, поступивших в отделения интенсивной терапии во Франции в ноябре 2000 г. с острым ИМ (менее 48 ч от начала симптомов) [19]. Среди 2320 пациентов этого регистра 487 (21%) страдали СД, из них 215 (44%) получали ПСМ. Больные, получавшие ПСМ, были старше и чаще имели повышенный уровень холестерина. Характер и локализация поражения миокарда были сравнимы в обеих группах. Результаты анализа показали, что внутрибольничная смертность от ИМ среди больных СД, получавших до госпитализации ПСМ, была ниже (10,2%), чем у больных СД без ПСМ (16,9%) (р=0,035). К сожалению, не был проведен анализ смертности в зависимости от вида препарата. Эта цель была поставлена в исследовании, проведенном в Дании.
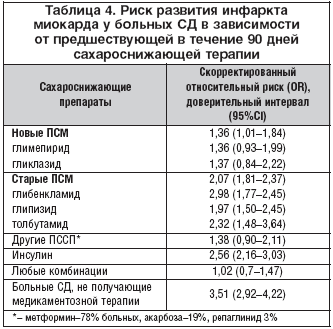
Популяционное исследование по типу «случай – контроль» охватило 6636 больных, впервые госпитализированных в связи с острым ИМ в период с 1994 по 2002 г. Данные были получены из национального регистра – The Hospital Discharge Registry (HDR) of North Jutland Country [20]. В качестве контроля были проанализированы истории болезни 66 839 пациентов соответствующего возраста и пола, имевших факторы риска развития ИМ. После анализа всех данных было показано, что применение любого сахароснижающего препарата ассоциируется с риском развития ИМ. Для пациентов, принимавших в течение как минимум 90 дней перед госпитализацией так называемые «старые» производные СМ (глибенкламид, хлорпропамид, глипизид), скорректированный относительный риск развития ИМ составил 2,07 (95% ДИ, 1,81–2,37) и был достоверно выше, чем для «новых» производных СМ (OР 1,36; 95% ДИ, 1,01–1,84, P=0,01). Риск развития ИМ у пациентов, получавших инсулин, был выше, чем у получавших ПССП (р<0,005). Риск развития ИМ при приеме препаратов, не относящихся к ПСМ (метформин – 78% больных, акарбоза – 19%, репаглинид – 3%) был такой же, как и при приеме «новых» ПСМ. Комбинация ПССП не ассоциировалась с риском развития ИМ. Вместе с тем отсутствие сахароснижающей терапии у больных СД соответствовало максимальному риску госпитализации в связи с ИМ. При анализе более длительной сахароснижающей терапии (в течение 180 дней до госпитализации) существенных различий получено не было (табл. 4).
Одним из последних исследований, специально посвященных оценке смертности больных СД 2 типа, получавших комбинированную терапию метформином и ПСМ, было исследование, проведенное группой ученых из Университета Флоренции под руководством доктора E. Mannucci [21,22]. Оно позволило не только оценить роль комбинированной терапии вообще, но и обозначить уровень сердечно–сосудистой безопасности для каждого отдельного препарата сульфонилмочевины в подобной ситуации. Средняя продолжительность наблюдения за больными составила 31,4±10,4 мес. За 3–летний период было зафиксировано 295 смертей. У больных, получавших комбинированное лечение препаратами сульфонилмочевины и бигуанидами, отмечена достоверно большая смертность (6,4 vs. 5,2%, p<0,05) по сравнению со всеми другими больными.
С целью выяснения различий в уровне смертности среди больных, получавших различные ПСМ в комбинации с бигуанидами, был использован анализ выживаемости по Каплану–Мейеру.
Терапия с глибенкламидом ассоциировалась с достоверно более высокой годовой смертностью (8,7%) по сравнению с репаглинидом (3,1%, p=0,002), гликлазидом (2,1%, p=0,001) и глимепиридом (0,4%, p<0,0001). У пациентов, получавших репаглинид или гликлазид в сочетании с метформином, годовая смертность была достоверно выше, чем у больных на комбинированной терапии с глимепиридом (соответственно, p=0,024 и 0,034). В то же время различия в уровне смертности между репаглинидом и гликлазидом были статистически не достоверны.
Глимепирид может применяться как в качестве монотерапии, так и в комбинации с метформином и инсулином.
В середине 2011 г. на российском рынке появился новый комбинированный препарат Амарил® М: фиксированная комбинация метформина и глимепирида. Пока будет доступен один вариант дозировки: глимепирид 2 мг + метформин 500 мг. Данная комбинация позволяет воздействовать как на секрецию инсулина, так и на периферическую чувствительность тканей к инсулину и имеет все преимущества комбинированного препарата.
Заключение
В заключение можно отметить, что в клинической практике имеется эффективный сахароснижающий препарат Амарил® (глимепирид), обеспечивающий хороший контроль гликемии при однократном приеме, способствующий снижению массы тела, не имеющий побочных действий, обладающий экстрапанкреатическим инсулинсберегающим эффектом, безопасный при назначении лицам с сердечно–сосудистыми заболеваниями, с большим диапазоном дозировок. Все эти свойства делают Амарил® (глимепирид) одним из ведущих сахароснижающих препаратов в лечении СД 2 типа.
![Таблица 1. Целевые показатели контроля углеводного обмена при СД 1 и 2 типа [2]](/data/articles/Image/t19/n27/1707-1.gif)




Литература
1. Дедов И.И. Сахарный диабет: развитие технологий в диагностике, лечении и профилактике (пленарная лекция) // Сахарный диабет. — 2010. — № 3 (48). — С. 6—13.
2. Алгоритм специализированной медицинской помощи больным сахарным диабетом. / Под ред. И.И. Дедова, М.В. Шестаковой. Изд. 4–е, доп. – М., 2009.
3. Nathan D.M., Buse J.B., Davidson M.B., Heine R.J., Holman R.R., Sherwin R., Zinman B. Management of Hyperglycemia in Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy. A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. 2006;№ 29:1963—1972.
4. Nathan D.M., Buse J.B., Davidson M.B., Ferranini E., Holman R.R., Sherwin R., Zinman B. American Diabetes Association; European Association for the Study of Diabetes. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy. A consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. 2009;32:193—203.
5. Эндокринология. Национальное руководство. / Под ред. И.И. Дедова, Г.А. Мельниченко. – М.: ГЭОТАР–Медиа, 2008.
6. Проект «Консенсус совет экспертов Российской ассоциации эндокринологов (РАЭ) по инициации и интенсификации сахароснижающей терапии СД 2 типа». Дедов И.И., Шестакова М.В., Аметов А.С., Анциферов М.Б. и др. // Сахарный диабет. – 2011. – № 1. – С. 98–108.
7. Rodbard H.W., Jellinger P.S., Davidson J.A. еt al. Statement by an American Association of Clinical Endocrinologists / American College of Endocrinology Consensus Panel on Type 2 Diabetes Mellitus: An Algorithm for Glycemic Control // Endocr Pract. 2009;15(6):540—559.
8. Gangji A.S., Cukierman T., Gerstein H.C. et al. A systematic review and meta–analysis of hypoglycemia and cardiovascular events: a comparison of glyburide with other secretagogues and with insulin // Diabetes Care. 2007;30:389 –394.
9. AguilarBryan L., Bryan J. Molecular biology of adenosine tnphosphatesensitrve potassium channels. // Endocr Rev. 1999;20: 101135.
10. Brecardm E., Dorschner H., Schwanstecher С. et al. Stoichiometry of sulfonylurea action. // Diabetologia. 1999;42, supp 1.,232:A65.
11. Seino S. and Miki T. КATP channels as metabolitic sensors: protective roles against acute metabolic changes. // Medicographia. 2005;27, 4:307–3010.
12. Herman M. et al. Diabetes Res Clin Pract 2000; 50 (Suppl):S346Kramer, W. et al. Differential interaction of glimepiride and glibenclamide with the b–cell sulfonylurea receptor. Photoaffinity labeling of a 65 kDa by [3H] glimepiride. //Biochim. Biophys. Fcta 1191 (1994) 278–290.
13. Muller G. The mollecular mechanism of the insulinmimetic/sensitizing activity of....Molecular Medicine. 2000;6(11):907–933.
14. Paes A.H., Bakker A., Soe–Agnie C.J. Impact of doses frequency on patient compliance. // Diabet Care. 1997 Oct; 20(10):1512–7.
15. Eckel J. Direct effects of glimepinde on protein expression of cardiac glucose transporters. // Horm Metab Res. 1996;28: 508–511.
16. Draeger K.E. et al. Long–term treatment of type 2 Diabetic Patients with New Oral Antidiabetic Agent Glimepiride (Amaryl): a double blind comparision with Glibenclamide. // Horm. Metab. Res. 1996;28:419–25.
17. Klepzig H., Kober G., Matter C. et al. Sulfonylureas and ischaemic preconditioning. // Eur Heart J. 1999; 20: 439–446.
18. Pogatsa G. et al. Effects of Glimepiride and Gliclazide on Cardiac Arrhytmias in Patient with type 2 diabetes and cardiac insufficiency. // Diabetes. 2001;50 (suppl):A 128.
19. Hanania G., Gambou J.P., Gueret P. et al. USIC 2000 investigator. Management and in–hospital outcome of patients with acute myocardial infarction admitted to intensive care units at the turn of the century: results from the French nationwide USIC 2000 registry. // Heart. 2004;90:1404–1410.
20. Johnsen S.P., Monster T.B.M., Olsen M.L. et al. Risk and short–term prognosis of Myocardial infarction among users of antidiabetic drugs. // American journal of therapeutics. 2006;13, 2;134–140.
21. Mannucci E., Monami M., Masotti G., Marchionni N. All–cause mortality in diabetic patientstreated with combination of sulfonylureas and biguanides. // Diabetes. Metab. Res. Rev. 2004;20(1):44–47.
22. Александров А.А., Кухаренко С.С., Ядрихинская М.Н. Сердечно–сосудистые последствия современного алгоритма сахароснижающей терапии: «Флорентийская гипотеза». // Сахарный диабет. – 2010. – № 4. – С. 31–37.












