–Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Њ–≤–Њ–і—П—Й–Є—Е—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –≤ 2008 –≥–Њ–і—Г –љ–∞ –µ–ґ–µ–≥–Њ–і–љ—Л—Е –Ї–Њ–љ–≥—А–µ—Б—Б–∞—Е –Т—Б–µ—А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Э–∞—Г—З–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–≤ (–Т–Э–Ю–Ъ), –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–≤ (–Х–Ю–Ъ), –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є (–Х–Ю–Р–У), –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–≥–Њ –Ї–Њ–ї–ї–µ–і–ґ–∞ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Њ–≤ (–Р–Ъ–Ъ), –±—Л–ї–Є –≤—Л–і–µ–ї–µ–љ—Л —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–µ–µ «—В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ» —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ –Є–ї–Є –Љ–∞—А–Ї–µ—А—Л –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ (–≤—Л—Б–Њ–Ї–Є–µ —Г—А–Њ–≤–љ–Є –Њ–±—Й–µ–≥–Њ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є, —В—А–Є–≥–ї–Є—Ж–Є—А–Є–і–Њ–≤ –Є –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–і–Њ–≤ –≤—Л—Б–Њ–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є) –Є «–љ–µ—В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ» –Љ–∞—А–Ї–µ—А—Л –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ (–≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є—П, –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ —Ж–Є—В–Њ–Ї–Є–љ—Л, –≤—Л—Б–Њ–Ї–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Љ–∞–ї—Л—Е –њ–ї–Њ—В–љ—Л—Е —З–∞—Б—В–Є—Ж –Ы–Я–Э–Я) —А–∞–Ј–≤–Є—В–Є—П –°–°–Ю. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ «–љ–µ—В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ» –Љ–∞—А–Ї–µ—А—Л –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ —П–≤–ї—П—О—В—Б—П –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–є —З–∞—Б—В—М—О –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –њ–Њ –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–Љ—Г —В–Є–њ—Г.
–Ю–ґ–Є—А–µ–љ–Є–µ –Є –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–Њ–љ–Є—П – –Є–љ—В–µ—А–љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –њ—А–Њ–±–ї–µ–Љ–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–∞—П –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ–Љ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –°–°–Ю. –°–µ–≥–Њ–і–љ—П –≤ –Љ–Є—А–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –љ–∞—Б—В–Њ—П—Й–∞—П —Н–њ–Є–і–µ–Љ–Є—П – 30% –љ–∞—Б–µ–ї–µ–љ–Є—П –Ј–µ–Љ–љ–Њ–≥–Њ —И–∞—А–∞ —Б—В—А–∞–і–∞—О—В –Њ–ґ–Є—А–µ–љ–Є–µ–Љ (–±–µ–Ј —Г—З–µ—В–∞ —В–µ—Е, –Ї—В–Њ –Є–Љ–µ–µ—В –њ—А–Њ—Б—В–Њ –Є–Ј–±—Л—В–Њ–Ї –Љ–∞—Б—Б—Л —В–µ–ї–∞). –Ю–ґ–Є—А–µ–љ–Є–µ – —Н—В–Њ –љ–µ —В–Њ–ї—М–Ї–Њ –Є–Ј–±—Л—В–Њ—З–љ—Л–є –Њ–±—К–µ–Љ –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є, –Њ–±–ї–∞–і–∞—О—Й–Є–є —В–µ–љ–і–µ–љ—Ж–Є–µ–є –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –љ–Њ –Є —Б–ї–Њ–ґ–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є—Е –њ–Њ–≤—Л—И–µ–љ–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Є —А–∞–Ј–≤–Є—В–Є—О –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є (–Р–У). –°—А–µ–і–Є –ї–Є—Ж —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Р–У –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ 5–6 —А–∞–Ј —З–∞—Й–µ, —З–µ–Љ —Г –ї–Є—Ж —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –≤–µ—Б–Њ–Љ, —Н—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П —В–µ–Љ, —З—В–Њ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –Є–Љ–µ—О—Й–Є–µ –Љ–µ—Б—В–Њ –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є, —П–≤–ї—П—О—В—Б—П –Ї–ї—О—З–µ–≤—Л–Љ–Є –Ј–≤–µ–љ—М—П–Љ–Є –≤ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е –њ–Њ–≤—Л—И–µ–љ–Є—П –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П [1,3,4,5,8,9].
–Я–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П —Б–≤—П–Ј—М –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є—П —Б —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є (–°–°–Ч) –њ—А–Њ—Б–ї–µ–ґ–Є–≤–∞–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —З–µ—В–Ї–Њ: —Б—В–µ–њ–µ–љ—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞, —З–∞—Б—В–Њ—В–∞ –Є–љ—Д–∞—А–Ї—В–Њ–≤ –Љ–Є–Њ–Ї–∞—А–і–∞ –Є –Є–љ—Б—Г–ї—М—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ —А–µ–≥–Є—Б—В—А–Є—А—Г—О—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ, —З–µ–Љ —Г –ї–Є—Ж —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –≤–µ—Б–Њ–Љ.
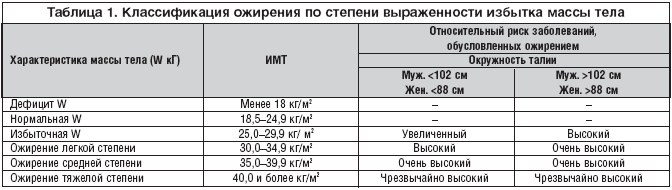
–≠–Ї—Б–њ–µ—А—В—Л –Т–Ю–Ч, –љ–∞ –Њ—Б–љ–Њ–≤–µ –≤–µ–ї–Є—З–Є–љ—Л –Ш–љ–і–µ–Ї—Б –Ь–∞—Б—Б—Л –Ґ–µ–ї–∞ (–Ш–Ь–Ґ – –Є–љ–і–µ–Ї—Б –Ъ–µ—В–ї–µ), –Ї–Њ—В–Њ—А—Л–є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П, –Ї–∞–Ї –Њ—В–љ–Њ—И–µ–љ–Є–µ –Љ–∞—Б—Б—Л (W [–Ї–≥]) –Ї –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —В–µ–ї–∞ (S [–Љ2]) – –Ш–Ь–Ґ=W/S [–Ї–≥/–Љ2], –њ—А–µ–і–ї–Њ–ґ–Є–ї–Є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—О –Ї—А–Є—В–µ—А–Є–µ–≤ –Њ–ґ–Є—А–µ–љ–Є—П, –Ї–∞–Ї —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –°–°–Ч (—В–∞–±–ї. 1) [1,5,7]. –†–∞–љ–µ–µ –Њ–ґ–Є—А–µ–љ–Є–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–ї–Њ—Б—М –њ—А–Є –Ј–љ–∞—З–µ–љ–Є–Є –Ш–Ь–Ґ, –њ—А–µ–≤—Л—И–∞—О—Й–µ–Љ 30 –Ї–≥/–Љ2. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞ –љ–∞—З–Є–љ–∞–µ—В –≤–Њ–Ј—А–∞—Б—В–∞—В—М –њ—А–Є –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є—Е –Ј–љ–∞—З–µ–љ–Є—П—Е –Ш–Ь–Ґ (25 –Ї–≥/–Љ2). –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–µ —Б —Н—В–Є–Љ, –Ј–љ–∞—З–µ–љ–Є–µ –Ш–Ь–Ґ –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ 25,0–29,9 –Ї–≥/–Љ2 –±—Л–ї–Њ –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Ї–∞–Ї «–Є–Ј–±—Л—В–Њ—З–љ—Г—О –Љ–∞—Б—Б—Г —В–µ–ї–∞».
–£–≤–µ–ї–Є—З–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ь–Ґ) –Ј–∞ —Б—З–µ—В –≤—Л—Б–Њ–Ї–Њ–є –њ—А–Њ–њ–Њ—А—Ж–Є–Є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є —Б–≤—П–Ј–∞–љ–Њ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Р–У –Є —Ж–µ–ї–Њ–≥–Њ —А—П–і—П –і—А—Г–≥–Є—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –°–°–Ч. –Ч–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Љ–µ–ґ–і—Г –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –Є –Р–У –±—Л–ї–∞ –і–Њ–Ї—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –≤–Њ –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є (Framingham Heart Study), –Ї–Њ—В–Њ—А–Њ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –њ–Њ –Љ–µ—А–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Ї —А–Њ—Б—В—Г –Ш–Ь–Ґ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Р–У –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –≥—А—Г–њ–њ–∞—Е –љ–∞—Б–µ–ї–µ–љ–Є—П —Г –ї–Є—Ж –Њ–±–Њ–µ–≥–Њ –њ–Њ–ї–∞. –Ю—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –Њ–і–љ–Є–Љ –Є–Ј –≤–∞–ґ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –Р–У —П–≤–ї—П–µ—В—Б—П –љ–µ–і–∞–≤–љ—П—П –њ—А–Є–±–∞–≤–Ї–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞; –њ–Њ –і–∞–љ–љ—Л–Љ –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Њ–Ї–Њ–ї–Њ 70% —Б–ї—Г—З–∞–µ–≤ –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ–љ–∞—П –Р–У –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–∞—Б—М —Б –љ–µ–і–∞–≤–љ–µ–є –њ—А–Є–±–∞–≤–Ї–Њ–є –≤–µ—Б–∞ –Є–ї–Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ [5,7].
–Ц–Є—А–Њ–≤–∞—П —В–Ї–∞–љ—М – –љ–µ –њ—А–Њ—Б—В–Њ –њ–∞—Б—Б–Є–≤–љ—Л–є –љ–∞–Ї–Њ–њ–Є—В–µ–ї—М –ґ–Є—А–∞ («–∞–Ї–Ї—Г–Љ—Г–ї—П—В–Њ—А —Н–љ–µ—А–≥–Є–Є»). –Ю–љ–∞ —П–≤–ї—П–µ—В—Б—П –∞–Ї—В–Є–≤–љ—Л–Љ –∞—Г—В–Њ–, –њ–∞—А–∞– –Є —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–Љ –Њ—А–≥–∞–љ–Њ–Љ, —Б–њ–Њ—Б–Њ–±–љ—Л–Љ —Б–Є–љ—В–µ–Ј–Є—А–Њ–≤–∞—В—М –Є —Б–µ–Ї—А–µ—В–Є—А–Њ–≤–∞—В—М –≤ –Ї—А–Њ–≤–Њ—В–Њ–Ї —А–∞–Ј–ї–Є—З–љ—Л–µ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –њ–µ–њ—В–Є–і–љ–Њ–є –Є –љ–µ–њ–µ–њ—В–Є–і–љ–Њ–є –њ—А–Є—А–Њ–і—Л, –Є–≥—А–∞—О—Й–Є–µ –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –≥–Њ–Љ–µ–Њ–Ї–Є–љ–µ–Ј–µ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–Є—Б—В–µ–Љ, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Р–і–Є–њ–Њ—Ж–Є—В—Л – —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –µ–і–Є–љ–Є—Ж—Л –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є —П–≤–ї—П—О—В—Б—П –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–µ–є––∞–ї—М—Д–∞ (–§–Э–Ю–α), –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞–1 (–Ш–Р–Я–1), –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞–6 (–Ш–Ы–6), –ї–µ–њ—В–Є–љ–∞, –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–Њ–≥–µ–љ–∞, –Є–љ—Б—Г–ї–Є–љ–Њ–њ–Њ–і–Њ–±–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —А–Њ—Б—В–∞–1 (–Ш–§–†–1), –Ї–Њ—В–Њ—А—Л–µ, –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—П –љ–∞ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А—Л, –њ—А–Є–≤–Њ–і—П—В –Ї —А–∞–Ј–≤–Є—В–Є—О –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є (–Ш–†) [3,6,8].
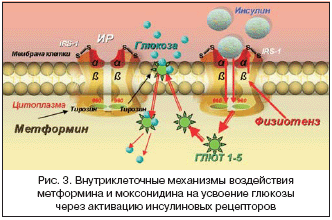
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Ј—Г—З–µ–љ–Є–µ –љ–µ–є—А–Њ–±–Є–Њ–ї–Њ–≥–Є–Є –Њ–ґ–Є—А–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Њ: —Г –ї–Є—Ж, —Б—В—А–∞–і–∞—О—Й–Є—Е –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –≤ –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–∞—Е –њ–Њ—З–µ–Ї –Є —Б–Ї–µ–ї–µ—В–љ–Њ–є –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Л —Г–≤–µ–ї–Є—З–µ–љ–∞, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –љ–µ–є—А–Њ–≥–µ–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –Р–У –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є. –Р–Ї—В–Є–≤–∞—Ж–Є—П —Б–Є–Љ–њ–∞—В–Њ––∞–і—А–µ–љ–∞–ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ—А–Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–µ —В–µ–ї–∞ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ —П–≤–ї—П–µ—В—Б—П —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –Ш–†, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –і–µ–≥—А–∞–і–∞—Ж–Є–Є —Б—Г–±—Б—В—А–∞—В–∞ —А–µ—Ж–µ–њ—В–Њ—А–∞ –Є–љ—Б—Г–ї–Є–љ–∞ IRS–1, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—О—Й–µ–≥–Њ –∞—Д—Д–Є–љ–љ–Њ—Б—В—М —А–µ—Ж–µ–њ—В–Њ—А–∞ –Ї –Є–љ—Б—Г–ї–Є–љ—Г, –Є —Г–Љ–µ–љ—М—И–µ–љ–Є—П –њ–ї–Њ—В–љ–Њ—Б—В–Є –Є–љ—Б—Г–ї–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –љ–∞ —Г–≤–µ–ї–Є—З–µ–љ–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ –Є –≤ —А–∞–Ј–Љ–µ—А–∞—Е –∞–і–Є–њ–Њ—Ж–Є—В–∞—Е (—А–Є—Б. 1). –Я–Њ–≤—Л—И–µ–љ–Є–µ —В–Њ–љ—Г—Б–∞ —Б–Є–Љ–њ–∞—В–Њ––∞–і—А–µ–љ–∞–ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –†–Р–Р–°, —З—В–Њ —Б—Г–Љ–Љ–∞—А–љ–Њ –≤–µ–і–µ—В –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О –Р–Ф. –Ш–† —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –љ–Њ—З–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –Р–Ф (Non–Dipper), —З—В–Њ —В–∞–Ї–ґ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Њ–љ—Г—Б–∞ –њ—А–Є –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–Љ –Њ–ґ–Є—А–µ–љ–Є–Є.
–Р–Ї—В–Є–≤–љ–Њ–µ —Г—З–∞—Б—В–Є–µ –≤ —А–∞–Ј–≤–Є—В–Є–Є –Р–У –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є –њ—А–Є–љ–Є–Љ–∞–µ—В —Б–Є–Љ–њ–∞—В–Њ––∞–і—А–µ–љ–∞–ї–Њ–≤–∞—П —Б–Є—Б—В–µ–Љ–∞ (–°–Р–°), –Ї–Њ—В–Њ—А–∞—П –Є–Љ–µ–µ—В —Б–ї–Њ–ґ–љ—Г—О —Б–Є—Б—В–µ–Љ—Г –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ (–≥–Є–њ–Њ—В–∞–ї–∞–Љ—Г—Б, —А–µ—В–Є–Ї—Г–ї—П—А–љ–∞—П —Д–Њ—А–Љ–∞—Ж–Є—П —Б—В–≤–Њ–ї–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞), –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –≥–∞–љ–≥–ї–Є–µ–≤ –Є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ —Б–ї–Њ—П –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤ (—А–Є—Б. 2). –Ь–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –љ–∞–±–ї—О–і–∞—О—Й–Є–µ—Б—П –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є (–Ш–† –Є –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ–є –≥–Є–њ–µ—А–Є–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є–Є – –У–Ш, —Б–µ–ї–µ–Ї—В–Є–≤–љ–∞—П –ї–µ–њ—В–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Є –≥–Є–њ–µ—А–ї–µ–њ—В–Є–љ–µ–Љ–Є—П), –≤—Л–Ј—Л–≤–∞—О—В —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, —Г—Б–Є–ї–µ–љ–Є–µ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —В–Њ–љ—Г—Б–∞, –њ–Њ–≤—Л—И–µ–љ–Є–µ –Њ–±—Й–µ–≥–Њ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ –Р–Ф.
–£ –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Р–Ф, —Б–Њ–њ—А—П–ґ–µ–љ–љ–Њ–≥–Њ —Б –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Њ–љ—Г—Б–∞, –≤—Л–Ј–≤–∞–љ–љ–Њ–≥–Њ –Ш–†, –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ–µ–є –ї–Є–њ–Є–і–Њ–≤ –њ–ї–∞–Ј–Љ—Л –≤ —Б—В–Њ—А–Њ–љ—Г –∞—В–µ—А–Њ–≥–µ–љ–љ–Њ–є –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є–Є. –≠—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Є–Љ–µ—О—В —В–µ–љ–і–µ–љ—Ж–Є—О –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –њ—А–Є –і–µ—Д–Є—Ж–Є—В–µ —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, –≥–Њ—А–Љ–Њ–љ–Њ–≤ —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ–ґ–Є—А–µ–љ–Є–µ – –Њ–і–Є–љ –Є–Ј —Д–∞–Ї—В–Њ—А–Њ–≤ –≤ —Б–Њ–Ј–≤–µ–Ј–і–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–≤–Њ–і—П—В –Ї —А–∞–Ј–≤–Є—В–Є—О –Р–У [2,4,9].
–Ш—Б—Е–Њ–і—П –Є–Ј –≤—Л—И–µ–Є–Ј–ї–Њ–ґ–µ–љ–љ–Њ–≥–Њ –Ї–Њ—А—А–µ–Ї—Ж–Є—П –Ш–†, –Ї–∞–Ї –≤–µ–і—Г—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ –≤ —Б–Є–Љ–њ–∞—В–Є–Ї–Њ—В–Њ–љ–Є–Є, —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –≤ –Њ–±—Й–µ–є —Б—Е–µ–Љ–µ –ї–µ—З–µ–љ–Є—П –Р–У, —Б–Њ—З–µ—В–∞—О—Й–µ–є—Б—П —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ.
–Ь–µ—В—Д–Њ—А–Љ–Є–љ – –њ—А–µ–њ–∞—А–∞—В –≥—А—Г–њ–њ—Л –±–Є–≥—Г–∞–љ–Є–і–Њ–≤, —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї–ї–µ—В–Њ—З–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є–љ—Б—Г–ї–Є–љ–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є –Є –Њ—А–≥–∞–љ–Њ–≤ (–њ–µ—З–µ–љ—М, —Б–Ї–µ–ї–µ—В–љ–∞—П –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А–∞, –ґ–Є—А–Њ–≤–∞—П —В–Ї–∞–љ—М) –Ї —Н–љ–і–Њ–≥–µ–љ–љ–Њ–Љ—Г –Є–љ—Б—Г–ї–Є–љ—Г, –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—П –≤–ї–Є—П–љ–Є—П –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М b––Ї–ї–µ—В–Њ–Ї –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л.
–Я–µ—А–≤–Є—З–љ—Л–є, —Б—Г–Љ–Љ–∞—А–љ—Л–є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –≤ –і–Њ–Ј–µ 1000–2000 –Љ–≥ –≤ —Б—Г—В–Ї–Є –≤—Л–Ј–≤–∞–љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л –њ–µ—З–µ–љ—М—О –Є —Б–≤–Њ–±–Њ–і–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В (–°–Ц–Ъ), —З–µ—А–µ–Ј –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ґ–Є—А–∞, —Б —Г—Б–Є–ї–µ–љ–Є–µ–Љ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–∞—Е–≤–∞—В–∞ –≥–ї—О–Ї–Њ–Ј—Л.
–У–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–∞—П —А–µ–∞–Ї—Ж–Є—П –њ–µ—З–µ–љ–Є –љ–∞ –Љ–µ—В—Д–Њ—А–Љ–Є–љ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞ –Є –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є – –≥–ї–Є–Ї–Њ–≥–µ–љ–Њ–ї–Є–Ј–∞, —З—В–Њ –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –Љ–∞–љ–Є—Д–µ—Б—В–Є—А—Г–µ—В—Б—П –≥–ї–Є–Ї–µ–Љ–Є–µ–є –љ–∞—В–Њ—Й–∞–Ї. –Я–Њ–і–Њ–±–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –љ–∞ —Г—А–Њ–≤–љ–µ –њ–µ—З–µ–љ–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –≤ –≥–µ–њ–∞—В–Њ—Ж–Є—В—Л –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –≥–ї—О–Ї–Њ–Ј—Л (–ї–∞–Ї—В–∞—В, –њ–Є—А—Г–≤–∞—В, –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В–∞) –Є –Ї–ї—О—З–µ–≤—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ –≥–ї—О–Ї–Њ–љ–µ–Њ–≥–µ–љ–µ–Ј–∞ (–≥–ї—О–Ї–Њ–Ј–∞–6–—Д–Њ—Б—Д–∞—В, —Д—А—Г–Ї—В–Њ–Ј–∞ –1,6– –±–Є–Њ—Д–Њ—Б—Д–∞—В–∞–Ј–∞, –њ–Є—А—Г–≤–∞—В–Ї–∞—А–±–Њ–Ї—Б–Є–ї–∞–Ј–∞).
–Ф—А—Г–≥–Є–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є –і–µ–є—Б—В–≤–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —П–≤–ї—П—О—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –∞–љ–∞—Н—А–Њ–±–љ–Њ–≥–Њ –≥–ї–Є–Ї–Њ–ї–Є–Ј–∞, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л –≤ –Ї—А–Њ–≤–Є, –Њ—В—В–µ–Ї–∞—О—Й–µ–є –Њ—В –Ї–Є—И–µ—З–љ–Є–Ї–∞, —Б –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞ (—В–Њ—Й–∞–Ї–Њ–≤–∞—П –Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є—П) –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, —З—В–Њ —Б—Г–Љ–Љ–∞—А–љ–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –њ–Њ—Б—В–њ—А–∞–љ–і–∞–ї—М–љ–Њ–є –≥–ї–Є–Ї–µ–Љ–Є–Є. –° —Г—З–µ—В–Њ–Љ —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–µ–є—Б—В–≤–Є—П –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –њ—А–∞–≤–Є–ї—М–љ–µ–µ –≥–Њ–≤–Њ—А–Є—В—М –љ–µ –Њ –µ–≥–Њ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ, –∞ –Њ–± –∞–љ—В–Є–≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ –≤–ї–Є—П–љ–Є–Є [2,3,9].
–Р–≥–Њ–љ–Є—Б—В—Л I1––Є–Љ–Є–і–∞–Ј–Њ–ї–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Ь–Њ–Ї—Б–Њ–љ–Є–і–Є–љ –Ј–∞–љ–Є–Љ–∞—О—В –Њ—Б–Њ–±–Њ–µ –Љ–µ—Б—В–Њ –≤ —В–µ—А–∞–њ–Є–Є –Р–У, —Б–Њ—З–µ—В–∞—О—Й–µ–є—Б—П —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, —З–µ—А–µ–Ј –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—Б–Є–Љ–њ–∞—В–Є–Ї–Њ—В–Њ–љ–Є–Є (—А–Є—Б. 2). –Ч–∞ —Б—З–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–Љ–Є–і–∞–Ј–Њ–ї–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ I––≥–Њ —В–Є–њ–∞ –≤ —Б—А–µ–і–љ–µ–Љ –Љ–Њ–Ј–≥–µ –Є –њ—А–µ—Б–Є–љ–∞–њ—В–Є—З–µ—Б–Ї–Є—Е α––∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л —Г–Љ–µ–љ—М—И–∞—О—В —Ж–µ–љ—В—А–∞–ї—М–љ—Г—О —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї—Г—О –Є–Љ–њ—Г–ї—М—Б–∞—Ж–Є—О, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —Б–љ–Є–ґ–µ–љ–Є—О –≥–Є–і—А–Њ–ї–Є–Ј–∞ –ґ–Є—А–Њ–≤, —Г–Љ–µ–љ—М—И–µ–љ–Є—О –°–Ц–Ъ, —Г—Б–Є–ї–µ–љ–Є—О –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≥–ї—О–Ї–Њ–Ј—Л –Є –њ–Њ–≤—Л—И–µ–љ–Є—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –Є–љ—Б—Г–ї–Є–љ—Г, —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –Ґ–У, –њ–Њ–≤—Л—И–µ–љ–Є—О –Ы–Я–Т–Я –Є —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –Ш–Р–Я–1. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е H. Lithell (1999 –≥.) –њ–Њ–ї—Г—З–µ–љ—Л –і–∞–љ–љ—Л–µ –Њ –≤–ї–Є—П–љ–Є–Є –Љ–Њ–Ї—Б–Њ–љ–Є–і–Є–љ–∞ –љ–∞ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ш–†. –Т –њ–Є–ї–Њ—В–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Т.–Р. –Р–ї–Љ–∞–Ј–Њ–≤–∞ (2000 –≥.) —В–∞–Ї–ґ–µ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –≤–ї–Є—П–љ–Є–µ –Љ–Њ–Ї—Б–Њ–љ–Є–і–Є–љ–∞ –љ–∞ –Ш–†. –Ф–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ–њ—А–µ–і–µ–ї–Є–ї–Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Љ–Њ–Ї—Б–Њ–љ–Є–і–Є–љ–∞ –≤–ї–Є—П—В—М –љ–∞ –Ш–† —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–Ј–±—Л—В–Њ—З–љ—Л–Љ –≤–µ—Б–Њ–Љ –Є —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –≥–ї—О–Ї–Њ–Ј–µ (–Э–Ґ–У).
–Т —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є ALMAZ, –≤ –Ї–Њ—В–Њ—А–Њ–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л 4––Љ–µ—Б—П—З–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П 202 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–† (—А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –≥—А—Г–њ–њ—Л –њ–Њ 101 –њ–∞—Ж–Є–µ–љ—В—Г), –±—Л–ї–Њ –Є–Ј—Г—З–µ–љ–Њ –≤–ї–Є—П–љ–Є–µ –Љ–Њ–Ї—Б–Њ–љ–Є–і–Є–љ–∞ (0,4 –Љ–≥ –≤ —Б—Г—В–Ї–Є) –Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ (1000 –Љ–≥ –≤ —Б—Г—В–Ї–Є) –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –≥–ї—О–Ї–Њ–Ј—Л —Г –±–Њ–ї—М–љ—Л—Е –Р–У, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ. –Ъ—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є: –≤–Њ–Ј—А–∞—Б—В >40 –ї–µ—В, –Ш–Ь–Ґ>27 –Ї–≥/–Љ2, –≥–ї—О–Ї–Њ–Ј–∞ –љ–∞—В–Њ—Й–∞–Ї >6,1 –Љ–Љ–Њ–ї—М/–ї. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ ALMAZ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –Љ–Њ–Ї—Б–Њ–љ–Є–і–Є–љ —Б–љ–Є–ґ–∞–ї —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л –љ–∞—В–Њ—Й–∞–Ї, —Б–љ–Є–ґ–∞–ї –≤–µ—Б –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–≤—Л—И–∞–ї —Б–Ї–Њ—А–Њ—Б—В—М —Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є –≥–ї—О–Ї–Њ–Ј—Л, —Б–љ–Є–ґ–∞–ї –Ш–†. –С—Л–ї–∞ —В–∞–Ї–ґ–µ –њ—А–Њ–≤–µ–і–µ–љ–∞ –Њ—Ж–µ–љ–Ї–∞ –≤–ї–Є—П–љ–Є—П –Љ–Њ–Ї—Б–Њ–љ–Є–і–Є–љ–∞ –Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ –љ–∞ –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–є –Ї–Њ–љ—В—А–Њ–ї—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–Ј–±—Л—В–Њ—З–љ—Л–Љ –≤–µ—Б–Њ–Љ, –Љ—П–≥–Ї–Њ–є –Р–У, –Ш–† –Є –Э–Ґ–У. –Э–∞ —Д–Њ–љ–µ –Љ–Њ–Ї—Б–Њ–љ–Є–і–Є–љ–∞ —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л –љ–∞—В–Њ—Й–∞–Ї —Б–љ–Є–ґ–∞–ї—Б—П –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ, —З–µ–Љ –љ–∞ —Д–Њ–љ–µ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞, –љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–ї—Б—П —Г—А–Њ–≤–µ–љ—М –Є–љ—Б—Г–ї–Є–љ–∞, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –Љ–µ—В—Д–Њ—А–Љ–Є–љ –љ–∞ –љ–µ–≥–Њ –љ–µ –≤–ї–Є—П–ї, –∞ –Ш–Ь–Ґ —Б–љ–Є–ґ–∞–ї—Б—П —А–∞–≤–љ–Њ–Ј–љ–∞—З–љ–Њ –љ–∞ —Д–Њ–љ–µ –Њ–±–Њ–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [3–5].
–Ю–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –њ–Њ–≤—Л—И–∞—О—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –Є–љ—Б—Г–ї–Є–љ—Г –њ–Њ—Б–ї–µ –љ–∞–≥—А—Г–Ј–Ї–Є –≥–ї—О–Ї–Њ–Ј–Њ–є. –Т–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –Є–љ—Б—Г–ї–Є–љ—Г –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є —В–Ї–∞–љ–Є –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –Љ–µ—В—Д–Њ—А–Љ–Є–љ–∞ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П —З–µ—А–µ–Ј —А—П–і –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤: —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –∞—Д—Д–Є–љ–љ—Л—Е –Ї –Є–љ—Б—Г–ї–Є–љ—Г —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, —З–µ—А–µ–Ј —Б—В–Є–Љ—Г–ї—П—Ж–Є—О —В–Є—А–Њ–Ј–Є–љ–Ї–Є–љ–∞–Ј—Л –њ–Њ–≤—Л—И–∞–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–љ—Б—Г–ї–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –∞–Ї—В–Є–≤–Є–Ј–Є—А—Г—О—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –Є –њ–µ—А–µ–Љ–µ—Й–µ–љ–Є–µ –Є–Ј –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –њ—Г–ї–∞ –љ–∞ –Ї–ї–µ—В–Њ—З–љ—Г—О –Љ–µ–Љ–±—А–∞–љ—Г —В—А–∞–љ—Б–њ–Њ—А—В–µ—А–Њ–≤ –≥–ї—О–Ї–Њ–Ј—Л (–У–Ы–Ѓ–Ґ 1–5). –Ь–Њ–Ї—Б–Њ–љ–Є–і–Є–љ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Н–Ї—Б–њ—А–µ—Б—Б–Є—О b–—Б—Г–±—К–µ–і–Є–љ–Є—Ж –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –±–µ–ї–Ї–∞ —Б—Г–±—Б—В—А–∞—В–∞ —А–µ—Ж–µ–њ—В–Њ—А–∞ –Є–љ—Б—Г–ї–Є–љ–∞ IRS–1, —З—В–Њ —Б—Г–Љ–Љ–∞—А–љ–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О –∞—Д–Є–љ–љ–Њ—Б—В–Є –Ї –Є–љ—Б—Г–ї–Є–љ—Г (—А–Є—Б. 3). –Т—Л—И–µ–њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –њ—А–Є–≤–Њ–і—П—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –њ–Њ–≥–ї–Њ—Й–µ–љ–Є—П –≥–ї—О–Ї–Њ–Ј—Л –Њ—А–≥–∞–љ–∞–Љ–Є––Љ–Є—И–µ–љ—П–Љ–Є –Є–љ—Б—Г–ї–Є–љ–∞ (–њ–µ—З–µ–љ—М—О, —Б–Ї–µ–ї–µ—В–љ–Њ–є –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А–Њ–є, –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ—М—О).
–Ь–Њ–Ї—Б–Њ–љ–Є–і–Є–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–ї–Є—П–љ–Є–µ –љ–∞ —Г—А–Њ–≤–µ–љ—М –Є–љ—Б—Г–ї–Є–љ–∞ –≤ –Ї—А–Њ–≤–Є, –Љ–µ—В—Д–Њ—А–Љ–Є–љ —А–µ–≥—Г–ї–Є—А—Г–µ—В —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –≥–ї–Є–Ї–Њ–Ј–Є–ї–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Э–≤. –Ю–±–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–ї–Є –Љ–∞—Б—Б—Г —В–µ–ї–∞, –Њ—Б—В–∞–≤–∞—П—Б—М –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –љ–µ–є—В—А–∞–ї—М–љ—Л–Љ–Є –Ї –ї–Є–њ–Є–і–∞–Љ [5].
–Ь–∞—В–µ—А–Є–∞–ї—Л, –Љ–µ—В–Њ–і—Л
–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –ї–µ—З–µ–љ–Є—П
–Э–∞–Љ–Є —Б —Ж–µ–ї—М—О –Њ—Ж–µ–љ–Ї–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Р–° —Г –±–Њ–ї—М–љ—Л—Е –Р–У –Є —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 57 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–У I–II —Б—В–µ–њ–µ–љ–Є (26 –Љ—Г–ґ—З–Є–љ, 31 –ґ–µ–љ—Й–Є–љ–∞) –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 25 –і–Њ 50 –ї–µ—В (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –њ–Њ –≥—А—Г–њ–њ–µ —Б–Њ—Б—В–∞–≤–Є–ї 39,6±3,5 –≥–Њ–і–∞); —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ш–Ь–Ґ≥25 –Ї–≥/–Љ2, –≤ —Б—А–µ–і–љ–µ–Љ –њ–Њ –≥—А—Г–њ–њ–µ —Б–Њ—Б—В–∞–≤–Є–ї 32,5±1,6 –Ї–≥/–Љ2. –Я–Њ –Є—Б—Е–Њ–і–љ—Л–Љ –і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–Љ –Є –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–Љ –і–∞–љ–љ—Л–Љ –њ–Њ–і–≥—А—Г–њ–њ—Л –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ —Б –Р–У –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є (—В–∞–±–ї. 2).
–Ъ—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —П–≤–ї—П–ї–Є—Б—М –і–∞–љ–љ—Л–µ —Д–Є–Ј–Є–Ї–∞–ї—М–љ–Њ–≥–Њ –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є: –Р–Ф≥145/90 –Љ–Љ —А—В.—Б—В., –Њ–Ї—А—Г–ґ–љ–Њ—Б—В—М —В–∞–ї–Є–Є –і–ї—П –Љ—Г–ґ—З–Є–љ –±–Њ–ї–µ–µ 94 —Б–Љ, —Г –ґ–µ–љ—Й–Є–љ – –±–Њ–ї–µ–µ 80 —Б–Љ, —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л –≤ –њ–ї–∞–Ј–Љ–µ >5,6 –Љ–Љ–Њ–ї—М/–ї, –Ґ–У>1,7 –Љ–Љ–Њ–ї—М/–ї, –Ы–Я–Т–Я<1,0 –Љ–Љ–Њ–ї—М/–ї. –° —Ж–µ–ї—М—О –Њ—Ж–µ–љ–Ї–Є —Б—В–µ–њ–µ–љ–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Р–°, –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ї —Б—В–∞–љ–і–∞—А—В–љ–Њ–Љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—О –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ї—А–Њ–≤–Є (—Г—А–Њ–≤–µ–љ—М –≥–ї–Є–Ї–µ–Љ–Є–Є, –≥–ї–Є–Ї–Њ–Ј–Є–ї–Є—А–Њ–≤–∞–љ–љ—Л–є HbA1—Б, –ї–Є–њ–Є–і–љ—Л–є —Б–њ–µ–Ї—В—А –Ї—А–Њ–≤–Є), –і–Њ –Є –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –і–≤–Њ–є–љ–Њ–є –і–Є–љ–∞–Љ–Є—З–љ—Л–є —В–µ—Б—В (–Ф–Ф–Ґ) –љ–∞ –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ—Л (–і–Њ—Д–∞–Љ–Є–љ, –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ, –∞–і—А–µ–љ–∞–ї–Є–љ).
–°—Г—В—М –Ф–Ф–Ґ – –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є –љ–∞ –≥–Њ—А–Љ–Њ–љ—Л —Б—В—А–µ—Б—Б–∞ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –≤ –і–≤–∞ —Н—В–∞–њ–∞: –і–Њ –Є –њ–Њ—Б–ї–µ —Б—В—А–µ—Б—Б–∞, –≥–і–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–Њ—А–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М 60–180–—Б–µ–Ї—Г–љ–і–љ–Њ–µ –њ—А–µ–±—Л–≤–∞–љ–Є–µ –≤ –Ї—А–Є–Њ—Б–∞—Г–љ–µ. –Я–Њ —А–∞–Ј–љ–Є—Ж–µ —Г—А–Њ–≤–љ–µ–є –љ–µ–є—А–Њ–≥–Њ—А–Љ–Њ–љ–Њ–≤ —Б—В—А–µ—Б—Б–∞ –Љ–Њ–ґ–љ–Њ –Њ—Ж–µ–љ–Є—В—М –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Б—В–∞—В—Г—Б –њ–∞—Ж–Є–µ–љ—В–∞. –Я—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –∞–і—А–µ–љ–∞–ї–Є–љ–∞ –Є –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ–∞ –≤ –Ї—А–Њ–≤–Є –≥–Њ–≤–Њ—А–Є—В –Њ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–Љ —Г—А–Њ–≤–љ–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Р–°, —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –і–Њ—Д–∞–Љ–Є–љ–∞ – –Ї—А–Є—В–µ—А–Є–є –і–µ–њ—А–µ—Б—Б–Є–≤–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П.
–Ш—Б—Е–Њ–і–љ–Њ –Є –њ–Њ—Б–ї–µ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ, –≤–Ї–ї—О—З–µ–љ–љ—Л–Љ –≤ –њ—А–Њ–≥—А–∞–Љ–Љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Њ–≤–Њ–і–Є–ї—Б—П —Б—В–∞–љ–і–∞—А—В–љ—Л–є –њ–µ—А–Њ—А–∞–ї—М–љ—Л–є —В–µ—Б—В —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –≥–ї—О–Ї–Њ–Ј–µ (–Я–Ґ–Ґ–У) —Б –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ–µ–є –Є–Љ–Љ—Г–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Є–љ—Б—Г–ї–Є–љ–∞ (–Ш–†–Ш), –°––њ–µ–њ—В–Є–і–∞ – –љ–∞—В–Њ—Й–∞–Ї, —З–µ—А–µ–Ј 30–60–120 –Љ–Є–љ—Г—В –њ–Њ—Б–ї–µ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ —В–µ—Б—В–∞ –љ–∞ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В—М –Ї –≥–ї—О–Ї–Њ–Ј–µ (–Я–Ґ–Ґ–У). –°––њ–µ–њ—В–Є–і —П–≤–ї—П–µ—В—Б—П –Є–љ–і–Є–Ї–∞—В–Њ—А–Њ–Љ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞ –Є–Ј –њ—А–Њ–Є–љ—Б—Г–ї–Є–љ–∞ –≤ b––Ї–ї–µ—В–Ї–∞—Е –Њ—Б—В—А–Њ–≤–Ї–Њ–≤ –Ы–∞–љ–≥–µ—А–≥–∞–љ—Б–∞ –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –≤—Л–і–µ–ї—П–µ—В—Б—П –≤ –Ї—А–Њ–≤–Њ—В–Њ–Ї –≤ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е, –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л—Е –њ–Њ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є —Б –Є–љ—Б—Г–ї–Є–љ–Њ–Љ. –Т –љ–Њ—А–Љ–µ – –љ–∞—В–Њ—Й–∞–Ї, —Г—А–Њ–≤–µ–љ—М –°––њ–µ–њ—В–Є–і–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Љ–µ–љ—М—И–µ 4 –љ–≥/–Љ–ї, –∞ –њ–Њ—Б–ї–µ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є –≥–ї—О–Ї–Њ–Ј–Њ–є –Њ—В–Љ–µ—З–∞–µ—В—Б—П 5–6––Ї—А–∞—В–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –µ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є.
–Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–Њ–≥—А–∞–Љ–Љ—Л –ї–µ—З–µ–љ–Є—П (8 –љ–µ–і–µ–ї—М), –і–ї—П –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –Є–љ—Б—Г–ї–Є–љ—Г –Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Р–°, –±–Њ–ї—М–љ—Л–µ –±—Л–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ—Л –љ–∞ –і–≤–µ –њ–Њ–і–≥—А—Г–њ–њ—Л: –њ–Њ–і–≥—А—Г–њ–њ–∞ –Р – 28 –±–Њ–ї—М–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –≤ –±–∞–Ј–Њ–≤–Њ–µ –ї–µ—З–µ–љ–Є–µ (–Ї–∞—А–і–Є–Њ–—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ β––±–ї–Њ–Ї–∞—В–Њ—А—Л, –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А—Л, –і–µ–Ј–Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Њ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П) –±—Л–ї –і–Њ–±–∞–≤–ї–µ–љ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л–є –њ—А–µ–њ–∞—А–∞—В – –Љ–Њ–Ї—Б–Њ–љ–Є–і–Є–љ 0,4–0,8 –Љ–≥ –≤ —Б—Г—В–Ї–Є; –њ–Њ–і–≥—А—Г–њ–њ–∞ –С – 29 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –≤ –њ—А–Њ–≥—А–∞–Љ–Љ—Г –ї–µ—З–µ–љ–Є—П –±—Л–ї –≤–Ї–ї—О—З–µ–љ –Љ–µ—В—Д–Њ—А–Љ–Є–љ 1000–2000 –Љ–≥ –≤ —Б—Г—В–Ї–Є. –£ –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –њ—А–Њ–≥—А–∞–Љ–Љ—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –Ї–∞—З–µ—Б—В–≤–µ –ї–Є–њ–Є–і–Њ–њ–Њ–љ–Є–ґ–∞—О—Й–µ–є —В–µ—А–∞–њ–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є —Д–µ–љ–Њ—Д–Є–±—А–∞—В – –Ґ—А–∞–є–Ї–Њ—А 145 (1–2 —В–∞–±–ї–µ—В–Ї–Є –≤ —Б—Г—В–Ї–Є).
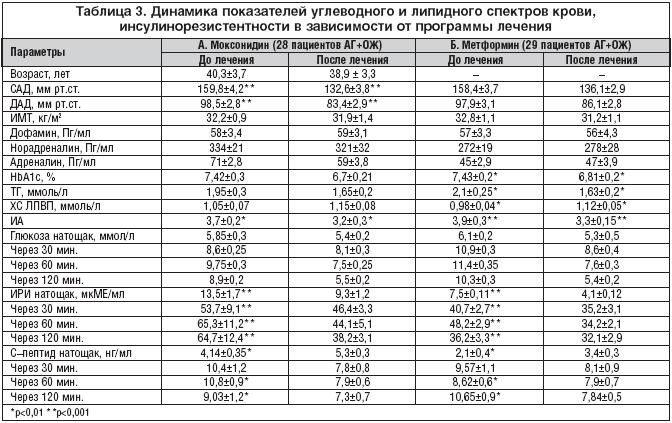
–Ш—Б—Б–ї–µ–і—Г–µ–Љ—Л–µ –њ–Њ–і–≥—А—Г–њ–њ—Л –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –њ–Њ –Є—Б—Е–Њ–і–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –Є –і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–µ–ґ–≥—А—Г–њ–њ–Њ–≤–Њ–≥–Њ —Б—А–∞–≤–љ–µ–љ–Є—П —Г—А–Њ–≤–љ–µ–є –Ї–∞—В–µ—Е–Њ–ї–∞–Љ–Є–љ–Њ–≤, –≥–ї—О–Ї–Њ–Ј—Л –љ–∞—В–Њ—Й–∞–Ї, –≥–ї–Є–Ї–Њ–Ј–Є–ї–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –Ї—А–Њ–≤–Є (–Ґ–У, –Ю–•–°, –•–° –Ы–Я–Т–Я, –Ш–Р), –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ш–†–Ш –Є –°––њ–µ–њ—В–Є–і–∞ –њ–Њ—Б–ї–µ –Я–Ґ–Ґ–У –і–Њ –Є –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 3.
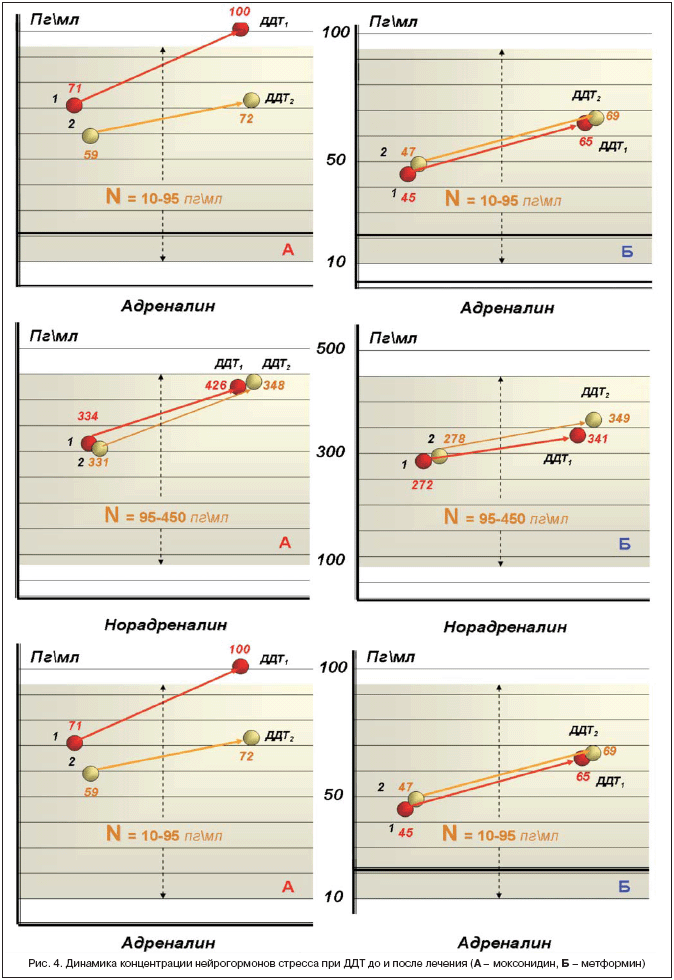
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј –і–∞–љ–љ—Л—Е —В–∞–±–ї–Є—Ж—Л –Є –і–Є–∞–≥—А–∞–Љ–Љ (—А–Є—Б. 4), –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –Р –Є—Б—Е–Њ–і–љ—Л–µ —Б—А–µ–і–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –љ–µ–є—А–Њ–≥–Њ—А–Љ–Њ–љ–Њ–≤ (–љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ, –∞–і—А–µ–љ–∞–ї–Є–љ) –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ, —З–µ–Љ –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –С: —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –љ–∞ 18,6 –Є 36,6% (p<0,01), –љ–Њ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –њ—А–µ–і–µ–ї–∞—Е —А–µ—Д–µ—А–µ–љ—В–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –љ–Њ—А–Љ—Л (–і–Њ—Д–∞–Љ–Є–љ – 10–100 –Я–≥/–Љ–ї, –љ–Њ—А–∞–і—А–µ–љ–∞–ї–Є–љ – 95–450 –Я–≥/–Љ–ї, –∞–і—А–µ–љ–∞–ї–Є–љ 10–85 –Я–≥/–Љ–ї). –Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ф–Ф–Ґ –і–Њ –ї–µ—З–µ–љ–Є—П –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –Р –і–Њ—Д–∞–Љ–Є–љ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–ї—Б—П –љ–∞ 8,6% (p<0,05), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –С –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Г–≤–µ–ї–Є—З–Є–ї—Б—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —В–Њ–ї—М–Ї–Њ –љ–∞ 5,2% (p>0,05); –Њ—Б—В–∞–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ф–Ф–Ґ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї–Є—Б—М –≤ –њ—А–µ–і–µ–ї–∞—Е —А–µ—Д–µ—А–µ–љ—В–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –љ–Њ—А–Љ—Л. –Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –і–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ф–Ф–Ґ: –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –Р (–Љ–Њ–Ї—Б–Њ–љ–Є–і–Є–љ) –њ—А–Є –Ф–Ф–Ґ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –љ–∞—А–∞—Б—В–∞–љ–Є–µ —Г—А–Њ–≤–љ–µ–є –љ–µ–є—А–Њ–≥–Њ—А–Љ–Њ–љ–Њ–≤, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Р–°, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –С —Н—В–Њ—В –њ—А–Є—А–Њ—Б—В —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П.
–Ш—Б—Е–Њ–і–љ—Л–µ —Б—Г–Љ–Љ–∞—А–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ, –ї–Є–њ–Є–і–љ–Њ–≥–Њ –њ—А–Њ—Д–Є–ї–µ–є –Є –Я–Ґ–Ґ–У –њ–Њ –њ–Њ–і–≥—А—Г–њ–њ–∞–Љ (–Р –Є –С) –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є (—Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ) –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –і—А—Г–≥ –Њ—В –і—А—Г–≥–∞. –Т –њ–Њ–і–≥—А—Г–њ–њ–µ –Р –Є–Љ–µ–ї–Њ –Љ–µ—Б—В–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ (p<0,001) –Є—Б—Е–Њ–і–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ш–†–Ш –Є –°––њ–µ–њ—В–Є–і–∞, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –њ–Њ–і–≥—А—Г–њ–њ—Л –С —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –љ–∞ 80 –Є –љ–∞ 97%, —З—В–Њ –Ї–Њ—Б–≤–µ–љ–љ–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Є –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ–є –≥–Є–њ–µ—А—Д—Г–љ–Ї—Ж–Є–Є –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –°–Р–°. –†–∞—Б—З–µ—В–љ—Л–є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –Ш–† (–Ъ–Ш–† = –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Є–µ –≥–ї—О–Ї–Њ–Ј–∞ –њ–ї–∞–Ј–Љ—Л –љ–∞—В–Њ—Й–∞–Ї –љ–∞ –Ш–†–Ш –љ–∞—В–Њ—Й–∞–Ї –і–µ–ї–µ–љ–љ–Њ–є –љ–∞ 22,5) –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –Р = 3,51 –Є –њ—А–µ–≤—Л—И–∞–ї –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –С = 2,03 –љ–∞ 42,2% (p<0,01).
–Я–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П (–≤ –Ї–Њ–љ—Ж–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —З–µ—А–µ–Ј 8 –љ–µ–і–µ–ї—М) –≤ –њ–Њ–і–≥—А—Г–њ–њ–∞—Е –Р –Є –С –Њ—В–Љ–µ—З–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Ш–†, —З—В–Њ —Б—Г–Љ–Љ–∞—А–љ–Њ (–≤ —Ж–µ–ї–Њ–Љ –њ–Њ –≥—А—Г–њ–њ–µ) –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А—Г–µ—В—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –њ–ї–Њ—Й–∞–і–Є –њ–Њ–і –Ї—А–Є–≤–Њ–є –Ш–†–Ш –љ–∞ 35%, p<0,001 –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Я–Ґ–Ґ–У (p<0,01) (—А–Є—Б. 5).
–Э–∞ —Д–Њ–љ–µ —Б–љ–Є–ґ–µ–љ–Є—П –Ш–† —Г –±–Њ–ї—М–љ—Л—Е –Р–У, —Б–Њ—З–µ—В–∞—О—Й–µ–є—Б—П —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –Њ—В–Љ–µ—З–µ–љ—Л –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Б–і–≤–Є–≥–Є –≤ —Г–≥–ї–µ–≤–Њ–і–љ–Њ–Љ –Њ–±–Љ–µ–љ–µ, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П HbA1c –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –Р –љ–∞ 9,7% (–Њ—В 7,42±0,3 –і–Њ 6,7±0,21%, p<0,05); –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –С –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї—Б—П —В–Њ–ї—М–Ї–Њ –љ–∞ 8,3% (–Њ—В 7,43±0,2 –і–Њ 6,81±0,2%, p<0,05).
–Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —Б–і–≤–Є–≥–Є –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Є —Б–Љ–µ—Й–µ–љ–Є—О –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –Ї—А–Њ–≤–Є –≤ —Б—В–Њ—А–Њ–љ—Г –∞–љ—В–Є–∞—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В–Є: –Ґ–У –Є –Ш–Р —Б–љ–Є–Ј–Є–ї–Є—Б—М —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –Р –љ–∞ 15,4 –Є 13,5%, –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ –С – –љ–∞ 22,4 –Є 15,4%; –•–° –Ы–Я–Т–Я —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–ї—Б—П –љ–∞ 9,5 –Є 14,3% (—А–∞–Ј–љ–Є—Ж–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–∞, p<0,01).
–°—Г–Љ–Љ–∞—А–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –°–Р–°, –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –Ш–†, –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–Њ–≤ –Ї—А–Њ–≤–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—О —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П –і–∞–≤–ї–µ–љ–Є—П, —Б–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ (p<0,01) —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –≤ —Ж–µ–ї–Њ–Љ –њ–Њ –≥—А—Г–њ–њ–µ –°–Р–Ф –љ–∞ 15,5% (–Њ—В 159,1±3,9 –і–Њ 134,4±3,3 –Љ–Љ —А—В.—Б—В.) –Є –Ф–Р–Ф –љ–∞ 13,6% (–Њ—В 98,2±3,9 –і–Њ 84,8±2,9 –Љ–Љ —А—В.—Б—В.).



–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Ь–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ. –Ь–Њ—Б–Ї–≤–∞. «–Ь–Х–Ф–њ—А–µ—Б––Є–љ—Д–Њ—А–Љ». 2007;
2. –Ь–Ї—А—В—Г–Љ—П–љ –Р.–Ь., –С–Є—А—О–Ї–Њ–≤–∞ –Х.–Т. –Ю—Б–љ–Њ–≤–љ–Њ–є –њ–Њ–і—Е–Њ–і –Ї —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. Consilium medicum. 2006. –Ґ 8, вДЦ 5, 54–57;
3. –Ь—Л—З–Ї–∞ –Т.–С., –І–∞–Ј–Њ–≤–∞ –Ш.–Х. –Ь–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П. (–Я–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–Њ –љ–∞ –Њ—Б–љ–Њ–≤–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є —Н–Ї—Б–њ–µ—А—В–Њ–≤ –Т–Э–Ю–Ъ –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. 2008., 1–16;
4. –І–∞–Ј–Њ–≤–∞ –Ш.–Х., –Р–ї–Љ–∞–Ј–Њ–≤ –Т.–Р., –®–ї—П—Е—В–Њ –Х.–Т. –Ь–Њ–Ї—Б–Њ–љ–Є–і–Є–љ —Г–ї—Г—З—И–∞–µ—В –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–є –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є–є –Ї–Њ–љ—В—А–Њ–ї—М —Г –њ–∞—Ж–Є–љ—В–Њ–≤ —Б –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–µ–є –Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ: –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ ALMAZ. Diabetes, Obesity and Metabolism. 2006. 8, 456–465;
5. –®–µ–≤—З–µ–љ–Ї–Њ –Ю.–Я., –Я—А–∞—Б–Ї—Г—А–љ–Є—З–Є–є –Х.–Р., –®–µ–≤—З–µ–љ–Њ –Р.–Ю. –Р—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–Њ–љ–Є—П –Є –Њ–ґ–Є—А–µ–љ–Є–µ. –Ь–Њ—Б–Ї–≤–∞. «–†–µ–Њ—Д–∞—А–Љ». 2006;
6. Barbato J.E., Zuckerbraun B.S., Overbaus M. And all. Nitric oxide modulates vascular inflammation and intimal hyperplasia in insulin resistance and metabolic syndrome. J. Physiol. Heart. Circ. 2005. 289, 228–236;
7. Caballero A.E. Endothelial dysfunction in obesity and insulin resistance: a road to diabetes and heart disease. Obes. Res. 2003. 11, 1278–1289;
8. Rabmouni K., Correia M.L.G., Haynes W.G. and all. Obesity –associated Hypertension. New insights into mechanisms. Hypertension. 2005. 45, 9–14;
9. Seelig M.S. Metabolic Sindrom–X. A complex of common diseases – diabetes, hypertension, heart disease, dyslipidemia and obesity – marked by insulin resistance and low magnesium/high calcium. Mineral Res. Intern. Tech. Prod. Infor.2003. 1–11.












