–£–≤–Β–¥–Β–Ϋ–Η–Β
–™–Η–Ω–Ψ―³–Ψ―¹―³–Α―²–Α–Ζ–Η―è (–™–Λ–Λ) βÄî ―Ä–Β–¥–Κ–Ψ–Β –Ϋ–Α―¹–Μ–Β–¥―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Β –Φ–Β―²–Α–±–Ψ–Μ–Η―΅–Β―¹–Κ–Ψ–Β –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Β, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ–Ψ–Β –Φ―É―²–Α―Ü–Η―è–Φ–Η –≤ –≥–Β–Ϋ–Β ALPL, –Κ–Ψ–¥–Η―Ä―É―é―â–Β–Φ –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ ―³–Β―Ä–Φ–Β–Ϋ―²–Α ―²–Κ–Α–Ϋ–Β–Ϋ–Β―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Ψ–Ι ―â–Β–Μ–Ψ―΅–Ϋ–Ψ–Ι ―³–Ψ―¹―³–Α―²–Α–Ζ―΄ (–Δ–ù–©–Λ). –ö–Α–Ϋ–Α–¥―¹–Κ–Η–Ι –≤―Ä–Α―΅ J.C. Rathbun –Ω―Ä–Η –Ψ–Ω–Η―¹–Α–Ϋ–Η–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹ –Κ―Ä–Α–Ι–Ϋ–Β –Ϋ–Η–Ζ–Κ–Η–Φ ―É―Ä–Ψ–≤–Ϋ–Β–Φ ―â–Β–Μ–Ψ―΅–Ϋ–Ψ–Ι ―³–Ψ―¹―³–Α―²–Α–Ζ―΄ (–©–Λ) –≤–Ω–Β―Ä–≤―΄–Β –Ω―Ä–Η–Φ–Β–Ϋ–Η–Μ ―²–Β―Ä–Φ–Η–Ϋ ¬Ϊ–≥–Η–Ω–Ψ―³–Ψ―¹―³–Α―²–Α–Ζ–Η―è¬Μ [1]. –ö–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Β ―¹–Η–Φ–Ω―²–Ψ–Φ―΄ –™–Λ–Λ –Ϋ–Β–Ψ–¥–Ϋ–Ψ―Ä–Ψ–¥–Ϋ―΄: –Ψ―² ―³–Α―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –≤–Α―Ä–Η–Α–Ϋ―²–Α ―¹ –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ–Ι –≥–Η–Ω–Ψ–Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Α―Ü–Η–Β–Ι ―¹–Κ–Β–Μ–Β―²–Α –Η –¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨―é –¥–Ψ –Ω–Ψ―¹―²–Β–Ω–Β–Ϋ–Ϋ–Ψ –Ω―Ä–Ψ–≥―Ä–Β―¹―¹–Η―Ä―É―é―â–Β–≥–Ψ –Ψ―¹―²–Β–Ψ–Ω–Ψ―Ä–Ψ–Ζ–Α ―É –≤–Ζ―Ä–Ψ―¹–Μ―΄―Ö. –ù–Α ―¹–Β–≥–Ψ–¥–Ϋ―è―à–Ϋ–Η–Ι –¥–Β–Ϋ―¨ –Ψ–±―â–Β–Ω―Ä–Η–Ϋ―è―²–Ψ –≤―΄–¥–Β–Μ―è―²―¨ –Ω―è―²―¨ –Ψ―¹–Ϋ–Ψ–≤–Ϋ―΄―Ö ―³–Ψ―Ä–Φ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² –≤–Ψ–Ζ―Ä–Α―¹―²–Α –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η―è –Ω–Β―Ä–≤―΄―Ö ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤: –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Α―è, –Η–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Α―è, –¥–Β―²―¹–Κ–Α―è, –≤–Ζ―Ä–Ψ―¹–Μ–Α―è, –Α ―²–Α–Κ–Ε–Β –Ψ–¥–Ψ–Ϋ―²–Ψ–≥–Η–Ω–Ψ―³–Ψ―¹―³–Α―²–Α–Ζ–Η―è [2].
–Δ–Ψ―΅–Ϋ–Α―è ―Ä–Α―¹–Ω―Ä–Ψ―¹―²―Ä–Α–Ϋ–Β–Ϋ–Ϋ–Ψ―¹―²―¨ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è –Ψ―¹―²–Α–Β―²―¹―è –Ϋ–Β–Η–Ζ–≤–Β―¹―²–Ϋ–Ψ–Ι –Η –Φ–Ψ–Ε–Β―² –≤–Α―Ä―¨–Η―Ä–Ψ–≤–Α―²―¨ –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Η, –Φ–Β―²–Ψ–¥–Α –Ψ―Ü–Β–Ϋ–Κ–Η –Η ―³–Ψ―Ä–Φ―΄ –™–Λ–Λ. –≠―²–Ϋ–Η―΅–Β―¹–Κ–Α―è –≥―Ä―É–Ω–Ω–Α ―¹ ―¹–Α–Φ―΄–Φ –≤―΄―¹–Ψ–Κ–Η–Φ ―É―Ä–Ψ–≤–Ϋ–Β–Φ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Β–Φ–Ψ―¹―²–Η –™–Λ–Λ βÄî ―ç―²–Ψ –Φ–Β–Ϋ–Ϋ–Ψ–Ϋ–Η―²―΄ –≤ –€–Α–Ϋ–Η―²–Ψ–±–Β, –ö–Α–Ϋ–Α–¥–Α. –Γ–Ψ–Ψ–±―â–Α–Β―²―¹―è, ―΅―²–Ψ –≤ ―ç―²–Ψ–Ι –Ω–Ψ–Ω―É–Μ―è―Ü–Η–Η 1 –Η–Ζ 25 ―΅–Β–Μ–Ψ–≤–Β–Κ –Ϋ–Β―¹–Β―² –Φ―É―²–Α―Ü–Η―é ALPL –Η –Ω―Ä–Η–Φ–Β―Ä–Ϋ–Ψ ―É 1 –Η–Ζ 2500 –Ϋ–Ψ–≤–Ψ―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ―΄―Ö –Η–Φ–Β–Β―²―¹―è –Μ–Β―²–Α–Μ―¨–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α –™–Λ–Λ. –†–Α―¹–Ω―Ä–Ψ―¹―²―Ä–Α–Ϋ–Β–Ϋ–Ϋ–Ψ―¹―²―¨ ―²―è–Ε–Β–Μ―΄―Ö ―³–Ψ―Ä–Φ –™–Λ–Λ –Ψ―Ü–Β–Ϋ–Η–≤–Α–Β―²―¹―è –≤ 1 –Ϋ–Α 100 000 ―Ä–Ψ–Ε–¥–Β–Ϋ–Η–Ι –≤ –ö–Α–Ϋ–Α–¥–Β [3]. –€–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ–Ψ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Ψ, ―΅―²–Ψ ―΅–Α―¹―²–Ψ―²–Α ―²―è–Ε–Β–Μ―΄―Ö ―³–Ψ―Ä–Φ –™–Λ–Λ –≤ –ï–≤―Ä–Ψ–Ω–Β ―¹–Ψ―¹―²–Α–≤–Μ―è–Β―² 1 –Ϋ–Α 300 000, –Ϋ–Ψ ―É–Φ–Β―Ä–Β–Ϋ–Ϋ―΄–Β ―³–Ψ―Ä–Φ―΄ –™–Λ–Λ, –Ω–Ψ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α–Φ ―²–Ψ–≥–Ψ –Ε–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è, –≤―¹―²―Ä–Β―΅–Α―é―²―¹―è –≤ 50 ―Ä–Α–Ζ ―΅–Α―â–Β [4]. –î–Α–Ϋ–Ϋ―΄–Β –Ψ ―Ä–Α―¹–Ω―Ä–Ψ―¹―²―Ä–Α–Ϋ–Β–Ϋ–Ϋ–Ψ―¹―²–Η –≤ –†–Ψ―¹―¹–Η–Η –Ψ―²―¹―É―²―¹―²–≤―É―é―², –Ψ–¥–Ϋ–Α–Κ–Ψ –Ω―Ä–Β–¥–Ω–Ψ–Μ–Α–≥–Α–Β–Φ–Α―è ―΅–Α―¹―²–Ψ―²–Α –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η―è ―²―è–Ε–Β–Μ―΄―Ö ―³–Ψ―Ä–Φ βÄî 1 –Ϋ–Α 100 000 –Ϋ–Ψ–≤–Ψ―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ―΄―Ö [5].
–≠―²–Η–Ψ–Μ–Ψ–≥–Η―è –Η –Ω–Α―²–Ψ–≥–Β–Ϋ–Β–Ζ –™–Λ–Λ
–≠―²–Η–Ψ–Μ–Ψ–≥–Η―è –Η –Ω–Α―²–Ψ–≥–Β–Ϋ–Β–Ζ –™–Λ–Λ –¥–Ψ –Ϋ–Α―¹―²–Ψ―è―â–Β–≥–Ψ –≤―Ä–Β–Φ–Β–Ϋ–Η –Ψ―¹―²–Α―é―²―¹―è –Ω―Ä–Β–¥–Φ–Β―²–Ψ–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι. –€―É―²–Α―Ü–Η–Η –≤ –≥–Β–Ϋ–Β ALPL, ―²–Α–Κ–Ε–Β –Η–Ζ–≤–Β―¹―²–Ϋ–Ψ–Φ –Κ–Α–Κ TNSALP, –Κ–Α―Ä―²–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–Φ –Ϋ–Α 1 ―Ö―Ä–Ψ–Φ–Ψ―¹–Ψ–Φ–Β (1p36.12), –≤―΄–Ζ―΄–≤–Α―é―² ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Δ–ù–©–Λ [6]. –Δ―è–Ε–Β–Μ―΄–Β ―³–Ψ―Ä–Φ―΄ ―¹ ―Ä–Α–Ϋ–Ϋ–Η–Φ –Ϋ–Α―΅–Α–Μ–Ψ–Φ –™–Λ–Λ ―¹ –±–Ψ–Μ―¨―à–Β–Ι –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨―é –±―É–¥―É―² –Η–Φ–Β―²―¨ –Α―É―²–Ψ―¹–Ψ–Φ–Ϋ–Ψ-―Ä–Β―Ü–Β―¹―¹–Η–≤–Ϋ―΄–Ι ―²–Η–Ω –Ϋ–Α―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è, ―²–Ψ–≥–¥–Α –Κ–Α–Κ ―³–Ψ―Ä–Φ―΄ ―¹ –±–Ψ–Μ–Β–Β –Ω–Ψ–Ζ–¥–Ϋ–Η–Φ –¥–Β–±―é―²–Ψ–Φ –Φ–Ψ–≥―É―² –±―΄―²―¨ ―É–Ϋ–Α―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ―΄ –Κ–Α–Κ –Ω–Ψ –Α―É―²–Ψ―¹–Ψ–Φ–Ϋ–Ψ-―Ä–Β―Ü–Β―¹―¹–Η–≤–Ϋ–Ψ–Φ―É, ―²–Α–Κ –Η –Ω–Ψ –Α―É―²–Ψ―¹–Ψ–Φ–Ϋ–Ψ-–¥–Ψ–Φ–Η–Ϋ–Α–Ϋ―²–Ϋ–Ψ–Φ―É ―²–Η–Ω―É –Ϋ–Α―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è [7]. –£ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –≤―Ä–Β–Φ―è –Ψ–Ω–Η―¹–Α–Ϋ–Ψ –Ϋ–Β –Φ–Β–Ϋ–Β–Β 411 –Φ―É―²–Α―Ü–Η–Ι –≥–Β–Ϋ–Α ALPL [8], –Κ–Α–Ε–¥–Α―è –Η–Ζ –Κ–Ψ―²–Ψ―Ä―΄―Ö –Φ–Ψ–Ε–Β―² ―¹–Ϋ–Η–Ε–Α―²―¨ –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Δ–ù–©–Λ.
–Δ–ù–©–Λ –Η–≥―Ä–Α–Β―² –Ω―Ä―è–Φ―É―é ―Ä–Ψ–Μ―¨ –≤ –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Β –Ψ―²―â–Β–Ω–Μ–Β–Ϋ–Η―è ―³–Ψ―¹―³–Α―²–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ –Ψ―² ―Ü–Β–Μ–Ψ–≥–Ψ ―Ä―è–¥–Α ―¹―É–±―¹―²―Ä–Α―²–Ψ–≤ [9]. –ü―Ä–Η ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Η –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Δ–ù–©–Λ –Ϋ–Α―Ä―É―à–Α–Β―²―¹―è –Φ–Β―²–Α–±–Ψ–Μ–Η–Ζ–Φ –Ϋ–Β–Ψ―Ä–≥–Α–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ω–Η―Ä–Ψ―³–Ψ―¹―³–Α―²–Α, –Ω–Η―Ä–Η–¥–Ψ–Κ―¹–Α–Μ―¨-5-―³–Ψ―¹―³–Α―²–Α (–≤–Η―²–Α–Φ–Η–Ϋ B6) –Η ―³–Ψ―¹―³–Ψ―ç―²–Α–Ϋ–Ψ–Μ–Α–Φ–Η–Ϋ–Α, –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² –Η―Ö –≤–Ϋ–Β–Κ–Μ–Β―²–Ψ―΅–Ϋ–Ψ–Β –Ϋ–Α–Κ–Ψ–Ω–Μ–Β–Ϋ–Η–Β [10].
–£ –Ϋ–Ψ―Ä–Φ–Β –Δ–ù–©–Λ ―Ä–Α―¹―â–Β–Ω–Μ―è–Β―² –Ϋ–Β–Ψ―Ä–≥–Α–Ϋ–Η―΅–Β―¹–Κ–Η–Ι –Ω–Η―Ä–Ψ―³–Ψ―¹―³–Α―² –¥–Ψ –¥–≤―É―Ö –Φ–Ψ–Μ–Β–Κ―É–Μ ―³–Ψ―¹―³–Α―²–Α, –Κ–Ψ―²–Ψ―Ä―΄–Β, ―¹–≤―è–Ζ―΄–≤–Α―è―¹―¨ ―¹ –Κ–Α–Μ―¨―Ü–Η–Β–Φ, ―³–Ψ―Ä–Φ–Η―Ä―É―é―² –Κ―Ä–Η―¹―²–Α–Μ–Μ―΄ –≥–Η–¥―Ä–Ψ–Κ―¹–Η–Α–Ω–Α―²–Η―²–Α, –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ―΄–Β –¥–Μ―è –Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Α―Ü–Η–Η –Κ–Ψ―¹―²–Ϋ–Ψ–≥–Ψ –Φ–Α―²―Ä–Η–Κ―¹–Α –Η ―Ä–Ψ―¹―²–Α –Κ–Ψ―¹―²–Ϋ–Ψ–Ι ―²–Κ–Α–Ϋ–Η [9]. –£–Ϋ–Β–Κ–Μ–Β―²–Ψ―΅–Ϋ–Ψ–Β –Ϋ–Α–Κ–Ψ–Ω–Μ–Β–Ϋ–Η–Β –Ϋ–Β–Ψ―Ä–≥–Α–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ω–Η―Ä–Ψ―³–Ψ―¹―³–Α―²–Α –±–Μ–Ψ–Κ–Η―Ä―É–Β―² ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β –Κ―Ä–Η―¹―²–Α–Μ–Μ–Ψ–≤ –≥–Η–¥―Ä–Ψ–Κ―¹–Η–Α–Ω–Α―²–Η―²–Α [11βÄ™13], ―΅―²–Ψ –Ω―Ä–Β–Ω―è―²―¹―²–≤―É–Β―² –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Ψ–Ι –Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Α―Ü–Η–Η –Κ–Ψ―¹―²–Ϋ–Ψ–Ι ―²–Κ–Α–Ϋ–Η –Η –Ω―Ä–Η–≤–Ψ–¥–Η―² –Κ ―¹–Κ–Β–Μ–Β―²–Ϋ―΄–Φ –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η―è–Φ. –ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, –Ϋ–Α–Κ–Ψ–Ω–Μ–Β–Ϋ–Ϋ―΄–Ι –Ϋ–Β–Ψ―Ä–≥–Α–Ϋ–Η―΅–Β―¹–Κ–Η–Ι –Ω–Η―Ä–Ψ―³–Ψ―¹―³–Α―² –Α–Κ―²–Η–≤–Ϋ–Ψ ―¹–Ψ–Β–¥–Η–Ϋ―è–Β―²―¹―è ―¹ –Η–Ψ–Ϋ–Α–Φ–Η –Κ–Α–Μ―¨―Ü–Η―è –Η –Ψ–±―Ä–Α–Ζ―É–Β―² –Κ―Ä–Η―¹―²–Α–Μ–Μ―΄ –Ω–Η―Ä–Ψ―³–Ψ―¹―³–Α―²–Α –Κ–Α–Μ―¨―Ü–Η―è, –Κ–Ψ―²–Ψ―Ä―΄–Ι –Ψ―²–Κ–Μ–Α–¥―΄–≤–Α–Β―²―¹―è –Μ–Η–±–Ψ –≤ –Ω–Ψ―΅–Κ–Α―Ö, –≤―΄–Ζ―΄–≤–Α―è –Ϋ–Β―³―Ä–Ψ–Κ–Α–Μ―¨―Ü–Η–Ϋ–Ψ–Ζ, –Μ–Η–±–Ψ –≤ ―¹―É―¹―²–Α–≤–Α―Ö, ―¹―²–Α–Ϋ–Ψ–≤―è―¹―¨ –Ω―Ä–Η―΅–Η–Ϋ–Ψ–Ι –Κ―Ä–Η―¹―²–Α–Μ–Μ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Α―Ä―²―Ä–Η―²–Α –Η –Ω―¹–Β–≤–¥–Ψ–Ω–Ψ–¥–Α–≥―Ä―΄ [14]. –ê–Ϋ–Ψ–Φ–Α–Μ–Η–Η ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –Κ–Ψ―¹―²–Β–Ι –≥―Ä―É–¥–Ϋ–Ψ–Ι –Κ–Μ–Β―²–Κ–Η –Φ–Ψ–≥―É―² –Ω―Ä–Η–≤–Ψ–¥–Η―²―¨ –Κ –≤―²–Ψ―Ä–Η―΅–Ϋ–Ψ–Ι –≥–Η–Ω–Ψ–Ω–Μ–Α–Ζ–Η–Η –Μ–Β–≥–Κ–Η―Ö –Η, –Κ–Α–Κ ―¹–Μ–Β–¥―¹―²–≤–Η–Β, –Κ ―Ä–Α–Ζ–≤–Η―²–Η―é –¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―Ä–Α–Ϋ–Ϋ–Β–≥–Ψ –≤–Ψ–Ζ―Ä–Α―¹―²–Α ―¹ –™–Λ–Λ [15].
–‰–Ζ–≤–Β―¹―²–Ϋ–Α –≤–Α–Ε–Ϋ–Α―è ―Ä–Ψ–Μ―¨ –≤–Η―²–Α–Φ–Η–Ϋ–Α –£6 –≤ ―Ä–Β–≥―É–Μ―è―Ü–Η–Η ―Ä–Α–±–Ψ―²―΄ –Ϋ–Β―Ä–≤–Ϋ–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄, –Ψ–±―É―¹–Μ–Ψ–≤–Μ–Β–Ϋ–Ϋ–Α―è –Β–≥–Ψ ―É―΅–Α―¹―²–Η–Β–Φ –≤ –Φ–Β―²–Α–±–Ψ–Μ–Η–Ζ–Φ–Β ―Ä―è–¥–Α –Ϋ–Β–Ι―Ä–Ψ―²―Ä–Α–Ϋ―¹–Φ–Η―²―²–Β―Ä–Ψ–≤. –î–Μ―è –Ω–Ψ―¹―²―É–Ω–Μ–Β–Ϋ–Η―è –≤–Η―²–Α–Φ–Η–Ϋ–Α –£6 –≤ –Π–ù–Γ –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ –Ψ―²―â–Β–Ω–Μ–Β–Ϋ–Η–Β ―³–Ψ―¹―³–Α―²–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ –Ψ―² –Ω–Η―Ä–Η–¥–Ψ–Κ―¹–Α–Μ―¨-5-―³–Ψ―¹―³–Α―²–Α (–Α–Κ―²–Η–≤–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α –≤–Η―²–Α–Φ–Η–Ϋ–Α B6). –ö–Α―²–Α–Μ–Η–Ζ–Α―²–Ψ―Ä–Ψ–Φ –Ψ―²―â–Β–Ω–Μ–Β–Ϋ–Η―è ―³–Ψ―¹―³–Α―²–Α ―è–≤–Μ―è–Β―²―¹―è –Δ–ù–©–Λ. –û–±―Ä–Α–Ζ–Ψ–≤–Α–≤―à–Η–Ι―¹―è –Ω–Η―Ä–Η–¥–Ψ–Κ―¹–Α–Μ―¨ –Ω―Ä–Ψ–Ϋ–Η–Κ–Α–Β―² ―΅–Β―Ä–Β–Ζ –≥–Β–Φ–Α―²–Ψ―ç–Ϋ―Ü–Β―³–Α–Μ–Η―΅–Β―¹–Κ–Η–Ι –±–Α―Ä―¨–Β―Ä –Η –Ω–Ψ―¹–Μ–Β –Ψ–±―Ä–Α―²–Ϋ–Ψ–≥–Ψ –Ω―Ä–Η―¹–Ψ–Β–¥–Η–Ϋ–Β–Ϋ–Η―è ―³–Ψ―¹―³–Α―²–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ ―É―΅–Α―¹―²–≤―É–Β―² –≤ ―¹–Η–Ϋ―²–Β–Ζ–Β –Ϋ–Β–Ι―Ä–Ψ–Φ–Β–¥–Η–Α―²–Ψ―Ä–Ψ–≤ (–≤ ―΅–Α―¹―²–Ϋ–Ψ―¹―²–Η, –™–ê–€–ö) [16]. –ü―Ä–Η –™–Λ–Λ –Ϋ–Α―Ä―É―à–Α–Β―²―¹―è –Ω―Ä–Ψ―Ü–Β―¹―¹ –Ω–Ψ―¹―²―É–Ω–Μ–Β–Ϋ–Η―è –≤–Η―²–Α–Φ–Η–Ϋ–Α –£6 –≤ –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–Ι –Φ–Ψ–Ζ–≥, ―΅―²–Ψ –Ψ–±―É―¹–Μ–Ψ–≤–Μ–Η–≤–Α–Β―² –Ϋ–Β–≤―Ä–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è, –Ϋ–Α–Ω―Ä–Η–Φ–Β―Ä –≤–Η―²–Α–Φ–Η–Ϋ –£6-–Ζ–Α–≤–Η―¹–Η–Φ―΄–Β ―¹―É–¥–Ψ―Ä–Ψ–≥–Η [17].
–Λ―É–Ϋ–Κ―Ü–Η―è ―³–Ψ―¹―³–Ψ―ç―²–Α–Ϋ–Ψ–Μ–Α–Φ–Η–Ϋ–Α, –Β―â–Β –Ψ–¥–Ϋ–Ψ–≥–Ψ ―¹–Ψ–Β–¥–Η–Ϋ–Β–Ϋ–Η―è, –Κ–Ψ―²–Ψ―Ä–Ψ–Β –Α–Κ–Κ―É–Φ―É–Μ–Η―Ä―É–Β―²―¹―è –Ω―Ä–Η –™–Λ–Λ, ―à–Η―Ä–Ψ–Κ–Ψ –Ϋ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Μ–Α―¹―¨ [18]. –ï–≥–Ψ –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –≤ –Φ–Ψ―΅–Β –Φ–Ψ–Ε–Β―² ―¹–Η–Μ―¨–Ϋ–Ψ –Ω–Ψ–≤―΄―à–Α―²―¨―¹―è –Ω―Ä–Η ―²―è–Ε–Β–Μ―΄―Ö ―³–Ψ―Ä–Φ–Α―Ö –™–Λ–Λ. –≠―²–Ψ –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ―΄–Ι ―¹―É–±―¹―²―Ä–Α―² –Δ–ù–©–Λ, –Ϋ–Ψ –Ψ–Ϋ ―²–Α–Κ–Ε–Β –Φ–Ψ–Ε–Β―² –Φ–Β―²–Α–±–Ψ–Μ–Η–Ζ–Η―Ä–Ψ–≤–Α―²―¨―¹―è –¥―Ä―É–≥–Η–Φ–Η –Ω―É―²―è–Φ–Η. –Λ–Ψ―¹―³–Ψ―ç―²–Α–Ϋ–Ψ–Μ–Α–Φ–Η–Ϋ –±―΄–Μ –Ψ–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ –≤ ―¹–Ω–Η–Ϋ–Ϋ–Ψ–Φ–Ψ–Ζ–≥–Ψ–≤–Ψ–Ι –Ε–Η–¥–Κ–Ψ―¹―²–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹ –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ–Ψ–Ι –™–Λ–Λ, –Η ―Ä–Α–Ϋ–Β–Β –Ω―Ä–Β–¥–Ω–Ψ–Μ–Α–≥–Α–Μ–Α―¹―¨ ―¹–≤―è–Ζ―¨ –Φ–Β–Ε–¥―É ―³–Ψ―¹―³–Ψ―ç―²–Α–Ϋ–Ψ–Μ–Α–Φ–Η–Ϋ–Ψ–Φ –Η ―ç–Ω–Η–Μ–Β–Ω―¹–Η–Β–Ι [19]. –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, ―Ä–Ψ–Μ―¨ –Δ–ù–©–Λ –≤ –Ω–Α―²–Ψ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α –¥–Ψ –Κ–Ψ–Ϋ―Ü–Α –Ϋ–Β ―è―¹–Ϋ–Α –Η ―²―Ä–Β–±―É–Β―² –¥–Α–Μ―¨–Ϋ–Β–Ι―à–Β–≥–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –≤ –Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η–Η –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄―Ö –Ω–Μ–Ψ―Ö–Ψ –Η–Ζ―É―΅–Β–Ϋ–Ϋ―΄―Ö ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤ –™–Λ–Λ.
–ü–Α―²–Ψ–≥–Β–Ϋ–Β–Ζ –™–Λ–Λ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ –Ϋ–Α ―Ä–Η―¹―É–Ϋ–Κ–Β 1.
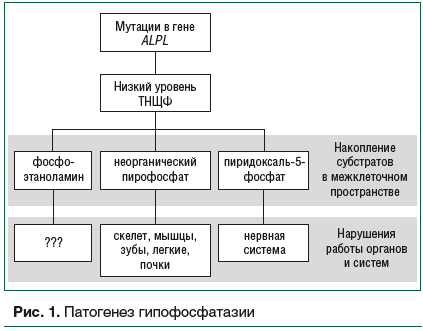
–ö–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Β ―³–Ψ―Ä–Φ―΄ –™–Λ–Λ
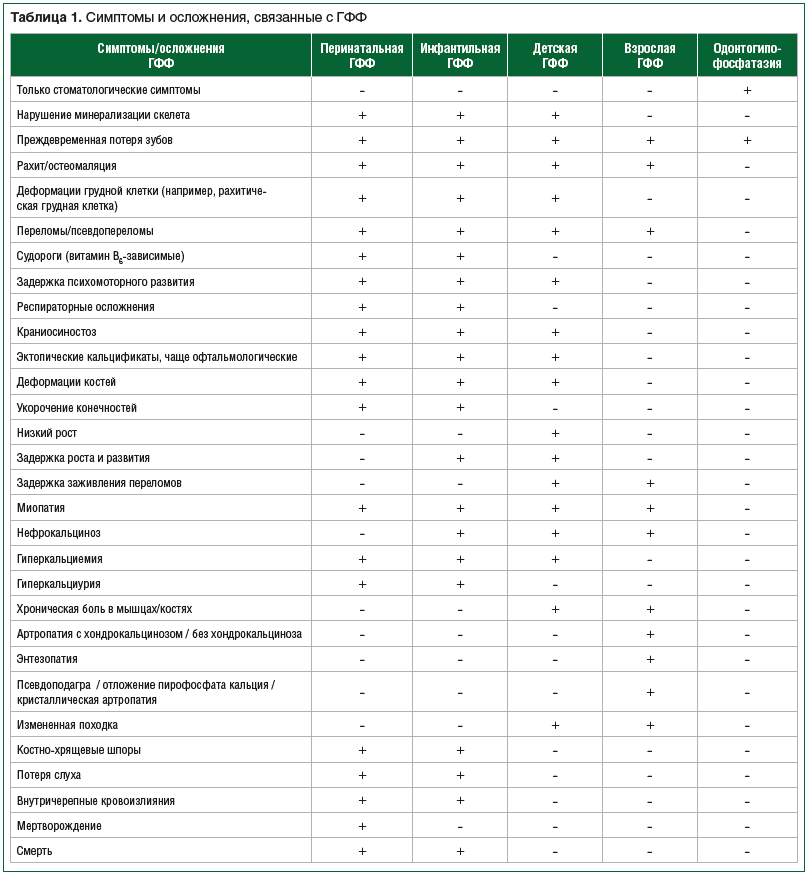
–Δ―è–Ε–Β―¹―²―¨ ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤ –Η –≤–Ψ–Ζ―Ä–Α―¹―² –Φ–Α–Ϋ–Η―³–Β―¹―²–Α―Ü–Η–Η –™–Λ–Λ –Ψ–Ω―Ä–Β–¥–Β–Μ―è―é―²―¹―è ―²–Η–Ω–Ψ–Φ –Ϋ–Α―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Η –Κ–Ψ–Ϋ–Κ―Ä–Β―²–Ϋ―΄–Φ–Η –Φ―É―²–Α―Ü–Η―è–Φ–Η. –ß–Β–Φ ―Ä–Α–Ϋ―¨―à–Β –≤–Ψ–Ζ–Ϋ–Η–Κ–Α–Β―² –¥–Β―³–Η―Ü–Η―² –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Δ–ù–©–Λ, ―²–Β–Φ –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ –±–Ψ–Μ–Β–Β ―³–Α―²–Α–Μ―¨–Ϋ―΄–Φ–Η –Φ–Ψ–≥―É―² –±―΄―²―¨ –Ω–Ψ―¹–Μ–Β–¥―¹―²–≤–Η―è. –ù–Α–Η–±–Ψ–Μ–Β–Β –Ψ–±―â–Β–Ω―Ä–Η–Ϋ―è―²–Α―è –Κ–Μ–Α―¹―¹–Η―³–Η–Κ–Α―Ü–Η―è, –Κ–Ψ―²–Ψ―Ä–Α―è –±–Α–Ζ–Η―Ä―É–Β―²―¹―è –Ϋ–Α –≤–Ψ–Ζ―Ä–Α―¹―²–Β –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η―è –Ω–Β―Ä–≤―΄―Ö ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è, –≤―΄–¥–Β–Μ―è–Β―² 4 –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Β ―³–Ψ―Ä–Φ―΄ –™–Λ–Λ: –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ―É―é (–Μ–Β―²–Α–Μ―¨–Ϋ―É―é), –Η–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ―É―é, –¥–Β―²―¹–Κ―É―é –Η –≤–Ζ―Ä–Ψ―¹–Μ―É―é [2]. –ü–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η―Ä―É–Β―²―¹―è –≤–Ϋ―É―²―Ä–Η―É―²―Ä–Ψ–±–Ϋ–Ψ (–Ω―Ä–Η ―É–Μ―¨―²―Ä–Α–Ζ–≤―É–Κ–Ψ–≤–Ψ–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η) –Η–Μ–Η –Ϋ–Β–Ω–Ψ―¹―Ä–Β–¥―¹―²–≤–Β–Ϋ–Ϋ–Ψ –Ω―Ä–Η ―Ä–Ψ–Ε–¥–Β–Ϋ–Η–Η, –Η–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α βÄî –≤ –Ω–Β―Ä–≤―΄–Β –¥–Ϋ–Η –Ω–Ψ―¹–Μ–Β ―Ä–Ψ–Ε–¥–Β–Ϋ–Η―è –¥–Ψ 6 –Φ–Β―¹. –Ε–Η–Ζ–Ϋ–Η, –¥–Β―²―¹–Κ–Α―è ―³–Ψ―Ä–Φ–Α βÄî –Ψ―² 6 –Φ–Β―¹. –¥–Ψ 18 –Μ–Β―², –≤–Ζ―Ä–Ψ―¹–Μ–Α―è ―³–Ψ―Ä–Φ–Α βÄî ―¹―²–Α―Ä―à–Β 18 –Μ–Β―². –Δ–Α–Κ–Ε–Β –≤―΄–¥–Β–Μ―è―é―² –Ψ–¥–Ψ–Ϋ―²–Ψ–≥–Η–Ω–Ψ―³–Ψ―¹―³–Α―²–Α–Ζ–Η―é, –Κ–Ψ–≥–¥–Α –Ω―Ä–Η –Ψ―²―¹―É―²―¹―²–≤–Η–Η –¥―Ä―É–≥–Η―Ö ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è ―Ä–Β–≥–Η―¹―²―Ä–Η―Ä―É―é―² –Ω―Ä–Β–Ε–¥–Β–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―É―é –Ω–Ψ―²–Β―Ä―é –Φ–Ψ–Μ–Ψ―΅–Ϋ―΄―Ö –Η–Μ–Η –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ―΄―Ö –Ζ―É–±–Ψ–≤ [20]. –Γ–Η–Φ–Ω―²–Ψ–Φ―΄ ―Ä–Α–Ζ–Μ–Η―΅–Α―é―²―¹―è –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² –≤–Ψ–Ζ―Ä–Α―¹―²–Α, –Ϋ–Ψ –±–Β–Ζ –Μ–Β―΅–Β–Ϋ–Η―è –≤―¹–Β –Ω–Α―Ü–Η–Β–Ϋ―²―΄ ―¹ –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Ι (–Μ–Β―²–Α–Μ―¨–Ϋ–Ψ–Ι) ―³–Ψ―Ä–Φ–Ψ–Ι [21, 22], –Ω―Ä–Η–Φ–Β―Ä–Ϋ–Ψ –Ω–Ψ–Μ–Ψ–≤–Η–Ϋ–Α –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Η–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ–Ψ–Ι [22] –Η–Φ–Β―é―² –Ω–Μ–Ψ―Ö–Ψ–Ι –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ –Ε–Η–Ζ–Ϋ–Η. –î–Μ―è –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –¥―Ä―É–≥–Η–Φ–Η ―³–Ψ―Ä–Φ–Α–Φ–Η –™–Λ–Λ –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ –Ε–Η–Ζ–Ϋ–Η –±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Β–Ϋ, –Ψ–¥–Ϋ–Α–Κ–Ψ –±–Β–Ζ –Μ–Β―΅–Β–Ϋ–Η―è –Ψ–Ϋ–Η –Φ–Ψ–≥―É―² ―¹―²―Ä–Α–¥–Α―²―¨ –Ψ―² –Ω―Ä–Ψ–≥―Ä–Β―¹―¹–Η―Ä―É―é―â–Η―Ö –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι, ―΅–Α―¹―²–Ψ –Ω―Ä–Η–≤–Ψ–¥―è―â–Η―Ö –Κ –Η–Ϋ–≤–Α–Μ–Η–¥–Η–Ζ–Α―Ü–Η–Η.
–™–Λ–Λ βÄî –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Β ―¹ ―Ä–Α–Ζ–Ϋ–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ―΄–Φ–Η –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Φ–Η –Ω―Ä–Ψ―è–≤–Μ–Β–Ϋ–Η―è–Φ–Η. –£ ―²–Α–±–Μ–Η―Ü–Β 1 –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ―΄ –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η, ―¹–Η–Φ–Ω―²–Ψ–Φ―΄ –Η–Μ–Η –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η―è, ―¹–≤―è–Ζ–Α–Ϋ–Ϋ―΄–Β ―¹ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄–Φ–Η ―³–Ψ―Ä–Φ–Α–Φ–Η –™–Λ–Λ, ―¹–Ψ–±―Ä–Α–Ϋ–Ϋ―΄–Β –Η–Ζ –Φ–Ϋ–Ψ–Ε–Β―¹―²–≤–Α –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι [2, 23βÄ™25]. –®–Η―Ä–Ψ–Κ–Η–Ι ―¹–Ω–Β–Κ―²―Ä ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤ –Ψ―²–Φ–Β―΅–Α–Β―²―¹―è ―¹–Ψ ―¹―²–Ψ―Ä–Ψ–Ϋ―΄ –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –Κ–Ψ―¹―²–Ϋ–Ψ–Ι ―¹–Η―¹―²–Β–Φ―΄, –Ϋ–Ψ –Η –¥―Ä―É–≥–Η―Ö –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ –Η ―¹–Η―¹―²–Β–Φ, ―²–Α–Κ–Η―Ö –Κ–Α–Κ –Φ―΄―à―Ü―΄, ―¹―É―¹―²–Α–≤―΄, –Ψ―Ä–≥–Α–Ϋ―΄ –¥―΄―Ö–Α–Ϋ–Η―è, –Ϋ–Β―Ä–≤–Ϋ–Α―è ―¹–Η―¹―²–Β–Φ–Α –Η –Ω–Ψ―΅–Κ–Η, ―΅―²–Ψ –Φ–Ψ–Ε–Β―² –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –≤–Μ–Η―è―²―¨ –Ϋ–Α ―³–Η–Ζ–Η―΅–Β―¹–Κ–Ψ–Β –Ζ–¥–Ψ―Ä–Ψ–≤―¨–Β, –Κ–Α―΅–Β―¹―²–≤–Ψ –Ε–Η–Ζ–Ϋ–Η –Η –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ –¥–Μ―è –Ω–Α―Ü–Η–Β–Ϋ―²–Α.
–î–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Α
–™–Λ–Λ –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η―Ä―É–Β―²―¹―è –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ–Η–Η –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι –Κ–Α―Ä―²–Η–Ϋ―΄, ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –¥–Α–Ϋ–Ϋ―΄―Ö –Η ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–≤ –±–Η–Ψ―Ö–Η–Φ–Η―΅–Β―¹–Κ–Η―Ö ―²–Β―¹―²–Ψ–≤. –î–Η―³―³–Β―Ä–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ–Α―è –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Α –¥–Ψ–Μ–Ε–Ϋ–Α –Ω―Ä–Ψ–≤–Ψ–¥–Η―²―¨―¹―è ―¹ –¥―Ä―É–≥–Η–Φ–Η –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è–Φ–Η ―¹–Κ–Β–Μ–Β―²–Α, –≤–Κ–Μ―é―΅–Α―è ―Ä–Α―Ö–Η―², –Ψ―¹―²–Β–Ψ–Φ–Α–Μ―è―Ü–Η―é –Η –Ϋ–Β―¹–Ψ–≤–Β―Ä―à–Β–Ϋ–Ϋ―΄–Ι –Ψ―¹―²–Β–Ψ–≥–Β–Ϋ–Β–Ζ. –î–Β―³–Η―Ü–Η―² –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Δ–ù–©–Λ ―è–≤–Μ―è–Β―²―¹―è –±–Η–Ψ―Ö–Η–Φ–Η―΅–Β―¹–Κ–Η–Φ –Φ–Α―Ä–Κ–Β―Ä–Ψ–Φ, –Ω–Ψ–Ζ–≤–Ψ–Μ―è―é―â–Η–Φ –Η―¹–Κ–Μ―é―΅–Η―²―¨ –¥―Ä―É–≥―É―é ―¹–Κ–Β–Μ–Β―²–Ϋ―É―é –Ω–Α―²–Ψ–Μ–Ψ–≥–Η―é, –Ω―Ä–Η ―ç―²–Ψ–Φ –≤–Α–Ε–Ϋ–Ψ –Η–Ϋ―²–Β―Ä–Ω―Ä–Β―²–Η―Ä–Ψ–≤–Α―²―¨ ―Ä–Β–Ζ―É–Μ―¨―²–Α―² –Η–Ζ–Φ–Β―Ä–Β–Ϋ–Η―è –Δ–ù–©–Λ ―¹–Ψ–≥–Μ–Α―¹–Ϋ–Ψ ―Ä–Β―³–Β―Ä–Β–Ϋ―¹–Ϋ―΄–Φ –Η–Ϋ―²–Β―Ä–≤–Α–Μ–Α–Φ, ―É―΅–Η―²―΄–≤–Α―é―â–Η–Φ –Ω–Ψ–Μ –Η –≤–Ψ–Ζ―Ä–Α―¹―² –Ω–Α―Ü–Η–Β–Ϋ―²–Α (―Ä–Η―¹. 2) [10]. –Δ–Α–Κ–Ε–Β –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Α―²―¨ ―¹―²–Α–±–Η–Μ―¨–Ϋ–Ψ –Ϋ–Η–Ζ–Κ―É―é –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Δ–ù–©–Λ –≤ –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Η―Ö –Η–Ζ–Φ–Β―Ä–Β–Ϋ–Η―è―Ö. –ü–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –Ϋ–Η–Ζ–Κ–Η–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Δ–ù–©–Λ –Ω–Ψ–Φ–Η–Φ–Ψ –™–Λ–Λ –Φ–Ψ–Ε–Β―² –±―΄―²―¨ ―¹–≤―è–Ζ–Α–Ϋ ―¹ –Φ–Ϋ–Ψ–≥–Ψ―΅–Η―¹–Μ–Β–Ϋ–Ϋ―΄–Φ–Η –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è–Φ–Η, ―²–Α–Κ–Η–Φ–Η –Κ–Α–Κ –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β –Ω–Η―²–Α–Ϋ–Η―è, –¥–Β―³–Η―Ü–Η―² ―Ü–Η–Ϋ–Κ–Α, ―¹–Η–Ϋ–¥―Ä–Ψ–Φ –ö―É―à–Η–Ϋ–≥–Α, –Κ–Μ–Β–Ι–¥–Ψ–Κ―Ä–Α–Ϋ–Η–Α–Μ―¨–Ϋ–Α―è –¥–Η―¹–Ω–Μ–Α–Ζ–Η―è –Η –¥―Ä―É–≥–Η–Β ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è, –Η―Ö –Η―¹–Κ–Μ―é―΅–Β–Ϋ–Η–Β ―²–Α–Κ–Ε–Β –≤–Α–Ε–Ϋ–Ψ. –î–Ψ–Ω–Ψ–Μ–Ϋ–Η―²–Β–Μ―¨–Ϋ―΄–Β –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ―΄–Β ―²–Β―¹―²―΄, –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Α―é―â–Η–Β –¥–Η–Α–≥–Ϋ–Ψ–Ζ, –≤–Κ–Μ―é―΅–Α―é―² –≥–Η–Ω–Β―Ä–Κ–Α–Μ―¨―Ü–Η–Β–Φ–Η―é, –≥–Η–Ω–Β―Ä―³–Ψ―¹―³–Α―²–Β–Φ–Η―é –Η –≥–Η–Ω–Β―Ä–Κ–Α–Μ―¨―Ü–Η―É―Ä–Η―é, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –Ω―Ä–Η –Η–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Ψ–Ι –Η –¥–Β―²―¹–Κ–Ψ–Ι ―³–Ψ―Ä–Φ–Α―Ö. –î–Μ―è –Ψ–Κ–Ψ–Ϋ―΅–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Η –™–Λ–Λ –Ω―Ä–Ψ–≤–Ψ–¥–Η―²―¹―è ―²–Β―¹―²–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β –≥–Β–Ϋ–Α ALPL.
![–†–Η―¹. 2. –†–Β―³–Β―Ä–Β–Ϋ―¹–Ϋ―΄–Β –Η–Ϋ―²–Β―Ä–≤–Α–Μ―΄ –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –©–Λ –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² –≤–Ψ–Ζ―Ä–Α―¹―²–Α –Η –Ω–Ψ–Μ–Α (–Α–¥–Α–Ω―²–Η―Ä–Ψ–≤–Α–Ϋ–Ψ –Η–Ζ [26]) –†–Η―¹. 2. –†–Β―³–Β―Ä–Β–Ϋ―¹–Ϋ―΄–Β –Η–Ϋ―²–Β―Ä–≤–Α–Μ―΄ –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –©–Λ –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² –≤–Ψ–Ζ―Ä–Α―¹―²–Α –Η –Ω–Ψ–Μ–Α (–Α–¥–Α–Ω―²–Η―Ä–Ψ–≤–Α–Ϋ–Ψ –Η–Ζ [26])](/upload/medialibrary/61e/42-2.png)
–¦–Β―΅–Β–Ϋ–Η–Β
–î–Ψ –Ϋ–Β–¥–Α–≤–Ϋ–Β–≥–Ψ –≤―Ä–Β–Φ–Β–Ϋ–Η –Μ–Β―΅–Β–Ϋ–Η–Β –™–Λ–Λ –±―΄–Μ–Ψ ―²–Ψ–Μ―¨–Κ–Ψ ―¹–Η–Φ–Ω―²–Ψ–Φ–Α―²–Η―΅–Β―¹–Κ–Η–Φ –Η –Ω–Ψ–¥–¥–Β―Ä–Ε–Η–≤–Α―é―â–Η–Φ: –≥–Η–¥―Ä–Α―²–Α―Ü–Η―è, –Ψ–≥―Ä–Α–Ϋ–Η―΅–Β–Ϋ–Η–Β –Ω–Ψ―²―Ä–Β–±–Μ–Β–Ϋ–Η―è –Κ–Α–Μ―¨―Ü–Η―è, –≤ –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄―Ö ―¹–Μ―É―΅–Α―è―Ö βÄî –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β ―²–Η–Α–Ζ–Η–¥–Ϋ―΄―Ö –¥–Η―É―Ä–Β―²–Η–Κ–Ψ–≤ –Ω―Ä–Η –≥–Η–Ω–Β―Ä–Κ–Α–Μ―¨―Ü–Η–Β–Φ–Η–Η –Η –≥–Η–Ω–Β―Ä–Κ–Α–Μ―¨―Ü–Η―É―Ä–Η–Η; –≤–Η―²–Α–Φ–Η–Ϋ –£6 –Ω―Ä–Η ―¹―É–¥–Ψ―Ä–Ψ–≥–Α―Ö; ―Ö–Η―Ä―É―Ä–≥–Η―΅–Β―¹–Κ–Η–Β –Ψ–Ω–Β―Ä–Α―Ü–Η–Η –Ω―Ä–Η ―¹–Κ–Β–Μ–Β―²–Ϋ―΄―Ö –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η―è―Ö; –Η―¹–Κ―É―¹―¹―²–≤–Β–Ϋ–Ϋ–Α―è –≤–Β–Ϋ―²–Η–Μ―è―Ü–Η―è –Μ–Β–≥–Κ–Η―Ö –¥–Μ―è –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ―΄–Φ–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è–Φ–Η; –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β –Α–Ϋ–Α–Μ―¨–≥–Β―²–Η–Κ–Ψ–≤ –Ω―Ä–Η ―Ö―Ä–Ψ–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι –±–Ψ–Μ–Η; ―Ä–Β–Α–±–Η–Μ–Η―²–Α―Ü–Η―è, –≤–Κ–Μ―é―΅–Α―é―â–Α―è ―³–Η–Ζ–Η–Ψ―²–Β―Ä–Α–Ω–Η―é –Η –Μ–Β―΅–Β–±–Ϋ―É―é –≥–Η–Φ–Ϋ–Α―¹―²–Η–Κ―É [27]. –Δ–Α–Κ–Ε–Β –Μ–Β―΅–Η―²―¨ –™–Λ–Λ –Ω―΄―²–Α–Μ–Η―¹―¨, –Ω―Ä–Η–Φ–Β–Ϋ―è―è –≤–Η―²–Α–Φ–Η–Ϋ D, –±–Η―¹―³–Ψ―¹―³–Ψ–Ϋ–Α―²―΄, ―²–Β―Ä–Η–Ω–Α―Ä–Α―²–Η–¥ –Η –¥–Α–Ε–Β –≤―΄–Ω–Ψ–Μ–Ϋ―è―è ―²―Ä–Α–Ϋ―¹–Ω–Μ–Α–Ϋ―²–Α―Ü–Η―é –Κ–Ψ―¹―²–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α, –Ψ–¥–Ϋ–Α–Κ–Ψ –Ϋ–Η –Ψ–¥–Η–Ϋ –Η–Ζ ―ç―²–Η―Ö –Ω–Ψ–¥―Ö–Ψ–¥–Ψ–≤ –Ϋ–Β –Ω―Ä–Η–≤–Β–Μ –Κ –Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ–Ψ–Φ―É ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―É. –ù–Α–Ω―Ä–Ψ―²–Η–≤, –≤–Η―²–Α–Φ–Η–Ϋ D –Φ–Ψ–Ε–Β―² ―É―¹―É–≥―É–±–Η―²―¨ –≥–Η–Ω–Β―Ä–Κ–Α–Μ―¨―Ü–Η–Β–Φ–Η―é –Η–Μ–Η –≥–Η–Ω–Β―Ä–Κ–Α–Μ―¨―Ü–Η―É―Ä–Η―é [28], –Α –±–Η―¹―³–Ψ―¹―³–Ψ–Ϋ–Α―²―΄ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –™–Λ–Λ ―É–≥–Ϋ–Β―²–Α―é―² –Ω―Ä–Ψ―Ü–Β―¹―¹ –Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Α―Ü–Η–Η, ―É―Ö―É–¥―à–Α―è ―²–Β―΅–Β–Ϋ–Η–Β –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è, –Η –Φ–Ψ–≥―É―² –≤―΄–Ζ―΄–≤–Α―²―¨ –Α―²–Η–Ω–Η―΅–Ϋ―΄–Β –Ω–Β―Ä–Β–Μ–Ψ–Φ―΄ –±–Β–¥―Ä–Β–Ϋ–Ϋ–Ψ–Ι –Κ–Ψ―¹―²–Η [29].
–£ 2009 –≥. –Ϋ–Α―΅–Α–Μ–Η―¹―¨ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Β –Η―¹–Ω―΄―²–Α–Ϋ–Η―è –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α –¥–Μ―è –Ζ–Α–Φ–Β―¹―²–Η―²–Β–Μ―¨–Ϋ–Ψ–Ι ―³–Β―Ä–Φ–Β–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η βÄî –Α―¹―³–Ψ―²–Α–Ζ–Α –Α–Μ―¨―³–Α. –€–Ψ–Μ–Β–Κ―É–Μ–Α –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è–Β―² ―¹–Ψ–±–Ψ–Ι ―΅–Β–Μ–Ψ–≤–Β―΅–Β―¹–Κ–Η–Ι ―Ä–Β–Κ–Ψ–Φ–±–Η–Ϋ–Α–Ϋ―²–Ϋ―΄–Ι –≥–Η–±―Ä–Η–¥–Ϋ―΄–Ι –±–Β–Μ–Ψ–Κ –©–Λ, –Η–Φ–Β―é―â–Η–Ι –≤―΄―¹–Ψ–Κ–Ψ–Β ―¹―Ä–Ψ–¥―¹―²–≤–Ψ –Κ –Κ―Ä–Η―¹―²–Α–Μ–Μ–Α–Φ –≥–Η–¥―Ä–Ψ–Κ―¹–Η–Α–Ω–Α―²–Η―²–Α [30]. –Δ–Β―Ä–Α–Ω–Β–≤―²–Η―΅–Β―¹–Κ–Ψ–Β –¥–Β–Ι―¹―²–≤–Η–Β ―Ä–Β–Α–Μ–Η–Ζ―É–Β―²―¹―è ―΅–Β―Ä–Β–Ζ –≥–Η–¥―Ä–Ψ–Μ–Η–Ζ –Ϋ–Β–Ψ―Ä–≥–Α–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ω–Η―Ä–Ψ―³–Ψ―¹―³–Α―²–Α, ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Ϋ–Α–Κ–Ψ–Ω–Μ–Β–Ϋ–Η―è –≤–Ϋ–Β–Κ–Μ–Β―²–Ψ―΅–Ϋ―΄―Ö ―¹―É–±―¹―²―Ä–Α―²–Ψ–≤ –Δ–ù–©–Λ, ―΅―²–Ψ ―É–Μ―É―΅―à–Α–Β―² –Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Α―Ü–Η―é ―¹–Κ–Β–Μ–Β―²–Α. –£ –Ω–Η–Μ–Ψ―²–Ϋ–Ψ–Φ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Η–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Ψ–Ι –Η –¥–Β―²―¹–Κ–Ψ–Ι ―³–Ψ―Ä–Φ–Α–Φ–Η –™–Λ–Λ ―¹ ―²―è–Ε–Β–Μ―΄–Φ ―²–Β―΅–Β–Ϋ–Η–Β–Φ –Α–≤―²–Ψ―Ä―΄ –Ω―Ä–Ψ–¥–Β–Φ–Ψ–Ϋ―¹―²―Ä–Η―Ä–Ψ–≤–Α–Μ–Η ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β –Φ―΄―à–Β―΅–Ϋ–Ψ–Ι ―¹–Η–Μ―΄ –Η ―É–Μ―É―΅―à–Β–Ϋ–Η–Β –Ω―Ä–Ψ―Ü–Β―¹―¹–Α –Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Α―Ü–Η–Η –≤ ―²–Β―΅–Β–Ϋ–Η–Β –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Η―Ö –Ϋ–Β–¥–Β–Μ―¨ –Ω–Ψ―¹–Μ–Β –Ϋ–Α―΅–Α–Μ–Α ―²–Β―Ä–Α–Ω–Η–Η, –Α ―²–Α–Κ–Ε–Β ―É–Μ―É―΅―à–Β–Ϋ–Η–Β –Μ–Β–≥–Ψ―΅–Ϋ―΄―Ö, –Κ–Ψ–≥–Ϋ–Η―²–Η–≤–Ϋ―΄―Ö –Η –¥–≤–Η–≥–Α―²–Β–Μ―¨–Ϋ―΄―Ö ―³―É–Ϋ–Κ―Ü–Η–Ι, –≤―΄―Ö–Ψ–¥―è―â–Β–Β –Ζ–Α ―Ä–Α–Φ–Κ–Η –Ω–Β―Ä–≤―΄―Ö –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Η―Ö –Ϋ–Β–¥–Β–Μ―¨ –Μ–Β―΅–Β–Ϋ–Η―è [30]. –†–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Ψ―Ä–Η–≥–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Η –±–Β–Ζ–Ψ–Ω–Α―¹–Ϋ–Ψ―¹―²–Η –Α―¹―³–Ψ―²–Α–Ζ―΄ –Α–Μ―¨―³–Α ―É –Φ–Μ–Α–¥–Β–Ϋ―Ü–Β–≤ ―¹ ―²–Β―Ö –Ω–Ψ―Ä –±―΄–Μ–Η –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Β–Ϋ―΄ –Φ–Ϋ–Ψ–≥–Ψ―΅–Η―¹–Μ–Β–Ϋ–Ϋ―΄–Φ–Η –Ϋ–Β–Ζ–Α–≤–Η―¹–Η–Φ―΄–Φ–Η –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è–Φ–Η.
–£ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –≤―Ä–Β–Φ―è –≤–Ψ –Φ–Ϋ–Ψ–≥–Η―Ö ―¹―²―Ä–Α–Ϋ–Α―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―² –Ψ–¥–Ψ–±―Ä–Β–Ϋ –¥–Μ―è –Ζ–Α–Φ–Β―¹―²–Η―²–Β–Μ―¨–Ϋ–Ψ–Ι ―³–Β―Ä–Φ–Β–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –™–Λ–Λ ―¹ –Ϋ–Α―΅–Α–Μ–Ψ–Φ –≤ –¥–Β―²―¹–Κ–Ψ–Φ –≤–Ψ–Ζ―Ä–Α―¹―²–Β. –≠―²–Ψ –Κ–Ψ–Ϋ―²―Ä–Α―¹―²–Η―Ä―É–Β―² ―¹ –Μ–Β―΅–Β–Ϋ–Η–Β–Φ –Α―¹―³–Ψ―²–Α–Ζ–Ψ–Ι –Α–Μ―¨―³–Α –≤–Ζ―Ä–Ψ―¹–Μ―΄―Ö, –Ψ―²–Ϋ–Ψ―¹–Η―²–Β–Μ―¨–Ϋ–Ψ –Κ–Ψ―²–Ψ―Ä–Ψ–≥–Ψ –¥–Α–Ϋ–Ϋ―΄―Ö –≤―¹–Β –Β―â–Β –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ [18]. –£ 2019 –≥. –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ―΄–Ι –Ω―Ä–Β–Ω–Α―Ä–Α―² –Α―¹―³–Ψ―²–Α–Ζ–Α –Α–Μ―¨―³–Α –Ζ–Α―Ä–Β–≥–Η―¹―²―Ä–Η―Ä–Ψ–≤–Α–Ϋ –≤ –†–Ψ―¹―¹–Η–Ι―¹–Κ–Ψ–Ι –Λ–Β–¥–Β―Ä–Α―Ü–Η–Η.
–™–Λ–Λ –≤ –†–Ψ―¹―¹–Η–Η
–£ 2020 –≥. –≤ –Ω―É–±–Μ–Η–Κ―É–Β–Φ–Ψ–Ι –≤ –†–Ψ―¹―¹–Η–Ι―¹–Κ–Ψ–Ι –Λ–Β–¥–Β―Ä–Α―Ü–Η–Η –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Ψ–Ι –Μ–Η―²–Β―Ä–Α―²―É―Ä–Β –Ψ–Ω–Η―¹–Α–Ϋ―΄ 16 ―¹–Μ―É―΅–Α–Β–≤ –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Η –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α ¬Ϊ–≥–Η–Ω–Ψ―³–Ψ―¹―³–Α―²–Α–Ζ–Η―è¬Μ ―É –¥–Β―²–Β–Ι.
–ü–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α
–û–Ω–Η―¹–Α–Ϋ–Ψ 3 ―¹–Μ―É―΅–Α―è –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ―΄ –™–Λ–Λ.
–ü–Β―Ä–≤–Ψ–Β –Ψ–Ω–Η―¹–Α–Ϋ–Η–Β –≤–Β―Ä–Η―³–Η–Κ–Α―Ü–Η–Η –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ―΄ –™–Λ–Λ –≤ –Ψ―²–Β―΅–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Ι –Ω―Ä–Α–Κ―²–Η–Κ–Β ―¹–¥–Β–Μ–Α–Ϋ–Ψ –ê.–ï. –£–Ψ–Μ–Κ–Ψ–≤―΄–Φ ―¹ –Κ–Ψ–Μ–Μ–Β–≥–Α–Φ–Η [31]. –ù–Α 37-–Ι –Ϋ–Β–¥–Β–Μ–Β –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ―¹―²–Η ―É –Φ–Α―²–Β―Ä–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α –Ϋ–Α–±–Μ―é–¥–Α–Μ–Ψ―¹―¨ –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ–Β ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―ç―Ö–Ψ–≥–Β–Ϋ–Ϋ–Ψ―¹―²–Η –Κ–Ψ―¹―²–Β–Ι ―¹–≤–Ψ–¥–Α ―΅–Β―Ä–Β–Ω–Α, –Β–≥–Ψ –Κ–Μ–Β–≤–Β―Ä–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α, –≤–Β–Ϋ–Β―΅–Ϋ―΄–Β ―¹–Η–Ϋ–Ψ―¹―²–Ψ–Ζ―΄ (―Ä–Η―¹. 3); ―É–Κ–Ψ―Ä–Ψ―΅–Β–Ϋ–Η–Β –¥–Β–Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Ψ–≤–Α–Ϋ–Ϋ―΄―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι, –¥–Β–Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Α―Ü–Η―è –Ω–Ψ–Ζ–≤–Ψ–Ϋ–Ψ―΅–Ϋ–Η–Κ–Α –Η ―Ä–Β–±–Β―Ä; –≥–Η–Ω–Ψ–Ω–Μ–Α–Ζ–Η―è –Κ–Ψ–Μ–Ψ–Κ–Ψ–Μ–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ–Ψ–Ι –≥―Ä―É–¥–Ϋ–Ψ–Ι –Κ–Μ–Β―²–Κ–Η. –†–Β–±–Β–Ϋ–Ψ–Κ ―Ä–Ψ–¥–Η–Μ―¹―è –≤ ―²―è–Ε–Β–Μ–Ψ–Φ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Η (–≤–Β―¹ 1100, ―Ä–Ψ―¹―² 38 ―¹–Φ, –Ω–Ψ ―à–Κ–Α–Μ–Β –ê–Ω–≥–Α―Ä 1/1), –Ϋ–Α–±–Μ―é–¥–Α–Μ–Α―¹―¨ –≥–Η–Ω–Β―Ä–Κ–Α–Μ―¨―Ü–Η–Β–Φ–Η―è, –≥–Η–Ω–Ψ―³–Ψ―¹―³–Α―²–Β–Φ–Η―è, –Ϋ–Η–Ζ–Κ–Η–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Δ–ù–©–Λ βÄî 19 –ï–î/–Μ (–Ϋ–Ψ―Ä–Φ–Α βÄî 35βÄ™106 –ï–î/–Μ). –ß–Β―Ä–Β–Ζ 20 –Φ–Η–Ϋ –Ω–Ψ―¹–Μ–Β ―Ä–Ψ–Ε–¥–Β–Ϋ–Η―è –≤―¹–Μ–Β–¥―¹―²–≤–Η–Β –Ϋ–Α―Ä–Α―¹―²–Α―é―â–Β–Ι –¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η ―Ä–Β–±–Β–Ϋ–Ψ–Κ ―É–Φ–Β―Ä. –™–Β–Ϋ–Β―²–Η―΅–Β―¹–Κ–Α―è –≤–Β―Ä–Η―³–Η–Κ–Α―Ü–Η―è –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α –Ϋ–Α ―²–Ψ―² –Φ–Ψ–Φ–Β–Ϋ―² –Ϋ–Β –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Α―¹―¨.
![–†–Η―¹. 3. –Θ–Μ―¨―²―Ä–Α–Ζ–≤―É–Κ–Ψ–≤–Ψ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –Ω―Ä–Η –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ–Β –™–Λ–Λ: –ê βÄî –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η―è –Κ–Ψ―¹―²–Β–Ι ―¹–≤–Ψ–¥–Α ―΅–Β―Ä–Β–Ω–Α –Ω–Ψ–¥ –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Β–Φ –¥–Α―²―΅–Η–Κ–Α, –£ βÄî –Κ–Μ–Β–≤–Β―Ä–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α ―΅–Β―Ä–Β–Ω–Α –Η–Ζ-–Ζ–Α –Ϋ–Α–Μ–Η―΅–Η―è –≤–Β–Ϋ–Β―΅–Ϋ―΄―Ö ―¹–Η–Ϋ–Ψ―¹―²–Ψ–Ζ–Ψ–≤ [31] –†–Η―¹. 3. –Θ–Μ―¨―²―Ä–Α–Ζ–≤―É–Κ–Ψ–≤–Ψ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –Ω―Ä–Η –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ–Β –™–Λ–Λ: –ê βÄî –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η―è –Κ–Ψ―¹―²–Β–Ι ―¹–≤–Ψ–¥–Α ―΅–Β―Ä–Β–Ω–Α –Ω–Ψ–¥ –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Β–Φ –¥–Α―²―΅–Η–Κ–Α, –£ βÄî –Κ–Μ–Β–≤–Β―Ä–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α ―΅–Β―Ä–Β–Ω–Α –Η–Ζ-–Ζ–Α –Ϋ–Α–Μ–Η―΅–Η―è –≤–Β–Ϋ–Β―΅–Ϋ―΄―Ö ―¹–Η–Ϋ–Ψ―¹―²–Ψ–Ζ–Ψ–≤ [31]](/upload/medialibrary/341/42-4.png)
–Δ–Α–Κ–Ε–Β –Ψ–Ω–Η―¹–Α–Ϋ―΄ ―¹–Μ―É―΅–Α–Η –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Ι –™–Λ–Λ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α –û. [32] –Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α –ß. [33]. –£ –Ψ–±–Ψ–Η―Ö ―¹–Μ―É―΅–Α―è―Ö –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Α –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α –™–Λ–Λ –±―΄–Μ–Α –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Α –≤ 1-–Ι –Φ–Β―¹―è―Ü –Ε–Η–Ζ–Ϋ–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Β–Ϋ–Α ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α–Φ–Η –≥–Β–Ϋ–Β―²–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Α–Ϋ–Α–Μ–Η–Ζ–Α –Η –Ϋ–Η–Ζ–Κ–Η–Φ–Η –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―è–Φ–Η –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Δ–ù–©–Λ. –ï―â–Β –≤–Ϋ―É―²―Ä–Η-―É―²―Ä–Ψ–±–Ϋ–Ψ –Ω―Ä–Η –Θ–½–‰ –±―΄–Μ–Η –Ψ–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ―΄ –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è ―Ä–Α–Ζ–≤–Η―²–Η―è ―¹–Κ–Β–Μ–Β―²–Α ―É –Ω–Μ–Ψ–¥–Α. –ü―Ä–Η ―Ä–Ψ–Ε–¥–Β–Ϋ–Η–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ϋ–Α–±–Μ―é–¥–Α–Μ–Η―¹―¨ –Φ–Ϋ–Ψ–Ε–Β―¹―²–≤–Β–Ϋ–Ϋ―΄–Β ―¹–Κ–Β–Μ–Β―²–Ϋ―΄–Β –¥–Η―¹–Ω―Ä–Ψ–Ω–Ψ―Ä―Ü–Η–Η, ―É–Κ–Ψ―Ä–Ψ―΅–Β–Ϋ–Η–Β, –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η–Η –Η –Ω–Β―Ä–Β–Μ–Ψ–Φ―΄ –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι, –Φ―è–≥–Κ–Η–Β –Κ–Ψ―¹―²–Η ―¹–≤–Ψ–¥–Α ―΅–Β―Ä–Β–Ω–Α –Ω―Ä–Ψ–¥–Α–≤–Μ–Η–≤–Α–Μ–Η―¹―¨, ―³–Ψ―Ä–Φ–Η―Ä―É―è ¬Ϊ–Φ–Β–Φ–±―Ä–Α–Ϋ–Ψ–Ζ–Ϋ―΄–Ι¬Μ ―΅–Β―Ä–Β–Ω, –≥―Ä―É–¥–Ϋ–Α―è –Κ–Μ–Β―²–Κ–Α –±―΄–Μ–Α –Φ―è–≥–Κ–Ψ–Ι, ―É–Ω–Μ–Ψ―â–Β–Ϋ–Ϋ–Ψ–Ι (―Ä–Η―¹. 4). –Γ–Ψ―¹―²–Ψ―è–Ϋ–Η–Β ―Ä–Β–±–Β–Ϋ–Κ–Α –û. –Ω–Ψ―¹–Μ–Β ―Ä–Ψ–Ε–¥–Β–Ϋ–Η―è –Ψ―Ü–Β–Ϋ–Η–≤–Α–Μ–Ψ―¹―¨ –Κ–Α–Κ –±–Ψ–Μ–Β–Β ―²―è–Ε–Β–Μ–Ψ–Β, –±―΄–Μ–Η –≤―΄―è–≤–Μ–Β–Ϋ―΄ –Φ―É―²–Α―Ü–Η–Η –≤ –≥–Ψ–Φ–Ψ–Ζ–Η–≥–Ψ―²–Ϋ–Ψ–Φ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Η, ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Δ–ù–©–Λ ―¹–Ψ―¹―²–Α–≤–Μ―è–Μ 37 –ï–¥/–Μ (–Ϋ–Ψ―Ä–Φ–Α βÄî 90βÄ™274 –ï–¥/–Μ) [32]. –Θ ―Ä–Β–±–Β–Ϋ–Κ–Α –ß. –≤―΄―è–≤–Μ–Β–Ϋ―΄ –¥–≤–Β –Φ―É―²–Α―Ü–Η–Η –≤ –≥–Β―²–Β―Ä–Ψ–Ζ–Η–≥–Ψ―²–Ϋ–Ψ–Φ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Η, ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Δ–ù–©–Λ βÄî 28 –ï–¥/–Μ (–Ϋ–Ψ―Ä–Φ–Α βÄî 53βÄ™128 –ï–¥/–Μ). –ü–Ψ―¹–Μ–Β –≤–Β―Ä–Η―³–Η–Κ–Α―Ü–Η–Η –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α –™–Λ–Λ –Ψ–±–Ψ–Η–Φ –¥–Β―²―è–Φ –±―΄–Μ–Α –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Α ―³–Β―Ä–Φ–Β–Ϋ―²-–Ζ–Α–Φ–Β―¹―²–Η―²–Β–Μ―¨–Ϋ–Α―è ―²–Β―Ä–Α–Ω–Η―è –Α―¹―³–Ψ―²–Α–Ζ–Ψ–Ι –Α–Μ―¨―³–Α.
![–†–Η―¹. 4. –ü–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α –™–Λ–Λ: –ê βÄî ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–≥―Ä–Α–Φ–Φ–Α –Κ–Ψ―¹―²–Β–Ι ―¹–Κ–Β–Μ–Β―²–Α –Η ―΅–Β―Ä–Β–Ω–Α –Ω–Α―Ü–Η–Β–Ϋ―²–Α –ß. [33], –£ βÄî ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–≥―Ä–Α–Φ–Φ–Α –≥―Ä―É–¥–Ϋ–Ψ–Ι –Κ–Μ–Β―²–Κ–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α –û. [32] –†–Η―¹. 4. –ü–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α –™–Λ–Λ: –ê βÄî ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–≥―Ä–Α–Φ–Φ–Α –Κ–Ψ―¹―²–Β–Ι ―¹–Κ–Β–Μ–Β―²–Α –Η ―΅–Β―Ä–Β–Ω–Α –Ω–Α―Ü–Η–Β–Ϋ―²–Α –ß. [33], –£ βÄî ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–≥―Ä–Α–Φ–Φ–Α –≥―Ä―É–¥–Ϋ–Ψ–Ι –Κ–Μ–Β―²–Κ–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α –û. [32]](/upload/medialibrary/01c/42-5.png)
–ü–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α –™–Λ–Λ –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η―Ä―É–Β―²―¹―è ―΅–Α―â–Β –≤―¹–Β–≥–Ψ –±–Β–Ζ –Ψ―¹–Ψ–±―΄―Ö –Ζ–Α―²―Ä―É–¥–Ϋ–Β–Ϋ–Η–Ι. –£–Β―Ä–Η―³–Η–Κ–Α―Ü–Η―è –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ–Α –Ϋ–Α ―¹–Μ–Β–¥―É―é―â–Β–Ι ―¹–Η–Φ–Ω―²–Ψ–Φ–Α―²–Η–Κ–Β: –Φ–Ϋ–Ψ–Ε–Β―¹―²–≤–Β–Ϋ–Ϋ―΄–Β –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η–Η ―¹–Κ–Β–Μ–Β―²–Α, –≥–Η–Ω–Ψ–Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Α―Ü–Η―è –Κ–Ψ―¹―²–Β–Ι, –Ω–Β―Ä–Β–Μ–Ψ–Φ―΄, –Ω–Η―Ä–Η–¥–Ψ–Κ―¹–Η–Ϋ-–Ζ–Α–≤–Η―¹–Η–Φ―΄–Β ―¹―É–¥–Ψ―Ä–Ψ–≥–Η, –¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ–Α―è –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨ –Η –≥–Η–Ω–Ψ–Ω–Μ–Α–Ζ–Η―è –Μ–Β–≥–Κ–Η―Ö –Ω―Ä–Η –Ϋ–Η–Ζ–Κ–Η―Ö ―É―Ä–Ψ–≤–Ϋ―è―Ö –Δ–ù–©–Λ –Η –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ―΄―Ö –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è―Ö –Ω–Α―Ä–Α―²–≥–Ψ―Ä–Φ–Ψ–Ϋ–Α, –≤–Η―²–Α–Φ–Η–Ϋ–Α D, –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Ψ–Φ –Η–Μ–Η –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ–Ψ–Φ ―É―Ä–Ψ–≤–Ϋ–Β –Κ–Α–Μ―¨―Ü–Η―è –≤ –Κ―Ä–Ψ–≤–Η. –ü–Ψ–Φ–Η–Φ–Ψ –Θ–½–‰ –Ω–Μ–Ψ–¥–Α –≤–Α–Ε–Ϋ–Ψ–Ι –Η–Ϋ―³–Ψ―Ä–Φ–Α―Ü–Η–Β–Ι ―è–≤–Μ―è―é―²―¹―è –Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ―΄–Ι ―¹–Β–Φ–Β–Ι–Ϋ―΄–Ι –Α–Ϋ–Α–Φ–Ϋ–Β–Ζ –Η –Ϋ–Η–Ζ–Κ–Η–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Δ–ù–©–Λ –≤ ―¹―΄–≤–Ψ―Ä–Ψ―²–Κ–Β –Κ―Ä–Ψ–≤–Η ―É ―Ä–Ψ–¥–Η―²–Β–Μ–Β–Ι. –Γ–Μ–Β–¥―É–Β―² –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ ―É –Ε–Β–Ϋ―â–Η–Ϋ –Ϋ–Α –Ω–Ψ–Ζ–¥–Ϋ–Η―Ö ―¹―Ä–Ψ–Κ–Α―Ö –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ―¹―²–Η ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Δ–ù–©–Λ –≤ ―¹―΄–≤–Ψ―Ä–Ψ―²–Κ–Β –≤―΄―à–Β, ―΅–Β–Φ –≤–Ϋ–Β –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ―¹―²–Η, –Η–Ζ-–Ζ–Α –Ω―Ä–Η―¹―É―²―¹―²–≤–Η―è –Ω–Μ–Α―Ü–Β–Ϋ―²–Α―Ä–Ϋ–Ψ–Ι –©–Λ [34].
–‰–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α
–û–Ω–Η―¹–Α–Ϋ–Ψ 4 ―¹–Μ―É―΅–Α―è –Η–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ―΄ –™–Λ–Λ –≤ –†–Λ: –Ω–Β―Ä–≤―΄–Ι ―¹–Μ―É―΅–Α–Ι βÄî –≤ 2009 –≥. [35], –≤ ―¹―²–Α―²―¨―è―Ö 2016 –≥. –Η 2017 –≥. –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ –≤―²–Ψ―Ä–Ψ–Ι ―¹–Μ―É―΅–Α–Ι [36, 37], ―²―Ä–Β―²–Η–Ι βÄî –≤ 2017 –≥. [37], ―΅–Β―²–≤–Β―Ä―²―΄–Ι βÄî –≤ 2019 –≥. [38].
–£―¹–Β –Ω–Α―Ü–Η–Β–Ϋ―²―΄ –Η–Φ–Β–Μ–Η ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Ϋ―É―é –¥–Μ―è –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è ―¹–Η–Φ–Ω―²–Ψ–Φ–Α―²–Η–Κ―É: ―Ä–Α―Ö–Η―²–Ψ–Ω–Ψ–¥–Ψ–±–Ϋ―΄–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è, –≤–Α―Ä―É―¹–Ϋ―É―é –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η―é –Ϋ–Η–Ε–Ϋ–Η―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι, –≤–Α–Μ―¨–≥―É―¹–Ϋ―É―é –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η―é ―¹―²–Ψ–Ω, ¬Ϊ―Ä–Α―Ö–Η―²–Η―΅–Β―¹–Κ–Η–Β ―΅–Β―²–Κ–Η¬Μ, ¬Ϊ–Ϋ–Η―²–Η –Ε–Β–Φ―΅―É–≥–Α¬Μ, ¬Ϊ―Ä–Α―Ö–Η―²–Η―΅–Β―¹–Κ–Η–Β –±―Ä–Α―¹–Μ–Β―²–Κ–Η¬Μ, –≤–Ψ―Ä–Ψ–Ϋ–Κ–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ―É―é –≥―Ä―É–¥–Ϋ―É―é –Κ–Μ–Β―²–Κ―É, ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Φ―΄―à–Β―΅–Ϋ–Ψ–≥–Ψ ―²–Ψ–Ϋ―É―¹–Α, –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ―É―é –Ω―Ä–Η–±–Α–≤–Κ―É –Φ–Α―¹―¹―΄ ―²–Β–Μ–Α (―Ä–Η―¹. 5–ê). –£ 2 ―¹–Μ―É―΅–Α―è―Ö –Ϋ–Α–±–Μ―é–¥–Α–Μ–Ψ―¹―¨ –≤―΄–Ω–Α–¥–Β–Ϋ–Η–Β –Φ–Ψ–Μ–Ψ―΅–Ϋ―΄―Ö –Ζ―É–±–Ψ–≤ [35, 38]. –Γ―²―Ä―É–Κ―²―É―Ä–Ϋ―΄–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è –≤ –Ω–Ψ―΅–Κ–Α―Ö –±―΄–Μ–Η –≤―΄―è–≤–Μ–Β–Ϋ―΄ ―É 2 –¥–Β―²–Β–Ι [36, 37]. –ù–Α ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–≥―Ä–Α–Φ–Φ–Α―Ö –Ϋ–Α–±–Μ―é–¥–Α–Μ–Η―¹―¨ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄–Β –¥–Β―¹―²―Ä―É–Κ―²–Η–≤–Ϋ―΄–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è –Κ–Ψ―¹―²–Ϋ–Ψ–Ι ―¹―²―Ä―É–Κ―²―É―Ä―΄: ―Ä–Β–Ζ–Κ–Ψ–Β –Η―¹―²–Ψ–Ϋ―΅–Β–Ϋ–Η–Β –Κ–Ψ―Ä–Κ–Ψ–≤–Ψ–≥–Ψ ―¹–Μ–Ψ―è, –Ϋ–Β―Ä–Ψ–≤–Ϋ–Ψ―¹―²―¨ –Κ–Ψ–Ϋ―²―É―Ä–Ψ–≤, –Φ–Ϋ–Ψ–Ε–Β―¹―²–≤–Β–Ϋ–Ϋ―΄–Β ―É―΅–Α―¹―²–Κ–Η –Ω―Ä–Ψ―¹–≤–Β―²–Μ–Β–Ϋ–Η–Ι (–≥–Η–Ω–Ψ–Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Α―Ü–Η–Η) –Φ–Β―²–Α–¥–Η–Α―³–Η–Ζ–Ψ–≤ –¥–Μ–Η–Ϋ–Ϋ―΄―Ö ―²―Ä―É–±―΅–Α―²―΄―Ö –Κ–Ψ―¹―²–Β–Ι (―Ä–Η―¹. 5–£), ―¹ ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Ϋ―΄–Φ–Η –¥–Μ―è –™–Λ–Λ ¬Ϊ–Η–Ζ―ä–Β–¥–Β–Ϋ–Ϋ―΄–Φ–Η¬Μ –Κ–Ψ–Ϋ―²―É―Ä–Α–Φ–Η (¬Ϊ―è–Ζ―΄–Κ–Α–Φ–Η –Ω–Μ–Α–Φ–Β–Ϋ–Η¬Μ), ―É–Κ–Ψ―Ä–Ψ―΅–Β–Ϋ–Η―è –¥–Η–Α―³–Η–Ζ–Ψ–≤ –Κ–Ψ―¹―²–Β–Ι, ―Ä–Α―¹―à–Η―Ä–Β–Ϋ–Η–Β ―ç–Ω–Η―³–Η–Ζ–Ψ–≤ ―¹ –Φ―è–≥–Κ–Ψ―²–Κ–Α–Ϋ–Ϋ–Ψ–Ι –Ω–Μ–Ψ―²–Ϋ–Ψ―¹―²―¨―é.
![–†–Η―¹. 5. –‰–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Α―è –™–Λ–Λ: –ê βÄî –≤–Ϋ–Β―à–Ϋ–Η–Ι –≤–Η–¥ ―Ä–Β–±–Β–Ϋ–Κ–Α, –£ βÄî ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–≥―Ä–Α–Φ–Φ–Α ―²―Ä―É–±―΅–Α―²―΄―Ö –Κ–Ψ―¹―²–Β–Ι [35] –†–Η―¹. 5. –‰–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Α―è –™–Λ–Λ: –ê βÄî –≤–Ϋ–Β―à–Ϋ–Η–Ι –≤–Η–¥ ―Ä–Β–±–Β–Ϋ–Κ–Α, –£ βÄî ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–≥―Ä–Α–Φ–Φ–Α ―²―Ä―É–±―΅–Α―²―΄―Ö –Κ–Ψ―¹―²–Β–Ι [35]](/upload/medialibrary/428/42-6.png)
–ë–Η–Ψ―Ö–Η–Φ–Η―΅–Β―¹–Κ–Η–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Η, ―΅―²–Ψ ―É –≤―¹–Β―Ö –¥–Β―²–Β–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Δ–ù–©–Λ –±―΄–Μ –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –Ω–Ψ–Ϋ–Η–Ε–Β–Ϋ. –£ 2 ―¹–Μ―É―΅–Α―è―Ö –Ω―Ä–Η –Ψ–±―Ä–Α―â–Β–Ϋ–Η–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤ –Ω–Ψ–Μ–Η–Κ–Μ–Η–Ϋ–Η–Κ–Η –Ω–Ψ –Φ–Β―¹―²―É –Ε–Η―²–Β–Μ―¨―¹―²–≤–Α –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ―΄–Β –Α–Ϋ–Α–Μ–Η–Ζ―΄ –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Η―¹―¨ –Ϋ–Β–Ψ–¥–Ϋ–Ψ–Κ―Ä–Α―²–Ϋ–Ψ, –Ψ–¥–Ϋ–Α–Κ–Ψ –Ϋ–Η–Ζ–Κ–Η–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è ―É―Ä–Ψ–≤–Ϋ―è –Δ–ù–©–Λ –±―΄–Μ–Η –Ω―Ä–Ψ–Η–≥–Ϋ–Ψ―Ä–Η―Ä–Ψ–≤–Α–Ϋ―΄ –Η –Ω–Ψ―¹―²–Α–≤–Μ–Β–Ϋ―΄ –Ϋ–Β–≤–Β―Ä–Ϋ―΄–Β –¥–Η–Α–≥–Ϋ–Ψ–Ζ―΄, ―΅―²–Ψ –Ω―Ä–Η–≤–Β–Μ–Ψ –Κ –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η―é –≤ –Κ–Α―΅–Β―¹―²–≤–Β –Μ–Β―΅–Β–Ϋ–Η―è –≤―΄―¹–Ψ–Κ–Η―Ö –¥–Ψ–Ζ –≤–Η―²–Α–Φ–Η–Ϋ–Α D, ―΅―²–Ψ –≤ ―Ä―è–¥–Β ―¹–Μ―É―΅–Α–Β–≤ ―É―Ö―É–¥―à–Α–Β―² ―²–Β―΅–Β–Ϋ–Η–Β –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è [35, 37].
–£ 3 ―¹–Μ―É―΅–Α―è―Ö –¥–Η–Α–≥–Ϋ–Ψ–Ζ –±―΄–Μ –≤–Β―Ä–Η―³–Η―Ü–Η―Ä–Ψ–≤–Α–Ϋ –≥–Β–Ϋ–Β―²–Η―΅–Β―¹–Κ–Η. –Θ 2 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –±―΄–Μ–Η –≤―΄―è–≤–Μ–Β–Ϋ―΄ –≥–Β―²–Β―Ä–Ψ–Ζ–Η–≥–Ψ―²–Ϋ―΄–Β –Φ―É―²–Α―Ü–Η–Η –≥–Β–Ϋ–Α ALPL [35, 38], ―É 1 ―Ä–Β–±–Β–Ϋ–Κ–Α –±―΄–Μ–Α –Ψ–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ–Α ―Ä–Α–Ϋ–Β–Β –Ϋ–Β –Ψ–Ω–Η―¹–Α–Ϋ–Ϋ–Α―è –≥–Ψ–Φ–Ψ–Ζ–Η–≥–Ψ―²–Ϋ–Α―è –Φ―É―²–Α―Ü–Η―è C497R [36, 37].
–Λ–Β―Ä–Φ–Β–Ϋ―²-–Ζ–Α–Φ–Β―¹―²–Η―²–Β–Μ―¨–Ϋ–Α―è ―²–Β―Ä–Α–Ω–Η―è –Α―¹―³–Ψ―²–Α–Ζ–Ψ–Ι –Α–Μ―¨―³–Α –±―΄–Μ–Α –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Α 2 –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ [36βÄ™38]. –£ ―Ä–Α–±–Ψ―²–Β –ï.C. –û―²―Ä–Ψ―â–Β–Ϋ–Κ–Ψ –Η ―¹–Ψ–Α–≤―². –Ϋ–Β ―¹–Ψ–Ψ–±―â–Α–Β―²―¹―è –Ψ ―²–Β―Ä–Α–Ω–Η–Η –Α―¹―³–Ψ―²–Α–Ζ–Ψ–Ι –Α–Μ―¨―³–Α –≤–≤–Η–¥―É –Ψ―²―¹―É―²―¹―²–≤–Η―è –Ϋ–Α ―²–Ψ―² –Φ–Ψ–Φ–Β–Ϋ―² –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α [35].
–†–Β–±–Β–Ϋ–Ψ–Κ –ö. ―¹ ―Ä–Ψ–Ε–¥–Β–Ϋ–Η―è –Ϋ–Α–±–Μ―é–¥–Α–Μ―¹―è –Α–Φ–±―É–Μ–Α―²–Ψ―Ä–Ϋ–Ψ –≤ ―¹–≤―è–Ζ–Η ―¹ –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Ι –Ω–Α―²–Ψ–Μ–Ψ–≥–Η–Β–Ι –Π–ù–Γ, –≥–Η–Ω–Β―Ä―²–Β–Ϋ–Ζ–Η–Ψ–Ϋ–Ϋ–Ψ-–≥–Η–¥―Ä–Ψ―Ü–Β―³–Α–Μ―¨–Ϋ―΄–Φ ―¹–Η–Ϋ–¥―Ä–Ψ–Φ–Ψ–Φ. –£ –¥–Α–Μ―¨–Ϋ–Β–Ι―à–Β–Φ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Β ―Ä–Β–±–Β–Ϋ–Κ–Α ―É―Ö―É–¥―à–Α–Μ–Ψ―¹―¨, –Ω–Α―Ü–Η–Β–Ϋ―² ―É–Φ–Β―Ä –≤ –≤–Ψ–Ζ―Ä–Α―¹―²–Β 1 –≥–Ψ–¥–Α 4 –Φ–Β―¹. –Ψ―² –Ω―Ä–Ψ–≥―Ä–Β―¹―¹–Η―Ä―É―é―â–Β–Ι –¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –Η ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ-―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η [37].
–Γ ―É―΅–Β―²–Ψ–Φ ―²–Ψ–≥–Ψ, ―΅―²–Ψ –Ω―Ä–Η –Η–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ–Β –™–Λ–Λ –¥–Β–±―é―² –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² –¥–Ψ 6 –Φ–Β―¹., –≤ 3 –Ψ–Ω–Η―¹–Α–Ϋ–Ϋ―΄―Ö ―¹–Μ―É―΅–Α―è―Ö –Ϋ–Α–±–Μ―é–¥–Α–Β―²―¹―è –¥–Ψ–≤–Ψ–Μ―¨–Ϋ–Ψ –Ω–Ψ–Ζ–¥–Ϋ―è―è –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Α –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α, –Ϋ–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α ―²–Η–Ω–Η―΅–Ϋ―É―é ―¹–Η–Φ–Ω―²–Ψ–Φ–Α―²–Η–Κ―É.
–î–Β―²―¹–Κ–Α―è ―³–Ψ―Ä–Φ–Α
–£ –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Ψ–Ι –Μ–Η―²–Β―Ä–Α―²―É―Ä–Β –≤ –†–Λ –Ψ–Ω–Η―¹–Α–Ϋ–Ψ 9 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –¥–Β―²―¹–Κ–Ψ–Ι ―³–Ψ―Ä–Φ–Ψ–Ι –™–Λ–Λ. –Γ–Η–Φ–Ω―²–Ψ–Φ―΄, –Κ–Ψ―²–Ψ―Ä―΄–Β –≤―¹―²―Ä–Β―΅–Α–Μ–Η―¹―¨ –Ω–Ψ―΅―²–Η ―É –≤―¹–Β―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –¥–Β―²―¹–Κ–Ψ–Ι ―³–Ψ―Ä–Φ–Ψ–Ι, –≤–Κ–Μ―é―΅–Α–Μ–Η –Ζ–Α–¥–Β―Ä–Ε–Κ―É ―Ä–Ψ―¹―²–Α –Η ―Ä–Α–Ζ–≤–Η―²–Η―è, –≥–Η–Ω–Ψ―²–Ψ–Ϋ–Η―é, –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β –Ω–Ψ―Ö–Ψ–¥–Κ–Η (¬Ϊ―É―²–Η–Ϋ–Α―è –Ω–Ψ―Ö–Ψ–¥–Κ–Α¬Μ), –±―΄―¹―²―Ä―É―é ―É―²–Ψ–Φ–Μ―è–Β–Φ–Ψ―¹―²―¨ [32, 33, 36, 39βÄ™42]. –ü–Ψ –¥–Α–Ϋ–Ϋ―΄–Φ ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–≥―Ä–Α―³–Η–Η –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Μ–Η―¹―¨ ―Ä–Α–Ζ–Φ―΄―²―΄–Β –Ζ–Ψ–Ϋ―΄ –Φ–Η–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Α―Ü–Η–Η –Η ―É―΅–Α―¹―²–Κ–Η ―Ä–Α–Ζ―Ä–Β–Ε–Β–Ϋ–Η―è –Κ–Ψ―¹―²–Ϋ–Ψ–Ι ―²–Κ–Α–Ϋ–Η –≤ –≤–Η–¥–Β ¬Ϊ―è–Ζ―΄–Κ–Ψ–≤ –Ω–Μ–Α–Φ–Β–Ϋ–Η¬Μ –≤ ―Ä–Α―¹―à–Η―Ä–Β–Ϋ–Ϋ―΄―Ö –Φ–Β―²–Α―³–Η–Ζ–Α―Ö –Κ–Ψ―¹―²–Β–Ι. –Θ 2 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –±―΄–Μ–Α –Ψ―²–Φ–Β―΅–Β–Ϋ–Α –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η―è ―΅–Β―Ä–Β–Ω–Α [32, 33]. –£―¹―²―Ä–Β―΅–Α–Μ–Η―¹―¨ –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Α―è –≤–Α―Ä―É―¹–Ϋ–Α―è –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η―è –±–Β–¥–Β―Ä, –≤–Α–Μ―¨–≥―É―¹–Ϋ–Α―è –¥–Β―³–Ψ―Ä–Φ–Α―Ü–Η―è –Κ–Ψ–Μ–Β–Ϋ–Ϋ―΄―Ö ―¹―É―¹―²–Α–≤–Ψ–≤ [33, 36]. –Θ 5 –¥–Β―²–Β–Ι –≤ –Α–Ϋ–Α–Φ–Ϋ–Β–Ζ–Β –≤―΄―è–≤–Μ―è–Μ–Ψ―¹―¨ ―Ä–Α–Ϋ–Ϋ–Β–Β –≤―΄–Ω–Α–¥–Β–Ϋ–Η–Β –Φ–Ψ–Μ–Ψ―΅–Ϋ―΄―Ö –Ζ―É–±–Ψ–≤ [33, 39, 41], ―΅―²–Ψ ―è–≤–Μ―è–Β―²―¹―è –≤–Α–Ε–Ϋ―΄–Φ –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η―΅–Β―¹–Κ–Η–Φ –Κ―Ä–Η―²–Β―Ä–Η–Β–Φ –Ω―Ä–Η –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Β –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α –™–Λ–Λ, –Ψ–¥–Ϋ–Α–Κ–Ψ ―²–Ψ–Μ―¨–Κ–Ψ –≤ 1 ―¹–Μ―É―΅–Α–Β –¥–Α–Ϋ–Ϋ―΄–Ι ―¹–Η–Φ–Ω―²–Ψ–Φ –±―΄–Μ –Α–¥–Β–Κ–≤–Α―²–Ϋ–Ψ –Ψ―Ü–Β–Ϋ–Β–Ϋ –Η –Ω―Ä–Η–≤–Β–Μ –Κ –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η―é –¥–Ψ–Ω–Ψ–Μ–Ϋ–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Ψ–±―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι –Η –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Β –Ω―Ä–Α–≤–Η–Μ―¨–Ϋ–Ψ–≥–Ψ –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α –≤ –≤–Ψ–Ζ―Ä–Α―¹―²–Β 1 –≥–Ψ–¥–Α [33].
–Θ –≤―¹–Β―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –±―΄–Μ–Η –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ―΄ –Ϋ–Η–Ζ–Κ–Η–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è –Δ–ù–©–Λ, –Ω―Ä–Η―΅–Β–Φ ―É –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤–Ω–Β―Ä–≤―΄–Β –Α–Ϋ–Α–Μ–Η–Ζ –±―΄–Μ –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ –≤ –¥–Ψ–≤–Ψ–Μ―¨–Ϋ–Ψ –Ω–Ψ–Ζ–¥–Ϋ–Β–Φ –≤–Ψ–Ζ―Ä–Α―¹―²–Β, –Ϋ–Α–Ω―Ä–Η–Φ–Β―Ä ―É –Φ–Α–Μ―¨―΅–Η–Κ–Α –ü. [32] ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Δ–ù–©–Λ –±―΄–Μ–Ψ –≤–Ω–Β―Ä–≤―΄–Β –Ζ–Α―Ä–Β–≥–Η―¹―²―Ä–Η―Ä–Ψ–≤–Α–Ϋ–Ψ ―²–Ψ–Μ―¨–Κ–Ψ –≤ 6 –Μ–Β―².
–£ –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄―Ö ―¹–Μ―É―΅–Α―è―Ö –±―΄–Μ–Η ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ―΄ –Ϋ–Β–≤–Β―Ä–Ϋ―΄–Β –¥–Η–Α–≥–Ϋ–Ψ–Ζ―΄ (―Ä–Α―Ö–Η―², ―¹–Ψ–Φ–Α―²–Ψ–≥–Β–Ϋ–Ϋ–Α―è –Ζ–Α–¥–Β―Ä–Ε–Κ–Α ―Ä–Ψ―¹―²–Α), –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Α ―²–Β―Ä–Α–Ω–Η―è –≤–Η―²–Α–Φ–Η–Ϋ–Ψ–Φ D, –Κ–Ψ―²–Ψ―Ä–Α―è ―É―Ö―É–¥―à–Α–Μ–Α ―²–Β―΅–Β–Ϋ–Η–Β –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è [33, 40]. –€–Α–Μ―¨―΅–Η–Κ―É –†. –Ω―Ä–Η –Ψ–±―Ä–Α―â–Β–Ϋ–Η–Η –Κ ―¹―²–Ψ–Φ–Α―²–Ψ–Μ–Ψ–≥―É –±―΄–Μ –Ω–Ψ―¹―²–Α–≤–Μ–Β–Ϋ –¥–Η–Α–≥–Ϋ–Ψ–Ζ ¬Ϊ–≥–Β–Ϋ–Β―Ä–Α–Μ–Η–Ζ–Ψ–≤–Α–Ϋ–Ϋ―΄–Ι –Ω–Α―Ä–Ψ–¥–Ψ–Ϋ―²–Η―² ―²―è–Ε–Β–Μ–Ψ–Ι ―¹―²–Β–Ω–Β–Ϋ–Η¬Μ [33].
–£–Ψ –≤―¹–Β―Ö –Ψ–Ω–Η―¹–Α–Ϋ–Ϋ―΄―Ö ―¹–Μ―É―΅–Α―è―Ö –±―΄–Μ–Α –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Α –Φ–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ–Ψ-–≥–Β–Ϋ–Β―²–Η―΅–Β―¹–Κ–Α―è –≤–Β―Ä–Η―³–Η–Κ–Α―Ü–Η―è –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α –™–Λ–Λ. –Ξ–Α―Ä–Α–Κ―²–Β―Ä–Ϋ–Ψ, ―΅―²–Ψ –≤―¹–Β –Φ―É―²–Α―Ü–Η–Η –≥–Β–Ϋ–Α ALPL –Ϋ–Α―Ö–Ψ–¥―è―²―¹―è –≤ –≥–Β―²–Β―Ä–Ψ–Ζ–Η–≥–Ψ―²–Ϋ–Ψ–Φ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Η.
–®–Β―¹―²–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ –Η–Ζ –¥–Α–Ϋ–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Α ―³–Β―Ä–Φ–Β–Ϋ―²-–Ζ–Α–Φ–Β―¹―²–Η―²–Β–Μ―¨–Ϋ–Α―è ―²–Β―Ä–Α–Ω–Η―è –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–Φ –Α―¹―³–Ψ―²–Α–Ζ–Α –Α–Μ―¨―³–Α –≤ –¥–Ψ–Ζ–Β 2 –Φ–≥ –Ϋ–Α 1 –Κ–≥ –Φ–Α―¹―¹―΄ ―²–Β–Μ–Α 3 ―Ä–Α–Ζ–Α –≤ –Ϋ–Β–¥–Β–Μ―é, –Α 1 –Ω–Α―Ü–Η–Β–Ϋ―²―É –≤ –≤–Ψ–Ζ―Ä–Α―¹―²–Β 18 –Μ–Β―² βÄî–≤ –¥–Ψ–Ζ–Β 70 –Φ–≥/―¹―É―² 6 ―Ä–Α–Ζ –≤ –Ϋ–Β–¥–Β–Μ―é [40].
–£ 1 ―¹–Μ―É―΅–Α–Β –Ψ―²–Φ–Β―΅–Α–Β―²―¹―è, ―΅―²–Ψ –≤–Ψ–Ω―Ä–Ψ―¹ –Ψ –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Η ―³–Β―Ä–Φ–Β–Ϋ―²-–Ζ–Α–Φ–Β―¹―²–Η―²–Β–Μ―¨–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –±―É–¥–Β―² ―Ä–Β―à–Α―²―¨―¹―è –Ω―Ä–Η ―É―Ö―É–¥―à–Β–Ϋ–Η–Η ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –≤ –¥–Η–Ϋ–Α–Φ–Η–Κ–Β [33]. –Θ –≤―¹–Β―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –¥–Β―²―¹–Κ–Ψ–Ι ―³–Ψ―Ä–Φ–Ψ–Ι –Ω–Ψ―¹–Μ–Β –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Η –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ –Ε–Η–Ζ–Ϋ–Η –±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ―΄–Ι. –ù–Α ―³–Ψ–Ϋ–Β ―²–Β―Ä–Α–Ω–Η–Η –Α―¹―³–Ψ―²–Α–Ζ–Ψ–Ι –Α–Μ―¨―³–Α ―É –≤―¹–Β―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ϋ–Α–±–Μ―é–¥–Α–Μ–Ψ―¹―¨ ―É–Μ―É―΅―à–Β–Ϋ–Η–Β ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è, –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ–Β ―É―¹–Κ–Ψ―Ä–Β–Ϋ–Η–Β ―²–Β–Φ–Ω–Ψ–≤ ―Ä–Ψ―¹―²–Α, –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β –Φ―΄―à–Β―΅–Ϋ–Ψ–Ι ―¹–Η–Μ―΄ –Η ―²–Ψ–Μ–Β―Ä–Α–Ϋ―²–Ϋ–Ψ―¹―²–Η –Κ ―³–Η–Ζ–Η―΅–Β―¹–Κ–Η–Φ –Ϋ–Α–≥―Ä―É–Ζ–Κ–Α–Φ.
–û–±―¹―É–Ε–¥–Β–Ϋ–Η–Β
–ê–Ϋ–Α–Μ–Η–Ζ –Ψ–Ω–Η―¹–Α–Ϋ–Ϋ―΄―Ö –≤ –Ψ―²–Β―΅–Β―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Η―Ö –Ε―É―Ä–Ϋ–Α–Μ–Α―Ö ―¹–Μ―É―΅–Α–Β–≤ –™–Λ–Λ –Ω–Ψ–Κ–Α–Ζ–Α–Μ, ―΅―²–Ψ –≤ ―¹–Η–Μ―É ―Ä–Α–Ζ–Ϋ―΄―Ö –Ω―Ä–Η―΅–Η–Ϋ (–Ω–Ψ–Μ–Η–Φ–Ψ―Ä―³-–Ϋ–Ψ―¹―²―¨ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤, –Ψ―à–Η–±–Κ–Η –Ω―Ä–Η –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Η –Η –Η–Ϋ―²–Β―Ä–Ω―Ä–Β―²–Α―Ü–Η–Η ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–≤ –Η–Ζ–Φ–Β―Ä–Β–Ϋ–Η―è –©–Λ, –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Α―è –Ψ―¹–≤–Β–¥–Ψ–Φ–Μ–Β–Ϋ–Ϋ–Ψ―¹―²―¨ –≤―Ä–Α―΅–Β–Ι –Ψ –™–Λ–Λ) –Ϋ–Α–±–Μ―é–¥–Α–Μ–Η―¹―¨ ―¹–Μ–Ψ–Ε–Ϋ–Ψ―¹―²–Η –≤ ―¹–≤–Ψ–Β–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ–Ι –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Β –Ω―Ä–Α–≤–Η–Μ―¨–Ϋ–Ψ–≥–Ψ –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α. –ö–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Β –Ω―Ä–Ψ―è–≤–Μ–Β–Ϋ–Η―è –™–Λ–Λ ―Ä–Α–Ζ–Ϋ–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ―΄ –Η –Ζ–Α―²―Ä–Α–≥–Η–≤–Α―é―² –Φ–Ϋ–Ψ–≥–Η–Β –Ψ―Ä–≥–Α–Ϋ―΄ –Η ―¹–Η―¹―²–Β–Φ―΄, –≤ ―¹–≤―è–Ζ–Η ―¹ ―΅–Β–Φ –Ω–Α―Ü–Η–Β–Ϋ―²―΄ –Φ–Ψ–≥―É―² –Ϋ–Α–±–Μ―é–¥–Α―²―¨―¹―è ―É ―¹–Ω–Β―Ü–Η–Α–Μ–Η―¹―²–Ψ–≤ ―¹–Α–Φ–Ψ–≥–Ψ ―Ä–Α–Ζ–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ―³–Η–Μ―è.
–‰–Ζ-–Ζ–Α ―¹―Ö–Ψ–Ε–Η―Ö –Κ–Ψ―¹―²–Ϋ―΄―Ö –Ω―Ä–Ψ―è–≤–Μ–Β–Ϋ–Η–Ι –™–Λ–Λ –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ –Ψ―à–Η–±–Ψ―΅–Ϋ–Ψ –±―΄–Μ–Η ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ―΄ –¥–Η–Α–≥–Ϋ–Ψ–Ζ―΄ –±–Ψ–Μ–Β–Β ―Ä–Α―¹–Ω―Ä–Ψ―¹―²―Ä–Α–Ϋ–Β–Ϋ–Ϋ―΄―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Ι, ―²–Α–Κ–Η―Ö –Κ–Α–Κ ―Ä–Α―Ö–Η―², –Ϋ–Β―¹–Ψ–≤–Β―Ä―à–Β–Ϋ–Ϋ―΄–Ι –Ψ―¹―²–Β–Ψ–≥–Β–Ϋ–Β–Ζ, –Ψ―¹―²–Β–Ψ–Ω–Ψ―Ä–Ψ–Ζ, –Ζ–Α–¥–Β―Ä–Ε–Κ–Α ―Ä–Ψ―¹―²–Α, –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è –Ω–Α―Ä–Ψ–¥–Ψ–Ϋ―²–Α –Η –¥―Ä. –ù–Β–≤–Β―Ä–Ϋ―΄–Ι –¥–Η–Α–≥–Ϋ–Ψ–Ζ –Φ–Ψ–Ε–Β―² ―É―Ö―É–¥―à–Η―²―¨ –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ –Ω–Ψ –¥–≤―É–Φ –Ω―Ä–Η―΅–Η–Ϋ–Α–Φ: –Ψ―²―¹―Ä–Ψ―΅–Β–Ϋ–Ϋ–Ψ–Β –Μ–Β―΅–Β–Ϋ–Η–Β –Η –Ω―Ä–Ψ―²–Η–≤–Ψ–Ω–Ψ–Κ–Α–Ζ–Α–Ϋ–Η―è. –£–Ψ –≤―¹–Β―Ö –Ψ–Ω–Η―¹–Α–Ϋ–Ϋ―΄―Ö ―¹–Μ―É―΅–Α―è―Ö –≤ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α―Ö –±–Η–Ψ―Ö–Η–Φ–Η―΅–Β―¹–Κ–Η―Ö –Α–Ϋ–Α–Μ–Η–Ζ–Ψ–≤ –Ϋ–Α–±–Μ―é–¥–Α–Μ–Η―¹―¨ –Ϋ–Η–Ζ–Κ–Η–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η ―³–Β―Ä–Φ–Β–Ϋ―²–Α –Δ–ù–©–Λ, ―΅―²–Ψ ―è–≤–Μ―è–Β―²―¹―è –≥–Μ–Α–≤–Ϋ―΄–Φ ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Ϋ―΄–Φ –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Ψ–Φ –™–Λ–Λ. –û–¥–Ϋ–Α–Κ–Ψ –≤ –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Β ―¹–Μ―É―΅–Α–Β–≤ ―ç―²–Η –¥–Α–Ϋ–Ϋ―΄–Β –±―΄–Μ–Η –Ω―Ä–Ψ–Η–≥–Ϋ–Ψ―Ä–Η―Ä–Ψ–≤–Α–Ϋ―΄ –Φ–Ϋ–Ψ–≥–Η–Φ–Η ―¹–Ω–Β―Ü–Η–Α–Μ–Η―¹―²–Α–Φ–Η, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –Ω―Ä–Η –Ω–Β―Ä–≤–Η―΅–Ϋ–Ψ–Φ –Ψ–±―Ä–Α―â–Β–Ϋ–Η–Η –Ζ–Α –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Ψ–Ι –Ω–Ψ–Φ–Ψ―â―¨―é –≤ –Ω–Ψ–Μ–Η–Κ–Μ–Η–Ϋ–Η–Κ–Α―Ö –Ω–Ψ –Φ–Β―¹―²―É –Ε–Η―²–Β–Μ―¨―¹―²–≤–Α.
–£ –Ψ–Ω–Η―¹–Α–Ϋ–Ϋ―΄―Ö ―¹–Μ―É―΅–Α―è―Ö –Η–Ζ –Ψ―²–Β―΅–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Ι –Ω―Ä–Α–Κ―²–Η–Κ–Η –Φ―΄ –Ϋ–Α–±–Μ―é–¥–Α–Β–Φ –Ζ–Α–¥–Β―Ä–Ε–Κ―É –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Η: ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –¥–Β―²―¹–Κ–Ψ–Ι ―³–Ψ―Ä–Φ–Ψ–Ι –™–Λ–Λ ―¹–Η–Φ–Ω―²–Ψ–Φ―΄ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è –Ω―Ä–Ψ―è–≤–Μ―è–Μ–Η―¹―¨ ―É–Ε–Β –≤ ―Ä–Α–Ϋ–Ϋ–Β–Φ –≤–Ψ–Ζ―Ä–Α―¹―²–Β, –Ψ–¥–Ϋ–Α–Κ–Ψ –¥–Η–Α–≥–Ϋ–Ψ–Ζ –≤ –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Β ―¹–Μ―É―΅–Α–Β–≤ –±―΄–Μ –Ω–Ψ―¹―²–Α–≤–Μ–Β–Ϋ –≥–Ψ―Ä–Α–Ζ–¥–Ψ –Ω–Ψ–Ζ–Ε–Β βÄî –≤ 3βÄ™4 –≥–Ψ–¥–Α, 6 –Μ–Β―² –Η –¥–Α–Ε–Β –≤ 15 –Μ–Β―². –™–Μ–Ψ–±–Α–Μ―¨–Ϋ–Ψ–Β –Ω―Ä–Ψ―¹–Ω–Β–Κ―²–Η–≤–Ϋ–Ψ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Ψ, ―΅―²–Ψ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –™–Λ–Λ ―΅–Α―¹―²–Ψ –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² –Ζ–Α–¥–Β―Ä–Ε–Κ–Α –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Η –Ϋ–Α 12 –Η –±–Ψ–Μ–Β–Β –Φ–Β―¹―è―Ü–Β–≤ ―É –¥–Β―²–Β–Ι –Η –Ω―Ä–Η–Φ–Β―Ä–Ϋ–Ψ –Ϋ–Α 10 –Μ–Β―² ―É –≤–Ζ―Ä–Ψ―¹–Μ―΄―Ö. –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –Ω–Ψ–¥–Ψ–±–Ϋ―΄–Β ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Ψ―²―Ä–Α–Ε–Α―é―² –≥–Μ–Ψ–±–Α–Μ―¨–Ϋ―É―é –Ψ–≥―Ä–Α–Ϋ–Η―΅–Β–Ϋ–Ϋ―É―é –Ψ―¹–≤–Β–¥–Ψ–Φ–Μ–Β–Ϋ–Ϋ–Ψ―¹―²―¨ –Ψ –±–Ψ–Μ–Β–Ζ–Ϋ–Η [43]. –Δ–Β–Φ –Ϋ–Β –Φ–Β–Ϋ–Β–Β –Ζ–Α 11 –Μ–Β―² ―¹ –Ω–Β―Ä–≤–Ψ–≥–Ψ –Ψ–Ω–Η―¹–Α–Ϋ–Η―è ―¹–Μ―É―΅–Α―è –™–Λ–Λ –≤ –†–Λ [31] –Ϋ–Α–±–Μ―é–¥–Α–Β―²―¹―è –Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ–Α―è –¥–Η–Ϋ–Α–Φ–Η–Κ–Α –≤ ―¹–≤–Ψ–Β–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ–Ι –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Β –≤–Β―Ä–Ϋ–Ψ–≥–Ψ –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α. –‰–Ϋ―²–Β―Ä–Β―¹–Β–Ϋ –Ψ–Ω―΄―² ―Ä–Β―²―Ä–Ψ―¹–Ω–Β–Κ―²–Η–≤–Ϋ–Ψ–Ι –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Η –™–Λ–Λ, –Κ–Ψ–≥–¥–Α –Ω―Ä–Η –Ω―Ä–Ψ–≤–Β―Ä–Κ–Β –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–Ι –±–Α–Ζ―΄ –¥–Α–Ϋ–Ϋ―΄―Ö –≤―΄―è–≤–Μ―è–Μ–Η―¹―¨ –Ϋ–Η–Ζ–Κ–Η–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è –Δ–ù–©–Λ, –Α –¥–Α–Μ–Β–Β –Α–Ϋ–Α–Μ–Η–Ζ–Η―Ä–Ψ–≤–Α–Μ–Η―¹―¨ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Β ―¹–Η–Φ–Ω―²–Ψ–Φ―΄ –Η –Ω―Ä–Η –Ω–Ψ–¥–Ψ–Ζ―Ä–Β–Ϋ–Η–Η –Ϋ–Α –™–Λ–Λ –Ψ–±―Ä–Α–Ζ―Ü―΄ –Κ―Ä–Ψ–≤–Η –Ϋ–Α–Ω―Ä–Α–≤–Μ―è–Μ–Η―¹―¨ –Ϋ–Α –≥–Β–Ϋ–Β―²–Η―΅–Β―¹–Κ–Ψ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β. –‰―¹–Ω–Ψ–Μ―¨–Ζ―É―è ―ç―²–Ψ―² –Ω–Ψ–¥―Ö–Ψ–¥, –Α–≤―²–Ψ―Ä―΄ –≤―΄―è–≤–Η–Μ–Η
3 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –™–Λ–Λ [42].
–™–Β–Ϋ–Β―²–Η―΅–Β―¹–Κ–Α―è –≤–Β―Ä–Η―³–Η–Κ–Α―Ü–Η―è –±―΄–Μ–Α –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Α –≤ –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Β –Ψ–Ω–Η―¹–Α–Ϋ–Ϋ―΄―Ö ―¹–Μ―É―΅–Α–Β–≤ –™–Λ–Λ –≤ –†–Λ. –Γ―²–Ψ–Η―² –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ –≤ ―Ä–Β–¥–Κ–Η―Ö ―¹–Μ―É―΅–Α―è―Ö –Ω―Ä–Η –™–Λ–Λ –Φ―É―²–Α―Ü–Η–Η –≤ –≥–Β–Ϋ–Β ALPL –Ϋ–Β –Ψ–±–Ϋ–Α―Ä―É–Ε–Η–≤–Α―é―²―¹―è, –Ω–Ψ―ç―²–Ψ–Φ―É –¥–Μ―è –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Η –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α –≤–Β–¥―É―â–Η–Φ ―è–≤–Μ―è–Β―²―¹―è ―¹–Ψ―΅–Β―²–Α–Ϋ–Η–Β –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è, ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Ϋ―΄―Ö ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Ψ–≤ –Η ―¹–Ϋ–Η–Ε–Β–Ϋ–Η―è –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Δ–ù–©–Λ –Ϋ–Η–Ε–Β –Ϋ–Ψ―Ä–Φ―΄ [44]. –ö–Μ―é―΅–Ψ–Φ –Κ –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Β –≤ –Κ–Α–Ε–¥–Ψ–Φ ―¹–Μ―É―΅–Α–Β ―è–≤–Μ―è–Β―²―¹―è –Η–Ζ–Φ–Β―Ä–Β–Ϋ–Η–Β –Η ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤―É―é―â–Α―è –Η–Ϋ―²–Β―Ä–Ω―Ä–Β―²–Α―Ü–Η―è –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Δ–ù–©–Λ –≤ ―¹―΄–≤–Ψ―Ä–Ψ―²–Κ–Β –Κ―Ä–Ψ–≤–Η. –ê–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ ―³–Β―Ä–Φ–Β–Ϋ―²–Α ―¹―É―â–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ –Φ–Β–Ϋ―è–Β―²―¹―è ―¹ –≤–Ψ–Ζ―Ä–Α―¹―²–Ψ–Φ, –Η ―É –¥–Β―²–Β–Ι –Ψ–Ϋ–Α –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –≤―΄―à–Β, ―΅–Β–Φ ―É –≤–Ζ―Ä–Ψ―¹–Μ―΄―Ö. –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –¥–Μ―è –Ω―Ä–Α–≤–Η–Μ―¨–Ϋ–Ψ–Ι –Η–Ϋ―²–Β―Ä–Ω―Ä–Β―²–Α―Ü–Η–Η –Α–Ϋ–Α–Μ–Η–Ζ–Α –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Δ–ù–©–Λ ―Ä–Β―à–Α―é―â–Β–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β –Η–Φ–Β–Β―² –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β ―Ä–Β―³–Β―Ä–Β–Ϋ―¹–Ϋ―΄―Ö –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι ―¹ ―É―΅–Β―²–Ψ–Φ –≤–Ψ–Ζ―Ä–Α―¹―²–Α –Η –Ω–Ψ–Μ–Α –¥–Μ―è –Κ–Α–Ε–¥–Ψ–≥–Ψ –Ω–Α―Ü–Η–Β–Ϋ―²–Α.
–†–Α–Ϋ–Ϋ―è―è –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Α –™–Λ–Λ –Η–Φ–Β–Β―² ―¹―É―â–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β –≤ ―¹–≤―è–Ζ–Η ―¹ –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η–Β–Φ ―³–Β―Ä–Φ–Β–Ϋ―²-–Ζ–Α–Φ–Β―¹―²–Η―²–Β–Μ―¨–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Α―¹―³–Ψ―²–Α–Ζ–Ψ–Ι –Α–Μ―¨―³–Α. –Γ ―É―΅–Β―²–Ψ–Φ –Ω―Ä–Ψ–≥―Ä–Β―¹―¹–Η―Ä―É―é―â–Β–≥–Ψ ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Α –≤―Ä–Ψ–Ε–¥–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è ―Ä–Α–Ϋ–Ϋ–Β–Β –Ϋ–Α―΅–Α–Μ–Ψ –Μ–Β―΅–Β–Ϋ–Η―è –Ψ–Ζ–Ϋ–Α―΅–Α–Β―² –Μ―É―΅―à–Η–Ι –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ ―¹ ―²–Ψ―΅–Κ–Η –Ζ―Ä–Β–Ϋ–Η―è ―Ä–Α–Ζ–≤–Η―²–Η―è –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι –Η –Η–Ϋ–≤–Α–Μ–Η–¥–Η–Ζ–Α―Ü–Η–Η –¥–Β―²–Β–Ι, –Α –¥–Μ―è –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ ―²―è–Ε–Β–Μ―΄–Φ–Η ―Ä–Α–Ϋ–Ϋ–Η–Φ–Η ―³–Ψ―Ä–Φ–Α–Φ–Η (–Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ–Ι –Η –Η–Ϋ―³–Α–Ϋ―²–Η–Μ―¨–Ϋ–Ψ–Ι) –≤–Ψ–≤―Ä–Β–Φ―è –Ω–Ψ―¹―²–Α–≤–Μ–Β–Ϋ–Ϋ―΄–Ι –¥–Η–Α–≥–Ϋ–Ψ–Ζ –Φ–Ψ–Ε–Β―² –Ψ–Ω―Ä–Β–¥–Β–Μ―è―²―¨ –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ –¥–Μ―è –Ε–Η–Ζ–Ϋ–Η ―Ä–Β–±–Β–Ϋ–Κ–Α.
–½–Α–Κ–Μ―é―΅–Β–Ϋ–Η–Β
–ê–Ϋ–Α–Μ–Η–Ζ ―¹–Μ―É―΅–Α–Β–≤ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è –™–Λ–Λ, –Ψ–Ω–Η―¹–Α–Ϋ–Ϋ―΄―Ö –Κ –Ϋ–Α―¹―²–Ψ―è―â–Β–Φ―É –≤―Ä–Β–Φ–Β–Ϋ–Η –≤ ―Ä–Ψ―¹―¹–Η–Ι―¹–Κ–Η―Ö –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Η―Ö –Ϋ–Α―É―΅–Ϋ―΄―Ö –Ε―É―Ä–Ϋ–Α–Μ–Α―Ö, –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Ψ–≤–Α―²―¨ –Ω―Ä–Α–Κ―²–Η–Κ―É―é―â–Η–Φ ―¹–Ω–Β―Ü–Η–Α–Μ–Η―¹―²–Α–Φ –Ω―Ä–Η –Ϋ–Α–Μ–Η―΅–Η–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α –Μ―é–±–Ψ–Ι –Κ–Ψ―¹―²–Ϋ–Ψ–Ι –Ω–Α―²–Ψ–Μ–Ψ–≥–Η–Η ―¹ ―Ä–Α―Ö–Η―²–Ψ–Ω–Ψ–¥–Ψ–±–Ϋ―΄–Φ–Η –Ω―Ä–Ψ―è–≤–Μ–Β–Ϋ–Η―è–Φ–Η –Ω―Ä–Ψ–≤–Ψ–¥–Η―²―¨ –Ψ–±―è–Ζ–Α―²–Β–Μ―¨–Ϋ―É―é –Ψ―Ü–Β–Ϋ–Κ―É ―É―Ä–Ψ–≤–Ϋ―è –Δ–ù–©–Λ –Κ–Α–Κ –Ψ―¹–Ϋ–Ψ–≤–Ψ–Ω–Ψ–Μ–Α–≥–Α―é―â–Β–≥–Ψ –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ ―²–Β―¹―²–Α –¥–Μ―è –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Β–Ϋ–Η―è –¥–Η–Α–≥–Ϋ–Ψ–Ζ–Α –™–Λ–Λ. –ü―Ä–Η –Η–Ϋ―²–Β―Ä–Ω―Ä–Β―²–Α―Ü–Η–Η ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–≤ –Η–Ζ–Φ–Β―Ä–Β–Ϋ–Η―è –©–Λ –Κ―Ä–Α–Ι–Ϋ–Β –≤–Α–Ε–Ϋ–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α―²―¨ ―Ä–Β―³–Β―Ä–Β–Ϋ―¹–Ϋ―΄–Β –¥–Η–Α–Ω–Α–Ζ–Ψ–Ϋ―΄ ―¹ ―É―΅–Β―²–Ψ–Φ –Ω–Ψ–Μ–Α –Η –≤–Ψ–Ζ―Ä–Α―¹―²–Α –Ω–Α―Ü–Η–Β–Ϋ―²–Α.
–ë–Μ–Α–≥–Ψ–¥–Α―Ä–Ϋ–Ψ―¹―²―¨
–ê–≤―²–Ψ―Ä―΄ –±–Μ–Α–≥–Ψ–¥–Α―Ä―è―² –≥―Ä―É–Ω–Ω―É MAG (Medical AdviserβÄôs Group) –≤ –Μ–Η―Ü–Β –ï–Μ–Β–Ϋ―΄ –·–Κ–Η–Φ–Ψ–≤–Ψ–Ι –Ζ–Α –Ω–Ψ–Φ–Ψ―â―¨ –≤ –Ω–Ψ–¥–≥–Ψ―²–Ψ–≤–Κ–Β ―Ä―É–Κ–Ψ–Ω–Η―¹–Η –Ω―Ä–Η ―³–Η–Ϋ–Α–Ϋ―¹–Ψ–≤–Ψ–Ι –Ω–Ψ–¥–¥–Β―Ä–Ε–Κ–Β –û–û–û ¬Ϊ–Γ–≤–Η–Κ―¹ –ë–Η–Ψ―³–Α―Ä–Φ–Α¬Μ.












