Мы поставили своей задачей изучить характер поражения дистальных артерий у больных с синдромом диабетической стопы в плане перспектив эндоваскулярной хирургии. Зная характер поражения периферических сосудов у таких больных, мы стремились разработать детали техники баллонной ангиопластики и стентирования. Проведено сравнение результатов лечения пациентов эндоваскулярными методами и традиционными методами у больных с синдромом диабетической стопы.
Материал и методы исследований
Под нашим наблюдением с 2006 по 2009 г. находились 102 пациента с сахарным диабетом (СД) 1 и 2 типов и синдромом диабетической стопы (СДС) в возрасте от 29 до 79 лет. У 54 пациентов в результате проведенной программы исследований выявлены показания к лечению эндоваскулярными методами. 48 пациентов методы эндоваскулярной хирургии применены не были. Обе группы были сопоставимы по основным демографическим параметрам, клиническим проявлениям СД и СДС. Мужчин было 69 (36 в 1–й и 33 во 2–й группе). В обеих группах сопутствующая медикаментозная терапия была комплексной и патогенетически обоснованной. Она включала коррекцию нарушений углеводного обмена, введение антиагрегантов (пентоксифиллин, дипиридамол) и введение Актовегина в дозе 1000 мг в сутки. Введение Актовегина начиналось за 5 дней до операции, в день операции и на следующий день доза увеличивалась до1500 мг, на 3–5–е сутки доза составляла 1000 мг в сутки.
Еще одну группу составили 98 пациентов, которые лечились по поводу сосудистых осложнений СДС с 2000 по 2005 г. Им проводились реконструктивные операции на сосудах нижних конечностях по поводу хронической артериальной недостаточности. Медикаментозное лечение этих больных не включало лечение Актовегином. По полу, возрасту, течению сахарного диабета и проявлениям артериальной недостаточности группы были идентичны.
Всем больным выполнялась диагностическая программа, включавшая исследования параметров гемостаза, реологических свойств крови, состояния регионарного кровотока в конечностях с использованием ультразвуковой допплерографии и дуплексного сканирования (ДС) артерий подвздошно-бедренно-берцового сегментов и стопы с расчетом лодыжечно-плечевого индекса (ЛПИ). Напряжение кислорода в I межпальцевом промежутке стопы определяли на кардиомониторе Solar во время ангиографии (АГ) до начала эндоваскулярного вмешательства (ангиографическая установка ANGIOSIGMA DAR 2400, SHIMADZU) в группе 1. Контрольное исследование проводилось на 3–и послеоперационные сутки.
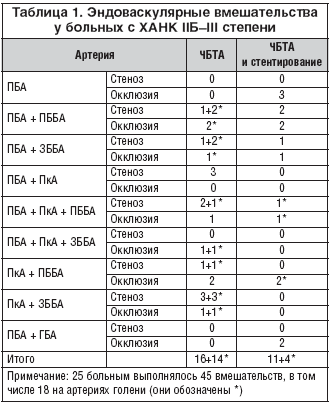
Ниже приводим виды и количество эндоваскулярных вмешательств у 54 пациентов с СДС. Среди них у 25 была констатирована IIБ–III степень ишемии, у 29 – IV. Виды и количество эндоваскулярных вмешательств у 25 пациентов со IIБ–III степенью хронической недостаточности артериального кровообращения (ХАНК) приводим в таблице 1. У этих больных чрескожная баллонная транслюминальная ангиопластика (ЧБТА) и стентирование выполнялись на сегментах следующих артерий: поверхностной бедренной (ПБА), подколенной (ПкА), передней и задней большеберцовых (ПББА и ЗББА). При эндоваскулярных вмешательствах в основном мы использовали антеградный трансфеморальный доступ (48 больных), однако в 3 случаях был выбран контрлатеральный доступ. У 3 больных с патологической извитостью подвздошных артерий был применен трансаксиллярный доступ.
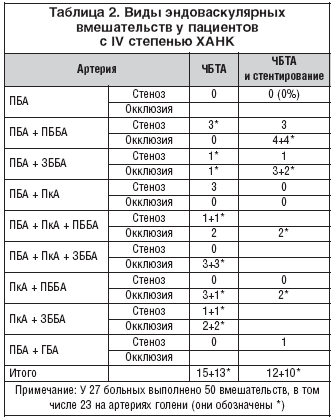
Из 29 больных с ишемией IV степени выполнить подобную операцию удалось у 27 (табл. 2).
У 35 были выполнены открытые реконструктивные операции: 25 пациентам со IIБ и III степенью ишемии и 10 – с IV степенью (табл. 3).
Ввиду отсутствия условий для реконструктивного вмешательства, комплексная консервативная терапия проведена 13 пациентам.
В обеих группах сопутствующая медикаментозная терапия была идентичной, комплексной и патогенетически обоснованной. Она включала коррекцию нарушений углеводного обмена, введение антиагрегантов и введение Актовегина в дозе 1000 мг в сутки. Введение Актовегина начиналось за 5 дней до операции, в день операции и на следующий день доза увеличивалась до1500 мг, на 3–5 сутки доза составляла 1000 мг в сутки.
Статистический анализ данных проводили с использованием программы STATISTICA 6.0 (StatSoft Inc., США).
Результаты исследований
Из 54 больных основной группы у 34 выявлены окклюзии ПБА и ПкА, у 20 – стенозы. При визуализации артерий подвздошно-бедренного и подколенного сегментов выраженных различий между ангиографическим и дуплексным исследованиями выявлено не было.
В артериях берцового сегмента, напротив, нами получены существенные различия между данными ДС и АГ. Так, у 9 пациентов с окклюзией ПБА или ПкА при ДС отмечалось отсутствие кровотока по ЗББА или ПББА. Однако при селективном введении контрастного препарата было получено контрастирование берцовых артерий у ряда больных.
Таким образом, из 68 артерий голени 34 пациентов с окклюзиями поверхностной бедренной и подколенной артерий в 18 (26%) случаях (у 9 больных) при ДС была ложно диагностирована окклюзия берцовых артерий.
Решающее значение в лечении рассматриваемых больных имеет наличие или отсутствие реальной окклюзии артерий голени (рис. 1 и 2).
Непосредственные результаты у больных обеих групп мы оценивали по модифицированной нами шкале R. Rutherford [13] (табл. 4). Суть изменений, внесенных в эту шкалу, состоит в замене показателя ЛПИ, неинформативного у лиц с СДС, на значения чрескожного напряжения кислорода (tcPO2). Нормальное значение tcP02 составляет 65 мм рт.ст., а значимое изменение – более 10 мм рт. ст. [1].
Приводим ближайшие результаты эндоваскулярных операций в группах больных с исходной степенью ишемии конечности IIБ–III. Восстановление магистрального кровотока достигнуто в 100% случаев. У всех 25 пациентов этот успех доказан ангиографически. Динамика степени ишемии после реваскуляризации показана в таблице 5.
Как видно из приведенных данных, у всех 25 больных наступило значительное улучшение, что выражалось в исчезновении боли в покое и значительном увеличении дистанции безболевой ходьбы, т.е. улучшилось качество жизни.
Что касается результатов открытых хирургических реконструкций у пациентов с такой же (IIБ–III) степенью ишемии, непосредственный положительный результат был достигнут также у всех у 25 пациентов (100%). Осложнения возникли у 2 больных, которым пришлось повторно выполнить тромбэктомию из зоны дистального анастомоза, после чего они были выписаны в удовлетворительном состоянии. У остальных пациентов ранний послеоперационный период протекал без осложнений.
Таким образом, в результате эндоваскулярных и открытых операций у больных с исходной степенью ишемии IIБ–III было достигнуто значительное и умеренное улучшение по шкале Rutherford (табл. 6).
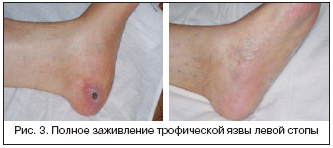
Из 29 больных основной группы с ишемией IV степени путем баллонной ангиопластики магистральный кровоток удалось восстановить в 27 случаях (93 %). В раннем послеоперационном периоде одному пациенту с протяженной окклюзией (11 см) поверхностной бедренной артерии пришлось выполнить высокую ампутацию в связи с прогрессированием ишемии, несмотря на восстановление магистрального кровотока после ангиопластики. Таким образом, клиническое улучшение было достигнуто у 26 больных (89%). На рисунке 3 представлены фотографии стопы больной К. до и через 3 месяца после ангиопластики ПБА и ЗББА.
Реконструктивные сосудистые операции были выполнены у 10 пациентов с IV степенью ХАНК, у 13 пациентов, несмотря на отсутствие условий для реконструктивной операции, конечность была признана жизнеспособной и проводилась консервативная терапия.
Непосредственные результаты лечения всех пациентов с IV степенью ХАНК представлены в таблице 7.
Результаты лечения в отдаленном периоде (18 месяцев) изучены у пациентов обеих групп (102 пациента). Помимо клинического осмотра, ряду пациентов выполнялось ДС, определение tcPO2, в нескольких случаях потребовалась повторная ангиография.
Из 25 человек основной группы с исходной IIБ и III степенью ХАНК живы 23 пациента. Двум больным на 4 и 6–м месяце после вмешательства (стентирование ПБА) была выполнена тромбэктомия. В дальнейшем кровоток в конечности оставался магистральным в течение всего периода наблюдения. У 4 пациентов в сроки от 8 до 10 месяцев были обнаружены окклюзии в подколенной и берцовых артериях, проявляющиеся повышением класса ХАНК, снижением tcPO2 на 10 и более мм рт. ст. Еще у двух больных окклюзия возникла после баллонной ангиопластики подколенной артерии. Все нарушения артериальной проходимости были верифицированы во время ангиографии и подвергнуты эндоваскулярной коррекции с хорошим ангиографическим и клиническим эффектом.
У остальных 15 пациентов ухудшение состояния кровообращения по сравнению с ранним послеоперационным периодом не отмечалось.
В группе из 27 пациентов с IV степенью ХАНК через 18 месяцев живы 22. Все случаи смерти в отдаленном периоде были обусловлены другими осложнениями СД и не связаны с хирургическим вмешательством. Высокие ампутации в разные сроки отдаленного периода были выполнены 5 пациентам. Общее количество ампутаций, принимая в расчет 2 случая неудавшейся реваскуляризации, у пациентов с IV степенью ХАНК достигло 8 (36%).
В отдаленном периоде в группе сравнения у больных с II–Б и III степенью ХАНК первичная проходимость шунтов (без повторных вмешательств) составила 76%. В 6 случаях выполнены повторные вмешательства: тромбэктомия из шунта (3) и повторное шунтирование реверсированной аутовеной (3). В результате вторичная проходимость шунта составила 20%.
Первичная проходимость шунта в течение 18 месяцев у пациентов с IV степенью ХАНК составила 60%.
Пациентам, получавшим консервативную терапию, выполнены 3 высокие ампутации в разные сроки отдаленного периода.
При сравнении непосредственных результатов лечения в двух группах, одна из которых получала Актовегин в комплексной периоперационном лечении (102 пациента), а другая не получала (98 пациентов), мы установили повышение уровня чрескожного напряжения кислорода на 6–12 мм в процессе предоперационной подготовки и уменьшение клинических проявлений артериальной недостаточности в послеоперационном периоде (улучшение по шкале Rutherford).
Обсуждение
Стентирование поверхностной бедренной артерии, как и другие авторы [1-4,7,9], мы выполняли, если поражение не распространялось на подколенную артерию. При распространении поражения на подколенную артерии мы ограничивались только баллонной ангиопластикой всего бедренно-подколенного сегмента. В подколенной артерии мы принципиально ограничивались ангиопластикой, поскольку стентирование подколенной артерии чревато повреждением стента и дальнейшим тромбозом. При поражении артерий голени мы старались ограничиться оптимальной баллонной ангиопластикой, предложенной Graziani [8]. Суть этого метода заключается в медленном и продолжительном (в течение 180 с) раздувании баллона, покрывающего всю поврежденную интиму. Стентирование артерий голени выполняется только в случае возникновения диссекции. Такая техника значительно уменьшает риск рестеноза баллонированного сегмента.
Как показано выше, непосредственный успех эндоваскулярных операций составил 96%. Отдельные авторы [6,12,14] полагают, что шунтирующие операции на сосудах при СДС более эффективны в плане долговременных результатов, чем баллонная ангиопластика. Другие хирурги [6,7,9,12,13], напротив, считают целесообразным использование методов рентгеноангиохирургии у таких больных.
При сравнении результатов рентгенохирургических и открытых реваскуляризаций у наших пациентов с II–Б и III степенью ишемии различий по изучаемым критериям не выявлено. У 100% пациентов в обеих группах достигнуто значительное или умеренное улучшение кровотока в конечности. Вместе с тем следует подчеркнуть, что эндоваскулярные вмешательства легче переносятся пациентами, из–за отсутствия операционной травмы.
В отдаленном периоде в исследуемой группе больных с ишемией IIБ–III степени ампутаций не было. Первичная проходимость зоны стентирования сохранялась у 15 (65%). У остальных 8 пациентов (35%) с реокклюзией потребовалось повторное вмешательство, которое у всех было успешным.
В группе сравнения была выполнена 1 ампутация (4%). Первичная проходимость шунтов сохранялась у 19 больных (76%), повторная операция потребовалась 5 пациентам (20%).
Иные результаты были получены при сравнении категорий пациентов с IV степенью ХАНК. В исследуемой группе реваскуляризация была выполнена у 27 (93%) больных, непосредственный положительный результат получен у 26 (89%). Этот факт сам по себе подчеркивает имеющиеся возможности реваскуляризации у самых тяжелых категорий больных СД. Между тем в группе сравнения непосредственный положительный результат при той же тяжелой степени ишемии достигнут лишь у 12 больных– 52%.
Через 18 месяцев в исследуемой группе больных с исходной IV степенью ХАНК выполнено 5 ампутаций (20%). У 21 (80%) сохранялся магистральный кровоток в конечности. Однако в группе сравнения в течение этого срока конечность удалось сохранить только у 9 человек (39%).
Выводы
1. Ангиографическое исследование должно выполняться всем пациентам с сахарным диабетом, имеющим жалобы на боль в нижних конечностях, возникающую при ходьбе на расстояние менее 200 м. Тем более, это исследование должно выполняться при появлении язвенно–некротических дефектов на стопе.
2. Восстановление магистрального кровотока даже по одной из берцовых артерий приводит к редукции степени ишемии и заживлению язвенно–некротических дефектов.
3. Эффективность рентегенохирургических методов реваскуляризации у пациентов с II–Б–III степенью ишемии не уступает результатам открытых операций на сосудах. У пациентов с IV степенью ишемии результаты применения баллонной ангиопластики и стентирования лучше, чем после применения традиционных методов лечения этой категории больных.
4. Применение Актовегина в дозе 1000 мг в сутки в периоперационном периоде у больных сахарным диабетом способствует улучшению непосредственных результатов хирургического лечения.







Литература
1. Зеленов М,А., Ерошкин И.А., Жуков А.О., Коков Л.С., Светухин А.М., Покровский А.В. Баллонная ангиопластика и стентирование нижних конечностей больных сахарным диабетом. Диагностическая и интервенционная радиология. 2007; 1(4): 73–78.
2. Капутин М.Ю. Овчаренко Д.В., Сорока В.В. и соавт. Субинтимальная ангиопластика в лечении больных с критической ишемией нижних конечностей. Медицинский академический журнал. 2007; 6(3): 103–108.
3. Затевахин И.И., Шиповский В.Н., Золкин В.Н. Баллонная ангиопластика при ишемии нижних конечностей. М., Медицина. 2004; 159–163.
4. Шиповский В.Н.. Золкин В.Н., Магомедов Ш.Г. Баллонная ангиопластика артерий голени. 2008; 2(4): 55–62.
5. Adam D.J., Beard J.D., Clevelend T.T. Bypass versus angioplasty in severe ischemia of leg (BASIL): multicentre, randomized controlled trial. Lancet. 2005;366 (9501): 1925–1934.
6. Blair J.M., Gewertz B.L., Moosa H.,Lu C. T., Zarris , Percutaneous transluminal angioplasty versus surgery for limb–threatening ischemia. J. Vasc.Surgery. 1989; 9 (5):698–703.
7. Faglia E., Clerici G., Caminiti M., Quarantiello A., Curci V., Morabito A. predictive values of transcutaneus oxygene tension for above–the–ankle amputation in diabetic patients with critical limb ischemia. Eur. J. Vasc. Endovasc. Surg. 2007; 33:731–736.
8. Graziani L., Silvestro A., Bertone V., Manara E., Alicandry A., Parrinello G., Manganoni A., Percutaneous transluminal angioplasty is feasible and effective in patients on chronic dialysis with severe peripheral artery disease. Nephrol. Dial. Transplant. 2007; 22(4): 1144–1149.
9. Inter–Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Eur. J. Vasc. Endovasc. Surg. 2007; 33: Suppl. 1
10. Molloy K.J., Nasym A., London N.J., Naylor A.R., Bell P.R., Fishwick G., Bolia A., Thompson M.M. Percutaneous transluminal angioplasty in the treatment of critical limb ischemia. J. Endovasc. therapy. 2003; 10 (2): 298–303.
11. Nasr M.K., McCarthy R.J., Hardman J., Chalmers A., Horrocks M. The increasing role of percutaneous transluminal angioplasty in the primary management of critical limb ischemia. Eur. J. Vasc. Endovasc. Surg. 2002; 23 (5): 398–403.
12. Parson R.E., Suggs W.D, Lee J.J., Sanchez L.A., Lyon R.T., Veith F.J. Percutaneous transluminal angioplasty for the treatment of the limb threatening ischemia: do the results justify an attempt before bypass grafting? J. Vasc.Surgery. 1998; 28 (6): 1066–1071.
13. Rutherford R.B., Durham J. Percutaneous balloon angioplasty for arteriosclerosis obliterans: Long–term results. In Pearce W.H. (eds). Technologies in vascular Surgery. 1992; 32–345.
14. Treiman G.S, Treiman R.L., Ichikawa L., Van Allan R. ,Should percutaneous transluminal angioplasty be recommended for treatment of infrageniculate popliteal artery or tibioperoneal trunk stenosis? J. Vasc.Surgery. 1995; 22 (4): 457–463, 464–465.












