–£ –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ –Ї—А–Њ–≤–Є, –∞ —В–∞–Ї–ґ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –µ–≥–Њ —Б—Г—В–Њ—З–љ–Њ–≥–Њ —А–Є—В–Љ–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞, —А–∞–Ј–≤–Є—В–Є—О –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–Є –љ–∞ —Д–Њ–љ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–∞ –Є –љ–µ–є—В—А–Њ—Д–Є–ї–Є–Є. –Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—А–Њ–≤–љ—П –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї–Њ—А—В–Є–Ј–Њ–ї–µ–Љ–Є–Є —Б–љ–Є–ґ–∞–µ—В—Б—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї (–Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤, –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤), —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –≥—А–Є–±–Ї–Њ–≤—Л—Е –Є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –≤—Л–Ј–≤–∞–љ–љ—Л—Е —Б–∞–њ—А–Њ—Д–Є—В–љ—Л–Љ–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ–Є). –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є –∞–Ї—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –љ–µ–є—В—А–Њ—Д–Є–ї–∞–Љ–Є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –њ—А–µ–і–∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є, —З—В–Њ —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В —П–≤–ї—П—В—М—Б—П –њ—А–Є—З–Є–љ–Њ–є —Б–љ–Є–ґ–µ–љ–Є—П –Є—Е —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ –Њ—В–≤–µ—В –љ–∞ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Г—О —Б—В–Є–Љ—Г–ї—П—Ж–Є—О. –£—Б—Г–≥—Г–±–ї–µ–љ–Є–µ –љ–∞—А—Г—И–µ–љ–Є–є –≤ –≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–Љ –Є–Љ–Љ—Г–љ–Є—В–µ—В–µ —Г –±–Њ–ї—М–љ—Л—Е —Б —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –Ј–∞–≤–Є—Б–Є—В –Њ—В —В—П–ґ–µ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Њ—В —Г—А–Њ–≤–љ—П –Ї–Њ—А—В–Є–Ј–Њ–ї–µ–Љ–Є–Є, –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —В–µ—З–µ–љ–Є—П –њ—А–Њ—Ж–µ—Б—Б–∞ (–љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ IgG –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –С–Ш–Ъ) [4].
–£—З–Є—В—Л–≤–∞—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ –Є —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Г –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ, –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ —Г –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ—Б–љ–Њ–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Ї–Њ—В–Њ—А—Л—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–∞ –∞–Ї—В–Є–≤–∞—Ж–Є—О –Ї–ї–µ—В–Њ–Ї––Љ–Є—И–µ–љ–µ–є –Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ–Њ––Љ–∞–Ї—А–Њ—Д–∞–≥–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л.
–Э–Њ–≤—Л–Љ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–Љ, —Б–Њ–Ј–і–∞–љ–љ—Л–Љ –≤ –Ш–љ—Б—В–Є—В—Г—В–µ –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є–Є –Ь–Ч –†–§ —Б –њ–Њ–Љ–Њ—Й—М—О –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–≥–Њ —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ—В–µ–Ј–∞, —П–≤–ї—П–µ—В—Б—П –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є (—Б–Њ–њ–Њ–ї–Є–Љ–µ—А N––Њ–Ї–Є—Б–Є–1,4–—Н—В–Є–ї–µ–љ–њ–Є–њ–µ—А–∞–Ј–Є–љ–∞ –Є 1,4–—Н—В–Є–ї–µ–љ–њ–Є–њ–µ—А–∞–Ј–Є–љ–Є—П –±—А–Њ–Љ–Є–і–∞) (—А–µ–≥. вДЦ 96/302/9, –њ–∞—В–µ–љ—В –†–§ вДЦ 2073031). –°–Є–љ—В–µ–Ј –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є—П –њ—А–Њ—Е–Њ–і–Є—В —З–µ—А–µ–Ј —Б—В–∞–і–Є—О N––Њ–Ї–Є—Б–ї–µ–љ–Є—П –≥–µ—В–µ—А–Њ—Ж–µ–њ–љ–Њ–≥–Њ —В—А–µ—В–Є—З–љ–Њ–≥–Њ –њ–Њ–ї–Є–∞–Љ–Є–љ–∞ –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ —В–Њ–Љ—Г, –Ї–∞–Ї –њ—А–Њ–Є—Б—Е–Њ–і–Є—В N––Њ–Ї–Є—Б–ї–µ–љ–Є–µ —В—А–µ—В–Є—З–љ—Л—Е –∞–Љ–Є–љ–Њ–≤ –≤ —А–∞—Б—В–µ–љ–Є—П—Е –Є –ґ–Є–≤—Л—Е –Њ—А–≥–∞–љ–Є–Ј–Љ–∞—Е –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞. –Ф–ї—П —Н—В–Є—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є —Е–∞—А–∞–Ї—В–µ—А–љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї –љ–µ–є—В—А–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –≤—Л–≤–µ–і–µ–љ–Є—О –Є–Ј –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Љ–љ–Њ–≥–Є—Е —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є (–Љ–µ—В–∞–ї–ї–Њ–≤, –Љ–Є–Ї—А–Њ–±–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, —В–Њ–Ї—Б–Є–љ–Њ–≤ –Є –і—А.). –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є, –Є–Љ–µ—О—Й–Є–є –±–Њ–ї–µ–µ 1000 –њ–Њ–≤—В–Њ—А—П—О—Й–Є—Е—Б—П –Ј–≤–µ–љ—М–µ–≤, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –≤c–µ –Є–Ј–≤–µ—Б—В–љ—Л–µ –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –Є –Њ–ї–Є–≥–Њ–Љ–µ—А–љ—Л–µ –і–µ—В–Њ–Ї—Б–Є–Ї–∞–љ—В—Л (–≥–µ–Љ–Њ–і–µ–Ј, –њ–Њ–ї–Є–≥–ї—О–Ї–Є–љ, –∞–ї—М–±—Г–Љ–Є–љ) [5]. –Ъ–ї–µ—В–Ї–∞–Љ–Є––Љ–Є—И–µ–љ—П–Љ–Є –і–ї—П –Я–Ю —П–≤–ї—П—О—В—Б—П –Љ–Њ–љ–Њ—Ж–Є—В—Л/–Љ–∞–Ї—А–Њ—Д–∞–≥–Є, –љ–µ–є—В—А–Њ—Д–Є–ї—Л –Є NK––Ї–ї–µ—В–Ї–Є. –Р–Ї—В–Є–≤–∞—Ж–Є—П –Ї–ї–µ—В–Њ–Ї –Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ–Њ––Љ–∞–Ї—А–Њ—Д–∞–≥–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –≤–µ–і–µ—В –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О –Љ–Є–≥—А–∞—Ж–Є–Є –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –≤ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –Њ—З–∞–≥, —Г—Б–Є–ї–µ–љ–Є—О –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–Є–Ј–Њ—Б–Њ–Љ–∞–ї—М–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤, –њ–Њ–≤—Л—И–µ–љ–Є—О —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Д–∞–≥–Њ—Ж–Є—В–Њ–≤ –њ–Њ–≥–ї–Њ—Й–∞—В—М –Є —Г–±–Є–≤–∞—В—М –Љ–Є–Ї—А–Њ–±—Л. –Я–Њ–Љ–Є–Љ–Њ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞, –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –Њ–±–ї–∞–і–∞–µ—В –і–µ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Њ–љ–љ—Л–Љ, –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ –Є –Љ–µ–Љ–±—А–∞–љ–Њ—Б—В–∞–±–Є–ї–Є–Ј–Є—А—Г—О—Й–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ [6]. –Ґ–∞–Ї–ґ–µ –њ—А–µ–њ–∞—А–∞—В –Њ–±–ї–∞–і–∞–µ—В –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ (–Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ –≤–≤–µ–і–µ–љ–љ—Л–є, –Њ–љ –і–µ–є—Б—В–≤—Г–µ—В –≤ —В–µ—З–µ–љ–Є–µ 1–2 –љ–µ–і–µ–ї—М) –Є –≤—Л—Б–Њ–Ї–Њ–є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—Г—В—П—Е –≤–≤–µ–і–µ–љ–Є—П (89%). –Я–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є —Б–њ–Њ—Б–Њ–±–µ–љ –њ—А–Њ–љ–Є–Ї–∞—В—М —З–µ—А–µ–Ј –≥–µ–Љ–∞—В–Њ—Н–љ—Ж–µ—Д–∞–ї–Є—З–µ—Б–Ї–Є–є –Є –≥–µ–Љ–∞—В–Њ–Њ—Д—В–∞–ї—М–Љ–Є—З–µ—Б–Ї–Є–є –±–∞—А—М–µ—А—Л [5,6].
–Т—В–Њ—А—Л–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–Љ, —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л–Љ –≤ –Ш–љ—Б—В–Є—В—Г—В–µ –±–Є–Њ–Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Њ–є —Е–Є–Љ–Є–Є, –∞–љ–∞–ї–Њ–≥ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П, —П–≤–ї—П–µ—В—Б—П –ї–Є–Ї–Њ–њ–Є–і (—А–µ–≥. вДЦ 95/211/1), –њ–Њ–ї—Г—З–Є–≤—И–Є–є –≤ 1996 –≥. –њ—А–µ–Љ–Є—О –Я—А–∞–≤–Є—В–µ–ї—М—Б—В–≤–∞ –†–Њ—Б—Б–Є–Є. –Ф–µ–є—Б—В–≤—Г—О—Й–µ–µ –љ–∞—З–∞–ї–Њ –ї–Є–Ї–Њ–њ–Є–і–∞ N––∞—Ж–µ—В–Є–ї–≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–Є–ї–N––∞—Ж–µ—В–Є–ї–Љ—Г—А–∞–Љ–Є–ї––∞–ї–∞–љ–Є–ї–D––Є–Ј–Њ–≥–ї—Г—В–∞–Љ–Є–љ (–≥–ї—О–Ї–Њ–Ј–∞–Љ–Є–љ–Є–ї–Љ—Г—А–∞–Љ–Є–ї–і–Є–њ–µ–њ—В–Є–і) – —Н—В–Њ –Њ—Б–љ–Њ–≤–љ–Њ–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –Ї–ї–µ—В–Њ—З–љ—Л—Е —Б—В–µ–љ–Њ–Ї –≤—Б–µ—Е –Є–Ј–≤–µ—Б—В–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є (7). –° 1995 –≥–Њ–і–∞ –ї–Є–Ї–Њ–њ–Є–і —А–∞–Ј—А–µ—И–µ–љ –Ї –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–Љ—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —Г –≤–Ј—А–Њ—Б–ї—Л—Е. –Т –і–µ–Ї–∞–±—А–µ 1998 –≥–Њ–і–∞ –њ–Њ–ї—Г—З–µ–љ–Њ —А–∞–Ј—А–µ—И–µ–љ–Є–µ –§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–Є—В–µ—В–∞ –љ–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –ї–Є–Ї–Њ–њ–Є–і–∞ –≤ –њ–µ–і–Є–∞—В—А–Є–Є.
–Т—Л—П–≤–ї–µ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л –ї–Є–Ї–Њ–њ–Є–і–∞ [7,8]:
1. –£—Б–Є–ї–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є HLA–DR––∞–љ—В–Є–≥–µ–љ–Њ–≤ –Ї–ї–µ—В–Њ–Ї –Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ–Њ––Љ–∞–Ї—А–Њ—Д–∞–≥–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л.
2. –°—В–Є–Љ—Г–ї—П—Ж–Є—П —Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤ –Ј–∞ —Б—З–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Б–Є–љ—В–µ–Ј–∞ —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤, –∞ –Є–Љ–µ–љ–љ–Њ —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є (–§–Э–Ю) –Є –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–∞–1 (–Ш–Ы–1), –≤—Б–ї–µ–і—Б—В–≤–Є–µ —З–µ–≥–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –∞–љ—В–Є–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–∞—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Љ–∞–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞.
3. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Ї—А–Њ–≤–Є –Є, –Ї–∞–Ї —А–µ–Ј—Г–ї—М—В–∞—В, —Б—В–Є–Љ—Г–ї—П—Ж–Є—П –ї–µ–є–Ї–Њ–њ–Њ—Н–Ј–∞.
4. –°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В, —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –Є–љ–і—Г–Ї—Ж–Є–µ–є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Є –Ї–ї–µ—В–Њ–Ї –Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ–Њ––Љ–∞–Ї—А–Њ—Д–∞–≥–∞–ї—М–љ–Њ–≥–Њ —А—П–і–∞, –≤—Б–ї–µ–і—Б—В–≤–Є–µ —З–µ–≥–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Є–љ–∞–Ї—В–Є–≤–Є—А–Њ–≤–∞—В—М –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–µ –Ї–ї–µ—В–Ї–Є in vivo –Є in vitro. –С–ї–Њ–Ї–∞–і–∞ –і–µ–є—Б—В–≤–Є—П –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є —Б–љ–Є–ґ–µ–љ–Є–µ –Ј–∞ —Б—З–µ—В —Н—В–Њ–≥–Њ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞.
–Ч–∞ –њ–Њ—Б–ї–µ–і–љ–µ–µ –і–µ—Б—П—В–Є–ї–µ—В–Є–µ –љ–∞–Ї–Њ–њ–ї–µ–љ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є –Њ–њ—Л—В –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –Э–∞–њ—А–Є–Љ–µ—А, –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –Є –ї–Є–Ї–Њ–њ–Є–і –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –≤ –ї–µ—З–µ–љ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –ї–µ–≥–Ї–Є—Е, –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –≥–љ–Њ–є–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Њ—Б—В—А—Л—Е —А–µ—Б–њ–Є—А–∞—В–Њ—А–љ—Л—Е –≤–Є—А—Г—Б–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є—П—Е, –≥–µ—А–њ–µ—Б–µ, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –≤–Є—А—Г—Б–љ—Л—Е –≥–µ–њ–∞—В–Є—В–Њ–≤ –Т –Є –°, –њ—Б–Њ—А–Є–∞–Ј–µ [9,10]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А—Л –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –Є –ї–Є–Ї–Њ–њ–Є–і – –і–≤–∞ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–∞, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Њ–≤–∞—В—М –љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–ї–µ—В–Њ–Ї –Љ–Њ–љ–Њ—Ж–Є—В–∞—А–љ–Њ––Љ–∞–Ї—А–Њ—Д–∞–≥–∞–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–ї–Є—П–љ–Є—П –і–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Ї–ї–Є–љ–Є–Ї–Є –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ —П–≤–ї—П–µ—В—Б—П –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –≤ —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є–Є.
–¶–µ–ї—М—О –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —П–≤–ї—П–ї–Њ—Б—М –Є–Ј—Г—З–µ–љ–Є–µ –Ї–ї–Є–љ–Є–Ї–Њ––Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ (–њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є, –ї–Є–Ї–Њ–њ–Є–і) –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ —Г –±–Њ–ї—М–љ—Л—Е –≤ –∞–Ї—В–Є–≤–љ–Њ–є —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л
–Ю–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є –ї–µ—З–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ –Њ—В–і–µ–ї–µ–љ–Є–Є –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є–Є –≠–Э–¶ –†–Р–Ь–Э (—А—Г–Ї–Њ–≤–Њ–і–Є—В–µ–ї—М – –њ—А–Њ—Д. –Ь–∞—А–Њ–≤–∞ –Х.–Ш.). –Р–Ї—В–Є–≤–љ–∞—П —Б—В–∞–і–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б—В–∞–≤–Є–ї–∞—Б—М –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–∞. –Ш–Ј –≥—А—Г–њ–њ—Л 87 –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –±—Л–ї–Њ –≤—Л–і–µ–ї–µ–љ–Њ 45 —З–µ–ї–Њ–≤–µ–Ї –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 20 –і–Њ 46 –ї–µ—В, –≤ –∞–Ї—В–Є–≤–љ–Њ–є —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Є–Љ–µ–≤—И–Є—Е –Ї–ї–Є–љ–Є–Ї—Г –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ –Є –≥–Њ—В–Њ–≤–Є–≤—И–Є—Е—Б—П –Ї –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О (–∞–і—А–µ–љ–∞–ї– –Є/–Є–ї–Є –∞–і–µ–љ–Њ–Љ —Н–Ї—В–Њ–Љ–Є–Є). –Я–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 3 –≥—А—Г–њ–њ—Л –њ–Њ –Љ–µ—А–µ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –≤ –Ї–ї–Є–љ–Є–Ї—Г, –≥–і–µ –Є–Љ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–µ –Ї–ї–Є–љ–Є–Ї–Њ––Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –Є –ї–Є–Ї–Њ–њ–Є–і. –Ъ–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Њ –≤ —Б–µ–±—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Г—О —В–µ—А–∞–њ–Є—О (–Є–љ–≥–Є–±–Є—В–Њ—А—Л —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞, –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є—О –њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ), —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї—Г—О –Є –ї—Г—З–µ–≤—Г—О —В–µ—А–∞–њ–Є—О.
–Т –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ –Є–Ј 18 —З–µ–ї–Њ–≤–µ–Ї, –Њ—В 28 –і–Њ 46 –ї–µ—В, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –Ї–Њ—В–Њ—А—Л—Е —Б–Њ—Б—В–∞–≤–Є–ї 36,4±7,4 –ї–µ—В, –Ї –Њ—Б–љ–Њ–≤–љ–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –і–Њ–±–∞–≤–ї–µ–љ –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –≤ –і–Њ–Ј–µ 6 –Љ–≥ –≤/–Љ, —З–µ—А–µ–Ј –і–µ–љ—М, вДЦ10.
–Т–Њ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ–µ –Є–Ј 15 —З–µ–ї–Њ–≤–µ–Ї, –Њ—В 20 –і–Њ 43 –ї–µ—В, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В —Б–Њ—Б—В–∞–≤–Є–ї 31,3±5,7 –ї–µ—В, –Ї –Њ—Б–љ–Њ–≤–љ–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –і–Њ–±–∞–≤–ї–µ–љ –ї–Є–Ї–Њ–њ–Є–і –≤ –і–Њ–Ј–µ 10 –Љ–≥ (1 —В.) per os, —З–µ—А–µ–Ј –і–µ–љ—М, N 10.
–Т –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –Є–Ј 12 —З–µ–ї–Њ–≤–µ–Ї –Њ—В 27 –і–Њ 45 –ї–µ—В, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В – 35,5±8,2 –ї–µ—В, –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–∞—П —В–µ—А–∞–њ–Є—П, –≤–Ї–ї—О—З–∞—О—Й–∞—П –≤ —Б–µ–±—П –Є–љ–≥–Є–±–Є—В–Њ—А—Л —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞, –Є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ, –≤ —В.—З. –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є. –Я–µ—А–≤–Є—З–љ—Л–є –Є–Љ–Љ—Г–љ–љ—Л–є —Б—В–∞—В—Г—Б –≤–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї—Б—П –і–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞. –Я–Њ–≤—В–Њ—А–љ—Л–є –Є–Љ–Љ—Г–љ–љ—Л–є —Б—В–∞—В—Г—Б –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї—Б—П —З–µ—А–µ–Ј 25–30 –і–љ–µ–є, –њ–Њ—Б–ї–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є—П –Є –ї–Є–Ї–Њ–њ–Є–і–∞, –∞ —В–∞–Ї–ґ–µ –љ–∞ —Д–Њ–љ–µ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –≤–Ї–ї—О—З–∞—О—Й–µ–є –≤ —Б–µ–±—П –Є–љ–≥–Є–±–Є—В–Њ—А—Л —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞.
–Т –і–Є–љ–∞–Љ–Є–Ї–µ –Є–Ј—Г—З–∞–ї–Њ—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ – —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л–µ –Њ—Й—Г—Й–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е –Є –Њ–±—К–µ–Ї—В–Є–≤–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ —В–µ—З–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –≤—П–ї–Њ—В–µ–Ї—Г—Й–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–є, —А–∞–љ–µ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –њ–Є–Њ–і–µ—А–Љ–Є–є.
–Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–∞ –њ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –і–Є–∞–≥–љ–Њ–Ј–∞–Љ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Њ—Б—М –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–∞ [11]:
A. –Я–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ
1. –≠–љ–і–Њ–≥–µ–љ–љ—Л–є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ:
3 –С–Њ–ї–µ–Ј–љ—М –Ш—Ж–µ–љ–Ї–Њ– –Ъ—Г—И–Є–љ–≥–∞ (–С–Ш–Ъ)
3 –°–Є–љ–і—А–Њ–Љ –Ш—Ж–µ–љ–Ї–Њ– –Ъ—Г—И–Є–љ–≥–∞ (–°–Ш–Ъ)
3 –Р–Ъ–Ґ–У–—Н–Ї—В–Њ–њ–Є—А–Њ–≤–∞–љ–љ—Л–є —Б–Є–љ–і—А–Њ–Љ (–њ–∞—А–∞–љ–µ–Њ–њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ –Ъ—Г—И–Є–љ–≥–∞)
3 –Я–µ—А–≤–Є—З–љ–∞—П –Љ–Є–Ї—А–Њ—Г–Ј–µ–ї–Ї–Њ–≤–∞—П –і–Є—Б–њ–ї–∞–Ј–Є—П –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤
2. –≠–Ї–Ј–Њ–≥–µ–љ–љ—Л–є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ (–Є–Ј–±—Л—В–Њ—З–љ–Њ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤ – –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–є –°–Ш–Ъ)
–С. –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ
1. –§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ (–±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М)
2. –§—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ:
3 –Я—Г–±–µ—А—В–∞—В–љ–Њ–—О–љ–Њ—И–µ—Б–Ї–Є–є –і–Є—Б–њ–Є—В—Г–Є—В–∞—А–Є–Ј–Љ (–Я–Ѓ–Ф)
3 –У–Є–њ–Њ—В–∞–ї–∞–Љ–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ
3 –Ю–ґ–Є—А–µ–љ–Є–µ
3 –°–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В
3 –Р–ї–Ї–Њ–≥–Њ–ї—М–љ—Л–є –њ—Б–µ–≤–і–Њ—Б–Є–љ–і—А–Њ–Љ –Ъ—Г—И–Є–љ–≥–∞
3 –Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–µ—З–µ–љ–Є.
–Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –≤–Њ –≤—Б–µ—Е —В—А–µ—Е –≥—А—Г–њ–њ–∞—Е —Б–Њ—Б—В–∞–≤–Є–ї–∞ 5,2±1,8 –ї–µ—В (–Њ—В –Њ–і–љ–Њ–≥–Њ –≥–Њ–і–∞ –і–Њ 10 –ї–µ—В).
–•–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –Љ–µ—В–Њ–і–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ–µ–є –≥–Њ—А–Љ–Њ–љ–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –±–Є–Њ—Е–Є–Љ–Є–Є —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –Є –±–Є–Њ—Е–Є–Љ–Є–Є –≥–Њ—А–Љ–Њ–љ–Њ–≤ –≠–Э–¶ –†–Р–Ь–Э (—А—Г–Ї–Њ–≤–Њ–і–Є—В–µ–ї—М –њ—А–Њ—Д. –У–Њ–љ—З–∞—А–Њ–≤ –Э.–Я.).
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –У–Э–¶ –Ш–љ—Б—В–Є—В—Г—В–∞ –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є–Є –Ь–Ч –†–§ (—А—Г–Ї–Њ–≤–Њ–і–Є—В–µ–ї—М – –њ—А–Њ—Д. –Я–Є–љ–µ–≥–Є–љ –С.–Т.). –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –Њ–±—А–∞–±–Њ—В–Ї–∞ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –њ—А–Њ–≥—А–∞–Љ–Љ—Л «Statistica 4.5». –£—А–Њ–≤–µ–љ—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–Є–є —Ж–Є—Д—А–Њ–≤—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≤—Л—З–Є—Б–ї—П–ї–Є –њ–Њ –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–Љ—Г –Ї—А–Є—В–µ—А–Є—О –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є –Ь–∞–љ–љ–∞––£–Є—В–љ–Є– –£–Є–ї–Ї–Њ–Ї—Б–Њ–љ–∞ (pU). –†–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М —Б —Г—А–Њ–≤–љ–µ–Љ –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є —А<0,05.
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–°—А–µ–і–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е 45 –±–Њ–ї—М–љ—Л—Е –≤ –∞–Ї—В–Є–≤–љ–Њ–є —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞.
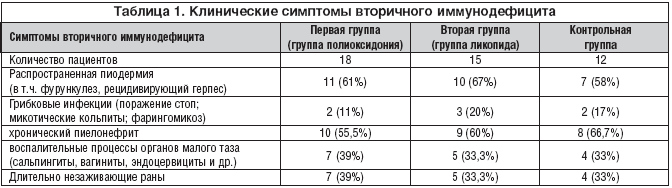
–Т –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е (18 —З–µ–ї–Њ–≤–µ–Ї –≤ –≤–Њ–Ј—А–∞—Б—В–µ 36,4±7,4 –ї–µ—В) –≤—Л—П–≤–ї–µ–љ–Њ —Б–ї–µ–і—Г—О—Й–µ–µ: —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–∞—П –њ–Є–Њ–і–µ—А–Љ–Є—П – —Г 11 (61%), –≥—А–Є–±–Ї–Њ–≤—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є – —Г 2 –±–Њ–ї—М–љ—Л—Е (11%), —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В – —Г 10 (55,5%), –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Њ—А–≥–∞–љ–∞—Е –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞ – —Г 7 (38,8%), –і–ї–Є—В–µ–ї—М–љ–Њ –љ–µ–Ј–∞–ґ–Є–≤–∞—О—Й–Є–µ —А–∞–љ—Л – —Г 7 (39%). –†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ –њ–Њ –≥—А—Г–њ–њ–∞–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –≤ —В–∞–±–ї–Є—Ж–µ 1.
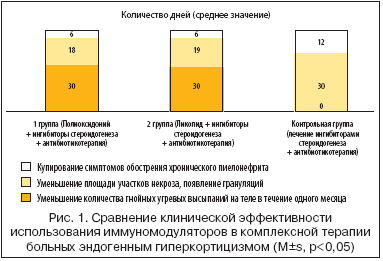
–Я–Њ—Б–ї–µ –≤–Ї–ї—О—З–µ–љ–Є—П –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є—П –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –±–Њ–ї—М–љ—Л—Е –≠–У –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ –∞–љ–∞–ї–Є–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞. –Т—Л—П–≤–ї–µ–љ–Њ –±—Л—Б—В—А–Њ–µ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є (–њ–Њ –ї–µ–є–Ї–Њ—Ж–Є—В–∞—А–љ–Њ–Љ—Г –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О). –Т —В–µ—З–µ–љ–Є–µ –Њ–і–љ–Њ–≥–Њ –Љ–µ—Б—П—Ж–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є—П —Г 11 –±–Њ–ї—М–љ—Л—Е –≠–У, –Є–Љ–µ–≤—И–Є—Е —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Г—О –њ–Є–Њ–і–µ—А–Љ–Є—О, —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М –≥–Є–њ–µ—А–µ–Љ–Є—П, —Б–љ–Є–Ј–Є–ї–Њ—Б—М –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≥–љ–Њ–є–љ—Л—Е —Г–≥—А–µ–≤—Л—Е –≤—Л—Б—Л–њ–∞–љ–Є–є –љ–∞ —В–µ–ї–µ. –Т —В–µ—З–µ–љ–Є–µ 2–3 –љ–µ–і–µ–ї—М (–≤ —Б—А–µ–і–љ–µ–Љ 18 –і–љ–µ–є) –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–ї–Њ—Й–∞–і–Є —Г—З–∞—Б—В–Ї–Њ–≤ –љ–µ–Ї—А–Њ–Ј–∞, –Њ—З–Є—Й–µ–љ–Є–µ –Ї—А—Г–њ–љ—Л—Е —П–Ј–≤ –Є –њ–Њ—П–≤–ї–µ–љ–Є–µ —Н–ї–µ–Љ–µ–љ—В–Њ–≤ –≥—А–∞–љ—Г–ї—П—Ж–Є–є –≤ –Њ–±–ї–∞—Б—В–Є —В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е —П–Ј–≤ –Є –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е —А–∞–љ, —А—Г–±—Ж–µ–≤–∞–љ–Є–µ –Љ–µ–ї–Ї–Є—Е —П–Ј–≤. –£ –±–Њ–ї—М–љ—Л—Е, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А—Л, –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ —А–∞–љ –і–ї–Є–ї–Њ—Б—М –≤ 1,5 —А–∞–Ј–∞ –і–Њ–ї—М—И–µ. –Т —В–µ—З–µ–љ–Є–µ 5–7 –і–љ–µ–є –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Њ–±–Њ—Б—В—А–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В–∞ –Є –і—А—Г–≥–Є—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤. –Т—Б–µ –±–Њ–ї—М–љ—Л–µ, –њ–Њ–ї—Г—З–∞–≤—И–Є–µ –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є, —Б—Г–±—К–µ–Ї—В–Є–≤–љ–Њ –Њ—В–Љ–µ—З–∞–ї–Є —Г–ї—Г—З—И–µ–љ–Є–µ –Њ–±—Й–µ–≥–Њ —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є—П, —Г–ї—Г—З—И–µ–љ–Є–µ –љ–∞—Б—В—А–Њ–µ–љ–Є—П, —З—В–Њ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Б–≤—П–Ј–∞–љ–Њ —Б –і–µ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Њ–љ–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞. –Я–Њ–±–Њ—З–љ—Л—Е –Є–ї–Є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М.
–Я—А–Є –Њ—Ж–µ–љ–Ї–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ –≤–Њ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е –≠–У (15 —З–µ–ї–Њ–≤–µ–Ї; –≤ –≤–Њ–Ј—А–∞—Б—В–µ 31,3±5,7 –ї–µ—В) –≤—Л—П–≤–ї–µ–љ–Њ —Б–ї–µ–і—Г—О—Й–µ–µ: —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–∞—П –њ–Є–Њ–і–µ—А–Љ–Є—П – —Г 10 (67%), –≥—А–Є–±–Ї–Њ–≤—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є – —Г 3 –±–Њ–ї—М–љ—Л—Е (20%), —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В – —Г 9 —З–µ–ї–Њ–≤–µ–Ї (60%), –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ –Њ—А–≥–∞–љ–∞—Е –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞ – —Г 5 (33,3%), –і–ї–Є—В–µ–ї—М–љ–Њ –љ–µ–Ј–∞–ґ–Є–≤–∞—О—Й–Є–µ —А–∞–љ—Л – —Г 5 –±–Њ–ї—М–љ—Л—Е (33%).
–Э–∞ —Д–Њ–љ–µ –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –ї–Є–Ї–Њ–њ–Є–і–∞ –≤–Њ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е –Њ—В–Љ–µ—З–µ–љ–Њ: —Г 5 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–Љ–µ–≤—И–Є—Е —В—А–Њ—Д–Є—З–µ—Б–Ї–Є–µ —П–Ј–≤—Л, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤ –њ–Њ–Ї–Њ–µ, —А–µ–њ–∞—А–∞—Ж–Є—О —В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –≤ —В–µ—З–µ–љ–Є–µ 18–20 –і–љ–µ–є (—Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–ї–Њ—Й–∞–і–Є —Г—З–∞—Б—В–Ї–Њ–≤ –љ–µ–Ї—А–Њ–Ј–∞ –Є –њ–Њ—П–≤–ї–µ–љ–Є–µ –≥—А–∞–љ—Г–ї—П—Ж–Є–є, —А—Г–±—Ж–µ–≤–∞–љ–Є–µ –Љ–µ–ї–Ї–Є—Е —П–Ј–≤). –Я–Њ —Б—А–Њ–Ї–∞–Љ —А—Г–±—Ж–µ–≤–∞–љ–Є—П –Є —Н–њ–Є—В–µ–ї–Є–Ј–∞—Ж–Є–Є —А–∞–љ –Њ—В–ї–Є—З–Є–є –≤ –њ–µ—А–≤–Њ–є –Є –≤–Њ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ, —В.–µ. –≤ 1,5–2 —А–∞–Ј–∞ —Б–Њ–Ї—А–∞—Й–∞–ї–Є—Б—М —Б—А–Њ–Ї–Є –ї–µ—З–µ–љ–Є—П –њ—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О. –Э–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –ї–Є–Ї–Њ–њ–Є–і–∞ –≤ —В–µ—З–µ–љ–Є–µ –Њ–і–љ–Њ–≥–Њ –Љ–µ—Б—П—Ж–∞ —Г –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –≥–љ–Њ–є–љ—Л—Е —Г–≥—А–µ–≤—Л—Е –≤—Л—Б—Л–њ–∞–љ–Є–є –љ–∞ —В–µ–ї–µ –Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≥–Є–њ–µ—А–µ–Љ–Є–Є. –Ъ–∞–Ї –Є –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ, –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Њ–±–Њ—Б—В—А–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В–∞ –Є –і—А—Г–≥–Є—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ –≤ —В–µ—З–µ–љ–Є–µ 6–7 –і–љ–µ–є. –Я–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≤ –≤–Є–і–µ –њ–Њ–≤—Л—И–µ–љ–Є—П —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л —В–µ–ї–∞ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М —Г 3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ —В—А–µ—В–Є–є –і–µ–љ—М –њ—А–Є–µ–Љ–∞ –ї–Є–Ї–Њ–њ–Є–і–∞, —Г –Њ–і–љ–Њ–є –±–Њ–ї—М–љ–Њ–є 20 –ї–µ—В –і–Њ 38°–°, —Г 2 –±–Њ–ї—М–љ—Л—Е 39 –Є 43 –ї–µ—В –і–Њ 37,2°–°, —З—В–Њ –љ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞, —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–ї–∞—Б—М –љ–∞ 10––є –і–µ–љ—М –њ—А–Є–µ–Љ–∞ –ї–Є–Ї–Њ–њ–Є–і–∞. –Р–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М. –°—Г–±—К–µ–Ї—В–Є–≤–љ–Њ –±–Њ–ї—М–љ—Л–µ –Њ—В–Љ–µ—З–∞–ї–Є —Г–ї—Г—З—И–µ–љ–Є–µ —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є—П.
–°—А–∞–≤–љ–µ–љ–Є–µ –њ–Њ —Б—А–Њ–Ї–∞–Љ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ –њ—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –±–Њ–ї—М–љ—Л—Е –≠–У –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1.
–Т –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (12 —З–µ–ї–Њ–≤–µ–Ї, –≤ –≤–Њ–Ј—А–∞—Б—В–µ – 35,5±8,2 –ї–µ—В) –≤—Л—П–≤–ї–µ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞: —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–∞—П –њ–Є–Њ–і–µ—А–Љ–Є—П – —Г 7 (58%) —З–µ–ї–Њ–≤–µ–Ї, –≥—А–Є–±–Ї–Њ–≤—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є —Г 2 (17%), —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В – —Г 8 —З–µ–ї–Њ–≤–µ–Ї (66,7%), –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –Њ—А–≥–∞–љ–Њ–≤ –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞ – —Г 4 (33%) —З–µ–ї–Њ–≤–µ–Ї, –і–ї–Є—В–µ–ї—М–љ–Њ –љ–µ –Ј–∞–ґ–Є–≤–∞—О—Й–Є–µ —А–∞–љ—Л – —Г 4 (33%).
–Т –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Г–≥—А–µ–≤—Л—Е –≤—Л—Б—Л–њ–∞–љ–Є–є –љ–∞ —В–µ–ї–µ –Є —Ж–≤–µ—В –Ї–Њ–ґ–Є –ї–Є—Ж–∞ –≤ —В–µ—З–µ–љ–Є–µ –Њ–і–љ–Њ–≥–Њ –Љ–µ—Б—П—Ж–∞ –ї–µ—З–µ–љ–Є—П –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞ –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є–є. –Ф–ї—П —Г–Љ–µ–љ—М—И–µ–љ–Є—П –њ–ї–Њ—Й–∞–і–Є —Г—З–∞—Б—В–Ї–Њ–≤ –љ–µ–Ї—А–Њ–Ј–∞ –Є –њ–Њ—П–≤–ї–µ–љ–Є—П —Н–ї–µ–Љ–µ–љ—В–Њ–≤ –≥—А–∞–љ—Г–ї—П—Ж–Є–є –≤ –Њ–±–ї–∞—Б—В–Є —В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е —П–Ј–≤ –Є –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е —А–∞–љ —В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –Њ—В 20 –і–Њ 35 –і–љ–µ–є (–≤ —Б—А–µ–і–љ–µ–Љ 30 –і–љ–µ–є). –Э–∞ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Њ–±–Њ—Б—В—А–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –≤—П–ї–Њ—В–µ–Ї—Г—Й–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–є –≤ —Б—А–µ–і–љ–µ–Љ —В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –Њ—В 10 –і–Њ 14 –і–љ–µ–є. –Ю–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ—П–ї–Њ—Б—М –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –і–µ–њ—А–µ—Б—Б–Є–≤–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ, —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є–µ–є, —А–∞–Ј–≤–Є–≤—И–Є—Е—Б—П –њ–Њ–і –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –љ–∞ —Б—В—А—Г–Ї—В—Г—А—Л –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ [10]. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е, –њ—А–Њ–ї–µ—З–µ–љ–љ—Л—Е –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–∞–Љ–Є, –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В–∞ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –і–ї–Є–ї–Њ—Б—М –≤ 1,5 —А–∞–Ј–∞ –і–Њ–ї—М—И–µ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤–Њ –≤—Б–µ—Е —В—А–µ—Е –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –і–ї–Є—В–µ–ї—М–љ—Л–µ, —Г–њ–Њ—А–љ–Њ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–Є —А–∞–Ј–ї–Є—З–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є, –њ–ї–Њ—Е–Њ –њ–Њ–і–і–∞—О—Й–Є–µ—Б—П —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± –Є—Б—В–Њ—Й–µ–љ–Є–Є –Ј–∞—Й–Є—В–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –°—А–µ–і–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ –њ—А–µ–Њ–±–ї–∞–і–∞–ї–∞ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П –≤ –≤–Є–і–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–є –њ–Є–Њ–і–µ—А–Љ–Є–Є —Г 62% (29/45) –±–Њ–ї—М–љ—Л—Е –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В–∞ —Г 60% (27/45). –Ф—А—Г–≥–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ –±—Л–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є –≤ –Њ—А–≥–∞–љ–∞—Е –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞ –Є –і–ї–Є—В–µ–ї—М–љ–Њ –љ–µ–Ј–∞–ґ–Є–≤–∞—О—Й–Є–Љ–Є —А–∞–љ–∞–Љ–Є –њ–Њ 35% –±–Њ–ї—М–љ—Л—Е (16/45) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –≥—А–Є–±–Ї–Њ–≤–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–µ–є – —Г 15,5% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (7/45).
–Т–Ї–ї—О—З–µ–љ–Є–µ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ (–њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –Є –ї–Є–Ї–Њ–њ–Є–і) –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–Њ–Ї—А–∞—В–Є—В—М —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–µ—А–≤–Њ–є –Є –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ –Ї—Г—А—Б—Л –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —Г–Љ–µ–љ—М—И–Є—В—М —Б—А–Њ–Ї–Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В–∞ –≤ 2 —А–∞–Ј–∞, —А–µ–≥—А–µ—Б—Б–Є—О –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –Њ—А–≥–∞–љ–∞—Е –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞ –Є —А–µ–њ–∞—А–∞—Ж–Є—О —В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е —П–Ј–≤ –≤ 1,5 —А–∞–Ј–∞, —Г–ї—Г—З—И–Є—В—М –Њ–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –±–Њ–ї—М–љ—Л—Е, —Б–Њ–Ї—А–∞—В–Є–≤ —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤—А–µ–Љ—П –њ—А–µ–і–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –≤ 1,5–2 —А–∞–Ј–∞. –Я–Њ —Б—А–Њ–Ї–∞–Љ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, —Н–њ–Є—В–µ–ї–Є–Ј–∞—Ж–Є–Є —В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е —А–∞–љ –Њ—В–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –њ–µ—А–≤–Њ–є (–њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є) –Є –≤—В–Њ—А–Њ–є (–ї–Є–Ї–Њ–њ–Є–і) –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.
–Ф–∞–ї–µ–µ —А–∞—Б—Б–Љ–Њ—В—А–Є–Љ, –Ї–∞–Ї –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ (–њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є—П –Є –ї–Є–Ї–Њ–њ–Є–і–∞) –Є–Ј–Љ–µ–љ—П–ї–Є—Б—М –њ–∞—А–∞–Љ–µ—В—А—Л –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е –±–Њ–ї—М–љ—Л—Е. –Я–µ—А–≤–Є—З–љ—Л–є –Є–Љ–Љ—Г–љ–љ—Л–є —Б—В–∞—В—Г—Б –≤–Њ –≤—Б–µ—Е —В—А–µ—Е –≥—А—Г–њ–њ–∞—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї—Б—П –і–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П: –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞, –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є – –њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ. –Я–Њ–≤—В–Њ—А–љ—Л–є –Є–Љ–Љ—Г–љ–љ—Л–є —Б—В–∞—В—Г—Б –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї—Б—П —З–µ—А–µ–Ј 25–30 –і–љ–µ–є, –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є—П –Є –ї–Є–Ї–Њ–њ–Є–і–∞ –Є –љ–∞ —Д–Њ–љ–µ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞.
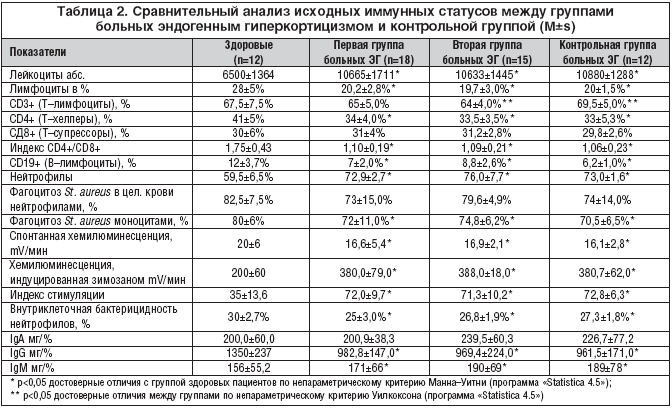
–Я—А–Є –Њ—Ж–µ–љ–Ї–µ –ї–µ–є–Ї–Њ—Ж–Є—В–∞—А–љ–Њ–є —Д–Њ—А–Љ—Г–ї—Л –Ї—А–Њ–≤–Є (—В–∞–±–ї. 2) –≤–Њ –≤—Б–µ—Е —В—А–µ—Е –≥—А—Г–њ–њ–∞—Е –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е –±–Њ–ї—М–љ—Л—Е –≠–У –Њ–±–љ–∞—А—Г–ґ–µ–љ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Б–і–≤–Є–≥ –≤–ї–µ–≤–Њ –Ј–∞ —Б—З–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—П –њ–∞–ї–Њ—З–Ї–Њ—П–і–µ—А–љ—Л—Е –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Є —Б–љ–Є–ґ–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –љ–∞ —Д–Њ–љ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –Ј–і–Њ—А–Њ–≤—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —В–∞–Ї–ґ–µ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–Љ —Б–Њ—Б—В–∞–≤–µ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –≤ –≤–Є–і–µ:
• —Б–љ–Є–ґ–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є CD4+––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (<31% – —Г 40% –±–Њ–ї—М–љ—Л—Е (18/45));
• –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ–Њ–≤—Л—И–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ CD8+––Ї–ї–µ—В–Њ–Ї;
• –Є–љ–≤–µ—А—Б–Є–Є –Є–Љ–Љ—Г–љ–Њ—А–µ–≥—Г–ї—П—В–Њ—А–љ–Њ–≥–Њ –Є–љ–і–µ–Ї—Б–∞ (–Љ–µ–љ—М—И–µ 1 – —Г 33% –±–Њ–ї—М–љ—Л—Е (15/45)).
–Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–∞–≥–Њ—Ж–Є—В–Њ–≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ:
• —Б–љ–Є–ґ–µ–љ–Є–µ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ—Б—В–Є –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ (<25% – —Г 35,5% (16/45));
• —Б–љ–Є–ґ–µ–љ–Є–µ —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ (<70% – —Г 22% (10/45));
• —Г—Е—Г–і—И–µ–љ–Є–µ —Д–∞–≥–Њ—Ж–Є—В–Њ–Ј–∞ St. aureus –Љ–Њ–љ–Њ—Ж–Є—В–∞–Љ–Є (<70% – 49% –±–Њ–ї—М–љ—Л—Е (22/45));
• –њ–Њ–≤—Л—И–µ–љ–љ–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –∞–Ї—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ —Д–∞–≥–Њ—Ж–Є—В–∞–Љ–Є –њ—А–Є –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–Є–Є –Є—Е –Ј–Є–Љ–Њ–Ј–∞–љ–Њ–Љ (>300 mV/min – —Г 71% –±–Њ–ї—М–љ—Л—Е (32/45));
• —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є –ї—О–Љ–Є–љ–Њ–ї–Ј–∞–≤–Є—Б–Є–Љ–Њ–є —Е–µ–Љ–Є–ї—О–Љ–Є–љ–µ—Б—Ж–µ–љ—Ж–Є–Є (<10 mV/–Љ–Є–љ – —Г 42% (19/45));
• –њ–Њ–≤—Л—И–µ–љ–Є–µ –Є–љ–і–µ–Ї—Б–∞ —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є (>60 —Г 73% –±–Њ–ї—М–љ—Л—Е –≠–У (33/45)).
–Э–∞—А—Г—И–µ–љ–Є—П –≤ –≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–Љ –Є–Љ–Љ—Г–љ–Є—В–µ—В–µ –≤—Л—А–∞–ґ–∞–ї–Є—Б—М –≤ –≤–Є–і–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ —Г 40% –±–Њ–ї—М–љ—Л—Е (18/45) –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–Њ–≤ G —Г 51% (23/45), –≤ –њ–Њ–≤—Л—И–µ–љ–Є–Є —Г—А–Њ–≤–љ—П IgM —Г 26,6% –±–Њ–ї—М–љ—Л—Е (12/45).
–Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –Є—Б—Е–Њ–і–љ—Л—Е –Є–Љ–Љ—Г–љ–љ—Л—Е —Б—В–∞—В—Г—Б–Њ–≤ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –≤ –∞–Ї—В–Є–≤–љ–Њ–є —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.
–Я—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –≤—Л—П–≤–ї–µ–љ—Л –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е –і–Њ –Є –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤ –Ї–∞–ґ–і–Њ–є –Є–Ј –≥—А—Г–њ–њ –±–Њ–ї—М–љ—Л—Е.
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –≤ –њ–µ—А–≤–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е –≠–У, –њ—А–Њ–ї–µ—З–µ–љ–љ—Л—Е –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–µ–Љ (–њ–Њ 6 –Љ–≥, N 10), –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–µ—А–≤–Є—З–љ—Л–Љ –Є–Љ–Љ—Г–љ–љ—Л–Љ —Б—В–∞—В—Г—Б–Њ–Љ (–і–Њ –ї–µ—З–µ–љ–Є—П), –≤—Л—П–≤–ї–µ–љ–Њ: —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–∞ (—Б 10665±1711 –і–Њ 9726,7±1752, —А>0,06) –Ј–∞ —Б—З–µ—В —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –≤ –Ї—А–Њ–≤–Є (—Б 72,9±2,7% –і–Њ 63,0±5,6%, —А<0,002); –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П —Г—А–Њ–≤–љ—П –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (—Б 20,2±2,8% –і–Њ 28,0±4,4%, —А<0,001). –Т —Б–Њ—Б—В–∞–≤–µ —Б—Г–±–њ–Њ–њ—Г–ї—П—Ж–Є–є –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П CD3+ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (—Б 65,0±5,0% –і–Њ 71±6,0%, —А<0,02). –Я–Њ–≤—Л—И–∞–µ—В—Б—П –Є–Љ–Љ—Г–љ–Њ—А–µ–≥—Г–ї—П—В–Њ—А–љ—Л–є –Є–љ–і–µ–Ї—Б CD4+/CD8+ (—Б 1,1±0,19 –і–Њ 1,48±0,31, —А<0,003) –Ј–∞ —Б—З–µ—В —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є CD4+––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (—Б 34±4,0% –і–Њ 43±5,0%, —А<0,03) –±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ CD8+––Ї–ї–µ—В–Њ–Ї, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ–± –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞. –Ґ–∞–Ї–ґ–µ –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (CD19+) (—Б 7±2,0% –і–Њ 9±2,0%, —А<0,03). –Я–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є—П –љ–Њ—А–Љ–∞–ї–Є–Ј—Г–µ—В—Б—П —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ (—Б 73±15,0% –і–Њ 82±9,0%, —А<0,05) –Є –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤ (—Б 72±11,0% –і–Њ 75±8,0%, —А<0,07), –њ–Њ–≤—Л—И–∞–µ—В—Б—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–∞—П –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ—Б—В—М –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ (—Б 25,0±3,0% –і–Њ 29,0±3,0%, —А<0,02). –Р–љ–∞–ї–Є–Ј —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є —Б–љ–Є–ґ–∞–µ—В —Г—А–Њ–≤–µ–љ—М —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є —Е–µ–Љ–Є–ї—О–Љ–Є–љ–µ—Б—Ж–µ–љ—Ж–Є–Є (16,6±5,4 –і–Њ 14,6±3,7 —А<0,04), –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б–љ–Є–ґ–∞—П –Є–љ–і–µ–Ї—Б —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є (—Б 72,0±9,7 –і–Њ 63,7±8,4, —А<0,02). –Я–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –ї—О–Љ–Є–љ–Њ–ї––Ј–∞–≤–Є—Б–Є–Љ–Њ–є —Е–µ–Љ–Є–ї—О–Љ–Є–љ–µ—Б—Ж–µ–љ—Ж–Є–Є –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Њ—Б—В–∞–µ—В—Б—П –±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є–є (380±79,0 –Є 382±68,2, —А>0,6). –° –њ–Њ–Љ–Њ—Й—М—О —Е–µ–Љ–Є–ї—О–Љ–Є–љ–µ—Б—Ж–µ–љ—Ж–Є–Є —А–µ–≥–Є—Б—В—А–Є—А—Г—О—В—Б—П –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–µ –∞–Ї—В–Є–≤–љ—Л–µ —Д–Њ—А–Љ—Л –Ї–Є—Б–ї–Њ—А–Њ–і–∞, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –њ–Њ–і–∞–≤–ї—П–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞, —З—В–Њ –Љ–Њ–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Ї–∞–Ї –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–∞ –Є –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є—П, —В–∞–Ї –Ї–∞–Ї –Є—Е –Є–Ј–±—Л—В–Њ—З–љ–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –ї–µ–ґ–Є—В –≤ –Њ—Б–љ–Њ–≤–µ –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–µ–≥–Њ –і–µ–є—Б—В–≤–Є—П –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л—Е –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л–µ —В–Ї–∞–љ–Є –Є –Њ—А–≥–∞–љ—Л. –Э–∞ –≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–µ –Ј–≤–µ–љ–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П, —В–∞–Ї –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П IgM —Г 5 –±–Њ–ї—М–љ—Л—Е (28%) —Б–љ–Є–ґ–∞–µ—В—Б—П –і–Њ –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ –Ј–і–Њ—А–Њ–≤—Л–Љ–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є, –њ—А–Є —Н—В–Њ–Љ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ IgG (–Є—Б—Е–Њ–і–љ—Л–є —Г—А–Њ–≤–µ–љ—М – 982,8±147; –њ—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є – 997,2±180,5 –Љ–≥/%).
–Я—А–Є –Њ—Ж–µ–љ–Ї–µ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞, –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –ї–Є–Ї–Њ–њ–Є–і–∞ (–њ–Њ 10 –Љ–≥, N 10), –±–Њ–ї—М–љ—Л—Е –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ—Л –≤—Л—П–≤–ї–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–∞ –љ–∞ —Д–Њ–љ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ (—Б 76±7,7% –і–Њ 65±4%, —А<0,01), –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П —Г—А–Њ–≤–љ—П –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (—Б 19,7±3% –і–Њ 29±5,7%, —А<0,03), —З—В–Њ –≥–Њ–≤–Њ—А–Є—В –Њ–± –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л.
–Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –і–∞–љ–љ–Њ–є –≥—А—Г–њ–њ—Л –±–Њ–ї—М–љ—Л—Е –≠–У –њ–Њ–ї—Г—З–µ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л (—В–∞–±–ї. 2):
• —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П CD3+––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (—Б 64±4,0% –і–Њ 71±4%; —А=0,02);
• –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –њ–Њ–≤—Л—И–∞—О—В—Б—П —Г—А–Њ–≤–љ–Є –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ CD4+ (—Б 33,5±3,5% –і–Њ 42,3±3,8%; —А=0,03) –Є CD8+––Ї–ї–µ—В–Њ–Ї (—Б 31,2±2,8 –і–Њ 35,0±3,3%; —А=0,032);
• –Є–Љ–Љ—Г–љ–Њ—А–µ–≥—Г–ї—П—В–Њ—А–љ—Л–є –Є–љ–і–µ–Ї—Б CD4+/CD8+ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ (—Б 1,09±0,21 –і–Њ 1,22±0,18, —А>0,5);
• —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ CD19+––Ї–ї–µ—В–Њ–Ї (—Б 8,8±2,6% –і–Њ 9,8±2,2%; —А=0,048);
• –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М St. aureus –љ–µ–є—В—А–Њ—Д–Є–ї–∞–Љ–Є (—Б 79,6±4,9 –і–Њ 82±4,4%; —А=0,04);
• —Г—Б–Є–ї–Є–≤–∞–µ—В—Б—П —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤ (—Б 74,8±6,2 –і–Њ 89,6±2,5%; —А=0,01);
• –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–∞—П –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ—Б—В—М –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –і–Њ –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є (29,7±4,2%, —А=0,04).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –ї–Є–Ї–Њ–њ–Є–і —Г –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В —Г—А–Њ–≤–љ–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Є –Ґ–—Е–µ–ї–њ–µ—А–Њ–≤, –Є –Ґ–—Б—Г–њ—А–µ—Б—Б–Њ—А–Њ–≤ –Є –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—В –љ–∞ –≤—Б–µ –Ј–≤–µ–љ—М—П —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞.
–Т–ї–Є—П–љ–Є–µ –ї–Є–Ї–Њ–њ–Є–і–∞ –љ–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л—Е –∞–Ї—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –љ–µ–є—В—А–Њ—Д–Є–ї–∞–Љ–Є —Б—Е–Њ–і–љ–Њ –њ–Њ –і–µ–є—Б—В–≤–Є—О —Б –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–µ–Љ. –Т—Л—П–≤–ї–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –∞–Ї—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ —Д–∞–≥–Њ—Ж–Є—В–∞–Љ–Є –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є —А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є (–Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ј–Є–Љ–Њ–Ј–∞–љ–Њ–Љ —Е–µ–Љ–Є–ї—О–Љ–Є–љ–µ—Б—Ж–µ–љ—Ж–Є–Є) (—Б 388±18 –і–Њ 305±36,7; —А<0,02) –Є —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є –Ы–•–Ы (—Б 17±2 –і–Њ 14,4±4; —А<0,04), –љ–∞ —Н—В–Њ–Љ —Д–Њ–љ–µ –Є–љ–≤–µ—А—Б–Є—П –Є–љ–і–µ–Ї—Б–∞ —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є (—Б 71±10 –і–Њ 56±3,4; —А<0,001). –°–Њ —Б—В–Њ—А–Њ–љ—Л –≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –њ–Њ—Б–ї–µ —В–µ—А–∞–њ–Є–Є –ї–Є–Ї–Њ–њ–Є–і–Њ–Љ —Г –±–Њ–ї—М–љ—Л—Е –≠–У –њ–Њ–≤—Л—И–µ–љ–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П IgM (>150–Љ–≥/% – —Г 40% –±–Њ–ї—М–љ—Л—Е (6/15)), IgA (>200–Љ–≥/% —Г 27% –±–Њ–ї—М–љ—Л—Е (4/15)) —Б–љ–Є–ґ–∞–µ—В—Б—П –і–Њ –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є, —Б–љ–Є–ґ–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М IgG –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П (—А>0,8).
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л –±–Њ–ї—М–љ—Л—Е –≠–У –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞ –Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є –≤—Л—П–≤–ї–µ–љ–∞ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–Ј–∞ –љ–∞ —Д–Њ–љ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ (—Б 73±1,6 –і–Њ 64±6,9, —А<0,05), –љ–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –і–∞–ї—М–љ–µ–є—И–µ–µ –њ–∞–і–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (—Б 20±1,5% –і–Њ 16,4±4,2%, —А<0,02). –Ш–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —Б–Њ—Б—В–∞–≤–µ —Б—Г–±–њ–Њ–њ—Г–ї—П—Ж–Є–є –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –њ—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л —Б–ї–µ–і—Г—О—Й–Є–µ:
• –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П CD3+––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (—Б 69,5±5,0% –і–Њ 61,5±5,8%; —А=0,03);
• —Г—А–Њ–≤–µ–љ—М –Ґ–—Е–µ–ї–њ–µ—А–Њ–≤ (CD4+) –љ–µ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П (33±5,3% –Є 33,5±4,8%; —А=0,07),
• –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Њ—Б—В–∞–µ—В—Б—П –±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є–є (6,2±1,0 –Є 6,4±2,9; —А=0,7);
• –і–∞–ї—М–љ–µ–є—И–µ–µ –њ–Њ–љ–Є–ґ–µ–љ–Є–µ —Д–∞–≥–Њ—Ж–Є—В–Њ–Ј–∞ St. aureus –≤ —Ж–µ–ї—М–љ–Њ–є –Ї—А–Њ–≤–Є –љ–µ–є—В—А–Њ—Д–Є–ї–∞–Љ–Є (—Б 74±14,0 –і–Њ 69±3,8; —А=0,03);
• —Г—Е—Г–і—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤ (—Б 70,5±6,5 —Б–љ–Є–ґ–∞–µ—В—Б—П –і–Њ 65,8±6,2; —А=0,028);
• –Њ—В–Љ–µ—З–µ–љ–∞ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –њ–Њ–≤—Л—И–µ–љ–Є—О –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ—Б—В–Є (—Б 27,3±1,8 –і–Њ 29,0±5,3; —А=0,06).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Є–Ј–Љ–µ–љ–µ–љ–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –≤ –Ї–ї–µ—В–Њ—З–љ–Њ–Љ –Є —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–Њ–Љ –Ј–≤–µ–љ—М—П—Е –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Є–љ–≥–Є–±–Є—В–Њ—А—Л —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞) –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В. –Я—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≥—Г–Љ–Њ—А–∞–ї—М–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ –Њ—В–Љ–µ—З–µ–љ–Њ –њ–∞–і–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є IgG (—Б 961,5±171,0 –і–Њ 830,±93,0, —А=0,02) –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –≥—А—Г–њ–њ –±–Њ–ї—М–љ—Л—Е –≠–У, –≤ –Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Ї—Г—А—Б—Л –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤. –Ю–±–љ–∞—А—Г–ґ–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Є —Г—Е—Г–і—И–µ–љ–Є–µ —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–∞–≥–Њ—Ж–Є—В–Њ–≤ —Г –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–Є–≤–µ–ї–Њ –Ї —Е—А–Њ–љ–Є–Ј–∞—Ж–Є–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ (–Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—З–∞–≥–Њ–≤ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є). –≠—В–Њ –≤—Л–Ј–≤–∞–ї–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ —Б–ї–Њ–ґ–љ–Њ—Б—В–Є –≤ –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–µ –±–Њ–ї—М–љ–Њ–≥–Њ –Ї –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б—А–Њ–Ї–Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є —Г–і–ї–Є–љ—П–ї–Є—Б—М –≤ 1,5–2 —А–∞–Ј–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–∞–Љ–Є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А—Л.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Э–∞—И–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –≤–Ї–ї—О—З–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –Є –ї–Є–Ї–Њ–њ–Є–і, –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Г—О —В–µ—А–∞–њ–Є—О –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –≥–љ–Њ–є–љ–Њ––≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–љ–Є–ґ–µ–љ–Є—О –Є—Е —В—П–ґ–µ—Б—В–Є. –С–ї–∞–≥–Њ–і–∞—А—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ—Г –≤–ї–Є—П–љ–Є—О –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ –љ–∞ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Г –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ —Б—А–Њ–Ї–Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Є–µ–ї–Њ–љ–µ—Д—А–Є—В–∞ —Б–Њ–Ї—А–∞—В–Є–ї–Є—Б—М –≤ 2 —А–∞–Ј–∞; –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ —В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –Є –њ–Њ—П–≤–ї–µ–љ–Є–µ —Б–≤–µ–ґ–Є—Е –≥—А–∞–љ—Г–ї—П—Ж–Є–є —Г–ї—Г—З—И–Є–ї–Њ—Б—М –≤ 1,5 —А–∞–Ј–∞, –≤ —В–µ—З–µ–љ–Є–µ 1 –Љ–µ—Б—П—Ж–∞ —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –њ–Є–Њ–і–µ—А–Љ–Є–Є. –°–ї–µ–і—Б—В–≤–Є–µ–Љ —Н—В–Њ–≥–Њ —П–≤–Є–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –Ї—Г—А—Б–Њ–≤–Њ–є –і–Њ–Ј—Л –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–Є—Б–ї–∞ –Ї–Њ–є–Ї–Њ––і–љ–µ–є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –њ—А–µ–і–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ: –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А—Л –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –Є –ї–Є–Ї–Њ–њ–Є–і –љ–µ –Њ–±–ї–∞–і–∞—О—В —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ (—З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –і–∞–љ–љ—Л–Љ –ї–Є—В–µ—А–∞—В—Г—А—Л) [6,7,12].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤–Ї–ї—О—З–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е –≠–У —П–≤–ї—П–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Њ—П–≤–ї–µ–љ–Є–є –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞.
–Ґ–∞–Ї –Ї–∞–Ї –і–µ—Д–µ–Ї—В—Л —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Ї—А–Њ–≤–Є —Г –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –≤—Б—В—А–µ—З–∞—О—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ, —В–Њ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А—Л –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –Є –ї–Є–Ї–Њ–њ–Є–і —П–≤–ї—П—О—В—Б—П –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є –Є–Љ–Љ—Г–љ–Њ–Ї–Њ—А—А–µ–Ї—Ж–Є–Є, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ—Г—О —Б–Є—Б—В–µ–Љ—Г. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –≤—Б–µ –±–Њ–ї—М–љ—Л–µ —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –≤ –њ–µ—А–≤–Њ–є –Є –≤–Њ –≤—В–Њ—А–Њ–є –≥—А—Г–њ–њ–∞—Е –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –Њ—В–≤–µ—З–∞–ї–Є –љ–∞ –≤–≤–µ–і–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤. –Т –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Є–Ј–Љ–µ–љ–µ–љ–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞ –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б—А–Њ–Ї–Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е —Г–і–ї–Є–љ—П—О—В—Б—П –≤ 1,5–2 —А–∞–Ј–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–∞–Љ–Є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А—Л.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –≤–Ї–ї—О—З–µ–љ–Є–µ –ї–Є–Ї–Њ–њ–Є–і–∞ –≤ –і–Њ–Ј–µ 10 –Љ–≥, per os, —З–µ—А–µ–Ј –і–µ–љ—М, вДЦ 10 –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ —Г –±–Њ–ї—М–љ—Л—Е —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —В—А—Г–і–љ–Њ –њ–Њ–і–і–∞—О—Й–Є—Е—Б—П —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –њ—А–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–Є –љ–∞—А—Г—И–µ–љ–Є–є –≤ —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–Њ–Љ –Ј–≤–µ–љ–µ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞. –Я–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є –≤ –і–Њ–Ј–µ –Њ—В 6 –і–Њ 12 –Љ–≥, –≤/–Љ, —З–µ—А–µ–Ј –і–µ–љ—М, вДЦ 10 —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –љ–∞–Ј–љ–∞—З–∞—В—М –±–Њ–ї—М–љ—Л–Љ –њ—А–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–∞ –Є –љ–∞–ї–Є—З–Є–Є –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є –њ—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П —Д–∞–≥–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ –Є –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ј–≤–µ–љ—М–µ–≤ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞.
–І–µ—А–µ–Ј 6 –Љ–µ—Б—П—Ж–µ–≤ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ–Њ–≤—В–Њ—А–Є—В—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞ –Є –њ—А–Њ–≤–µ—Б—В–Є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–∞, –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≤–µ—Б—В–Є –њ–Њ–≤—В–Њ—А–љ—Л–є –Ї—Г—А—Б –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ –њ–Њ –њ—А–Є–≤–µ–і–µ–љ–љ–Њ–є –≤—Л—И–µ —Б—Е–µ–Љ–µ.
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Ы–∞—В—Л—И–µ–≤–∞ –Ґ.–Т., –°–µ—В–і–Є–Ї–Њ–≤–∞ –Э.–•., –Ь–∞–љ—М–Ї–Њ –Ъ.–°. «–Т—В–Њ—А–Є—З–љ—Л–µ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В—Л. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–∞ –У–∞–ї–∞–≤–Є—В» // –¶–Є—В–Њ–Ї–Є–љ—Л –Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ, 2005–≥., вДЦ3
2. –•–∞–Є—В–Њ–≤ –†.–Ь., –Я–Є–љ–µ–≥–Є–љ –С.–Т. // «–Ю—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є–љ—Ж–Є–њ—Л –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є» // –Р–ї–ї–µ—А–≥–Є—П, –∞—Б—В–Љ–∞ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—П, 2000–≥., вДЦ1, —Б—В—А.9–16
3. –Ь–∞—А–Њ–≤–∞ –Х.–Ш., –Р—А–∞–њ–Њ–≤–∞ –°.–Ф., –С–µ–ї—М—З–µ–љ–Ї–Њ –Ы.–Т. // –С–Њ–ї–µ–Ј–љ—М –Ш—Ж–µ–љ–Ї–Њ––Ъ—Г—И–Є–љ–≥–∞ (–Љ–µ—В–Њ–і–Є—З–µ—Б–Ї–Њ–µ –њ–Њ—Б–Њ–±–Є–µ –і–ї—П –≤—А–∞—З–µ–є), –Ь. 2000–≥., —Б—В—А.4–8; 14–15
4. –Ь–∞–љ–Њ–≤–Є—Ж–Ї–∞—П –Р.–Т., –С–µ–ї—М—З–µ–љ–Ї–Њ –Ы.–Т., –®—Г–ї—М–ґ–µ–љ–Ї–Њ –Р.–Х., –Ь–∞—А–Њ–≤–∞ –Х.–Ш. // «–Ю—Ж–µ–љ–Ї–∞ –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є —Г –±–Њ–ї—М–љ—Л—Е —Б —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ–Њ–Љ» // –Ш–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—П, вДЦ5, 2003–≥.
5. –Э–µ–Ї—А–∞—Б–Њ–≤ –Р.–Т., –Я—Г—З–Ї–Њ–≤–∞ –Э.–У., –Ш–≤–∞–љ–Њ–≤–∞ –Р.–°.// «–•–Є–Љ–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л —Б–Њ–Ј–і–∞–љ–Є—П –њ–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є—П» // –Ш–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—П, 2000 –≥, вДЦ 5, —Б—В—А. 19–23
6. –Я–µ—В—А–Њ–≤ –†.–Т., –•–∞–Є—В–Њ–≤ –†.–Ь., –Э–µ–Ї—А–∞—Б–Њ–≤ –Р.–Т., –Р—В—В–∞—Г–ї–ї–∞—Е–∞–љ–Њ–≤ –†.–Ш., –Я—Г—З–Ї–Њ–≤–∞ –Э.–У., –Ш–≤–∞–љ–Њ–≤–∞ –Р.–°., –Я–Є–љ–µ–≥–Є–љ –С.–Т. –Є –і—А. // «–Я–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є–є – –њ—А–µ–њ–∞—А–∞—В –љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ —Б –Є–Ј–≤–µ—Б—В–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–Њ–є –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П» // –Ш–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—П,
вДЦ 5, 2000 –≥, —Б—В—А.24–28
7. –Р–љ–і—А–Њ–љ–Њ–≤–∞ –Ґ.–Ь., –Я–Є–љ–µ–≥–Є–љ –С.–Т. «–Ш–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А –ї–Є–Ї–Њ–њ–Є–і: —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –ї–µ—З–µ–љ–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –њ—А–Є—А–Њ–і—Л» // –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–∞—П –Ї–∞—А—В–Њ—В–µ–Ї–∞, 1999–≥. вДЦ1, —Б—В—А.23–25
8. –Ш–≤–∞–љ–Њ–≤ –Т.–Ґ., –•–∞–Є—В–Њ–≤ –†.–Ь., –Р–љ–і—А–Њ–љ–Њ–≤–∞ –Ґ., –Я–Є–љ–µ–≥–Є–љ –С.–Т. // «–Ы–Є–Ї–Њ–њ–Є–і – –љ–Њ–≤—Л–є –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л–є –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А»// –Ш–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—П, вДЦ 2, 1996 –≥, —Б—В—А. 4–6
9. –Ш–ї—М–Є–љ–∞ –Э.–Ш. // «–Т—В–Њ—А–Є—З–љ—Л–µ –Є–Љ–Љ—Г–љ–Њ–і–µ—Д–Є—Ж–Є—В–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П (–Т–Ш–Ф–°). –Я—А–Њ—В–Њ–Ї–Њ–ї—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П» // –Р–ї–ї–µ—А–≥–Є—П, –∞—Б—В–Љ–∞ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—П, 2000–≥., вДЦ1, —Б—В—А.31–33
10. –Я–Є–љ–µ–≥–Є–љ –С.–Т.//«–Я—А–Є–љ—Ж–Є–њ—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–Њ–≤ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤»// –Ы–µ—З–∞—Й–Є–є –Т—А–∞—З, вДЦ 8, 2000 –≥, —Б—В—А. 34–38
11. –Ф–µ–і–Њ–≤ –Ш.–Ш., –Ь–µ–ї—М–љ–Є—З–µ–љ–Ї–Њ –У.–Р. // –Р–ї–≥–Њ—А–Є—В–Љ—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –±–Њ–ї–µ–Ј–љ–µ–є —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –≥–ї–∞–≤–∞ «–С–Њ–ї–µ–Ј–љ–Є –Ї–Њ—А—Л –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤»// –Ь. 1995, —Б—В—А.107–120
12. –Я–Є–љ–µ–≥–Є–љ –С.–Т., –°–∞—А–∞—Д –Р.–°. // «–Ю–њ—Л—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Я–Њ–ї–Є–Њ–Ї—Б–Є–і–Њ–љ–Є—П – –љ–Њ–≤–Њ–≥–Њ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї—П—В–Њ—А–∞ –Є –і–µ—В–Њ–Ї—Б–Є–Ї–∞–љ—В–∞» // –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–∞—П –Ї–∞—А—В–Њ—В–µ–Ї–∞, 2000 –≥. вДЦ11 (41), —Б—В—А.34–35












