Доказано, что СД 2 типа представляет собой гетерогенное заболевание, в основе которого лежит практически 100%–я генетическая предрасположенность, реализующаяся под влиянием факторов окружающей среды.
Сформулирована концепция развития СД 2 типа, основанная на наличии двух фундаментальных патофизиологических дефектов: инсулинорезистентности (ИР) и дисфункции b–клеток поджелудочной железы. Причем оба феномена существуют, взаимообусловливая и отягощая друг друга, и опережают манифестацию заболевания на многие годы.
ИР рассматривается в настоящее время как ведущее патофизиологическое нарушение в развитии СД 2 типа, предшествующее декомпенсации функции b–клеток поджелудочной железы, которая обусловлена длительной компенсаторной гиперинсулинемией, а также феноменом липотоксичности. Гипергликемия замыкает «порочный круг», вызывая снижение чувствительности b–клеток к действию глюкозы и инсулина, что усиливает выраженность секреторного дефекта b–клеток (феномен «глюкозотоксичности») [1,2]. Основополагающая роль ИР в генезе СД 2 типа объясняет тесную связь данной патологии с другими компонентами метаболического синдрома (МС), такими как абдоминально–висцеральное ожирение, дислипидемия, нарушения гемостаза, микроальбуминурия (МАУ), ранний атеросклероз и ишемическая болезнь сердца (ИБС), артериальная гипертензия (АГ). Исходя из этого обоснованным является комплексное многофакторное воздействие на данные нарушения с целью адекватного контроля СД 2 типа.
Важнейшим клиническим признаком МС, занимающим центральное место в патогенезе ИР, является абдоминально–висцеральное ожирение. Открытиями последних лет в физиологии жировой ткани показано, что она выполняет функцию не только энергетического депо, но и является своеобразным секреторным органом, производящим более 90 цитокинов (адипокинов), включающих лептин, фактор некроза опухоли–a (ФНО–a), интерлейкин–6 (ИЛ–6), резистин, ангиотензиноген, адипонектин и многие другие, обладающие разнообразными центральными, периферическими и местными эффектами [3,4]. Наибольший интерес вследствие потенциального влияния на развитие ИР, СД 2 типа и сердечно–сосудистых заболеваний представляет адипонектин.
Адипонектин, несомненно, играет важную роль в патогенезе ИР, как фактор, способствующий ее коррекции. В проведенных экспериментальных и клинических исследованиях показано, что ИР, ожирение и СД 2 типа сочетаются с более низкими уровнями адипонектина в крови. Причем более тесные корреляционные связи отмечены именно с ИР. В экспериментальных работах показано, что адипонектин регулирует передачу инсулинового сигнала: увеличивает фосфорилирование тирозина инсулинового рецептора и повышает активность субстратов инсулинового рецептора. Адипонектин также активирует ц–АМФ–протеинкиназу, что приводит к стимуляции окисления свободных жирных кислот (СЖК), увеличению поглощения глюкозы в скелетных мышцах и печени, а также уменьшению содержания в них триглицеридов (ТГ) [5–7].
Таким образом, адипонектин может рассматриваться, как естественный инсулиновый сенситайзер, становясь заманчивой мишенью терапевтического воздействия с целью коррекции ИР.
Согласно современным принципам ведения пациентов сахарным диабетом 2 типа терапия должна быть комплексной, патогенетически обоснованной и учитывать гетерогенность метаболических нарушений. С этих позиций наиболее рациональным становится акцент на коррекцию инсулинорезистентности, как основополагающего дефекта, что позволяет также максимально сохранить функцию b–клеток, достичь эффективного долгосрочного гликемического контроля, коррекции дислипидемии и АГ с целью профилактики фатальных сердечно–сосудистых осложнений.
Американской диабетической ассоциацией совместно с Европейской Ассоциацией по изучению СД в сентябре 2006 года был разработан Консенсус по управлению СД 2 типа, в котором с целью усиления терапевтического воздействия на ИР рекомендуется раннее назначение метформина уже на этапе установления диагноза СД 2 типа.
Как известно, основной точкой приложения метформина является чувствительность к инсулину преимущественно на уровне печени. Метформин – единственный сахароснижающий препарат, уменьшающий продукцию глюкозы печенью, которая у пациентов с сахарным диабетом 2 типа повышена в среднем в 2 раза. Преимуществом метформина является понижение глюкозы в крови не только натощак, но и постпрандиально без риска развития гипогликемических состояний, что играет важную роль в профилактике сердечно–сосудистых осложнений сахарного диабета 2 типа. Благодаря данному эффекту, а также дополнительным ангиопротекторным свойствам метформин – единственный препарат, по данным UKPDS, снижающий риск смертности от инфаркта миокарда на 39%, инсульта – на 41%.
При отсутствии на фоне приема метформина контрольных целей терапии необходимо ее усиление с присоединением препаратов 2–го ряда, к которым относятся: базальный инсулин, пероральные сахароснижающие средства из группы сульфонилмочевины и тиазолидиндионы. В связи с гетерогенностью патофизиологических дефектов, определяющих развитие СД 2 типа, комбинированная терапия наиболее оправдана, позволяя добиваться целевых уровней гликемического контроля, а также успешно корригировать дислипидемию и АГ. В комбинированной терапии Консенсусный документ по управлению СД 2 типа от 2006 года впервые рекомендует более широкое использование тиазолидиндионов наравне с такими известными лекарственными средствами, как инсулин и препараты группы сульфонилмочевины [8].
Учитывая особенности течения заболевания, комбинация метформина с тиазолидиндионами, безусловно, является предпочтительной у пациентов с СД 2 типа, так как позволяет корригировать различные звенья патогенеза ИР и b–клеточную дисфункцию, параллельно снижая риск сердечно–сосудистых осложнений СД 2 типа.
Современным, мощным и безопасным препаратом из группы тиазолидиндионов в настоящее время является росиглитазон (Авандия).
Росиглитазон (Авандия) представляет собой синтетический агонист ядерных рецепторов PPARg, которые контролируют экспрессию генов, регулирующих углеводный и липидный обмен в тканях–мишенях (преимущественно мышечной и жировой). Благоприятное воздействие росиглитазона (Авандии) на метаболизм глюкозы происходит, в частности, за счет влияния на механизмы передачи инсулинового сигнала: повышения активности глюкозных транспортеров GLUT–1 и GLUT–4 в тканях. А основные метаболические эффекты в жировой ткани осуществляются за счет угнетения липолиза и снижения уровня СЖК, что благоприятно отражается на чувствительности периферических тканей к инсулину и приводит к уменьшению уровня атерогенных липидов в крови [10,11]. Положительное влияние росиглитазона (Авандии) направлено на ИР, на фоне снижения последней улучшается также функциональное состояние b–клеток поджелудочной железы вследствие уменьшения глюкозо– и липотоксичности и торможения процессов апоптоза b–клеток [9]. В настоящее время изучается потенциал препаратов из группы тиазолидиндионов в отношении атерогенеза, включая их воздействие на дислипидемию, процессы тромбообразования и системного воспаления.
Положительное воздействие на атерогенез может осуществляться за счет снижения пролиферации гладкомышечных клеток сосудов, экспрессии молекул адгезии, миграции моноцитов, а также гиполипидемического действия росиглитазона. Доказано повышение на фоне его приема уровня липопротеидов высокой плотности (ЛПВП), уменьшение уровня ТГ и изменение состава липопротеидов низкой плотности (ЛПНП) в сторону преобладания более крупных, менее атерогенных молекул. [13].
Росиглитазон и метформин воздействуют на ведущее звено патогенеза СД 2 типа – ИР, имея различные механизмы дейстивия и различное сродство к тканям–мишеням. Эта комбинация снижает риск прибавки массы тела, характерный для монотерапии глитазонами, улучшает эффективность и переносимость терапии СД 2 типа.
Комбинированная терапия метформином и росиглитазоном (Авандия) патогенетически оправдана, так как позволяет усилить воздействие на ИР и улучшить функцию b–клеток, обеспечивая надежный метаболический контроль, а также многофакторную коррекцию факторов риска микро– и макрососудистых осложнений СД 2 типа.
Цель данного исследования – изучить эффективность 24–недельной комбинированной терапии метформином и росиглитазоном (Авандия) у пациентов с СД 2 типа. Оценивалось комплексное многофакторное управление метаболическими и гемодинамическими нарушениями при СД 2 типа (по влиянию на углеводный и липидный обмен, ИР, суточный профиль АД, структурно–функциональное состояние миокарда, тип жироотложения и уровень адипонектина).
Материалы и методы
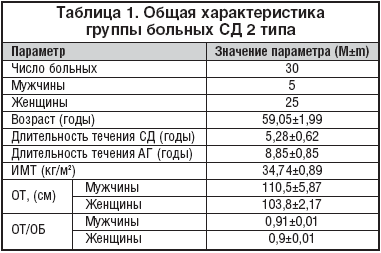
Исследование было открытым с последовательным титрованием дозы, включало 30 пациентов (5 мужчин и 25 женщин) с СД 2 типа в возрасте 59,05±1,99 лет. Длительность СД 2 типа составила в среднем по группе 5,28±0,62 лет (табл. 1).
Все пациенты имели выраженный избыток массы тела (Индекс массы тела, ИМТ) 34,74±0,89 кг/м2), с преимущественным распределением жировой ткани по висцерально–абдоминальному типу: Окружность талии (ОТ) у мужчин 110,5±5,87 см и соотношение окружности талии к окружности бедер (ОТ/ОБ) 0,91±0,01; ОТ у женщин 103,8±2,17 см; ОТ/ ОБ 0,9±0,01.
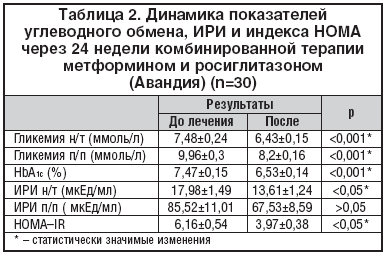
Пациенты характеризовались неудовлетворительной компенсацией углеводного обмена: в среднем по группе отмечалось повышение гликемии натощак (н/т) до 7,48±0,24 ммоль/л, гликемии постпрандиально (п/пр) – до 9,96±0,3 ммоль/л и уровня HbA1c до 7,47±0,15%. Отобранные в исследование пациенты характеризовались выраженной ИР, о чем свидетельствовало повышение индекса HOMA–IR в 83% случаев (в среднем по группе до 6,16±0,54). Гиперинсулинемия натощак исходно регистрировалась у 27% больных (средний уровень ИРИ н/т составлял 17,98±1,49 мкЕд/мл), п/п – у 53,3% больных, что говорит о наличии выраженной ИР у данной группы пациентов. Микроальбуминурия (МАУ) была диагностирована у 33,3%, средний ее уровень по группе составил – 45±10,14 мг/л, что свидетельствует о наличии эндотелиальной дисфункции.
У большинства пациентов имела место дислипидемия, проявлявшаяся повышением уровня общего холестерина (ОХ) до 5,83±0,19 ммоль/л, ЛПНП до 3,53±0,16 ммоль/л, ТГ до 2,43±0,23 ммоль/л и липопротеидов очень низкой плотности (ЛПОНП) до 1,14±0,12 ммоль/л.
В соответствии с протоколом исследования до включения всем пациентам назначалась терапия метформином в дозе 1500 мг, к которому впоследствии добавлялся росиглитазон (Авандия) в начальной дозе 4 мг 1 раз в сутки, независимо от приема пищи. В ходе исследования доза росиглитазона титровалась до 8 мг 1 раз в сутки через 8 недель приема при сохранении неудовлетворительного контроля СД. До включения в исследование все пациенты прошли курс обучения в школе для больных сахарным диабетом, в ходе которого получили необходимые знания по режиму питания и физических нагрузок, навыки по самоконтролю глюкозы крови и АД, сведения о возможных острых и отдаленных осложнениях диабета. Период наблюдения составил 24 недели с ежемесячными контрольными визитами. До и после 24 недель терапии всем включенным в исследование пациентам проводилось комплексное обследование.
Состояние углеводного обмена оценивали по: показателям гликемии натощак и постпрандиально, определяемым в капиллярной крови глюкозооксидазным методом, уровню HbA1c, определяемому на автоматическом анализаторе «Diastat» фирмы Bio–Rad (США). Состояние липидного обмена оценивали по показателям ОХ, ТГ, и ЛПВП, которые определялись с помощью стандартных лабораторных методик, а ЛПНП и ЛПОНП по формуле Фридвальда:
ЛПОНП = ТГ/2,2; ЛПНП = ОХ–ЛПВП–ЛПОНП.
Выраженность гиперинсулинемии оценивалась по уровню иммуннореактивного инсулина (ИРИ) в плазме венозной крови, определенному радиоиммунологическим методом. Для расчета ИР использовалась математическая модель гомеостаза (Homeostasis Model Assessment — НОМА) c определением индекса HOMA–IR (методика Matthews с соавт.), который рассчитывался по формуле: инсулин натощак (мкЕд/мл) х глюкоза натощак (ммоль/л) : 22,5. Нормальным считался показатель индекса HOMA–IR<2,77.
Всем пациентам проводили ЭхоКГ–исследование с оценкой степени гипертрофии миокарда левого желудочка (ЛЖ), которую диагностировали при повышении массы миокарда левого желудочка (ММЛЖ) у мужчин >294 г, у женщин >230 г., а также при индексе массы миокарда ЛЖ (ИММЛЖ)>131 г/м2 у мужчин и > 100 г/м2 у женщин. Для оценки диастолической функции использовались традиционные показатели, основанные на допплеровском спектре трансмитральных потоков: максимальная скорость раннего диастолического потока (Е), максимальная скорость потока предсердной систолы (А); отношение Е/А. Определение типа диастолической дисфункции осуществлялось по методике J. Moller и соавт., используя отношение Е/А. Диастолическое наполнение считали нормальным при значениях Е/А>1; диастолической дисфункции по типу нарушения релаксации соответствовало Е/А<1; рестриктивному типу– Е/А>2.
Проводилось также суточное мониторирование артериального давления (СМАД). Для диагностики МАУ использовали тест–полоски «Микраль–тест» (фирмы Roche) для полуколичественного определения альбумина в моче.
Содержание жировой массы тела и ее распределение оценивалось с помощью анализатора жировых отложений двухфотонной рентгеновской абсорбциометрии (DEXA). Оценка секреторной активности жировой ткани включала определение адипонектина в сыворотке венозной крови методом ИФА.
Статистическая обработка данных проведена с помощью пакета прикладных программ Statistica 6.0. Данные приведены в виде средних арифметических значений и ошибки средней (М±m). Для оценки динамики показателей на фоне лечения использовался парный непараметрический метод анализа по Вилкоксону. Критический уровень значимости (р) при проверке полученных статистических данных был меньше 0,05.
Результаты и обсуждение
Метаболические эффекты
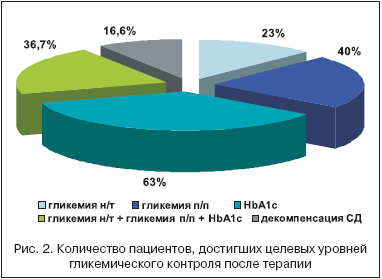
Через 24 недели комбинированной терапии метформином и росиглитазоном (Авандия) достигнуто снижение всех параметров, характеризующих ИР: уровень ИРИ н/т снизился с 17,98±1,49 до 13,61±1,24 мкЕд/мл (p<0,05), ИРИ п/п – с 85,52±11,01 до 67,53±8,59 мкед/мл (р>0,05) и отмечалось достоверное уменьшение индекса HOMA–IR на 35,6% – с 6,16±0,54 до 3,97±0,38 (р<0,05), причем у 40% пациентов данный показатель нормализовался, что подтверждает высокую эффективность данной комбинации препаратов в отношении коррекции чувствительности периферических тканей к инсулину. Следствием снижения ИР было достижение целевых уровней гликемического контроля и улучшение липидного профиля у большинства пациентов. Причем хороший сахароснижающий эффект был достигнут у 60% пациентов при приеме росиглитазона 4 мг/сут., у 40% пациентов на 8–й неделе терапии потребовалось увеличение дозы росиглитазона до 8 мг/сут., которую они получали до конца исследования. В среднем по группе отмечалось клинически значимое и статистически достоверное улучшение показателей углеводного обмена, включая снижение уровня гликемии натощак на 1,06 ммоль/л (p<0,001) и постпрандиально на 1,75 ммоль/л (р<0,001), а также уровня HbA1c на D 0,94% (p<0,001) (табл. 2). Целевые уровни контроля гликемии достигнуты: по уровню HbA1c у 63% пациентов, по уровню гликемии натощак – у 23%, уровню гликемии постпрандиально – у 40% пациентов. Целевые уровни гликемического контроля по всем показателям гликемической «триады» достигнуты у 36,7% больных пациентов, что свидетельствует о высокой сахароснижающей эффективности комбинации метформина и росиглитазона и улучшении компенсации СД у большинства пациентов (рис. 1–2).
Через 24 недели комбинированной терапии метформином и росиглитазоном отмечалась благоприятная динамика ряда показателей липидного обмена: снижение уровня ТГ на 0,63 ммоль/л (p<0,005) и ЛПОНП на 0,31 ммоль/л (p<0,005), а также снижение уровня Апо В–белка на 0,23 ммоль/л (p<0,005). Отмечена тенденция к снижению уровня ОХ, ЛПНП, повышение уровня ЛПВП, не достигшая уровня статистической значимости (табл. 3).
Как известно, сочетание гипертриглицеридемии, низкого уровня ХС–ЛПВП и преобладание в крови малых плотных ЛПНП при близком к нормальному значению ХС ЛПНП характеризует диабетическую дислипидемию, которая приводит к раннему развитию коронарного атеросклероза.
Гипертриглицеридемия возникает в результате повышения продукции ЛПОНП, а также нарушения их катаболизма в печени. Проводимые ранее эпидемиологические и клинические исследования показали, что увеличенный уровень ТГ является независимым фактором риска ИБС наряду с гиперхолестеринемией. Полученные в нашем исследовании результаты показывают эффективность комбинированного воздействия метформина и росиглитазона в коррекции дислипидемии, отсутствие достоверного изменения уровня ЛПВП, ОХ и ХС ЛПНП может быть связано с недостаточной длительностью наблюдения. Так, по данным литературы, в течение первых 3–6 мес. применения росиглитазона (Авандии) может происходить стабилизация уровня ХС ЛПВП и даже некоторое повышение уровня ХС ЛПНП, а в течение последующих 1,5 лет эти показатели нормализуются [16].
С одной стороны, подобные результаты свидетельствуют, что коррекция ИР на фоне терапии метформином с росиглитазоном положительно влияет на основные метаболические дефекты, благоприятно воздействует на течение СД 2 типа за счет устранения глюкозо– и липотоксичности. Наше иследование также подтверждает благоприятное действие данной комбинации на факторы риска атерогенеза и сердечно–сосудистых заболеваний.
Влияние на массу жировой ткани, висцеральное жировое депо и секреторную активность жировой ткани
В проведенном нами исследовании через 24 недели комбинированной терапии метформином и росиглитазоном (Авандия) в среднем по группе отмечена тенденция к снижению массы тела с 93,83±2,82 до 92,7±2,94 кг и ИМТ с 34,75±0,89 до 34,43±0,95 кг/м2, но динамика данных показателей не достигла уровня статистической значимости.
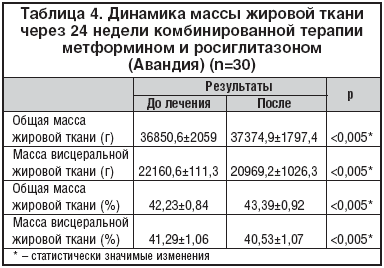
Однако несмотря на незначительное снижение массы тела в целом, по данным рентгеновской абсорбциометрии отмечено достоверное снижение массы и процентного содержания висцеральной жировой ткани с 41,29±1,06 до 40,53±1,07% (табл. 4), что сопровождалось уменьшением таких антропометрических показателей, как ОТ и ОТ/ОБ: произошло уменьшение ОТ у мужчин со 110,5±5,87 до 106,8±6,07 см (D3,7; р<0,05) и ОТ/ОБ с 0,91±0,01 до 0,89±0,01 (р<0,001); ОТ у женщин уменьшился с 103,8±2,17 до 102,7±2,12 см (D1,1; р<0,05) и ОТ/ОБ с 0,9±0,01 до 0,89±0,01 (р<0,001).
Необходимо особо подчеркнуть, что на фоне проводимой терапии у 70% пациентов (21 чел.), отмечено значительное уменьшение массы тела с 91,86±4,21 до 89,24±4,15 кг (D2,62; р<0,05), причем снижение веса происходило именно за счет висцеральной жировой ткани: ОТ в данной группе уменьшилась со 104,05±2,48 до 102,19±2,59 см (D1,86; р<0,05) уменьшилось также ОТ/ОБ с 0,88±0,01 до 0,86±0,01 (р<0,05), что подтверждено данными рентгеновской абсорбциометрии снизились: масса и процент жировой ткани с 37019,4±2161,1 до 35046±2052,8 г. и с 43,87±1,37 до 42±1,18% соответственно (р<0,05), а также масса и процент висцеральной жировой ткани с 21008,7±1281,1 г и с 41,65±1,45% до 39,82±1,34% соответственно (р<0,05). В этой группе больных отмечено выраженное уменьшение степени выраженности ИР: по уровню HOMA-IR на 38% (с 5,17±0,81 до 3,2±0,58), по уровню ИРИ натощак и постпрандиально с 16,35±2,37 до 11,93±2,05 и с 34,38±7,48 до 28,15±6,95 мкед/мл соответственно (р<0,05). У данных пациентов наблюдалось значительное улучшение параметров гликемического контроля и липидного профиля. Уменьшились: гликемия натощак с 6,77±0,22 до 5,94±0,13 ммоль/л, постпрандиальная гликемия с 9,35±0,39 до 7,87±0,18 ммоль/л, а HbA1c с 7,06±0,2 до 6,15±0,12%. Регистрировались: уменьшение уровня ТГ с 2,3±0,26 до 1,82±0,22 ммоль/л и апо В-белка с 1,97±0,14 до 1,67±0,13 г/л (р<0,05).
Таким образом, помимо адекватного метаболического контроля, важнейшим достижением комбинированной терапии метформином и росиглитазоном является благоприятное воздействие на массу тела, за счет анорексигенного действия метформина и перераспределения жировой ткани под действием росиглитазона с уменьшением доли висцеральной жировой ткани в пользу подкожного жирового депо. У большинства исследуемых пациентов отмечено уменьшение выраженности висцерального ожирения, которое является важнейшим маркером ИР. Как уже отмечалось, именно висцеральная жировая ткань (вследствие своих анатомических и функциональных особенностей) является важнейшим патофизиологическим звеном синдрома ИР, следовательно, достоверное уменьшение именно ее объема значительно повышает чувствительность тканей к инсулину.
В нашем исследовании изучалась также динамика тесно связанного с феноменом ИР адипокина–адипонектина. Было показано, что в среднем по группе адипонектин находился в границах нормы – 8,88±1,18 мкЕд/мл (норма у женщин – 13,2±6,1 мкЕд/мл у мужчин – 9,5±3,6 мкЕд/мл), но у 47% пациентов адипонектин был исходно снижен, у 33% – в пределах нормы и лишь у 20% – превышал нормальный уровень.
Уменьшение выраженности висцерального ожирения сочеталось с положительной динамикой адипонектина: отмечена тенденция к повышению адипонектина в среднем по группе с 8,88±1,18 до 11,24±1,18 мкЕд/мл, причем достоверное повышение уровня данного адипонектина на 56% отмечалось у 37% пациентов, имевших исходно низкий или нормальный его уровень адипонектина, что, несомненно, играет роль в коррекции ИР и снижении риска прогрессирования сердечно–сосудистой патологии у данных пациентов.
Влияние на гемодинамические показатели
Многофакторное влияние коррекции ИР отразилось и на состоянии сердечно–сосудистой системы. Исходно у всех пациентов, включенных в исследование, регистрировалось повышение уровней системного АД, как по данным измерения АД в динамике при контрольных осмотрах, так и по данным СМАД: средние уровни «офисного АД» составили: систолическое артериальное давление (САД) 141,13±1,88 мм рт.ст.; диастолическое артериальное давление (ДАД) 90,25±0,95 мм рт.ст. Усредненные показатели АД по данным СМАД представлены в таблице 5. Через 24 недели комбинированной терапии метформином и росиглитазоном, средний уровень «офисного» САД снизился на 11,1% с 141,13±1,88 до 125,5±1,47 мм рт.ст., а средний уровень «офисного» ДАД снизился на 13,2% с 90,25±0,95 до 78,38±1,05 мм рт.ст. (р<0,001). Достижение целевых цифр давления наблюдалось у 19 человек (63,3%). Отмеченная тенденция подтверждена данными СМАД: среднесуточное значение САД снизилось на 5,4%, ДАД–на 3,8% (р<0,05), а пульсовое АД (ПАД) – на 9,2% (р>0,05). Достоверно уменьшились индексы нагрузки временем САД и ДАД (табл. 5).
Несмотря на тот факт, что развитие АГ в данной группе больных опережало манифестацию СД 2 типа, воздействие на ИР и метаболический профиль благоприятно отразилось на гемодинамических параметрах. Улучшение суточного профиля АД у исследуемых пациентов значительно снижает риск развития и прогрессирования макроваскулярных осложнений СД 2 типа и оказывает благоприятное протективное действие на основные органы–мишени (сердце, сосуды, почки).
Подобное действие подтверждено в нашем исследовании при оценке структурно–функционального состояния миокарда левого желудочка. Как известно, поражение сердца при СД 2 типа характеризуется не только ранним развитием коронарного атеросклероза, но и микрососудистой дисфункцией, приводящей к развитию диабетической миокардиопатии. По современным представлениям диабетическая миокардиопатия обусловлена наличием у пациентов с СД 2 типа ИР, хронической гипергликемии. Данный показатель является независимым фактором риска развития и прогрессирования ИБС, что объясняется снижением дилатационной способности коронарных артерий, повышением потребности миокарда в кислороде, субэндокардиальной ишемией, снижением сократимости миокарда ЛЖ и развитием опасных для жизни аритмий.
Исходно гипертрофия левого желудочка диагностирована у 83,3% больных. У 53,3% больных, участвующих в исследовании, были выявлены признаки диастолической дисфункции ЛЖ по I типу (Е/А – 0,89±0,06) признаков диастолической дисфункции ЛЖ по II типу выявлено не было. Признаков систолической формы сердечной недостаточности также выявлено не было: фракция выброса (ФВ) была удовлетворительной, конечный систолический объем (КСО) и ударный объем (УО) оставались в норме. Конечный диастолический объем (КДО) соответствовал норме.
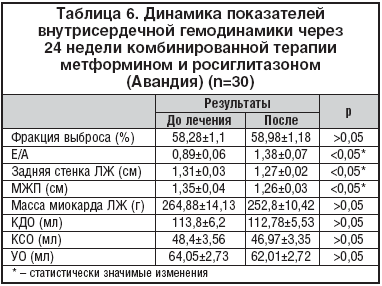
Нами была проведена оценка структурно–функционального состояния миокарда в динамике: по данным Эхо–КГ после лечения у 30% больных произошла нормализация диастолической функции ЛЖ. Также достоверно уменьшились: размер задней стенки ЛЖ – на 0,04 см (p<0,05), межжелудочковой перегородки (МЖП) – на 0,09 см (p<0,05), масса миокарда ЛЖ – на 12,08 г (p>0,05) (табл. 6).
Полученные результаты говорят об улучшении диастолического расслабления миокарда желудочков и устранении начальных признаков сердечной недостаточности. Говорить об истинном уменьшении гипертрофии ЛЖ преждевременно по причине непродолжительного срока наблюдения, но тенденция к снижению данного важнейшего фактора риска сердечно–сосудистой заболеваемости и смертности четко прослеживается в нашем исследовании.
При суммарной оценке факторов сердечно–сосудистого риска большое значение в последние годы придается такому параметру, как МАУ. Связь МАУ с повышенным риском сердечно–сосудистой смертности объясняется единством патогенетических механизмов развития ИР, связанной с ней сердечно–сосудистой патологии и диабетической нефропатии. Такие известные маркеры риска сердечно–сосудистой заболеваемости, как системная гипертензия, хроническая гипергликемия, дислипидемия и дисфункция эндотелия, являются компонентами синдрома ИР, а также основными звеньями цепи развития диабетической нефропатии. В нашем исследовании на фоне коррекции ИР, отмечалось достоверное уменьшение МАУ – с 45±10,14 до 23±6,5 мг/л (D 22; p<0,05), после 24 недель терапии. Кроме того, частота выявляемости данного важнейшего параметра на фоне терапии снизилась в среднем по группе с 33 до 23%.
Таким образом, комбинированной терапией метформином и росиглитазоном достигнута коррекция различных метаболических и гемодинамических проявлений синдрома ИР.
Переносимость и безопасность. В ходе исследования большинство пациентов отмечало хорошую переносимость препарата. На фоне приема препарата Авандия в течение всего времени исследования не было зафиксировано ни одного случая гипогликемии. Других нежелательных эффектов на фоне приема препарата также зафиксировано не было. У 9 пациентов произошло увеличение веса, в среднем на 2,6±0,24 кг.
В целом можно говорить о хорошей переносимости и безопасности комбинированной терапии метформином и росиглитазоном (Авандия) у пациентов с СД 2 типа.
Обсуждение
Главным преимуществом применения комбинации метформина и росиглитазона у пациентов с СД 2 типа является комплексное воздействие на ведущее звено патогенеза СД 2 типа – ИР за счет различных механизмов действия и различного сродства к тканям–мишеням у данных препаратов.
Степень ИР по критерию HOMA–IR в нашем исследовании уменьшилась на 35,6%, причем у 40% пациентов была достигнута нормализация данного показателя. Выраженность гиперинсулинемии натощак и постпрандиально существенно и статистически достоверно снизилась – на 24 и 21% соответственно. Ранее подобное влияние на ИР было доказано в международных исследованиях, причем достигнутое увеличение чувствительности периферических тканей к инсулину сохранялось на протяжении не менее 30 месяцев [14].
Комплексное воздействие посредством коррекции ИР на все компоненты метаболического синдрома позволило в первую очередь улучшить метаболический профиль у большинства пациентов. Комбинированная терапия метформином и росиглитазоном способствовала коррекции показателей гликемического и липидного контроля. Достоверно снижались уровни гликемии натощак, постпрандиально и уровень HbA1c. Целевые уровни контроля гликемии достигнуты: по уровню HbA1c – у 63% пациентов, по уровню гликемии натощак – у 23% и постпрандиально – у 40% пациентов, и что особенно важно – у 36,7% пациентов целевые уровни гликемии наблюдались по всем параметрам гликемической триады. По результатам нашего исследования уровень HbA1c снизился в среднем по группе на 1%. Эти данные перекликаются с ранее проведенными исследованиями, подтвердившими эффективность подобной комбинации в коррекции нарушений углеводного обмена: добавление росиглитазона к монотерапии метформином приводило к снижению уровня HbA1c на 0,8–1,2% [13,14].
Улучшение липидного спектра крови также неоднократно демонстрировалось в проводимых ранее исследованиях по оценке эффективности росиглитазона (Авандии). Наиболее часто достоверная динамика затрагивала такие показатели, как ЛПВП и ЛПНП – с преобладанием в их составе более крупных, менее атерогенных частиц. В проведенном нами исследовании отмечено достоверное снижение на фоне комбинированной терапии атерогенных фракций липидов: ТГ – на 25,5%, ЛПОНП – на 27,2%, а также снижение уровня АПО А– и В–белка на 14,7% и тенденции к нормализации уровня ОХ, ЛПНП, и ЛПВП. Полученные данные требуют подтверждения в более крупных, продолжительных исследованиях по изучению влияния как монотерапии росиглитазоном, так и его различных комбинаций на метаболические нарушения, свойственные СД 2 типа.
Полученные в нашем исследовании данные убедительно показали снижение степени висцерального ожирения, сочетавшиеся с положительной динамикой уровня адипонектина, что имеет крайне важное значение в снижении риска сердечно–сосудистой патологии у пациентов с СД 2 типа. Достигнуто увеличение уровня адипонектина в среднем по группе на 30%, а повышение уровня данного адипокина на 56% отмечалось у 37% пациентов, имевших исходно низкий или нормальный уровень.
Необходимо подчеркнуть, что особенно ярко прослеживалась связь динамики ИР, массы висцеральной жировой ткани и уровня адипонектина. В группе пациентов, у которых масса тела снизилась в среднем всего на 2,62 кг, отмечалось достоверное уменьшение массы общей и висцеральной жировой ткани, а также снижение степени ИР (по данным HOMA–IR) на 38% и повышение уровня адипонектина на 12,7%. Эти данные подтверждаются другими крупными международными исследованиями, в которых у пациентов с СД 2 типа наиболее выраженная корреляция уровня адипонектина наблюдалась с ИР и степенью выраженности висцерального ожирения [5,7].
Положительное влияние комбинированной терапии метформином и росиглитазоном на гемодинамические параметры явилось результатом как прямого (путем коррекции ИР), так и опосредованного (через улучшение метаболического профиля) действия данных препаратов. Подтверждением этого является положительная динамика параметров СМАД и ЭхоКГ, а именно: достоверное уменьшение среднесуточных уровней САД и ДАД, а также снижение индекса нагрузки временем САД и ДАД. По данным ЭхоКГ достигнута нормализация диастолической функции ЛЖ после лечения у 30% больных, что в сочетании с достоверным уменьшением размеров задней стенки ЛЖ, межжелудочковой перегородки и тенденцией к уменьшению массы миокарда ЛЖ свидетельствует об улучшении функционального состояния миокарда ЛЖ.
Наше исследование еще раз подтверждает глубокую взаимосвязь между основными компонентами МС, такими, как СД 2 типа, АГ, дислипидемия, висцеральное ожирение посредством феномена ИР. Эффективная коррекция ИР комбинированной терапией метформином и росиглитазоном (Авандия) открывает новые перспективы комплексной коррекции многоплановых нарушений, сопровождающих развитие СД 2 типа, в том числе его сердечно–сосудистых осложнений.



Литература
1. Аметов А.С. Инсулиносекреция и инсулинорезистентность: две стороны одной медали. Проблемы эндокринологии; 2002,Т.48, № 3, стр. 31–36.
2. Аметов А.С. Нарушения жизненного цикла и функции ?–клеток поджелудочной железы: центральное звено патогенеза сахарного диабета 2 типа. Учебное пособие. М, 2002 г.
3. Дедов И.И., Мельниченко Г.А. Ожирение: этиология, патогенез, клинические аспекты. Руководство для врачей. М, 2004 г.
4. Despres J. Abdominal obesity is important component of insulin–resistence sindrom Nutricion 1993;9:452–459.
5. Abbasi F., Chu J.W., Lamendola C., McLaughlin T., Hayden J., Reaven G.M., Reaven P.D. Discrimination between obesity and insulin resistance in the relationship with adiponectin Diabetes 53(4):939–947, 2004. American Diabetes Association, Inc.
6. Scherer PE. Adiponectin/ACRP30/AdipoQ. Symposium: Adipose tissue as a secretory organ. Program and abstracts of the 62nd Scientific Sessions of the American Diabetes Association. June 14–18, 2002, San Francisco, California. Diabetes, Volume 51, Supplement 2.
7. Trujillo ME, Scherer PE Adiponectin: journey from an adipocyte secretory protein to biomarker of the metabolic syndrome. 2005 J Intern Med 257:167–175.
8. Nathan D.M., Buse J.B., Davidson M.B., Heine R.J., Holman R.R., Sherwin R. and Zinman B. Management of Hyperglycemia in Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy; Diabetes Care 2006; 49: 1711–21.
9. Ovalle F, Bell DS. Clinical evidence of thiazolidindionediones –induced improvement of pancreatic b cell function in patients with type 2 diabetes mellitus. Diabetes Obes Metab 2002;4: 56–59.
10. Arny l. Werner,M.T. Travaglini. A Review of rosiglitazone in type 2 diabetes Mellitus. Pharmacotherapy. Pharmacotherapy Publications 2001,21(9):1082–1099.
11. Diamant M, Heine RJ Thiazolidindionediones in type2 diabetes mellitus:current clinical evidence Drugs 2003;63:1373–1405.
12. Miyazaki Y,He H Rosiglitazone improves downstream insulin receptor signalling in type 2 diabetic patients Diabetes 2003 v. 52(8):1943–1950.
13. Fonseca VA Biswas N Salzman A Once–daily rosiglitazone in combination with metformin effectively reduced hyperglycemia in patients with type 2 diabetes. Diabetes 1999 ;48: A100.
14. Jones N. P., Mather R., Owen S. et al. Long–term efficacy of rosiglitazone as monotherapy or in combination with metformin. Diabetologia 2000; 43 (suppl. 1): 64–71.
15. O’ Moore–Sullivan TM Prins JB Thiazolidindiones and type 2 diabetes: new drugs for an old diseases.Med. J Aust 2002;176:381–386.
16. Gerich J. E. Is muscle the major site of insulin resistance in type 2 (non–insulin–dependent) diabetes mellitus. Diabetologia 1991; 34:607–61.












