–Т–≤–µ–і–µ–љ–Є–µ
–≠–љ–і–Њ–≥–µ–љ–љ—Л–є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ (–≠–У, —Б–Є–љ–і—А–Њ–Љ –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞) вАФ —Н—В–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–Ј–±—Л—В–Ї–∞ –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ [1]. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є –≠–У —П–≤–ї—П—О—В—Б—П —Б–µ–Ї—А–µ—В–Є—А—Г—О—Й–∞—П –∞–і—А–µ–љ–Њ–Ї–Њ—А—В–Є–Ї–Њ—В—А–Њ–њ–љ—Л–є –≥–Њ—А–Љ–Њ–љ (–Р–Ъ–Ґ–У) –∞–і–µ–љ–Њ–Љ–∞ –≥–Є–њ–Њ—Д–Є–Ј–∞, –Ї–Њ—А—В–Є–Ј–Њ–ї-–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–∞—П –∞–і–µ–љ–Њ–Љ–∞ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞ –Є –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ–∞—П –Њ–њ—Г—Е–Њ–ї—М —Б —Н–Ї—В–Њ–њ–Є—З–µ—Б–Ї–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–µ–є –Р–Ъ–Ґ–У [1]. –°–Љ–µ—А—В–љ–Њ—Б—В—М –њ—А–Є –≠–У –≤ 4вАУ5 —А–∞–Ј –≤—Л—И–µ, —З–µ–Љ –≤ –Њ–±—Й–µ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є [2, 3]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П —Г—А–Њ–≤–љ—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –њ—А–Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є –≠–У –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г–ї—Г—З—И–Є—В—М –њ—А–Њ–≥–љ–Њ–Ј –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [1, 4]. –Ю–і–љ–Є–Љ –Є–Ј —Г—Б–ї–Њ–≤–Є–є —Г—Б–њ–µ—И–љ–Њ–≥–Њ —А–µ—И–µ–љ–Є—П —Н—В–Њ–є –Ј–∞–і–∞—З–Є —П–≤–ї—П–µ—В—Б—П —А–∞–љ–љ—П—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –≠–У, —З—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±–µ—Б–њ–µ—З–µ–љ–Њ –љ–∞–ї–Є—З–Є–µ–Љ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л—Е –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е —В–µ—Б—В–Њ–≤ [5]. –°–Њ–≥–ї–∞—Б–љ–Њ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –і–ї—П —Б–Ї—А–Є–љ–Є–љ–≥–∞ –њ—А–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є–Є –љ–∞ –≠–У —Б–ї–µ–і—Г–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Њ–і–љ–Њ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є: –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Б—Г—В–Њ—З–љ–Њ–є —Н–Ї—Б–Ї—А–µ—Ж–Є–Є —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ —Б –Љ–Њ—З–Њ–є (–°–≠–°–Ъ–Ь), –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ —Б–ї—О–љ–µ (–Ъ–°), —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є (–Ъ–°–Ъ), –≤–Ј—П—В–Њ–є —Г—В—А–Њ–Љ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ 1 –Љ–≥ –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ–∞ –љ–∞–Ї–∞–љ—Г–љ–µ –≤ 23:00 (–Љ–∞–ї–∞—П –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ–Њ–≤–∞—П –њ—А–Њ–±–∞, –Ь–Ф–Я), —В–µ—Б—В —Б 2 –Љ–≥ –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ–∞. –Ф–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –љ–∞–ї–Є—З–Є—П –≠–У –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ–Њ–ї—Г—З–Є—В—М –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–≤—Г—Е –Є–Ј –≤—Л—И–µ–њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е —В–µ—Б—В–Њ–≤ [1]. –Т —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О –±–Њ–ї–µ–Ј–љ–Є –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞ –њ—А–Є–Њ—А–Є—В–µ—В –Њ—В–і–∞–µ—В—Б—П –і–≤—Г–Љ —В–µ—Б—В–∞–Љ: –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—О —Г—А–Њ–≤–љ—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ 23:00, –Є –Ь–Ф–Я [6]. –Т—Л–±–Њ—А –њ–µ—А–≤—Л—Е –і–≤—Г—Е —В–µ—Б—В–Њ–≤ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є 1-–є –ї–Є–љ–Є–Є —П–≤–ї—П–µ—В—Б—П –Њ–њ—А–∞–≤–і–∞–љ–љ—Л–Љ, —В. –Ї. —Б–Ї—А–Є–љ–Є–љ–≥ –њ—А–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є–Є –љ–∞ –≠–У –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –≤—Л–њ–Њ–ї–љ—П–µ—В—Б—П –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Г—А–Њ–≤–љ—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ, –њ—А–µ–і—К—П–≤–ї—П–µ–Љ—Л–Љ –Ї —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤—Л–Љ —В–µ—Б—В–∞–Љ, –Є —П–≤–ї—П–µ—В—Б—П –Љ–µ—В–Њ–і–Њ–Љ –≤—Л–±–Њ—А–∞ –і–ї—П —Б–Ї—А–Є–љ–Є–љ–≥–∞ –≠–У [1, 6вАУ9]. –Ґ–µ—Б—В –Њ–±–ї–∞–і–∞–µ—В –≤—Л—Б–Њ–Ї–Њ–є —В–Њ—З–љ–Њ—Б—В—М—О, –Њ–љ –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л–є, –љ–µ —В—А–µ–±—Г–µ—В –Љ–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Є —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—Б—В—Л–Љ –≤ –Є—Б–њ–Њ–ї–љ–µ–љ–Є–Є, –Љ–Њ–ґ–µ—В –±—Л—В—М –ї–µ–≥–Ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ –њ–∞—Ж–Є–µ–љ—В–Њ–Љ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –≤ –і–Њ–Љ–∞—И–љ–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е –њ–Њ—Б–ї–µ –њ–Њ–ї—Г—З–µ–љ–Є—П —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—В–µ–є–љ–µ—А–∞ –Є –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –і–ї—П —Б–±–Њ—А–∞ —Б–ї—О–љ—Л [1, 6, 8]. –Ґ–∞–Ї–ґ–µ –Њ–љ –ї–Є—И–µ–љ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–є, —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –і–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –°–≠–°–Ъ–Ь –Є —В–µ—Б—В–Њ–≤ —Б –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ–Њ–Љ [1, 6]. –Ю–і–љ–∞–Ї–Њ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ —Н—В–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ —П–≤–ї—П–µ—В—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ –µ–і–Є–љ–Њ–≥–Њ —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –Њ—Ж–µ–љ–Ї–Є –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –µ–і–Є–љ—Л—Е —А–µ—Д–µ—А–µ–љ—Б–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –і–ї—П —Г—А–Њ–≤–љ—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –∞ —В–∞–Ї–ґ–µ –µ–і–Є–љ–Њ–є —В–Њ—З–Ї–Є —А–∞–Ј–і–µ–ї–µ–љ–Є—П –љ–Њ—А–Љ—Л –Є –≠–У [10, 11]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –Љ–Є—А–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –і–≤–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е –Љ–µ—В–Њ–і–∞ –Њ—Ж–µ–љ–Ї–Є –Ъ–°: –Є–Љ–Љ—Г–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –Є –Љ–µ—В–Њ–і –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–љ–Њ–є —Е—А–Њ–Љ–∞—В–Њ–≥—А–∞—Д–Є–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —В–∞–љ–і–µ–Љ–љ–Њ–є –Љ–∞—Б—Б-—Б–њ–µ–Ї—В—А–Њ–Љ–µ—В—А–Є–µ–є [10, 12вАУ14]. –° —Г—З–µ—В–Њ–Љ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–Є—П –Љ–µ—В–Њ–і–Њ–≤ –Њ—Ж–µ–љ–Ї–Є —Г—А–Њ–≤–љ—П –Ъ–° —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –≤ –Ї–∞–ґ–і–Њ–є –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є —А–∞–Ј—А–∞–±–∞—В—Л–≤–∞—В—М —Б–≤–Њ–Є —А–µ—Д–µ—А–µ–љ—Б–љ—Л–µ –Є –њ–Њ—А–Њ–≥–Њ–≤—Л–µ –Ј–љ–∞—З–µ–љ–Є—П [1, 6, 11].
–Т —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ъ–° —И–Є—А–Њ–Ї–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –њ–Њ–ї—Г—З–Є–ї –Љ–µ—В–Њ–і –∞–≤—В–Њ–Љ–∞—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Н–ї–µ–Ї—В—А–Њ—Е–µ–Љ–Є–ї—О–Љ–Є–љ–µ—Б—Ж–µ–љ—В–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ (–≠–•–Ы–Р). –Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Њ–≤ –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О –±–Њ–ї–µ–Ј–љ–Є –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞ –і–ї—П –Љ–µ—В–Њ–і–∞ –≠–•–Ы–Р —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ —В–Њ—З–Ї–∞ —А–∞–Ј–і–µ–ї–µ–љ–Є—П 9,4 –љ–Љ–Њ–ї—М/–ї –Ї–∞–Ї –њ–Њ—А–Њ–≥–Њ–≤–∞—П –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≠–У [6]. –Ю–і–љ–∞–Ї–Њ, —Б–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ї–Њ—В–Њ—А–Њ–≥–Њ –±—Л–ї–∞ –њ—А–µ–і–ї–Њ–ґ–µ–љ–∞ —Н—В–∞ —В–Њ—З–Ї–∞ —А–∞–Ј–і–µ–ї–µ–љ–Є—П, –≤—Л—Б–Њ–Ї–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М (84,4%) –Є —Б–њ–µ—Ж–Є¬≠—Д–Є—З–љ–Њ—Б—В—М (92,3%) –њ–Њ—А–Њ–≥–Њ–≤–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П 9,4 –љ–Љ–Њ–ї—М/–ї –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≠–У —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ [15]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –љ–µ —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Ъ—Г—И–Є–љ–≥–∞ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –Њ–ґ–Є—А–µ–љ–Є–µ [16вАУ19]. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –≤ –§–У–С–£ ¬Ђ–Э–Ь–Ш–¶ –Є–Љ. –Т.–Р. –Р–ї–Љ–∞–Ј–Њ–≤–∞¬ї –Ь–Є–љ¬≠–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є –њ—А–Є –Њ—Ж–µ–љ–Ї–µ —Г—А–Њ–≤–љ—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –Љ–µ—В–Њ–і–Њ–Љ –∞–≤—В–Њ–Љ–∞—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≠–•–Ы–Р –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≠–У –≤ –њ–µ—А–Є–Њ–і —Б 2015 –њ–Њ 2018 –≥. –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Њ—Б—М –њ–Њ—А–Њ–≥–Њ–≤–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ 6,7 –љ–Љ–Њ–ї—М/–ї, –Ї–Њ—В–Њ—А–Њ–µ –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –≤ –Ї–∞—З–µ—Б—В–≤–µ —А–µ—Д–µ—А–µ–љ—Б–љ–Њ–≥–Њ —Б–Њ–≥–ї–∞—Б–љ–Њ –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –Ї –љ–∞–±–Њ—А—Г —А–µ–∞–≥–µ–љ—В–Њ–≤ –і–ї—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Ъ–°.
–¶–µ–ї—М—О –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Њ –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞—В—М —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Ж–µ–љ–Ї–Є —Г—А–Њ–≤–љ—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–є –Љ–µ—В–Њ–і–Њ–Љ –≠–•–Ы–Р –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –§–У–С–£ ¬Ђ–Э–Ь–Ш–¶ –Є–Љ. –Т.–Р. –Р–ї–Љ–∞–Ј–Њ–≤–∞¬ї –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –≤ —Б–≤—П–Ј–Є —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –≠–У, –Є –Њ–њ—А–µ–і–µ–ї–Є—В—М –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–µ –њ–Њ—А–Њ–≥–Њ–≤–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–∞–љ–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б–Є–љ–і—А–Њ–Љ–∞ –Ъ—Г—И–Є–љ–≥–∞ —Г —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–С—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Ї–Њ–≥–Њ—А—В–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Ф–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ —Б —Ж–µ–ї—М—О —Б–Ї—А–Є–љ–Є–љ–≥–∞ –≠–У –≤—Л–њ–Њ–ї–љ—П–ї—Б—П –∞–љ–∞–ї–Є–Ј —Б–ї—О–љ—Л, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –љ–∞ –Ї–Њ—А—В–Є–Ј–Њ–ї, –±—Л–ї–∞ –Є–Ј—Г—З–µ–љ–∞ –±–∞–Ј–∞ –і–∞–љ–љ—Л—Е –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –§–У–С–£ ¬Ђ–Э–Ь–Ш–¶ –Є–Љ. –Т.–Р. –Р–ї–Љ–∞–Ј–Њ–≤–∞¬ї –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є –≤ –њ–µ—А–Є–Њ–і —Б 2015 –њ–Њ 2018 –≥. –С—Л–ї–Њ –љ–∞–є–і–µ–љ–Њ 420 —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —В–µ—Б—В–Њ–≤ –љ–∞ –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П —Г –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е –Є —Б—В–∞—Ж–Є–Њ–љ–∞—А–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ч–∞—В–µ–Љ –≤ —Б–Є—Б—В–µ–Љ–µ —А–µ–≥–Є—Б—В—А–∞—Ж–Є–Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е –і–∞–љ–љ—Л—Е Quality Management System –±—Л–ї–Є –Є–Ј—Г—З–µ–љ—Л —Н–ї–µ–Ї—В—А–Њ–љ–љ—Л–µ –Є—Б—В–Њ—А–Є–Є –±–Њ–ї–µ–Ј–љ–Є —Б —Ж–µ–ї—М—О –≤—Л–±–Њ—А–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –Ї—А–Є—В–µ—А–Є—П–Љ –≤–Ї–ї—О—З–µ–љ–Є—П.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 18 –ї–µ—В –Є —Б—В–∞—А—И–µ, —Г –Ї–Њ—В–Њ—А—Л—Е —Г—А–Њ–≤–µ–љ—М –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –±—Л–ї –Њ–њ—А–µ–і–µ–ї–µ–љ —Б —Ж–µ–ї—М—О —Б–Ї—А–Є–љ–Є–љ–≥–∞ –љ–∞ –≠–У. –Ґ–∞–Ї–ґ–µ —Г –і–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ–ї–ґ–µ–љ –±—Л–ї –±—Л—В—М –Є–Ј–≤–µ—Б—В–µ–љ —А–µ–Ј—Г–ї—М—В–∞—В –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –Њ–і–љ–Њ–≥–Њ –Є–Ј —Б–ї–µ–і—Г—О—Й–Є—Е —В–µ—Б—В–Њ–≤: –°–≠–°–Ъ–Ь, –Ъ–°–Ъ, –Ј–∞–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–ї–љ–Њ—З—М, –Ь–Ф–Я. –Ъ—А–Є—В–µ—А–Є–Є –љ–µ–≤–Ї–ї—О—З–µ–љ–Є—П –±—Л–ї–Є —Б–ї–µ–і—Г—О—Й–Є–Љ–Є: –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М, —А–∞–±–Њ—В–∞ –≤ –љ–Њ—З–љ—Г—О —Б–Љ–µ–љ—Г, —Г–Ї–∞–Ј–∞–љ–Є–µ –љ–∞ –Ї—А–Њ–≤–Њ—В–Њ—З–Є–≤–Њ—Б—В—М –і–µ—Б–µ–љ, –њ—А–Є–µ–Љ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤ –Є –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ —Б—В–µ—А–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞, –Њ—Б—В—А—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Г—А–Њ–≤–µ–љ—М –≥–ї–Є–Ї–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –±–Њ–ї–µ–µ 7,5% –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞, —В—П–ґ–µ–ї–∞—П —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–∞—П —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–∞—П –њ–∞—В–Њ–ї–Њ–≥–Є—П, —В–µ—А–Љ–Є–љ–∞–ї—М–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П. –Т—Б–µ–≥–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 100 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (28 –Љ—Г–ґ—З–Є–љ, 72 –ґ–µ–љ—Й–Є–љ—Л), –Љ–µ–і–Є–∞–љ–∞ –≤–Њ–Ј—А–∞—Б—В–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 46 –ї–µ—В [34; 61].
–Ь–µ—В–Њ–і–Є–Ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г—А–Њ–≤–љ—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ —Б–ї—О–љ–µ
–Р–љ–∞–ї–Є–Ј —Б–ї—О–љ—Л –љ–∞ –Ї–Њ—А—В–Є–Ј–Њ–ї –љ–∞–Ј–љ–∞—З–∞–ї–Є –≤—А–∞—З–Є-—Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є –Э–Ь–Ш–¶ –Є–Љ. –Т.–Р. –Р–ї–Љ–∞–Ј–Њ–≤–∞ –њ—А–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є–Є –љ–∞ –≠–У —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е –Є —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є [1, 16]. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –Ј–∞–њ–Њ–ї–љ—П–ї–Є –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ –і–Њ–±—А–Њ–≤–Њ–ї—М–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ –Њ–±—А–∞–±–Њ—В–Ї—Г –њ–µ—А—Б–Њ–љ–∞–ї—М–љ—Л—Е –і–∞–љ–љ—Л—Е. –°–њ–µ—Ж–Є–∞–ї—М–љ—Л–є –Ї–Њ–љ—В–µ–є–љ–µ—А –і–ї—П —Б–±–Њ—А–∞ —Б–ї—О–љ—Л Salivette Sarstedi (SARSDEDT AG&CO, –У–µ—А–Љ–∞–љ–Є—П) –Є –Є–љ—Б—В—А—Г–Ї—Ж–Є—О –њ–Њ —Б–±–Њ—А—Г —Б–ї—О–љ—Л –њ–∞—Ж–Є–µ–љ—В—Г –≤—Л–і–∞–≤–∞–ї –≤—А–∞—З-—Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥, –Ї–Њ—В–Њ—А—Л–є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –°–±–Њ—А —Б–ї—О–љ—Л –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –њ–∞—Ж–Є–µ–љ—В–Њ–Љ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ —Б 23:00 –і–Њ 24:00. –Ч–∞ —Б—Г—В–Ї–Є –і–Њ —Б–±–Њ—А–∞ –∞–љ–∞–ї–Є–Ј–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –≤–Њ–Ј–і–µ—А–ґ–Є–≤–∞—В—М—Б—П –Њ—В —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –∞–ї–Ї–Њ–≥–Њ–ї—П; –Ј–∞ 30 –Љ–Є–љ вАФ –Њ—В –Ї—Г—А–µ–љ–Є—П, —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ –љ–∞–њ–Є—В–Ї–Њ–≤, –Ї—А–Њ–Љ–µ –њ—А–Њ—Б—В–Њ–є –≤–Њ–і—Л, –Њ—В —З–Є—Б—В–Ї–Є –Ј—Г–±–Њ–≤. –Я–Њ—Б–ї–µ —Б–±–Њ—А–∞ —Б–ї—О–љ—Л –Ї–Њ–љ—В–µ–є–љ–µ—А –њ–Њ–Љ–µ—Й–∞–ї–Є –≤ —Е–Њ–ї–Њ–і–Є–ї—М–љ–Є–Ї (–љ–µ –≤ –Љ–Њ—А–Њ–Ј–Є–ї—М–љ–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ). –Э–∞ —Б–ї–µ–і—Г—О—Й–µ–µ —Г—В—А–Њ –њ–Њ—Б–ї–µ —Б–±–Њ—А–∞ —Б–ї—О–љ—Л –Ї–Њ–љ—В–µ–є–љ–µ—А –і–Њ—Б—В–∞–≤–ї—П–ї–Є –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є—О (–њ–∞—Ж–Є–µ–љ—В —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –Є–Ј –і–Њ–Љ–∞ –Є–ї–Є –Љ–µ–і–њ–µ—А—Б–Њ–љ–∞–ї, –µ—Б–ї–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ), –љ–µ –і–Њ–њ—Г—Б–Ї–∞—П –µ–≥–Њ –љ–∞–≥—А–µ–≤–∞. –Я—А–Њ–±–Є—А–Ї–Є —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А–Њ–≤–∞–ї–Є –≤ —В–µ—З–µ–љ–Є–µ 2вАУ3 –Љ–Є–љ –љ–∞ —Б–Ї–Њ—А–Њ—Б—В–Є 1000 –Њ–±–Њ—А–Њ—В–Њ–≤ –≤ –Љ–Є–љ—Г—В—Г. –Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ъ–° –Љ–µ—В–Њ–і–Њ–Љ –∞–≤—В–Њ–Љ–∞—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≠–•–Ы–Р –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–∞ Cobas e411 (¬Ђ–•–Њ—Д—Д–Љ–∞–љ–љ-–Ы—П –†–Њ—И¬ї, –®–≤–µ–є—Ж–∞—А–Є—П). –Т –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –Э–Ь–Ш–¶ –Є–Љ. –Т.–Р. –Р–ї–Љ–∞–Ј–Њ–≤–∞ —А–µ—Д–µ—А–µ–љ—Б–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –і–ї—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, —П–≤–ї—П–µ—В—Б—П 6,7 –љ–Љ–Њ–ї—М/–ї.
–Ф–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≠–У –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є —Б–ї–µ–і—Г—О—Й–Є–µ –Ї—А–Є—В–µ—А–Є–Є: —Г—А–Њ–≤–µ–љ—М –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, 6,7 –љ–Љ–Њ–ї—М/–ї –Є –≤—Л—И–µ –Є –љ–∞–ї–Є—З–Є–µ –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –Њ–і–љ–Њ–≥–Њ –Є–Ј –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е —Г—Б–ї–Њ–≤–Є–є: –њ–Њ–≤—Л—И–µ–љ–Є–µ –°–≠–°–Ъ–Ь; –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Љ–µ–љ–µ–µ 50 –љ–Љ–Њ–ї—М/–ї –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ь–Ф–Я; –Ъ–°–Ъ, –Ј–∞–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–ї–љ–Њ—З—М, 207 –љ–Љ–Њ–ї—М/–ї –Є –≤—Л—И–µ. –Т —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ —Г—А–Њ–≤–µ–љ—М –Ъ–° –±—Л–ї –љ–Є–ґ–µ 6,7 –љ–Љ–Њ–ї—М/–ї, –≤—Л–њ–Њ–ї–љ—П–ї—Б—П –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –Њ–і–Є–љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–є —В–µ—Б—В. –Х—Б–ї–Є –µ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Є –њ—А–Њ—В–Є–≤ –≠–У, –і–∞–ї—М–љ–µ–є—И–µ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є. –Х—Б–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤—В–Њ—А–Њ–≥–Њ —В–µ—Б—В–∞ –±—Л–ї–Є –≤ –њ–Њ–ї—М–Ј—Г –≠–У, –≤—Л–њ–Њ–ї–љ—П–ї–Є –µ—Й–µ –Њ–і–Є–љ –Є–ї–Є –і–≤–∞ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е —В–µ—Б—В–∞, –µ—Б–ї–Є –Њ–љ–Є –±—Л–ї–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ–Є, —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–Є –і–Є–∞–≥–љ–Њ–Ј –≠–У. –Я—А–Є —Г—А–Њ–≤–љ–µ –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, 6,7 –љ–Љ–Њ–ї—М/–ї –Є –≤—Л—И–µ –њ–∞—Ж–Є–µ–љ—В–∞ –Њ–±—Б–ї–µ–і–Њ–≤–∞–ї–Є –≤ —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Њ—В–і–µ–ї–µ–љ–Є–Є –Э–Ь–Ш–¶ –Є–Љ. –Т.–Р. –Р–ї–Љ–∞–Ј–Њ–≤–∞. –Ф–Є–∞–≥–љ–Њ–Ј —Б—З–Є—В–∞–ї–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ—Л–Љ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –і–≤—Г—Е —В–µ—Б—В–Њ–≤, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є—Е –≤ –њ–Њ–ї—М–Ј—Г –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [6]. –°–±–Њ—А —Б—Г—В–Њ—З–љ–Њ–є –Љ–Њ—З–Є –љ–∞ –Ї–Њ—А—В–Є–Ј–Њ–ї –њ—А–Њ–≤–Њ–і–Є–ї—Б—П —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Њ–≤ –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О –±–Њ–ї–µ–Ј–љ–Є –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞ [6].
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Љ–µ—В–Њ–і–Њ–Љ –≠–•–Ы–Р —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–∞ Cobas e411. –†–µ—Д–µ—А–µ–љ—Б–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 38вАУ208 –љ–Љ–Њ–ї—М/–ї/—Б—Г—В. –Ь–Ф–Я –≤—Л–њ–Њ–ї–љ—П–ї–Є —Б–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–µ [6]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ъ–°–Ъ –њ—А–Њ–≤–Њ–і–Є–ї–Є –Љ–µ—В–Њ–і–Њ–Љ –≠–•–Ы–Р, —В–Њ—З–Ї–Њ–є —А–∞–Ј–і–µ–ї–µ–љ–Є—П –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≠–У —Б—З–Є—В–∞–ї–Є –Ј–љ–∞—З–µ–љ–Є–µ 50 –љ–Љ–Њ–ї—М/–ї –Є –±–Њ–ї–µ–µ. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ъ–°–Ъ –≤ –њ–Њ–ї–љ–Њ—З—М –≤—Л–њ–Њ–ї–љ—П–ї–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ, –Ї–Њ—В–Њ—А—Л–µ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ —З–µ—А–µ–Ј 48 —З –њ–Њ—Б–ї–µ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є. –Ч–∞–±–Њ—А –Ї—А–Њ–≤–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї—Б—П —Г –±–Њ–і—А—Б—В–≤—Г—О—Й–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ 24:00. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є —А–µ–Ј—Г–ї—М—В–∞—В–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є —В–Њ—З–Ї—Г —А–∞–Ј–і–µ–ї–µ–љ–Є—П –Љ–µ–љ–µ–µ 207 –љ–Љ–Њ–ї—М/–ї (7,5 –Љ–Ї–≥/–і–ї), –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ—Г—О D. Papanicolaou et al. [20].
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –њ—А–Њ–≤–µ–і–µ–љ —Б –њ–Њ–Љ–Њ—Й—М—О –њ–∞–Ї–µ—В–∞ IBM SPSS Statistics v. 23 (–°–®–Р). –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –љ–µ –±—Л–ї–Њ –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ, –і–∞–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ –≤–Є–і–µ –Љ–µ–і–Є–∞–љ—Л –Є –Ї–≤–∞—А—В–Є–ї–µ–є [25 –њ–µ—А—Ж–µ–љ—В–Є–ї—М;75 –њ–µ—А—Ж–µ–љ—В–Є–ї—М]. –Ф–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–Є–є –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –Ї—А–Є—В–µ—А–Є—П ѕЗ-–Ї–≤–∞–і—А–∞—В–∞ –Я–Є—А—Б–Њ–љ–∞ —Б –њ–Њ–њ—А–∞–≤–Ї–Њ–є –Щ–µ—В—Б–∞, –∞ –і–ї—П –љ–µ–њ—А–µ—А—Л–≤–љ—Л—Е –і–∞–љ–љ—Л—Е —Б—А–∞–≤–љ–µ–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –Ї—А–Є—В–µ—А–Є—П –Ь–∞–љ–љ–∞ вАФ –£–Є—В–љ–Є. –Я–Њ–Є—Б–Ї —В–Њ—З–Ї–Є —А–∞–Ј–і–µ–ї–µ–љ–Є—П –Ј–љ–∞—З–µ–љ–Є—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≠–У, —Б —А–∞—Б—З–µ—В–Њ–Љ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ—Б—В—А–Њ–µ–љ–Є—П –Ї—А–Є–≤—Л—Е –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї (ROC-–∞–љ–∞–ї–Є–Ј). –Т –Ї–∞—З–µ—Б—В–≤–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ–є –њ–µ—А–µ–Љ–µ–љ–љ–Њ–є –±—Л–ї–Њ –≤—Л–±—А–∞–љ–Њ –љ–∞–ї–Є—З–Є–µ –≠–У. –Ю–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —В–Њ—З–Ї–Њ–є —А–∞–Ј–і–µ–ї–µ–љ–Є—П —Б—З–Є—В–∞–ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –Ъ–°, –Ї–Њ—В–Њ—А–Њ–Љ—Г —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–∞ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —Б—Г–Љ–Љ–∞ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є –Љ–µ—В–Њ–і–∞, —А–∞—Б—Б—З–Є—В–∞–љ–љ–∞—П –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ ROC-–∞–љ–∞–ї–Є–Ј–∞.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Ф–Є–∞–≥–љ–Њ–Ј –≠–У –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ —Г 28 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ—Б—В–∞–≤–Є–ї–Є –≥—А—Г–њ–њ—Г 1 (—Г 24 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–∞ –Р–Ъ–Ґ–У-–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–∞—П –∞–і–µ–љ–Њ–Љ–∞ –≥–Є–њ–Њ—Д–Є–Ј–∞, —Г 3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї –≤—Л—П–≤–ї–µ–љ –Р–Ъ–Ґ–У-–љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–є –≥–Є–њ–µ—А–Ї–Њ—А—В–Є—Ж–Є–Ј–Љ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –≥–Є–њ–µ—А–њ—А–Њ–і—Г–Ї—Ж–Є–Є –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П–Љ–Є –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤, —Г 1 –њ–∞—Ж–Є–µ–љ—В–Ї–Є вАФ –∞–≤—В–Њ–љ–Њ–Љ–љ–∞—П –њ—А–Њ–і—Г–Ї—Ж–Є—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–Є–Љ–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П–Љ–Є –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤). –Т 72 —Б–ї—Г—З–∞—П—Е –і–∞–љ–љ—Л—Е –Ј–∞ –≥–Є–њ–µ—А–њ—А–Њ–і—Г–Ї—Ж–Є—О –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –љ–µ –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ, —Н—В–Є –њ–∞—Ж–Є–µ–љ—В—Л —Б–Њ—Б—В–∞–≤–Є–ї–Є –≥—А—Г–њ–њ—Г 2. –У—А—Г–њ–њ—Л 1 –Є 2 –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –њ–Њ –њ–Њ–ї—Г, –≤–Њ–Ј—А–∞—Б—В—Г, –Є–љ–і–µ–Ї—Б—Г –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ). –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 1. –Т –≥—А—Г–њ–њ–µ 1 —Г—А–Њ–≤–µ–љ—М –Ъ–° –±—Л–ї 6,7 –љ–Љ–Њ–ї—М/–ї –Є –≤—Л—И–µ –≤ 25 —Б–ї—Г—З–∞—П—Е. –Ш–Ј 25 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –Ъ–° –≤ 5 —Б–ї—Г—З–∞—П—Е –і–Є–∞–≥–љ–Њ–Ј –≠–У –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ 3 –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е —В–µ—Б—В–Њ–≤ (–Ъ–°–Ъ, –Ь–Ф–Я –Є –°–≠–°–Ъ–Ь). –Т 20 —Б–ї—Г—З–∞—П—Е –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –≠–У –±—Л–ї–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л 2 —В–µ—Б—В–Њ–≤: –Ъ–°–Ъ –Є –Ь–Ф–Я вАФ —Г 7 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ъ–°–Ъ –Є –°–≠–°–Ъ–Ь вАФ —Г 10 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –°–≠–Ъ–°–Ь –Є –Ь–Ф–Я вАФ —Г 3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–£ 3 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Г—А–Њ–≤–µ–љ—М –Ъ–° –Њ–Ї–∞–Ј–∞–ї—Б—П –љ–Є–ґ–µ 6,7 –љ–Љ–Њ–ї—М/–ї, –Њ–і–љ–∞–Ї–Њ –њ–Њ –і–∞–љ–љ—Л–Љ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–Њ –≤—Б–µ—Е 3 —Б–ї—Г—З–∞—П—Е –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј –≠–У. –Ш–Ј –љ–Є—Е —Г 2 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –≥–Є–њ–µ—А–њ—А–Њ–і—Г–Ї—Ж–Є—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –±—Л–ї–∞ –і–Њ–Ї–∞–Ј–∞–љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є 2 —В–µ—Б—В–Њ–≤ (–°–≠–°–Ъ–Ь –Є –Ъ–°–Ъ). –Т–њ–Њ—Б–ї–µ–і—Б—В–≤–Є–Є —Г –љ–Є—Е –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ –±–Њ–ї–µ–Ј–љ—М –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞, –≤ —В. —З. –њ–Њ –і–∞–љ–љ—Л–Љ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г–і–∞–ї–µ–љ–љ–Њ–є –∞–і–µ–љ–Њ–Љ—Л –≥–Є–њ–Њ—Д–Є–Ј–∞. –Ю–±–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є –Є–Љ–µ–ї–Є –љ–Њ—А–Љ–∞–ї—М–љ—Л–є –Ш–Ь–Ґ (23 –Ї–≥/–Љ2 –Є 24 –Ї–≥/–Љ2). –£ 1 –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј –∞–≤—В–Њ–љ–Њ–Љ–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞–Љ–Є –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ 2 –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е —В–µ—Б—В–Њ–≤ (–љ–Њ—А–Љ–∞–ї—М–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ъ–°–Ъ –≤ –њ–Њ–ї–љ–Њ—З—М –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ь–Ф–Я). –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є –Њ–њ–µ—А–Є—А–Њ–≤–∞–љ—Л (–Ї—А–Њ–Љ–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б –∞–≤—В–Њ–љ–Њ–Љ–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–µ–є –Ї–Њ—А—В–Є–Ј–Њ–ї–∞, –Ї–Њ—В–Њ—А–Њ–є –±—Л–ї–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ), –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (–Р–Ъ–Ґ–У-—Б–µ–Ї—А–µ—В–Є—А—Г—О—Й–∞—П –∞–і–µ–љ–Њ–Љ–∞ –≥–Є–њ–Њ—Д–Є–Ј–∞ –≤ 24 —Б–ї—Г—З–∞—П—Е, –Ї–Њ—А—В–Є–Ј–Њ–ї-—Б–µ–Ї—А–µ—В–Є—А—Г—О—Й–∞—П –∞–і–µ–љ–Њ–Љ–∞ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞ –≤ 3 —Б–ї—Г—З–∞—П—Е).
–Т –≥—А—Г–њ–њ–µ 2 –Є–Ј 72 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Г—А–Њ–≤–µ–љ—М –Ъ–° –Њ–Ї–∞–Ј–∞–ї—Б—П –љ–Є–ґ–µ 6,7 –љ–Љ–Њ–ї—М/–ї –≤ 65 —Б–ї—Г—З–∞—П—Е. –Ш–Ј –љ–Є—Е 31 –њ–∞—Ж–Є–µ–љ—В—Г –±—Л–ї –≤—Л–њ–Њ–ї–љ–µ–љ 1 –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є —В–µ—Б—В, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ—В–Њ—А–Њ–≥–Њ —В–∞–Ї–ґ–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Є –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є –≠–У (–°–≠–°–Ъ–Ь вАФ –≤ 15 —Б–ї—Г—З–∞—П—Е, –Ь–Ф–Я вАФ –≤ 3 —Б–ї—Г—З–∞—П—Е, –Ъ–°–Ъ вАФ –≤ 13 —Б–ї—Г—З–∞—П—Е). –Т 30 —Б–ї—Г—З–∞—П—Е –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ 2 –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е —В–µ—Б—В–∞, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≠–У (–Ъ–°–Ъ –Є –Ь–Ф–Я вАФ —Г 6 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ъ–°–Ъ –Є –°–≠–°–Ъ–Ь вАФ —Г 19 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –°–≠–°–Ъ–Ь –Є –Ь–Ф–Я вАФ —Г 5 –њ–∞—Ж–Є–µ–љ—В–Њ–≤). –І–µ—В—Л—А–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ—Л 3 —В–µ—Б—В–∞ (–Ъ–°–Ъ, –°–≠–°–Ъ–Ь –Є –Ь–Ф–Я), –Є—Е —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–Љ–Є, –≠–У –±—Л–ї –Є—Б–Ї–ї—О—З–µ–љ. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–Є –∞–љ–∞–ї–Є–Ј–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Ь–Ф–Я –≤ –≥—А—Г–њ–њ–µ 2 75 –њ—А–Њ—Ж–µ–љ—В–Є–ї—М –Ј–љ–∞—З–µ–љ–Є—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 56 –љ–Љ–Њ–ї—М/–ї (—В–∞–±–ї. 1). –≠—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П —В–µ–Љ, —З—В–Њ —Г 8 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ј–љ–∞—З–µ–љ–Є—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –Ї—А–Њ–≤–Є –њ–Њ—Б–ї–µ –њ—А–Њ–±—Л —Б –і–µ–Ї—Б–∞–Љ–µ—В–∞–Ј–Њ–љ–Њ–Љ –±—Л–ї–Є –≤—Л—И–µ 50 –љ–Љ–Њ–ї—М/–ї. –Ю–і–љ–∞–Ї–Њ —Г –і–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≠–У –±—Л–ї –Є—Б–Ї–ї—О—З–µ–љ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –і—А—Г–≥–Є—Е —В–µ—Б—В–Њ–≤ (–Ъ–°, –°–≠–Ъ–°–Ь, –Ъ–°–Ъ).
–£ 7 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (4 –ґ–µ–љ—Й–Є–љ—Л) –Є–Ј –≥—А—Г–њ–њ—Л 2 —Г—А–Њ–≤–µ–љ—М –Ъ–° –Њ–Ї–∞–Ј–∞–ї—Б—П 6,7 –љ–Љ–Њ–ї—М/–ї –Є –≤—Л—И–µ, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Њ –≤ –њ–Њ–ї—М–Ј—Г –≠–У. –Ю–і–љ–∞–Ї–Њ –њ—А–Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≠–У –±—Л–ї –Є—Б–Ї–ї—О—З–µ–љ –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ 2 —В–µ—Б—В–Њ–≤ (–°–≠–Ъ–°–Ь –Є –Ь–Ф–Я вАФ –≤ 4 —Б–ї—Г—З–∞—П—Е, –°–≠–Ъ–°–Ь –Є –Ъ–°–Ъ вАФ –≤ 2 —Б–ї—Г—З–∞—П—Е, –Ь–Ф–Я –Є –Ъ–°–Ъ вАФ –≤ 1 —Б–ї—Г—З–∞–µ). –Ь–µ–і–Є–∞–љ–∞ –Ъ–° —Г —Н—В–Є—Е 7 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ 10,19 –љ–Љ–Њ–ї—М/–ї [8,9; 11,265], –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Ъ–° вАФ 13,1 –љ–Љ–Њ–ї—М/–ї. –£ 5 —З–µ–ї–Њ–≤–µ–Ї –±—Л–ї–Њ –Њ–ґ–Є—А–µ–љ–Є–µ. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –і–Њ–Ї—Г–Љ–µ–љ—В–∞—Ж–Є–Є –љ–µ –љ–∞–є–і–µ–љ–Њ —Г–Ї–∞–Ј–∞–љ–Є–є –љ–∞ –Ї—А–Њ–≤–Њ—В–Њ—З–Є–≤–Њ—Б—В—М –і–µ—Б–µ–љ –Є–ї–Є –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–µ—В–Њ–і–Є–Ї–Є —Б–±–Њ—А–∞ –Ъ–°, –Њ–і–љ–∞–Ї–Њ –њ–Њ–ї–љ–Њ—Б—В—М—О –Є—Б–Ї–ї—О—З–Є—В—М —Н—В–Є —Д–∞–Ї—В–Њ—А—Л –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–ї–Њ—Б—М –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ. –£ 2 —З–µ–ї–Њ–≤–µ–Ї (—Б–Њ–≥–ї–∞—Б–љ–Њ –Ј–∞–Ї–ї—О—З–µ–љ–Є—О –њ—Б–Є—Е–Њ–ї–Њ–≥–∞) –њ—А–Є—З–Є–љ–Њ–є –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞ –Љ–Њ–≥–ї–Є –±—Л—В—М —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–Њ –∞–і–∞–њ—В–∞—Ж–Є–Є –Є –і–µ–њ—А–µ—Б—Б–Є—П.
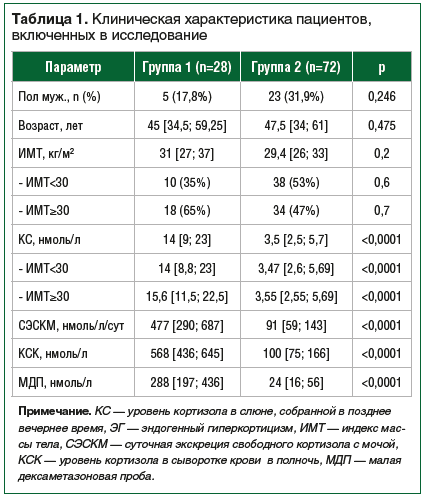
–Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ —В–∞–±–ї–Є—Ж–µ 1, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ъ–° –±—Л–ї–Є –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ 1 (14 –љ–Љ–Њ–ї—М/–ї –њ—А–Њ—В–Є–≤ 3,5 –љ–Љ–Њ–ї—М/–ї, p<0,0001). –Ь—Л –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –±–Њ–ї—М–љ—Л—Е —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Є —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –љ–µ –Њ—В–ї–Є—З–∞–ї–Њ—Б—М –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е. –Э–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –Ш–Ь–Ґ —Г—А–Њ–≤–µ–љ—М –Ъ–° –≤ –≥—А—Г–њ–њ–µ 1 –±—Л–ї –≤—Л—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ 2. –Ю—В–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Ъ–° —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –≤ –≥—А—Г–њ–њ–µ 1 –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ. –Т –≥—А—Г–њ–њ–µ 2 –Љ–µ–і–Є–∞–љ–∞ –Ъ–° —В–∞–Ї–ґ–µ –љ–µ –Њ—В–ї–Є—З–∞–ї–∞—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞. –†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ —Г—А–Њ–≤–љ—О –Ъ–° –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Љ–∞—Б—Б—Л —В–µ–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1.
–Т –≥—А—Г–њ–њ–µ 1 —Г 5 (18%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Г—А–Њ–≤–µ–љ—М –Ъ–° –Њ–Ї–∞–Ј–∞–ї—Б—П –≤—Л—И–µ 6,7 –љ–Љ–Њ–ї—М/–ї –Є –љ–Є–ґ–µ, —З–µ–Љ 9,4 –љ–Љ–Њ–ї—М/–ї. –Ш–Ј –љ–Є—Е —Г 3 –±—Л–ї–Њ –Њ–ґ–Є—А–µ–љ–Є–µ, —Г 2 –і—А—Г–≥–Є—Е –Є–Ј–±—Л—В–Њ—З–љ–∞—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞ –Є–ї–Є –љ–Њ—А–Љ–∞–ї—М–љ–∞—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞. –Т–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –і–Є–∞–≥–љ–Њ–Ј –±–Њ–ї–µ–Ј–љ–Є –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞.
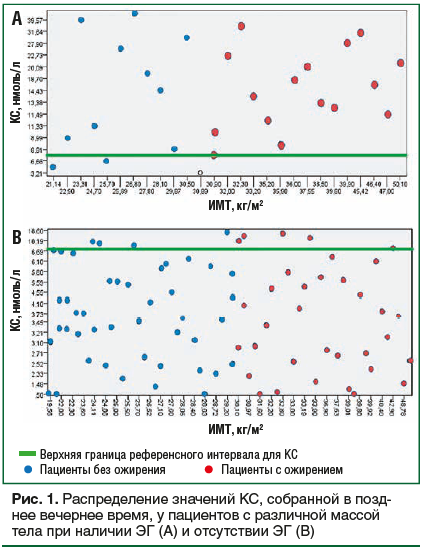
–Я–Њ –і–∞–љ–љ—Л–Љ ROC-–∞–љ–∞–ї–Є–Ј–∞, –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —В–Њ—З–Ї–Њ–є —А–∞–Ј–і–µ–ї–µ–љ–Є—П –Ј–љ–∞—З–µ–љ–Є—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≠–У —Б —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О 93% [95% –Ф–Ш 74; 97] –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О 87% [95% –Ф–Ш 83; 91] –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –Ј–љ–∞—З–µ–љ–Є–µ 6,6 –љ–Љ–Њ–ї—М/–ї. –Я–ї–Њ—Й–∞–і—М –њ–Њ–і –Ї—А–Є–≤–Њ–є (AUC) —Б–Њ—Б—В–∞–≤–Є–ї–∞ 0,944, p<0,001 (—А–Є—Б. 2).
–Ґ–∞–Ї–ґ–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ ROC-–∞–љ–∞–ї–Є–Ј–∞ –±—Л–ї–Є –Њ—Ж–µ–љ–µ–љ—Л —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М –і—А—Г–≥–Є—Е –њ–Њ—А–Њ–≥–Њ–≤—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –Ъ–°, —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л—Е —А–∞–љ–µ–µ [15]. –Ф–ї—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є 9,4 –љ–Љ–Њ–ї—М/–ї –Є 6,85 –љ–Љ–Њ–ї—М/–ї —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Њ–Ї–∞–Ј–∞–ї–∞—Б—М 71% –Є 89% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –∞ —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М вАФ 91,7% –Є 88% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Ф–ї—П —В–Њ—З–Ї–Є —А–∞–Ј–і–µ–ї–µ–љ–Є—П 6,7 –љ–Љ–Њ–ї—М/–ї —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–Є–ї–∞ 89,3%, –∞ —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М вАФ 88%. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Ж–µ–љ–Ї–Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–ї—П –і—А—Г–≥–Є—Е –њ–Њ—А–Њ–≥–Њ–≤—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –Ъ–°, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 2.
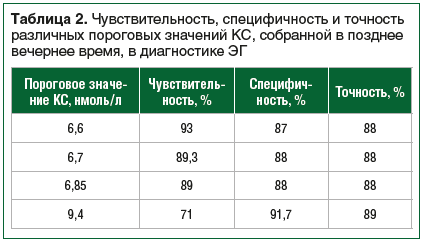
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–ї—П —Б–Ї—А–Є–љ–Є–љ–≥–∞ –≠–У —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ –њ–Њ—А–Њ–≥–Њ–≤—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М 6,6 –љ–Љ–Њ–ї—М/–ї, —В–Њ—З–љ–Њ—Б—В—М вАФ 88%. –І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М, —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М –Є —В–Њ—З–љ–Њ—Б—В—М –і–ї—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є 6,7 –љ–Љ–Њ–ї—М/–ї –Є 6,85 –љ–Љ–Њ–ї—М/–ї —В–∞–Ї–ґ–µ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –±–ї–Є–Ј–Ї–Є–Љ–Є –Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–Є–Љ–Є (—Б–Љ. —В–∞–±–ї. 2).
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Т –љ–∞—И–µ–Љ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Ж–µ–љ–Ї–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ъ–° –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–є –Љ–µ—В–Њ–і–Њ–Љ –≠–•–Ы–Р –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –§–У–С–£ ¬Ђ–Э–Ь–Ш–¶ –Є–Љ. –Т.–Р. –Р–ї–Љ–∞–Ј–Њ–≤–∞¬ї –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –≤ —Б–≤—П–Ј–Є —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –≠–У. –Я–Њ –і–∞–љ–љ—Л–Љ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ ROC-–∞–љ–∞–ї–Є–Ј–∞, –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≠–У –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ –њ–Њ—А–Њ–≥–Њ–Љ —Г—А–Њ–≤–љ—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, —П–≤–ї—П–µ—В—Б—П –Ј–љ–∞—З–µ–љ–Є–µ 6,6 –љ–Љ–Њ–ї—М/–ї —Б —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О 93% –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О 87%. –Э–∞—И–Є –і–∞–љ–љ—Л–µ —Б–Њ–≤–њ–∞–ї–Є —Б —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –≤—Л—Б–Њ–Ї–∞—П –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ—Б—В—М –і–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б–Є–љ–і—А–Њ–Љ–∞ –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞ [18вАУ22]. –Ґ–∞–Ї, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є N. Yilmaz et al. –±—Л–ї –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ 7-–ї–µ—В–љ–Є–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ъ–° –Љ–µ—В–Њ–і–Њ–Љ –≠–•–Ы–Р –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≠–У. –С—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –і–∞–љ–љ—Л–µ –Њ —В–Њ–Љ, —З—В–Њ —В–Њ—З–Ї–∞ —А–∞–Ј–і–µ–ї–µ–љ–Є—П 0,288 –Љ–Ї–≥/–і–ї –Њ–±–ї–∞–і–∞–ї–∞ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О 89,6% –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О 81,6% –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ —Б–Є–љ–і—А–Њ–Љ–∞ –Ъ—Г—И–Є–љ–≥–∞ [18]. –Я–Њ –і–∞–љ–љ—Л–Љ K.D.S. Jarial et al., –њ–Њ—А–Њ–≥–Њ–≤–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ 10,54 –љ–Љ–Њ–ї—М/–ї –і–ї—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –Њ–±–ї–∞–і–∞–ї–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О 85,7% –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О 88,2% [22]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є, –Њ–±—А–∞—Й–∞–µ—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ —И–Є—А–Њ–Ї–Є–є —А–∞–Ј–±—А–Њ—Б –њ–Њ—А–Њ–≥–Њ–≤—Л—Е –Ј–љ–∞—З–µ–љ–Є–є, –њ—А–µ–і–ї–∞–≥–∞–µ–Љ—Л—Е —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –∞–≤—В–Њ—А–∞–Љ–Є [18, 19, 21вАУ23]. –≠—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є—П–Љ–Є –≤ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–∞—Е, –∞ —В–∞–Ї–ґ–µ –≤ –Љ–µ—В–Њ–і–Є–Ї–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є [10вАУ12].
–Т –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є –≤ –±–Њ–ї—М—И–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ъ–° –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –Љ–µ—В–Њ–і–Њ–Љ –≠–•–Ы–Р —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–Њ–≤ Elecsys 1010, Elecsys 2010, MODULAR ANALYTICS E170, Cobas e 411, Cobas e 60. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ—В–Ї—А—Л—В—Л–Љ –Њ—Б—В–∞–µ—В—Б—П –≤–Њ–њ—А–Њ—Б –Њ–± –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —В–Њ—З–Ї–Є —А–∞–Ј–і–µ–ї–µ–љ–Є—П –Ъ–° –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –Є –±–µ–Ј –Њ–ґ–Є—А–µ–љ–Є—П. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Њ–ґ–Є—А–µ–љ–Є–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –љ–µ —Г 100% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л—Е –Њ–±—Б–ї–µ–і—Г—О—В –≤ —Б–≤—П–Ј–Є —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –≠–У, –≤–Ї–ї—О—З–∞—П —В–µ—Е, —Г –Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ—Л–Љ [16вАУ19]. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ R.A. Alwani et al., —Б—А–µ–і–Є 73 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –≤ —Б–≤—П–Ј–Є —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –≠–У (—Г 53 –±—Л–ї–∞ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –±–Њ–ї–µ–Ј–љ—М –Ъ—Г—И–Є–љ–≥–∞, —Г 20 —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј ¬Ђ–њ—Б–µ–≤–і–Њ—Б–Є–љ–і—А–Њ–Љ –Ъ—Г—И–Є–љ–≥–∞¬ї), –Њ–ґ–Є—А–µ–љ–Є–µ –Є–Љ–µ–ї–Њ –Љ–µ—Б—В–Њ –≤ 60% —Б–ї—Г—З–∞–µ–≤ [19]. –Ш–Ј 249 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е D. Erickson et al., —Б–Є–љ–і—А–Њ–Љ –Ъ—Г—И–Є–љ–≥–∞ –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ —Г 47 —З–µ–ї–Њ–≤–µ–Ї, –Њ–ґ–Є—А–µ–љ–Є–µ –Є–Љ–µ–ї–Є 28 (60%) –Є–Ј –љ–Є—Е. –Р –Є–Ј 202 –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е –≠–У –љ–µ –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ, –Њ–ґ–Є—А–µ–љ–Є–µ –±—Л–ї–Њ —Г 135 (66,8%) [17]. –Я–Њ –љ–∞—И–Є–Љ –і–∞–љ–љ—Л–Љ, –Є–Ј 28 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≠–У 65% –Є–Љ–µ–ї–Є –Њ–ґ–Є—А–µ–љ–Є–µ, –∞ —Б—А–µ–і–Є 72 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е —Б–Є–љ–і—А–Њ–Љ –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞ –љ–µ –±—Л–ї –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ, –Њ–ґ–Є—А–µ–љ–Є–µ –±—Л–ї–Њ —Г 47%, —З—В–Њ –љ–µ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є—В –і–∞–љ–љ—Л–Љ –і—А—Г–≥–Є—Е –∞–≤—В–Њ—А–Њ–≤ [16вАУ19]. –Ґ–∞–Ї–ґ–µ –≤ –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г 5 (18%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≠–У –Є–Ј 28 —Г—А–Њ–≤–µ–љ—М –Ъ–° –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П –Њ–Ї–∞–Ј–∞–ї—Б—П –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ 6,7вАУ9,4 –љ–Љ–Њ–ї—М/–ї, —Г 3 –Є–Ј –љ–Є—Е –Є–Љ–µ–ї–Њ –Љ–µ—Б—В–Њ –Њ–ґ–Є—А–µ–љ–Є–µ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –≠–У —В–Њ—З–Ї–Є —А–∞–Ј–і–µ–ї–µ–љ–Є—П, –њ–Њ–ї—Г—З–µ–љ–љ–Њ–є –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П —Б–њ–Њ—А–љ—Л–Љ.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ц.–Х. –С–µ–ї–Њ–є –Є —Б–Њ–∞–≤—В. –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –≠–У —В–∞–Ї–ґ–µ –±—Л–ї–∞ –њ–Њ–ї—Г—З–µ–љ–∞ —В–Њ—З–Ї–∞ —А–∞–Ј–і–µ–ї–µ–љ–Є—П 6,85 –љ–Љ–Њ–ї—М/–ї, –Ї–Њ—В–Њ—А–∞—П —Г –ї–Є—Ж —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –Ш–Ь–Ґ –њ–Њ–Ї–∞–Ј–∞–ї–∞ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М 91,1% –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М 96,9%, –∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ вАФ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М 91,1% –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М 84,6% [15]. –Ф–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –≠–У —Б—А–µ–і–Є –ї–Є—Ж —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М —В–Њ—З–Ї–Є —А–∞–Ј–і–µ–ї–µ–љ–Є—П 9,4 –љ–Љ–Њ–ї—М/–ї —Б–Њ—Б—В–∞–≤–Є–ї–Є 84,4% –Є 97,9% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [15]. –Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —В–Њ—З–Ї–∞ —А–∞–Ј–і–µ–ї–µ–љ–Є—П 6,85 –љ–Љ–Њ–ї—М/–ї –Є —В–Њ—З–Ї–∞ —А–∞–Ј–і–µ–ї–µ–љ–Є—П 6,7 –љ–Љ–Њ–ї—М/–ї –њ–Њ–Ї–∞–Ј–∞–ї–Є –Њ—З–µ–љ—М –±–ї–Є–Ј–Ї–Є–µ —Б–Њ –Ј–љ–∞—З–µ–љ–Є–µ–Љ 6,6 –љ–Љ–Њ–ї—М/–ї —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М (89% –Є 88% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –і–ї—П –Њ–±–Њ–Є—Е –Ј–љ–∞—З–µ–љ–Є–є, –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б 93% –Є 87% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –і–ї—П —В–Њ—З–Ї–Є —А–∞–Ј–і–µ–ї–µ–љ–Є—П 6,6 –љ–Љ–Њ–ї—М/–ї). –Ф–ї—П —Н—В–Є—Е –Ј–љ–∞—З–µ–љ–Є–є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П 9,4 –љ–Љ–Њ–ї—М/–ї. –Я–Њ –і–∞–љ–љ—Л–Љ –Ц.–Х. –С–µ–ї–Њ–є –Є —Б–Њ–∞–≤—В., —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –і–ї—П —В–Њ—З–Ї–Є —А–∞–Ј–і–µ–ї–µ–љ–Є—П 9,4 –љ–Љ–Њ–ї—М/–ї –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –і–Њ–≤–Њ–ї—М–љ–Њ –љ–Є–Ј–Ї–Њ–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –њ–Њ—А–Њ–≥–Њ–≤—Л–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є (–∞ –Є–Љ–µ–љ–љ–Њ 84,4%) –Ї–∞–Ї –і–ї—П –ї–Є—Ж —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ, —В–∞–Ї –Є –і–ї—П –ї–Є—Ж —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –Ш–Ь–Ґ [15]. –° —Г—З–µ—В–Њ–Љ —В–Њ–≥–Њ, —З—В–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, —П–≤–ї—П–µ—В—Б—П —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –≠–У, –≤—Л—Б–Њ–Ї–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Љ–µ—В–Њ–і–∞ –Њ—З–µ–љ—М –≤–∞–ґ–љ–∞, —В. –Ї. –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –њ—А–Є –µ–≥–Њ –љ–∞–ї–Є—З–Є–Є, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є, —В–Њ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–Њ–µ —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є [1, 6], –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–Є—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –Є –Є—Б–Ї–ї—О—З–Є—В—М –і–Є–∞–≥–љ–Њ–Ј –≠–У.
–Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —В–Њ—З–Ї–Є —А–∞–Ј–і–µ–ї–µ–љ–Є—П 6,6 –љ–Љ–Њ–ї—М/–ї –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ 3 –ї–Њ–ґ–љ–Њ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–∞. –Т 2 —Б–ї—Г—З–∞—П—Е –≠–У –±—Л–ї –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г—А–Њ–≤–љ—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ —Б—Г—В–Њ—З–љ–Њ–є –Љ–Њ—З–µ, –Ь–Ф–Я –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ъ–°–Ъ –≤ –њ–Њ–ї–љ–Њ—З—М. –Т –Њ–±–Њ–Є—Е —Б–ї—Г—З–∞—П—Е —Н—В–Њ –±—Л–ї–Є –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б –±–Њ–ї–µ–Ј–љ—М—О –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞ —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ –Ш–Ь–Ґ. –Т 1 —Б–ї—Г—З–∞–µ –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–∞ –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–∞ –∞–≤—В–Њ–љ–Њ–Љ–љ–∞—П –њ—А–Њ–і—Г–Ї—Ж–Є—П –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞–Љ–Є, —З—В–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –і–∞–љ–љ—Л–µ –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є–µ –Њ —В–Њ–Љ, —З—В–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ъ–° –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П –Њ–±–ї–∞–і–∞–µ—В –љ–Є–Ј–Ї–Њ–є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –∞–≤—В–Њ–љ–Њ–Љ–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ [24]. –Ґ–∞–Ї, –≤ —А–∞–±–Њ—В–µ I. Kuzu et al. –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М —Н—В–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Ъ—Г—И–Є–љ–≥–∞ (–≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Н—В–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ –љ–∞–Ј—Л–≤–∞—О—В –∞–≤—В–Њ–љ–Њ–Љ–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–µ–є –Ї–Њ—А—В–Є–Ј–Њ–ї–∞) —Б–Њ—Б—В–∞–≤–ї—П–µ—В 60% [24].
–Ґ–∞–Ї–ґ–µ –≤ –љ–∞—И–µ–є —А–∞–±–Њ—В–µ —Г 7 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ —Г—А–Њ–≤–љ—П –Ъ–° –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л. –Я—А–Є—З–Є–љ—Л –ї–Њ–ґ–љ–Њ–≥–Њ –њ–Њ–≤—Л—И–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ъ–° –Є–Ј–≤–µ—Б—В–љ—Л –Є –Њ–њ–Є—Б–∞–љ—Л —А–∞–љ–µ–µ [7вАУ9]. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –љ–µ –≤—Б–µ–≥–і–∞ —Г–і–∞–µ—В—Б—П –Є—Б–Ї–ї—О—З–Є—В—М –≤—Б–µ –Є–Ј –љ–Є—Е, –Њ—Б–Њ–±–µ–љ–љ–Њ —Н—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є –Ї–Њ–љ—В–∞–Љ–Є–љ–∞—Ж–Є–Є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –Ї—А–Њ–≤–Є, —З—В–Њ –Љ–Њ–ґ–µ—В –љ–µ –Њ–њ—А–µ–і–µ–ї—П—В—М—Б—П –≤–Є–Ј—Г–∞–ї—М–љ–Њ, –љ–Њ –њ—А–Є–≤–Њ–і–Є—В—М –Ї –ї–Њ–ґ–љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—О –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Ъ–°. –Э–∞–ї–Є—З–Є–µ –≤ –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –ї–Њ–ґ–љ–Њ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –Є –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –∞–љ–∞–ї–Є–Ј–∞ —Г—А–Њ–≤–љ—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –≠–У –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–Є –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є —Б–Є–љ–і—А–Њ–Љ–∞ –Ш—Ж–µ–љ–Ї–Њ вАФ –Ъ—Г—И–Є–љ–≥–∞ –Ї–∞–Ї –Љ–Є–љ–Є–Љ—Г–Љ –і–≤—Г—Е —В–µ—Б—В–Њ–≤ [1, 6].
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—И–µ–є —А–∞–±–Њ—В—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ–Љ –љ–∞ –≠–У –і–ї—П –Њ—Ж–µ–љ–Ї–Є —Г—А–Њ–≤–љ—П –Ъ–°, —Б–Њ–±—А–∞–љ–љ–Њ–є –≤ –њ–Њ–Ј–і–љ–µ–µ –≤–µ—З–µ—А–љ–µ–µ –≤—А–µ–Љ—П, –±–Њ–ї–µ–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —В–Њ—З–Ї–Є —А–∞–Ј–і–µ–ї–µ–љ–Є—П, –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –і–ї—П –ї–Є—Ж —Б —А–∞–Ј–ї–Є—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞, –≤–Ї–ї—О—З–∞—П –љ–Њ—А–Љ–∞–ї—М–љ—Г—О –Љ–∞—Б—Б—Г —В–µ–ї–∞, –Є–Ј–±—Л—В–Њ—З–љ—Г—О –Љ–∞—Б—Б—Г —В–µ–ї–∞ –Є –Њ–ґ–Є—А–µ–љ–Є–µ. –Я–Њ –љ–∞—И–Є–Љ –і–∞–љ–љ—Л–Љ, —В–∞–Ї–Њ–є —В–Њ—З–Ї–Њ–є —П–≤–ї—П–µ—В—Б—П 6,6 –љ–Љ–Њ–ї—М/–ї, –≤–Љ–µ—Б—В–µ —Б —В–µ–Љ –њ–Њ—А–Њ–≥–Њ–≤—Л–µ –Ј–љ–∞—З–µ–љ–Є—П 6,7 –љ–Љ–Њ–ї—М/–ї –Є 6,85 –љ–Љ–Њ–ї—М/–ї –Љ–∞–ї–Њ —Г—Б—В—Г–њ–∞—О—В –≤ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є –Є —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –≠–У.












