Введение
В современных условиях развития фармацевтических препаратов, когда врачу предлагается широкий выбор лекарственных средств для лечения того или иного вида патологии, особенно важно делать выбор в пользу лекарства с доказанными эффективностью и безопасностью. Это заложено в принципах доказательной медицины, основой которых является последовательный научный подход на всех уровнях разработки лекарственного препарата, включая предрегистрационный этап и этап экспертизы.Основой предрегистрационного этапа исследований служат изучение физико-химических свойств и активности препарата в отношении этиологических, патогенетических механизмов заболевания, изучение лиганд-рецепторного взаимодействия in vitro, исследование лекарственного средства на моделях животных. Завершающим этапом являются клинические исследования (КИ) на здоровых добровольцах и больных людях [1, 2]. При этом именно проведение КИ позволяет наиболее достоверно оценить прогнозируемую эффективность работы лекарственного препарата у больных и безопасность его применения.
Основой экспертизы доказанности эффективности и безопасности лекарственного препарата является экспертиза «польза – риск» [3, 4]. На основании всех проведенных in vitro и in vivo исследований, а также КИ на здоровых добровольцах и пациентах делается вывод о том, не превышает ли риск возникновения нежелательных реакций от использования препарата при каждом показании в инструкции по медицинскому применению (ИМП) пользу. Если риск превышает пользу или это невозможно оценить, такой препарат не будет одобрен Минздравом для регистрации в качестве лекарственного средства. Разработчику будет возвращено досье на доработку препарата с рекомендациями расширить доказательную базу за счет проведения дополнительных тестов, доклинических исследований или КИ.
Такой подход в Российской Федерации был введен Федеральным законом № 61-ФЗ «Об обращении лекарственных средств». Впервые на законодательном уровне введены понятия качества лекарственного средства (соответствие лекарственного средства требованиям фармакопейной статьи либо – в случае ее отсутствия – нормативной документации или нормативного документа), безопасности лекарственного средства (характеристика лекарственного средства, основанная на сравнительном анализе его эффективности и риска причинения вреда здоровью) и эффективности лекарственного препарата (характеристика степени положительного влияния лекарственного препарата на течение, продолжительность заболевания или его предотвращение, реабилитацию, на сохранение, предотвращение или прерывание беременности). Также одним из требований законодательства стало обязательное проведение КИ или его части, если это международное многоцентровое КИ, на территории РФ с участием отечественных клинических центров [5]. Это заложило основу развития фармацевтической отрасли в РФ в соответствии с принципами доказательной медицины, что позволит практикующим врачам-клиницистам делать выбор в пользу лучших препаратов.
Одним из существенных прорывов в области доказательной медицины в РФ стали разработка и принятие пакета документов, регулирующих изучение и регистрацию фармацевтических препаратов Евразийской экономической комиссией (ЕАЭК) [6]. Основой рекомендаций, принятых ЕАЭК, служат принципы Международной конференции по гармонизации технических требований регистрации фармацевтических препаратов (International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH)) и нормативные документы Европейского медицинского агентства (European Medicines Agency (EMA)). В первый пакет документов, утвержденный 3 ноября 2016 г., вошли Правила надлежащей клинической практики (с интегрированными требованиями к структуре и содержанию отчета о КИ, представлению информации по безопасности в ходе КИ, периодическому отчету по безопасности разрабатываемого лекарственного препарата и др.), Правила проведения исследований биоэквивалентности лекарственных препаратов (с интегрированными требованиями к фармакодинамическим исследованиям в рамках изучения биоэквивалентности и др.), Правила о надлежащей практике фармаконадзора, Правила проведения исследований биологических лекарственных средств и другие документы. Официально нормативная база регулирования обращения лекарств в РФ была ратифицирована 6 мая 2017 г. При этом был предусмотрен переходный период, обеспечивающий переход от национального регулирования (ФЗ № 61-ФЗ) к единому регулированию стран ЕАЭС. Так, до 31 декабря 2020 г. фармпроизводитель имеет право выбрать, по каким правилам (национальным или единым) будет осуществляться регистрация препаратов. Однако все препараты, которые были или будут зарегистрированы по национальным правилам до 31 декабря 2020 г., должны пройти перерегистрацию по правилам единого рынка до 31 декабря 2025 г. Этим заложена прочная основа, обеспечивающая как выведение эффективных и безопасных лекарств в будущем, так и санацию фармацевтического рынка, удаление с него препаратов, эффективность и безопасность которых не полностью изучены.
Клинические исследования оригинальных препаратов
Оригинальный (референтный) лекарственный препарат – это лекарственный препарат, который впервые зарегистрирован в Российской Федерации, качество, эффективность и безопасность которого доказаны на основании результатов доклинических исследований лекарственных средств и КИ (ФЗ № 61-ФЗ). При этом часть КИ должны пройти на территории РФ. Такой подход позволяет отечественному регуляторному органу следить за качеством проводимых регистрационных КИ и не выпустить на рынок препараты, изучение эффективности и безопасности которых проводилось в странах с менее строгими регуляторными требованиями.Программа КИ оригинальных препаратов зависит от многих факторов, в т. ч. от предполагаемого механизма действия, показаний, нежелательных реакций и др. Но в целом подход должен включать в себя следующие шаги [1]:
1. Изучение фармакологических свойств у человека (часто этот этап называют I фазой):
a. Оценка переносимости, в т. ч. исследования переносимости различных доз.
b. Оценка метаболизма лекарственного средства и лекарственных взаимодействий: определение/описание фармакокинетики (ФК) и фармакодинамики (ФД), в т. ч. исследование ФК и/или ФД при однократном и многократном введении.
c. Оценка активности, в т. ч. исследование лекарственных взаимодействий.
2. Поисковые терапевтические (II фаза):
a. Поисковое применение по целевому показанию.
b. Подбор дозы для последующих исследований.
c. Получение исходных данных для подбора дизайна, конечных точек и методологии подтверждающих исследований.
3. Подтверждающие терапевтические (исследования III фазы):
a. Подтверждение/доказательство эффективности.
b. Установление профиля безопасности.
c. Получение необходимых данных для оценки отношения пользы к риску в целях обоснования регистрации.
d. Установление зависимости «доза – эффект».
Проведение каждой фазы КИ в соответствии с современными научными взглядами и регуляторными требованиями требует огромных инвестиций времени, финансов и человеческих ресурсов. В исследовании принимает участие группа медицинских научных экспертов, которые разрабатывают программу и протокол КИ, следят за его проведением с научной точки зрения. Группа клинических операций во главе с проектным менеджером непосредственно занимается подбором и управлением центрами КИ. Менеджеры по управлению данными (Data management) формируют клиническую базу данных (БД), куда стекается вся информация из центров, осуществляют чистку БД и передают ее группе биостатистиков, которые проводят статистический анализ для медицинских научных экспертов. При этом используются самые современные материалы, оборудование и программное обеспечение, целью которых является обеспечение целостности получаемых данных и невозможности осуществить коррекцию (подделку) на любом этапе получения.
Результатом программы КИ является формирование регистрационного досье с последующей подачей в регуляторные органы для получения регистрационного удостоверения (РУ).
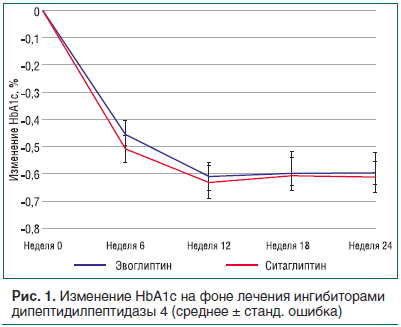
Так, для выведения препарата эвоглиптин (новый препарат класса ингибиторов дипептидилпептидазы 4 типа) на международный рынок было проведено 8 КИ [7], в т. ч. 4 КИ I фазы, где были изучены биодоступность, метаболизм, экскреция, межлекарственные взаимодействия с препаратами различных групп, ФК у пациентов с нарушениями функции почек. Были выполнены поисковое исследование II фазы и 2 КИ III фазы, где были изучены эффективность и безопасность в широкой популяции (281 человек), включая российских пациентов. При проведении КИ на территории РФ в трех исследовательских центрах были успешно пройдены международный аудит и одна инспекция Росздравнадзора. Результаты данного КИ показали, что эвоглиптин эффективен в отношении снижения уровня гликированного гемоглобина после перорального применения в дозе 5 мг 1 раз в день в течение 24 нед. Снижение уровня HbA1c составило (в %) -0,58 ± 0,70 от исходного уровня, что было сопоставимо с данными, полученными на фоне терапии уже существующим на рынке и активно применяемым в клинической практике ситаглиптином – -0,61 ± 0,66 (рис. 1).
В последние десятилетия наблюдается всплеск в области разработки и регистрации биологических препаратов, в т. ч. для лечения СД. Среди них аналоги инсулина и их смеси, агонисты глюкагоноподобного пептида-1 (аГПП-1), смеси аналогов инсулина с аГПП-1 и др. [8, 9].
Биологические лекарственные препараты – лекарственные препараты, действующее вещество которых произведено или выделено из биологического источника и для определения свойств и качества которых необходима комбинация биологических и физико-химических методов [5]. По сравнению с так называемыми small molecules (низкомолекулярными препаратами) биологические препараты – высокомолекулярные. У них намного более сложное строение, поскольку чаще всего они имеют пептидную, полипептидную или белковую природу. Тем не менее этапы клинической разработки коренным образом не отличаются от таковых у small molecules: КИ фармакологии (I фаза), поисковые исследования II фазы и регистрационные исследования эффективности и безопасности III фазы.
Клинические исследования воспроизведенных препаратов
Воспроизведенный лекарственный препарат (ВЛП) – это лекарственный препарат, который имеет такой же качественный и количественный состав действующих веществ в такой же лекарственной форме, что и референтный лекарственный препарат, и биоэквивалентность или терапевтическая эквивалентность которого референтному лекарственному препарату подтверждена соответствующими исследованиями [5].Как и в случае с оригинальными препаратами, существуют низкомолекулярные и высокомолекулярные ВЛП. Однако подходы к КИ в данном случае будут абсолютно разными. Основной задачей разработчика ВЛП является доказательство сходства с оригинальным. При этом возможность доказательства сходства small molecules намного проще по сравнению с биологическими препаратами. Рассмотрим отдельно программу КИ для дженериков (низкомолекулярных ВЛП) и биоаналогов (биосимиляров – высокомолекулярных ВЛП).
Клинические исследования низкомолекулярных ВЛП
Подход к разработке дженериков значительно проще, чем оригинальных препаратов. Не требуются прогнозирование эффективности, изучение механизма действия, подбор терапевтических доз, модификации пути доставки в организм и т. д., поскольку это уже было сделано на этапе разработки оригинального (референтного) препарата.Тем не менее для выпуска препарата производитель должен предоставить доказательства того, что дженерик также эффективен и безопасен, как оригинальный препарат. Для этого нужно последовательно подтвердить идентичность структуры действующего вещества (ДВ) и биоэквивалентность (эквивалентную биодоступность) препаратов [10].
Подтверждение структуры ДВ для сахароснижающих препаратов, например, метформина, как и для остальных малых молекул, полученных химических синтезом, как правило, не вызывает проблем. Во-первых, чаще всего все реакции синтеза препарата после окончания действия патента становятся общедоступными, что позволяет воспроизвести оригинальный препарат [11]. Во-вторых, при современном уровне развития аналитических методик (например, высокоэффективная жидкостная хроматография в сочетании с тандемной масс-спектрометрией или аналогичные методики) конечный продукт с высокой степенью точности может быть сравнен с оригиналом, что в результате и служит основой доказательности идентичности ДВ препаратов [12].
На следующем этапе необходимо доказать биоэквивалентность препаратов. Лекарственные средства биоэквивалентны тогда, когда обладают схожей биодоступностью, т. е. одинаковой степенью и кинетикой адсорбции из лекарственного препарата с последующей доступностью в месте своего действия. Если это так, то и действовать они будут одинаково, поскольку эффективность лекарственного препарата в первую очередь определяет содержащееся в нем ДВ [5]. ДВ Глюкофажа – метформин (метформина гидрохлорид), который, попадая в организм, оказывает терапевтическое действие, в результате чего достигается снижение уровня глюкозы в крови.
Биодоступность препарата в основном определяется качественным и количественным составом вспомогательных веществ [13]. В зависимости от вспомогательных веществ таблетка может раствориться в желудочно-кишечном тракте раньше или позже, чем оригинальный препарат. Кроме того, вспомогательные вещества могут блокировать всасывание ДВ, действуя на стенку желудочно-кишечного тракта. В результате существует высокий риск получения разных концентраций ДВ в крови, сопровождающийся снижением терапевтического эффекта (если концентрации ДВ дженерика ниже оригинального) или токсическим действием (если концентрации ДВ дженерика выше оригинального). Если биодоступность существенно не отличается, то препараты признаются биоэквивалентными. По этой причине все возможности влияния вспомогательных веществ препарата должны быть тщательно проанализированы на этапе разработки.
На основании известных ФК данных выбираются временные точки забора крови для определения ДВ. Точное количество добровольцев (от 18 до 50 и более) рассчитывается на основании вариабельности препаратов [14]. Также определяется, следует провести исследование натощак или после еды. Как правило, проводят в одном состоянии (натощак), этого достаточно с регуляторной точки зрения. Тем не менее пища или ее отсутствие могут по-разному влиять на биодоступность препаратов, что особо важно учитывать для антидиабетических средств [15].
Добровольцы, соответствующие критериям включения/невключения, получают один из препаратов (тестируемый препарат – дженерик или препарат сравнения – оригинальный/референтный), и по определенным временным точкам (15–20 точек) производится забор крови для анализа концентрации ДВ в течение 24–48 или 2 ч. Точки забора крови специально рассчитываются для дальнейшей точной оценки концентраций препарата в крови. Общий объем кровопотери за исследование обычно не превышает 350 мл.
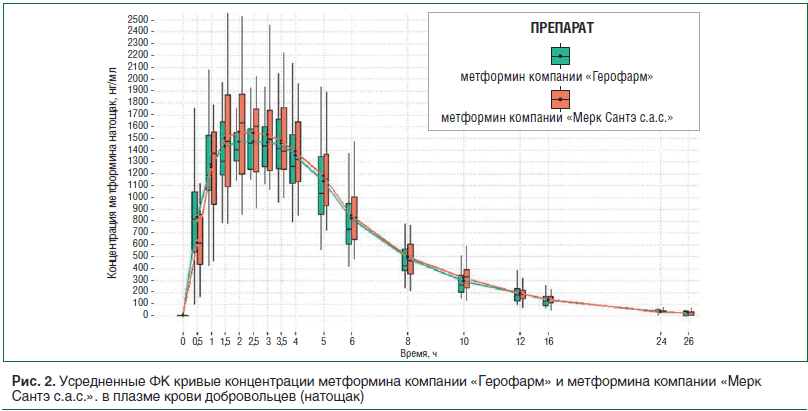
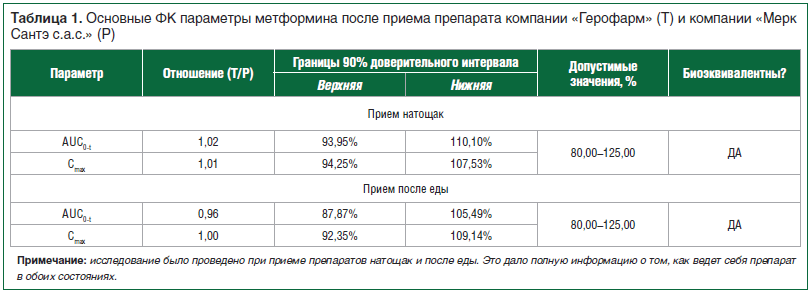
По результатам анализа данных лаборатории строят усредненный график ФК профиля препаратов и рассчитывают основные ФК показатели: AUC (площадь под ФК кривой концентрация – время) и Cmax – максимальная концентрация препарата. Для признания препаратов биоэквивалентными доверительные интервалы отношений AUC и Cmax тестируемого препарата (T) к референтному (Р) препарату должны укладываться в допустимые интервалы (чаще всего от 80 до 125) [10]. Кроме того, следует учитывать и само отношение Т/Р. Оно показывает, насколько близок дженерик к воспроизведенному препарату. При отношении «1» препараты практически идентичны. Правда, стоит отметить, что отношение «1» не всегда наблюдается даже при сравнении разных серий оригинального препарата между собой. На рисунке 2 и в таблице 1 приведены данные исследования биоэквивалентности препарата метформин компании «Герофарм» с препаратом сравнения метформин компании «Мерк Сантэ с.а.с.». Из приведенных данных видно, что ФК профили как графически, так и объективно совпадают с таковыми референтного препарата, что позволяет сделать вывод об их биоэквивалентности.
Клинические исследования высокомолекулярных ВЛП на примере биоаналогов (биосимиляров) инсулина
Воспроизведение биологических препаратов (пептидов, полипептидов, белков) – намного более сложный процесс по сравнению со small molecules [16–20]. Это исходит из сложности как структуры биологической молекулы, так и технологического процесса ее получения. В таблице 2 приведены основные отличия дженериков от биосимиляров.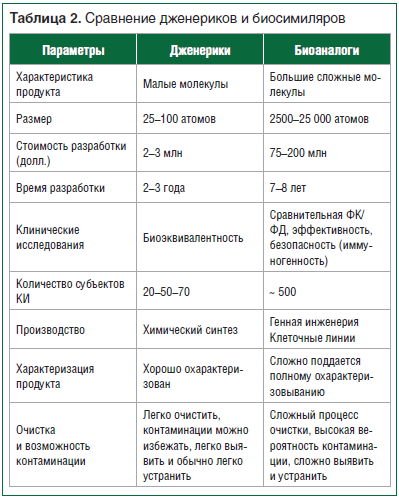
В соответствии с этим отличаются и программы КИ. Для успешного выведения на рынок биоаналогов, например, линейки инсулинов (генно-инженерные инсулины человека и аналоги инсулина человека), необходимо провести комплекс испытаний, которые доказывают их эффективность и подобие (эквивалентность) оригинальному препарату. При этом изучение и сравнение проводятся поэтапно. Цель таких сравнительных исследований – выявить отличия от оригинальных препаратов. Если на определенном этапе существенно значимых различий не выявляется, то препарат переходит на следующий уровень изучения [21].
На первом этапе необходимо доказать отсутствие различий физико-химических свойств разрабатываемого инсулина и оригинального препарата. Проводится изучение состава, физических свойств, первичной, вторичной и третичной структуры, родственных соединений и примесей, производственных примесей, N- и C-концевых последовательностей, свободных SH-групп и дисульфидных мостиков и т. д. После этого, на втором этапе проводятся in vitro фармакодинамические исследования. Среди них – связывание с инсулиновыми рецепторами (в т. ч. кинетика включения-выключения), биологическая активность: аутофосфорилирование рецептора и метаболическая активность. Для изучения метаболической активности применяются методы образования гликогена, липогенез, ингибирование стимулированного липолиза, транспорт глюкозы и т. д. На третьем этапе проводится изучение биосимиляров инсулина на человеке – КИ.
Цель КИ – доказать эффективность и безопасность применения биосимиляров инсулина у человека. Как правило, проводятся 2 исследования: 1) изучение фармакологии инсулина, результаты которого могут быть экстраполированы на эффективность, 2) изучение иммуногенности и безопасности инсулина.
«Золотым стандартом» изучения фармакологии инсулина является проведение гиперинсулинемических эугликемических клэмпов [3, 22–25]. Проведение клэмпов обязательно для выведения препаратов инсулина на рынок в Европе, США и других странах с высоким уровнем регуляторных требований. В таком клэмп-исследовании в условиях стационара под присмотром команды врачей-исследователей добровольцам (здоровым или больным СД 1-го типа) вводится поочередно с перерывом в 1–2 нед. тестируемый и референтный инсулин. Задачей такого рода исследований является удержание уровня гликемии в определенном диапазоне независимо от введенного препарата. После начала действия инсулина у добровольца начинает снижаться уровень глюкозы в плазме крови. Для того чтобы не допустить падения до неприемлемого уровня и «зажать» уровень глюкозы крови в определенных рамках, исследователь начинает внутривенное введение глюкозы с определенной скоростью. По мере усиления действия инсулина (вплоть до достижения пика действия) скорость инфузии глюкозы (СИГ) увеличивается. Основная задача клинической команды при этом – поддерживать уровень глюкозы крови в заранее заданных пределах, например, 4,5–5,5 ммоль/л. Когда инсулин прекращает свое действие, исследователь постепенно снижает СИГ до полной отмены.
Изменение СИГ на фоне введенного инсулина отражает выраженность его действия. Основными изучаемыми фармакодинамическими параметрами будут: площадь под ФД-кривой «время – эффект» (СИГ) с момента введения до окончания клэмп-исследования в момент t (СИГ-AUC0–t) для ультракоротких и коротких инсулинов, площадь под кривой СИГ для времени интервала дозирования (СИГ-AUC0–τ) для базальных и средней продолжительности действия инсулинов, а также максимальная СИГ (СИГmax) для ультракоротких, коротких и средней продолжительности действия инсулинов. Другими значимыми конечными ФД показателями являются: время начала действия и время достижения максимальной СИГ (Т СИГmax) для препаратов инсулина и аналогов инсулина человека ультракороткого, короткого и средней продолжительности действия и СИГ-AUC за определенные временные промежутки, имеющие значение для соответствующего препарата инсулина.
Параллельно проводятся заборы крови у добровольцев для определения концентрации инсулина в крови (ФК). Основные конечные ФК показатели в зависимости от типа изучаемого инсулина: AUC0–t – площадь под ФК-кривой «концентрация – время» с момента введения до окончания клэмп-исследования в момент t или AUC0–τ – площадь под ФК-кривой «концентрация – время» для времени интервала дозирования; Cmax – максимальная концентрация инсулина в плазме крови. Дополнительные конечные ФК показатели: AUC0–∞ – площадь под ФК-кривой «концентрация – время», экстраполированная на бесконечное время; частичные AUC (имеющие значение для соответствующего инсулина); Tmax – время достижения максимальной концентрации инсулина в плазме крови; T1/2 – период полувыведения инсулина из плазмы крови.
Таким образом, в одном исследовании на одной популяции в 20–50 человек одновременно изучаются зависимость «концентрация – время» и «эффект – время» тестируемого и референтного инсулинов. Это позволяет с высокой точностью изучить действие инсулина и доказать его аналогичность референтному препарату. При этом полученные ФК и ФД профили инсулина экстраполируются на в/в путь введения, если он предусмотрен для данного препарата инсулина или аналога инсулина человека, проведение дополнительных отдельных фармакологических исследований при его в/в введении не требуется [21, 25].
Клэмпы – технически сложные и наукоемкие исследования, для проведения которых необходимы глубокие знания физико-химических и биологических свойств продукта, клинической фармакологии, регуляторных требований и стандартов проведения КИ. Все клэмпы должны проводиться высококвалифицированными профессионалами в профильных клиниках. Инсулины компании «Герофарм» проходят изучение их фармакологических свойств в ведущих клиниках РФ: ФГБУ «НМИЦ эндокринологии» Минздрава России (Москва) и ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России (Санкт-Петербург). Компания осуществила значительные инвестиции в обучение и техническое оснащение клинических центров для проведения клэмпов на уровне мировых стандартов.
На данный момент (январь 2018 г.) были успешно окончены клэмпы следующих препаратов: инсулин лизпро, раствор для подкожного введения, инсулин лизпро двухфазный 25, суспензия для подкожного введения, инсулин человеческий генно-инженерный микс 30/70, суспензия для подкожного введения. На рисунках 3, 4 и в таблице 3 представлены сравнительные ФК/ФД данные препарата инсулин лизпро двухфазный 25, суспензия для подкожного введения, 100 МЕ/мл ОАО «Герофарм-Био» (Россия) и «Лилли Франс С.а.С.» (Франция) с использованием метода гиперинсулинемического эугликемического клэмпа на здоровых добровольцах. Из приведенных данных видно, что ФК и ФД профили совпадают с таковыми референтного препарата, что позволяет сделать вывод об их биоэквивалентности. В настоящее время продолжаются клэмп-исследования других форм генно-инженерного инсулина человека и аналогов инсулина.
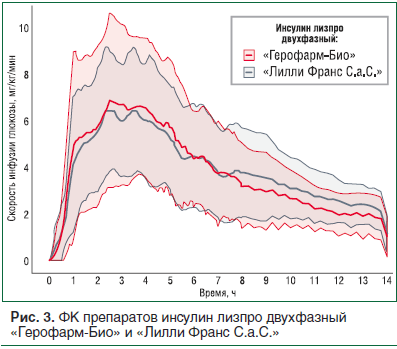
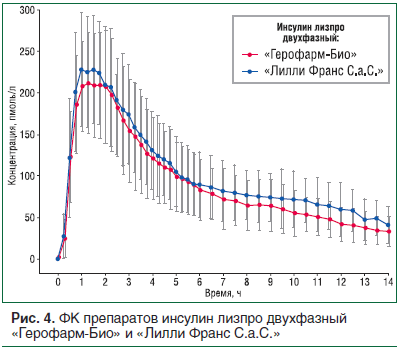
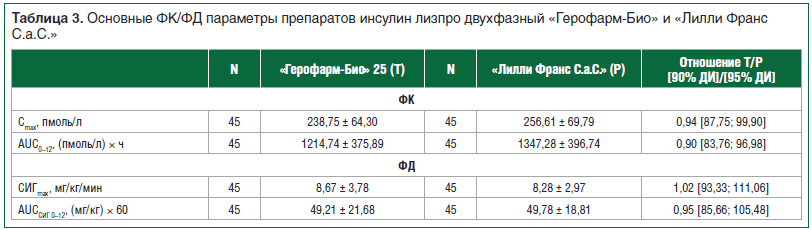
В соответствии с руководствами изучения биоаналогов проводить отдельные исследования эффективности не требуется, поскольку конечные точки, изучаемые в этих исследованиях (обычно это HbA1с), считаются недостаточно чувствительными для выявления потенциальных клинически значимых различий между двумя инсулинами. В то же время фармакодинамические данные, полученные во время клэмп-исследований, могут быть экстраполированы на эффективность препарата [21, 25].
Изучение безопасности инсулина представляет собой многоцентровые исследования (10–20 центров) с популяцией 150–400 больных СД 1-го или 2-го типа. Больные проходят лечение тестируемым инсулином или соответствующим препаратом сравнения в течение не менее 6 мес. Собирается кровь на изучение титра антител, концентрации инсулина в крови, гликированного гемоглобина. Эти исследования позволяют окончательно убедиться в безопасности и эффективности препарата для выведения на рынок и рекомендации его применения в рутинной практике [23, 24, 26].
Комплекс КИ в совокупности с предварительным изучением физико-химических свойств и биологической активности позволяет с высокой достоверностью подтверждать эффективность и безопасность линейки инсулинов компании и доказать отсутствие отличий продуктов компании от зарубежных аналогов.












