Введение
Всестороннее обеспечение пациентов необходимой медицинской помощью — ключевая задача системы здравоохранения. Повышение доступности медицинской помощи и медикаментов является первым шагом на пути к достижению глобальной цели — улучшению здоровья пациентов и снижению для них финансового бремени [1].
Инновации являются основным двигателем медицинской науки, однако сложный производственный процесс, программы клинических исследований значительно удорожают стоимость препаратов, что приводит к дополнительной финансовой нагрузке на систему здравоохранения и пациен та. Назначение дорогостоящего оригинального препарата снижает приверженность лечению в 2–3 раза в сравнении с более «экономичным» подобным препаратом, приводя в итоге к отказу от лечения [2]. Биосимиляры оригинальных препаратов, в частности аналогов инсулина, производящиеся после окончания срока патента на оригинальные препараты, позволяют расширить доступ к высокотехнологичным препаратам широким слоям населения [3, 4].
В настоящее время понятие биоаналоговых (биоподобных) лекарственных препаратов (биосимиляров) закреплено в Федеральном законе «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ [5].
Процесс доказательства биоэквивалентности биосимиляра и оригинального (референтного) препарата на доклиническом и клиническом этапах регламентирован Правилами проведения исследований биологических лекарственных средств Евразийского экономического союза на оснЦ eвании международных документов (Всемирной организации здравоохранения, Международной конференции по гармонизации технических требований при регистрации лекарственных препаратов по медицинскому применению, Европейского агентства по лекарственным средствам) [6, 7] и обязателен к исполнению для компаний, производящих биоподобные препараты.
При доказательстве биоэквивалентности инсулинов на доклиническом этапе проводят оценку физико-химических характеристик молекулы, включающих аминокислотную последовательность, размер, заряд, изоэлектрическую точку и гидрофобность, посттрансляционные модификации, данные о конформации макромолекул, степень контаминации и виды контаминантов.
В целях выявления различий в свойствах биосимиляров и референтных лекарственных препаратов проводятся с f0авнительные испытания in vitro на связывание с рецептором инсулина с оценкой аутофосфорилирования рецептора и его метаболической активности, включая связь с инсулиноподобным фактором роста 1, а также испытания на последующую биологическую активность.
При доклиническом исследовании биоанало гичного инсулина или аналога инсулина проведение исследований фармакологической безопасности, репродуктивной токсичности и канцерогенности не требуется [7].
Клиническую эквивалентность оценивают в ходе двойного слепого гиперинсулинового эугликемического клэмп-исследования при однократном подкожном введении биоаналогичного (биоподобного) и оригинального (референтного) инсулина отмывочной фазой. В ходе исследования изучаются профили «время — концентрация» и «время — действие», отражающие фармакокинетику и фармакодинамику препарата соответственно [7]. Данные исследований, проведенных компаниями — производителями биосимиляров, публикуются и находятся в открытом доступе [8, 9].
При доказанной биоэквивалентности все показания, противопоказания, нежелательные реакции у особых групп пациентов (пожилых, детей, беременных, с недостаточностью функции почек, печени и т. д.) экстраполируются на биосимиляр из инструкции по медицинскому применению референтного препарата. Клинические исследования биосимиляров на детях не проводятся ни в Российской Федерации, ни в странах Евросоюза и США, имеющих высокий уровень регулирования [6, 10].
Особое внимание при производстве биосимиляров инсулинов уделяется иммуногенности, которая исследуется на этапе доклинического доказательства биоэквивалентности с помощью физико-химических тестов, включающих анализ структуры молекулы, примесей и вспомогательных веще ств, являющихся препарат-ассоциированными факторами [6, 7, 11].
Далее иммуногенная безопасность доказывается в ходе III фазы клинических исследований биоподобных инсулинов [12–14].
Компания «Герофарм» является одним из ведущих производителей биоподобных инсулинов в мире [15]: биосимиляры инсулина лизпро (РинЛиз®), инсулина аспарт (РинФаст®), инсулина гларгин (РинГлар®), а также биосимиляры инсулиновых аналогов лизпро двухфазный 25/75 (РинЛиз® Микс 25) и аспарт двухфазный 30/70 (РинФаст® Микс 30) выпускаются как в катриджах, так и в предварительно заполненных шприц-ручках.
Компания «Герофарм» имеет полный цикл производства — от синтеза молекул до разработки готовой лекарственной формы, а также организует проведение доклинических и клинических исследований. Производство фармацевтических субстанций и лекарственных препаратов соответствует требованиям GMP и ISO 9001 [16].
Биоэквивалентность, эффективность, безопасность, в том числе в отношении иммуногенности, всех производимых компанией биосимиляров инсулиновых аналогов доказаны в соответствии с регуляторными требованиями, в том числе с проведением гиперинсулиновых эугликемических клэмпов и исследований III фазы [8, 9, 17, 18].
Преимущества инсулиновых помп
Технологии по доставке сахароснижающих препаратов играют все более важную роль в управлении сахарным диабетом (СД) [19]. В первую очередь, это касается инсулиновых помп при СД 1 типа (вне зависимости от возраста пациента), которые обеспечивают гибкий физиологический режим введения инсулина, более стабильный гликемический контроль без увеличения частоты гипогликемий или кетоацидоза [20, 21]. Применение инсулиновой помпы у пациентов с СД 2 типа, нуждающихся в интенсивной инсулинотерапии, позволяет лучше контролировать гликемический профиль, способствует снижению уровня гликированного гемоглобина (HbA1c) на 1,1% против 0,4% и уменьшению суточной дозы инсулина на 20% в сравнении с режимом многократных инъекций [22, 23].
Помповая инсулинотерапия, или непрерывная (постоянная) подкожная инфузия инсулина (НПИИ), — современный метод инсулинотерапии, позволяющий лучше всего поддерживать уровень глюкозы, приближенный к физиологическим нормам. В режиме НПИИ инсулин вводится в базальном режиме с предварительно установленной скоростью и отдельными болюсами препарата во время приема пищи и при возникновении гипергликемии [24].
Помповая инсулинотерапия имеет существенные преимущества по сравнению с множественными инъекциями препарата с помощью шприц-ручек: низкая вариабельность действия инсулина, высокая точность дозирования (до 0,01 ЕД), комбинирование скорости (базальной и болюсной) введения гормона в течение суток в зависимости от потребности пациента. Уменьшение количества инъекций также является преимуществом помповой инсулинотерапии и немаловажным фактором улучшения качества жизни пациентов [24].
Сочетание инсулиновой помпы с непрерывным
мониторированием глюкозы в режиме реального времени, или флэш-мониторинга, позволяет достичь безопасного контроля уровня глюкозы в виде времени нахождения в целевом диапазоне (TIR, time-in-range) от 3,9 до 10,0 ммоль/л не менее 70% времени при уровне HbA1c не более 7% [25, 26].
В настоящее время все более широкое распространение получает применение инсулиновых помп и непрерывного мониторирования глюкозы с алгоритмом автоматического изменения скорости инфузии инсулина (систем закрытой петли "close-loop"), позволяющей достичь целевого уровня HbA1c у 92% пациентов, улучшения гликемического контроля — у 89%. Среди преимуществ такого метода терапии респонденты отмечают увеличение времени нахождения в целевом диапазоне гликемии (78%), уменьшение частоты легкой (60%) и тяжелой (58%) гипогликемии, улучшение гликемического контроля ночью (94%) [27].
По данным Национального регистра сахарного диабета Российской Федерации, количество пациентов, использующих инсулиновую помпу, увеличивается на 5% каждые 5 лет [28]. В развитых странах этот показатель достигает 63% [29].
Требования к инсулиновым аналогам ультракороткого действия при использовании в помпах
Основными требованиями к инсулинам, используемым в инсулиновых помпах, являются быстрое начало и короткий период действия, что определяется абсорбционными свойствами синтезированных молекул вследствие низкой способности к самоассоциации. Клинически это проявляется снижением числа гипогликемий и лучшим постпрандиальным контролем [30]. Немаловажной является стабильность используемого инсулина в резервуаре длительное время, не меняющаяся под действием различных внешних факторов. Повышенная температура окружающей среды, контакт с гидрофобной поверхностью катетера, сотрясения могут изменять структуру и свойства молекулы инсулина, что грозит изоэлектрической преципитацией, образованием фибрилл и окклюзией катетера [31]. В случае прекращения поступления инсулина вследствие окклюзии катетера быстро развиваются гипергликемия, кетоацидоз и требуется экстренная госпитализация [32].
Инсулиновые аналоги ультракороткого действия, имея улучшенные фармакокинетические свойства, доказали клинические преимущества применения в инсулиновой помпе в сравнении с человеческими инсулинами короткого действия [33]. Согласно клиническим рекомендациям в инсулиновых помпах применяются аналоги инсулина ультракороткого действия, которые можно использовать как у взрослых, так и у детей [24].
Молекулы современных ультракоротких инсулиновых аналогов (аспарт, лизпро, глулизин) имеют отличия в строении в виде изменения последовательности аминокислот, что не приводит к существенной разнице в фармакокинетике и фармакодинамике этих препаратов, а также их клинической эффективности и безопасности. В то же время инсулиновые аналоги в инсулиновых помпах продемонстрировали большую стабильность инсулина аспарт и инсулина лизпро с меньшей частотой окклюзий катетера в сравнении с инсулином глулизин (аспарт 9,2%, лизпро 15,7% и глулизин 40,9%; р<0,01) [35].
Несмотря на то, что, согласно требованиям регуляторных органов, биоэквивалентность и иммунологическая безопасность биосимиляров инсулинов аспарт (РинФаст®) и лизпро (РинЛиз®) уже были доказаны, было принято решение отдельно проанализировать данные биосимиляры в условиях использования в инсулиновых помпах.
Цель исследования: оценить стабильность производимых субстанций (биосимиляров инсулина) по показателям: количественное определение, содержание примесей, уровень рН, а также точность дозирования и склонность к окклюзии катетера при использовании в инсулинов fbх помпах.
Материал и методы
Материал представлен на основании отчетов о проведении исследований in vitro препарата РинЛиз®, раствор для внутривенного и подкожного введения, 100 ЕД/мл (2020 г.), и препарата РинФаст®, раствор для внутривенного и подкожного введения, 100 ЕД/мл (2021 г.), на базе научно-практического подразделения «Фарм-Холдинг» компании «ГЕРОФАРМ», отвечающего за разработку новых лекарственных препаратов.
Для введения препаратов были использованы следующие инсулиновые помпы:
MiniMedТМ 640G («Медтроник МиниМед», США);
MiniMed Paradigm REAL-Time (c системой постоянного мониторирования уровня глюкозы; «Медтроник
МиниМед», США);
система для самоконтроля глюкозы в крови с возможностью введения инсулина Accu-Chek® Combo (Roche Diabetes Care GmbH, Германия).
Точность дозирования ультракоротких инсулинов определяли при минимальной (0,1 ЕД) и максимальной (75 ЕД) болюсной дозе для помп MiniMedТМ 640G, рекомендованной производителем [36], при минимальной (0,1 ЕД) и максимальной (0,25 ЕД) дозе для помп MiniMed Paradigm REAL-Time и Accu-Chek® Combo. Ежедневно производилось 25 замеров для каждой болюсной дозы на каждой инсулиновой помпе с каждым из исследуемых инсулинов [36, 37].
Согласно инструкции производителя для инсулиновых помп MiniМedTM 640G, MiniМed Paradigm® REAL-Time и Accu-Chek® Combo точность введения при базальной скорости, равной 1,0 ЕД/ч, составляет ±5% [36, 37].
Оценку точности дозирования и склонности к катетерной окклюзии проводили гравиметрическим методом, основываясь на требованиях ГОСТ Р МЭК 60601-2-24-2017 «Изделия медицинские электрические» [38].
Окклюзия катетеров всех помп оценивалась в течение 72 ч при базальной скорости введения инсулина 1,0 ЕД/ч. Время исследования определялось рекомендациями производителя о смене катетера и резервуара каждые 3 дня (72 ч) [36, 37].
Оценку стабильности инсулина проводили для выявления возможной деградации инсулина. Контроль показателей рН и количественного содержания инсулина в резервуаре проводили каждые 24 ч. Кроме того, был проведен анализ растворов непосредственно после заполнения резервуара помпы, а также выполнен входной контроль (контроль качества препарата по исследуемым показателям перед проведением тестирования). Таким образом, одна параллель одной серии препарата включала 5 точек:
«Точка 0» (непосредственно после заполнения резервуара).
«Точка 5 часов» (5 ч хранения в резервуаре).
«Точка 24 часа» (24 ч хранения в резервуаре с использованием расходных материалов к помпе).
«Точка 48 часов» (48 ч хранения в резервуаре с использованием расходных материалов к помпе).
«Точка 72 часа» (72 ч хранения в резервуаре с использованием расходных материалов к помпе).
Хранение инсулина осуществлялось при температуре 37±0,5 °С.
Исследование инсулинов РинЛиз® и РинФаст® проводили в 3 сериях с использованием вышеперечисленных помп.
Оценку количественного содержания инсулина, родственных примесей и примесей, превышающих молекулярную массу лизпро и аспарт, осуществляли методом высокоэффективной жидкостной хроматографии.
Результаты и обсуждение
В результате исследования инсулина РинЛиз® было показано, что максимальное отклонение от номинального значения минимального болюса для инсулиновых помп MiniMedТМ 640G и MiniMed Paradigm REAL-Time составило 5,0%, для помпы Accu-Chek® Combo — 7,0%. Максимальное отклонение от номинального значения максимального болюса для инсулиновых помп MiniMedТМ 640G составило 1,2%, для MiniMed Paradigm REAL-Time — 2,0%, для помпы Accu-Chek® Combo — 1,9% (табл. 1).
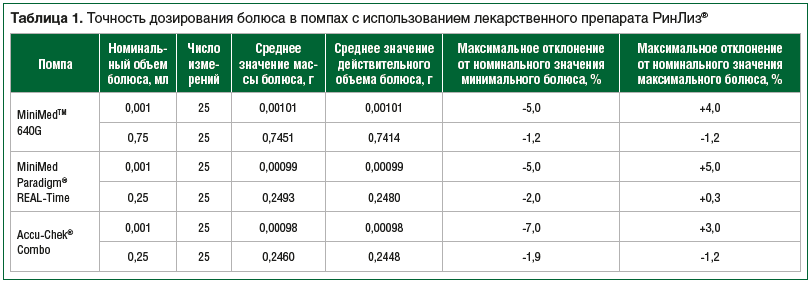
Относительная погрешность объемной скорости потока инсулина РинЛиз® для инсулиновых помп MiniMedТМ 640G и Accu-Chek® Combo составила 1,0%, для инсулиновой помпы MiniMed Paradigm REAL-Time — 2,0%, что соответствует точности дозирования, заявленной изготовителем.
Во время испытания сигнал опасности окклюзии не срабатывал, т. е. склонности к катетерной окклюзии в течение рекомендованного интервала замены инфузионной магистрали (72 ч) не выявлено.
В процессе исследования инсулина РинЛиз® при использовании в помпе Accu-Chek® Combo значения рН находились в пределах спецификации на заявленный препарат, отклонение среднего показателя в каждой серии не превышало 0,05% (рис. 1А).
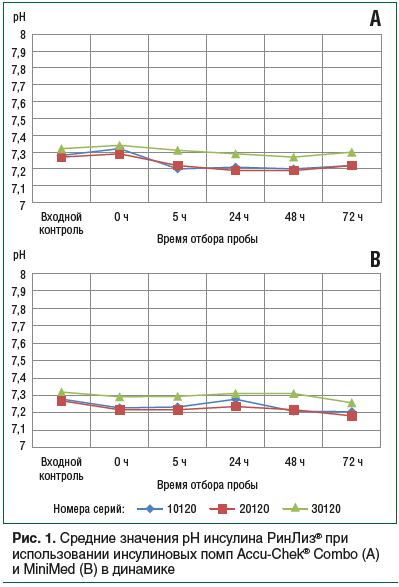
При использовании инсулина РинЛиз® в помпах MiniMed значения рН также находились в пределах спецификации на заявленный препарат, отклонение среднего показателя в каждой серии не превышало 1,5%, хотя было отмечено небольшое снижение рН в течение 72 ч (рис. 1B).
Согласно нормативной документации на используемый в ходе исследования инсулин РинЛиз® содержание инсулина лизпро должно быть в пределах 90–105%. Содержание А-21-дезамидоинсулина лизпро не должно превышать 2%, остальных близкомолекулярных примесей — 6%. При этом доля примесей с молекулярной массой, превышающей молекулярную массу инсулина лизпро, не должна быть более 1,5%.
В ходе исследования установлено, что значения по показателям «количественное определение инсулина лизпро» при использовании в помпе Accu-Chek® Combo находились в пределах спецификации на исследуемый инсулин и относительное стандартное отклонение (RSD) по всем точкам трех серий препарата не превышало 10% (рис. 2А).

Стабильность лекарственного препарата РинЛиз® в помпах MiniMed оставалась неизменной в течение 72 ч наблюдения. Среднее отклонение по каждой точке каждой серии препарата не превышало 10,0% (рис. 2B).
Исследование содержания примесей в инсулине лизпро при использовании в помпе Accu-Chek® Combo показало, что уровень А-21-дезамидоинсулина лизпро не превысил 0,25% за весь период наблюдения (при допустимом показателе 2,0%), относительное среднее отклонение от заявленных показателей составило 10% (рис. 3).
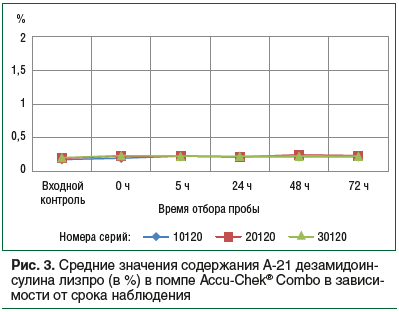
Содержание других родственных примесей инсулина лизпро также не превысило допустимых спецификацией 6% и составило не более 1,7%.
При использовании инсулина лизпро в помпах MiniMed содержание примеси А-21 дезамидоинсулина лизпро не превысило 0,3% с относительным стандартным отклонением по основным точкам не более 10%. Максимальное среднее значение суммарного содержания примесей у этого препарата несколько увеличилось к концу периода наблюдения с 1,1% до 1,9%, что, однако, было значительно ниже допустимого количества.
В процессе исследования примесей с молекулярной массой, превышающей молекулярную массу лизпро, при использовании Accu-Chek® Combo содержание их оставалось стабильным в течение 72 ч, не превысив показатель 0,23% с относительным стандартным отклонением от средних показателей менее 10%.
При использовании помп MiniMed количество примесей с молекулярной массой, превышающей молекулярную массу лизпро, незначительно возросло, но не превысило 2,0%, что значительно ниже допустимого загрязнения в 6%.
Согласно результатам изучения точности дозирования инсулина РинФаст® в инсулиновых помпах максимальное отклонение от номинального значения минимального болюса для инсулиновых помп MiniMedТМ 640G и MiniMed Paradigm REAL-Time составило 5,0%, а для помпы Accu-Chek® Combo — 9,0%. Максимальное отклонение от номинального значения максимального болюса для инсулиновых помп MiniMedТМ 640G и MiniMed Paradigm REAL-Time составило 0,8%, для помпы Accu-Chek® Combo — 2,5% (табл. 2).

Относительная погрешность объемной скорости потока инсулина РинФаст® для инсулиновых помп MiniMedТМ 640G и MiniMed Paradigm REAL-Time составила -1,2% и +0,7% соответственно, для инсулиновой помпы Accu-Chek® Combo — -2,1%, что соответствует точности дозирования, заявленной изготовителем (табл. 3).

Во время испытания срабатывания сигнала опасности окклюзии не было. Таким образом, склонность к образованию катетерной окклюзии в течение 72 ч, что соответствует рекомендованному интервалу замены инфузионной магистрали, не выявлена.
Результаты оценки показателя рН, количественного содержания инсулина, родственных примесей и примесей, превышающих молекулярную массу аспарт, в целом соответствовали установленным нормам спецификации препарата.
В результате проведения комплекса исследований точности дозирования и стабильности лекарственных препаратов РинЛиз® и РинФаст® при использовании для непрерывной подкожной инфузии с помощью инсулиновых помп было установлено:
точность дозирования инсулиновых помп MiniMedТМ 640G, MiniMed Paradigm® REAL-Time и Accu-Chek® Combo, используемых с изученными препаратами, соответствует точности дозирования, заявленной изготовителем;
при моделировании процесса непрерывной подкожной инфузии с использованием лекарственных препаратов катетерной окклюзии не возникало в течение 72 ч;
при оценке по показателям рН, количественному содержанию Ц 8нсулина, родственных примесей и примесей, превышающих молекулярную массу лизпро и аспарт, отклонений от установленных норм спецификации препаратов не выявлено.
Заключение
Биосимиляры аналогов инсулинов занимают все более значимое место в лечении пациентов, нуждающихся в инсулинотерапии, позволяя без ухудшения качества лечения значительно снизить его стоимость. Проведение исследований физико-химической и клинической биоэквивалентности биосимиляра и оригинального препарата, а также иммуногенной безопасности, согласно требованиям регуляторных органов, позволяет говорить о безопасности и эффективности биоподобных препаратов.
Доказанные в ходе физико-биохимических исследований биоэквивалентности, гиперинсулиновых эугликемических клэмп-исследований, а также наблюдательных исследований III фазы безопасность, в том числе иммуногенная, эффективность биосимиляров инсулинов, клиническая биоэквивалентность инсулинов РинФаст® и РинЛиз® и оригинальных препаратов аспарт и лизпро позволили экстраполировать на биосимиляры все показания, противопоказания, нежелательные реакции из инструкции по медицинскому применению референтного препарата.
Исследование продемонстрировало стабильность производимых субстанций по таким показателям, как химический состав, содержание примесей, показатель рН, а также точность дозирования и отсутствие окклюзий в системах в течение 72 ч. Имеющаяся доказательная база позволяет использовать инсулины РинФаст® и РинЛиз® в инсулиновых помпах у пациентов всех возрастных групп.
Материалы представлены на основании результатов исследований, проведенных компанией «ГЕРОФАРМ».












