
Исследованы роль витамина D в контексте процессов старения, развития опухолей и атеросклероза, влияние на состояние иммунитета и экспрессию генов. Во многих эпидемиологических исследованиях недостаточность витамина D была определена как фактор риска развития таких заболеваний, как рак, сердечно-сосудистые болезни (ССЗ), сахарный диабет (СД) [3].
Низкая концентрация 25-гидроксивитамина D (25(OH)D)
является независимым фактором риска сердечно-сосудистых событий, в частности, инсультов и внезапной сердечной смерти [4].
В метаанализе обсервационных исследований самая высокая концентрация 25(OH) витамина D в сыворотке была ассоциирована с уменьшением кардиометаболических расстройств на 43% по сравнению с более низкими концентрациями. Более высокие уровни витамина D в популяции людей среднего и пожилого возраста ассоциировались с существенным снижением количества ССЗ, СД 2-го типа и метаболического синдрома [5].
Термин «витамин D» объединяет витамин D3 – холекальциферол и витамин D2 – эргокальциферол. Витамин D3 (холекальциферол) синтезируется в эпидермисе кожи под воздействием ультрафиолетового излучения солнечного света (В-спектр) из 7-дегидрохолестерола. Далее он проходит два процесса гидроксилирования: в печени под действием 25-гидроксилазы образуется 25(ОН)D (25-гидроксивитамин D) или кальцидиол, а в почках под действием 1α-гидроксилазы синтезируется биологически активный 1,25(OH)2D3 (1,25-дигидроксивитамин D) или кальцитриол. 1,25(OH)2D3 может синтезироваться не только в почках, но и в клетках поджелудочной железы, желудка, толстого кишечника, эпидермиса, эндотелия сосудов, а также в макрофагах и плаценте. Другая форма витамина D – эргокальциферол D2 синтезируется из эргостерола в растениях [6]. Широкое распределение рецепторов витамина D в организме человека (включая кишечник, почки, кости, паращитовидные железы, клетки иммунной системы, гладкие мышцы и миокард) обусловливает плейотропные эффекты активации рецепторов витамина D [7]. Тем не менее остается недостаточно проанализированным участие витамина D в патогенезе артериальной гипертензии (АГ). АГ – стойкое повышение артериального давления (АД) от 140/90 мм рт. ст. и выше. Важными патогенетическими факторами АГ признаны тканевая инсулинорезистентность, сопряженная с усилением реабсорбции натрия, активности симпатической нервной системы, экспрессией протоонкогенов и ослаблением вазодилататорных стимулов, а также повышение плотности рецепторов сосудистого русла и миокарда и их чувствительности к адренергическим воздействиям под влиянием избыточной секреции кортизола и тиреоидных гормонов. Типичными осложнениями АГ являются инсульт, инфаркт, сердечная и почечная недостаточность. По данным Минздрава России, в 2014 г. с диагнозом «болезни системы кровообращения», установленным впервые в жизни, в РФ зарегистрировано 28,8 тыс. человек, в 2015 г. – 31,2 тыс., в 2016 г. – 31,7 тыс. В 2017 г. в РФ от гипертонической болезни умерло 16 723 человек, от ССЗ – 857 980, от цереброваскулярных заболеваний – 264 854 [8].
Витамин D участвует в регулировании секреции ренина в юкстагломерулярном аппарате [9]. На фоне дефицита витамина D происходит повышение активности работы ренин-ангиотензин-альдостероновой системы (РААС), что способствует повышению АД [10, 11].
Традиционно для описания гормональной регуляции АД приводят схему работы РААС, контролирующей состояние тонуса сосудов, электролитного состава крови и водно-солевого обмена (рис. 1, 2) [12–14].
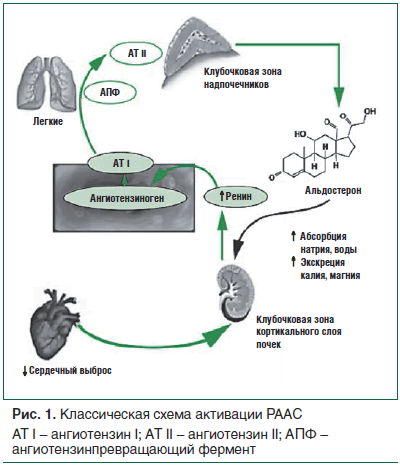
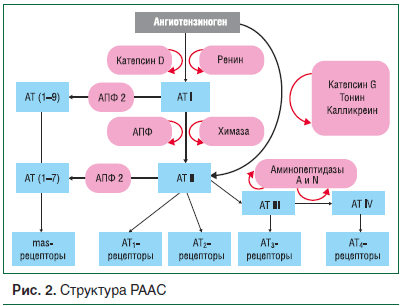
Ренин является протеолитическим ферментом, не обладающим прессорными свойствами [15], при взаимодействии с ангиотензиногеном приводит к образованию ангиотензина I (АТ I). АТ I не обладает вазопрессорной активностью, под воздействием ангиотензинпревращающего фермента (АПФ) быстро превращается в ангиотензин II (АТ II), который является наиболее мощным из известных прессорных факторов [16]. Возможно преобразование АТ I в АТ II с помощью фермента химазы, активность которого максимальна в ткани сердца и стенке сосудов, в то время как активность АПФ максимальна в ткани почек [17]. Существуют альтернативные пути образования АТ II, минуя воздействие АПФ и химазы, напрямую из ангиотензиногена при участии ферментов катепсина G, тонина и калликреина. Физиологические эффекты АТ II опосредуются через его связь со специфическими рецепторами 1-гo и 2-го типа: АТ1- и АТ2-рецепторами. При связи АТ II с АТ1-рецептором происходит запуск атерогенных процессов в организме: спазм сосудов, пролиферация гладких мышечных клеток, фиброзирование тканей, всплеск свободнорадикального окисления [18]. С активацией именно этой группы рецепторов связывают развитие АГ, ремоделирование стенок сосудов и сердечной мышцы, приводящих к неблагоприятным изменениям сердечно-сосудистой системы. Активация АТ2-рецепторов оказывает противоположное действие: происходят дилатация сосудов, высвобождение эндотелиального оксида азота (NO), индукция секреции простациклина и брадикинина, торможение гипертрофии кардиомиоцитов и активности коллагеназы.
В эксперименте показано, что в патогенезе АГ у крыс ключевую роль играет локальная продукция АТ II, поскольку в хроническую стадию процесса активность ренина и АПФ в плазме крови в норме или даже снижена, тогда как продукция АТ II в стенке сосуда значительно возрастает [19].
Взаимодействие местной РААС и паракринных факторов, в частности трансформирующего фактора роста бета (TGF-β), на уровне эндотелия описано в обзоре А.В. Москалева [20]. TGF-β принадлежит к семейству димерных полипептидов с молекулярной массой 25 кДа. Источниками TGF-β являются преимущественно моноциты и макрофаги, содержащие его постоянно, но секретирующие только при активации. Кроме того, TGF-β могут продуцировать и другие клетки, такие как фибробласты, эндотелиоциты, нейтрофилы, эозинофилы, тучные клетки, гладкомышечные клетки, а также клетки многих видов злокачественных опухолей [21, 22]. Выявлено, что молекула TGF-β проявляет 3 основных типа биологической активности: ингибирует пролиферацию большинства клеток, в т. ч. эпителиальных, стимулирует рост некоторых мезенхимальных клеток; обладает иммуносупрессорным эффектом; усиливает формирование межклеточного матрикса (рис. 3). Три изоформы TGF-β имеют сходные биологические эффекты, однако наиболее выраженной экспрессией и значимой ролью при воспалении, ремоделировании и фиброзировании сосудов и миокарда обладает TGF-β1 [23].
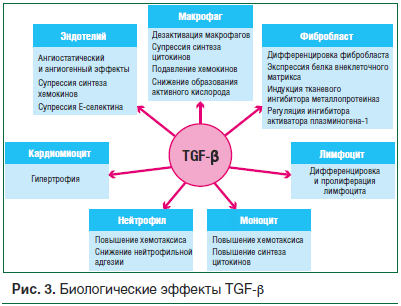
Перегрузки, давление активируют РААС с генерацией АТ II. Гипертрофические эффекты АТ II опосредуются активацией TGF-β1-сигнальных путей. TGF-β1 индуцирует гипертрофию кардиомиоцитов и интерстициальный фиброз. В почечной, сердечной, сосудистой тканях АТ II индуцирует воспалительную реакцию путем стимуляции экспрессии провоспалительных хемокинов, ответственных за тканевое накопление иммунокомпетентных клеток [24]. АТ II также вовлечен в контроль адипогенеза в виде регуляции синтеза липидов и их накопления в адипоцитах [25].
В обзоре А.В. Барсукова установлена четкая связь между активностью РААС, в т. ч. местной в жировой ткани, и метаболическими факторами сердечно-сосудистого риска [26].
В своей работе S. Engeli et al. продемонстрировали, что экспрессия матричной рибонуклеиновой кислоты (мРНК) ангиотензиногена в абдоминальной жировой ткани значительно выше, чем в подкожной. Адипоциты также экспрессируют как рецепторы к АГ II, которые превращают жировые клетки в своеобразную мишень для паракринных влияний этого гормона, так и АТ II, который, в свою очередь, приводит к нарушению дифференцировки преадипоцитов до зрелых клеток, вызывая тем самым накопление липидов не в адипоцитах, а в висцеральных паренхиматозных органах и поперечно-полосатых мышцах [27].
Предполагается, что ренин-ангиотензиновая система жировой ткани обладает прогипертензивными эффектами. В экспериментальных исследованиях было установлено, что искусственная экспрессия гена ангиотензиногена в жировой ткани трансгенной линии мышей приводит к увеличению содержания АГ II в крови на 20% и некоторому повышению АД. Выявлено, что у людей с висцеральным ожирением отмечаются более высокие уровни ангиотензиногена, альдостерона, а также повышенная экспрессия генов рецепторов к АТ II. Это связано с аутокринно-паракринной ролью жировой ткани, способной к выработке альдостеронстимулирующего фактора [28, 29].
Увеличение активности РААС жировой ткани при ожирении сопровождается снижением уровня адипонектина [30]. У детей с ожирением на фоне приема витамина D повышается уровень адипонектина, снижаются уровень триацилглицеридов и индекс HOMA (индекс инсулинорезистентности) [31].
В обзоре В.С. Пыхтиной с соавт. о взаимодействии РААС и репликативного клеточного старения в ходе старения сосудов РААС рассматривается в роли одного из главных источников хронического воспаления и окислительного стресса [14].
Л.В. Кежун, Л.В. Янковская в своем обзоре анализируют роль РААС и витамина D в развитии АГ у женщин в перименопаузальном периоде [32].
В обзоре Е.Н. Дудинской и О.Н. Ткачевой о роли витамина D в развитии АГ приведены данные об ассоциации дефицита витамина D с нарушением кальциевого обмена, повышением тонуса РААС, дисфункцией эндотелия, формированием метаболического синдрома. Представленные результаты исследований открывают перспективу применения созданного на основе витамина D нового класса антигипертензивных препаратов [33].
Метаанализ по изучению данных 11 клинических испытаний, проводимых у людей с гипертензией, в которых витамин D обладал антигипертензивным действием, показал, что данные не достигли уровня статистической значимости (95% доверительный интервал (ДИ) от –0,8 до 0,7), однако были получены достоверные данные о снижении диастолического давления (95% ДИ от –5,5 до –0,6). На основании анализа был сделан вывод о том, что витамин D не оказывает существенного влияния на АД у людей с нормальным АД [34].
Подавление секреции ренина витамином D через активацию его рецепторов происходит независимо от кальциевого гомеостаза и нарушений водно-солевого обмена. В культуре клеток in vitro введение активного метаболита – кальцитриола подавляло транскрипцию гена ренина за счет геномного механизма, связанного с воздействием на ядерные РВD (рецепторы к витамину D), что указывает на способность D-дефицита увеличивать риск развития АГ [35].
В экспериментальных работах было показано, что кальцитриол подавляет высвобождение воспалительных цитокинов (ФНО-α, ИЛ-6 и ИЛ-10), регулирует АД, электролитный баланс, гомеостаз [36, 37].
По данным Y. Talmor et al., в экспериментальных моделях терапия витамином D также уменьшает повреждение, вызванное оксидативным стрессом. Витамин D in vitro уменьшает образование интерлейкина-6 (ИЛ-6) и активность ядерного транскрипционного фактора NF-кВ, а также предотвращает ингибирование продукции эндотелиальной NO-синтазы конечными продуктами гликозилирования [38].
В эксперименте на мышах, генетически лишенных витамин D-связывающего белка, наблюдались повышенная продукция ренина и АТ II, развитие гипертензии, гипертрофии левого желудочка сердца, полидипсии [39].
Применение препаратов витамина D и его активных метаболитов в клинической практике прописано в отечественных и международных клинических рекомендациях.
В большинстве случаев применяются нативные формы витамина D, однако в ситуации, когда имеется предполагаемое нарушение метаболизма витамина D, например, при выраженном поражении почек (скорость клубочковой фильтрации 60 мл/мин и менее) или печени, требуется назначение активных метаболитов витамина D – кальцитриола, альфакальцидола или их аналогов. Кальцитриол идентичен самому активному метаболиту витамина D – 1,25-дигидроксивитамину D, а альфакальцидол отличается от кальцитриола лишь отсутствием гидроксильной группы в 25-м положении.
Прием кальцитриола (0,25–1,0 мкг/сут) может вызывать гиперкальциемию, в связи с этим нужно учитывать, что, в отличие от нативных форм, его прием должен обязательно сопровождаться регулярным контролем уровня кальция и фосфатов в крови (в начале лечения — 1 р./нед., при достижении оптимальной эффективной дозы – каждые 2–3 нед. лечения). Назначение альфакальцидола ассоциируется с несколько меньшим риском гиперкальциемии за счет того, что в кишечнике он находится в неактивной форме, активизируясь после биотрансформации в печени. При хронической почечной недостаточности также требуется контроль уровня активности щелочной фосфатазы (ЩФ), кроме того, требуется предварительная коррекция гиперфосфатемии (при ее наличии). В случае лечения активными метаболитами витамина D уровень в крови 25(ОН)D нельзя использовать для контроля эффективности лечения.
Также в настоящее время в клинической практике кардиологов и нефрологов для кардиоренальной протекции используют аналоги витамина D – селективный активатор рецептора витамина D парикальцитол [40]. Термин «селективный» означает, что молекула действует в основном на паращитовидные железы и в меньшей степени – на клетки кишечника и костей, вызывая меньшие концентрации сывороточного кальция и фосфора. По данным D. Andress, такого рода селективные активаторы оказывают также противовоспалительное и антитромботическое действие и могут подавлять пролиферацию гладкомышечных клеток сосудов, активность РААС, кальцификацию сосудов и их жесткость, способствуют регрессии гипертрофии левого желудочка [41].
На рисунке 4 представлена схема активации рецепторов PBD в сердечно-сосудистой системе.
![Рис. 4. Механизм ингибирования гипертрофии миокарда и повреждения сосудов через активацию PBD [33] Рис. 4. Механизм ингибирования гипертрофии миокарда и повреждения сосудов через активацию PBD [33]](/upload/medialibrary/a6f/60-4.png)
Таким образом, анализ доступных современных научных данных позволяет сформулировать следующие выводы:
Несомненное участие витамина D в регуляции АД (как прямое, так и опосредованное через местную РААС) позволяет расширить представление о роли D-гормона, сформировав представление о D-эндокринной системе, ее взаимосвязи с другими механизмами патогенеза АГ.
Значимость местных РААС в формировании патофизиологических нарушений гораздо больше, чем циркулирующей РААС.
Учитывая распространенность заболеваний, связанных с дефицитом витамина D, необходимо активно внедрять скрининговые методы выявления дефицита этого витамина в популяции (например, в рамках ежегодной диспансеризации и т. п.).
С получением новых данных о патогенезе формирования АГ появляются дополнительные прогностические критерии заболевания, позволяющие разрабатывать инновационные подходы к их терапии, например, использование препаратов витамина D и его метаболитов для коррекции развития АГ, в т. ч. в рамках метаболического синдрома.












