–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–Є–љ—Ж–Є–њ—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –Т—Л–±–Њ—А –њ–∞—Ж–Є–µ–љ—В–Њ–≤,
–љ—Г–ґ–і–∞—О—Й–Є—Е—Б—П –≤ –ї–µ—З–µ–љ–Є–Є
–°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –Т–Ю–Ч (1994) –і–Є–∞–≥–љ–Њ–Ј –Ю–Я —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –Є —Г –Љ—Г–ґ—З–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 50 –ї–µ—В —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –њ–Њ –і–∞–љ–љ—Л–Љ –і–≤—Г—Е—Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–є —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–є –∞–±—Б–Њ—А–±—Ж–Є–Њ–Љ–µ—В—А–Є–Є (DXA) –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Ї–Њ—Б—В–љ–Њ–є (–Ь–Я–Ъ) —В–Ї–∞–љ–Є –і–Њ –2,5 —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–є –Њ—В –њ–Є–Ї–Њ–≤–Њ–є –Ь–Я–Ъ (–Ґ––Ї—А–Є—В–µ—А–Є–є ≤–2,5) [6,7]. –Ю–і–љ–∞–Ї–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Є—Б—Е–Њ–і –Ю–Я – —Н—В–Њ –љ–Є–Ј–Ї–Њ—В—А–∞–≤–Љ–∞—В–Є—З–љ—Л–є –њ–µ—А–µ–ї–Њ–Љ, –∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –Љ–µ—В–Њ–і—Л –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Ь–Я–Ъ (DXA), –Њ–±–ї–∞–і–∞—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О, –Є–Љ–µ—О—В –љ–Є–Ј–Ї—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є –љ–µ –≤—Б–µ–≥–і–∞ –і–Њ—Б—В—Г–њ–љ—Л. –Я–Њ—Н—В–Њ–Љ—Г –≤ –Њ—Б–љ–Њ–≤—Г –≤—Л—П–≤–ї–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е, –њ–Њ–і—Е–Њ–і—П—Й–Є—Е –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є, –њ–Њ–ї–Њ–ґ–µ–љ–∞ —Б—В—А–∞—В–µ–≥–Є—П –њ–Њ–Є—Б–Ї–∞, –Ј–∞–Ї–ї—О—З–∞—О—Й–∞—П—Б—П –≤ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–Є –ї–Є—Ж —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [8]. –§–∞–Ї—В–Њ—А—Л, —Г–≤–µ–ї–Є—З–Є–≤–∞—О—Й–Є–µ —А–Є—Б–Ї –љ–Є–Ј–Ї–Њ—В—А–∞–≤–Љ–∞—В–Є—З–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Ь–Я–Ъ, –њ—А–Є–≤–µ–і–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1.
–Р–±—Б–Њ–ї—О—В–љ—Л–є –і–µ—Б—П—В–Є–ї–µ—В–љ–Є–є —А–Є—Б–Ї –Ї–ї—О—З–µ–≤—Л—Е –Њ—Б—В–µ–Њ–њ–Њ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ (–њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –±–µ–і—А–∞, –њ–ї–µ—З–∞, –ї—Г—З–≤–Њ–є –Ї–Њ—Б—В–Є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤) –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б—В—А–∞–љ (–Ъ–Є—В–∞—П, –§—А–∞–љ—Ж–Є–Є, –Ш—В–∞–ї–Є–Є, –ѓ–њ–Њ–љ–Є–Є, –Ш—Б–њ–∞–љ–Є–Є, –®–≤–µ—Ж–Є–Є, –Ґ—Г—А—Ж–Є–Є, –Т–µ–ї–Є–Ї–Њ–±—А–Є—В–∞–љ–Є–Є –Є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є —А–∞–Ј–ї–Є—З–љ—Л—Е —А–∞—Б, –ґ–Є–≤—Г—Й–Є—Е –≤ –°–®–Р: –µ–≤—А–Њ–њ–µ–є—Ж–µ–≤, –љ–µ–≥—А–Њ–≤, –Є—Б–њ–∞–љ—Ж–µ–≤, –∞–Ј–Є–∞—В–Њ–≤) –Љ–Њ–ґ–љ–Њ –Њ—Ж–µ–љ–Є—В—М —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–є –њ—А–Њ–≥—А–∞–Љ–Љ—Л FRAX (fracture risk assessment tool), –і–Њ—Б—В—Г–њ–љ–Њ–є –±–µ—Б–њ–ї–∞—В–љ–Њ –≤ –Ш–љ—В–µ—А–љ–µ—В–µ –њ–Њ –∞–і—А–µ—Б—Г: http://www.shef.ac.uk/FRAX. –°—В—А–∞–љ—Л, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –†–Њ—Б—Б–Є—П, –Ї–Њ—В–Њ—А—Л–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ —А–∞–љ–ґ–Є—А–Њ–≤–∞–љ—Л –њ–Њ —А–Є—Б–Ї—Г –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, –Љ–Њ–≥—Г—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Ї–∞—В–µ–≥–Њ—А–Є—О —Б—В—А–∞–љ—Л, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –≤ –Ї–Њ—В–Њ—А–Њ–є —Б—Е–Њ–і–љ—Л —Б –ї–Њ–Ї–∞–ї—М–љ—Л–Љ–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є –і–∞–љ–љ—Л–Љ–Є [10]. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —А–∞–Ј–љ—Л—Е –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–є –≤ –†–Њ—Б—Б–Є–Є –≤ —Б—А–µ–і–љ–µ–Љ –±–ї–Є–Ј–Ї–∞ –Ї —В–∞–Ї–Њ–≤–Њ–є –≤ –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е —Б—В—А–∞–љ–∞—Е (–Р–љ–≥–ї–Є–Є, –У–µ—А–Љ–∞–љ–Є–Є), –Њ—В–љ–µ—Б–µ–љ–љ—Л—Е –Ї –≤—Л—Б–Њ–Ї–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є —А–Є—Б–Ї–∞ [8].
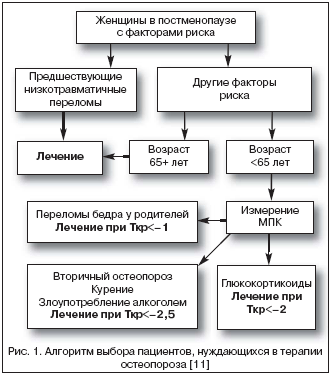
–Э–Њ–≤—Л–є –њ–Њ–і—Е–Њ–і –Ї –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Ю–Я, –Њ—Б–љ–Њ–≤–∞–љ–љ—Л–є –љ–∞ –Њ—Ж–µ–љ–Ї–µ –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Є–љ—П—В—М —А–µ—И–µ–љ–Є–µ –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –љ–∞—З–Є–љ–∞—В—М –ї–µ—З–µ–љ–Є–µ —Г –±–Њ–ї—М—И–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—А–Є—Б. 1) –±–µ–Ј –Є–Ј–Љ–µ—А–µ–љ–Є—П –Ь–Я–Ъ. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –ґ–µ–ї–∞—В–µ–ї—М–љ–Њ –Є–Ј–Љ–µ—А–Є—В—М –Є—Б—Е–Њ–і–љ—Г—О –Ь–Я–Ъ –Љ–µ—В–Њ–і–Њ–Љ DXA –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Є—Б—Е–Њ–і–љ–Њ–є —В–Њ—З–Ї–Є –Є –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П.
–Я–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л
–њ—А–Є–Љ–µ–љ–µ–љ–Є—П –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В–Њ–≤
–і–ї—П –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞
–С–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В—Л (–С–§) —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –≤ –ї–µ—З–µ–љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ [8], –∞ —В–∞–Ї–ґ–µ —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ –і—А—Г–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ї–Њ—Б—В–µ–є —Б –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ—Б—В–љ–Њ–є —А–µ–Ј–Њ—А–±—Ж–Є–µ–є.
–С–§ —Б–њ–Њ—Б–Њ–±–љ—Л –Є–Ј–±–Є—А–∞—В–µ–ї—М–љ–Њ —Б–≤—П–Ј—Л–≤–∞—В—М—Б—П —Б –Ї–Њ—Б—В–љ—Л–Љ –Љ–Є–љ–µ—А–∞–ї–Њ–Љ, —З—В–Њ –і–∞–µ—В –Є–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –≤ –ї–µ—З–µ–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є. –†–∞–љ–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –С–§ –љ–∞ –≥–Є–і—А–Њ–Ї—Б–Є–∞–њ–∞—В–Є—В (–Ї–Њ—Б—В–љ—Л–є –Љ–Є–љ–µ—А–∞–ї): –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –≤—Л–њ–∞–і–µ–љ–Є—П –Ї–∞–ї—М—Ж–Є—П —Д–Њ—Б—Д–∞—В–∞ –≤ –Њ—Б–∞–і–Њ–Ї, –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –∞–Љ–Њ—А—Д–љ–Њ–≥–Њ –≥–Є–і—А–Њ–Ї—Б–Є–∞–њ–∞—В–Є—В–∞ –≤ –Ї—А–Є—Б—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–є, –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –∞–≥—А–µ–≥–∞—Ж–Є–Є –Є —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ [12]. –Ю—Б–љ–Њ–≤–љ–∞—П –Ї–ї–µ—В–Ї–∞––Љ–Є—И–µ–љ—М –і–ї—П –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –С–§ – –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В. –Я—А–Є –Ї–Њ—Б—В–љ–Њ–є —А–µ–Ј–Њ—А–±—Ж–Є–Є —Б–Њ–Ј–і–∞–µ—В—Б—П –Ї–Є—Б–ї–∞—П —Б—А–µ–і–∞, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є—О –С–§ –Є–Ј –≥–Є–і—А–Њ–Ї—Б–Є–∞–њ–∞—В–Є—В–∞. –Ю—Б—В–µ–Њ–Ї–ї–∞—Б—В –Ј–∞—Е–≤–∞—В—Л–≤–∞–µ—В –С–§ (–љ–∞–Є–±–Њ–ї–µ–µ –≤–µ—А–Њ—П—В–љ–Њ, –≤–Љ–µ—Б—В–µ —Б –Ї–∞–ї—М—Ж–Є–µ–Љ –Є –Ї–Њ—Б—В–љ—Л–Љ –Љ–∞—В—А–Є–Ї—Б–Њ–Љ), –Ј–∞—В–µ–Љ –љ–Є—В—А–Њ–≥–µ–љ–—Б–Њ–і–µ—А–ґ–∞—Й–Є–є –С–§ –±–ї–Њ–Ї–Є—А—Г–µ—В —Д–µ—А–Љ–µ–љ—В —Д–∞—А–љ–µ–Ј–Є–ї–њ–Є—А–Њ—Д–Њ—Б—Д–∞—В–—Б–Є–љ—В–∞–Ј—Г, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г—Е—Г–і—И–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–Є –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В–∞, —Г–Љ–µ–љ—М—И–µ–љ–Є—О —А–∞–Ј—А—Г—И–µ–љ–Є—П –Ї–Њ—Б—В–Є; –≤ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –Њ—Б—В–µ–Њ–Ї–ї–∞—Б—В –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –∞–њ–Њ–њ—В–Њ–Ј—Г [12]. –Э–∞—Б—В—Г–њ–ї–µ–љ–Є–µ –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л –њ—А–Є–≤–Њ–і–Є—В –Ї –±—Л—Б—В—А–Њ–Љ—Г –њ–Њ—Б—В–Њ—П–љ–љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—О –Ї–Њ—Б—В–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, —З—В–Њ –≤—Л—А–∞–ґ–∞–µ—В—Б—П –≤ –њ–Њ–≤—Л—И–µ–љ–Є–Є –Љ–∞—А–Ї–µ—А–Њ–≤ –Ї–Њ—Б—В–љ–Њ–є —А–µ–Ј–Њ—А–±—Ж–Є–Є –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –љ–∞ 50–100% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –ґ–µ–љ—Й–Є–љ–∞–Љ–Є —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ [13], –њ–Њ—Н—В–Њ–Љ—Г –∞–љ—В–Є—А–µ–Ј–Њ—А–±—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –С–§ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Г —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –С–§ —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –Њ—Б—В–µ–Њ—Ж–Є—В–∞, –Њ—В–Ї—А—Л–≤–∞—П –Ї–Њ–љ–µ–Ї—Б–Є–љ–43––≥–µ–Љ–Є–Ї–∞–љ–∞–ї, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Н–Ї—Б—В—А–∞—Ж–µ–ї—О–ї—П—А–љ–Њ–є —Б–Є–≥–љ–∞–ї–—А–µ–≥—Г–ї–Є—А—Г—О—Й–µ–є –Ї–Є–љ–∞–Ј—Л [14] –Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л –∞–Ї—В–Є–≤–∞—Ж–Є–є –Є –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—О –њ–Њ—В–µ—А–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –љ–Є—В—А–Њ–≥–µ–љ—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –С–§. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –†–Њ—Б—Б–Є–Є –і–ї—П –ї–µ—З–µ–љ–Є—П –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –і–Њ—Б—В—Г–њ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ –љ–Є—В—А–Њ–≥–µ–љ—Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –С–§: –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ (–Ґ–µ–≤–∞–љ–∞—В –Є –і—А.) – —В–∞–±–ї–µ—В–Ї–∞ 70 –Љ–≥ 1 —А–∞–Ј –≤ –љ–µ–і–µ–ї—О, –Є–±–∞–љ–і—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ – —В–∞–±–ї–µ—В–Ї–∞ 150 –Љ–≥ 1 —А–∞–Ј –≤ –Љ–µ—Б—П—Ж –Є–ї–Є —А–∞—Б—В–≤–Њ—А 3 –Љ–≥ 1 —А–∞–Ј –≤ 3 –Љ–µ—Б—П—Ж–∞ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ —Б—В—А—Г–є–љ–Њ (15–20 —Б), –Ј–Њ–ї–µ–љ–і—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ – —А–∞—Б—В–≤–Њ—А 5 –Љ–≥ 1 —А–∞–Ј –≤ –≥–Њ–і –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Ї–∞–њ–µ–ї—М–љ–Њ (15–20 –Љ–Є–љ.).
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є
–Ї–Є—Б–ї–Њ—В—Л, –Ї–∞–Ї —Б—А–µ–і—Б—В–≤–∞
–і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П
–љ–Є–Ј–Ї–Њ—В—А–∞–≤–Љ–∞—В–Є—З–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤
–Р–ї–µ–љ–і—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ – –љ–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ—Л–є –С–§, –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ –і–ї—П –ї–µ—З–µ–љ–Є—П –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Б 1995 –≥–Њ–і–∞. –Ь–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–Њ–Ї–∞–Ј–∞–ї–Є –µ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—В—М –њ–Њ—В–µ—А—О –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є –њ—А–Є –њ—А–Є–µ–Љ–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –і–Њ–Ј—Л 5 –Љ–≥ –µ–ґ–µ–і–љ–µ–≤–љ–Њ —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –±–µ–Ј –Ю–Я [15], –∞ —В–∞–Ї–ґ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М –Ь–Я–Ъ –≤ –і–Њ–Ј–µ 5 –Є 10 –Љ–≥ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, —Б—В—А–∞–і–∞—О—Й–Є—Е –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ—Л–Љ –Ю–Я [16,17]. –Р–ї–µ–љ–і—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ –Ј–љ–∞—З–Є–Љ–Њ —Б–љ–Є–ґ–∞–µ—В —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —В–µ–ї –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤ [16,17] –Є –≤–љ–µ–њ–Њ–Ј–≤–Њ–љ–Њ—З–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [17] —Г –ґ–µ–љ—Й–Є–љ —Б –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–Њ–Љ –Є –њ–µ—А–µ–ї–Њ–Љ–∞–Љ–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –∞ —В–∞–Ї–ґ–µ —Г –ґ–µ–љ—Й–Є–љ —Б –Ю–Я –±–µ–Ј –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [19]. –Я—А–Њ—В–Є–≤–Њ–њ–µ—А–µ–ї–Њ–Љ–љ–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –і–∞–ґ–µ —Г –ґ–µ–љ—Й–Є–љ —Б –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ (–±–Њ–ї—М–љ—Л–µ —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –њ–Њ—В–µ—А–µ–є –Ї–Њ—Б—В–љ–Њ–є –Љ–∞—Б—Б—Л –Є–ї–Є –ґ–µ–љ—Й–Є–љ—Л —Б—В–∞—А—И–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞) [20]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Њ—В–Є–≤–Њ–њ–µ—А–µ–ї–Њ–Љ–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 2.
–Ъ—А—Г–њ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ (Fracture Intervention Trial – FIT) –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –∞–ї–µ–љ–і—А–Њ–љ–∞—В, –±–ї–∞–≥–Њ–і–∞—А—П —Г–Љ–µ–љ—М—И–µ–љ–Є—О —З–Є—Б–ї–∞ –і–љ–µ–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –≤ –њ–Њ—Б—В–µ–ї–Є, –Є –і–љ–µ–є —Б –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ–є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О [21]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ —Б–ї–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Є –њ—А–Є–µ–Љ–µ –њ—А–µ–њ–∞—А–∞—В–∞ (–љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М —В–∞–±–ї–µ—В–Ї—Г —Б—В—А–Њ–≥–Њ –љ–∞—В–Њ—Й–∞–Ї, –Ј–∞–њ–Є–≤–∞—В—М –њ–Њ–ї–љ—Л–Љ —Б—В–∞–Ї–∞–љ–Њ–Љ –≤–Њ–і—Л, 30 –Љ–Є–љ—Г—В –љ–µ –њ—А–Є–љ–Є–Љ–∞—В—М –њ–Є—Й—Г –Є –љ–∞—Е–Њ–і–Є—В—М—Б—П –≤ –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є), –∞ —В–∞–Ї–ґ–µ –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –Ї—А–∞–є–љ–µ –љ–Є–Ј–Ї–Њ–є –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –ї–µ—З–µ–љ–Є—О. –≠—В–Њ –њ–Њ—Б–ї—Г–ґ–Є–ї–Њ —Б—В–Є–Љ—Г–ї–Њ–Љ –Ї –і–∞–ї—М–љ–µ–є—И–Є–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ –Є —Б–Њ–Ј–і–∞–љ–Є—О —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Д–Њ—А–Љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ – —В–∞–±–ї–µ—В–Њ–Ї –њ–Њ 70 –Љ–≥, –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л—Е 1 —А–∞–Ј –≤ –љ–µ–і–µ–ї—О. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л 70 –Љ–≥ 1 —А–∞–Ј –≤ –љ–µ–і–µ–ї—О –±—Л–ї–Њ —В–∞–Ї–ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –і–ї—П —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Ь–Я–Ъ, –Ї–∞–Ї –Є —А–∞–љ–µ–µ –Є—Б–њ—Л—В–∞–љ–љ–Њ–є –і–Њ–Ј–Є—А–Њ–≤–Ї–Є 10 –Љ–≥ 1 —А–∞–Ј –≤ —Б—Г—В–Ї–Є [22]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ –і–Њ–Ј–µ 70 –Љ–≥ 1 —А–∞–Ј –≤ –љ–µ–і–µ–ї—О —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –µ–ґ–µ–і–љ–µ–≤–љ–Њ–Љ—Г –њ—А–Є–µ–Љ—Г 10 –Љ–≥ –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Њ—Ж–µ–љ–Є–≤–∞—О—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ —Б–љ–Є–ґ–µ–љ–Є—О —А–Є—Б–Ї–∞ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ 3–4 –ї–µ—В. –Я–∞—Ж–Є–µ–љ—В—Л, –њ–Њ–ї—Г—З–∞—О—Й–Є–µ –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г, –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –≤ —В–µ—З–µ–љ–Є–µ 10 –Є –±–Њ–ї–µ–µ –ї–µ—В. –Ы–µ—З–µ–љ–Є–µ –∞–ї–µ–љ–і—А–Њ–љ–∞—В–Њ–Љ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Њ –њ–Њ–≤—Л—И–µ–љ–Є—О –Ь–Я–Ъ –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –ї–µ—З–µ–љ–Є—П (+13,7% –≤ –њ–Њ—П—Б–љ–Є—З–љ–Њ–Љ –Њ—В–і–µ–ї–µ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞ –Є 6,7% –≤ –±–µ–і—А–µ) [23]. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–Ї—А–∞—В–Є–ї–Є –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞, –Ь–Я–Ъ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–ї–Њ—Б—М. –Ю–і–љ–∞–Ї–Њ —Г –±–Њ–ї—М–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–µ –љ–µ–њ—А–µ—А—Л–≤–љ–Њ –њ—А–Є–љ–Є–Љ–∞–ї–Є –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г –≤ —В–µ—З–µ–љ–Є–µ 5 –ї–µ—В –Є –Ј–∞—В–µ–Љ –њ—А–µ–Ї—А–∞—В–Є–ї–Є –ї–µ—З–µ–љ–Є–µ, —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–∞—А–Ї–µ—А–Њ–≤ –Ї–Њ—Б—В–љ–Њ–≥–Њ —А–∞–Ј—А—Г—И–µ–љ–Є—П —Б–Њ—Е—А–∞–љ—П–ї–Њ—Б—М –µ—Й–µ 5 –ї–µ—В, –Є –ї–Є—И—М —Г —З–µ—В–≤–µ—А—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–∞—А–Ї–µ—А—Л –Ї–Њ—Б—В–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ–Њ–≤—Л—И–∞–ї–Є—Б—М —З–µ—А–µ–Ј 1 –≥–Њ–і –њ–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –Є —Н—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Є —Б–љ–Є–ґ–µ–љ–Є—О –Ь–Я–Ъ [24]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є —А–Є—Б–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –љ–Њ–≤—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г 10 –ї–µ—В –Є —В–Њ–ї—М–Ї–Њ 5 –ї–µ—В —Б –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ –µ—Й–µ 5 –ї–µ—В, –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ. –У–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ї–Њ—Б—В–љ—Л—Е –±–Є–Њ–њ—Б–Є–є –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –∞–ї–µ–љ–і—А–Њ–љ–∞—В –≤ —В–µ—З–µ–љ–Є–µ 10 –ї–µ—В, –≤—Л—П–≤–Є–ї–Њ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –Ї–Њ—Б—В–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –љ–∞—А—Г—И–µ–љ–Є—П –Ї–Њ—Б—В–љ–Њ–є –Љ–Є–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–Є [25]. –Ю–і–љ–∞–Ї–Њ –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–Є–Ј–Ї—Г—О –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –ї–µ—З–µ–љ–Є—О, –і–∞–ґ–µ —Б—А–µ–і–Є –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –њ—А–µ–њ–∞—А–∞—В 1 —А–∞–Ј –≤ –љ–µ–і–µ–ї—О [26]. –Э–Њ–≤—Л–µ –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В—Л —Б –±–Њ–ї–µ–µ —А–µ–і–Ї–Є–Љ —А–µ–ґ–Є–Љ–Њ–Љ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –±—Л–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л –≤ —В–Њ–Љ —З–Є—Б–ї–µ –і–ї—П —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П. –•–Њ—В—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В—Л, –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –њ—А–µ–і–њ–Њ—З–Є—В–∞—О—В –њ—А–Є–љ–Є–Љ–∞—В—М –њ—А–µ–њ–∞—А–∞—В —А–µ–ґ–µ [27,28], —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –і–Њ–Ї–∞–Ј–∞–≤—И–Є—Е –±–Њ–ї—М—И—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–±–∞–љ–і—А–Њ–љ–Њ–≤–Њ–є –Є–ї–Є –Ј–Њ–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є, –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В. –°–њ–µ–Ї—В—А –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —И–Є—А–µ (—В–∞–±–ї. 2), —В.–Ї. –±—Л–ї–Є –њ—А–Њ–≤–µ–і–µ–љ—Л –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ —Г –Љ—Г–ґ—З–Є–љ [29] –Є —Г –±–Њ–ї—М–љ—Л—Е —Б –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л–Љ –Ю–Я [30].
–Ш–Љ–µ—О—В—Б—П —В–∞–Ї–ґ–µ –і–∞–љ–љ—Л–µ –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ –і–Њ–Ј–µ 35 –Љ–≥ –і–ї—П –њ–Њ–≤—Л—И–µ–љ–Є—П –Ь–Я–Ъ —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —Б –Ю–Я –Є —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ —В–Є—А–µ–Њ—В–Њ–Ї—Б–Є–Ї–Њ–Ј–Њ–Љ –љ–∞ —Д–Њ–љ–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Н—Г—В–Є—А–µ–Њ–Ј–∞ [31]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–ї–Њ–≤–Є–љ–љ–Њ–є –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞ (35 –Љ–≥) –њ–Њ–Ї–∞–Ј–∞–ї–Є –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і–ї—П —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Ь–Я–Ъ —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —Б –Њ—Б—В–µ–Њ–њ–µ–љ–Є–µ–є [32].
–Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П
–Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ
–∞–ї–µ–љ–і—А–Њ–љ–∞—В–∞
–Ъ –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –≤–Њ–њ—А–Њ—Б—Л –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ю–Я –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Б —А–∞–Ј–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ –Є–Ј—Г—З–∞—О—В—Б—П, –љ–Њ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞ –њ–Њ –≤–Њ–њ—А–Њ—Б—Г –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–µ—В, —В.–Ї. –њ–Њ—З—В–Є –≤–Њ –≤—Б–µ—Е —А–∞–±–Њ—В–∞—Е –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –і–∞–љ–љ—Л–µ –њ–Њ –њ–µ—А–µ–ї–Њ–Љ–∞–Љ. –Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –Ї–∞–Ї –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —А–∞–Ј–љ—Л—Е –њ–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Г –і–µ–є—Б—В–≤–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —В–∞–Ї –Є –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л–µ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П. –°–Њ—З–µ—В–∞–љ–Є–µ –∞–ї–µ–љ–і—А–Њ–љ–∞—В–∞ –Є —Н—Б—В—А–Њ–≥–µ–љ––≥–µ—Б—В–∞–≥–µ–љ–љ–Њ–є –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Ч–У–Ґ) —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –Њ–Ї–∞–Ј—Л–≤–∞–ї–Њ –±–Њ–ї–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –љ–∞ –Ь–Я–Ъ –Є –Ї–Њ—Б—В–љ—Л–µ –Љ–∞—А–Ї–µ—А—Л, —З–µ–Љ –Ї–∞–ґ–і—Л–є –≤–Є–і —В–µ—А–∞–њ–Є–Є –≤ –Њ—В–і–µ–ї—М–љ–Њ—Б—В–Є. –Ю–і–љ–∞–Ї–Њ –љ–µ—В –і–∞–љ–љ—Л—Е –Њ–± —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –њ–Њ–і –Є—Е –≤–ї–Є—П–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [33–35].
–Я—А–Њ–≤–µ–і–µ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–ї–Є—П–љ–Є—П —А–∞–ї–Њ–Ї—Б–Є—Д–µ–љ–∞ 60 –Љ–≥, –∞–ї–µ–љ–і—А–Њ–љ–∞—В–∞ 10 –Љ–≥ –Є –Є—Е —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –љ–∞ –Ь–Я–Ъ –Є –Љ–∞—А–Ї–µ—А—Л –Ї–Њ—Б—В–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≤ —В–µ—З–µ–љ–Є–µ 12 –Љ–µ—Б. –ї–µ—З–µ–љ–Є—П —Г 331 –ґ–µ–љ—Й–Є–љ—Л –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –і–Њ 75 –ї–µ—В (–Ґ––Ї—А–Є—В–µ—А–Є–є –њ–Њ —И–µ–є–Ї–µ –±–µ–і—А–∞ –Љ–µ–љ–µ–µ –2,0) [36]. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–ї–µ–љ–і—А–Њ–љ–∞—В–∞ –±—Л–ї–Њ –њ–Њ—З—В–Є –≤ 2 —А–∞–Ј–∞ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –њ–Њ –њ—А–Є–±–∞–≤–Ї–µ –Ь–Я–Ъ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є —А–∞–ї–Њ–Ї—Б–Є—Д–µ–љ–Њ–Љ. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Н—В–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Њ–Ї–∞–Ј—Л–≤–∞–ї–∞ –µ—Й–µ –±–Њ–Ю–ї—М—И–Є–є —Н—Д—Д–µ–Ї—В –љ–∞ –Ь–Я–Ъ, –љ–Њ –љ–µ–Є–Ј–≤–µ—Б—В–љ–Њ, –≤–ї–Є—П–µ—В –ї–Є —Н—В–Њ –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–∞ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤.
–Я—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –∞–љ–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ (–њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ—Л–є –≥–Њ—А–Љ–Њ–љ – –Я–Ґ–У) –Є –∞–љ—В–Є—А–µ–Ј–Њ—А–±—В–Є–≤–љ—Л–Љ (–∞–ї–µ–љ–і—А–Њ–љ–∞—В) –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–ї–Њ—Б—М, —З—В–Њ –∞–ї–µ–љ–і—А–Њ–љ–∞—В, —Г–Љ–µ–љ—М—И–∞—П –Ї–Њ—Б—В–љ—Г—О —А–µ–Ј–Њ—А–±—Ж–Є—О, –њ–Њ–Ј–≤–Њ–ї–Є—В –і–Њ—Б—В–Є—З—М –ї—Г—З—И–µ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –≤ —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Ь–Я–Ъ. –Ю–і–љ–∞–Ї–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ —В–µ—А–Є–њ–∞—А–∞—В–Є–і–Њ–Љ –Є –∞–ї–µ–љ–і—А–Њ–љ–∞—В–Њ–Љ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –Љ–µ–љ–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ, —З–µ–Љ –ї–µ—З–µ–љ–Є–µ —В–Њ–ї—М–Ї–Њ —В–µ—А–Є–њ–∞—А–∞—В–Є–і–Њ–Љ –Ї–∞–Ї —Г –ґ–µ–љ—Й–Є–љ [37], —В–∞–Ї –Є —Г –Љ—Г–ґ—З–Є–љ —Б—В–∞—А—И–µ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є [38]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П –Я–Ґ–У –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –і–Њ–±–Є—В—М—Б—П –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Ь–Я–Ъ [39].
–Ш–љ—В–µ—А–µ—Б–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –∞–ї–µ–љ–і—А–Њ–љ–∞—В–Њ–Љ –Є –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Є–Ј –≥—А—Г–њ–њ—Л –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D – –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–Њ–Љ. –Я—А–Є–µ–Љ –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л 70 –Љ–≥ 1 —А–∞–Ј –≤ –љ–µ–і–µ–ї—О –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–Њ–Љ –≤ –і–Њ–Ј–µ 1 –Љ–Ї–≥ –µ–ґ–µ–і–љ–µ–≤–љ–Њ –Є 500 –Љ–≥ –Ї–∞–ї—М—Ж–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї –і–Њ–±–Є—В—М—Б—П –ї—Г—З—И–µ–є –њ—А–Є–±–∞–≤–Ї–Є –Ь–Я–Ъ –≤ –њ–Њ—П—Б–љ–Є—З–љ–Њ–Љ –Њ—В–і–µ–ї–µ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞, –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –±–µ–і—А–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –∞–ї–µ–љ–і—А–Њ–љ–∞—В–∞ –Є –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D —Б –Ї–∞–ї—М—Ж–Є–µ–Љ —Г –њ–Њ–ґ–Є–ї—Л—Е –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Є–Љ–µ–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —А–Є—Б–Ї–∞ –њ–∞–і–µ–љ–Є–є –Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ [40].
–С–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –∞–ї–µ–љ–і—А–Њ–љ–∞—В–Њ–Љ –Є –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л
–Я—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є –і–ї—П —В–µ—А–∞–њ–Є–Є –∞–ї–µ–љ–і—А–Њ–љ–∞—В–Њ–Љ —П–≤–ї—П—О—В—Б—П –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –њ—А–µ–њ–∞—А–∞—В—Г, –≥–Є–њ–Њ–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П, –љ–∞–ї–Є—З–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –њ–Є—Й–µ–≤–Њ–і–∞ (–љ–∞–њ—А–Є–Љ–µ—А, –∞—Е–∞–ї–∞–Ј–Є—П –Є–ї–Є —Б—В—А–Є–Ї—В—Г—А–∞), —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Ї–Њ—А–Њ—Б—В–Є –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є –Љ–µ–љ–µ–µ 30 –Љ–ї/–Љ–Є–љ. –Р–ї–µ–љ–і—А–Њ–љ–∞—В —Б–ї–µ–і—Г–µ—В —Б –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М—О –њ—А–Є–Љ–µ–љ—П—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (–Ц–Ъ–Ґ) –Є –Є–Ј–±–µ–≥–∞—В—М –µ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б—В—А—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ. –†–µ–Ј—Г–ї—М—В–∞—В—Л 10––ї–µ—В–љ–µ–≥–Њ –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–ї–µ–љ–і—А–Њ–љ–∞—В–∞ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є (–Э–ѓ) –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 3 [23].
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј —В–∞–±–ї–Є—Ж—Л 3, –і–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Є–µ–Љ –∞–ї–µ–љ–і—А–Њ–љ–∞—В–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–µ —Г–≤–µ–ї–Є—З–Є–ї —З–Є—Б–ї–Њ –Э–ѓ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–µ–Љ–Є, –Ї—В–Њ 5 –њ–Њ—Б–ї–µ–і–љ–Є–µ –ї–µ—В –љ–µ –њ—А–Є–љ–Є–Љ–∞–ї —Н—В–Њ—В –њ—А–µ–њ–∞—А–∞—В, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –Э–ѓ —Б–Њ—Б—В–Њ—А–Њ–љ—Л –Ц–Ъ–Ґ. –Э–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ (—Н–Ј–Њ—Д–∞–≥–Є—В, —Н—А–Њ–Ј–Є–Є, –≥–µ–Љ–Њ—А—А–∞–≥–Є–Є, —А–µ—Д–ї—О–Ї—Б, –≥–∞—Б—В—А–Є—В, —П–Ј–≤–∞ –ґ–µ–ї—Г–і–Ї–∞ –Є –і—А.) –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –≤ –µ—Й–µ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –њ—А–Є –њ—А–Є–µ–Љ–µ –∞–ї–µ–љ–і—А–Њ–љ–∞—В–∞ –≤ –і–Њ–Ј–µ 70 –Љ–≥ [41].
–У–Є–њ–Њ–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П –Є –і—А—Г–≥–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –і–Њ–ї–ґ–љ—Л –±—Л—В—М —Б–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞–љ—Л –і–Њ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П –∞–ї–µ–љ–і—А–Њ–љ–∞—В–Њ–Љ. –Я–Њ –љ–∞—И–Є–Љ –і–∞–љ–љ—Л–Љ [42], –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –ї–µ—З–µ–љ–Є—П –∞–ї–µ–љ–і—А–Њ–љ–∞—В–Њ–Љ –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ–µ–є –Ї–∞–ї—М—Ж–Є—П –Є —Д–Њ—Б—Д–Њ—А–∞ –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Я–Ґ–У. –Э–Њ –Ї–Њ–ї–µ–±–∞–љ–Є—П —Н—В–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –њ—А–µ–і–µ–ї–∞—Е –Є—Е –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є. –Э–∞—И–Є –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –і–Њ–±–∞–≤–Ї–Є —В–Њ–ї—М–Ї–Њ 500 –Љ–≥ –Ї–∞–ї—М—Ж–Є—П, —З—В–Њ, –≤–µ—А–Њ—П—В–љ–Њ, –±—Л–ї–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –≥–Є–њ–Њ–Ї–∞–ї—М—Ж–Є–µ–Љ–Є–Є. –Т —В–∞–±–ї–Є—Ж–µ 4 —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –њ—А–∞–≤–Є–ї—М–љ–Њ–Љ—Г –њ—А–Є–µ–Љ—Г –∞–ї–µ–љ–і—А–Њ–љ–∞—В–∞ –і–ї—П –Љ–Є–љ–Є–Љ–Є–Ј–∞—Ж–Є–Є –Э–ѓ.
–Я–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –∞–Ї—В–Є–≤–љ–Њ –Њ–±—Б—Г–ґ–і–∞—О—В—Б—П —В–∞–Ї–Є–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В–Њ–≤, –Ї–∞–Ї –Њ—Б—В–µ–Њ–љ–µ–Ї—А–Њ–Ј —З–µ–ї—О—Б—В–Є, —Д–Є–±—А–Є–ї—П—Ж–Є—П –њ—А–µ–і—Б–µ—А–і–Є–є, –њ–Њ—З–µ—З–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –Є —А–∞–Ј–≤–Є—В–Є–µ –љ–Є–Ј–Ї–Њ—Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Є—Е —З—А–µ–Ј–≤–µ—А—В–µ–ї—М–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –Ю—Б—В–µ–Њ–љ–µ–Ї—А–Њ–Ј —З–µ–ї—О—Б—В–Є – —Н—В–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П, –Ї–∞–Ї –Њ—В–Ї—А—Л—В—Л–є —Г—З–∞—Б—В–Њ–Ї –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї–Њ—Б—В–Є –≤ –Ј–Њ–љ–µ –≤–µ—А—Е–љ–µ–є –Є–ї–Є –љ–Є–ґ–љ–µ–є —З–µ–ї—О—Б—В–Є, –љ–µ –Ј–∞–ґ–Є–≤–∞—О—Й–Є–є –≤ —В–µ—З–µ–љ–Є–µ 6–8 –љ–µ–і–µ–ї—М, —З—В–Њ –±—Л–ї–Њ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ –≤—А–∞—З–Њ–Љ [43,44]. –Ю—В–і–µ–ї—М–љ—Л–µ —Б–ї—Г—З–∞–Є –Њ—Б—В–µ–Њ–љ–µ–Ї—А–Њ–Ј–∞ —З–µ–ї—О—Б—В–Є –±—Л–ї–Є –Њ–њ–Є—Б–∞–љ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В—Л, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –∞–ї–µ–љ–і—А–Њ–љ–∞—В –њ–Њ –њ–Њ–≤–Њ–і—Г –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞, –Њ–і–љ–∞–Ї–Њ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Б–ї—Г—З–∞–µ–≤ —Б–≤—П–Ј–∞–љ–Њ —Б –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л—Е –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В–Њ–≤ –і–ї—П —В–µ—А–∞–њ–Є–Є –Ї–Њ—Б—В–љ—Л—Е –Љ–µ—В–∞—Б—В–∞–Ј–Њ–≤ —Г –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е [45–47]. –Ю–њ–Є—Б–∞–љ—Л —Б–ї—Г—З–∞–Є –љ–µ–Ї—А–Њ–Ј–∞ —З–µ–ї—О—Б—В–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–µ—З–µ–љ–Є—П –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В–∞–Љ–Є [48,49].
–£–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–ї—Г—З–∞–µ–≤ —Д–Є–±—А–Є–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є –±—Л–ї–Њ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ —В–Њ–ї—М–Ї–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ј–Њ–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ [50]. –Ф–∞–љ–љ—Л–є –њ–Њ–±–Њ—З–љ—Л–є —Н—Д—Д–µ–Ї—В –љ–∞–±–ї—О–і–∞–ї—Б—П, –Ї–Њ–≥–і–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Г–ґ–µ –љ–µ –±—Л–ї–Њ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є. –Т –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –і—А—Г–≥–Є—Е –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В–Њ–≤ —В–∞–Ї–Њ–≥–Њ –Э–ѓ –Њ–њ–Є—Б–∞–љ–Њ –љ–µ –±—Л–ї–Њ –Є, –±–Њ–ї–µ–µ —В–Њ–≥–Њ, –≤ –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ј–Њ–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –Ї–Њ–≥–і–∞ –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –њ–Њ–ї—Г—З–∞–ї–Є –≤–Є—В–∞–Љ–Є–љ D –≤ –і–Њ–Ј–µ 50000–125000 –Х–Ф, —Б–ї—Г—З–∞–µ–≤ —Д–Є–±—А–Є–ї—П—Ж–Є–Є –њ—А–µ–і—Б–µ—А–і–Є–є –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ –љ–µ –±—Л–ї–Њ [51]. –Я–Њ—З–µ—З–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л—Е –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В–Њ–≤ –±—Л–ї–Є –Њ–њ–Є—Б–∞–љ—Л –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ —Г –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Ю–і–љ–∞ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –Њ–±—Б—Г–ґ–і–∞–µ–Љ—Л—Е –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Њ–±–ї–µ–Љ – —Н—В–Њ —А–∞–Ј–≤–Є—В–Є–µ –љ–Є–Ј–Ї–Њ—В—А–∞–≤–Љ–∞—В–Є—З–љ—Л—Е —З—А–µ–Ј–≤–µ—А—В–µ–ї—М–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –±–µ–і—А–∞ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –С–§. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ 9063 –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –ї–µ—З–µ–љ–Є–µ –С–§ –Љ–µ–љ–µ–µ 2 –ї–µ—В, —Б–ї—Г—З–∞–Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –±–µ–і—А–∞ —Б–Њ—Б—В–∞–≤–Є–ї–Є 8,43 –љ–∞ 1000 –њ–∞—Ж–Є–µ–љ—В–Њ––ї–µ—В, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Б—А–µ–і–Є –±–Њ–ї—М–љ—Л—Е, –њ—А–Є–≤–µ—А–ґ–µ–љ–љ—Л—Е –Ї –ї–µ—З–µ–љ–Є—О 2 –≥–Њ–і–∞ – –ї–Є—И—М 4,67 –љ–∞ 1000 –њ–∞—Ж–Є–µ–љ—В–Њ–≤––ї–µ—В (p=0,016) [52]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ, –Њ–њ–Є—Б–∞–љ—Л –µ–і–Є–љ–Є—З–љ—Л–µ —Б–ї—Г—З–∞–Є —З—А–µ–Ј–≤–µ—А—В–µ–ї—М–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –ї–µ—З–µ–љ–Є–µ –∞–ї–µ–љ–і—А–Њ–љ–∞—В–Њ–Љ –±–Њ–ї–µ–µ 5 –Є–ї–Є 6 –ї–µ—В. –Ю–љ–Є –Њ—В–ї–Є—З–∞—О—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–Њ–є: –њ—А–Њ—Б—В—Л–µ –њ–Њ–њ–µ—А–µ—З–љ—Л–µ –Є–ї–Є –Ї–Њ—Б—Л–µ –њ–µ—А–µ–ї–Њ–Љ—Л —Б —Г—В–Њ–ї—Й–µ–љ–Є–µ–Љ –Ї–Њ—А—В–Є–Ї–∞–ї—М–љ–Њ–≥–Њ —Б–ї–Њ—П –≤–Њ–Ї—А—Г–≥ –њ–µ—А–µ–ї–Њ–Љ–∞ [53].
–Ю–і–љ–∞–Ї–Њ —Б–ї—Г—З–∞–Є —В–∞–Ї–Є—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ —А–µ–і–Ї–Є –Є –љ–µ—Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л —Б –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, –Ї–Њ—В–Њ—А—Л—Е —Г–і–∞–µ—В—Б—П –Є–Ј–±–µ–ґ–∞—В—М –±–ї–∞–≥–Њ–і–∞—А—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –С–§. –Х–і–Є–љ—Б—В–≤–µ–љ–љ–Њ–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –Љ–Њ–ґ–µ—В –Њ–±—Б—Г–ґ–і–∞—В—М—Б—П –≤ —Б–≤—П–Ј–Є —Б –Њ–њ–Є—Б–∞–љ–Є–µ–Љ –њ–Њ–і–Њ–±–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–ї—Г—З–∞–µ–≤ – —Н—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –С–§ –њ–Њ—Б–ї–µ 5 –ї–µ—В –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —В–Њ–ї—М–Ї–Њ —В–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ, —Г –Ї–Њ—В–Њ—А—Л—Е —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ—А–µ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –Љ–µ–ґ–≤–µ—А—В–µ–ї—М–љ—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, —В.–µ. –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –љ–µ–њ—А–µ—А—Л–≤–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –С–§ –њ—П—В–Є–ї–µ—В–љ–Є–Љ —Б—А–Њ–Ї–Њ–Љ –і–ї—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –С–§ —П–≤–ї—П—О—В—Б—П –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –Ю–Я, –∞ –∞–ї–µ–љ–і—А–Њ–љ–∞—В –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ –і–ї—П –ї–µ—З–µ–љ–Є—П —Б—В–µ—А–Њ–Є–і–љ–Њ–≥–Њ –Ю–Я –Є –Ю–Я —Г –Љ—Г–ґ—З–Є–љ. –°–Њ–≥–ї–∞—Б–љ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ, –њ—А–Є–љ—П—В—Л–Љ –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б—В—А–∞–љ–∞—Е, –Є–Љ–µ–љ–љ–Њ –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ —Г–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –Ї–∞–Ї –њ—А–µ–њ–∞—А–∞—В –њ–µ—А–≤–Њ–≥–Њ –≤—Л–±–Њ—А–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ю–Я —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є —Б—В–Њ–Є–Љ–Њ—Б—В–Є [54,55]. –Э–µ–Љ–∞–ї–Њ–≤–∞–ґ–љ—Л–Љ —И–∞–≥–Њ–Љ –≤ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–Є —Б—В–Њ–Є–Љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –∞–ї–µ–љ–і—А–Њ–љ–∞—В–Њ–Љ —Б—В–∞–ї–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –≥–µ–љ–µ—А–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Э–∞–њ—А–Є–Љ–µ—А, —Б–Њ–≥–ї–∞—Б–љ–Њ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–Љ—Г —Б–∞–є—В—Г –љ–∞–ї–Є—З–Є—П –Є —Б—В–Њ–Є–Љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –∞–њ—В–µ–Ї–∞—Е –Ь–Њ—Б–Ї–≤—Л www.medlux.ru —Б—А–µ–і–љ—П—П —Б—В–Њ–Є–Љ–Њ—Б—В—М –≥–Њ–і–Њ–≤–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ґ–µ–≤–∞–љ–∞—В–Њ–Љ (–∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ – –≥–µ–љ–µ—А–Є—З–µ—Б–Ї–Є–є –њ—А–µ–њ–∞—А–∞—В –Ї–Њ–Љ–њ–∞–љ–Є–Є –Ґ–µ–≤–∞) —Б–Њ—Б—В–∞–≤–ї—П–µ—В 10800 —А—Г–±., –§–Њ—Б–∞–Љ–∞–Ї—Б–Њ–Љ (–∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ – –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –Ї–Њ–Љ–њ–∞–љ–Є–Є –Ь–µ—А–Ї) – 24000 —А—Г–±., –С–Њ–љ–≤–Є–≤–∞ (–Є–±–∞–љ–і—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ 150 –Љ–≥) – 16800 —А—Г–±., –Р–Ї–ї–∞—Б—В–∞ (–Ј–Њ–ї–µ–љ–і—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞) – 19500 —А—Г–±. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≥–µ–љ–µ—А–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –∞–ї–µ–љ–і—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –њ—А–Њ—И–µ–і—И–Є–µ —А–µ–≥–Є—Б—В—А–∞—Ж–Є—О –≤ –Х–≤—А–Њ–њ–µ, –°–®–Р –Є –†–Њ—Б—Б–Є–Є, –њ–Њ–Ј–≤–Њ–ї—П—О—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–Њ–Ї—А–∞—В–Є—В—М —Б—В–Њ–Є–Љ–Њ—Б—В—М –њ—А–Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П.





–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Melton LJ, 3rd, Atkinson EJ, O’Connor MK, et al. (1998) Bone density and fracture risk in men. J Bone Miner Res, 1998, 13:1915.
2. Melton LJ, 3rd, Chrischilles EA, Cooper C, et al. (1992) Perspective. How many women have osteoporosis? J Bone Miner Res, 1992, 7:1005.
3. Kanis JA, Johnell O, Oden A, et al.: Long–term risk of osteoporotic fracture in Malmo. Osteoporos Int, 2000, 11:669.
4. Melton LJ, 3rd, Crowson CS and O’Fallon WM Fracture incidence in Olmsted County, Minnesota: comparison of urban with rural rates and changes in urban rates over time. Osteoporos Int, 1999 9:29.
5. Johnell O and Kanis JA (2006) An estimate of the worldwide prevalence and disability associated with osteoporotic fractures. Osteoporos Int, 2006, 17:1726.
6. World Health Organisation. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. WHO Technical Reports Series 843. WHO, Geneve; 1994.
7. Kanis JA, Melton LJ, Christiansen C, et.al. The diagnosis of osteoporosis.// J. Bone Mineral Research, 1994, 9, pp. 1137–1141.
8. –Ы–µ—Б–љ—П–Ї –Ю.–Ь., –С–µ–љ–µ–≤–Њ–ї–µ–љ—Б–Ї–∞—П –Ы.–Ш.: «–Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј. –Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ» –Є–Ј–і–∞—В–µ–ї—М—Б—В–≤–Њ «–У—Н–Њ—В–∞—А––Ь–µ–і–Є–∞, 2009, —Б—В—А. 74–81.
9. Kanis JA and World Health Organization Scientific Group. Assessment of osteoporosis at the primary health care level. Report of a WHO Scientific Group. 2008. University of Shefield, UK.
10. Kanis JA, Johnell O, De Laet C, Johanson H, Oden A, Ogelsby AK.: International variations of hip fracture probability: implications for risk assessment.// J. Bone Mineral Reserch, 2002, Vol. 17, pp. 1237–1244.
11. Kanis JA, Burlet N, Cooper C, Delmas PD, Reginster J–Y, Borgstrom F, Rizzoli R.: European guidance for the diagnosis and management of osteoporosis in postmenopausal women, 2008.
12. Russell RGG, Watts NB, Ebetino FH, Rogers MJ.: Mechanisms of action of bisphosphonates: similarities and differences and their potential influence on clinical efficacy.// Osteoporosis International, 2008, Vol. 19, pp. 733–759.
13. Delmas PD, Stenner D, Wahner HW, et.al.: Serum bone glaprotein increases with aging in normal women: implication for the mechanism of age–related bone loss.// J. Clinical Investigation, 1983, Vol. 71, pp. 1316–1321.
14. Plotkin LI, Manolagas SC, Bellido T.: Dissociation of the pro–apoptotic effects of bisphosphonates on osteoclast from their anti–apoptotic effects on osteoblasts/osteocytes with novel analogs.// J. Bone, 2006, Vol. 39, pp. 443–452.
15. McClung M, et.al.: Alendronate prevents postmenopausal bone loss in women without osteoporosis.// Annual Internal Medicine, 1998, Vol. 128, pp. 253–261.
16. Liberman UA, et.al.: Effect of oral alendronate on bone mineral density and the incidence of fractures in postmenopausal osteoporosis.// New England J. Medicine, 1995, Vol. 333, pp. 1437–1443.
17. Black DM, et al.: Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures.// J. Lancet, 1996, Vol. 348, pp. 1535–1541.
18. Black DM, et al.: Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures.// J. Lancet, 1996, Vol. 348, pp. 1535–1541.
19. Cummings SR, et.al.: Effect of alendronate on risk of fracture in women with low bone mineral density but without vertebral fractures.// JAMA, 1998, Vol. 208, pp. 2077–2082.
20. Ensrud KE, et.al.: Treatment with alendronate prevents fractures in women at highest risk.// Arch Int Med, 1997, Vol. 157, pp. 2617–2624.
21. Nevitt MC, et al.: Effect of alendronate on limited–activity days and bed–disability days caused by back pain in postmenopausal women with existing vertebral fractures// J. Arch Int Med, 2000, Vol. 160, pp. 77–85.
22. Rizzoli R, et.al.: Two–year results of once–weekly administration of alendronate 70 mg for the treatment of postmenopausal osteoporosis.// J. Bone Miner. Res., 2002, Vol. 17, pp. 1988–1996.
23. Bone HG, et.al.:Ten years experience with alendronate for osteoporosis in postmenopausal women.// New England J. Medicine, 2004, Vol. 350, pp. 1189–1199.
24. Bauer DC, et.al.: Increased bone turnover after discontinuing alendronate predicts bone loss over 5 years, the FLEX study.// J Bone Mineral Research, 2005, Vol. 20, suppl. 1, s 95.
25. Recker RR, et.al.: Normal bone histomorphometry and 3D microarchitecture after 10 years of alendronate treatment of postmenopausal women.// J. Bone Mineral Res, 19 Suppl 1, s 45.
26. Sheehy O, Kindundu C. M. Barbeau M. LeLorier J.: Differences in persistence among different weekly oral bisphosphonate medications.// J. Osteoporosis International, published ahead of printing.
27. Cooper A, Drake J, Brankin E on behalf of the persistent investigators: Treatment persistence with once–monthly ibandronate and patient support vs. once–weekly alendronate results from the PERSIST study.// International J Clinical Practice, 2006, Vol. 60, pp. 896–905.
28. Emkey R, Koltun W, Beusterien K, Seidman L, Kivitz A, Devas V, Masanauskaite D.: Patient preference for once–monthly ibandronate versus once–weekly alendronate in a randomized open–label, cross–over trial: the Bonviva Alendronate Trial in Osteoporosis (BALTO).// Current Medical Research Opinion, 2005, Vol. 21, pp. 1895–1903.
29. Orwoll E, Ettinger M, Weiss S et al.: Alendronate for the treatment of osteoporosis in men. // New England J Medicine, 2000 Vol.343: 604–610
30. Saag –ЪD R,Schnitzer TJ,Brown JP Awkins F,Goemaere S,et al. Alendronate for the prevention and treatment of glucocorticoid–induced os¬teoporosis. Glucocorticoid–induced Osteoporosis Intervention Study Group. // New England J. Medicine 1998;339:292–299.
31. –С–µ–ї–∞—П –Ц.–Х., –†–Њ–ґ–Є–љ—Б–Ї–∞—П –Ы.–ѓ., –Ъ–Њ–ї–µ—Б–љ–Є–Ї–Њ–≤–∞ –У.–°., –Ш–ї—М–Є–љ –Р.–Т., –°–∞–Ј–Њ–љ–Њ–≤–∞ –Э.–Ш., –І–µ—А–љ–Њ–≤–∞ –Ґ.–Ю., –Р–ї–µ–Ї—Б–µ–µ–≤–∞ –Ґ.–Ь., –Ф–Њ—А–Њ—Д–µ–µ–≤–∞ –Ю.–Ъ., –У–Њ–ї—М–і–Љ–∞–љ –Х.–Ш., –Я–Є–Љ–µ–љ–Њ–≤–∞ –°.–Ш., –Ь–µ–ї—М–љ–Є—З–µ–љ–Ї–Њ –У.–Р..: –Ю–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –і–Њ–Ј—Л –∞–ї–µ–љ–і—А–Њ–љ–∞—В–∞ (–§–Њ—Б–∞–Љ–∞–Ї—Б 35 –Љ–≥) –і–ї—П –ї–µ—З–µ–љ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ —Б —Б—Г–±–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ —В–Є—А–µ–Њ—В–Њ–Ї—Б–Є–Ї–Њ–Ј–Њ–Љ –Ц. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Є –Њ—Б—В–µ–Њ–њ–∞—В–Є–Є, 2007, вДЦ 1, —Б—В—А. 12–19.
32. Luckey MM, Gilchrist N, Bone HG, Davie MW, de Villiers TJ, Wu M, Daifotis AG, Santora AC, Orloff JJ.: Therapeutic equivalence of alendronate 35 milligrams once weekly and 5 milligrams daily in the prevention of postmenopausal osteoporosis Obstet Gynecol. 2003 101:711–21.
33. S.L.Greenspan; R.D. Emkey; H.G. Bone III et al. Significant differential effect of alendronate, estrogen, or combination therapy on the rate of bone loss after discontinuation of treatment of postmenopausal osteoporosis. Ann Intern Med. 2002;137:875–883.
34. Palomba S, Orio F, Colao A. et al. Effect of estrogen replacement plus low–dose alendronate treatment on bone density in surgically postmenopausal women with osteoporosis. J Clin Endocrinol Metab. 2002. 87(4):1502–1508.
35. Evio S, Tiitinen A, Laitinen K. et al. Effects of alendronate and hormone replacement therapy, alone and in combination, on bone mass and markers of bone turnover in elderly women with osteoporosis. J Clin Endocrinol Metab 2003. 89, 626–631.
36. Johnell O, Scheele WH, Lu Y, Reginster JY, Need AG, Seeman E. Additive effects of raloxifene and alendronate on bone density and biochemical markers of bone remodeling in postmenopausal women with osteoporosis. J Clin Endocrinol Metab. 2002;87:985–92.
37. Black DM, Greenspan S.L., Ensrud K.I. et al. The effects of Parathyroid hormone and Alendronate alone or in combination in postmenopausal osteoporosis. New Engl J Medicine 2003 Vol.349 pp. 1207–1215.
38. Finkelstein JS, Hayes A, Hunzelman J et al.: The effects of parathyroid hormone, alendronate, or both in men with osteoporosis. New Engl J Med 2003 Vol.349 pp. 1216–1226.
39. Rittmaster RS, Bolognese M, Ettinger M. et al.: Enhancement of bone mass in osteoporotic women with parathyroid hormone followed by alendronate. J Clin Endocrinol Metab. 2000 Vol. 85 pp.2129–2134.
40. Ringe JD, Farahmand P, Schacht E, Rozehnal A.: Superiority of a combined treatment of Alendronate and Alfacalcidol compared to the combination of Alendronate and plain vitamin D or alfacalcidol alone in established postmenopausal or male osteoporosis (AAC–Trial)// J. Rheumatology International, 2007, Vol. 27, pp. 425–434.
41. Greenspan S, Field–Munves E, Tonino R, et al. Tolerability of once–weekly alendronate in patients with osteoporosis: a randomized, double–blind, placebo–controlled study. Mayo Clin Proc. 2002 Oct;77(10):1044–52].
42. –†–Њ–ґ–Є–љ—Б–Ї–∞—П –Ы.–ѓ., –Ф–Ј–µ—А–∞–љ–Њ–≤–∞ –Ы.–Ъ., –Ь–∞—А–Њ–≤–∞ –Х.–Ш. –Є –і—А. –†–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В–Њ–Љ–—Д–Њ—Б–∞–Љ–∞–Ї—Б–Њ–Љ. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Є –Њ—Б—В–µ–Њ–њ–∞—В–Є–Є. 1998, вДЦ2, —Б.28–32.
43. Bagan J, Blade J, Cozar JM, Constela M, Garcia Sanz R, Gomez Veiga F, et al. Recommendations for the prevention, diagnosis, and treatment of osteonecrosis of the jaw (ONJ) in cancer patients treated with bisphosphonates. Med Oral Patol Oral Cir Bucal 2007;12(4):E336–340.
44. Burr DB. Summary of ASBMR Task Force on ONJ. J Musculoskelet Neuronal Interact 2007;7(4): 354–355.
45. Weitzman R, Sauter N, Eriksen EF, Tarassoff PG, Lacerna LV, Dias R, et al. Critical review: updated recommendations for the prevention, diagnosis, and treatment of osteonecrosis of the jaw in cancer patients—May 2006. Crit Rev Oncol Hematol 2007;62:148–152.
46. Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 2003;61(9):1115–1117.
47. Ruggiero SL, Mehrotra B, Rosenberg TJ, Engroff SL. Osteonecrosis of the jaws associated with the use of bisphosphonates: a review of 63 cases. J Oral Maxillofac Surg 2004;62(5):527–534.
48. Schwartz HC. Osteonecrosis of the jaws: a complication of cancer chemotherapy. Head Neck Surg1982;4(3):251–253.
49. Marx RE, Sawatari Y, Fortin M, Broumand V. Bisphosphonate–induced exposed bone (osteonecrosis/osteopetrosis) of the jaws: risk factors, recognition, prevention, and treatment. J Oral Maxillofac Surg 2005;63(11):1567–1575.
50. Black DM, Delmas PD, M.D., Eastell R, M.D. Reid IR, Boonen, Cauley JA.: Once–Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis.// New England J. Medicine, 2007;356:1809–1822.
51. Lyles KW, Colon–Emeric CS, Sc MH.. et all.: Zolendronic acid and clinical fractures and mortality after hip fractures.// New England J. Medicine, 2007 Vol. 357, pp.1799–1809.
52. Curtis JR, Westfall AO, Cheng H, Delzell E, Saag KG.: Risk of hip fracture after bisphosphonate discontinuation: implication for a drug holiday.// J. Osteoporosis International, 2008, Vol. 19, pp. 1613–1620.
53. Lenart BA, Neviaser AS, Lyman S, Chang CC, Edobor–Osula F, Steele B, Meulen MCH, Lorich DG, Lane JM.: Association of low–energy femoral fractures with prolonged bisphosphonate use: a case control study.// J. Osteoporosis International, 2008, published online ahead of printing.
54. Kanis JA, Burlet N, Cooper C, Delmas PD, Reginster J–Y, Borgstrom F, Rizzoli R.: European guidance for the diagnosis and management of osteoporosis in postmenopausal women, 2008.
55. National Institute for Health and Clinical Excellence (2007) Final appraisal determination. Alendronate, etidronate, risendronate, raloxifene and strontium ranelate for the primary prevention of osteoporotic fragility fractures in postmenopausal women. NICE, London.












