Широкое распространение ожирения и его осложнений послужили причиной исследований пусковых механизмов ожирения, которые в настоящее время актуальны среди нейробиологических исследований в мире [8]. Однако на сегодняшний день остается малоизученным вопрос о состоянии гипоталамо–гипофизарно–надпочечниковой системы (ГГНС) у больных с экзогенно–конституциональным ожирением (ЭКО). Результаты исследований в опубликованных работах часто носят противоречивый характер. Отсутствует единое мнение о характере изменений гормонов ГГНС у больных с ожирением. Между тем, учет состояния ГГНС и у больных с ЭКО представляется важным в клинической практике эндокринолога.
В последние 15 лет сделано множество важных открытий в этой области, включая обнаружение гормонов, вырабатываемых жировой тканью (лептин), гормонов желудочно–кишечного тракта (грелин) и выявление множества центральных и периферических путей регуляции энергетического баланса. Нейробиология ожирения становится быстро развивающейся областью исследований, незаменимой для понимания патогенеза заболевания. Мозг играет ведущую роль в регуляции энергетического равновесия, поскольку он оказывает влияние на потребление пищи и расход энергии. Ключевая роль в регуляции массы тела (МТ) принадлежит гипоталамусу [14,17]. В настоящее время выделяют несколько подкорковых ядер, формирующих чувство голода. К ним относятся аркуатное ядро (АЯ) и паравентрикулярные ядра (ПВЯ), латеральная гипоталамическая область и ядро солитарного тракта (ЯСТ). Они являются местом синтеза и рецепции, различных как орексигенных, так и анорексигенных факторов, имеют афферентные и эфферентные связи, которым по–прежнему отдается ведущая роль в регуляции массы тела [1,2,16]. Системы мозга, контролирующие потребление и расход энергии, подразделяются на анаболическую и катаболическую, каждая система включает в себя разные типы нейронов, способных контролировать как потребление энергии, так и ее расход. Эти нейроны высвобождают различные молекулы, включая нейропептид Y, агутиподобный протеин (АГПП), меланостимулирующий гормон (МСГ), эндоканнабиноиды, кокаин–амфетамин–регулируемый транскрипт (КАРТ), кортикотропин–рилизинг–гормон (КТРГ), тиреотропин–рилизинг–гормон (ТРГ), серотонин и др. На активность данных систем влияют краткосрочные и долгосрочные сигналы, которые сообщают о состоянии запасов и тратах энергии. В то время как лептин и инсулин называют долгосрочными сигналами, гормоны желудочно–кишечного тракта (ЖКТ) – глюкагон, холецистокинин и глюкагонподобный пептид–1 (ГПП–1) известны как краткосрочные сигналы, которые информируют о состоянии насыщения [4].
Клетки желудочно–кишечного тракта (ЖКТ) секретируют также пептид YY3–36, который синтезируется L–клетками дистального отдела тонкой и толстой кишки, он попадает в циркуляцию после приема пищи и является анорексигенным гормоном. Пептид YY3–36 был впервые обнаружен в 1980 г., и только недавно было установлено, что он выполняет функцию гормона, регулирующего аппетит [5,18]. Он проникает в гематоэнцефалический барьер и действует на уровне аркуатных ядер гипоталамуса, стимулируя чувство насыщения и уменьшая потребление пищи. По данным зарубежных исследований, при ожирении отмечается низкий уровень пептида YY3–36 [6,11].
Важную роль в формировании нормального энергетического гомеостаза играет серотонин. В организме человека около 90% эндогенного серотонина содержится в ЖКТ, где он в основном синтезируется и накапливается в ЕС–клетках [3]. Серотонин не проникает через гематоэнцефалический барьер, является сильным стимулятором гладкой мускулатуры и важным регулятором кишечной моторики [10]. Данный монамин, который образуется в кишечнике, регулирует периферический симпатический термогенез [15], что позволяет предположить возможность участия серотонина в регуляции расхода энергии у больных с ЭКО.
На основе современных взглядов на этиологию и патогенез ожирения мы рассмотрели наиболее актуальные этиологические механизмы развития ЭКО. Опираясь на данные предыдущих работ и собственного научного исследования, мы проанализировали причины нарастания массы тела у пациентов с ЭКО и представили в нашей статье.
Цель исследования: изучение особенностей ГГНС и их взаимосвязь с накоплением жирового депо у пациентов с ЭКО.
Материал и методы
Обследовано 327 человек (228 женщин и 99 мужчин), жителей г. Москвы и г. Кирова, обратившихся к эндокринологу с жалобами на прогрессивную прибавку в весе ежегодно более 5 кг. Все обследованные работают на крупных предприятиях г. Москвы и г. Кирова, имеющих собственные медицинские кабинеты, где проводятся регулярные медицинские обследования сотрудников. Выбор предприятий обусловлен возможностью наблюдения большого числа рабочих разных возрастных групп.
Проводилось измерение антропометрических показателей: роста, массы тела, индекса массы тела (ИМТ), окружности талии. ИМТ рассчитывался путем деления массы тела (кг) на квадрат роста (м), масса тела определялась на электронных весах, окружность талии – сантиметровой лентой, рост – ростомером. ИМТ оценивался согласно классификации ВОЗ 1997 г. При ИМТ равном 25–29 кг/м2 диагностировалась избыточная масса тела, при 30,0–34,9 кг/м2 – ожирение I степени, при 35,0–39,9 кг/м2 – ожирение II степени, при ≥40 кг/м2 – ожирение III степени.
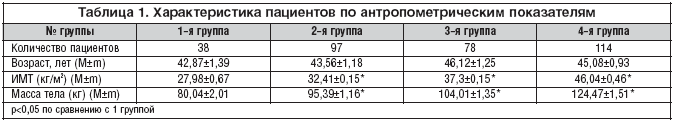
Подавляющее большинство пациентов, включенных в исследование, имели ожирение. Среди обследованных в 1–ю группу вошли пациенты с избыточной массой тела, во 2–ю группу – с I степенью ожирения, в 3–ю группу – со II степенью ожирения, в 4–ю группу – с III степенью ожирения (табл. 1).
Критериями включения пациентов в исследование были: индекс массы тела (ИМТ) более 25 кг/м2, прогрессирующая прибавка в весе за год более 5 кг, срок заболевания 5 лет и более.
Критериями исключения являлись: эндокринный генез ожирения, тяжелое течение сопутствующей патологии, декомпенсации гемодинамики и углеводного обмена, применение заместительной терапии тиреоидными препаратами, глюкокортикостероидами и гормонотерапии в климактерическом периоде.
Лабораторные показатели (уровень нейропептида YY3–36, АКТГ, кортизола, серотонина) исследовались в лаборатории клинической иммунологии с группой радиоиммунологического анализа Российского кардиологического научно–производственного комплекса Росмедтехнологий, зав. лабораторией – профессор В.П. Мосенко. Всем пациентам было проведено определение уровня пептида YY3–36 в сыворотке иммуноферментным методом набором ELISA DSL–10–33600 (США). За нормальные приняты показатели пептида YY3–36 натощак 29–125 пг/мл. Определение АКТГ проводилось иммуноферментным способом. Нами использовался набор ACHT ELISA (США). Нормальный уровень АКТГ составил 8,3–57,8 пг/мл. Количественное определение кортизола в сыворотке больных с ожирением нами произведено иммуноферментным методом ELISA (США). За нормальные уровни кортизола натощак приняты 6,9–17,7 мкг/дл. Уровень серотонина определяли методом ВЭЖК (на системе «Биохром», Россия) с электрохимическими детектированием (BAS, модель LC–4B, США). Разделение проводили на обращенно–фазовой колонке Hibar LiChrosorb RP–8 (5 μm) (Merk, Германия). За нормальные приняты показатели 100–350 нг/мл серотонина натощак. У всех больных, включенных в исследование, анализ композиции тела проводился методом рентгеновской абсорбциометрии (Dual Energy X–ray Absorbtiometry) и биоимпендансным методом (BIA) с помощью анализатора жировой массы BC–532 (TANITA, Япония).
Статистический анализ проводился с помощью программного пакета Statistic SPSS 12,0 для Windows. Для оценки значимости различий распространенности в группах использовали метод «Хи–квадрат». За критический уровень значимости р при проверке гипотез принят 0,05. Для оценки степени взаимосвязи количественных признаков использовали коэффициент ранговой корреляции Спирмена.
Результаты и обсуждение
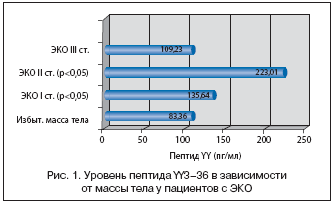
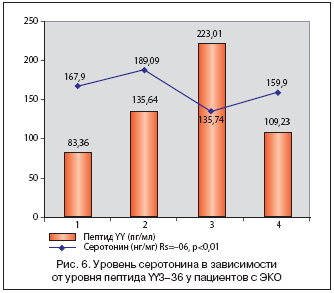
В нашем исследовании, посвященном изучению уровней пептида YY3–36 у пациентов с прогрессирующей формой ЭКО, установлено наличие высокого уровня общего сывороточного пептида YY3–36 (рис. 1), кортизола, в условиях дефицита серотонина. Выявленная нами разница между уровнями пептида YY3–36 у пациентов с различными степенями ЭКО, предполагает, что циркулирующий пептид YY3–36 участвует в адипостате. Уровень сывороточного пептида YY3–36 прогрессивно увеличивался по мере нарастания массы тела. У пациентов со II степенью ожирения отмечается резкое увеличение пептида YY3–36, затем некоторое снижение у пациентов с ИМТ более 30 кг/м2. Вероятно, это связано с существенными нейроэндокринными нарушениями у пациентов с III степенью ожирения, а стабилизация уровня пептида YY3–36 может рассматриваться как адаптация к новому гормональному статусу. Можно предположить, что высокий уровень пептида YY3–36 играет важную роль в регуляции энергетического гомеостаза у пациентов с ЭКО [7,9]. Высокий уровень сывороточного пептида YY3–36, вероятно, ингибирует продукцию серотонина клетками ЖКТ, способствуя снижению термогенеза и расхода энергии [13] (рис. 2). У пациентов с прогрессирующей формой ЭКО недостаточность серотонина может развиться и вследствие развития лептинрезистентности.
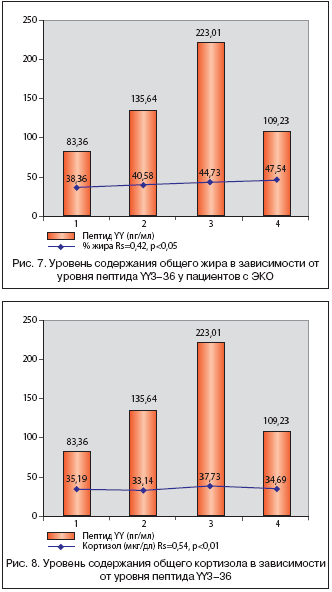
ЭКО характеризуется состоянием гиперкортизолемии. У всех обследованных уровень кортизола повышен независимо от увеличения веса и объема жировой ткани (рис. 3). Структурная гомология нейропептида Y с пептидом YY3–36, выделенным из кишечника, предполагает взаимное перекрывание их физиологических активностей, включающих в себя влияние на пищевое поведение. Возможно, пептид YY3–36 стимулирует ГГНС посредством прямого воздействия на гипоталамус либо опосредованно путем стимуляции парасимпатической нервной системы. Можем предположить, что циркулирующий пептид YY3–36 у пациентов с ЭКО способствует развитию гиперсенсибилизации системы гипофиз–надпочечники к адренокортикотропному гормону. Таким образом, гиперкортизолемия у больных с ЭКО, возможно, является следствием увеличения активации ГГНС, что может способствовать увеличению лептинрезистентности.
Уровень АКТГ в крови во всех группах по ИМТ статистически значимо не отличался от концентрации АКТГ у здоровых людей.
ЭКО характеризуется состоянием положительного энергетического баланса, при котором происходит увеличение процента общего жира с ростом массы тела (рис. 4). Определение количества жировой ткани методом рентгеновской абсорбциометрии свидетельствовал об ее избыточном количестве. По данным жирометрии нами установлено, что характер распределения жира у обследованных пациентов соответствует андроидному типу (преимущественно в области туловища и верхних конечностей) и характеризует его как наиболее опасный с метаболической точки зрения вид ожирения. У всех обследованных процент жира превышал показатели нормы, что свидетельствует об опасности возникновения таких заболеваний, как сахарный диабет 2–го типа, артериальной гипертензии и ИБС.
Изучение взаимосвязи общего пептида YY3–36 с кортизолом и серотонином, регулирующими массу тела, показало наличие положительной корреляции между секрецией пептида YY3–36, кортизолом и количеством общей жировой массы и отрицательной корреляции с уровнем серотонина.
При анализе статистических взаимосвязей уровня пептида YY наиболее значимые коэффициенты корреляции были выявлены с серотонином (r=–0,6), (p<0,05) (рис. 6), процентом жира (r=0,42), (p<0,05) (рис. 7), кортизолом (r=0,54), (p<0,01) (рис. 8).
Можем предположить, что пептид YY3–36 увеличивает сенсибилизацию гипофиза к АКТГ, контролирует секрецию серотонина и кортизола надпочечниками и осуществляет взаимосвязь между ГГНС и адипостатом. Полученные результаты убедительно демонстрируют важнейшую роль пептида YY3–36 в прогрессировании процесса ожирения. Если рассматривать ожирение в соответствии с концепцией ГГН–дисфункции, объясняющей патологические реакции организма нарушением жирового обмена, то уровень пептида YY3–36 может быть маркером нарушения ГГН–регуляции массы тела. Зарубежные исследования свидетельствуют, что у лиц с ожирением отмечаются низкие эндогенные уровни пептида YY3–36 [19]. Это позволяет предположить участие этого пептида в патогенезе ожирения. Однако наши данные противоречат данным литературы. Результаты нашего исследования обнаружили, что у людей с большим избыточным весом синтез этого гормона повышен против нормы. Пептид YY3–36 избыточно продуцируется клетками ЖКТ у больных с ожирением и его количество отражает нарушения энергетического обмена, а обнаруженные нами достоверные взаимосвязи между серотонином и АКТГ позволили предположить новые возможные контролирующие механизмы действия данного пептида.
Новая информация в отношении контроля приема пищи и их гормональной регуляции расширила наше представление об энергетическом гомеостазе. Каждый новый сигнальный путь – это потенциальная цель для создания лекарств, направленных на лечение ожирения, растущее число таких сигнальных молекул указывает, что прием пищи контролируется сложным системным процессом.
Выводы
1. Развитие и прогрессирование экзогенно–конституционального ожирения непосредственно связано с гиперсекрецией пептида YY3–36. Установлена прямая зависимость между показателями уровня пептида YY3–36, кортизола и процентом общего жира и обратная связь с секрецией серотонина.
2. Исследование взаимосвязи между клиническими параметрами и выраженностью гормонального дисбаланса выявили у 100% больных повышенную базальную секрецию кортизола.
3. Многофакторный анализ гормонального статуса ГГНС позволил выявить гиперсенсибилизацию передней доли гипофиза к АКТГ у больных с экзогенно–конституциональным ожирением.
4. Всесторонний детальный анализ участия ГГНС в патогенезе ожирения позволил установить пониженное содержание общего серотонина у пациентов с ЭКО.

Литература
1. Бубнова М.Г. Ожирение: причины и механизмы нарастания массы тела, подходы к коррекции. Consilium medicum, 2005; 5: 23–46.
2. Пигарева Е.А., Дзеранова Л.К., Рожинская Л.Я., Тишова Ю.А. и соавт. Ожирение и гинекомастия у пациента с центральным несахарным диабетом. Ожирение и метаболизм. 2006; 8: 51–54.
3. Пальцев М.А., Кветной И.М. Руководство по нейроиммуноэндокринологии. «Медицина», 2006: 103–104.
4. Романцова Т.И. Патогенетический подход к лечению ожирения и сахарного диабета 2 типа. 2008; 4: 2–10.
5. Batterham R.L., Cowley M.A. et al. Gut hormone PYY (3–36) physiologically inhibits food intake. Nature 2002; 418: 650–654.
6. Batterham R.L., Cohen M.A., et al. Inhibition of food intake in obese subjects by peptide YY 3–36. N Engl J Med 2003; 349: 941–948.
7. Bray G.A., York D.A., Fisler J.S. Experimental obesity: a homeostatic failure due to defective nutrient stimulation of thesympathetic nervous system. Vitam Horm 1989; 45: 1–125.
8. Richrd D. , Boisvert P. Obesity 2006; 14: 187–188.
9. Fukushima M., Tokunaga K., Lupien J., Kemnitz J.W., Bray G.A. Dynamic and static phases of obesity following lesions in PVN and VMH. Am J Physiol 1987; 253: 523 – 52.
10. Gershon M.D. The enteric nervous system: a second brain. Hosp Rract (Minneap). 1999 Jul 15; 34(7): 35–38, 41–42 passim.
11. Grandt D., Schimiczek M., Beglinger C. et al. Two molecular forms of peptide YY (PYY) are abundant in human blood: characterization of a radioimmuoassy recognizing PYY 1–36 and 3–36. J Regul Pept 1994; 51: 151–159.
12. Hainer V., Kabrnova K., Aldoon B. et al. Weight loss with sibutramine improves glycemic control and other metabolic parameters in obese patients with type 2 diabetes mellitus. Diabetes Obes Metab 2000; 2: 175–187.
13. Hayashi A., Sonoda R., Kimura Y. et al. Antiobesity effect of YM348, a novel 5–HT2C receptor agonist, in Zucker rats. Brain Res 2004; 1011: 221–227.
14. Konturek P.C. Neuro–hormonal control of food intake; basic mechanisms and clinical implications. J. Physiol and Pharmacol. 2005; 56: 5–25.
15. Rothwel N.J., Stock M.J. Effect of diet and fenfluramine on thermogenesis in the rat: possible involvement of serotonergic mechamisms. Int J Obes 1987; 11: 319–324.
16. Sahu A. Minireview: A hupothalamic role in energy balance with special emphasis on leptin. Endocrinology 2004; 145: 2613–2620.
17. Schwartz M.W., Wood S.C., Porte. D. Jr. et al. Nature 2000: 661–70.
18. Tatemoto K., Mutt V. Isolation of two novel candidate hormones using a chemical method for finding naturally occurring polypeptides. Nature 1980; 285: 417– 418.
19. Viardot A., Heilbronn L.K., Herzog H., Gregersen S., Compbell L.V. Abnormal postprandial PYY responce in insulin sensitive nondiabetic subjects with a strong family history of type 2 diabetes. Int. J. Оbesity. 2008; Vol. 24: 24.












