Однако интенсификация сахароснижающей терапии лимитируется риском развития гипогликемических состояний, прибавки веса и, как результат, повышения летальности от острых сосудистых катастроф. Эпизоды гипогликемии выявлялись в 3 раза чаще в группе интенсивного лечения по сравнению со стандартной терапией при проведении исследования AСCORD [13] и в 2 раза чаще – в исследовании VADT [14], что сопровождалось увеличением общей летальности на 22% в исследовании АССORD и повышением случаев сердечно-сосудистых событий в последующие 3 мес. после тяжелой гипогликемии у пожилых людей – в исследовании VADT.
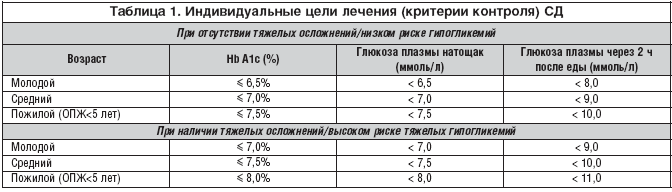
В связи с вышеизложенным Российской ассоциацией эндокринологов в конце 2011 г. предложено индивидуализировать целевые уровни гликемического контроля [15] в зависимости от возраста пациента, ожидаемой продолжительности жизни (ОПЖ), риска развития гипогликемических состояний и наличия/отсутствия тяжелых сердечно-сосудистых осложнений (табл. 1).
СДт2 характеризуется двумя основными патогенетическими дефектами: снижением чувствительности к инсулину (или инсулинорезистентностью) и неадекватной секрецией инсулина для преодоления барьера инсулинорезистентности. Инсулинорезистентность зачастую предшествует развитию СД в течение многих лет и является генетически обусловленной, хотя и усугубляется такими внешними факторами, как ожирение, снижение физической активности, беременность и избыток контринсулярных гормонов. Изначально существующая инсулинорезистентность компенсируется за счет гиперинсулинемии, что поддерживает нормальную толерантность к углеводам. Нарушение толерантности к углеводам наблюдается при возрастании инсулинорезистентности или снижении компенсаторных возможностей инсулиновой секреции либо при прогрессировании обоих дефектов [16, 17]. По современным представлениям, СДт2 манифестирует в ситуации, когда секреторные возможности β-клеток оказываются несостоятельными для преодоления барьера инсулинорезистентности. Основная роль в этой несостоятельности инсулярного аппарата отводится генетическим нарушениям [17], однако немаловажную роль в снижении секреторных резервов инсулярного аппарата играет так называемый «феномен глюкозотоксичности», за счет которого развивается апоптоз и гибель β-клеток. По статистическим данным, к моменту манифестации заболевания у пациентов функционируют только 50% от изначального количества β-клеток, что подтверждает теорию постепенного прогрессирования нарушений углеводного обмена: от нормогликемии в условиях инсулинорезистентности и гиперинсулинемии до манифестации СД через последовательные стадии нарушения гликемии натощак и нарушенной толерантности к глюкозе [18].
Исходя из вышеизложенного, напрашивается вполне логичный вывод о том, что основным стратегическим направлением в лечении СДт2 должно быть воздействие на инсулинорезистентность как главное патогенетическое звено в развитии заболевания. Снижая инсулинорезистентность, или, иными словами, повышая чувствительность к инсулину, мы уменьшаем нагрузку на инсулярный аппарат, сохраняя тем самым его секреторные возможности и снимая негативное влияние гиперинсулинемии на повышение аппетита, прибавку веса, состояние сердечно-сосудистой системы. Наиболее простой способ повышения чувствительности к инсулину – снижение веса за счет изменения образа жизни и характера питания, что, к сожалению, позволяет достичь целевого уровня гликемии менее чем у 30% пациентов с впервые выявленным СДт2 [6]. В таких ситуациях необходимы средства, воздействующие на основное патогенетическое звено синдрома, – инсулинорезистентность.
Наиболее доступным и эффективным средством в настоящее время является метформин (оригинальный препарат метформина – Глюкофаж®), основной механизм действия которого заключается в снижении инсулинорезистентности за счет повышения активности тирозинкиназы инсулинового рецептора в периферических тканях. В результате улучшается утилизация и окисление глюкозы в периферических тканях [19, 20], подавляется липолиз и окисление свободных жирных кислот как альтернативного энергосубстрата [21, 22]. Именно с повышением чувствительности к инсулину печеночной ткани связывают снижение глюконеогенеза и гликогенолиза [23, 24]. Таким образом, сахароснижающий эффект метформина является не столько гипогликемическим, сколько антигипергликемическим, т.к. приводит к снижению печеночной продукции глюкозы и уровня гликемии натощак. С повышением чувствительности периферических тканей к инсулину связывают и снижение потребности в инсулине и улучшение функциональных возможностей β-клеток в связи со снижением глюкозотоксичности [25]. Кроме того, как показывают недавние исследования, метформин может способствовать повышению уровня глюкагонподобного пептида-1 (ГПП-1), стимулирующего, как известно, секрецию инсулина за счет улучшения абсорбции глюкозы в более дистальных отделах тонкого кишечника, где в основном и локализованы L-клетки, секретирующие ГПП-1 [26].
В случае непереносимости метформина или наличии противопоказаний последний алгоритм IDF 2011 г. предлагает как альтернативный вариант для пациентов, не имеющих избыточного веса, применение препаратов сульфонилмочевины (ПСМ) в качестве первой линии лечения, исходя из предположения, что основным патогенетическим дефектом в развитии СДт2 без ожирения является неадекватная секреция инсулина. Данный вариант начала медикаментозного лечения обосновывается не только необходимостью патогенетического подхода к терапии, но и достаточной доказательной базой эффективности и безопасности применения ПСМ, а также относительной дешевизной и доступностью такого альтернативного варианта лечения.
Как указывалось выше, у большинства людей с СДт2 мероприятия по изменению образа жизни не обеспечивают достижения целевых параметров углеводного обмена либо из-за недостаточного снижения веса, его повторного набора, либо из-за прогрессирования заболевания или вследствие сочетания этих и ряда других факторов. Поэтому рекомендуется начинать терапию метформином вместе с изменением образа жизни сразу после установления диагноза. При отсутствии специфических противопоказаний метформин рекомендуется назначать в первую очередь благодаря его влиянию на гликемию, отсутствию прибавки в весе и гипогликемических состояний, обычно хорошей переносимости с низкой частотой побочных эффектов, высокому уровню приверженности и относительно низкой стоимости. Доза метформина должна постепенно (в течение 1–2 мес.) увеличиваться до максимально эффективной и переносимой.
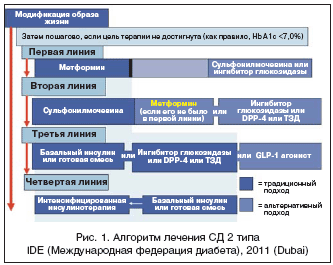
Вторая линия терапии
Вместе с тем, даже максимальные дозы метформина далеко не всегда позволяют добиться целевого уровня гликемии и снижения уровня Hb A1c <7,0% в течение первых 2–3 мес. лечения, как рекомендуется авторами последнего алгоритма IDF (2011 г.). При сохранении упорной гипергликемии следует решить вопрос о быстром добавлении других сахароснижающих препаратов. Четкого консенсуса в отношении второго препарата, добавляемого к метформину, пока не существует, и выбор делается между ПСМ и ингибиторами ДПП-4 или ТЗД и блокаторами α-глюкозидазы в качестве альтернативы (рис. 1). В частности, когда риск гипогликемии особенно опасен (например, у пациентов, занимающихся тяжелым физическим трудом), целесообразно дополнительное назначение ингибиторов ДПП-4 либо препарата класса ТЗД – пиоглитазона. В случаях, когда одна из основных целей лечения – снижение веса, а уровень Hb A1c <8,0%, предпочтительно назначение блокаторов α-глюкозидазы.
В качестве второй линии препаратов при невозможности достижения целевого уровня гликемического контроля при применении ПСМ предлагается применение метформина, если он не был назначен ранее, либо ингибиторов ДПП-4, или ТЗД или блокаторов α-глюкозидазы как альтернативного варианта (рис. 1).
Третья линия терапии
Если модификация образа жизни, метформин и второй препарат не привели к достижению целевых параметров контроля углеводного обмена, следующий этап заключается в начале или интенсифицировании инсулинотерапии (рис. 1). Если уровень А1с близок к целевому (< 8,0%), можно добавить третий пероральный сахароснижающий препарат в качестве альтернативного варианта. В качестве дополнительного сахароснижающего средства алгоритм IDF 2011 г. предлагает либо блокаторы α-глюкозидазы или ингибиторы ДПП-4, или ТЗД, либо, в качестве альтернативного варианта – агонисты ГПП-1 (эксенатид, лираглютид), когда одна из основных целей лечения – снижение веса, а уровень Hb A1c <8,0%. Тем не менее, такой подход более дорогостоящий и не всегда оказывается эффективным по сравнению с переходом на инсулинотерапию или ее интенсификацией.
Четвертая линия терапии
Интенсивная инсулинотерапия обычно заключается во введении дополнительных инъекций инсулина короткого или ультракороткого действия перед отдельными приемами пищи для уменьшения постпрандиальных колебаний гликемии (рис. 1). При переходе на интенсивную инсулинотерапию с инъекциями инсулина короткого или быстрого действия следует отменить секретогены инсулина (ПСМ или глиниды), поскольку они обладают синергичным с вводимым инсулином действием.
Однако клиницисты-эндокринологи зачастую сталкиваются с проблемой невозможности добиться целевого уровня контроля гликемии в течение 2–3 мес. лечения. Обусловлено это тем, что исходный уровень Hb A1c у пациентов может колебаться от 6,5 до 10% и выше, что, безусловно, осложняет возможности быстрого и эффективного достижения цели.
Стратификация лечебной тактики
по Алгоритму РАЭ 2011 г.
В связи с этим Российской ассоциацией эндокринологов (РАЭ) в конце 2011 г. предложен дифференцированный подход к назначению и коррекции сахароснижающей терапии в зависимости от исходного уровня Hb A1c с последующим изменением лечения при недостижении цели не ранее чем через 6 мес. от начала проводимой терапии. Действительно, если исходный уровень Hb A1c не превышает 7,5%, вполне реально достижение целевого уровня <6,5% с помощью монотерапии метформином, пиоглитазоном, ингибиторами ДПП-4 (дипептидилпептидазы) или α-глюкозидазы, как это представлено на рисунке 2. Двойная комбинация при неэффективности монотерапии предполагает добавление препаратов, так или иначе стимулирующих секрецию инсулина либо за счет непосредственного воздействия на β-клетку (ПСМ, глиниды и аналоги ГПП-1), либо опосредованно, за счет блокады расщепления нативного ГПП-1 ингибиторами фермента ДПП-4. В любом случае такая комбинация воздействует на оба патогенетических звена развития СДт2: инсулинорезистентность и неадекватную секрецию инсулина, в результате чего обеспечивается адекватный гликемический контроль не только по уровню гликемии натощак, но и после еды, приводя к быстрому достижению цели.
Какая комбинация предпочтительнее у пациентов с исходным уровнем Hb A1c от 6,5 до 7,5%? Если исходить из критериев переносимости и безопасности, то возможный риск гипогликемии при применении секретогенов у больных с исходно невысоким уровнем Hb A1c превышает выраженность побочных эффектов со стороны желудочно-кишечного тракта и отечного синдрома, связанных с применением инкретинов и ТЗД соответственно. Именно поэтому авторы алгоритма РАЭ предлагают в качестве наиболее рациональных комбинаций в первую очередь сочетание метформина с ингибиторами ДПП-4 или аналогами ГПП-1, а во вторую очередь – метформина с секретогенами (ПСМ или глинидами). Если модификация образа жизни, метформин и второй препарат не привели к достижению целевых параметров контроля углеводного обмена, следующий этап заключается в начале или интенсификации инсулинотерапии (рис. 2). Если уровень А1с близок к целевому (<7,5%), можно добавить третий пероральный сахароснижающий препарат. Тем не менее, такой подход более дорогостоящий и не всегда оказывается эффективным по сравнению с переходом на инсулинотерапию или ее интенсификацией [27].
Тактика ведения пациентов
с уровнем А1с от 7,6 до 9%
Подавляющее большинство пациентов с СДт2 имеют на момент диагностики заболевания уровень А1с >7,6%. На сегодняшний день не существует таких препаратов, которые способны обеспечить достижение целевого уровня контроля при монотерапии в течение 2–3 мес. (табл. 2).
Именно поэтому авторы алгоритма предлагают изначально использовать комбинированную «двойную» терапию для достижения быстрого и эффективного контроля гликемии (рис. 3). Такой подход основан на данных многочисленных исследований, показавших, что одновременное назначение препаратов с различными точками приложения действия обеспечивает более значимое снижение А1с не только за более короткие сроки, но и в значительно меньших дозировках, нежели начальная монотерапия метформином с последующим присоединением второго препарата [28–30]. Метформин является основой всех возможных комбинаций, из которых наиболее безопасной является комбинация метформина с инкретиновыми миметиками, за счет отсутствия риска гипогликемических состояний и прибавки в весе, а самой эффективной –комбинация метформина с ПСМ, поскольку эти препараты наиболее значимо снижают уровень А1с, а их комбинация обеспечивает хороший контроль не только гликемии, но и уровня холестерина и липидного спектра крови [30].
В случае неэффективности «двойной» терапии рекомендуется добавить третий препарат, исходя и в этом случае из принципов эффективности и безопасности: метформин и в этой ситуации считается основой терапии, при этом наиболее безопасным с точки зрения риска развития гипогликемических состояний является добавление к комбинации метформина с инкретиновыми миметиками ТЗД, а наиболее эффективным –присоединение ПСМ к комбинации метформина с инкретиновыми миметиками. Таким образом, пациентам, имеющим уровень А1с, близкий к 7,5%, целесообразнее назначать комбинацию метформина с ТЗД и инкретиновыми миметиками, тогда как пациентам с более высоким уровнем А1с логичнее применять комбинацию метформина с СМ и инкретиновыми миметиками. Следующим этапом достижения целевого уровня гликемии при неэффективности «тройной» комбинации является назначение инсулинотерапии сначала в фоновом, а затем и фоново-болюсном режиме, при переходе к которому необходимо отменить препараты, так или иначе стимулирующие секрецию инсулина.
Тактика ведения пациентов
при уровне А1с >9%
В клинической практике нередки ситуации, при которых уже на этапе диагностики СДт2 у пациентов имеется значительная гипергликемия и уровень Hb A1c превышает 9%, однако отсутствует клиническая симптоматика заболевания, что свидетельствует о достаточной секреторной активности инсулярного аппарата. Тактикой выбора в этой ситуации, по предложению авторов алгоритма, может быть не интенсивная инсулинотерапия, которая абсолютно показана при А1с >10% и выраженной клинической симптоматике, а изначальная «тройная» терапия. Наиболее эффективной при этом считается комбинация метформина с ПСМ и инкретиновыми миметиками, наиболее безопасной с точки зрения риска гипогликемии – комбинация метформина с инкретиновыми миметиками и ТЗД (рис. 4).
Однако практикующим врачам хорошо известно, как неблагоприятно влияют сложные схемы сахароснижающей терапии на следование пациентов врачебным предписаниям в повседневной практике. Как показали результаты исследования DARTS [31], только 30% пациентов твердо придерживаются терапии одним лекарственным средством и менее 13% – большим количеством препаратов и в больших дозах (раздельная комбинация). Именно этим фактом объясняется появление оффицинальных комбинированных сахароснижающих препаратов, состоящих из комбинации метформина с различными препаратами других классов. Наиболее эффективной является комбинация метформина с ПСМ, позволяющая добиться наиболее быстрого и значимого снижения уровня А1с, используя при этом меньшие дозы каждой из составляющих, что, безусловно, снижает риск развития и выраженность побочных эффектов (желудочно-кишечные нарушения, прибавка веса, гипогликемические состояния).
Одним из препаратов этой группы, зарегистрированных в России, является Глюкованс® – единственный в России комбинированный препарат, имеющий в составе оригинальный метформин и глибенкламид в микронизированной форме, которая обеспечивает ряд преимуществ по сравнению с обычной формой глибенкламида, подтвержденных в клинических исследованиях, в т.ч., меньший риск возникновения гипогликемии и более безопасное действие по сравнению с обычной формой глибенкламида [28, 33]. Кроме того, более быстрое высвобождение глибенкламида из таблетки Глюкованса® эффективнее препятствует повышению уровня гликемии в первые 3 ч после еды по сравнению со стандартной формой глибенкламида [34, 35]. Технология калиброванного размера частиц, использованная при создании Глюкованса®, обеспечивает контролируемое высвобождение компонентов препарата в соответствии с физиологическими потребностями пациента [34]. Таким образом, целевые значения гликемии достигаются при применении меньших доз метформина и глибенкламида в составе Глюкованса® в сравнении с дозами, применяемыми при монотерапии [33].
Препарат выпускается в двух дозировках, содержащих 2,5/500 мг глибенкламида/метформина и 5,0/500 мг глибенкламида/метформина соответственно, что дает возможность титрования дозы глибенкламида для снижения риска развития гипогликемических состояний. Таким образом, применяя Глюкованс в терапии СДт2, можно достичь целевого уровня контроля гликемии как у пациентов с неэффективностью высших доз метформина либо при его непереносимости, так и у пациентов, которым показана изначально «двойная» терапия при уровне А1с>8,0% либо «тройная» терапия при уровне А1с >9,0% в сочетании с инкретиновыми миметиками или ТЗД. Применение Глюкованса не только обеспечивает воздействие на оба основных патогенетических дефекта СДт2, но и позволяет добиться эффекта на меньших дозах с меньшим риском побочных эффектов и с большей комплаентностью пациентов в отношении приема назначаемой терапии [36]. Глюкованс может быть использован в любой когорте пациентов с СДт2 вне зависимости от исходного уровня HbA1c, разумеется, с учетом индивидуальных целей лечения, исключающих риск развития гипогликемических состояний, при отсутствии тяжелых сосудистых осложнений с учетом возраста и ожидаемой продолжительности жизни.
![Рис. 2. РАЭ 2011. Алгоритм контроля гликемии при СДт2 (адапт. по [15])](/data/articles/Image/t21/n12/668-3.gif)
![Рис. 3. РАЭ 2011. Алгоритм контроля гликемии при СДт2 (уровень А1с от 7,6 до 9%) (адапт. по [15])](/data/articles/Image/t21/n12/668-4.gif)
![Таблица 2. Клиническая эффективность различных классов ПССП [32]](/data/articles/Image/t21/n12/668-5.gif)
![Рис. 4. РАЭ 2011. Алгоритм контроля гликемии при СДт2 (уровень А1с >9%) (адапт. по [15])](/data/articles/Image/t21/n12/668-6.gif)
Литература
1. World Health Organisation: «The World Health Report 1998. Life in 21st Century – a Vision for ALL». – Geneva: World Health Organisation, 1998.
2. Cунцов Ю.И. Современные сахароснижающие препараты, используемые в России при лечении сахарного диабета 2 типа // Сах. диабет. 2012. № 1. С. 6–10.
3. Hsueh W.A., Law R.E. Cardiovascular risk continuum: Implications of insulin resistance and diabetes // Am. J. Med. 1998. Vol. 105. 4S–14S.
4. Доборджгинидзе Л.М., Грацианский Н.А. Роль статинов в коррекции диабетической дислипидемии // Сах. диабет. 2001. № 2. C.41–47.
5. Coutinho M., Gerstein H.C., Wang Y., Yusuf S. The relationship between glucose and incident cardiovascular events: a metaregression analysis of published data from 20 studies of 95,783 individuals followed for 12.4 years // Diabetes Care. 1999. Vol. 22. P. 233–240 .
6. UK Prospective Diabetes Study (UKPDS) Group: Intensive blood glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complication in patients with type 2 diabetes (UKPDS 33) // Lancet. 1998. Vol. 352. P. 837–853.
7. Ohkubo Y., Kishikawa H., Araki E. et al. Intensive insulintherapy prevents the progression of diabetic microvascular complications in Japanese patients with NIDDM: a randomized prospective 6-year study // Diabetes Res. Clin. Pract. 1995. Vol. 28. P. 103–117.
8. Kahn S.E., Zinman B., Lachin J.M. et al. A Diabetes Outcome Progression Trial [ADOPT] Study Group. Rosiglitazone-associated fractures in type 2 diabetes:an analysis from A Diabetes Outcome Progression Trial (ADOPT) // Diabetes Care. 2008. Vol. 31. P. 845–851.
9. Patel A., MacMahon S., Chalmers J. et al. ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes // N. Engl. J. Med. 2008. Vol. 358. P. 2560–2572.
10. Wilcox R., Kupfer S., Erdmann E. PROactive Study Investigators. Effects of pioglitazone on major adverse cardiovascular events in high-risk patients with type 2 diabetes: results from PROspective pioglitAzone Clinical Trial In macro Vascular Events (PROactive 10) // Am. Heart J. 2008. Vol. 155. P. 712–717.
11. Holman R.R., Paul S.K., Bethel M.A. et al. 10-year follow-up of intensive glucose control in type 2 diabetes // N. Engl. J. Med. 2008. Vol. 359. P. 1577–1589.
12. Gaede P., Valentine W.J., Palmer A.J. et al. Costeffectiveness of intensified versus conventional multifactorial intervention in type 2 diabetes: results and projections from the Steno-2 study // Diabetes Care. 2008. Vol. 31. P. 1510–1515.
13. Miller M.E., Byington R.P., Goff D.C. Jr et al. Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of intensive glucose lowering in type 2 diabetes // N. Engl. J. Med. 2008. Vol. 358. P. 2545–2559.
14. Duckworth W., Abraira C., Moritz T. et al. VADT Investigators. Glucose control and vascular complications in veterans with type 2 diabetes [published correction appears] // N. Engl. J. Med. 2009. Vol. 361. P. 1024–1025, 1028], N. Engl. J. Med. 2009. Vol. 360. P. 129–139.
15. Алгоритмы специализированной медицинской помощи больным сахарным диабетом /Под ред. И.И. Дедова, М.В. Шестаковой. – М.: ООО «Информполиграф», 2011. 115 с.
16. DeFronzo R.A. Pathogenesis of type 2 diabetes: metabolic and molecular implications for identifying diabetes genes // Diabetes Rev. 1997. Vol. 5. P. 177–269.
17. Kahn C.R., Vicent D., Doria A. Genetics of non-insulin-dependent (type-II) diabetes mellitus // Ann. Rev. Med. 1996. Vol. 47. P. 509–531.
18. Kahn C.R. Insulin action, diabetogenes, and the cause of type II diabetes // Diabetes. 1994. Vol. 43. P. 1066–1084.
19. Kirpichnikov D., McFarlane S.I., Sowers J.R. Metformin: an update // Ann. Intern. Med. 2002. Vol. 137. P. 25–33.
20. Riccio A., Del Prato S., Vigili de Kreutzenberg S., Tiengo A. Glucose and lipid metabolism in non-insulin-dependent diabetes. Effect of metformin // Diabet. Metab. 1991. Vol. 17. P. 180–184.
21. Perriello G., Misericordia P., Volpi E et al. // Acute antihyperglycemic mechanisms of metformin in NIDDM. Evidence for suppression of lipid oxidation and hepatic glucose production // Diabetes. 1994. Vol. 43. P. 920–928.
22. Radziuk J., Zhang Z., Wiernsperger N., Pye S. Metformin and its liver targets in the treatment of type 2 diabetes // Curr. Drug. Targets Immune Endocrin. Metabol. Disord. 2003. Vol. 3. P. 151–169.
23. Wollen N., Bailey C.J. Inhibition of hepatic gluconeogenesis by metformin. Synergism with insulin // Biochem. Pharmac. 1988. Vol. 37. P. 4353–4358.
24. Ferner R.E., Rawlins M.D., Alberti K.G.M.M. Impaired B-cell responses improve when fasting blood glucose concentrate is reduced in noninsulin-dependent diabetes // Quat. J. Med. 1988. Vol. 250. P. 137–146.
25. Lindsay J.R., Duffy N.A., McKillop A.M. et al. // Inhibition of dipeptidyl peptidase IV activity by oral metformin in Type 2 diabetes // Diabet. Med. 2005. Vol. 22. P. 654–657.
26. Sinha Roy R., Bergeron R., Zhu L. et al. // Metformin is a GLP-1 secretagogue, not a dipeptidyl peptidase-4 inhibitor // Diabetol. 2007. Vol. 50 (Suppl. 1).S.284.
27. Schwartz S. et al. Insulin 70/30 mix plus metformin versus triple oral therapy in the treatment of type 2 diabetes after failure of the two oral drugs // Diabetes Care. 2003. Vol. 26. P. 2238–2243.
28. De Fronzo R.A., Godman A.M. And The Multicenter Metformin Study Group. Efficacy of metformin in patients with non-insulin-dependent diabetes mellitus // N. Engl. J. Med. 1995. Vol. 333. P. 541–549.
29. Hermann L.S., Schersten B., Bitsen P.-O. et al. Therapeutic comparison of metformin and sulphonylurea alone and in various combinations // Diabetes Care. 1994. Vol. 17. P. 1100–1109.
30. Tosi F., Muggeo M., Brun E. et al. Combination treatment with metformin and glibenclamide versus single-drug therapies in type 2 diabetes mellitus: a randomized, double-blind, comparative study // Metabolism. 2003. Vol. 7. P. 862–867.
31. Morris A.D. Considerations in assessing effectiveness and costs of diabetes care: lessons from DARTS // Diabetes Metab. Res. Rev. 2002. Vol. 18 (Suppl. 3). S.32–35.
32. Nathan D.M., Buse J.B., Davidson M.B. et al. Management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy // Diabetes Care. 2006. Vol. 29. P. 1963–1971.
33. Marre M. et al. Diabet. Med. 2002. Vol. 19 (8): P. 673–80.
34. Howlett H. et al. Curr. Med. Res. Opin. 2003. Vol. 19 (3): P. 218–25.
35. Donahue. Clinical Pharmacokinetics. 2002 (41) 15. P. 1301–1309.
36. Pan F., Chernew M.E., Fendrick A.M. Impact of fixed-dose combination drugs on adherence to prescription medications // J. Gen. Intern. Med. 2008. Vol. 23(5). P. 611–614.












