Введение
Пациенты с сахарным диабетом (СД) примерно в 1,5 раза чаще испытывают снижение когнитивных функций, чем пациенты без данного заболевания [1]. Так, при СД 1 типа регистрируется снижение скорости психомоторной эффективности, обработки информации, умственной гибкости, внимания, а также зрительного восприятия [2]. Тогда как при СД 2 типа чаще имеется дефицит памяти, снижение психомоторной скорости, страдают исполнительные функции [3]. Сложная патофизиология изменений в центральной нервной системе при СД до сих пор полностью не выяснена. На развитие когнитивных нарушений влияет возраст пациента на момент манифестации СД, состояние контроля гликемии и наличие диабетических осложнений [4]. Имеются гипотезы, объясняющие патофизиологию снижения когнитивных функций, связанного с диабетом. Основные гипотезы, указывающие на потенциальные механизмы действия, включают гипергликемию, гипогликемию или вариабельность гликемии, микрососудистые заболевания, резистентность к инсулину, гиперинсулинизм, гиперфосфорилирование тау протеина и отложение β-амилоида [5].
Ассоциированный с микротрубочками тау протеин представляет собой белок цитоскелета, который регулирует развитие нейронов. В головном мозге почти 20% тау протеина фосфорилируется в физиологических условиях; однако при патологических состояниях, таких как болезнь Альцгеймера, тау протеин является гиперфосфорилированным [6]. Этот процесс вызывает потерю сродства к микротрубочкам, изменяя внутриклеточный транспорт и, как следствие, приводя к дисфункции синапсов, дегенерации нейронов и снижению когнитивных способностей [7]. По данным S. Abbondante, в экспериментальных моделях СД 1 типа отмечается гиперфосфорилирование тау протеина [8]. Кроме того, у пациентов с СД 2 типа выявлена положительная связь между когнитивными нарушениями и тау протеином в спинномозговой жидкости, а также лобной и теменной атрофией [9]. Таким образом, таупатия, возможно, играет роль в развитии когнитивных нарушений при СД. В связи с этим цель нашего исследования заключалась в оценке роли тау протеина в формировании когнитивных нарушений при СД 1 и 2 типа.
Материал и методы
Было получено заключение от этического комитета ФГБОУ ВО СибГМУ Минздрава России за № 5265 от 02.05.2017 г. о возможности проведения исследования.
Дизайн — обсервационное, поперечное, одномоментное исследование. Проверка гипотезы осуществлялась на основании полученных результатов и их статистического анализа.
Критериями исключения из исследования были: наличие органического поражения головного мозга (опухоли, инсульт); употребление препаратов и веществ, изменяющих когнитивные функции (психотропные, наркотические вещества); хронический алкоголизм; состояние после тяжелых травм и операций; наличие гематологических, онкологических, тяжелых инфекционных заболеваний, тяжелые гипогликемии и диабетический кетоацидоз последние 6 мес. до исследования.
В исследование было включено 63 пациента с СД 1 типа (средний возраст составил 29,1±8,5 года, от 18 до 45 лет) и контрольная группа 1 — 25 человек, сопоставимых по полу и возрасту. Кроме того, было набрано 102 пациента с СД 2 типа (возраст 60,8±11,9 года, от 18 до 85 лет), группа контроля 2 составила 20 человек, сопоставимых по полу и возрасту.
У всех пациентов был произведен забор венозной крови в количестве 5 мл для оценки содержания глюкозы крови, гликированного гемоглобина (HbA1c), уровня тау протеина. Также на визите 1 пациенты совместно с врачом заполняли опросник, оценивающий когнитивные функции, — Монреальскую шкалу когнитивных нарушений (MoCA), а также тест запоминания 12 слов. Для оценки вариабельности содержания глюкозы использовали данные, полученные при непрерывном мониторировании гликемии на приборе iPro-2 (Medtronic, США), программное обеспечение CareLink iProTM. Коэффициенты вариабельности рассчитывали в программе-калькуляторе EasyGV (версия 9.0). Исследовались следующие показатели: стандартное отклонение (SD), скорость изменения гликемии (MAG), средний уровень гликемии (MEAN), амплитуда колебаний глюкозы (MAGE), индекс продолжительности повышения гликемии (CONGA), индекс лабильности гликемии (LI), индекс риска гипогликемии/гипергликемии (LBGI/HBGI).
Размеры выборки рассчитывались по формуле минимального объема групп для сравнения показателя в двух независимых группах. Статистические показатели рассчитывались в программе IBM SPSS Statistics (США). Нормальность распределения признаков оценивали с использованием W-теста Шапиро — Уилка. В описательном анализе при нормальном распределении вычисляли среднее арифметическое значение (X), ошибку среднего значения. Если определялось нормальное распределение признаков, то использовали оценку среднего значения (m), а в случае ненормального — квартилей (Me, Q1-Q3). Кроме того, при сравнительном анализе при нормальном распределении подсчитывали t-критерий Стьюдента и Z-критерий Манна — Уитни (U) при ненормальном. В случае определения зависимых данных применяли критерий Уилкоксона. Критическим уровнем значимости считали 0,05. Частотный анализ был использован для оценки качественных параметров. Для верификации достоверности различий был определен χ2 Пирсона. В корреляционном анализе использовали коэффициент Спирмена.
Результаты исследования
Анализ общей характеристики пациентов показал, что пациенты как с СД 1 типа, так и с СД 2 типа были сопоставимы по возрасту и имели значимо повышенные уровни гликемии (U=57,5; p<0,001; U=61,5 p<0,001) и HbA1c (U=25,5; p<0,001; U=19,5 p<0,001), которые говорят об отсутствии компенсации заболевания (табл. 1).

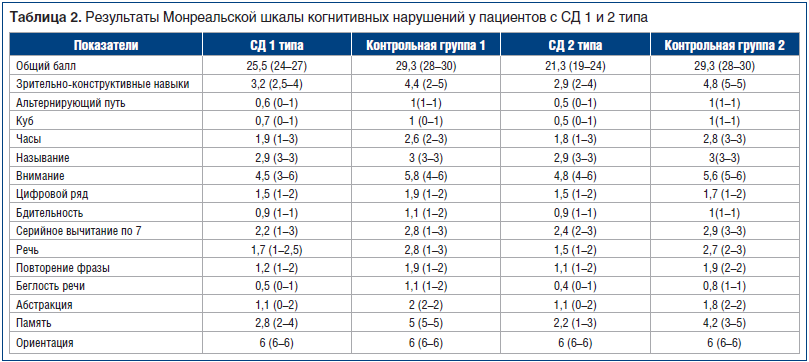
Анализ когнитивных функций у пациентов с СД 1 типа показал снижение общего балла (U=36,0; p<0,001), а также результатов оценки зрительно-конструктивных функций (U=436,0; p<0,001), внимания (U=446,0; p<0,001), речи (U=388,5; p<0,001), абстракции (U=420,0; p<0,001) и памяти (U=108,0; p<0,001). При СД 2 типа по сравнению с контрольной группой 2 выявили снижение общего балла (U=81,5; p<0,001), а также результатов оценки зрительно-конструктивных навыков (U=178,5; p<0,001), внимания (p=0,0; U=568,0; p<0,001), речи (U=252,0; p<0,001), абстракции (U=519,5; p<0,001) и памяти (U=267,5; p<0,001) (табл. 2).
Затем был проведен сравнительный анализ уровня тау протеина, который был значимо выше у пациентов с СД 1 типа, чем в контрольной группе 1 (U=113,0; р=0,001). Также более высокое содержание данного белка было зарегистрировано у пациентов с СД 2 типа (U=151,0; р=0,001) (табл. 3).

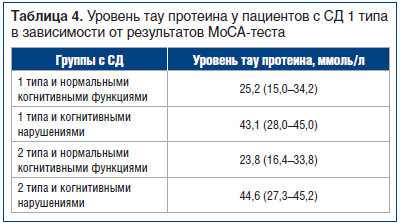
Всех пациентов с СД 1 и 2 типа разделили на 2 группы: с нормальными когнитивными функциями (MoCA-тест более 26–30 баллов) и с когнитивными нарушениями (менее 26 баллов). В результате был получен более высокий уровень тау протеина у пациентов, имеющих низкий балл по результатам MoCA, средний уровень 43,1 ммоль/л (U=11,0; p<0,001). Такая же тенденция была выявлена в группе с СД 2 типа, средний уровень 44,6 ммоль/л у пациентов с когнитивными расстройствами (U=11,0; p<0,001) (табл. 4).
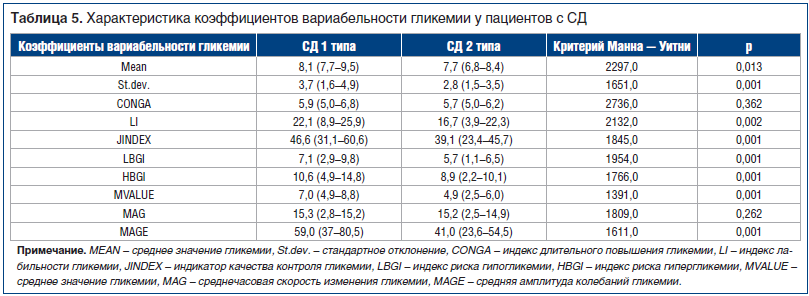
Для более глубокой оценки было проведено исследование вариабельности гликемии у пациентов с СД 1 и 2 типа (табл. 5).
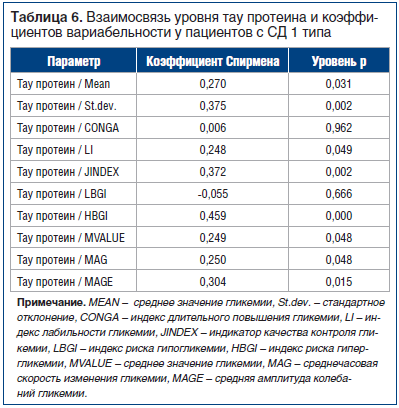
При проведении корреляционного анализа в группе пациентов с СД 1 типа была выявлена положительная корреляционная связь тау протеина с уровнями гликемии натощак, гликированного гемоглобина и МоСА-тестом (r=0,6, p<0,001; r=0,5, p<0,001; r=0,9, p<0,001). В группе пациентов с СД 2 типа была найдена связь низкой значимости уровня тау протеина с наличием когнитивных расстройств (r=0,2, p<0,001) и высокой — с возрастом пациентов (r=0,8, p<0,001). Значимые корреляции коэффициентов вариабельности и связи с тау протеином были выявлены только в группе с СД 1 типа (табл. 6).
Обсуждение
СД ассоциирован с когнитивными нарушениями, которые проявляются в виде клинических симптомов снижения памяти, внимания, а также скорости обработки различной информации и исполнительных функций [10, 11]. В нашем исследовании у пациентов с СД 1 типа регистрируется снижение зрительно-конструктивных навыков и внимания, а при СД 2 типа наиболее выражено снижение памяти и беглости речи. В качестве основного механизма развития данных нарушений Holmes et al. предлагает рассматривать изменения уровня глюкозы, включающие как гипогликемию, так и гипергликемию [12]. В результате оценки данных было выявлено, что хроническая гипергликемия и ее вариабельность ассоциированы с когнитивными расстройствами при СД. Кроме того, имеются исследования тау-зависимых механизмов когнитивных расстройств при СД. При индуцированном экспериментальном СД выявляется гиперфосфорилирование тау протеина в коре и гиппокампе [13]. Также появляются исследования тау протеина в спинномозговой жидкости пациентов с СД 1 и 2 типа, которые показывают его значимое увеличение по сравнению со таковым у здоровых людей [14, 15]. В данном исследовании была проведена оценка уровня тау протеина в сыворотке пациентов с СД 1 и 2 типа, которая показала значимо высокие уровни тау протеина у пациентов с когнитивными расстройствами.
Заключение
Пациенты с СД 1 и 2 типа имеют когнитивные нарушения, которые ассоциированы с повышением уровня тау протеина в сыворотке плазмы, что указывает на патофизиологическую роль таупатии в развитии осложнений со стороны центральной нервной системы при СД. Также выявлена связь неудовлетворительной компенсации углеводного обмена с повышением уровня тау протеина у пациентов с СД 1 типа, что указывает на вклад хронической гипергликемии и вариабельности глюкозы в развитие когнитивных расстройств.












