–ö–Ψ–Ϋ―³―É―Ü–Η–Ι
–ü–Ψ–Ε–Α–Μ―É–Ι, ―¹–Β–≥–Ψ–¥–Ϋ―è –Ϋ–Β―² –±–Ψ–Μ–Β–Β –¥–≤―É―¹–Φ―΄―¹–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η―è –Ϋ–Η –Κ –Ψ–¥–Ϋ–Ψ–Ι –Η–Ζ –≥―Ä―É–Ω–Ω ―¹–Α―Ö–Α―Ä–Ψ―¹–Ϋ–Η–Ε–Α―é―â–Η―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ ―²–Η–Α–Ζ–Ψ–Μ–Η–¥–Η–Ϋ–¥–Η–Ψ–Ϋ–Α–Φ–Η (–Δ–½–î).
–ö 2000 –≥–Ψ–¥―É –Ϋ–Α ―Ä―΄–Ϋ–Κ–Β –Ω―Ä–Η―¹―É―²―¹―²–≤–Ψ–≤–Α–Μ–Ψ 3 –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α ―ç―²–Ψ–Ι –≥―Ä―É–Ω–Ω―΄. –ö –Ϋ–Α―¹―²–Ψ―è―â–Β–Φ―É –≤―Ä–Β–Φ–Β–Ϋ–Η –Ψ–¥–Η–Ϋ –Ω–Ψ–Μ–Ϋ–Ψ―¹―²―¨―é –Ζ–Α–Ω―Ä–Β―â–Β–Ϋ (―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ), –Κ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―é –≤―²–Ψ―Ä–Ψ–≥–Ψ (―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ) –Η–Φ–Β―é―²―¹―è –Ψ―΅–Β–Ϋ―¨ ―É―¹―²–Ψ–Ι―΅–Η–≤―΄–Β –Η ―à–Η―Ä–Ψ–Κ–Ψ ―Ä–Α―¹–Ω―Ä–Ψ―¹―²―Ä–Α–Ϋ–Β–Ϋ–Ϋ―΄–Β –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Β –Ω―Ä–Β―²–Β–Ϋ–Ζ–Η–Η, –Α ―²―Ä–Β―²–Η–Ι (–Ω–Η–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ), –Ϋ–Β –Η–Φ–Β―é―â–Η–Ι ―΅–Β―²–Κ–Η―Ö –Ω―Ä–Β―²–Β–Ϋ–Ζ–Η–Ι –Κ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―é, –Ϋ–Α ―¹–Α–Φ–Ψ–Φ –¥–Β–Μ–Β –≤ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Η–Η –≤―Ä–Α―΅–Β–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ ―΅–Β―²–Κ–Ψ –¥–Η―¹―²–Α–Ϋ―Ü–Η―Ä–Ψ–≤–Α–Ϋ –Ψ―² –≤―²–Ψ―Ä–Ψ–≥–Ψ. –£–Ψ―² –Η –Ω–Ψ–Μ―É―΅–Α–Β―²―¹―è, ―΅―²–Ψ –≤ ―Ü–Β–Μ–Ψ–Φ –Ϋ–Β–Ψ–¥–Ψ–Μ–Η–Φ–Ψ–≥–Ψ –Η –Ψ―¹–Ψ–±–Ψ–≥–Ψ –Ε–Β–Μ–Α–Ϋ–Η―è –Κ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―é ―ç―²–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ ―É –Ω―Ä–Α–Κ―²–Η―΅–Β―¹–Κ–Η―Ö –≤―Ä–Α―΅–Β–Ι –Κ–Α–Κ–―²–Ψ –Ϋ–Β –Ω―Ä–Ψ―¹–Φ–Α―²―Ä–Η–≤–Α–Β―²―¹―è. –ü–Ψ –Κ―Ä–Α–Ι–Ϋ–Β–Ι –Φ–Β―Ä–Β, –Ω–Ψ–Μ–Ψ–Ε–Β–Ϋ–Η–Β ―²–Α–Κ–Ψ–≤–Ψ, ―΅―²–Ψ –Ψ―²–≤–Β―² –Ϋ–Α –≤–Ψ–Ω―Ä–Ψ―¹ –Ψ –Ω–Ψ–Ω―É–Μ―è―Ä–Ϋ–Ψ―¹―²–Η ―ç―²–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ –≤―΄–Ζ―΄–≤–Α–Β―² –Ψ―â―É―â–Β–Ϋ–Η–Β ―Ä–Α―¹―²–Β―Ä―è–Ϋ–Ϋ–Ψ–Ι –Ϋ–Β–Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Ϋ–Ψ―¹―²–Η –Κ–Α–Κ ―¹―Ä–Β–¥–Η –Ω―Ä–Α–Κ―²–Η–Κ―É―é―â–Η―Ö –≤―Ä–Α―΅–Β–Ι, ―²–Α–Κ –Η ―É –Ω―Ä–Β–¥―¹―²–Α–≤–Η―²–Β–Μ–Β–Ι ―³–Α―Ä–Φ–Α―Ü–Β–≤―²–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –±–Η–Ζ–Ϋ–Β―¹–Α.
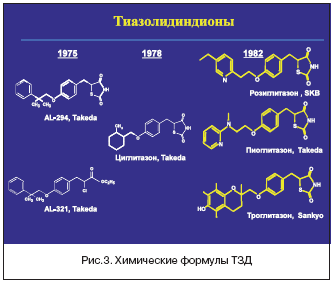
–‰–Ϋ―¹―É–Μ–Η–Ϋ–―¹–Β–Ϋ―¹–Η―²–Α–Ι–Ζ–Β―Ä―΄, –Δ–½–î –±―΄–Μ–Η –≤–Ω–Β―Ä–≤―΄–Β –Ψ―²–Κ―Ä―΄―²―΄ –≤ –·–Ω–Ψ–Ϋ–Η–Η –≤ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Β ―Ä–Α–Ζ―Ä–Α–±–Ψ―²–Ψ–Κ Takeda Chemical Industries. –Γ–Ψ–Ζ–¥–Α–Ϋ–Η–Β –Ω–Η–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ψ–Μ–Η―Ü–Β―²–≤–Ψ―Ä―è–Μ–Ψ ―¹–Ψ–±–Ψ–Ι –≤―΄―¹―à–Η–Ι –Ω–Η–Κ –¥–Ψ―¹―²–Η–Ε–Β–Ϋ–Η–Ι –Ω–Ψ―΅―²–Η 40––Μ–Β―²–Ϋ–Η―Ö –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ―΄―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι –≤ ―ç―²–Ψ–Φ –Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Η–Η. –û―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Ι –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―² –Ϋ–Ψ–≤–Ψ–≥–Ψ –Κ–Μ–Α―¹―¹–Α –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ AL–321 –±―΄–Μ –≤―΄–¥–Β–Μ–Β–Ϋ –≤ 1975 –≥–Ψ–¥―É. –‰–Ζ 2 ―²―΄―¹. –Η–Ζ―É―΅–Β–Ϋ–Ϋ―΄―Ö ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Ϋ―΄―Ö ―ç―²–Ψ–≥–Ψ –Η―¹―Ö–Ψ–¥–Ϋ–Ψ–≥–Ψ –≤–Β―â–Β―¹―²–≤–Α –≤ 1982 –≥–Ψ–¥―É –¥–Μ―è –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è –±―΄–Μ –Ψ―²–Ψ–±―Ä–Α–Ϋ –Ω–Η–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ (–ü–™) [1].
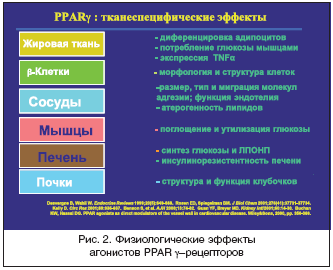
–û―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Ι –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ –¥–Β–Ι―¹―²–≤–Η―è ―ç―²–Η―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ ―¹–≤―è–Ζ–Α–Ϋ ―¹ –Α–Κ―²–Η–≤–Α―Ü–Η–Β–Ι ―è–¥–Β―Ä–Ϋ―΄―Ö PPAR γ–―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤ (–Α–Ϋ–≥–Μ–Η–Ι―¹–Κ–Α―è –Α–±–±―Ä–Β–≤–Η–Α―²―É―Ä–Α, –Ψ–Ζ–Ϋ–Α―΅–Α―é―â–Α―è «―Ä–Β―Ü–Β–Ω―²–Ψ―Ä―΄, –Α–Κ―²–Η–≤–Η―Ä―É–Β–Φ―΄–Β –Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―²–Ψ―Ä–Α–Φ–Η –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ»). –ù–Α–Ζ–≤–Α–Ϋ–Η–Β ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤ –Ω–Ψ―è–≤–Η–Μ–Ψ―¹―¨ –Ω―Ä–Η –Ω–Ψ–Η―¹–Κ–Β ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ϋ―΄―Ö –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η–Ι, –Ϋ–Α –Κ–Ψ―²–Ψ―Ä―΄–Β –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤―É―é―² –≤–Β―â–Β―¹―²–≤–Α, –≤―΄–Ζ―΄–≤–Α―é―â–Η–Β ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β –≤ –Κ–Μ–Β―²–Κ–Β –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Α ―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Η―Ö –≤–Ϋ―É―²―Ä–Η–Κ–Μ–Β―²–Ψ―΅–Ϋ―΄―Ö –Ψ―Ä–≥–Α–Ϋ–Β–Μ–Μ – –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ.
PPAR –Ψ―²–Ϋ–Ψ―¹―è―²―¹―è –Κ –Ψ―¹–Ψ–±–Ψ–Φ―É –≤–Η–¥―É ―è–¥–Β―Ä–Ϋ―΄―Ö ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤, –Κ–Ψ―²–Ψ―Ä―΄–Β ―Ä–Β–≥―É–Μ–Η―Ä―É―é―² ―ç–Κ―¹–Ω―Ä–Β―¹―¹–Η―é –≥–Β–Ϋ–Ψ–≤ –Κ–Μ–Β―²–Κ–Η –≤ –Ψ―²–≤–Β―² –Ϋ–Α ―¹–≤―è–Ζ―΄–≤–Α–Ϋ–Η–Β ―¹–Ψ ―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Η–Φ –¥–Μ―è –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α –≤–Β―â–Β―¹―²–≤–Ψ–Φ – –Μ–Η–≥–Α–Ϋ–¥–Ψ–Φ (―Ä–Η―¹. 1). –ù–Α ―¹–Β–≥–Ψ–¥–Ϋ―è―à–Ϋ–Η–Ι –¥–Β–Ϋ―¨ –Ψ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ–Ψ–≤–Α–Ϋ―΄ ―²―Ä–Η ―²–Η–Ω–Α PPAR, –Κ–Ψ―²–Ψ―Ä―΄–Β –Ψ–±–Ψ–Ζ–Ϋ–Α―΅–Α―é―²―¹―è, –Κ–Α–Κ PPAR α, PPAR β –Η PPAR γ.
–Δ–Η–Α–Ζ–Ψ–Μ–Η–¥–Η–Ϋ–¥–Η–Ψ–Ϋ―΄ ―è–≤–Μ―è―é―²―¹―è –Μ–Η–≥–Α–Ϋ–¥–Α–Φ–Η PPARγ ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤. –£ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –≤―Ä–Β–Φ―è ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ψ, ―΅―²–Ψ ―³―É–Ϋ–Κ―Ü–Η–Η PPAR –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ ―à–Η―Ä–Β –Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―Ü–Η–Η –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ. –ü–Ψ–¥ –≤–Μ–Η―è–Ϋ–Η–Β–Φ –Α–Κ―²–Η–≤–Α―Ü–Η–Η PPAR γ ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤ –Η–Ζ–Φ–Β–Ϋ―è–Β―²―¹―è ―Ä–Β–≥―É–Μ―è―Ü–Η―è ―É–≥–Μ–Β–≤–Ψ–¥–Ϋ–Ψ–≥–Ψ –Ψ–±–Φ–Β–Ϋ–Α, –Ϋ–Ψ ―΅―²–Ψ –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –≤–Α–Ε–Ϋ–Ψ – ―¹―É―â–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ –Ω–Ψ–≤―΄―à–Α–Β―²―¹―è ―΅―É–≤―¹―²–≤–Η―²–Β–Μ―¨–Ϋ–Ψ―¹―²―¨ –Κ –Η–Ϋ―¹―É–Μ–Η–Ϋ―É –Ε–Η―Ä–Ψ–≤–Ψ–Ι, –Φ―΄―à–Β―΅–Ϋ–Ψ–Ι –Η –Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Ψ–Ι ―²–Κ–Α–Ϋ–Β–Ι. –≠―²–Ψ ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ―É–Β―² –Δ–½–î, –Κ–Α–Κ –Η–Ϋ―¹―É–Μ–Η–Ϋ–―¹–Β–Ϋ―¹–Η―²–Α–Ι–Ζ–Β―Ä―΄, –Η –¥–Β–Μ–Α–Β―² –Η―Ö –Ω―Ä–Η–Ϋ―Ü–Η–Ω–Η–Α–Μ―¨–Ϋ–Ψ –Ω―Ä–Η–≤–Μ–Β–Κ–Α―²–Β–Μ―¨–Ϋ―΄–Φ–Η –¥–Μ―è –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹–Α―Ö–Α―Ä–Ϋ―΄–Φ –¥–Η–Α–±–Β―²–Ψ–Φ (–Γ–î) 2 ―²–Η–Ω–Α. –†–Α–Ϋ–Β–Β –¥–Μ―è ―²–Α–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö –Β–¥–Η–Ϋ―¹―²–≤–Β–Ϋ–Ϋ―΄–Φ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–Φ, ―¹–Ϋ–Η–Ε–Α―é―â–Η–Φ –Η–Ϋ―¹―É–Μ–Η–Ϋ–Ψ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²―¨, –±―΄–Μ –Φ–Β―²―³–Ψ―Ä–Φ–Η–Ϋ (―Ä–Η―¹. 2) [2].
–ü–Ψ ―¹―²–Β–Ω–Β–Ϋ–Η –Α―³–Η–Ϋ–Ϋ–Ψ―¹―²–Η –Κ PPAR γ–―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α–Φ –Η–Ζ–≤–Β―¹―²–Ϋ―΄–Β –Δ–½–î ―Ä–Α―¹–Ω–Ψ–Μ–Α–≥–Α―é―²―¹―è ―¹–Μ–Β–¥―É―é―â–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ: ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ>–ü–™>―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ [3]. –Λ–Ψ―Ä–Φ―É–Μ―΄ ―ç―²–Η―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ―΄ –Ϋ–Α ―Ä–Η―¹―É–Ϋ–Κ–Β 3.
–ü–Β―Ä–≤―΄–Φ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–Φ –Η–Ζ –Κ–Μ–Α―¹―¹–Α –Δ–½–î, –Ω–Ψ―¹―²―É–Ω–Η–≤―à–Η–Φ –≤ –Α–Ω―²–Β–Κ–Η –Γ–®–ê –≤ 1997 –≥., –±―΄–Μ ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ. –û–±―¹―É–Ε–¥–Α―²―¨ –Β–≥–Ψ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²―΄–Β ―¹–≤–Ψ–Ι―¹―²–≤–Α ―¹–Β–Ι―΅–Α―¹ –Ϋ–Β―² –Ϋ–Η–Κ–Α–Κ–Ψ–≥–Ψ ―¹–Φ―΄―¹–Μ–Α, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –Ω―Ä–Ψ–¥–Α–Ε–Η ―ç―²–Ψ–≥–Ψ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α –≤ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –≤―Ä–Β–Φ―è –Ζ–Α–Ω―Ä–Β―â–Β–Ϋ―΄. –û–¥–Ϋ–Α–Κ–Ψ –≤―¹–Β –Ε–Β ―¹―²–Ψ–Η―² –Ϋ–Α–Ω–Ψ–Φ–Ϋ–Η―²―¨ ―²–Ψ, ―΅―²–Ψ –≤–Μ–Η―è–Ϋ–Η–Β ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ϋ–Α –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Η ―É–≥–Μ–Β–≤–Ψ–¥–Ϋ–Ψ–≥–Ψ –Ψ–±–Φ–Β–Ϋ–Α –Η ―³–Α–Κ―²–Ψ―Ä―΄ ―Ä–Η―¹–Κ–Α ―Ä–Α–Ζ–≤–Η―²–Η―è –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι –Η―à–Β–Φ–Η―΅–Β―¹–Κ–Ψ–Ι –±–Ψ–Μ–Β–Ζ–Ϋ–Η ―¹–Β―Ä–¥―Ü–Α –±―΄–Μ–Ψ –≤–Β―¹―¨–Φ–Α –Η –≤–Β―¹―¨–Φ–Α –Ω―Ä–Η–≤–Μ–Β–Κ–Α―²–Β–Μ―¨–Ϋ―΄–Φ, –Η –Ϋ–Β –Ψ–Ϋ–Η –Ω–Ψ―¹–Μ―É–Ε–Η–Μ–Η –Ω―Ä–Η―΅–Η–Ϋ–Ψ–Ι –Η–Ζ―ä―è―²–Η―è –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α ―¹ ―Ä―΄–Ϋ–Κ–Α –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤.
–ü―Ä–Β–Ω–Α―Ä–Α―² ―¹–Ϋ–Η–Ε–Α–Μ –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―é –≥–Μ―é–Κ–Ψ–Ζ―΄ –Η –Η–Ϋ―¹―É–Μ–Η–Ϋ–Α –≤ –Κ―Ä–Ψ–≤–Η, ―É–≤–Β–Μ–Η―΅–Η–≤–Α–Μ ―ç–Κ―¹–Ω―Ä–Β―¹―¹–Η―é –≥–Μ―é–Κ–Ψ–Ζ–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Ϋ―¹–Ω–Ψ―Ä―²–Β―Ä–Α (–Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –™–¦–°–Δ4) –Η –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Η―Ö –Ω―Ä–Ψ–Φ–Β–Ε―É―²–Ψ―΅–Ϋ―΄―Ö –Ω―Ä–Ψ–¥―É–Κ―²–Ψ–≤ –≤ –Η–Ϋ―¹―É–Μ–Η–Ϋ–―¹–Η–≥–Ϋ–Α–Μ―¨–Ϋ–Ψ–Φ –Κ–Α―¹–Κ–Α–¥–Β. –ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, –Ψ–Ϋ ―É–Φ–Β–Ϋ―¨―à–Α–Μ ―É―Ä–Ψ–≤–Β–Ϋ―¨ ―²―Ä–Η–≥–Μ–Η―Ü–Β―Ä–Η–¥–Ψ–≤ –Η –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ―¹―²―¨ –Α―Ä―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–Ι –≥–Η–Ω–Β―Ä―²–Ψ–Ϋ–Η–Η. –ë―΄–Μ–Ψ –Ψ–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ–Ψ ―²–Α–Κ–Ε–Β, ―΅―²–Ψ ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ ―É–≥–Ϋ–Β―²–Α–Β―² –≤–Ψ–Μ―¨―²–Α–Ε––Ζ–Α–≤–Η―¹–Η–Φ―΄–Ι –≤―Ö–Ψ–¥ –≤ –Κ–Α―Ä–¥–Η–Ψ–Φ–Η–Ψ―Ü–Η―² –Η–Ψ–Ϋ–Α –Κ–Α–Μ―¨―Ü–Η―è –Ω–Ψ–¥ –≤–Μ–Η―è–Ϋ–Η–Β–Φ –Ϋ–Ψ―Ä–Α–¥―Ä–Β–Ϋ–Α–Μ–Η–Ϋ–Α, –Ω―Ä–Β–Ω―è―²―¹―²–≤―É―è ―²–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ –Κ–Α–Μ―¨―Ü–Η–Β–≤–Ψ–Ι –Ω–Β―Ä–Β–≥―Ä―É–Ζ–Κ–Β –Φ–Η–Ψ–Κ–Α―Ä–¥–Η–Α–Μ―¨–Ϋ–Ψ–Ι –Κ–Μ–Β―²–Κ–Η –Η –Β–Β –Ω–Ψ―¹–Μ–Β–¥―É―é―â–Β–Φ―É –Ω–Ψ–≤―Ä–Β–Ε–¥–Β–Ϋ–Η―é.
–ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ ―¹–Ϋ–Η–Ε–Α–Μ ―΅–Α―¹―²–Ψ―²―É –≤–Α–Ζ–Ψ―¹–Ω–Α―¹―²–Η―΅–Β―¹–Κ–Ψ–Ι ―¹―²–Β–Ϋ–Ψ–Κ–Α―Ä–¥–Η–Η ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î, ―É–Φ–Β–Ϋ―¨―à–Α–Μ –Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―Ü–Η―é –Ϋ–Β–Ψ–Η–Ϋ―²–Η–Φ―΄ –Ω–Ψ―¹–Μ–Β –Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ–Ψ–≥–Ψ ―¹―²–Β–Ϋ―²–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α –Η ―É–Μ―É―΅―à–Α–Μ –Κ―Ä–Ψ–≤–Ψ―²–Ψ–Κ –≤ –Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ―΄―Ö ―¹–Ψ―¹―É–¥–Α―Ö ―¹–Β―Ä–¥―Ü–Α. –ö ―²–Ψ–Φ―É –Ε–Β –Ω―Ä–Η –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Η ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ –Φ–Β―²–Α–±–Ψ–Μ–Η―΅–Β―¹–Κ–Η–Φ ―¹–Η–Ϋ–¥―Ä–Ψ–Φ–Ψ–Φ –Ω―Ä–Β–Ω–Α―Ä–Α―² ―É–Φ–Β–Ϋ―¨―à–Α–Μ ―΅–Α―¹―²–Ψ―²―É ―Ä–Α–Ζ–≤–Η―²–Η―è –Γ–î –≤ –±―É–¥―É―â–Β–Φ [4–7].
–Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, ―¹ ―²–Ψ―΅–Κ–Η –Ζ―Ä–Β–Ϋ–Η―è –≤–Μ–Η―è–Ϋ–Η―è –Ϋ–Α ―³–Α–Κ―²–Ψ―Ä―΄ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–≥–Ψ –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ–Α –Ω―Ä–Η –Γ–î 2 ―²–Η–Ω–Α, ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –≤―΄–≥–Μ―è–¥–Β–Μ –≤–Β―¹―¨–Φ–Α –Ω―Ä–Η–≤–Μ–Β–Κ–Α―²–Β–Μ―¨–Ϋ–Ψ. –ö–Α―Ä―²–Η–Ϋ―É ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–≥–Ψ –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ–Α –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Ψ «–Ω–Ψ―Ä―²–Η–Μ–Η» ―¹–≤–Ψ–Ι―¹―²–≤–Α ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α ―É―¹–Η–Μ–Η–≤–Α―²―¨ –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η ―Ö―Ä–Ψ–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η –Κ―Ä–Ψ–≤–Ψ–Ψ–±―Ä–Α―â–Β–Ϋ–Η―è, –Α ―²–Α–Κ–Ε–Β –Β–≥–Ψ ―¹–Ω–Ψ―¹–Ψ–±–Ϋ–Ψ―¹―²―¨ –Ω–Ψ―²–Β–Ϋ―Ü–Η―Ä–Ψ–≤–Α―²―¨ –Ϋ–Α―Ä–Α―¹―²–Α–Ϋ–Η–Β –≤–Β―¹–Α ―²–Β–Μ–Α –±–Ψ–Μ―¨–Ϋ―΄―Ö. –‰–Ϋ―²–Β―Ä–Β―¹–Ϋ–Ψ, ―΅―²–Ψ –Ω―Ä–Η ―ç―²–Ψ–Φ –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ―΄―Ö –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Ι ―¹–Ψ ―¹―²–Ψ―Ä–Ψ–Ϋ―΄ ―¹―²―Ä―É–Κ―²―É―Ä―΄ ―¹–Β―Ä–¥―Ü–Α –Η –Ϋ–Α―Ä–Α―¹―²–Α–Ϋ–Η―è ―Ä–Η―¹–Κ–Α ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–Ι ―¹–Φ–Β―Ä―²–Η –Ψ―²–Φ–Β―΅–Β–Ϋ–Ψ –Ϋ–Β –±―΄–Μ–Ψ [8].
–£ ―²–Ψ –Ε–Β –≤―Ä–Β–Φ―è, ―É–Ε–Β –≤ –Ω–Β―Ä–≤―΄–Β –¥–≤–Α –≥–Ψ–¥–Α –Β–≥–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è –≤ –Γ–®–ê –±―΄–Μ–Ψ –≤―΄―è–≤–Μ–Β–Ϋ–Ψ –±–Ψ–Μ–Β–Β 500 ―¹–Μ―É―΅–Α–Β–≤ –≥–Β–Ω–Α―²–Ψ―²–Ψ–Κ―¹–Η―΅–Ϋ–Ψ―¹―²–Η, –≤ ―².―΅. 43 ―¹–Μ―É―΅–Α―è –Ψ―¹―²―Ä–Ψ–Ι –Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η, –Ζ–Α–Κ–Ψ–Ϋ―΅–Η–≤―à–Η–Β―¹―è ―¹–Φ–Β―Ä―²―¨―é 23 –±–Ψ–Μ―¨–Ϋ―΄―Ö. –£ –·–Ω–Ψ–Ϋ–Η–Η ―É 153 –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η―Ö ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ, ―Ä–Α–Ζ–≤–Η–Μ―¹―è ―²―è–Ε–Β–Μ―΄–Ι –≥–Β–Ω–Α―²–Η―² (8 –Μ–Β―²–Α–Μ―¨–Ϋ―΄―Ö –Η―¹―Ö–Ψ–¥–Ψ–≤) [9]. –‰–Ζ––Ζ–Α ―²–Α–Κ–Η―Ö ―²―è–Ε–Β–Μ―΄―Ö –Ω–Ψ–±–Ψ―΅–Ϋ―΄―Ö ―ç―³―³–Β–Κ―²–Ψ–≤ ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –±―΄–Μ –Ψ―²–Ψ–Ζ–≤–Α–Ϋ ―¹ ―³–Α―Ä–Φ–Α―Ü–Β–≤―²–Η―΅–Β―¹–Κ–Ψ–≥–Ψ ―Ä―΄–Ϋ–Κ–Α –≤ 2000 –≥. –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –Ψ–±–Μ–Α–¥–Α―è –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ―΄–Φ –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ–Ψ–Φ –≤ –Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η–Η –Μ–Β―΅–Β–Ϋ–Η―è –Γ–î 2 ―²–Η–Ω–Α –Η ―Ä―è–¥–Α –Β–≥–Ψ –Ψ―¹–Ϋ–Ψ–≤–Ϋ―΄―Ö ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι (–Γ–Γ–û), –Ω―Ä–Β–Ω–Α―Ä–Α―² –Ψ–Κ–Α–Ζ–Α–Μ―¹―è –Ϋ–Β–Ω―Ä–Η–Β–Φ–Μ–Β–Φ―΄–Φ –¥–Μ―è –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι –Ω―Ä–Α–Κ―²–Η–Κ–Η –Η–Ζ––Ζ–Α ―¹–≤–Ψ–Ι―¹―²–≤, –Ϋ–Η–Κ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ –Ϋ–Α–Ω―Ä―è–Φ―É―é –Ϋ–Β ―¹–≤―è–Ζ–Α–Ϋ–Ϋ―΄―Ö ―¹ –Γ–î –Η –Β–≥–Ψ –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η―è–Φ–Η.
–Γ–Β–≥–Ψ–¥–Ϋ―è –Ϋ–Α –Φ–Η―Ä–Ψ–≤–Ψ–Φ ―³–Α―Ä–Φ–Α―Ü–Β–≤―²–Η―΅–Β―¹–Κ–Ψ–Φ ―Ä―΄–Ϋ–Κ–Β –Ω―Ä–Η―¹―É―²―¹―²–≤―É―é―² –¥–≤–Α –Ω―Ä–Β–¥―¹―²–Α–≤–Η―²–Β–Μ―è –Κ–Μ–Α―¹―¹–Α –Δ–½–î – ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –Η –ü–™, –Ζ–Α―Ä–Β–≥–Η―¹―²―Ä–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄–Β –≤ –Γ–®–ê –≤ 1999 –≥., –≤ –†–Ψ―¹―¹–Η–Η – –≤ 2004 –≥.
–î–Α–Ϋ–Ϋ―΄–Β –Ψ –≤–Μ–Η―è–Ϋ–Η–Η ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ϋ–Α ―³–Α–Κ―²–Ψ―Ä―΄ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–≥–Ψ ―Ä–Η―¹–Κ–Α ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α, –Ω–Ψ–Ε–Α–Μ―É–Ι, –Ϋ–Β –Φ–Β–Ϋ–Β–Β –≤–Ω–Β―΅–Α―²–Μ―è―é―â–Η–Β, ―΅–Β–Φ ―É ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α. –ö–Α–Κ –Η ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ, ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ ―¹–Ϋ–Η–Ε–Α–Β―² ―É―Ä–Ψ–≤–Β–Ϋ―¨ ―¹–Η―¹―²–Ψ–Μ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Η –¥–Η–Α―¹―²–Ψ–Μ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Α―Ä―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –¥–Α–≤–Μ–Β–Ϋ–Η―è ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –±–Ψ–Μ―¨–Ϋ―΄–Φ–Η, –Μ–Β―΅–Β–Ϋ–Ϋ―΄–Φ–Η –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α–Φ–Η ―¹―É–Μ―¨―³–Ψ–Ϋ–Η–Μ–Φ–Ψ―΅–Β–≤–Η–Ϋ―΄ [10].
–†–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ ―¹―É―â–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ –Ϋ–Β ―¹–Ϋ–Η–Ε–Α–Β―² ―É―Ä–Ψ–≤–Β–Ϋ―¨ ―²―Ä–Η–≥–Μ–Η―Ü–Β―Ä–Η–¥–Β–Φ–Η–Η ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α, –Ϋ–Ψ ―¹–¥–≤–Η–≥–Α–Β―² ―¹–Ω–Β–Κ―²―Ä ―Ö–Ψ–Μ–Β―¹―²–Β―Ä–Η–Ϋ–Α –≤ ―¹―²–Ψ―Ä–Ψ–Ϋ―É ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η―è –Β–≥–Ψ –Α―²–Β―Ä–Ψ–≥–Β–Ϋ–Ϋ–Ψ―¹―²–Η. –ê–Ϋ―²–Η–Α―²–Β―Ä–Ψ–≥–Β–Ϋ–Ϋ–Ψ–Β –¥–Β–Ι―¹―²–≤–Η–Β ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ω―Ä–Ψ―è–≤–Μ―è–Β―²―¹―è –≤ –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Η ―É―Ä–Ψ–≤–Ϋ―è ―Ö–Ψ–Μ–Β―¹―²–Β―Ä–Η–Ϋ–Α –¦–ü–£–ü, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –Ζ–Α ―¹―΅–Β―² –Ϋ–Α―Ä–Α―¹―²–Α–Ϋ–Η―è ―³―Ä–Α–Κ―Ü–Η–Η –¦–ü–£–ü2. –ü―Ä–Η ―ç―²–Ψ–Φ, –Ψ–¥–Ϋ–Α–Κ–Ψ, –Ψ―²–Φ–Β―΅–Α–Β―²―¹―è ―É–Φ–Β―Ä–Β–Ϋ–Ϋ–Ψ–Β –Ϋ–Α―Ä–Α―¹―²–Α–Ϋ–Η–Β –Ψ–±―â–Β–≥–Ψ ―Ö–Ψ–Μ–Β―¹―²–Β―Ä–Η–Ϋ–Α –Η –Ψ–±―â–Β–≥–Ψ –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Α ―Ö–Ψ–Μ–Β―¹―²–Β―Ä–Η–Ϋ–Α –¦–ü–ù–ü [11].
–£–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Β ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ϋ–Α ―É―Ä–Ψ–≤–Β–Ϋ―¨ –ï–―¹–Β–Μ–Β–Κ―²–Η–Ϋ–Α –Η –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―é –Γ–―Ä–Β–Α–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –±–Β–Μ–Κ–Α –≤ –Κ―Ä–Ψ–≤–Η, ―É–Φ–Β–Ϋ―¨―à–Α―è –Ω–Ψ―Ä–Α–Ε–Β–Ϋ–Η–Β ―¹–Ψ―¹―É–¥–Η―¹―²―΄―Ö ―¹―²–Β–Ϋ–Ψ–Κ ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α [12,13], ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É–Β―² ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η―é –Κ―Ä–Ψ–≤–Ψ―²–Ψ–Κ–Α –≤ –Ω–Β―Ä–Η―³–Β―Ä–Η―΅–Β―¹–Κ–Η―Ö ―¹–Ψ―¹―É–¥–Α―Ö. –ö–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η ―ç―²–Ψ –Ϋ–Α―Ö–Ψ–¥–Η―² ―¹–≤–Ψ–Β –Ψ―²―Ä–Α–Ε–Β–Ϋ–Η–Β –≤ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ–Φ ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η–Η –Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η―è ―²–Ψ–Μ―â–Η–Ϋ―΄ –Η–Ϋ―²–Η–Φ–Α/–Φ–Β–¥–Η–Α –≤ –Ψ–±―â–Η―Ö –Κ–Α―Ä–Ψ―²–Η–¥–Ϋ―΄―Ö –Α―Ä―²–Β―Ä–Η―è―Ö ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ –Η―à–Β–Φ–Η―΅–Β―¹–Κ–Ψ–Ι –±–Ψ–Μ–Β–Ζ–Ϋ―¨―é ―¹–Β―Ä–¥―Ü–Α, –Μ–Β―΅–Β–Ϋ–Ϋ―΄―Ö ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Ψ–Φ [14]. –î–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ ―É–Φ–Β–Ϋ―¨―à–Α―è ―É―Ä–Ψ–≤–Β–Ϋ―¨ –€–€–ü–9 [15], –Ψ―²―Ä–Α–Ε–Α―é―â–Β–≥–Ψ ―¹―²–Β–Ω–Β–Ϋ―¨ ―Ä–Η―¹–Κ–Α ―Ä–Α–Ζ―Ä―΄–≤–Α –Α―²–Β―Ä–Ψ―¹–Κ–Μ–Β―Ä–Ψ―²–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–Ι –±–Μ―è―à–Κ–Η ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α, –Η –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ ―¹–Ϋ–Η–Ε–Α―è –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―é –Η–Ϋ–≥–Η–±–Η―²–Ψ―Ä–Α –Α–Κ―²–Η–≤–Α―²–Ψ―Ä–Α ―²–Κ–Α–Ϋ–Β–≤–Ψ–≥–Ψ –Ω–Μ–Α–Ζ–Φ–Η–Ϋ–Ψ–≥–Β–Ϋ–Α–1 (–‰–ê–ü–1) [16], ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Κ–Ψ―²–Ψ―Ä–Ψ–≥–Ψ ―Ä–Β–Ζ–Κ–Ψ ―É–≤–Β–Μ–Η―΅–Β–Ϋ ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α, ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –Ψ–±―É―¹–Μ–Ψ–≤–Μ–Η–≤–Α–Β―² ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―Ä–Η―¹–Κ–Α ―Ä–Α–Ζ―Ä―΄–≤–Α –Α―²–Β―Ä–Ψ―¹–Κ–Μ–Β―Ä–Ψ―²–Η―΅–Β―¹–Κ–Η―Ö –±–Μ―è―à–Β–Κ –Η ―Ä–Α–Ζ–≤–Η―²–Η―è ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ―΄―Ö ―¹–Ψ―¹―É–¥–Ψ–≤ ―É ―²–Α–Κ–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö.
–û―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –Η–Ϋ―²–Β―Ä–Β―¹–Ϋ―΄ –¥–Α–Ϋ–Ϋ―΄–Β –Ψ–± –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Η ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ ―è–≤–Ϋ―΄–Φ–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è–Φ–Η –Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ–Ψ–≥–Ψ –Κ―Ä–Ψ–≤–Ψ–Ψ–±―Ä–Α―â–Β–Ϋ–Η―è. –ü―Ä–Η–Β–Φ ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –≤–Ψ –≤―Ä–Β–Φ―è ―¹―²―Ä–Β―¹―¹–Ψ–≤―΄―Ö ―¹–Η―²―É–Α―Ü–Η–Ι –±–Ψ–Μ―¨–Ϋ―΄–Φ–Η –Γ–î 2 ―²–Η–Ω–Α ―¹ –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β–Φ –Ω–Β―Ä―³―É–Ζ–Η–Η –Φ–Η–Ψ–Κ–Α―Ä–¥–Α –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ ―É–Μ―É―΅―à–Α–Β―² ―²–Κ–Α–Ϋ–Β–≤–Ψ–Β –Φ–Η–Ψ–Κ–Α―Ä–¥–Η–Α–Μ―¨–Ϋ–Ψ–Β –Κ―Ä–Ψ–≤–Ψ―¹–Ϋ–Α–±–Ε–Β–Ϋ–Η–Β. –†–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ ―¹–Ϋ–Η–Ε–Α–Β―² ―΅–Α―¹―²–Ψ―²―É ―Ä–Β―¹―²–Β–Ϋ–Ψ–Ζ–Ψ–≤ ―É ―¹―²–Β–Ϋ―²–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Γ–î 2 ―²–Η–Ω–Α –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –≥―Ä―É–Ω–Ω–Ψ–Ι –Ω–Μ–Α―Ü–Β–±–Ψ (38,2% vs 50%) [17]. –ë–Ψ–Μ–Β–Β ―²–Ψ–≥–Ψ, ―²–Ψ–Μ―¨–Κ–Ψ –Ω―Ä–Η―¹–Ψ–Β–¥–Η–Ϋ–Β–Ϋ–Η–Β ―²–Β―Ä–Α–Ω–Η–Η ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Ψ–Φ –Κ –Ω―Ä–Ψ–≤–Ψ–¥–Η–Φ–Ψ–Φ―É –Α–Ψ―Ä―²–Ψ––Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ–Ψ–Φ―É ―à―É–Ϋ―²–Η―Ä–Ψ–≤–Α–Ϋ–Η―é ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² ―¹–¥–Β–Μ–Α―²―¨ ―ç―²–Ψ –Η–Ϋ–≤–Α–Ζ–Η–≤–Ϋ–Ψ–Β –≤–Φ–Β―à–Α―²–Β–Μ―¨―¹―²–≤–Ψ –Ψ–±―ä–Β–Κ―²–Η–≤–Ϋ–Ψ –Ψ–Ω―Ä–Α–≤–¥–Α–Ϋ–Ϋ―΄–Φ, ―²–Α–Κ –Κ–Α–Κ –≤ –Ω–Ψ–¥–Ψ–±–Ϋ–Ψ–Ι ―¹–Η―²―É–Α―Ü–Η–Η –Ψ–Ϋ–Ψ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ –±–Ψ–Μ–Β–Β ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ, ―΅–Β–Φ –Ω―Ä–Ψ―¹―²–Ψ –Ϋ–Β–Η–Ϋ–≤–Α–Ζ–Η–≤–Ϋ–Α―è –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ–Α―è –Φ–Β–¥–Η–Κ–Α–Φ–Β–Ϋ―²–Ψ–Ζ–Ϋ–Α―è ―²–Β―Ä–Α–Ω–Η―è.
–ü―Ä–Η–Β–Φ ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ–Η –Ω–Ψ―¹–Μ–Β –Ψ–Ω–Β―Ä–Α―Ü–Η–Η ―²―Ä–Α–Ϋ―¹–Ω–Μ–Α–Ϋ―²–Α―Ü–Η–Η ―¹–Β―Ä–¥―Ü–Α ―¹–Ϋ–Η–Ε–Α–Β―² ―΅–Α―¹―²–Ψ―²―É ―Ä–Α–Ζ–≤–Η―²–Η―è –Ω–Ψ―Ä–Α–Ε–Β–Ϋ–Η–Ι –Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ―΄―Ö ―¹–Ψ―¹―É–¥–Ψ–≤ –≤ –Ω–Β―Ä–Β―¹–Α–Ε–Β–Ϋ–Ϋ–Ψ–Φ ―¹–Β―Ä–¥―Ü–Β, ―É–Φ–Β–Ϋ―¨―à–Α–Β―² ―΅–Η―¹–Μ–Ψ –Ϋ–Β―³–Α―²–Α–Μ―¨–Ϋ―΄―Ö –Κ–Α―Ä–¥–Η–Α–Μ―¨–Ϋ―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι –Η ―¹–Μ―É―΅–Α–Β–≤ –Ψ―²―²–Ψ―Ä–Ε–Β–Ϋ–Η―è –Ω–Β―Ä–Β―¹–Α–Ε–Β–Ϋ–Ϋ–Ψ–≥–Ψ ―¹–Β―Ä–¥―Ü–Α [18].
–ö–Α–Κ –Η –Ω―Ä–Η–Β–Φ ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α, –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α ―²–Α–Κ–Ε–Β ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É–Β―² –Ω–Ψ–≤―΄―à–Β–Ϋ–Η―é –≤–Β―¹–Α ―²–Β–Μ–Α –±–Ψ–Μ―¨–Ϋ―΄―Ö [19] –Η –Ϋ–Α―Ä–Α―¹―²–Α–Ϋ–Η―é –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Ψ–≤ –Ζ–Α―¹―²–Ψ–Ι–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η –Κ―Ä–Ψ–≤–Ψ–Ψ–±―Ä–Α―â–Β–Ϋ–Η―è. –û–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ–Ψ, ―΅―²–Ψ ―²–Β―Ä–Α–Ω–Η―è ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Ψ–Φ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 52 –Ϋ–Β–¥–Β–Μ―¨ ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α –Ϋ–Β ―¹–Ψ–Ω―Ä–Ψ–≤–Ψ–Ε–¥–Α–Β―²―¹―è –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Β–Φ –Φ–Α―¹―¹―΄ –Φ–Η–Ψ–Κ–Α―Ä–¥–Α –Η ―³―Ä–Α–Κ―Ü–Η–Η –≤―΄–±―Ä–Ψ―¹–Α –Μ–Β–≤–Ψ–≥–Ψ –Ε–Β–Μ―É–¥–Ψ―΅–Κ–Α, –Ϋ–Ψ –≤–Β–¥–Β―² –Κ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η –Ϋ–Β–Ζ–Ϋ–Α―΅–Η–Φ–Ψ–Φ―É –Ϋ–Α―Ä–Α―¹―²–Α–Ϋ–Η―é –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ––¥–Η–Α―¹―²–Ψ–Μ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ψ–±―ä–Β–Φ–Α –Μ–Β–≤–Ψ–≥–Ψ –Ε–Β–Μ―É–¥–Ψ―΅–Κ–Α ―¹–Β―Ä–¥―Ü–Α. –£ –Ψ―²–Μ–Η―΅–Η–Β –Ψ―² ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Ψ–≤ –≥–Β–Ω–Α―²–Ψ―²–Ψ–Κ―¹–Η―΅–Ϋ–Ψ―¹―²–Η ―É ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ϋ–Β –Ψ―²–Φ–Β―΅–Β–Ϋ–Ψ. –£–Ω–Ψ–Μ–Ϋ–Β –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ, ―΅―²–Ψ –Φ–Ϋ–Ψ–≥–Η–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α―²–Β–Μ―è–Φ –Ω–Ψ–¥–Ψ–±–Ϋ―΄–Β ―¹–≤–Ψ–Ι―¹―²–≤–Α ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è–Μ–Η―¹―¨ –≤–Β―¹―¨–Φ–Α –Ω–Β―Ä―¹–Ω–Β–Κ―²–Η–≤–Ϋ―΄–Φ–Η –¥–Μ―è ―¹–Ϋ–Η–Ε–Β–Ϋ–Η―è ―Ä–Η―¹–Κ–Α ―Ä–Α–Ζ–≤–Η―²–Η―è –Η―à–Β–Φ–Η―΅–Β―¹–Κ–Ψ–Ι –±–Ψ–Μ–Β–Ζ–Ϋ–Η ―¹–Β―Ä–¥―Ü–Α –Η –Β–Β –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α.
–û–¥–Ϋ–Α–Κ–Ψ –Ϋ–Α–Κ–Ψ–Ω–Μ–Β–Ϋ–Ϋ―΄–Ι –Ψ–Ω―΄―² –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α, –Κ ―¹–Ψ–Ε–Α–Μ–Β–Ϋ–Η―é, –±–Β–Ζ–Ε–Α–Μ–Ψ―¹―²–Ϋ–Ψ ―Ä–Α–Ζ―Ä―É―à–Η–Μ –≤–Ψ–Ζ–Ϋ–Η–Κ―à–Η–Β –Η–Μ–Μ―é–Ζ–Η–Η –Κ–Μ–Η–Ϋ–Η―Ü–Η―¹―²–Ψ–≤. –†–Α–Ϋ–Ϋ–Η–Β –Ψ–±―¹–Β―Ä–≤–Α―Ü–Η–Ψ–Ϋ–Ϋ―΄–Β –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è –±―΄–Μ–Η –Ω―Ä–Ψ―²–Η–≤–Ψ―Ä–Β―΅–Η–≤―΄. –Γ –Ψ–¥–Ϋ–Ψ–Ι ―¹―²–Ψ―Ä–Ψ–Ϋ―΄, –±―΄–Μ –Ψ–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ―΄–Ι –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Ι ―Ä–Η―¹–Κ ―Ä–Α–Ζ–≤–Η―²–Η―è –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α ―É –Ω–Ψ–Ε–Η–Μ―΄―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η―Ö ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ, –Α –Ϋ–Β –¥―Ä―É–≥–Η–Β –Ω–Β―Ä–Ψ―Ä–Α–Μ―¨–Ϋ―΄–Β –≥–Η–Ω–Ψ–≥–Μ–Η–Κ–Β–Φ–Η―΅–Β―¹–Κ–Η–Β ―¹―Ä–Β–¥―¹―²–≤–Α; ―¹ –¥―Ä―É–≥–Ψ–Ι – –Η–Φ–Β–Μ–Ψ―¹―¨ –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Ψ ―Ä–Α–±–Ψ―², –≤ –Κ–Ψ―²–Ψ―Ä―΄―Ö –Ω–Ψ–¥–Ψ–±–Ϋ―΄–Ι ―Ä–Η―¹–Κ –Ϋ–Β –±―΄–Μ –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Β–Ϋ.
–€–Β―²–Α––Α–Ϋ–Α–Μ–Η–Ζ 42 ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι, ―¹―Ä–Α–≤–Ϋ–Η–≤–Α―é―â–Η―Ö ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –Η –Ω–Μ–Α―Ü–Β–±–Ψ –Η–Μ–Η –¥―Ä―É–≥–Ψ–Ι ―²–Η–Ω –Α–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –Μ–Β―΅–Β–Ϋ–Η―è ―É 27 ―²―΄―¹. –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α –≤ –Κ–Μ–Η–Ϋ–Η–Κ–Α―Ö –ö–Μ–Η–≤–Μ–Β–Ϋ–¥–Α (–Γ–®–ê), –Ω–Ψ–Κ–Α–Ζ–Α–Μ, ―΅―²–Ψ ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –Ω―Ä–Η ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η–Η ―¹ –Ω–Μ–Α―Ü–Β–±–Ψ –Η–Μ–Η –¥―Ä―É–≥–Η–Φ–Η –Ω–Β―Ä–Ψ―Ä–Α–Μ―¨–Ϋ―΄–Φ–Η –≥–Η–Ω–Ψ–≥–Μ–Η–Κ–Β–Φ–Η―΅–Β―¹–Κ–Η–Φ–Η –Φ–Β–¥–Η–Κ–Α–Φ–Β–Ϋ―²–Α–Φ–Η –Ϋ–Α 43% ―É–≤–Β–Μ–Η―΅–Η–≤–Α–Β―² ―Ä–Η―¹–Κ –Ψ―¹―²―Ä–Ψ–≥–Ψ –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α –Η ―Ä–Η―¹–Κ ―Ä–Α–Ζ–≤–Η―²–Η―è ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η. –ü―Ä–Η ―ç―²–Ψ–Φ ―Ä–Η―¹–Κ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–Ι ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²–Η –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ –Ϋ–Β ―É–≤–Β–Μ–Η―΅–Η–≤–Α–Β―²―¹―è [20,21]. –ü–Ψ―¹–Μ–Β–¥―É―é―â–Η–Β –Φ–Β―²–Α––Α–Ϋ–Α–Μ–Η–Ζ―΄, –≤–Κ–Μ―é―΅–Α―é―â–Η–Β –¥–Α–Ϋ–Ϋ―΄–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι RECORD, ADOPT, DREAM, –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι, –≤–Ψ―à–Β–¥―à–Η―Ö –≤ –Ω―Ä–Β–¥―΄–¥―É―â–Η–Β –Φ–Β―²–Α––Α–Ϋ–Α–Μ–Η–Ζ―΄, ―²–Α–Κ–Ε–Β –Ω–Ψ–¥―²–≤–Β―Ä–¥–Η–Μ–Η –≤–Ζ–Α–Η–Φ–Ψ―¹–≤―è–Ζ―¨ –Ω―Ä–Η–Β–Φ–Α ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α ―¹ –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Φ ―Ä–Η―¹–Κ–Ψ–Φ –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α [22].
–ö 2010 –≥–Ψ–¥―É –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Ι ―Ä–Η―¹–Κ –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α –Ω–Ψ–¥ –≤–Μ–Η―è–Ϋ–Η–Β–Φ ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –±―΄–Μ –Ψ―²–Φ–Β―΅–Β–Ϋ –≤ 7 –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è―Ö [23–26,27–29], –Ω―Ä–Η―΅–Β–Φ –≤ 3–―Ö –Η–Ζ –Ϋ–Η―Ö ―ç―²–Ψ –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β –±―΄–Μ–Ψ ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η –¥–Ψ–Κ–Α–Ζ–Α–Ϋ–Ψ [23,28,29].
–ü–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄–Β –¥–Α–Ϋ–Ϋ―΄–Β ―¹―²–Α–≤–Η–Μ–Η –Ω–Ψ–¥ ―¹–Ψ–Φ–Ϋ–Β–Ϋ–Η–Β –Ω―Ä–Α–≤–Ψ–Φ–Β―Ä–Ϋ–Ψ―¹―²―¨ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α, –Ϋ–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α –≤―¹–Β –Β–≥–Ψ –Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ–Ψ–Β –≤–Μ–Η―è–Ϋ–Η–Β –Ϋ–Α ―³–Α–Κ―²–Ψ―Ä―΄ ―Ä–Η―¹–Κ–Α ―Ä–Α–Ζ–≤–Η―²–Η―è –‰–ë–Γ –Η ―É–Μ―É―΅―à–Β–Ϋ–Η–Β ―²–Β―΅–Β–Ϋ–Η―è –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄―Ö –Β–Β –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι. –ü―Ä–Η ―ç―²–Ψ–Φ –Ω―Ä–Η―΅–Η–Ϋ―΄ ―É―΅–Α―â–Β–Ϋ–Η―è –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è –Ψ―¹―²―Ä–Ψ–≥–Ψ –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α –Ω–Ψ–¥ –≤–Μ–Η―è–Ϋ–Η–Β–Φ ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α, –Β―¹–Μ–Η –Ϋ–Β ―É –≤―¹–Β―Ö, ―²–Ψ, –Ω–Ψ –Κ―Ä–Α–Ι–Ϋ–Β–Ι –Φ–Β―Ä–Β, ―É –Ψ―²–¥–Β–Μ―¨–Ϋ―΄―Ö –≥―Ä―É–Ω–Ω –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α, –Ψ―¹―²–Α–≤–Α–Μ–Η―¹―¨ –Α–±―¹–Ψ–Μ―é―²–Ϋ–Ψ –Ϋ–Β ―è―¹–Ϋ―΄–Φ–Η –Η –Ϋ–Η–Κ–Α–Κ –Ϋ–Β –≤―΄―²–Β–Κ–Α–Μ–Η –Η–Ζ –≤―¹–Β―Ö –Β–≥–Ψ –≤―΄―à–Β–Ψ–Ω–Η―¹–Α–Ϋ–Ϋ―΄―Ö ―¹–≤–Ψ–Ι―¹―²–≤.
–Γ―Ö–Ψ–¥–Ϋ―΄–Β –±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ―΄–Β ―¹–≤–Ψ–Ι―¹―²–≤–Α –≤ –Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η–Η ―²―Ä–Α–¥–Η―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö ―³–Α–Κ―²–Ψ―Ä–Ψ–≤ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–≥–Ψ –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ–Α –±―΄–Μ–Η –Ψ–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ―΄ –Η ―É –ü–™ (―Ä–Η―¹. 4). –û–¥–Ϋ–Α–Κ–Ψ –Ω–Ψ―¹–Μ–Β –Ϋ–Β–≥–Α―²–Η–≤–Ϋ–Ψ–≥–Ψ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ψ–Ω―΄―²–Α ―¹ ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Ψ–Φ –Η ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Ψ–Φ –Ψ–Ϋ–Η, –Κ―Ä–Ψ–Φ–Β ―ç–Ϋ―²―É–Ζ–Η–Α–Ζ–Φ–Α, –≤―΄–Ζ―΄–≤–Α–Μ–Η –Η –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Ϋ―É―é –Ϋ–Α―¹―²–Ψ―Ä–Ψ–Ε–Β–Ϋ–Ϋ–Ψ―¹―²―¨. –î–Μ―è –†–Ψ―¹―¹–Η–Η ―Ä–Α–Ζ―Ä–Β―à–Β–Ϋ–Η–Β –Ω–Ψ–¥–Ψ–±–Ϋ–Ψ–Ι –¥–≤―É―¹–Φ―΄―¹–Μ–Β–Ϋ–Ϋ–Ψ–Ι ―¹–Η―²―É–Α―Ü–Η–Η –Η–Φ–Β–Β―² –Ψ―¹–Ψ–±–Ψ–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β, ―²–Α–Κ –Κ–Α–Κ –≤ –Ϋ–Α―à–Β–Ι ―¹―²―Ä–Α–Ϋ–Β –¥–Μ―è –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è –¥–Ψ―¹―²―É–Ω–Β–Ϋ –Ψ―²–Β―΅–Β―¹―²–≤–Β–Ϋ–Ϋ―΄–Ι –Ω–Η–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –≤ ―³–Ψ―Ä–Φ–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α «–î–Η–Α–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ», –û–ê–û «–ê–ö–†–‰–Ξ–‰–ù», ―¹ ―à–Η―Ä–Ψ–Κ–Η–Φ ―¹–Ω–Β–Κ―²―Ä–Ψ–Φ –¥–Ψ–Ζ–Η―Ä–Ψ–≤–Ψ–Κ: 15, 30 –Η 45 –Φ–≥.
–ü–Ψ–¥–Ψ–±–Ϋ–Ψ –¥―Ä―É–≥–Η–Φ –Δ–½–î, –ü–™ ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É–Β―² –Ϋ–Α―Ä–Α―¹―²–Α–Ϋ–Η―é –≤–Β―¹–Α ―²–Β–Μ–Α –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α –Η ―É–≤–Β–Μ–Η―΅–Η–≤–Α–Β―² –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η –Κ―Ä–Ψ–≤–Ψ–Ψ–±―Ä–Α―â–Β–Ϋ–Η―è. –£ ―²–Ψ –Ε–Β –≤―Ä–Β–Φ―è –ü–™ , –Κ–Α–Κ –Η ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ, –Ϋ–Β –Ψ–Κ–Α–Ζ―΄–≤–Α–Β―² –≥–Β–Ω–Α―²–Ψ―²–Ψ–Κ―¹–Η―΅–Β―¹–Κ–Ψ–≥–Ψ ―ç―³―³–Β–Κ―²–Α, ―¹–≤–Ψ–Ι―¹―²–≤–Β–Ϋ–Ϋ–Ψ–≥–Ψ ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ―É. –ü―Ä–Η ―ç―²–Ψ–Φ –Β–≥–Ψ –±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ–Ψ–Β –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Β –Ϋ–Α ―²―Ä–Α–¥–Η―Ü–Η–Ψ–Ϋ–Ϋ―΄–Β ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²―΄–Β ―³–Α–Κ―²–Ψ―Ä―΄ ―Ä–Η―¹–Κ–Α –¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ –≤―΄―Ä–Α–Ε–Β–Ϋ–Ψ.
–ù–Β–Φ–Α–Μ―΄–Ι –≤–Κ–Μ–Α–¥ –≤ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―Ä–Η―¹–Κ–Α ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–≥–Ψ ―Ä–Η―¹–Κ–Α –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α –≤–Ϋ–Ψ―¹–Η―² –≤–Μ–Η―è–Ϋ–Η–Β –ü–™ –Ϋ–Α ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Α―Ä―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –¥–Α–≤–Μ–Β–Ϋ–Η―è ―É ―ç―²–Η―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö.
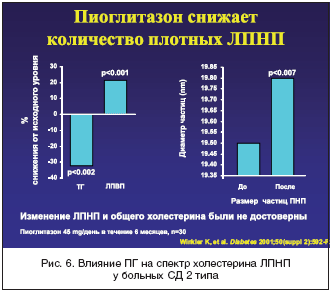
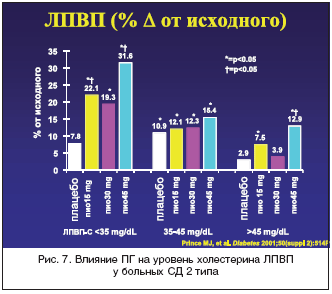
–ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, –ü–™ – ―ç―²–Ψ –Β–¥–Η–Ϋ―¹―²–≤–Β–Ϋ–Ϋ―΄–Ι –Δ–½–î, –Κ–Ψ―²–Ψ―Ä―΄–Ι –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ ―¹–Ϋ–Η–Ε–Α–Β―² ―É―Ä–Ψ–≤–Β–Ϋ―¨ ―²―Ä–Η–≥–Μ–Η―Ü–Β―Ä–Η–¥–Ψ–≤ –≤ –Κ―Ä–Ψ–≤–Η (―Ä–Η―¹. 5), ―É–≤–Β–Μ–Η―΅–Η–≤–Α–Β―² –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ –±–Ψ–Μ―¨―à–Η―Ö –Μ–Β–≥–Κ–Η―Ö ―΅–Α―¹―²–Η―Ü –≤ –Ψ–±―â–Β–Ι ―³―Ä–Α–Κ―Ü–Η–Η –Μ–Η–Ω–Ψ–Ω―Ä–Ψ―²–Β–Η–Ϋ–Ψ–≤ –Ϋ–Η–Ζ–Κ–Ψ–Ι –Ω–Μ–Ψ―²–Ϋ–Ψ―¹―²–Η (―Ä–Η―¹. 6), –Ϋ–Β –Ω–Ψ–≤―΄―à–Α―è –≤ ―Ü–Β–Μ–Ψ–Φ –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η ―ç―²–Η―Ö –Μ–Η–Ω–Ψ–Ω―Ä–Ψ―²–Β–Η–Ϋ–Ψ–≤ –≤ –Κ―Ä–Ψ–≤–Η, –Η –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ ―É–≤–Β–Μ–Η―΅–Η–≤–Α–Β―² –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―é –≤ –Κ―Ä–Ψ–≤–Η –¦–ü–£–ü (―Ä–Η―¹. 7) [31–36]. –ü–Ψ–¥–Ψ–±–Ϋ―΄–Β ―¹–¥–≤–Η–≥–Η –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ ―É–Φ–Β–Ϋ―¨―à–Α―é―² –Α―²–Β―Ä–Ψ–≥–Β–Ϋ–Ϋ―΄–Ι –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ –¥–Η―¹–Μ–Η–Ω–Η–¥–Β–Φ–Η–Η ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α. –Γ–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Α –≤–Η―¹―Ü–Β―Ä–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Ε–Η―Ä–Α –Ω–Ψ–¥ –≤–Μ–Η―è–Ϋ–Η–Β–Φ –ü–™ ―²–Α–Κ–Ε–Β ―è–≤–Μ―è–Β―²―¹―è ―³–Α–Κ―²–Ψ―Ä–Ψ–Φ, ―É–Φ–Β–Ϋ―¨―à–Α―é―â–Η–Φ ―Ä–Η―¹–Κ –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è –Α―²–Β―Ä–Ψ–≥–Β–Ϋ–Ϋ―΄―Ö ―¹–¥–≤–Η–≥–Ψ–≤ –Φ–Β―²–Α–±–Ψ–Μ–Η–Ζ–Φ–Α [37].
–ü―Ä–Α–Κ―²–Η―΅–Β―¹–Κ–Η –Κ–Α–Κ –¥–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨―¹―²–≤–Ψ –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Α–Ϋ―²–Η–Α―²–Β―Ä–Ψ―¹–Κ–Μ–Β―Ä–Ψ―²–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –¥–Β–Ι―¹―²–≤–Η―è –ü–™ –Φ–Ψ–Ε–Ϋ–Ψ ―Ä–Α―¹―¹–Φ–Α―²―Ä–Η–≤–Α―²―¨ –¥–Α–Ϋ–Ϋ―΄–Β –Ψ–± ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η–Η ―¹–Ψ–Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η―è –Η–Ϋ―²–Η–Φ–Α/–Φ–Β–¥–Η–Α –≤ –Κ–Α―Ä–Ψ―²–Η–¥–Ϋ―΄―Ö ―¹–Ψ―¹―É–¥–Α―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α, –Ϋ–Α―Ö–Ψ–¥―è―â–Η―Ö―¹―è –Ϋ–Α ―²–Β―Ä–Α–Ω–Η–Η –ü–™ (―Ä–Η―¹. 8) [38].
–Θ–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η–Β ―Ä–Α–Ζ–Φ–Β―Ä–Ψ–≤ –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α –≤ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ―΄―Ö ―É―¹–Μ–Ψ–≤–Η―è―Ö –Ψ―¹―²―Ä–Ψ–≥–Ψ –Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ–Ψ–≥–Ψ ―¹–Η–Ϋ–¥―Ä–Ψ–Φ–Α –Ω–Ψ–¥ –≤–Μ–Η―è–Ϋ–Η–Β–Φ –ü–™ – ―ç―²–Ψ –Β―â–Β –Ψ–¥–Η–Ϋ –Ω―Ä–Η–≤–Μ–Β–Κ–Α―²–Β–Μ―¨–Ϋ―΄–Ι ―à―²―Ä–Η―Ö –≤ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–Φ –Ω–Ψ―Ä―²―Ä–Β―²–Β –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α [39].
–£ ―¹–Ω–Β―Ü–Η–Α–Μ―¨–Ϋ–Ψ–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η, –Η–Ζ―É―΅–Α–≤―à–Β–Φ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²―΄–Β ―ç―³―³–Β–Κ―²―΄ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è –ü–™ «The Prospective Pioglitazon Clinical Trail in Macrovascular Events (PROactiv)», –≤ –Κ–Ψ―²–Ψ―Ä–Ψ–Φ ―É―΅–Α―¹―²–≤–Ψ–≤–Α–Μ–Ψ –±–Ψ–Μ–Β–Β 5 ―²―΄―¹. –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ –≤―΄―¹–Ψ–Κ–Η–Φ ―Ä–Η―¹–Κ–Ψ–Φ –Φ–Α–Κ―Ä–Ψ―¹–Ψ―¹―É–¥–Η―¹―²―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι, –±―΄–Μ–Ψ –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ–Ψ, ―΅―²–Ψ –Μ–Β―΅–Β–Ϋ–Η–Β –ü–™ –≤–Β–Μ–Ψ –Κ ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η –Ϋ–Β–¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ–Φ―É ―¹–Ϋ–Η–Ε–Β–Ϋ–Η―é ―Ä–Η―¹–Κ–Α –Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι –Η –Κ ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ –Ζ–Ϋ–Α―΅–Η–Φ–Ψ–Φ―É ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η―é –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Ψ–≥–Ψ –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―è, –≤–Κ–Μ―é―΅–Α―é―â–Β–≥–Ψ –≤ ―¹–Β–±―è –Ψ–±―â–Β–Β ―΅–Η―¹–Μ–Ψ ―¹–Φ–Β―Ä―²–Ϋ―΄―Ö ―¹–Μ―É―΅–Α–Β–≤, –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ ―Ä–Α–Ζ–≤–Η–≤―à–Η―Ö―¹―è –Η–Ϋ―³–Α―Ä–Κ―²–Ψ–≤ –Φ–Η–Ψ–Κ–Α―Ä–¥–Α –Η –Η–Ϋ―¹―É–Μ―¨―²–Ψ–≤ –≤–Φ–Β―¹―²–Β –≤–Ζ―è―²―΄―Ö [40]. –ü―Ä–Η ―ç―²–Ψ–Φ –ü–™ ―É–≤–Β–Μ–Η―΅–Η–≤–Α–Μ ―Ä–Η―¹–Κ ―Ä–Α–Ζ–≤–Η―²–Η―è ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η, –Ϋ–Ψ –Ϋ–Β ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²–Η ―¹ –Ϋ–Β–Ι ―¹–≤―è–Ζ–Α–Ϋ–Ϋ–Ψ–Ι!
–£ 2009 –≥–Ψ–¥―É –±―΄–Μ–Ψ –Ψ–Ω―É–±–Μ–Η–Κ–Ψ–≤–Α–Ϋ–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η–Β –¥–Β–Ι―¹―²–≤–Η―è –ü–™ –Η ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α, –Κ–Ψ―²–Ψ―Ä–Ψ–Β –±―΄–Μ–Ψ –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Ψ –≤ –ö–Α–Ϋ–Α–¥–Β, –≥–¥–Β ―É –Α–Φ–±―É–Μ–Α―²–Ψ―Ä–Ϋ―΄―Ö –±–Ψ–Μ―¨–Ϋ―΄―Ö 66 –Μ–Β―² –Η ―¹―²–Α―Ä―à–Β, –Ϋ–Α―΅–Α–≤―à–Η―Ö –Μ–Β―΅–Β–Ϋ–Η–Β ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Ψ–Φ –Η–Μ–Η –ü–™ –Φ–Β–Ε–¥―É 1 –Α–Ω―Ä–Β–Μ―è 2002 –≥–Ψ–¥–Α –Η 31 –Φ–Α―Ä―²–Α 2008 –≥–Ψ–¥–Α, –Η–Ζ―É―΅–Α–Μ―¹―è ―Ä–Η―¹–Κ ―Ä–Α–Ζ–≤–Η―²–Η―è –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α, ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η –Η –Μ–Β―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Η―¹―Ö–Ψ–¥–Α –≤ ―É―¹–Μ–Ψ–≤–Η―è―Ö ―Ä–Β―²―Ä–Ψ―¹–Ω–Β–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –Κ–Ψ–≥–Ψ―Ä―²–Ϋ–Ψ–≥–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è. –£ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –≤–Ψ―à–Μ–Ψ 39 736 –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α [27]. –ü–Ψ―¹–Μ–Β ―¹–±–Α–Μ–Α–Ϋ―¹–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –≥―Ä―É–Ω–Ω –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ω–Ψ –¥–Β–Φ–Ψ–≥―Ä–Α―³–Η―΅–Β―¹–Κ–Η–Φ –Η –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Φ –¥–Α–Ϋ–Ϋ―΄–Φ, –Α ―²–Α–Κ–Ε–Β –¥–Ψ–Ζ–Α–Φ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤, ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö, –Μ–Β―΅–Β–Ϋ–Ϋ―΄―Ö –ü–™, –±―΄–Μ –Ψ―²–Φ–Β―΅–Β–Ϋ –±–Ψ–Μ–Β–Β –Ϋ–Η–Ζ–Κ–Η–Ι ―Ä–Η―¹–Κ ―Ä–Α–Ζ–≤–Η―²–Η―è –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι, ―΅–Β–Φ ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ϋ–Α ―²–Β―Ä–Α–Ω–Η–Η ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Ψ–Φ (―¹–±–Α–Μ–Α–Ϋ―¹–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄–Ι –Η–Ϋ–¥–Β–Κ―¹ ―Ä–Η―¹–Κ–Α 0,86, 95% –î–‰ 0,76–0,90). –ü―Ä–Η –¥–Α–Μ―¨–Ϋ–Β–Ι―à–Β–Φ –Α–Ϋ–Α–Μ–Η–Ζ–Β –±―΄–Μ–Ψ –Ψ–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ–Ψ, ―΅―²–Ψ ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö, –Μ–Β―΅–Β–Ϋ–Ϋ―΄―Ö –ü–™, –Ψ―²–Φ–Β―΅–Α–Μ―¹―è –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ –±–Ψ–Μ–Β–Β –Ϋ–Η–Ζ–Κ–Η–Ι ―Ä–Η―¹–Κ ―¹–Φ–Β―Ä―²–Η (–‰–†=0,86, 95%–î–‰ 0,75–0,98) –Η –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ –±–Ψ–Μ–Β–Β –Ϋ–Η–Ζ–Κ–Η–Ι ―Ä–Η―¹–Κ ―Ä–Α–Ζ–≤–Η―²–Η―è ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η (–‰–†=0,77,95% –î–‰ 0,69–0,87). –û–¥–Ϋ–Α–Κ–Ψ –Ω–Ψ ―΅–Α―¹―²–Ψ―²–Β ―Ä–Α–Ζ–≤–Η―²–Η―è –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α ―ç―²–Η –≥―Ä―É–Ω–Ω―΄ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ –Φ–Β–Ε–¥―É ―¹–Ψ–±–Ψ–Ι –Ϋ–Β –Ψ―²–Μ–Η―΅–Α–Μ–Η―¹―¨.
–£ 2010 –≥–Ψ–¥―É –±―΄–Μ –Ψ–Ω―É–±–Μ–Η–Κ–Ψ–≤–Α–Ϋ ―¹―Ä–Α–≤–Ϋ–Η―²–Β–Μ―¨–Ϋ―΄–Ι –Α–Ϋ–Α–Μ–Η–Ζ ―²–Β―Ä–Α–Ω–Η–Η –ü–™ –Η ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Ψ–Φ ―É 227571 –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α 65 –Μ–Β―² –Η ―¹―²–Α―Ä―à–Β, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η―Ö –≤ ―¹–Η―¹―²–Β–Φ–Β Medicare –Γ–®–ê ―²–Β―Ä–Α–Ω–Η―é ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Ψ–Φ –Η–Μ–Η –ü–™ –≤ ―²–Β―΅–Β–Ϋ–Η–Β –Ϋ–Β –Φ–Β–Ϋ–Β–Β 3 –Μ–Β―² ―¹ 2006 –Ω–Ψ 2009 –≥–Ψ–¥. –‰―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β ―¹ ―É―΅–Α―¹―²–Η–Β–Φ ―΅–Μ–Β–Ϋ–Ψ–≤ FDA –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Ψ, ―΅―²–Ψ –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –ü–™ –≤–Β–¥–Β―² –Κ –Ω–Ψ–≤―΄―à–Β–Ϋ–Η―é ―Ä–Η―¹–Κ–Α –Η–Ϋ―¹―É–Μ―¨―²–Α, ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η –Η –Ψ–±―â–Β–Ι ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²–Η, –Α ―²–Α–Κ–Ε–Β –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ ―É–≤–Β–Μ–Η―΅–Η–≤–Α–Β―² –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨, ―³–Ψ―Ä–Φ–Η―Ä―É–Β–Φ―΄–Ι –Ψ–±―â–Η–Φ –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ–Φ –Ψ―¹―²―Ä―΄―Ö –Η–Ϋ―³–Α―Ä–Κ―²–Ψ–≤ –Φ–Η–Ψ–Κ–Α―Ä–¥–Α, ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η, –Η–Ϋ―¹―É–Μ―¨―²–Α –Η –Ψ–±―â–Β–Ι ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²–Η –≤–Φ–Β―¹―²–Β –≤–Ζ―è―²―΄―Ö ―É –Μ–Η―Ü 65 –Μ–Β―² –Η ―¹―²–Α―Ä―à–Β [41]. –†–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ, ―Ö–Ψ―²―è –Ψ―³–Η―Ü–Η–Α–Μ―¨–Ϋ–Ψ –Η –Ϋ–Β –Ζ–Α–Ω―Ä–Β―â–Β–Ϋ –Κ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―é –≤ –Κ–Μ–Η–Ϋ–Η–Κ–Β, –¥–Ψ–Μ–Ε–Β–Ϋ, –Ω–Ψ ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Α―Ü–Η–Η FDA, ―¹ –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ–Ψ–Ι –Ψ―¹―²–Ψ―Ä–Ψ–Ε–Ϋ–Ψ―¹―²―¨―é –Ω―Ä–Η–Φ–Β–Ϋ―è―²―¨―¹―è –≤ ―É―¹–Μ–Ψ–≤–Η―è―Ö ―Ä–Η―¹–Κ–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Η–Α–Μ―¨–Ϋ–Ψ–Ι –Η―à–Β–Φ–Η–Η, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ ―É –Μ―é–¥–Β–Ι, –Ω―Ä–Η–Ϋ–Η–Φ–Α―é―â–Η―Ö –Ϋ–Η―²―Ä–Α―²―΄, –Η –Ω―Ä–Η –Κ–Ψ–Φ–±–Η–Ϋ–Α―Ü–Η–Η ―¹ –Η–Ϋ―¹―É–Μ–Η–Ϋ–Ψ–Φ.
–£ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η, –Ψ–Ω―É–±–Μ–Η–Κ–Ψ–≤–Α–Ϋ–Ϋ–Ψ–Φ –≤ –£–Β–Μ–Η–Κ–Ψ–±―Ä–Η―²–Α–Ϋ–Η–Η, –Ω–Ψ–¥―΅–Β―Ä–Κ–Ϋ―É―²―΄ ―¹–Μ–Β–¥―É―é―â–Η–Β –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Β ―Ä–Α–Ζ–Μ–Η―΅–Η―è –≤ –Κ–Μ–Α―¹―¹–Α―Ö –Ω–Β―Ä–Ψ―Ä–Α–Μ―¨–Ϋ―΄―Ö ―¹–Α―Ö–Α―Ä–Ψ―¹–Ϋ–Η–Ε–Α―é―â–Η―Ö ―¹―Ä–Β–¥―¹―²–≤: –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –ü–™ –≤–Β–¥–Β―² –Κ –±–Ψ–Μ–Β–Β –Ϋ–Η–Ζ–Κ–Ψ–Ι –Ψ–±―â–Β–Ι ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²–Η –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –Φ–Β―²―³–Ψ―Ä–Φ–Η–Ϋ–Ψ–Φ –Η –Η–Φ–Β–Β―² –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –±–Ψ–Μ–Β–Β –±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ―΄–Ι –Ω―Ä–Ψ―³–Η–Μ―¨ ―Ä–Η―¹–Κ–Α –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Ψ–Φ [42].
–£–Φ–Β―¹―²–Β ―¹ ―²–Β–Φ –Ω―Ä–Η–Ζ–Ϋ–Α–Ϋ–Η–Β –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Μ–Η–¥–Β―Ä―¹―²–≤–Α –ü–™ ―¹―Ä–Β–¥–Η –¥―Ä―É–≥–Η―Ö –Δ–½–î –≤ –Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η–Η ―É–Μ―É―΅―à–Β–Ϋ–Η―è ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–≥–Ψ –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ–Α ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α –≤―¹–Β –Ε–Β –≤―΄–Ζ―΄–≤–Α–Β―² –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Ψ –≤–Ψ–Ω―Ä–Ψ―¹–Ψ–≤. –£–Β–¥―¨ –Ϋ–Β―² –Ϋ–Η–Κ–Α–Κ–Ψ–≥–Ψ ―¹–Ψ–Φ–Ϋ–Β–Ϋ–Η―è –≤ ―²–Ψ–Φ, ―΅―²–Ψ ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –Η ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ ―²–Α–Κ–Ε–Β ―Ä–Β–Α–Μ―¨–Ϋ–Ψ –Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ–Ψ –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤―É―é―² –Ϋ–Α –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Η ―É–≥–Μ–Β–≤–Ψ–¥–Ϋ–Ψ–≥–Ψ –Ψ–±–Φ–Β–Ϋ–Α, –Η–Ϋ―¹―É–Μ–Η–Ϋ–Ψ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η –Η –Ϋ–Α –Φ–Ϋ–Ψ–≥–Η–Β ―²―Ä–Α–¥–Η―Ü–Η–Ψ–Ϋ–Ϋ―΄–Β ―³–Α–Κ―²–Ψ―Ä―΄ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–≥–Ψ –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ–Α –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α. –ß―²–Ψ –Ε–Β –Ω–Ψ–Φ–Β―à–Α–Μ–Ψ –Η–Φ –¥–Ψ―¹―²–Η―΅―¨ ―¹―²–Ψ–Μ―¨ –Ε–Β –≤–Ω–Β―΅–Α―²–Μ―è―é―â–Η―Ö ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–≤, ―΅―²–Ψ –Η –ü–™? –ü–Ψ–Μ–Ψ–Ε–Η–Φ, ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ―É –Ω–Ψ–Φ–Β―à–Α–Μ–Α –Β–≥–Ψ –≥–Β–Ω–Α―²–Ψ―²–Ψ–Κ―¹–Η―΅–Ϋ–Ψ―¹―²―¨. –û–¥–Ϋ–Α–Κ–Ψ ―²―Ä―É–¥–Ϋ–Ψ –Ω–Ψ–Ϋ―è―²―¨ ―²–Ψ, –Ω–Ψ―΅–Β–Φ―É ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –≤ ―Ä―è–¥–Β ―¹–Μ―É―΅–Α–Β–≤ ―É–≤–Β–Μ–Η―΅–Η–≤–Α–Β―² –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ ―¹–Μ―É―΅–Α–Β–≤ ―Ä–Α–Ζ–≤–Η―²–Η―è –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α, –Α –ü–™ – –Ϋ–Β―²? –½–Α ―¹―΅–Β―² –Ϋ–Β–±–Ψ–Μ―¨―à–Ψ–≥–Ψ ―Ä–Α–Ζ–Μ–Η―΅–Η―è –≤ –Η―Ö –≤–Μ–Η―è–Ϋ–Η–Η –Ϋ–Α –Ψ–±–Φ–Β–Ϋ –Μ–Η–Ω–Η–¥–Ψ–≤? –ö–Α–Κ–―²–Ψ –Ϋ–Β –Ψ―΅–Β–Ϋ―¨ ―É–±–Β–¥–Η―²–Β–Μ―¨–Ϋ–Ψ...
–€–Ψ–Ε–Ϋ–Ψ –Μ–Η ―¹–Β–Ι―΅–Α―¹ –Ϋ–Α–Ι―²–Η –Ψ―²–≤–Β―² –Ϋ–Α ―ç―²–Ψ―² –≤–Ψ–Ω―Ä–Ψ―¹? –£–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Α –Μ–Η –≤ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –≤―Ä–Β–Φ―è ―³–Ψ―Ä–Φ―É–Μ–Η―Ä–Ψ–≤–Κ–Α –≥–Η–Ω–Ψ―²–Β–Ζ―΄, ―Ö–Ψ―²―è –±―΄ ―΅–Α―¹―²–Η―΅–Ϋ–Ψ–≥–Ψ –Ψ–±―ä―è―¹–Ϋ―è―é―â–Β–Ι –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ―¹―²–Η –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –¥–Β–Ι―¹―²–≤–Η―è –Ψ―²–¥–Β–Μ―¨–Ϋ―΄―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ ―ç―²–Ψ–≥–Ψ –Κ–Μ–Α―¹―¹–Α?
–î–Α, –Β―¹–Μ–Η –Ω―Ä–Η–Ϋ―è―²―¨ –≤–Ψ –≤–Ϋ–Η–Φ–Α–Ϋ–Η–Β, ―΅―²–Ψ ―É –Δ–½–î –Φ–Ψ–≥―É―² –±―΄―²―¨ –Η –¥―Ä―É–≥–Η–Β –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ―΄ –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η―è –Ϋ–Α –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ, –Κ―Ä–Ψ–Φ–Β –Η―Ö ―¹–≤–Ψ–Ι―¹―²–≤ –Η–Ϋ―¹―É–Μ–Η–Ϋ–Ψ–―¹–Β–Ϋ―¹–Η―²–Α–Ι–Ζ–Β―Ä–Ψ–≤, –Η–Ζ–Φ–Β–Ϋ―è―é―â–Η―Ö –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Η –Η–Ϋ―¹―É–Μ–Η–Ϋ–Ψ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η, ―É–≥–Μ–Β–≤–Ψ–¥–Ϋ–Ψ––Μ–Η–Ω–Η–¥–Ϋ–Ψ–≥–Ψ –Ψ–±–Φ–Β–Ϋ–Ψ–≤, –Α―Ä―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Ψ–Ι –≥–Η–Ω–Β―Ä―²–Ψ–Ϋ–Η–Η, –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι –≤–Ψ―¹–Ω–Α–Μ–Β–Ϋ–Η―è –Η ―¹–≤–Β―Ä―²―΄–≤–Α–Β–Φ–Ψ―¹―²–Η –Κ―Ä–Ψ–≤–Η.
–ü–Α―Ä–Α–Μ–Μ–Β–Μ―¨–Ϋ―΄–Ι –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η―è – ―ç―²–Ψ ―É―¹–Η–Μ–Β–Ϋ–Η–Β –Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―Ü–Η–Η –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ, –≤–Ψ–Ζ–Ϋ–Η–Κ–Α―é―â–Β–Β –Ω―Ä–Η –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Η –Ϋ–Α ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä―΄, –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Η―Ä―É―é―â–Η―Ö ―ç―²–Ψ―² –Ω―Ä–Ψ―Ü–Β―¹―¹. –ö –Ϋ–Η–Φ, –Κ–Α–Κ –Φ―΄ –Ζ–Ϋ–Α–Β–Φ, –Ψ―²–Ϋ–Ψ―¹―è―²―¹―è PPAR γ–―Ä–Β―Ü–Β–Ω―²–Ψ―Ä―΄ – ―¹―É–±―¹―²―Ä–Α―² –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η―è –Δ–½–î.
–ù–Α–¥–Ψ –Ω―Ä–Η–Ζ–Ϋ–Α―²―¨―¹―è, ―΅―²–Ψ –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Ψ –Κ–Μ–Η–Ϋ–Η―Ü–Η―¹―²–Ψ–≤, –Ω–Ψ––≤–Η–¥–Η–Φ–Ψ–Φ―É, –Ϋ–Β –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –Ψ―²―΅–Β―²–Μ–Η–≤–Ψ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è–Β―² ―¹–Β–±–Β, –Κ –Κ–Α–Κ–Ψ–≥–Ψ ―Ä–Ψ–¥–Α –Ψ–±―ä–Β–Κ―²–Α–Φ –Ψ―²–Ϋ–Ψ―¹―è―²―¹―è –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ―΄.
–ü–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ―΄ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è―é―² ―¹–Ψ–±–Ψ–Ι –≤–Ϋ―É―²―Ä–Η–Κ–Μ–Β―²–Ψ―΅–Ϋ―΄–Β –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η―è (–Ψ―² 0,1 –¥–Ψ 1,5 –Φ–Η–Κ―Ä–Ψ–Φ–Η–Κ―Ä–Ψ–Ϋ –≤ –¥–Η–Α–Φ–Β―²―Ä–Β), ―¹–Ψ―¹―²–Ψ―è―â–Η–Β –Η–Ζ –Φ–Α―²―Ä–Η–Κ―¹–Α, ―¹–Ψ–¥–Β―Ä–Ε–Α―â–Β–≥–Ψ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄–Β ―³–Β―Ä–Φ–Β–Ϋ―²―΄, –Κ–Ψ―²–Ψ―Ä―΄–Ι –Ψ–Κ―Ä―É–Ε–Β–Ϋ –Ψ–¥–Ϋ–Ψ―¹–Μ–Ψ–Ι–Ϋ–Ψ–Ι –Φ–Β–Φ–±―Ä–Α–Ϋ–Ψ–Ι. –ü–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ―΄ –Ψ–Κ–Α–Ζ–Α–Μ–Η―¹―¨ ―¹–Α–Φ―΄–Φ–Η –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η–Φ–Η –Κ–Μ–Β―²–Ψ―΅–Ϋ―΄–Φ–Η –Ψ―Ä–≥–Α–Ϋ–Β–Μ–Μ–Α–Φ–Η, –Ψ―²–Κ―Ä―΄―²―΄–Φ–Η –≤ 1954 –≥. J. Rhodin. –ë–Η–Ψ―Ö–Η–Φ–Η―΅–Β―¹–Κ–Ψ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η―è –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Ψ –Ϋ–Α–Μ–Η―΅–Η–Β –≤ –Ϋ–Η―Ö –Ψ–Κ―¹–Η–¥–Α–Ζ, –Ω―Ä–Ψ–¥―É―Ü–Η―Ä―É―é―â–Η―Ö –Ω–Β―Ä–Β–Κ–Η―¹―¨ –≤–Ψ–¥–Ψ―Ä–Ψ–¥–Α –Η –Κ–Α―²–Α–Μ–Α–Ζ―΄, ―΅―²–Ψ –Η ―è–≤–Η–Μ–Ψ―¹―¨ –Ω–Ψ–≤–Ψ–¥–Ψ–Φ –¥–Μ―è –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η―è ―²–Β―Ä–Φ–Η–Ϋ–Α «–Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ―΄». –û–Κ―¹–Η–¥–Α–Ζ―΄ –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ ―¹–Μ―É–Ε–Α―² –Ψ–¥–Ϋ–Η–Φ –Η–Ζ –≤–Α–Ε–Ϋ―΄―Ö –Η―¹―²–Ψ―΅–Ϋ–Η–Κ–Ψ–≤ –Α–Κ―²–Η–≤–Ϋ―΄―Ö –Κ–Η―¹–Μ–Ψ―Ä–Ψ–¥–Ϋ―΄―Ö ―Ä–Α–¥–Η–Κ–Α–Μ–Ψ–≤ – ―¹―É–Ω–Β―Ä–Ψ–Κ―¹–Η–¥–Ϋ–Ψ–≥–Ψ –Α–Ϋ–Η–Ψ–Ϋ–Α, ―¹–Η–Ϋ–≥–Μ–Β―²–Ϋ–Ψ–≥–Ψ –Κ–Η―¹–Μ–Ψ―Ä–Ψ–¥–Α, –≥–Η–¥―Ä–Ψ–Κ―¹–Η–Μ―¨–Ϋ–Ψ–≥–Ψ ―Ä–Α–¥–Η–Κ–Α–Μ–Α –Η –Ω–Β―Ä–Β–Κ–Η―¹–Η –≤–Ψ–¥–Ψ―Ä–Ψ–¥–Α. –ü–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ―΄ –Ω―Ä–Η―¹―É―²―¹―²–≤―É―é―² –Ω―Ä–Α–Κ―²–Η―΅–Β―¹–Κ–Η –≤–Ψ –≤―¹–Β―Ö –Κ–Μ–Β―²–Κ–Α―Ö ―ç―É–Κ–Α―Ä–Η–Ψ―². –Π–Η―²–Ψ–Μ–Ψ–≥–Η –¥–Ψ ―¹–Η―Ö –Ω–Ψ―Ä –¥–Η―¹–Κ―É―²–Η―Ä―É―é―², ―è–≤–Μ―è―é―²―¹―è –Μ–Η –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ―΄ ―Ä–Α–Ζ–Ϋ–Ψ–≤–Η–¥–Ϋ–Ψ―¹―²―¨―é –Μ–Η–Ζ–Ψ―¹–Ψ–Φ –Η–Μ–Η –Ε–Β ―¹–Α–Φ–Ψ―¹―²–Ψ―è―²–Β–Μ―¨–Ϋ―΄–Φ–Η –¥―Ä–Β–≤–Ϋ–Η–Φ–Η –¥–Ψ–Φ–Η―²–Ψ―Ö–Ψ–Ϋ–¥―Ä–Η–Α–Μ―¨–Ϋ―΄–Φ–Η –Ψ–Κ–Η―¹–Μ–Η―²–Β–Μ―¨–Ϋ―΄–Φ–Η –Ψ―Ä–≥–Α–Ϋ–Β–Μ–Μ–Α–Φ–Η.
–Θ―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ψ, ―΅―²–Ψ –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ–Ϋ―΄–Β –±–Β–Μ–Κ–Η ―¹–Ω–Ψ―¹–Ψ–±–Ϋ―΄ –Κ–Α―²–Α–Μ–Η–Ζ–Η―Ä–Ψ–≤–Α―²―¨ –Ψ–Κ–Ψ–Μ–Ψ 50 ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö –±–Η–Ψ―Ö–Η–Φ–Η―΅–Β―¹–Κ–Η―Ö ―Ä–Β–Α–Κ―Ü–Η–Ι, –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β –¥–Β–Ζ–Η–Ϋ―²–Ψ–Κ―¹–Η–Κ–Α―Ü–Η―é –Ψ–±―Ä–Α–Ζ―É―é―â–Η―Ö―¹―è ―¹–≤–Ψ–±–Ψ–¥–Ϋ―΄―Ö ―Ä–Α–¥–Η–Κ–Α–Μ–Ψ–≤, –Α ―²–Α–Κ–Ε–Β –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β –Η―Ö –Ω―Ä–Ψ–¥―É–Κ―Ü–Η–Η ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Ψ–Κ―¹–Η–¥–Α–Ζ.
–‰–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ, –Κ–Α―¹–Α―é―â–Η–Β―¹―è –Η―Ö ―΅–Η―¹–Μ–Α –Η ―¹―²―Ä―É–Κ―²―É―Ä–Ϋ―΄―Ö –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Ψ–≤, –≤―¹―²―Ä–Β―΅–Α―é―²―¹―è –Ω―Ä–Η –Φ–Ϋ–Ψ–≥–Η―Ö –±–Ψ–Μ–Β–Ζ–Ϋ―è―Ö ―΅–Β–Μ–Ψ–≤–Β–Κ–Α. –Θ ―΅–Β–Μ–Ψ–≤–Β–Κ–Α –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β ―΅–Η―¹–Μ–Α –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ –Ψ―²–Φ–Β―΅–Β–Ϋ–Ψ –≤ –≥–Β–Ω–Α―²–Ψ―Ü–Η―²–Α―Ö –Ω―Ä–Η –≤–Η―Ä―É―¹–Ϋ–Ψ–Φ –≥–Β–Ω–Α―²–Η―²–Β, –Μ–Β–Ω―²–Ψ―¹–Ω–Η―Ä–Ψ–Ζ–Β. –Θ–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β ―΅–Η―¹–Μ–Α –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ –Η –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β –Κ–Α―²–Α–Μ–Α–Ζ–Ϋ–Ψ–Ι –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –≤ –≥–Β–Ω–Α―²–Ψ―Ü–Η―²–Α―Ö –Φ–Ψ–Ε–Ϋ–Ψ –≤―΄–Ζ–≤–Α―²―¨ –Η―¹–Κ―É―¹―¹―²–≤–Β–Ϋ–Ϋ–Ψ –≤ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Β ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é ―Ä―è–¥–Α –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤, –Α –≤ –Κ–Α―Ä–¥–Η–Ψ–Φ–Η–Ψ―Ü–Η―²–Α―Ö – ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ–≥–Ψ –Ω―Ä–Η–Β–Φ–Α ―ç―²–Α–Ϋ–Ψ–Μ–Α [43].
–Γ―²–Ψ–Η―² –Ϋ–Α–Ω–Ψ–Φ–Ϋ–Η―²―¨, ―΅―²–Ψ –Δ–½–î –≤–Ϋ–Α―΅–Α–Μ–Β ―Ä–Α–Ζ―Ä–Α–±–Α―²―΄–≤–Α–Μ–Η―¹―¨ –Κ–Α–Κ –Α–Ϋ―²–Η–Ψ–Κ―¹–Η–¥–Α–Ϋ―²―΄, –Ω–Ψ―ç―²–Ψ–Φ―É –Η―Ö ―¹–Ω–Ψ―¹–Ψ–±–Ϋ–Ψ―¹―²―¨ –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Ψ–≤–Α―²―¨ –Ϋ–Α ―³―É–Ϋ–Κ―Ü–Η―é –Η –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è–Β―²―¹―è –≤–Ω–Ψ–Μ–Ϋ–Β –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Ι.
–û―Ä–≥–Α–Ϋ―΄––Φ–Η―à–Β–Ϋ–Η, –Ω–Ψ―Ä–Α–Ε–Β–Ϋ–Η–Β –Κ–Ψ―²–Ψ―Ä―΄―Ö –Ψ―²–Φ–Β―΅–Β–Ϋ–Ψ –Ω―Ä–Η –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Η –Δ–½–î – ―ç―²–Ψ –Ω–Β―΅–Β–Ϋ―¨ –Η ―¹–Β―Ä–¥―Ü–Β. –£ –Ψ–±–Ψ–Η―Ö –Η–Ζ –Ϋ–Η―Ö –Ψ–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ―΄ PPAR γ–―Ä–Β―Ü–Β–Ω―²–Ψ―Ä―΄. –£ –Ω–Β―΅–Β–Ϋ–Η ―²–Α–Κ–Η―Ö ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤ –Φ–Ϋ–Ψ–≥–Ψ, –≤ ―¹–Β―Ä–¥―Ü–Β – –Ϋ–Β–±–Ψ–Μ―¨―à–Ψ–Β –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ.
–ü―Ä–Η–Β–Φ ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ψ–Κ–Α–Ζ―΄–≤–Α–Β―² –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ ―¹–Η–Μ―¨–Ϋ–Ψ–Β –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Β –Ϋ–Α –Ω–Β―΅–Β–Ϋ―¨. –£–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ, ―ç―²–Ψ ―¹–≤―è–Ζ–Α–Ϋ–Ψ ―¹ ―²–Β–Φ, ―΅―²–Ψ –Ω–Ψ–¥ –≤–Μ–Η―è–Ϋ–Η–Β–Φ ―²―Ä–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –≤ –Ϋ–Β–Ι –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ ―¹―²–Η–Φ―É–Μ―è―Ü–Η―è –Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―Ü–Η–Η –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ, –Ϋ–Ψ –Η ―É―¹–Η–Μ–Η–≤–Α–Β―²―¹―è –Ψ–±–Φ–Β–Ϋ α–―²–Ψ–Κ–Ψ―³–Β―Ä–Ψ–Μ–Α, –Ψ–Κ–Α–Ζ―΄–≤–Α―é―â–Β–≥–Ψ –¥–Ψ–±–Α–≤–Ψ―΅–Ϋ–Ψ–Β –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Β –Ϋ–Α –Ψ–±–Φ–Β–Ϋ ―¹–≤–Ψ–±–Ψ–¥–Ϋ―΄―Ö ―Ä–Α–¥–Η–Κ–Α–Μ–Ψ–≤. –ù–Β –Ψ―²―¹―é–¥–Α –Μ–Η –±―΄―¹―²―Ä–Ψ–Β ―Ä–Α–Ζ–≤–Η―²–Η–Β –Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η ―É –Μ–Η―Ü ―¹ –Η―¹―Ö–Ψ–¥–Ϋ–Ψ–Ι ―¹–Μ–Α–±–Ψ―¹―²―¨―é –¥–Β–Ζ–Η–Ϋ―²–Ψ–Κ―¹–Η–Κ–Α―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö –Α–Ϋ―²–Η–Ψ–Κ–Η―¹–Μ–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Ψ–≤?
–ü―Ä–Η –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Η ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α –Ϋ–Α–Η–±–Ψ–Μ–Β–Β ―¹–Μ–Α–±―΄–Φ –Φ–Β―¹―²–Ψ–Φ, –Κ–Α–Κ –Ω–Ψ–Κ–Α–Ζ―΄–≤–Α–Β―² –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Ι –Ψ–Ω―΄―², ―¹―²–Α–Ϋ–Ψ–≤–Η―²―¹―è –Φ–Η–Ψ–Κ–Α―Ä–¥. –ü―Ä–Η ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Η –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ –≤ –Φ–Η–Ψ–Κ–Α―Ä–¥–Β –≤ –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Ϋ―΄―Ö ―É―¹–Μ–Ψ–≤–Η―è―Ö –Φ–Ψ–Ε–Β―² –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ―É―²―¨ –Φ–Β―²–Α–±–Ψ–Μ–Η―΅–Β―¹–Κ–Α―è ―¹–Η―²―É–Α―Ü–Η―è, –≤―΄–Ζ―΄–≤–Α–Β–Φ–Α―è –≤ –¥―Ä―É–≥–Η―Ö ―¹–Μ―É―΅–Α―è―Ö –Η–Ζ–±―΄―²–Ψ―΅–Ϋ―΄–Φ –Ω–Ψ―²―Ä–Β–±–Μ–Β–Ϋ–Η–Β–Φ –Α–Μ–Κ–Ψ–≥–Ψ–Μ―è. –£ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –≤―Ä–Β–Φ―è –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Β–Ϋ–Ψ, ―΅―²–Ψ –Δ–½–î –Η, –≤ ―΅–Α―¹―²–Ϋ–Ψ―¹―²–Η, ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ –Α–Κ―²–Η–≤–Ϋ–Ψ –≤–Φ–Β―à–Η–≤–Α―é―²―¹―è –≤ –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β ―ç―³―³–Β–Κ―²―΄ –Α–Μ–Κ–Ψ–≥–Ψ–Μ―è –≤ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Β ―΅–Β–Μ–Ψ–≤–Β–Κ–Α [44]. –ï―¹–Μ–Η –Ω–Ψ–¥–Ψ–±–Ϋ–Ψ–Β –≤–Ζ–Α–Η–Φ–Ψ–¥–Β–Ι―¹―²–≤–Η–Β –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² –≤ –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Β –±–Ψ–Μ―¨–Ϋ–Ψ–≥–Ψ –Γ–î 2 ―²–Η–Ω–Α, –Ϋ–Β―²―Ä―É–¥–Ϋ–Ψ –Ω―Ä–Β–¥–Ω–Ψ–Μ–Ψ–Ε–Η―²―¨ –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ―¹―²―¨ ―Ä–Α–Ζ–≤–Η―²–Η―è –Φ–Β―²–Α–±–Ψ–Μ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ ―ç―³―³–Β–Κ―²–Α –Ψ―¹―²―Ä–Ψ–≥–Ψ –Α–Μ–Κ–Ψ–≥–Ψ–Μ―¨–Ϋ–Ψ–≥–Ψ –Ψ―²―Ä–Α–≤–Μ–Β–Ϋ–Η―è –Ϋ–Α ―²–Κ–Α–Ϋ–Β–≤–Ψ–Φ ―É―Ä–Ψ–≤–Ϋ–Β, –≤ –Φ–Η–Ψ–Κ–Α―Ä–¥–Β. –ê–Μ–Κ–Ψ–≥–Ψ–Μ―¨ –Η –Φ–Η–Ψ–Κ–Α―Ä–¥ – ―ç―²–Ψ –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –Α–Μ–Κ–Ψ–≥–Ψ–Μ―¨–Ϋ–Α―è –Φ–Η–Ψ–Ω–Α―²–Η―è, ―ç―²–Ψ –Η ―Ä–Α–Ζ–≤–Η―²–Η–Β –Ψ―¹―²―Ä–Ψ–≥–Ψ –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α. –™–Μ–Α–≤–Ϋ―΄–Β –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ―΄ ―Ä–Α–Ζ–≤–Η―²–Η―è –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α –Ω―Ä–Η –Ψ―²―Ä–Α–≤–Μ–Β–Ϋ–Η–Η ―ç―²–Α–Ϋ–Ψ–Μ–Ψ–Φ – –Ϋ–Β –Α―²–Β―Ä–Ψ―¹–Κ–Μ–Β―Ä–Ψ―²–Η―΅–Β―¹–Κ–Η–Β: ―ç–Ϋ–¥–Ψ―²–Β–Μ–Η–Α–Μ―¨–Ϋ–Α―è –¥–Η―¹―³―É–Ϋ–Κ―Ü–Η–Η, ―¹–Ω–Α–Ζ–Φ –Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ―΄―Ö ―¹–Ψ―¹―É–¥–Ψ–≤ [45,46]. –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β ―Ä–Η―¹–Κ–Α ―Ä–Α–Ζ–≤–Η―²–Η―è –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α –Ω―Ä–Η –Ω―Ä–Η–Β–Φ–Β ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ–Α ―²–Β–Ψ―Ä–Β―²–Η―΅–Β―¹–Κ–Η –≤–Ω–Ψ–Μ–Ϋ–Β –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ―΄–Ι ―³–Β–Ϋ–Ψ–Φ–Β–Ϋ, –Κ–Ψ―²–Ψ―Ä―΄–Ι –Ψ–±―ä–Β–Κ―²–Η–≤–Ϋ–Ψ –Φ–Ψ–Ε–Β―² –±―΄―²―¨ ―¹–≤―è–Ζ–Α–Ϋ ―¹ ―ç―²–Α–Ϋ–Ψ–Μ––Ζ–Α–≤–Η―¹–Η–Φ―΄–Φ –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Ψ–Φ, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ ―É –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Κ–Ψ–Ϋ―²–Η–Ϋ–≥–Β–Ϋ―²–Α –±–Ψ–Μ―¨–Ϋ―΄―Ö.
–ü–Η–Ψ–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ – –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –Φ–Β–Ϋ–Β–Β –Ε–Β―¹―²–Κ–Η–Ι –Α–Κ―²–Η–≤–Α―²–Ψ―Ä PPAR γ–―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤, ―΅–Β–Φ ―Ä–Ψ–Ζ–Η–≥–Μ–Η―²–Α–Ζ–Ψ–Ϋ [47], –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ, –Η–Φ–Β–Ϋ–Ϋ–Ψ –Ω–Ψ―ç―²–Ψ–Φ―É –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ––Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―²–Η–≤–Ϋ―΄–Ι ―ç―³―³–Β–Κ―² ―É –Ϋ–Β–≥–Ψ –Φ–Ψ–Ε–Β―² –±―΄―²―¨ –Φ–Β–Ϋ–Β–Β –≤―΄―Ä–Α–Ε–Β–Ϋ. –ö–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η – ―ç―²–Ψ –Ψ―²―¹―É―²―¹―²–≤–Η–Β –Ω–Ψ―Ä–Α–Ε–Β–Ϋ–Η–Ι –Ψ―Ä–≥–Α–Ϋ–Ψ–≤––Φ–Η―à–Β–Ϋ–Η–Ι –Η –Ω―Ä–Β–Ψ–±–Μ–Α–¥–Α–Ϋ–Η–Β ―ç―³―³–Β–Κ―²–Ψ–≤, ―¹–≤―è–Ζ–Α–Ϋ–Ϋ―΄―Ö ―¹–Ψ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β–Φ –Η–Ϋ―¹―É–Μ–Η–Ϋ–Ψ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η. –ü–Ψ–¥–Ψ–±–Ϋ–Α―è –Κ–Ψ–Φ–±–Η–Ϋ–Α―Ü–Η―è ―¹–≤–Ψ–Ι―¹―²–≤, –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ, –Ψ–±―ä―è―¹–Ϋ―è–Β―² –Ψ―²–Φ–Β―΅–Β–Ϋ–Ϋ–Ψ–Β ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Ψ–±―â–Β–Ι ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²–Η ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α, –Κ–Ψ―²–Ψ―Ä–Ψ–Β –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ –±–Ψ–Μ–Β–Β –≤―΄―Ä–Α–Ε–Β–Ϋ–Ψ –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –¥―Ä―É–≥–Η–Φ–Η ―¹–Α―Ö–Α―Ä–Ψ―¹–Ϋ–Η–Ε–Α―é―â–Η–Φ–Η ―¹―Ä–Β–¥―¹―²–≤–Α–Φ–Η.
–Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ –Φ–Ψ–Ε–Ϋ–Ψ –Ω―Ä–Β–¥–Ω–Ψ–Μ–Ψ–Ε–Η―²―¨, ―΅―²–Ψ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Α―è –Κ–Α―Ä―²–Η–Ϋ–Α, ―Ä–Α–Ζ–≤–Η–≤–Α―é―â–Α―è―¹―è ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Γ–î 2 ―²–Η–Ω–Α –Ω―Ä–Η –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Η –Δ–½–î, ―³–Ψ―Ä–Φ–Η―Ä―É–Β―²―¹―è –Ω–Ψ–¥ –≤–Μ–Η―è–Ϋ–Η–Β–Φ –Ϋ–Α –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ –¥–≤―É―Ö –Ψ―¹–Ϋ–Ψ–≤–Ϋ―΄―Ö –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Ψ–≤: 1) ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η–Β –Η–Ϋ―¹―É–Μ–Η–Ϋ―Ä–Β–Ζ–Η―¹―²–Β–Ϋ―²–Ϋ–Ψ―¹―²–Η –Η ―¹–≤―è–Ζ–Α–Ϋ–Ϋ–Ψ–≥–Ψ ―¹ –Ϋ–Β–Ι ―Ä–Η―¹–Κ–Α –Ω―Ä–Ψ–≥―Ä–Β―¹―¹–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –Γ–î –Η ―¹–Ψ―¹―É–¥–Η―¹―²―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι –Η 2) ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Ψ–±–Φ–Β–Ϋ–Α ―¹–≤–Ψ–±–Ψ–¥–Ϋ―΄―Ö ―Ä–Α–¥–Η–Κ–Α–Μ–Ψ–≤ –Ω–Ψ–¥ –≤–Μ–Η―è–Ϋ–Η–Β–Φ ―É–≤–Β–Μ–Η―΅–Η–≤–Α―é―â–Β–≥–Ψ―¹―è –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Α ―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Η―Ö –≤–Ϋ―É―²―Ä–Η–Κ–Μ–Β―²–Ψ―΅–Ϋ―΄―Ö –Ψ―Ä–≥–Α–Ϋ–Β–Μ–Μ. –Γ ―ç―²–Ψ–Ι ―²–Ψ―΅–Κ–Η –Ζ―Ä–Β–Ϋ–Η―è ―¹―²–Α–Ϋ–Ψ–≤―è―²―¹―è –Ω–Ψ–Ϋ―è―²–Ϋ―΄–Φ–Η –Ψ–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ–Ϋ―΄–Β ―Ä–Α–Ζ–Μ–Η―΅–Η―è –≤ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Η―¹―Ö–Ψ–¥–Α―Ö –Ω―Ä–Η –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Η ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö –Δ–½–î, –Ω–Ψ―è–≤–Μ―è–Β―²―¹―è –Ω–Ψ―²―Ä–Β–±–Ϋ–Ψ―¹―²―¨ –Ω–Ψ–Η―¹–Κ–Α –Ϋ–Ψ–≤―΄―Ö –Φ–Β–Ϋ–Β–Β –Ω–Β―Ä–Ψ–Κ―¹–Η―¹–Ψ–Φ––Α–Κ―²–Η–≤–Ϋ―΄―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ –Η –Ψ―¹–Ψ–Ζ–Ϋ–Α–Β―²―¹―è –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²―¨ –≤ –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Β –Ζ–Α –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―è–Φ–Η –Ψ–±–Φ–Β–Ϋ–Α ―¹–≤–Ψ–±–Ψ–¥–Ϋ―΄―Ö ―Ä–Α–¥–Η–Κ–Α–Μ–Ψ–≤ –Ω―Ä–Η –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Η –¥–Α–Ϋ–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤ ―¹ ―Ü–Β–Μ―¨―é –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è ―¹–≤―è–Ζ–Α–Ϋ–Ϋ―΄―Ö ―¹ –Ω–Ψ–¥–Ψ–±–Ϋ―΄–Φ –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Ψ–Φ –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι.
–ö–Ψ–Ϋ–Β―΅–Ϋ–Ψ, ―ç―²–Ψ ―²–Ψ–Μ―¨–Κ–Ψ –≥–Η–Ω–Ψ―²–Β–Ζ–Α. –ù–Ψ –Β–Β –Φ–Ψ–Ε–Ϋ–Ψ –Ω―Ä–Ψ–≤–Β―Ä–Η―²―¨, –¥–Ψ–Κ–Α–Ζ–Α―²―¨ –Η–Μ–Η –Ψ―²–≤–Β―Ä–≥–Ϋ―É―²―¨. –‰–≥―Ä–Α ―è–≤–Ϋ–Ψ ―¹―²–Ψ–Η―² ―¹–≤–Β―΅. –ß―²–Ψ–±―΄ –Ω–Ψ–Ι–Φ–Α―²―¨ ―΅–Β―Ä–Ϋ―É―é –Κ–Ψ―à–Κ―É –≤ ―²–Β–Φ–Ϋ–Ψ–Ι –Κ–Ψ–Φ–Ϋ–Α―²–Β, –Ϋ―É–Ε–Ϋ–Α –≤―¹–Ω―΄―à–Κ–Α ―¹–≤–Β―²–Α. –ù–Β –≤ –Κ–Ψ–Φ–Ϋ–Α―²–Β – –≤ –≥–Ψ–Μ–Ψ–≤–Β. –£ ―΅–Β–Μ–Ψ–≤–Β―΅–Β―¹–Κ–Ψ–Ι –Κ―É–Μ―¨―²―É―Ä–Β –Ω―Ä–Η–Φ–Β―Ä–Ψ–≤ ―²–Ψ–Φ―É –Ϋ–Β ―¹―΅–Β―¹―²―¨.



–¦–Η―²–Β―Ä–Α―²―É―Ä–Α
1. Ikeda –ù. Discovery of The Thiazolidinediones Class and its Distinct Futures. Insulin Resistence, Dyslipidemia, and Type 2 Diabetes. Opportunities Offered by the Thiazolidinediones. 36th Annual Meeting of the European Association for The Study of Diabetes. Report, 2000;3.
2. Willson T.M., P.J.Brown, D.D. Sternbach, B.R. Henke. The PPARs: From Orphan Receptors to Drug Discovery. J.Med. Chem. 2000, 43; 4: 527–550.
3. Lehmann J.M., Moore L.B., Smith– Oliver T. A ; Wilkison W.o; Willson T/M; Kliewer S.A. An antidiabetic thiazolidinedione is a high affinity ligand for peroxisome proliferator–acntivated receptor γ (PPARγ). J. Biol. Chem. 1995; 270: 12953– – 12956.
4. Kawasaki J.; Hirano K.; Nishimura J.; Fujishima M.; Kanaide H. Mechanisms of vasorelaxation induced by troglitazone, a novel antidiabetic drug, in the porcine coronary artery. Circulation, 1998; 98: 2446–2452.
5. Nakajama T.; Iwasawa K.; Oonuma H.; Imuta H.; Hazama H.; Asano M.; Morita T.; Nakamura F.; Suzuki J.; Suzuki S.; Kawakami Y.; Omata M.; Okuda Y. Troglitazone inhibits voltagt–dependent calcium currents in guinea pig cardiac
myocytes. Circulation. 1999; 99: 2942– 2950.
6. Mirakami T.; Mizuno S.; Ohsato K.; Moriuchi I.; Arai Y.; Nio Y.; Kaku B.; Takahashi Y.; Ohnaka M. Effects of Troglitazone on frequency of coronary vasospastic–induced angina pectoris in patient with diabetes mellitus. Am. J. Cariol. 1999; 84: 92–95.
7. Takagi T.; Akasaka T.; Yamamuro A.; Honda Y.; Hozumi T.; Morioka S.; Yoshida K. Troglitazone reduces neointimal Tissue proliferation after coronary stent impantation in patients with non–insulin dependent diabetes mellitus. J. Am Coll Cardiol 2000; 36: 1529–1535.
8. Sinon S.; Loke Y.K.; Furrberg C.D. Thiazolidintdiones and heart Failure. Diabetes Care. 2007; 30: 2148–2153.
9. Tollman K.G. Thiazolidinedione hepatotoxity: a class effect? Int J Clin Practice. 2000; Suppl 113: 29 –34
10 Sutton M, Rendell M, Dandona P, Dole J F, Murphy K, Patwardhan R, Patel J, Freed M. A Comparison of the Effects of Rosiglitazone and Glyburide on Cardiovascular Function and Glycemic Control in Patients With Type 2 Diabetes. Diabetes Care 2002; 25:2058–2064
11. Boyle P.; King A.B.; Olansky L.; Marchetti A.; Lau H.; Magar R.; Martin J. Effects of pioglitazone and Rosiglitazone on blood lipid levels and glycemic cjntrol in patient with type 2 diabetes mellitus: aretrospective review of randomly selected medical records. Clin.Ther. 2002:24(3): 378– 396.
12. Haffner SM, Greenberg AS, Weston WM, Chen H, Williams K, Freed MI. Effect of Rosiglitazone Treatment on Nontraditional Markers of Cardiovascular Disease in Patients With Type 2 Diabetes Mellitus Circulation 2002; 106:679–684.
13. Albertini JP, et al. Markers of Endothelial Dysfunction and Insulin Resistance. Beneficial Effects of Rosiglitazone in Type 2 Diabetes (abstract 494 P). Diabetes 2004; 53 (Suppl. 2):A117
14. Sidhu JS, Kaposzta Z, Markus HS, Kaski JC. Effect of Rosiglitazone on Common Carotid Intima–Media Thickness Progression in Coronary Artery Disease Patients Without Diabetes Mellitus. Arterioscler Thromb Vasc Biol 2004; 24:930–934
15. Haffner SM, Greenberg AS, Weston WM, Chen H, Williams K, Freed MI. Effect of Rosiglitazone Treatment on Nontraditional Markers of Cardiovascular Disease in Patients With Type 2 Diabetes Mellitus Circulation 2002; 106:679–684.
16. Freed M et al. Effect of combination therapy with rosiglitazone and Glibenclamide on PAI–1 antigen, PAI–1 activity, and tPA in patients with type 2 diabetes. Diabetologia 2000;43 (supplement1): A267, Abs 1024 + poster.
17. Choi D, Kim S–K, Choi S–H, Ko Y–G, Ahn C–W, Jang Y, Lim S–K, Lee H–C, Cha B–S. Preventative Effects of Rosiglitazone on Restenosis After Coronary Stent Implantation in Patients With Type 2 Diabetes. Diabetes Care 2004; 27:2654–2660
18. Srikanthan P, et al. Impact of Rosiglitazone on Vascular Events, Atherosclerosis and Allograft Rejection in Cardiac Transplant Patients with Diabetes (abstract 615 P). Diabetes 2004; 53 (Suppl. 2):A146.
19. Carey DG, Cowin GJ, Galloway GJ et al. Effect of rosiglitazone on insulin sensitivity and body composition in type 2 diabetic patients. Obes Res 2002; 10:1008–1015.
20. Nesto R.W.; Bell D.; Bonow R.O.et al. Thiazolidinedione use, fluid retention, and congestive heart failure; a consensus statement from the American Heart Association and American Diabetes Association. Circulation.2003; 108 (23): 2941–2948.
21. Singh S.;Lake Y.K.; Fuberg C.D. Long–term risk of Cardiovascular events with rosiglitazone: a meta–analysis. JAMA 2007;298:1189–1195.
22. Kaul S.; Bolger A.F.; Herrington D.; Giugliano R.P.; Eckel R.H. Thiazolidinedione drugs and cardiovascular risk: a science advisory from the American Heart Association and American College of Cardiology foundation. J Am Coll Cardiol. 2010; 55: 1885–1894.
23. Gerrits C.M.; Bhattacharya M.; Manthena S.; Baran R.; Peres A.; Kupfer S.A. A comparison of pioglitazone and rosiglitazone for hospitalization for acute myocardial infarction in type 2 diabetes. Farmacoepidemiol Drug Saf. 2007;16(10): 1065–1071.
24. Walker A.M.; Koro C.E.; Landon J. Coronary heart disease outcomes in patients receiving antidiabetic agents in the PharMetrics database 2000 – 2007. Pharmacoepidemiol Drug Saf. 2008; 17(8) 760–768.
25. Winkelmayer W.C.; Setoguchi S.; Levin R.; Solomon D.H. Comparison of cardiovascular outcomes in elderly patients with diabetes who initiated rosiglitazone vs pioglitazone therapy. Argh Intern Med. 2008; 168(21): 2368–2375.
26. Doormuth C.R.; Maclure M.; Carney C.; Schneeweiss S.; Wright J.M. Rosiglitazone and myocardial infarction in patients previously prescribed metformin. PloS One. 2009; 4(6):e6080.
27. Juurink D.N.; Gomes T.; Lipscombe L.L.; Austin P.C.; Hux J.E.; Mandani M.M. Adverse cardiovascular events during treatment with pioglitazone and rosiglitszone: population based cohord study. BMJ.2009;339:b2942/
28. Ziyadeh N.; McAfee A.T.; Koro C.; Landon J.; Arnold Chan K. The tthiazolidobnediones rosiglitazone and pioglitazone and the risk of coronary heart disease: a retrospective cohort study using a US health insurance database. Clin Ther. 2009; 31(11): 2665–2677.
29. Brownstein J.S.; Murphy S.N.; Goldin A.B.et al. Rapid identification of myocardial infarction risk associated with diabetes medication using electronic medical records. Diabetes Care. 2010; 33(3):526 – 531.
30. Miyazaki Y, Matsuda M, Mahankali A, et al. Mechanism of glucose–lowering effect by rosiglitazone in patients with type 2 diabetes. Diabetes. 2001; 50 (suppl 2) : A 126.
31. Rosenblatt S, Miskin B, Glazer NM, Prince MJ, Roberson KE. 2001. The impact of pioglitazone on glycemic control and atherogenic dyslipidemia in patients with type 2 diabetes mellitus. Coron. Artery Dis. 12: 413–423.
32. Kipnes MS, Krosnick A, Rendell MS, Egan JW, Mathisen AL, Schneider RL. Pioglitazone hydrochloride in combination with sulfonylurea therapy improves glycemic control in patients with type 2 diabetes mellitus: a randomized, placebo–controlled study. Am J Med 2001; 111:10–17.
33. Einhorn D, Rendell M, Rosenzweig J, Egan JW, Mathisen AL, Schneider RL.
Pioglitazone hydrochloride in combination with metformin in the treatment of type 2 diabetes mellitus: a randomized, placebo–controlled study. The Pioglitazone 027 Study Group. Clin Ther 2000;22:1395–1409.
34. Rubin C, Egan J, Schneider R. Combination therapy with pioglitazone and insulin in patients with type 2 diabetes. Diabetes. 1999;48(Suppl 1):A110; Abstract
35. Winkler K, Friedrich I, Nauck M et al. Pioglitazone reduces dens LDL–particles in patients with type 2 diabetes (abstract 592p) Diabetes 2001;50(suppl 2): A147.
36. Prince MJ, Zagar AJ, Robertson KE. Effect of pioglitazone on HDL–C, a cardiovascular risk factor in type 2 diabetes (abstract 514p) Diabetes 2001;50(suppl 2):A128.
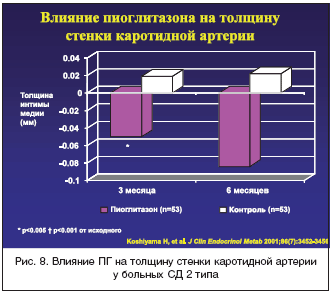
37. Yoshinori Miyazaki, Archana Mahankali, Masafumi Matsuda, Srikanth Mahankali, Jean Hardies, Kenneth Cusi, Lawrence J. Mandarino and Ralph A. DeFronzo Effect of Pioglitazone on Abdominal Fat Distribution and Insulin Sensitivity in Type 2 Diabetic Patients. J. Clin. Endocrinol. Metab. 2002 87: 2784–2791
38. Koshiyama H, Shimono D, Kuwamura N, Minamikawa J, Nakamura Y. Rapid communication: inhibitory effect of pioglitazone on carotid arterial wall thickness in type 2 diabetes. J Clin Endocrinol Metab. 2001;86:3452–3456.
39. Thiemermann C, Wayman NS. Menarini Academy Cardiovascular Research Awards in Basic Science 2001: ligands of the orphan receptor peroxisome–proliferator activator–gamma reduce myocardial infarct size. Med Sci Monit 2001;7:787–789.
40. Dormandy J.A.; Charbonnel B.; Eckland D,J., et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study ( PROspective pioglitAzone Clinical Trial in the macroVascular Events): a randomized controlled Trial. Lancet 2005; 366: 1279–1289.
41. Graham D.; Ouellrt–Hellstrom R.; MaGurdy T.E.; Ali F.; Sholley C.; Worral C,; Kelman J.A. Risk of acute myocardial Infarction, Stroke, heart failure, and Death in elderly Medicare patietnts treated with rosiglitazone or pioglitazone. JAMA. 2010; 304(4): 411–418.
42. Tzoulaki I.; Molokha M.; Curcin V.; Little M.P.; Millett C.; Ng A.; Hughes R.I.; Khunti K.; Wilkins M.; Majeed A.; Elliott P. Risk of cardiovascular disease and all cause mortality among patients with type 2 diabetes prescribed oral antidiabetes drugs: retrospective cohort study using UK general practice research database. BMJ 2009;339:b4731 doi: 10.1136/bmj.b4731.
43. Gartner J. Organelle disease: peroxisomal disorders. Eur J Pediatr. 2000; 159 (Suppl 3): S236–S239.
44. Stopponi S.; Somaini L.; Cannella A.; Braconi S.; Kallupi M.; Ruggeri B.; Heilig M.; Demopulos G.; gaitanaris G.; Massi M.; Circcocioppo R. Activation of nuclear Receptors by the antidiabetic agent pioglitazone suppresses alcohol drinking and relapse to alcohol seeking. Biol Psychiatry. 2011 Apr 1;69(7):642–9
45. Gowda R.M.; Khan I.A.; Vasavada B.C.; Sacchi T.J. Alcohol–triggered acute myocardial infarction. Am J Therp. 2003; 10(1):71–72.
46. Biyik I.; Ergene O. Acute myocardial infarction associated with alcohol intake in an adolescent with normal coronary arteries. Cardiology in the Young.2006; 16: 190–192.
47. Young P.W.; Buckle D.R.; Cantello B.C.; Chapman H.; Clapham J.C.; Coyle P.J., et al. Identification of high–affinity binding sites for the insulin sensitizer rosiglitazone (BRL–49653) in rodent and human adipocytes using a radioiodinated ligand for peroxisomal proliferator–activated receotor gamma. J Pharmacol Exp Ther. 1998;284: 751–759.












