–Т–≤–µ–і–µ–љ–Є–µ
–Ы–µ—З–µ–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –љ–∞—В—А–Є–є-–≥–ї—О–Ї–Њ–Ј–љ–Њ–≥–Њ –Ї–Њ—В—А–∞–љ—Б–њ–Њ—А—В–µ—А–∞ 2 —В–Є–њ–∞ (–Ш–Э–У–Ґ-2) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О —Б–µ—А–і—Ж–∞ –Є —Б–Њ—Б—Г–і–Њ–≤ –Є –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є —Б–≤—П–Ј–∞–љ–Њ —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –њ–Њ –њ–Њ–≤–Њ–і—Г —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є [1, 2]. –•–Њ—В—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Ш–Э–У–Ґ-2 –љ–∞ —Б–µ—А–і—Ж–µ –Є —Б–Њ—Б—Г–і—Л –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ–Љ —Д–∞–Ї—В–Њ—А–Њ–≤, –≥–Є–њ–µ—А–Ї–µ—В–Њ–љ–µ–Љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –≤–∞–ґ–љ—Л—Е –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ [3]. –°—Г—В—М —Н—В–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ —Б–Њ—Б—В–Њ–Є—В –≤ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–Є –љ–∞—Е–Њ–і—П—Й–µ–≥–Њ—Б—П –≤ —Г—Б–ї–Њ–≤–Є—П—Е –≥–Є–њ–Њ–Ї—Б–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ —Н–љ–µ—А–≥–Є–µ–є, –њ–Њ–ї—Г—З–∞–µ–Љ–Њ–є –Є–Ј –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ вАФ ¬Ђ–±–µ—А–µ–ґ–ї–Є–≤–Њ–≥–Њ¬ї —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—Г–±—Б—В—А–∞—В–∞, —В—А–µ–±—Г—О—Й–µ–≥–Њ –Љ–µ–љ—М—И–µ–≥–Њ —А–∞—Б—Е–Њ–і–∞ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –і–ї—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Р–Ґ–§ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥–ї—О–Ї–Њ–Ј–Њ–є –Є –ї–∞–Ї—В–∞—В–Њ–Љ [3]. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –ї–µ—З–µ–љ–Є–µ –Ш–Э–У–Ґ-2 –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–Њ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Н—Г–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–µ—В–Њ–∞—Ж–Є–і–Њ–Ј–∞ (–Ф–Ъ–Р), —Б–Њ—Б—В–Њ—П–љ–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –љ–∞ —Д–Њ–љ–µ –Њ–Ї–Њ–ї–Њ–љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –≥–ї–Є–Ї–µ–Љ–Є–Є —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ –Ї–µ—В–Њ¬≠–∞—Ж–Є–і–Њ–Ј–∞ [4]. –Ф–Ъ–Р —П–≤–ї—П–µ—В—Б—П —Г—А–≥–µ–љ—В–љ—Л–Љ —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ, –Ї–Њ—В–Њ—А–Њ–µ –Љ–Њ–ґ–µ—В –≤—Л–Ј–≤–∞—В—М –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞–љ–Є–µ, –≥–Є–њ–Њ—В–µ–љ–Ј–Є—О, –њ–Њ—В–µ—А—О —Б–Њ–Ј–љ–∞–љ–Є—П, –Њ—В–µ–Ї –Љ–Њ–Ј–≥–∞, –∞ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –њ—А–Є–≤–Њ–і–Є—В—М –Ї –ї–µ—В–∞–ї—М–љ–Њ–Љ—Г –Є—Б—Е–Њ–і—Г. –Т 2015 –≥. –£–њ—А–∞–≤–ї–µ–љ–Є–µ –њ–Њ –Ї–Њ–љ—В—А–Њ–ї—О –Ј–∞ –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є –Є –ї–µ–Ї–∞—А—Б—В–≤–∞–Љ–Є –°–®–Р (FDA) –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–ї–Њ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –Њ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–Љ —А–Є—Б–Ї–µ –Ф–Ъ–Р, —Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ш–Э–У–Ґ-2 [5]. –Т–≤–Є–і—Г –Љ–∞–ї–Њ–є –і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –Ї–µ—В–Њ–љ–µ–Љ–Є–Є –љ–µ –Є—Б—Б–ї–µ–і—Г–µ—В—Б—П –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –£—В–Њ—З–љ–µ–љ–Є–µ –≤–∞–ґ–љ–Њ—Б—В–Є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ –Ї–µ—В–Њ–љ–µ–Љ–Є–Є –Є –Ї–µ—В–Њ–љ—Г—А–Є–Є –њ—А–Є —В–µ—А–∞–њ–Є–Є –Ш–Э–У–Ґ-2, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є—В—Г–∞—Ж–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Њ–љ –±—Г–і–µ—В –њ–Њ–Ї–∞–Ј–∞–љ, –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ.
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Њ—Ж–µ–љ–Є—В—М –і–Є–љ–∞–Љ–Є–Ї—Г —Г—А–Њ–≤–љ—П –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ –≤ –Ї—А–Њ–≤–Є –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –Ш–Э–У–Ґ-2 –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –і—А—Г–≥–Є–Љ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ –Ї–ї–∞—Б—Б–Њ–Љ —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ вАФ –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –і–Є–њ–µ–њ—В–Є–і–Є–ї–њ–µ–њ—В–Є–і–∞–Ј—Л-4 (–Є–Ф–Я–Я-4).
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ 2 —В–Є–њ–∞ —Б –љ–µ—Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л–Љ –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –≥–ї–Є–Ї–µ–Љ–Є–Є –љ–∞ —Д–Њ–љ–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Љ–µ—В—Д–Њ—А–Љ–Є–љ–Њ–Љ, –Ї–Њ—В–Њ—А—Л–µ –љ–Є–Ї–Њ–≥–і–∞ –љ–µ –њ–Њ–ї—Г—З–∞–ї–Є —В–µ—А–∞–њ–Є—О –Ш–Э–У–Ґ-2 –Є–ї–Є –Є–Ф–Я–Я-4. –Ъ—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П –±—Л–ї–Є: –≤–Њ–Ј—А–∞—Б—В 20вАУ75 –ї–µ—В, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≥–ї–Є–Ї–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ (HbA1c) –Њ—В 7,5 –і–Њ 10% –Є —Б–Ї–Њ—А–Њ—Б—В—М –Ї–ї—Г–±–Њ—З–Ї–Њ–≤–Њ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є (–°–Ъ–§) –њ–Њ CKD-EPI >60 –Љ–ї/–Љ–Є–љ –љ–∞ 1,73 –Љ2. –Ъ—А–Є—В–µ—А–Є—П–Љ–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є: –Є–љ—Б—Г–ї–Є–љ–Њ—В–µ—А–∞–њ–Є—П –Є–ї–Є –њ–Њ–ї—Г—З–µ–љ–Є–µ –і—А—Г–≥–Є—Е —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–љ–Є–ґ–∞—О—Й–Є—Е –Љ–∞—Б—Б—Г —В–µ–ї–∞, –Є/–Є–ї–Є –±–∞—А–Є–∞—В—А–Є—З–µ—Б–Ї–∞—П —Е–Є—А—Г—А–≥–Є—П –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–є –≥–Њ–і. –Я–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ—Л –≤ 2 –≥—А—Г–њ–њ—Л, —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ –њ–Њ –њ–Њ–ї—Г, –≤–Њ–Ј—А–∞—Б—В—Г, –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –і–Є–∞–±–µ—В–∞, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ HbA1c –Є –Є–љ–і–µ–Ї—Б—Г –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ). –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 46 –њ–∞—Ж–Є–µ–љ—В–Њ–≤: 21 –њ–∞—Ж–Є–µ–љ—В вАФ –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Г—О –≥—А—Г–њ–њ—Г, 25 вАФ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г. –Т —В–µ—З–µ–љ–Є–µ 3 –Љ–µ—Б. –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–є –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є –і–∞–њ–∞–≥–ї–Є—Д–ї–Њ–Ј–Є–љ 10 –Љ–≥/—Б—Г—В, –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ вАФ –≤–Є–ї–і–∞–≥–ї–Є–њ—В–Є–љ 100 –Љ–≥/—Б—Г—В. –Ю–±—А–∞–Ј—Ж—Л –Ї—А–Њ–≤–Є –Ј–∞–±–Є—А–∞–ї–Є –љ–∞—В–Њ—Й–∞–Ї (–≤—А–µ–Љ—П –≥–Њ–ї–Њ–і–∞–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–ї–Њ –Њ—В 8 –і–Њ 12 —З, –љ–∞–Ї–∞–љ—Г–љ–µ –Є—Б–Ї–ї—О—З–∞–ї–Є –њ—А–Є–µ–Љ –∞–ї–Ї–Њ–≥–Њ–ї—П). –Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –ЭbA1c –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –Љ–µ—В–Њ–і–Њ–Љ –∞—Д—Д–Є–љ–љ–Њ–є —Е—А–Њ–Љ–∞—В–Њ–≥—А–∞—Д–Є–Є (Bio-Rad, –°–®–Р) (–љ–Њ—А–Љ–∞ <6%); –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є (–Ї—А–µ–∞—В–Є–љ–Є–љ, –Љ–Њ—З–µ–≤–Є–љ—Г –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Є –Љ–Њ—З–µ, –ї–Є–њ–Є–і–љ—Л–є —Б–њ–µ–Ї—В—А) –Њ–њ—А–µ–і–µ–ї—П–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —А–µ–∞–Ї—В–Є–≤–Њ–≤ –Є –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–∞ Cobas Integra 400 plus (Roche, –§—А–∞–љ—Ж–Є—П); –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Є–Ј–Љ–µ—А—П–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О —Д–Њ—В–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ (—А–µ–∞–Ї—В–Є–≤—Л —Д–Є—А–Љ—Л DiaSys, –У–µ—А–Љ–∞–љ–Є—П) (—А–µ—Д–µ—А–µ–љ—Б–љ—Л–є –і–Є–∞–њ–∞–Ј–Њ–љ 0,02вАУ0,27 –Љ–Љ–Њ–ї—М/–ї). –Т—Л–±–Њ—А –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ –Ї–∞–Ї –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —Б–≤—П–Ј–∞–љ —Б —В–µ–Љ, —З—В–Њ –Њ–љ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 80% —Ж–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є—Е –Ї–µ—В–Њ–љ–Њ–≤ –Є —П–≤–ї—П–µ—В—Б—П –±–Њ–ї–µ–µ —Б—В–∞–±–Є–ї—М–љ—Л–Љ –≤ –Ї—А–Њ–≤–Є, —З–µ–Љ –∞—Ж–µ—В–Њ–∞—Ж–µ—В–∞—В –Є –∞—Ж–µ—В–Њ–љ. –Я–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ –≤—Л—И–µ –≤–µ—А—Е–љ–µ–є –≥—А–∞–љ–Є—Ж—Л —А–µ—Д–µ—А–µ–љ—Б–љ–Њ–≥–Њ –і–Є–∞–њ–∞–Ј–Њ–љ–∞ —А–∞—Б—Ж–µ–љ–Є–≤–∞–ї–Є –Ї–∞–Ї –љ–∞–ї–Є—З–Є–µ –≥–Є–њ–µ—А–Ї–µ—В–Њ–љ–µ–Љ–Є–Є.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–∞–Ї–µ—В–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ–≥—А–∞–Љ–Љ–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П STATISTICA 10 (StatSoft Inc, –°–®–Р). –Ф–∞–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Ї–∞–Ї —Б—А–µ–і–љ–µ–µ ¬± —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ (M¬±SD) –Є–ї–Є –≤ –≤–Є–і–µ –Љ–µ–і–Є–∞–љ—Л –Є –Ї–≤–∞—А—В–Є–ї–µ–є (Me, 25% –Ї–≤–∞—А—В–Є–ї—М вАФ 75% –Ї–≤–∞—А—В–Є–ї—М) –≤ —Б–ї—Г—З–∞–µ –љ–µ–љ–Њ—А–Љ–∞–ї—М–љ–Њ—Б—В–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П. –†–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ U-–Ї—А–Є—В–µ—А–Є—П –Ь–∞–љ–љ–∞ вАФ –£–Є—В–љ–Є. –Ъ–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —А–∞–љ–≥–Њ–≤–Њ–≥–Њ –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В–∞ –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –°–њ–Є—А–Љ–µ–љ–∞. –Э—Г–ї–µ–≤–∞—П –≥–Є–њ–Њ—В–µ–Ј–∞ –Њ—В–≤–µ—А–≥–∞–ї–∞—Б—М –њ—А–Є —А<0,05.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
–Я–∞—Ж–Є–µ–љ—В—Л –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –і—А—Г–≥ –Њ—В –і—А—Г–≥–∞ –њ–Њ –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ (—В–∞–±–ї. 1). –Т –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е —Г—А–Њ–≤–µ–љ—М HbA1c –Є —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л –љ–∞—В–Њ—Й–∞–Ї –њ—А–µ–≤—Л—И–∞–ї–Є —Ж–µ–ї–µ–≤—Л–µ –Ј–љ–∞—З–µ–љ–Є—П. –°—А–µ–і–љ–Є–є –Ш–Ь–Ґ –±—Л–ї –њ–Њ–≤—Л—И–µ–љ –Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї I —Б—В–µ–њ–µ–љ–Є –Њ–ґ–Є—А–µ–љ–Є—П. –°—А–µ–і–љ–Є–µ —Г—А–Њ–≤–љ–Є –Р–Ф –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ —Ж–µ–ї–µ–≤–Њ–Љ –і–Є–∞–њ–∞–Ј–Њ–љ–µ. –£—А–Њ–≤–µ–љ—М –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ –±—Л–ї –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –і–Њ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є.
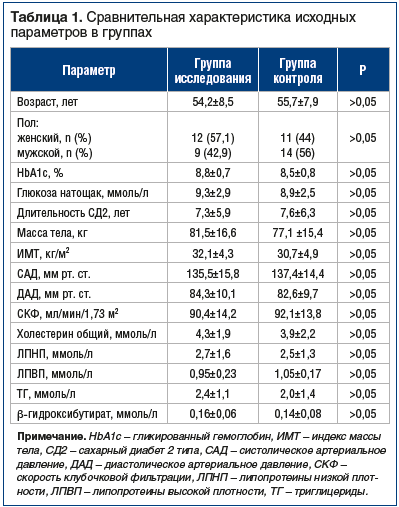
–Э–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –і–∞–њ–∞–≥–ї–Є—Д–ї–Њ–Ј–Є–љ–Њ–Љ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Ј–љ–∞—З–Є–Љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є HbA1c —Б 8,8¬±0,7% –і–Њ 7,4¬±0,5% (—А=0,005), –≥–ї—О–Ї–Њ–Ј—Л –њ–ї–∞–Ј–Љ—Л –љ–∞—В–Њ—Й–∞–Ї —Б 9,3¬±2,9 –Љ–Љ–Њ–ї—М/–ї –і–Њ 7,3¬±1,2 –Љ–Љ–Њ–ї—М/–ї (—А=0,007). –І–µ—А–µ–Ј 3 –Љ–µ—Б. –≤ –≥—А—Г–њ–њ–µ –і–∞–њ–∞–≥–ї–Є—Д–ї–Њ–Ј–Є–љ–∞ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –љ–∞ 2,4¬±1,9 –Ї–≥. –Т –≥—А—Г–њ–њ–µ –≤–Є–ї–і–∞–≥–ї–Є–њ—В–Є–љ–∞ —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є HbA1c –Є –≥–ї—О–Ї–Њ–Ј—Л –њ–ї–∞–Ј–Љ—Л –љ–∞—В–Њ—Й–∞–Ї, —Е–Њ—В—П –Є –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ (—Б 8,5¬±0,8% –і–Њ 7,9¬±0,5% (—А=0,01) –Є —Б 8,9¬±2,5 –Љ–Љ–Њ–ї—М/–ї –і–Њ 7,8¬±1,4 –Љ–Љ–Њ–ї—М/–ї (—А=0,009) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –Я—А–Є —Н—В–Њ–Љ –≤ –≥—А—Г–њ–њ–µ –≤–Є–ї–і–∞–≥–ї–Є–њ—В–Є–љ–∞ –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–∞—Б—Б—Л —В–µ–ї–∞ –Є –Ш–Ь–Ґ —З–µ—А–µ–Ј 3 –Љ–µ—Б. —В–µ—А–∞–њ–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є. –£–≤–µ–ї–Є—З–Є–≤–∞–ї–∞—Б—М –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –і–Њ –ї–µ—З–µ–љ–Є—П (0,24¬±0,13 –њ—А–Њ—В–Є–≤ 0,16¬±0,06, p=0,003). –Т –≥—А—Г–њ–њ–µ –і–∞–њ–∞–≥–ї–Є—Д–ї–Њ–Ј–Є–љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ —З–µ—А–µ–Ј 3 –Љ–µ—Б. –ї–µ—З–µ–љ–Є—П –±—Л–ї–∞ –Ј–љ–∞—З–Є–Љ–Њ –≤—Л—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –≤–Є–ї–і–∞–≥–ї–Є–њ—В–Є–љ–∞ (0,24¬±0,13 –њ—А–Њ—В–Є–≤ 0,17¬±0,05, —А=0,006). –У–Є–њ–µ—А–Ї–µ—В–Њ–љ–µ–Љ–Є—П –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ —Г 5 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (23,8%) –≤ –≥—А—Г–њ–њ–µ –і–∞–њ–∞–≥–ї–Є—Д–ї–Њ–Ј–Є–љ–∞ –Є —Г 1 (4%) –њ–∞—Ж–Є–µ–љ—В–∞ –≤ –≥—А—Г–њ–њ–µ –≤–Є–ї–і–∞–≥–ї–Є–њ—В–Є–љ–∞ (—А=0,035). –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –љ–Є —Г –Њ–і–љ–Њ–≥–Њ –Є–Ј –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ –±—Л–ї–Њ –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї —В–Њ—И–љ–Њ—В–∞, —А–≤–Њ—В–∞, –Њ–і—Л—И–Ї–∞, —Г—Б—В–∞–ї–Њ—Б—В—М –Є–ї–Є —Б–њ—Г—В–∞–љ–љ–Њ—Б—В—М —Б–Њ–Ј–љ–∞–љ–Є—П.
–Э–µ –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –Ї–Њ—А—А–µ–ї—П—Ж–Є–є –Љ–µ–ґ–і—Г –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ –Є –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–∞, –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –і–Є–∞–±–µ—В–∞, —Г—А–Њ–≤–љ–µ–Љ –°–Ъ–§, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ HbA1c. –Ю—В–Љ–µ—З–∞–ї–∞—Б—М —Б–ї–∞–±–∞—П –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ –Є –і–Є–љ–∞–Љ–Є–Ї–Є –Љ–∞—Б—Б—Л —В–µ–ї–∞ (r= -0,48, p=0,02), –љ–Њ –љ–µ –Ш–Ь–Ґ (r= -0,32, p=0,09).
–Т –љ–∞—Б—В–Њ—П—Й–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г—А–Њ–≤–µ–љ—М –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –≤ —Е–Њ–і–µ —В–µ—А–∞–њ–Є–Є –і–∞–њ–∞–≥–ї–Є—Д–ї–Њ–Ј–Є–љ–Њ–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–µ—А–∞–њ–Є–µ–є –≤–Є–ї–і–∞–≥–ї–Є–њ—В–Є–љ–Њ–Љ. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–Њ–≥–ї–∞—Б—Г—О—В—Б—П —Б –і–∞–љ–љ—Л–Љ–Є –і—А—Г–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–∞–±–µ—В–Њ–Љ, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ш–Э–У–Ґ-2, –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ї–µ—В–Њ–љ–Њ–≤—Л—Е —В–µ–ї –≤ –Ї—А–Њ–≤–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є [6вАУ8]. –†–∞–Ј–≤–Є—В–Є–µ –≥–Є–њ–µ—А–Ї–µ—В–Њ–љ–µ–Љ–Є–Є –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є –љ–µ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ –Њ—В–Љ–µ–љ—Л —В–µ—А–∞–њ–Є–Є –љ–Є —Г –Њ–і–љ–Њ–≥–Њ –Є–Ј –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–•–Њ—В—П —В–Њ—З–љ—Л–є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Љ–µ—Е–∞–љ–Є–Ј–Љ, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л–є –Ј–∞ —А–∞–Ј–≤–Є—В–Є–µ –Ї–µ—В–Њ–≥–µ–љ–µ–Ј–∞, –≤—Л–Ј–≤–∞–љ–љ–Њ–≥–Њ –Ш–Э–У–Ґ-2, –Є–Ј—Г—З–µ–љ –љ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О, —Б—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –Њ—Б–љ–Њ–≤–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —П–≤–ї—П–µ—В—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞ –Є –≥–ї—О–Ї–∞–≥–Њ–љ–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П —Б–µ–Ї—А–µ—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–∞ –≤ –Њ—В–≤–µ—В –љ–∞ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л –≤ –њ–ї–∞–Ј–Љ–µ –Ј–∞ —Б—З–µ—В –≥–ї—О–Ї–Њ–Ј—Г—А–Є–Є –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Б–µ–Ї—А–µ—Ж–Є–Є –≥–ї—О–Ї–∞–≥–Њ–љ–∞ –Ј–∞ —Б—З–µ—В –Љ–µ–љ—М—И–µ–є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –∞–ї—М—Д–∞-–Ї–ї–µ—В–Њ–Ї –≥–ї—О–Ї–Њ–Ј–Њ–є –Є —Б–љ–Є–ґ–µ–љ–Є—П –њ–∞—А–∞–Ї—А–Є–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞ [9]. –Т —Б—А–µ–і–љ–µ–Љ —А–∞—Б—З–µ—В–љ–Њ–µ –Љ–Њ–ї—П—А–љ–Њ–µ –Њ—В–љ–Њ—И–µ–љ–Є–µ –≤–љ—Г—В—А–Є–њ–µ—З–µ–љ–Њ—З–љ–Њ–≥–Њ –Є–љ—Б—Г–ї–Є–љ–∞ –Ї –≥–ї—О–Ї–∞–≥–Њ–љ—Г —Б–љ–Є–ґ–∞–µ—В—Б—П —Б 9 –і–Њ 7 –љ–∞—В–Њ—Й–∞–Ї –Є —Б 29 –і–Њ 24 –≤–Њ –≤—А–µ–Љ—П –µ–і—Л [10]. –≠—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –ї–Є–њ–Њ–ї–Є–Ј—Г –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є, –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ї–µ—В–Њ–≥–µ–љ–µ–Ј–∞ –≤ –њ–µ—З–µ–љ–Є –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ї–µ—В–Њ–љ–Њ–≤—Л—Е —В–µ–ї –≤ –Ї—А–Њ–≤–Є. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П —Г–≥–ї–µ–≤–Њ–і–Њ–≤, –Ј–љ–∞—З–Є–Љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ–Ј –Є–љ—Б—Г–ї–Є–љ–Њ–≤, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Њ—Б—В—А—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е, —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –∞–ї–Ї–Њ–≥–Њ–ї—П –Љ–Њ–≥—Г—В –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—В—М –Ї —А–∞–Ј–≤–Є—В–Є—О –Ф–Ъ–Р. –†–Є—Б–Ї –Ф–Ъ–Р –Љ–Њ–ґ–µ—В –±—Л—В—М –≤—Л—И–µ —В–∞–Ї–ґ–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–ї–Є—В–µ–ї—М–љ—Л–Љ –∞–љ–∞–Љ–љ–µ–Ј–Њ–Љ –°–Ф2, —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О ќ≤-–Ї–ї–µ—В–Њ–Ї –Є–ї–Є –њ—А–Є –ї–∞—В–µ–љ—В–љ–Њ–Љ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–Љ –і–Є–∞–±–µ—В–µ —Г –≤–Ј—А–Њ—Б–ї—Л—Е (LADA) [4].
–Ю–і–љ–∞–Ї–Њ –і–∞–љ–љ—Л–µ –њ–Њ –≤–ї–Є—П–љ–Є—О –Ш–Э–У–Ґ-2 –љ–∞ —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –Ф–Ъ–Р –Њ—Б—В–∞—О—В—Б—П –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–Љ–Є. –Ґ–∞–Ї, –≤ –Њ–і–љ–Њ–Љ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є –±–∞–Ј—Л –і–∞–љ–љ—Л—Е –Њ—В—З–µ—В–Њ–≤ –Њ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є—П—Е, —А–Є—Б–Ї –Ф–Ъ–Р —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ш–Э–У–Ґ-2, –±—Л–ї –Ј–љ–∞—З–Є–Љ–Њ –≤—Л—И–µ, —З–µ–Љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є–Ф–Я–Я-4 [11]. –Т –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–∞ –Њ—Б–љ–Њ–≤–µ –±–∞–Ј—Л –і–∞–љ–љ—Л—Е –Ј–∞ 2 –≥–Њ–і–∞ —В–∞–Ї–ґ–µ —Б—А–∞–≤–љ–Є–≤–∞–ї–Є –≤–ї–Є—П–љ–Є–µ —В–µ—А–∞–њ–Є–Є –Ш–Э–У–Ґ-2 –Є –Є–Ф–Я–Я-4 –љ–∞ —А–Є—Б–Ї –Ф–Ъ–Р. –Ю—В–љ–Њ—И–µ–љ–Є–µ —А–Є—Б–Ї–Њ–≤ (–Ю–†) –Ф–Ъ–Р –і–ї—П –Ш–Э–У–Ґ-2 —Б–Њ—Б—В–∞–≤–Є–ї–Њ 2,2 (95% –Ф–Ш 1,4вАУ3,6) [12]. –Ю–і–љ–∞–Ї–Њ –≤ —Н—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–µ —Г—З–Є—В—Л–≤–∞–ї–Є –љ–µ–і–∞–≤–љ—О—О –Є—Б—В–Њ—А–Є—О –Є–љ—Д–µ–Ї—Ж–Є–є, –≤–Ї–ї—О—З–∞—П –Є–љ—Д–µ–Ї—Ж–Є–Є –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є, –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є –Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, –Є–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –ї–µ–Ї–∞—А—Б—В–≤, –Ї–Њ—В–Њ—А—Л–µ –≤–ї–Є—П—О—В –љ–∞ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї, —В–∞–Ї–Є—Е –Ї–∞–Ї –і–Є¬≠—Г—А–µ—В–Є–Ї–Є, –Є–љ–≥–Є–±–Є—В–Њ—А—Л–∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ –Є–ї–Є –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–∞ II. C –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј 81 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –њ—А–Є–µ–Љ –Ш–Э–У–Ґ-2 –љ–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Ф–Ъ–Р [13]. Wang et al. —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ш–Э–У–Ґ-2 –љ–µ –њ–Њ–≤—Л—И–∞–ї–Њ —А–Є—Б–Ї –Ф–Ъ–Р –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –і—А—Г–≥–Є—Е –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е –∞–љ—В–Є–≥–Є–њ–µ—А–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [14]. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –∞–љ–∞–ї–Є–Ј–Є—А—Г–µ–Љ—Л–µ –≥—А—Г–њ–њ—Л –љ–µ –±—Л–ї–Є –њ–Њ–ї–љ–Њ—Б—В—М—О –Є–і–µ–љ—В–Є—З–љ—Л–Љ–Є, —З—В–Њ –Љ–Њ–≥–ї–Њ –Њ—В—А–∞–Ј–Є—В—М—Б—П –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Т 2018 –≥. –±—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–±—Й–µ–љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Ї–Њ–≥–Њ—А—В–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Б—А–∞–≤–љ–Є–≤–∞–ї–Є –і–∞–љ–љ—Л–µ 56 325 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –Ш–Э–У–Ґ-2 —Б –і–∞–љ–љ—Л–Љ–Є 974 179 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –Є–Ф–Я–Я-4 [15]. –Ч–∞ –≤—А–µ–Љ—П –љ–∞–±–ї—О–і–µ–љ–Є—П –±—Л–ї–Њ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ 63 —Б–ї—Г—З–∞—П –Ф–Ъ–Р. –Э–µ –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є—П —А–Є—Б–Ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–Њ –њ–Њ–≤–Њ–і—Г –Ф–Ъ–Р –≤ –≥—А—Г–њ–њ–µ –Ш–Э–У–Ґ-2 –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О –≥—А—Г–њ–њ–Њ–є –Є–Ф–Я–Я-4 (–Ю–† 0,956; 95% –Ф–Ш 0,581вАУ1,572; —А=0,996). –І–∞—Б—В–Њ—В–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –њ–Њ –њ–Њ–≤–Њ–і—Г –Ф–Ъ–Р –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 30 –і–љ–µ–є –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є –Ш–Э–У–Ґ-2 —Б–Њ—Б—В–∞–≤–Є–ї–∞ 2,501 —Б–ї—Г—З–∞—П –љ–∞ 1000 —З–µ–ї–Њ–≤–µ–Ї–Њ-–ї–µ—В, —З—В–Њ –±—Л–ї–Њ –Ј–љ–∞—З–Є–Љ–Њ –±–Њ–ї—М—И–µ, —З–µ–Љ –≤ —В–µ—З–µ–љ–Є–µ –њ–Њ—Б–ї–µ–і—Г—О—Й–Є—Е 3 –ї–µ—В –љ–∞–±–ї—О–і–µ–љ–Є—П (0,614 —Б–ї—Г—З–∞—П –љ–∞ 1000 —З–µ–ї–Њ–≤–µ–Ї–Њ-–ї–µ—В). –Я—А–Є —Н—В–Њ–Љ –љ–µ –±—Л–ї–Њ –њ–Њ–ї—Г—З–µ–љ–Њ —А–∞–Ј–ї–Є—З–Є–є –≤ —А–Є—Б–Ї–µ –Ф–Ъ–Р –Љ–µ–ґ–і—Г –і–≤—Г–Љ—П –≥—А—Г–њ–њ–∞–Љ–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—А–µ–Љ–µ–љ–Є, –њ—А–Њ—И–µ–і—И–µ–≥–Њ –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ш–Э–У–Ґ-2 –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Њ—Б—М —Б –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –Ф–Ъ–Р —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –Љ–Є–Ї—А–Њ—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є (–Ю–† 2,044; 95% –Ф–Ш 0,900вАУ4,640; p=0,088) –Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –і–Є—Г—А–µ—В–Є–Ї–Є (–Ю–† 3,648; 95% –Ф–Ш 0,720вАУ18,480; p=0,118). –°—А–µ–і–Є —Д–∞–Ї—В–Њ—А–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –≤–ї–Є—П—В—М –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –љ–∞–і–Њ –Њ—В–Љ–µ—В–Є—В—М –µ–≥–Њ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є, –∞ —В–∞–Ї–ґ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і–∞–љ–љ—Л—Е –њ–Њ –і–Њ–Ј–∞–Љ–Є–љ—Б—Г–ї–Є–љ–Њ–≤,–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –°–Ф, —Г—А–Њ–≤–љ—О –Ш–Ь–Ґ –Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (–љ–∞–њ—А–Є–Љ–µ—А, —Г—А–Њ–≤–љ—П –°-–њ–µ–њ—В–Є–і–∞). –Т —Ж–µ–ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є–µ –Ф–Ъ–Р –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ш–Э–У–Ґ-2 –њ—А–Є –°–Ф2 –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Б —З–∞—Б—В–Њ—В–Њ–є –Љ–µ–љ–µ–µ 0,2% [16, 17]. –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Н—В–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤ –њ–µ—А–≤—Л–µ 2 –Љ–µ—Б. –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ [11, 18, 19]. –Я—А–Є —А–∞–Ј–≤–Є—В–Є–Є —В–∞–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, –Ї–∞–Ї —В–Њ—И–љ–Њ—В–∞, —А–≤–Њ—В–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –∞–ї–Ї–Њ–≥–Њ–ї—П –Є–ї–Є –љ–µ–і–∞–≤–љ–µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П –і–Њ–Ј—Л –Є–љ—Б—Г–ї–Є–љ–∞, –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–ї–µ–Ј–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –ґ–Є–і–Ї–Њ—Б—В–Є –Є —Г–≥–ї–µ–≤–Њ–і–Њ–≤. –Я–∞—Ж–Є–µ–љ—В–∞–Љ —Б–ї–µ–і—Г–µ—В –≤—А–µ–Љ–µ–љ–љ–Њ –њ—А–µ–Ї—А–∞—В–Є—В—М –њ—А–Є–µ–Љ –Ш–Э–У–Ґ-2, –Њ–±—А–∞—В–Є—В—М—Б—П –Ї —Б–≤–Њ–µ–Љ—Г –≤—А–∞—З—Г –Є –≤–≤–µ—Б—В–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Г—О –і–Њ–Ј—Г —Г–ї—М—В—А–∞–Ї–Њ—А–Њ—В–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї–Є–љ–∞ –≤–Љ–µ—Б—В–µ —Б –њ—А–Є–µ–Љ–Њ–Љ —Г–≥–ї–µ–≤–Њ–і–Њ–≤ –Є –і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –ґ–Є–і–Ї–Њ—Б—В–Є [20]. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –°–Ф2 –Љ–µ–љ–µ–µ 10 –ї–µ—В, –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є–љ—Б—Г–ї–Є–љ –Є –љ–µ –Є–Љ–µ—О—Й–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –∞–±—Б–Њ–ї—О—В–љ–Њ–є –Є–љ—Б—Г–ї–Є–љ–Њ–њ–µ–љ–Є–Є, –±–µ–Ј —В—П–ґ–µ–ї—Л—Е —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —В–µ—А–∞–њ–Є—П –і–∞–њ–∞–≥–ї–Є—Д–ї–Њ–Ј–Є–љ–Њ–Љ –љ–µ –њ—А–Є–≤–Њ–і–Є–ї–∞ –Ї —А–∞–Ј–≤–Є—В–Є—О –Ф–Ъ–Р.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Э–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–∞–ї—М–љ–µ–є—И–Є–µ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б –љ–∞–і–ї–µ–ґ–∞—Й–Є–Љ–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ–Є —В–µ—Б—В–∞–Љ–Є –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Б–Ї–ї–Њ–љ–љ—Л –Ї —А–∞–Ј–≤–Є—В–Є—О —Г –љ–Є—Е –Ф–Ъ–Р –≤ –љ–∞—З–∞–ї–µ –ї–µ—З–µ–љ–Є—П –Ш–Э–У–Ґ-2. –Т—А–∞—З–Є –і–Њ–ї–ґ–љ—Л —Г—З–Є—В—Л–≤–∞—В—М —А–Є—Б–Ї–Є –Ф–Ъ–Р –њ—А–Є —Б—В–∞—А—В–µ –Ш–Э–У–Ґ-2, –Њ–і–љ–∞–Ї–Њ —Б —Г—З–µ—В–Њ–Љ –љ–Є–Ј–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є —А–∞–Ј–≤–Є—В–Є—П –Ф–Ъ–Р —А—Г—В–Є–љ–љ—Л–є –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥ –Ї–µ—В–Њ–љ–Њ–≤—Л—Е —В–µ–ї, –≤ —В. —З. –±–µ—В–∞-–≥–Є–і—А–Њ–Ї—Б–Є–±—Г—В–Є—А–∞—В–∞, –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–µ–љ.












