–Т–≤–µ–і–µ–љ–Є–µ
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –≤ —Д–Є—В–Њ–Љ–µ–і–Є—Ж–Є–љ–µ –Ї–ї—О—З–µ–≤—Л–Љ –Љ–Њ–Љ–µ–љ—В–Њ–Љ —П–≤–ї—П–µ—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –≤–µ—Й–µ—Б—В–≤, –≤—Е–Њ–і—П—Й–Є—Е –≤ —Б–Њ—Б—В–∞–≤ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ю–і–љ–∞ –Є–Ј –≥–ї–∞–≤–љ—Л—Е —Ж–µ–ї–µ–є –і–∞–љ–љ–Њ–є –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є вАУ –њ—А–µ–і—Б—В–∞–≤–Є—В—М –љ–∞—Г—З–љ—Л–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–µ–≤–Њ—Б—Е–Њ–і—Б—В–≤–∞ –Љ–љ–Њ–≥–Є—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –≤ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Е –Њ—В–і–µ–ї—М–љ—Л–Љ–Є —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–Љ–Є. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –≤ —В–µ—З–µ–љ–Є–µ —Б—В–Њ–ї–µ—В–Є–є, –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –≤–Њ –Љ–љ–Њ–≥–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Э–∞–Љ –њ—А–µ–і—Б—В–Њ–Є—В —А–∞—Б—Б–Љ–Њ—В—А–µ—В—М —Н—Д—Д–µ–Ї—В —Б–Є–љ–µ—А–≥–Є–Є, –Ї–Њ—В–Њ—А—Л–є —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –њ—А–Є –і–µ–є—Б—В–≤–Є–Є —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є—Е —Б–Њ–±–Њ–є —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Є –Є—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤, –Є –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–∞–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–Т —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –ї–µ–ґ–∞—Й–Є–µ –≤ –Њ—Б–љ–Њ–≤–µ —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є, –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –љ–µ–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л–Љ–Є. –Ґ–Њ–ї—М–Ї–Њ —В–Њ—З–љ–Њ–µ –њ–Њ–љ–Є–Љ–∞–љ–Є–µ —Н—В–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –њ–Њ–Ј–≤–Њ–ї–Є—В —А–∞–Ј—А–∞–±–Њ—В–∞—В—М –љ–Њ–≤–Њ–µ –њ–Њ–Ї–Њ–ї–µ–љ–Є–µ —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Љ–Њ–љ–Њ- –Є –Љ—Г–ї—М—В–Є–њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В, –Ї–Њ—В–Њ—А—Л–µ –±—Г–і—Г—В –љ–µ —В–Њ–ї—М–Ї–Њ –Њ—В–≤–µ—З–∞—В—М —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ —Б—В–∞–љ–і–∞—А—В–∞–Љ –Ї–∞—З–µ—Б—В–≤–∞, –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤, –љ–Њ –Є —Б–Љ–Њ–≥—Г—В –і–Њ–њ–Њ–ї–љ–Є—В—М –Є–ї–Є –Ј–∞–Љ–µ–љ–Є—В—М —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –Є–ї–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є –≤ –ї–µ—З–µ–љ–Є–Є –Љ–љ–Њ–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Т–∞–ґ–љ—Л–Љ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ–Љ, —Б–Њ–і–µ–є—Б—В–≤—Г—О—Й–Є–Љ –Є–Ј—Г—З–µ–љ–Є—О –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б—В–∞–ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –њ—А–Њ–Є–Ј–Њ—И–µ–і—И–Є–µ –≤ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ –Ј–∞–Ї–Њ–љ–Њ–і–∞—В–µ–ї—М—Б—В–≤–µ, —В—А–µ–±—Г—О—Й–Є–µ –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, –≤—Е–Њ–і—П—Й–Є—Е –≤ —Б–Њ—Б—В–∞–≤ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞.
–Т 1970вАУ1980-—Е –≥–Њ–і–∞—Е –Є–Ј-–Ј–∞ –Њ—В—Б—Г—В—Б—В–≤–Є—П –≤—Л—Б–Њ–Ї–Њ—В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–љ—Л—Е –∞–љ–∞–ї–Є—В–Є—З–µ—Б–Ї–Є—Е –Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –≤—Л–њ–Њ–ї–љ—П—В—М —Н—В–Є —В—А–µ–±–Њ–≤–∞–љ–Є—П –±—Л–ї–Њ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ. –Т —В–Њ –≤—А–µ–Љ—П –Љ–љ–Њ–≥–Є–µ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –љ–µ –Є–Ј—Г—З–∞–ї–Є—Б—М –≤ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, —В. –µ. –љ–µ –Є–Љ–µ–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е, –њ—А–Њ–≤–µ—А–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤ –Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–µ–ї–Ї–Є–µ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –Ї–Њ–Љ–њ–∞–љ–Є–Є –љ–µ –Є–Љ–µ–ї–Є –і–Њ—Б—В–∞—В–Њ—З–љ—Л—Е —Д–Є–љ–∞–љ—Б–Њ–≤—Л—Е —Б—А–µ–і—Б—В–≤ –і–ї—П –≤—Л–њ–Њ–ї–љ–µ–љ–Є—П –≤—Б–µ—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –∞–љ–∞–ї–Њ–≥–Њ–≤ —Б—В–∞–љ–і–∞—А—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –Ї—А—Г–њ–љ—Л–µ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –Ї–Њ–Љ–њ–∞–љ–Є–Є –љ–µ –±—Л–ї–Є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ—Л –≤ –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–Э–∞—З–∞–ї—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б–Є–љ–µ—А–≥–Є–Є –≤ —Д–Є—В–Њ–Љ–µ–і–Є—Ж–Є–љ–µ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Є –і–≤–∞ —Б–Њ–±—Л—В–Є—П: –≤–Њ-–њ–µ—А–≤—Л—Е, —Н—В–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –љ–Њ–≤—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –∞–љ–∞–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —Е–Є–Љ–Є–Є –Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –±–Є–Њ–ї–Њ–≥–Є–Є, –∞ –≤–Њ-–≤—В–Њ—А—Л—Е, –љ–µ–Њ–ґ–Є–і–∞–љ–љ–Њ –њ—А–Њ–Є–Ј–Њ—И–µ–і—И–∞—П —Б–Љ–µ–љ–∞ –њ–∞—А–∞–і–Є–≥–Љ—Л –≤ —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є. –≠—В–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Ј–∞–Ї–ї—О—З–∞–ї–Њ—Б—М –≤ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–Љ –њ–µ—А–µ—Е–Њ–і–µ –Њ—В —В–µ—А–∞–њ–Є–Є –Љ–Њ–љ–Њ–њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Ї —В–µ—А–∞–њ–Є–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ –њ—А–Є –ї–µ—З–µ–љ–Є–Є —И–Є—А–Њ–Ї–Њ–≥–Њ –Ї—А—Г–≥–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є вАУ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –°–Я–Ш–Ф–∞, –≥–Є–њ–µ—А—В–Њ–љ–Є–Є, –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е.
–Т —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤ –љ–µ–і–∞–≤–љ–µ–µ –≤—А–µ–Љ—П –±—Л–ї–∞ –Њ–±–Њ–Ј–љ–∞—З–µ–љ–∞ –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П –±–Є–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є, –Ї–Њ—В–Њ—А–∞—П –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —Б–≤–Њ–µ–≥–Њ —А–Њ–і–∞ —Б–Њ–≥–ї–∞—Б–Њ–≤–∞–љ–љ—Л—Е –і–µ–є—Б—В–≤–Є—П—Е –љ–µ –љ–∞ –њ—А—П–Љ—Г—О, –∞ —Б –њ–Њ–Љ–Њ—Й—М—О –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –Є–ї–Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е –і–ї—П –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Њ–њ—Г—Е–Њ–ї–Є (–љ–∞–њ—А–Є–Љ–µ—А, –∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј–∞ –Є –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –Њ–љ–Ї–Њ–≥–µ–љ–Њ–≤, –Є–љ–і—Г–Ї—Ж–Є–Є –∞–њ–Њ–њ—В–Њ–Ј–∞, –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є–ї–Є –±–Њ—А—М–±—Л —Б –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є) –Є –њ—А–Є–≤–Њ–і–Є—В –Ї –µ–µ —Г–љ–Є—З—В–Њ–ґ–µ–љ–Є—О. –≠—В–∞ –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –Љ–љ–Њ–≥–Њ—Ж–µ–ї–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є, –Ї–Њ—В–Њ—А–∞—П –±—Г–і–µ—В –Њ–њ–Є—Б–∞–љ–∞ –і–∞–ї–µ–µ –≤ —Н—В–Њ–Љ –Њ–±–Ј–Њ—А–µ. –°—Е–Њ–ґ–Є–µ –Љ–µ—В–Њ–і—Л —П–≤–ї—П—О—В—Б—П –Њ—Б–љ–Њ–≤–Њ–є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є –Ї–Є—В–∞–є—Б–Ї–Њ–є –Є –∞—О—А–≤–µ–і–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л. –Э–µ—В —Б–Њ–Љ–љ–µ–љ–Є–є –≤ —В–Њ–Љ, —З—В–Њ –Љ–Њ–љ–Њ–њ—А–µ–њ–∞—А–∞—В—Л, –Ї–Њ—В–Њ—А—Л–µ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Б–Њ–і–µ—А–ґ–∞—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е, —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –њ—А–Њ—П–≤–ї—П—В—М —Н—Д—Д–µ–Ї—В—Л —Б–Є–љ–µ—А–≥–Є–Є.
–Я–Њ—З–µ–Љ—Г –љ–∞–ї–Є—З–Є–µ —Н—Д—Д–µ–Ї—В–∞ —Б–Є–љ–µ—А–≥–Є–Є –≤–∞–ґ–љ–Њ –Є –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–Њ –і–ї—П —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤? –°—В—А–∞—В–µ–≥–Є—П –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ –њ–Њ–љ–Є–Љ–∞–љ–Є–Є —В–Њ–≥–Њ, —З—В–Њ –Љ–љ–Њ–≥–Є–µ –±–Њ–ї–µ–Ј–љ–Є –Є–Љ–µ—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ—А–Є—З–Є–љ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є —Б–ї–Њ–ґ–љ—Г—О –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—О. –Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г—Б–њ–µ—И–љ–µ–µ –њ–Њ–і–і–∞—О—В—Б—П –ї–µ—З–µ–љ–Є—О –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –њ—А–∞–≤–Є–ї—М–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ—Л—Е –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —З–µ–Љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–Њ–љ–Њ–њ—А–µ–њ–∞—А–∞—В–Њ–≤, —З—В–Њ –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ —А—П–і–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ–±–ї–∞—Б—В—П—Е –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –љ–∞—Г–Ї–Є. –Ю—Б–Њ–±–µ–љ–љ–Њ —Н—В–Њ —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—П. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г–ґ–µ –Є–Ј–≤–µ—Б—В–љ—Л –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ—А–Є–Љ–µ—А–Њ–≤ —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є –≤ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є, —Е–Њ—В—П –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ —Б–Њ–≤—Б–µ–Љ –≤—Л—П—Б–љ–µ–љ—Л –Є—Е —В–Њ—З–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л. –Т —Д–Є—В–Њ—В–µ—А–∞–њ–Є–Є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–Њ –љ–∞–ї–Є—З–Є—П —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є —П–≤–ї—П–µ—В—Б—П —Б–ї–Њ–ґ–љ–Њ–є –Ј–∞–і–∞—З–µ–є –≤ —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б–ї–Њ–ґ–љ—Л–µ —Б–Љ–µ—Б–Є –Ї—А—Г–њ–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є, —Б –љ–µ–±–Њ–ї—М—И–Є–Љ –і–Њ–±–∞–≤–ї–µ–љ–Є–µ–Љ –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є –≤–Њ–ї–Њ–Ї–Њ–љ, –Ї–Њ—В–Њ—А—Л–µ —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Њ–≤–∞—В—М —Б –і—А—Г–≥–Є–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П –њ–Њ—Б–ї–µ–і–љ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤ —Д–Є—В–Њ–Љ–µ–і–Є—Ж–Є–љ–µ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–µ –љ–∞–ї–Є—З–Є—П —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є.
–§–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ–Њ–і—Е–Њ–і
–Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —Н—Д—Д–µ–Ї—В–∞ —Б–Є–љ–µ—А–≥–Є–Є
–°–ї–Њ–ґ–љ–Њ—Б—В—М –Њ–і–љ–Њ–Ј–љ–∞—З–љ–Њ–є —Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–Ї–Є —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —В–µ—А–Љ–Є–љ–∞ ¬Ђ—Н—Д—Д–µ–Ї—В —Б–Є–љ–µ—А–≥–Є–Є¬ї –њ–Њ–Ї–∞–Ј–∞–љ–∞ –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±–Њ–ї—М—И–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є [1вАУ11]. –Э–∞–Є–±–Њ–ї–µ–µ –њ—А–Є–Љ–µ–љ–Є–Љ—Л–Љ –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Л–Љ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є —П–≤–ї—П–µ—В—Б—П –Є–Ј–Њ–±–Њ–ї–Є—З–µ—Б–Ї–Є–є –Љ–µ—В–Њ–і Berenbaum [11].
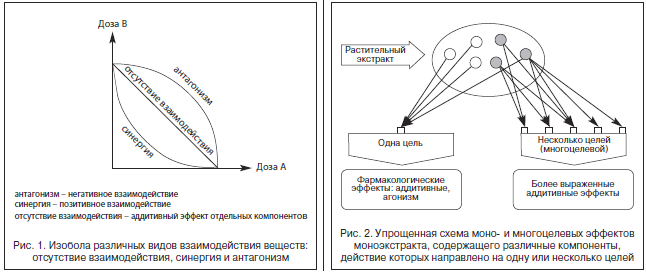
–Ф–ї—П –і–µ–Љ–Њ–љ—Б—В—А–∞—Ж–Є–Є –Є–Ј–Њ–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –і–µ–є—Б—В–≤–Є—П —Б–Љ–µ—Б–Є –і–≤—Г—Е –≤–µ—Й–µ—Б—В–≤ –Љ–Њ–≥—Г—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –Љ–Њ–і–µ–ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –Є–ї–Є in vitro. –Ш–Ј–Њ–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є –Љ–µ—В–Њ–і –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–≥–ї—П–і–љ–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞—В—М –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ –і–Њ–Ј –Њ—В–і–µ–ї—М–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –љ–∞ –≥—А–∞—Д–Є–Ї–µ (—А–Є—Б. 1).
–Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –і–Њ–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ –≥–µ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е —В–Њ—З–Ї–∞—Е —Б –Ї–Њ–Њ—А–і–Є–љ–∞—В–∞–Љ–Є, —Б–Њ–≤–њ–∞–і–∞—О—Й–Є–Љ–Є –њ–Њ –≤–µ–ї–Є—З–Є–љ–µ –і–Њ–Ј –Њ—В–і–µ–ї—М–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤. –Ш–Ј–Њ–±–Њ–ї–∞ –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞–µ—В –њ–Њ–і —Б–Њ–±–Њ–є –ї–Є–љ–Є—О –Є–ї–Є –Ї—А–Є–≤—Г—О –Љ–µ–ґ–і—Г —В–Њ—З–Ї–∞–Љ–Є –Њ–і–љ–Њ–≥–Њ –Є —В–Њ–≥–Њ –ґ–µ —Н—Д—Д–µ–Ї—В–∞. –Ф–ї—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Є–Ј–Њ–±–Њ–ї—Л –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Ј–љ–∞—В—М –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Њ—В–і–µ–ї—М–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Є –Њ–Ї–∞–Ј—Л–≤–∞–µ–Љ—Л–є –Є–Љ–Є —Н—Д—Д–µ–Ї—В. –Ф–ї—П —В–Њ—З–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–ї–µ–љ–Є—П –Є–Ј–Њ–±–Њ–ї—Л –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–∞–љ–љ—Л–µ –Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П—Е –і–Њ–Ј. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤–µ—Й–µ—Б—В–≤ –Р –Є –Т, –њ—А–Њ—П–≤–ї—П—О—Й–Є–µ —Н—Д—Д–µ–Ї—В —Б–Є–љ–µ—А–≥–Є–Є, –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –Є—Б—Е–Њ–і—П –Є–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–≥–Њ –≥—А–∞—Д–Є–Ї–∞.
–Я—А–Є –љ–∞–ї–Є—З–Є–Є –Є—Б—В–Є–љ–љ–Њ–є —Б–Є–љ–µ—А–≥–Є–Є –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –і–Њ–ї–ґ–љ–Њ–≥–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Љ–µ–љ—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–∞. –Ф–Њ—Б—В–Є–≥–∞–µ–Љ—Л–є –≤ —В–∞–Ї–Њ–Љ —Б–ї—Г—З–∞–µ —А–µ–Ј—Г–ї—М—В–∞—В –Љ–Њ–ґ–µ—В –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј –њ—А–µ–≤–Ј–Њ–є—В–Є –Њ–ґ–Є–і–∞–µ–Љ—Л–є. –Ь–Њ–ґ–љ–Њ –њ–Њ–ї–∞–≥–∞—В—М, —З—В–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –і–Њ–Ј—Л –њ—А–Є –њ—А–∞–≤–Є–ї—М–љ–Њ –≤—Л–±—А–∞–љ–љ–Њ–Љ —Б–Њ—З–µ—В–∞–љ–Є–Є —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ —Б –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ —Г–Љ–µ–љ—М—И–Є—В –µ–≥–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л.
–Ъ–Њ–љ–µ—З–љ–Њ, –љ–∞–ї–Є—З–Є–µ —Н—Д—Д–µ–Ї—В–∞ —Б–Є–љ–µ—А–≥–Є–Є –љ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —В–Њ–ї—М–Ї–Њ –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Њ–і–љ–Њ–≥–Њ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞, –∞ –µ—Б—В—М –ї–Є –Њ–љ –њ—А–Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ вАУ –µ—Й–µ –±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ–Њ —Г—Б—В–∞–љ–Њ–≤–Є—В—М –≤ —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ –≤ —Н–Ї—Б—В—А–∞–Ї—В–µ –Њ–±—Л—З–љ–Њ —Б–Њ–і–µ—А–ґ–∞—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –≤–µ—Й–µ—Б—В–≤–∞, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –њ—А–Њ—П–≤–ї—П—В—М —Б–µ–±—П –≤–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є.
–Ь–µ—Е–∞–љ–Є–Ј–Љ—Л —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є
–°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ–Њ—Б–ї–µ–і–љ–Є—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є–Ј—Л—Б–Ї–∞–љ–Є–є, –∞–Ї—В—Г–∞–ї—М–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ —З–µ—В—Л—А–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Б–Є–љ–µ—А–≥–Є–Є:
1) –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ –Љ–љ–Њ–≥–Њ—Ж–µ–ї–µ–≤—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є;
2) —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Є–ї–Є —Д–Є–Ј–Є–Ї–Њ-—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б —Г–ї—Г—З—И–µ–љ–Є–µ–Љ —А–∞—Б—В–≤–Њ—А–Є–Љ–Њ—Б—В–Є, —Б–Ї–Њ—А–Њ—Б—В—М—О —А–µ–Ј–Њ—А–±—Ж–Є–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є;
3) –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ –≤–µ—Й–µ—Б—В–≤ –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –±–∞–Ї—В–µ—А–Є—П–Љ;
4) —Г—Б—В—А–∞–љ–µ–љ–Є–µ –Є–ї–Є –љ–µ–є—В—А–∞–ї–Є–Ј–∞—Ж–Є—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–є –≤–µ—Й–µ—Б—В–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е—Б—П –≤ —Н–Ї—Б—В—А–∞–Ї—В–µ –Є–ї–Є –і–Њ–±–∞–≤–ї–µ–љ–љ—Л—Е –Ї –љ–µ–Љ—Г, –≤ —Ж–µ–ї—П—Е –њ–Њ–≤—Л—И–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ–ї—Г—З–∞–µ–Љ–Њ–≥–Њ –≤ –Є—В–Њ–≥–µ –њ—А–µ–њ–∞—А–∞—В–∞.
–†–∞—Б—Б–Љ–Њ—В—А–Є–Љ –њ–Њ–і—А–Њ–±–љ–µ–µ —Г–Ї–∞–Ј–∞–љ–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л.
1. –Ю–±–µ—Б–њ–µ—З–µ–љ–Є–µ –Љ–љ–Њ–≥–Њ—Ж–µ–ї–µ–≤—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є
–†–µ—И–µ–љ–Є–µ –Ј–∞–і–∞—З–Є –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –Љ–љ–Њ–≥–Њ—Ж–µ–ї–µ–≤—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞–µ—В –њ–Њ–і —Б–Њ–±–Њ–є —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –Њ—В–і–µ–ї—М–љ—Л–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –Љ–Њ–љ–Њ—Н–Ї—Б—В—А–∞–Ї—В–∞ –Є–ї–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ –±—Г–і—Г—В –љ–∞–њ—А–∞–≤–ї–µ–љ—Л –љ–µ –љ–∞ –Њ–і–љ—Г –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Г—О —Ж–µ–ї—М, –∞ –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Ж–µ–ї–µ–є —Б—А–∞–Ј—Г –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Њ–≤–∞—В—М –Ї–∞–Ї –∞–≥–Њ–љ–Є—Б—В—Л –Є —Б–Є–љ–µ—А–≥–Є—Б—В—Л. Imming –Є —Б–Њ–∞–≤—В. [12] –њ–µ—А–µ—З–Є—Б–ї–Є–ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –≤–∞–ґ–љ—Л–µ —Ж–µ–ї–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Н—В–Њ: —Д–µ—А–Љ–µ–љ—В—Л, —Б—Г–±—Б—В—А–∞—В—Л, –Љ–µ—В–∞–±–Њ–ї–Є—В—Л –Є –±–µ–ї–Ї–Є, —А–µ—Ж–µ–њ—В–Њ—А—Л, –Є–Њ–љ–љ—Л–µ –Ї–∞–љ–∞–ї—Л, —В—А–∞–љ—Б–њ–Њ—А—В–љ—Л–µ –±–µ–ї–Ї–Є, –Ф–Э–Ъ, –†–Э–Ъ, —А–Є–±–Њ—Б–Њ–Љ—Л, –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ –Є —Д–Є–Ј–Є–Ї–Њ-—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л.
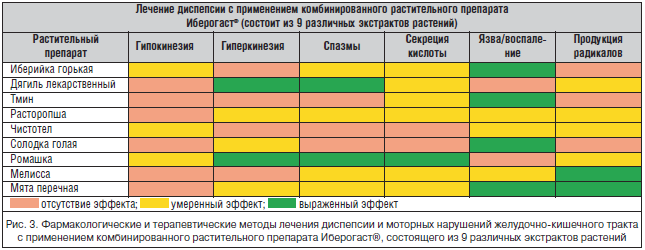
–Ь–љ–Њ–≥–Њ—Ж–µ–ї–µ–≤–Њ–є –њ—А–Є–љ—Ж–Є–њ –і–µ–є—Б—В–≤–Є—П —Д–∞—А–Љ–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±—Г–і–µ—В –Њ—Б–Њ–±–µ–љ–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –≤ —Б–ї—Г—З–∞–µ —А–∞–Ј–≤–Є—В–Є—П –љ–µ–≥–∞—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –±–Њ–ї–µ–Ј–љ–Є, –Ї–Њ–≥–і–∞ —Б–ї–Њ–ґ–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —В—А–µ–±—Г–µ—В —Б–ї–Њ–ґ–љ–Њ–≥–Њ –ґ–µ, –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П. –Т —Н—В–Њ–є —Б–≤—П–Ј–Є —Б–ї–µ–і—Г–µ—В –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ –њ–Њ–ї–Є–≤–∞–ї–µ–љ—В–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –≤—В–Њ—А–Є—З–љ—Л—Е —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї –њ–Њ–ї–Є—Д–µ–љ–Њ–ї—Л –Є —В–µ—А–њ–µ–љ–Њ–Є–і—Л. –Я–µ—А–≤—Л–µ –Њ–±–ї–∞–і–∞—О—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —Б–≤—П–Ј—Л–≤–∞—В—М —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л (–±–µ–ї–Ї–Є, –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ—Л), –≤—В–Њ—А—Л–µ вАУ —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї –Ї–ї–µ—В–Њ—З–љ—Л–Љ –Љ–µ–Љ–±—А–∞–љ–∞–Љ, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –Є—Е –ї–Є–њ–Њ—Д–Є–ї—М–љ–Њ—Б—В—М—О –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –њ—А–Њ–љ–Є–Ї–∞—В—М —З–µ—А–µ–Ј —Б—В–µ–љ–Ї–Є –Ї–ї–µ—В–Њ–Ї —З–µ–ї–Њ–≤–µ–Ї–∞ –Є–ї–Є –±–∞–Ї—В–µ—А–Є–є. –Ь–љ–Њ–≥–Є–µ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ —Н–Ї—Б—В—А–∞–Ї—В—Л –±–Њ–≥–∞—В—Л —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–Љ–Є —Н—В–Є—Е –і–≤—Г—Е –Ї–∞—В–µ–≥–Њ—А–Є–є, –њ–Њ—Н—В–Њ–Љ—Г —Б–њ–Њ—Б–Њ–±–љ—Л –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ–Њ–≤—Л—Б–Є—В—М –Њ–±—Й—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Є —Е–Њ—А–Њ—И–µ–є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є.
–Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Њ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 2, –њ—А–Є –љ–∞–ї–Є—З–Є–Є –≤ –Љ–Њ–љ–Њ—Н–Ї—Б—В—А–∞–Ї—В–µ —Б–Љ–µ—Б–Є –≤–µ—Й–µ—Б—В–≤, –і–µ–є—Б—В–≤–Є–µ –Ї–Њ—В–Њ—А—Л—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–∞ –Њ–і–љ—Г —Ж–µ–ї—М, –Љ–Њ–ґ–љ–Њ –Њ–ґ–Є–і–∞—В—М —В–Њ–ї—М–Ї–Њ –∞–і–і–Є—В–Є–≤–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞. –Т —Б–ї—Г—З–∞–µ –ґ–µ –µ—Б–ї–Є –і–µ–є—Б—В–≤–Є–µ –Њ—В–і–µ–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј–љ—Л—Е —Ж–µ–ї–µ–є-–Љ–Є—И–µ–љ–µ–є, —В–Њ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В —Н—Д—Д–µ–Ї—В —Б–Є–љ–µ—А–≥–Є–Є.
Williamson [13] –±—Л–ї –Њ–і–љ–Є–Љ –Є–Ј –њ–µ—А–≤—Л—Е, –Ї—В–Њ –Њ–±—А–∞—В–Є–ї—Б—П –Ї –њ—А–Њ–±–ї–µ–Љ–∞—В–Є–Ї–µ —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є –Є –≤ –Њ–±–Ј–Њ—А–љ–Њ–є —Б—В–∞—В—М–µ –Њ–њ–Є—Б–∞–ї –љ–µ–Ї–Њ—В–Њ—А—Л–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤.
–Я—А–Є–Љ–µ—А 1. –Ґ–µ—В—А–∞–≥–Є–і—А–Њ–Ї–∞–љ–љ–∞–±–Є–љ–Њ–ї –Њ–±–ї–∞–і–∞–µ—В –∞–љ—В–Є—Б–њ–∞—Б—В–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, –∞ —В–∞–Ї–ґ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≥–∞–ї–ї—О—Ж–Є–љ–Њ–≥–µ–љ–љ–Њ–µ, –њ—А–Њ—В–Є–≤–Њ—А–≤–Њ—В–љ–Њ–µ, –∞–љ–Ї—Б–Є–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–µ, –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –Є –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ. –Ф–∞–љ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –±—Л–ї–Є –і–Њ–Ї–∞–Ј–∞–љ—Л –љ–∞ –Є–Љ–Љ—Г–љ–Њ–≥–µ–љ–љ–Њ–є –ґ–Є–≤–Њ—В–љ–Њ–є –Љ–Њ–і–µ–ї–Є —А–∞—Б—Б–µ—П–љ–љ–Њ–≥–Њ —Б–Ї–ї–µ—А–Њ–Ј–∞ [14]. –≠–Ї—Б—В—А–∞–Ї—В –Ї–∞–љ–љ–∞–±–Є—Б–∞ —Б —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ —Н–Ї–≤–Є–Љ–Њ–ї—П—А–љ–Њ–≥–Њ —В–µ—В—А–∞–≥–Є–і—А–Њ–Ї–∞–љ–љ–∞–±–Є–љ–Њ–ї–∞ –±—Л–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –≤ —Б–≤–Њ–µ–Љ —Б–њ–∞–Ј–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–Љ –і–µ–є—Б—В–≤–Є–Є, —З–µ–Љ –Њ–і–Є–љ –ї–Є—И—М —В–µ—В—А–∞–≥–Є–і—А–Њ–Ї–∞–љ–љ–∞–±–Є–љ–Њ–ї. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г —Н–Ї—Б—В—А–∞–Ї—В, –љ–µ —Б–Њ–і–µ—А–ґ–∞—Й–Є–є —В–µ—В—А–∞–≥–Є–і—А–Њ–Ї–∞–љ–љ–∞–±–Є–љ–Њ–ї–∞, –њ—А–Є –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–Љ –Є–Ј—Г—З–µ–љ–Є–Є –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Є–ї—М–љ–Њ–≥–Њ –∞–љ—В–Є—Б–њ–∞—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞, —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л —Н–Ї—Б—В—А–∞–Ї—В–∞ –Ї–∞–љ–љ–∞–±–Є—Б–∞, –≤–µ—А–Њ—П—В–љ–Њ –Ї–∞–љ–љ–∞–±–Є–і–Є–Њ–ї, –Љ–Њ–≥—Г—В –≤—Л–Ј—Л–≤–∞—В—М —Н—Д—Д–µ–Ї—В—Л —Б–Є–љ–µ—А–≥–Є–Є [15, 16]. –≠—В–Њ—В —Д–∞–Ї—В –Љ–Њ–≥ –±—Л –Њ–±—К—П—Б–љ–Є—В—М –±–Њ–ї–µ–µ —Б–Є–ї—М–љ—Г—О —Б–њ–∞–Ј–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н–Ї—Б—В—А–∞–Ї—В–∞.
–Я—А–Є–Љ–µ—А 2. –Т —Б–≤–Њ–µ –≤—А–µ–Љ—П –њ—А–Њ–≤–µ–і–µ–љ—Л –±–Њ–ї–µ–µ 40 –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –Є–Ј—Г—З–µ–љ–Є—О —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Н–Ї—Б—В—А–∞–Ї—В–∞ –Ј–≤–µ—А–Њ–±–Њ—П, –Ї–Њ—В–Њ—А—Л–є –њ–Њ–Ї–∞–Ј–∞–љ –њ—А–Є –ї–µ–≥–Ї–Њ–є, —Б—А–µ–і–љ–µ–є –Є –і–∞–ґ–µ —Г–Љ–µ—А–µ–љ–љ–Њ —В—П–ґ–µ–ї–Њ–є –і–µ–њ—А–µ—Б—Б–Є–Є. –Т —В–Њ–Љ –ґ–µ —З–Є—Б–ї–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—Б–Є—Е–Њ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є (–љ–∞–њ—А–Є–Љ–µ—А, –Є–Љ–Є–њ—А–∞–Љ–Є–љ–Њ–Љ, —Д–ї—Г–Љ–∞–Ј–µ–љ–Є–ї–Њ–Љ, —Д–ї—Г–Њ–Ї—Б–µ—В–Є–љ–Њ–Љ –Є–ї–Є –∞–Љ–Є—В—А–Є–њ—В–Є–ї–Є–љ–Њ–Љ) [17вАУ19]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П, –њ–Њ –і–∞–љ–љ—Л–Љ –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Є–Љ–µ–µ—В—Б—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е —Н–Ї—Б—В—А–∞–Ї—В–∞ –Ј–≤–µ—А–Њ–±–Њ—П вАУ –≥–Є–њ–µ—А—Д–Њ—А–Є–љ, –≥–Є–њ–µ—А–µ—Ж–Є–љ, –∞–Љ–µ–љ—В–Њ—Д–ї–∞–≤–Њ–љ, —А—Г—В–Є–љ –Є –≥–Є–њ–µ—А–Њ–Ј–Є–і [20вАУ21]. –≠—В–Є –≤–µ—Й–µ—Б—В–≤–∞ –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ –Њ–Ї–∞–Ј—Л–≤–∞–µ–Љ—Л–є –Ј–≤–µ—А–Њ–±–Њ–µ–Љ —Н—Д—Д–µ–Ї—В. –Т –љ–µ–є—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є –¶–Э–° —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–≤—П–Ј—Л–≤–∞—О—Й–Є—Е —А–∞–і–Є–Њ–ї–Є–≥–∞–љ–і–Њ–≤ in vitro –±—Л–ї–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ –Ј–≤–µ—А–Њ–±–Њ—П, –Ї–Њ—В–Њ—А–∞—П –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ–Љ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –µ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤. –Т –Ї–∞—З–µ—Б—В–≤–µ –Љ–Є—И–µ–љ–µ–є –і–ї—П –≤—Б–µ—Е –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Ј–≤–µ—А–Њ–±–Њ—П –≤—Л—Б—В—Г–њ–∞—О—В –њ—А–µ- –Є –њ–Њ—Б—В—Б–Є–љ–∞–њ—В–Є—З–µ—Б–Ї–Є–µ –љ–µ–є—А–Њ–љ—Л, –≥–Є–њ–Њ—В–∞–ї–∞–Љ—Г—Б –Є –≥–Є–њ–Њ—Д–Є–Ј [22].
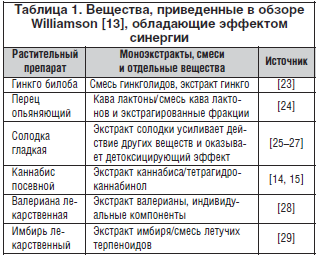
–Я—А–Є–Љ–µ—А 3. –Х—Й–µ –Њ–і–Є–љ –њ—А–Є–Љ–µ—А –Љ–љ–Њ–≥–Њ—Ж–µ–ї–µ–≤–Њ–≥–Њ –њ—А–Є–љ—Ж–Є–њ–∞ —В–µ—А–∞–њ–Є–Є вАУ —Н—В–Њ –њ—А–µ–њ–∞—А–∞—В –Ш–±–µ—А–Њ–≥–∞—Б—В¬Ѓ, –Ї–Њ—В–Њ—А—Л–є —Б–Њ—Б—В–Њ–Є—В –Є–Ј –і–µ–≤—П—В–Є —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ –Є –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –≤–µ–і—Г—Й–µ–≥–Њ —Д–Є—В–Њ–њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –і–Є—Б–њ–µ–њ—Б–Є–Є –Є –Љ–Њ—В–Њ—А–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –Ї–Є—И–µ—З–љ–Є–Ї–∞. –Ф–≤–µ–љ–∞–і—Ж–∞—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –і–≤–∞ –њ–Њ—Б–≤—П—Й–µ–љ—Л —Б—А–∞–≤–љ–µ–љ–Є—О –Ш–±–µ—А–Њ–≥–∞—Б—В–∞ —Б —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є —Ж–Є–Ј–∞–њ—А–Є–і–Њ–Љ –Є –Љ–µ—В–Њ–Ї–ї–Њ–њ—А–∞–Љ–Є–і–Њ–Љ, –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –њ–Њ–ї–љ—Г—О —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї—Г—О —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ—Б—В—М –Ш–±–µ—А–Њ–≥–∞—Б—В–∞ —Б —В–µ–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ, —З—В–Њ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ —Д–Є—В–Њ–њ—А–µ–њ–∞—А–∞—В–∞ —А–∞–Ј–≤–Є–≤–∞–ї–Њ—Б—М –Љ–µ–љ—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ш–±–µ—А–Њ–≥–∞—Б—В–∞ —Б–≤—П–Ј–∞–љ–∞ —Б –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–µ–є –љ–∞—А—Г—И–µ–љ–љ–Њ–є –Љ–Њ—В–Њ—А–Є–Ї–Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –Ј–∞ —Б—З–µ—В —Б–љ–Є–ґ–µ–љ–Є—П –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–є –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—Г—В–µ–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є, –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є –Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –∞—Д—Д–µ—А–µ–љ—В–љ—Л–µ –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л–µ –љ–µ—А–≤–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞.
–Т –Њ—В–ї–Є—З–Є–µ –Њ—В —Н—В–Њ–≥–Њ –Љ—Г–ї—М—В–Є—Д–Є—В–Њ–њ—А–µ–њ–∞—А–∞—В–∞ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ–Њ–љ–Њ–њ—А–µ–њ–∞—А–∞—В—Л —Ж–Є–Ј–∞–њ—А–Є–і –Є –Љ–µ—В–Њ–Ї–ї–Њ–њ—А–∞–Љ–Є–і —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —Г—Б—В—А–∞–љ–µ–љ–Є—О —В–Њ–ї—М–Ї–Њ –Њ–і–љ–Њ–≥–Њ —Б–Є–Љ–њ—В–Њ–Љ–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –і–Є—Б–њ–µ–њ—Б–Є–Є. –Ъ–∞–ґ–і—Л–є —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–є —Н–Ї—Б—В—А–∞–Ї—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ –љ–∞ –≤—Б–µ—Е —А–µ–ї–µ–≤–∞–љ—В–љ—Л—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–Њ–і–µ–ї—П—Е in vitro –Є in vivo. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –≤—Б–µ —Н–Ї—Б—В—А–∞–Ї—В—Л —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В (–љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Ј –љ–Є—Е —Б–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є) –Њ–±—Й–µ–Љ—Г —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ—Г —Н—Д—Д–µ–Ї—В—Г (—А–Є—Б. 3).
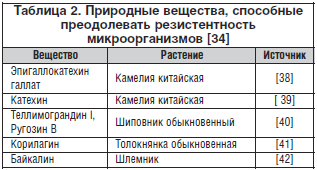
–Т —В–∞–±–ї–Є—Ж–µ 1 –њ—А–Є–≤–µ–і–µ–љ—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –њ—А–Є–Љ–µ—А—Л –Љ–Њ–љ–Њ—Н–Ї—Б—В—А–∞–Ї—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–ї–∞–і–∞—О—В —Н—Д—Д–µ–Ї—В–Њ–Љ —Б–Є–љ–µ—А–≥–Є–Є (—В–∞–Ї–Њ–є –≤—Л–≤–Њ–і –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б—Г–±—Д—А–∞–Ї—Ж–Є–є –Є –Њ—В–і–µ–ї—М–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є –Њ–і–Є–љ–Њ—З–љ—Л—Е —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤).
2. –§–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л: —Г–ї—Г—З—И–µ–љ–Є–µ —А–∞—Б—В–≤–Њ—А–Є–Љ–Њ—Б—В–Є, —Б–Ї–Њ—А–Њ—Б—В–Є —А–µ–Ј–Њ—А–±—Ж–Є–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є
–Э–µ –Є—Б–Ї–ї—О—З–µ–љ —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ—Л–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П –≤ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е —Н–Ї—Б—В—А–∞–Ї—В–∞—Е вАУ —Е–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ—Л–µ –≤ —Д–Є—В–Њ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є–Є –≤–µ—Й–µ—Б—В–≤–∞, –Ї–Њ—В–Њ—А—Л–µ —З–∞—Б—В–Њ –љ–µ –Њ–±–ї–∞–і–∞—О—В —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, –љ–∞–њ—А–Є–Љ–µ—А –њ–Њ–ї–Є—Д–µ–љ–Њ–ї—Л –Є–ї–Є —Б–∞–њ–Њ–љ–Є–љ—Л, –љ–Њ –Љ–Њ–≥—Г—В —Г–ї—Г—З—И–∞—В—М —А–∞—Б—В–≤–Њ—А–Є–Љ–Њ—Б—В—М –Є/–Є–ї–Є —Б–Ї–Њ—А–Њ—Б—В—М —А–µ–Ј–Њ—А–±—Ж–Є–Є –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –≤ —Н–Ї—Б—В—А–∞–Ї—В–µ –Є —В–µ–Љ —Б–∞–Љ—Л–Љ –њ–Њ–≤—Л—И–∞—В—М –µ–≥–Њ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М, –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—П –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н–Ї—Б—В—А–∞–Ї—В–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–Њ–љ–Њ–њ—А–µ–њ–∞—А–∞—В–Њ–Љ. –Э–∞–њ—А–Є–Љ–µ—А, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н–Ї—Б—В—А–∞–Ї—В–∞ –ї–Є—Б—В—М–µ–≤ –±–µ–ї–ї–∞–і–Њ–љ–љ—Л —Б–Њ —Б–≤–Њ–Є–Љ –Њ—Б–љ–Њ–≤–љ—Л–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ LвАУ–≥–Є–Њ—Б—Ж–Є–∞–Љ–Є–љ–Њ–Љ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –љ–∞–ї–Є—З–Є–µ–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е —Д–ї–∞–≤–Њ–љ–Њ–ї-—В—А–Є–≥–ї–Є–Ї–Њ–Ј–Є–і–Њ–≤ –≤ —Н–Ї—Б—В—А–∞–Ї—В–µ, –Ї–Њ—В–Њ—А—Л–µ –і–µ–є—Б—В–≤—Г—О—В –Ї–∞–Ї –Ї–∞—В–∞–ї–Є–Ј–∞—В–Њ—А —А–µ–Ј–Њ—А–±—Ж–Є–Є [30]. –Х—Й–µ –Њ–і–Є–љ –њ—А–Є–Љ–µ—А вАУ —Н–Ї—Б—В—А–∞–Ї—В –∞–Љ–Љ–Є –Ј—Г–±–љ–Њ–є. –Х–µ –Њ—Б–љ–Њ–≤–љ—Л–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ —П–≤–ї—П–µ—В—Б—П –Ї–µ–ї–ї–Є–љ, –Ї–Њ—В–Њ—А—Л–є —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ–Њ–ї–љ–Њ—Б—В—М—О –±–Є–Њ–і–Њ—Б—В—Г–њ–љ—Л–Љ —Г–ґ–µ —З–µ—А–µ–Ј 10 –Љ–Є–љ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б —З–Є—Б—В—Л–Љ —Н–Ї–≤–Є–Љ–Њ–ї—П—А–љ—Л–Љ –Ї–µ–ї–ї–Є–љ–Њ–Љ, –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 60 –Љ–Є–љ [31].
–Р–љ–∞–ї–Њ–≥–Є—З–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –≤–µ—Й–µ—Б—В–≤–∞, —Б–≤—П–Ј–∞–љ–љ–Њ–µ —Б –њ–Њ–ї–Є—Д–µ–љ–Њ–ї—М–љ—Л–Љ–Є –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ—Л–Љ–Є –≤–µ—Й–µ—Б—В–≤–∞–Љ–Є, –≤—Е–Њ–і—П—Й–Є–Љ–Є –≤ —Б–Њ—Б—В–∞–≤ —Н–Ї—Б—В—А–∞–Ї—В–∞, –±—Л–ї–Њ –љ–µ–і–∞–≤–љ–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –≤ —А–∞–±–Њ—В–µ Butterweck –Є —Б–Њ–∞–≤—В. [21]. –У–Є–њ–µ—А–Є—Ж–Є–љ –Є–Ј –Ј–≤–µ—А–Њ–±–Њ—П –њ—А–Њ–і—Л—А—П–≤–ї–µ–љ–љ–Њ–≥–Њ, –Ї–Њ—В–Њ—А—Л–є –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–ї—Б—П –Ї–∞–Ї –Њ—Б–љ–Њ–≤–љ–Њ–є –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В, —Б–∞–Љ –њ–Њ —Б–µ–±–µ –Њ–±–ї–∞–і–∞–µ—В –ї–Є—И—М —Б–ї–∞–±—Л–Љ –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–љ—Л–Љ (–Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–Љ –Љ–Њ–љ–Њ–∞–Љ–Є–љ–Њ–Ї—Б–Є–і–∞–Ј—Л) —Н—Д—Д–µ–Ї—В–Њ–Љ, –њ–Њ—В–Њ–Љ—Г —З—В–Њ –µ–≥–Њ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –Ї—А–∞–є–љ–µ –љ–Є–Ј–Ї–∞. –Ю–і–љ–∞–Ї–Њ –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –≥–Є–њ–µ—А–Є—Ж–Є–љ–∞ —Б –њ–Њ–ї–Є—Д–µ–љ–Њ–ї–Њ–Љ —Н–њ–Є–Ї–∞—В–µ—Е–Є–љ–Њ–Љ, –њ—А–Њ—Ж–Є–∞–љ–Є–і–Є–љ–Њ–Љ, –≥–Є–њ–µ—А–Њ–Ј–Є–і–Њ–Љ –Є–ї–Є —А—Г—В–Є–љ–Њ–Љ, –Ї–Њ—В–Њ—А—Л–µ –Њ–±—Л—З–љ–Њ –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—В –≤ —Н–Ї—Б—В—А–∞–Ї—В–µ, –њ–ї–∞–Ј–Љ–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –≥–Є–њ–µ—А–Є—Ж–Є–љ–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П, —З—В–Њ –≤—Л–Ј—Л–≤–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ—Г—О –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М [32].
3. –≠—Д—Д–µ–Ї—В —Б–Є–љ–µ—А–≥–Є–Є –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є
–Ґ—А–µ—В–Є–є –≤–∞—А–Є–∞–љ—В —Н—Д—Д–µ–Ї—В–Њ–≤ —Б–Є–љ–µ—А–≥–Є–Є –Є–Ј–≤–µ—Б—В–µ–љ –≤ —В–µ—З–µ–љ–Є–µ –Љ–љ–Њ–≥–Є—Е –ї–µ—В. –Ю–љ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ —Б –≤–µ—Й–µ—Б—В–≤–∞–Љ–Є, —Б–њ–Њ—Б–Њ–±–љ—Л–Љ–Є –њ–Њ–ї–љ–Њ—Б—В—М—О –Є–ї–Є —З–∞—Б—В–Є—З–љ–Њ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–є. –°–∞–Љ—Л–є –Є–Ј–≤–µ—Б—В–љ—Л–є –њ—А–Є–Љ–µ—А —В–∞–Ї–Њ–≥–Њ —Б–Њ—З–µ—В–∞–љ–Є—П вАУ пГҐ-–ї–∞–Ї—В–∞–Љ–∞–Ј–љ—Л–є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ —Б –Ї–ї–∞–≤—Г–ї–∞–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є (—Б—Г–ї—М–±–∞–Ї—В–∞–Љ –Є–ї–Є —В–∞–Ј–Њ–±–∞–Ї—В–∞–Љ), –Ї–Њ—В–Њ—А—Л–є —Г—Б–њ–µ—И–љ–Њ –Є–љ–≥–Є–±–Є—А—Г–µ—В –і–µ–є—Б—В–≤–Є–µ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞–Ј—Л [33].
–†–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ —Г –±–∞–Ї—В–µ—А–Є–є —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –њ–Њ —В—А–µ–Љ –њ—А–Є—З–Є–љ–∞–Љ: 1) –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П —Г—З–∞—Б—В–Ї–∞ –±–∞–Ї—В–µ—А–Є–Є, –Ї–Њ—В–Њ—А—Л–є —П–≤–ї—П–µ—В—Б—П –Љ–Є—И–µ–љ—М—О –і–ї—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞; 2) –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є —А–∞–Ј—А—Г—И–∞—О—В –Є–ї–Є –Є–Ј–Љ–µ–љ—П—О—В —Д–µ—А–Љ–µ–љ—В—Л, –њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ—Л–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ–Є; 3) —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –±–∞—А—М–µ—А, –њ—А–µ–њ—П—В—Б—В–≤—Г—О—Й–Є–є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–Љ—Г –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞ [34].
–Я–µ—А–≤–∞—П –њ—А–Є—З–Є–љ–∞ –њ—А–µ–Њ–і–Њ–ї–µ–≤–∞–µ—В—Б—П –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ—Б–≤—П–Ј—Л–≤–∞—О—Й–Є–Љ–Є –±–µ–ї–Ї–∞–Љ–Є. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –Є–Љ–µ–µ—В—Б—П –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—А–Є—А–Њ–і–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –Ї–Њ—В–Њ—А—Л–µ —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–µ–Њ–і–Њ–ї–µ–≤–∞—В—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –љ–∞–њ—А–Є–Љ–µ—А, —Н–њ–Є–≥–∞–ї–ї–Њ–Ї–∞—В–µ—Е–Є–љ –≥–∞–ї–ї–∞—В (EGCG) –і–µ–є—Б—В–≤—Г–µ—В –≤–Љ–µ—Б—В–µ —Б пГҐ-–ї–∞–Ї—В–∞–Љ–∞–Ј–љ—Л–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–Љ, –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—П –љ–∞ –њ–µ–њ—В–Є–і–Њ–≥–ї–Є–Ї–∞–љ–Њ–≤—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л –Ї–ї–µ—В–Њ—З–љ–Њ–є —Б—В–µ–љ–Ї–Є –±–∞–Ї—В–µ—А–Є–є [35, 36]. –Ф—А—Г–≥–Є–µ –≤–µ—Й–µ—Б—В–≤–∞ –і–µ–є—Б—В–≤—Г—О—В –Ї–∞–Ї –Є–љ–≥–Є–±–Є—В–Њ—А—Л —В–Њ–њ–Њ–Є–Ј–Њ–Љ–µ—А–∞–Ј—Л IV –Є–ї–Є —Б–Є–љ—В–µ–Ј–∞ –†–Э–Ъ.
–Я—А–µ–Њ–і–Њ–ї–µ–љ–Є–µ –≤—В–Њ—А–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–Є –ї–∞–Ї—В–∞–Љ–∞–Ј –Є–ї–Є –і—А—Г–≥–Є—Е —А–∞—Б—Й–µ–њ–ї—П—О—Й–Є—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –≥–µ–љ–µ—А–Є—А—Г—О—В—Б—П –±–∞–Ї—В–µ—А–Є—П–Љ–Є. –Т –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ EGCG —В–∞–Ї–ґ–µ –њ–Њ–Љ–Њ–≥–∞–µ—В –њ—А–µ–Њ–і–Њ–ї–µ–≤–∞—В—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М, –љ–∞–њ—А–Є–Љ–µ—А, –Ј–Њ–ї–Њ—В–Є—Б—В–Њ–≥–Њ —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–∞ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–∞ [37].
–Т —В—А–µ—В—М–µ–Љ —Б–ї—Г—З–∞–µ —А–∞–Ј–≤–Є—В–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Б–≤—П–Ј–∞–љ–Њ —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є —Б—В–µ–љ–Ї–Є –±–∞–Ї—В–µ—А–Є–Є –і–ї—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –Є/–Є–ї–Є –≤—Л–Ї–∞—З–Є–≤–∞–љ–Є–µ–Љ –µ–≥–Њ –Є–Ј –Ї–ї–µ—В–Ї–Є (¬Ђefflux pump¬ї) –±—Л—Б—В—А–µ–µ, —З–µ–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї –њ–Њ—А–∞–Ј–Є—В —Б–≤–Њ–Є –Љ–Є—И–µ–љ–Є. –Ю–±—Л—З–љ–Њ –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–µ –≤–µ—Й–µ—Б—В–≤–∞ —Б–∞–Љ–Є –њ–Њ —Б–µ–±–µ –љ–µ —П–≤–ї—П—О—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –љ–Њ –Њ–Ї–∞–Ј—Л–≤–∞–µ–Љ–Њ–µ –Є–Љ–Є –і–µ–є—Б—В–≤–Є–µ –Є–Ј–Љ–µ–љ—П–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤.
–Я—А–Є—А–Њ–і–љ—Л–µ –≤–µ—Й–µ—Б—В–≤–∞, —Б–њ–Њ—Б–Њ–±–љ—Л–µ –њ—А–µ–Њ–і–Њ–ї–µ–≤–∞—В—М —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 2.
–Я—А–Є–Љ–µ—А 1. –†–µ–Ј–µ—А–њ–Є–љ [43, 44] –Є –Ї–∞—А–љ–Њ–Ј–љ–∞—П –Ї–Є—Б–ї–Њ—В–∞ —А–Њ–Ј–Љ–∞—А–Є–љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ [45] –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–Љ –≤–µ—Й–µ—Б—В–≤–∞–Љ, –Њ–±–ї–∞–і–∞—О—Й–Є–Љ —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М –љ–∞—Б–Њ—Б–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –±–∞–Ї—В–µ—А–Є–є –Є —Б–љ–Є–ґ–∞—В—М –Є—Е –∞–Ї—В–Є–≤–љ–Њ—Б—В—М.
–Я—А–Є–Љ–µ—А 2. –Ґ–Є–Љ–Њ–ї –Є –Ї–∞—А–≤–∞–Ї—А–Њ–ї, –і–≤–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є—П, –≤—Е–Њ–і—П—Й–Є–µ –≤ —Б–Њ—Б—В–∞–≤ —Н—Д–Є—А–љ–Њ–≥–Њ –Љ–∞—Б–ї–∞ —В–Є–Љ—М—П–љ–∞ –Њ–±—Л–Ї–љ–Њ–≤–µ–љ–љ–Њ–≥–Њ, –≤—Л—Б—В—Г–њ–∞—О—В –≤ –Ї–∞—З–µ—Б—В–≤–µ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е ¬Ђ–Љ–µ–Љ–±—А–∞–љ–љ—Л—Е –њ–µ—А–Љ–Є–∞–±–Є–ї–Є–Ј–∞—В–Њ—А–Њ–≤¬ї, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ —З–µ—А–µ–Ј –Љ–µ–Љ–±—А–∞–љ—Г –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є. –Ы–Є—Б—В—М—П –ґ–µ —А–∞—Б—В–µ–љ–Є—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ —Б–Њ–і–µ—А–ґ–∞—В –±–∞–є–Ї–∞–ї–µ–Є–љ вАУ 5,6,7-—В—А–Є–≥–Є–і—А–Њ–Ї—Б–Є—Д–ї–∞–≤–Њ–љ –Є –µ–≥–Њ –≥–ї–Є–Ї–Њ–Ј–Є–і вАУ 7-–Ї–Є—Б–ї–Њ—В–∞ –≥–ї—О–Ї—Г—А–Њ–љ–Њ–≤–∞—П вАУ –±–∞–є–Ї–∞–ї–Є–љ, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–є –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е –≤–Є–і–∞—Е —И–ї–µ–Љ–љ–Є–Ї–∞. –≠—В–Є —Д–ї–∞–≤–Њ–љ–Њ–Є–і—Л –Њ–±–ї–∞–і–∞—О—В –і–≤—Г–Љ—П –њ—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ—Л–Љ–Є —Б–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є —Б —В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ–Њ–≤—Л–Љ–Є –Є пГҐ-–ї–∞–Ї—В–∞–Љ–∞–Ј–љ—Л–Љ–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є –њ—А–Њ—В–Є–≤ –Љ–µ—В–Є—Ж–Є–ї–ї–Є–љ—Г—Б—В–Њ–є—З–Є–≤–Њ–≥–Њ –Ј–Њ–ї–Њ—В–Є—Б—В–Њ–≥–Њ —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–∞ (–Ь–£–Ч–°) [46]. –С–∞–є–Ї–∞–ї–µ–Є–љ –Є–љ–≥–Є–±–Є—А—Г–µ—В —В—А–∞–љ—Б–њ–Њ—А—В —В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ–∞ –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –≤–ї–Є—П–љ–Є—П –љ–∞ –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л–є –Ј–∞ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є–µ —Д–ї–∞–≤–Њ–љ–Њ–Є–і–Њ–≤ –≥–µ–љ tetK. –Я—А–Є —Н—В–Њ–Љ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–∞—П –Є–љ–≥–Є–±–Є—А—Г—О—Й–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ–∞ –њ—А–Њ—В–Є–≤ –Ь–£–Ч–°, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–∞—П 4 –Љ–≥/–Љ–ї, —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П. –Ю—В–і–µ–ї—М–љ–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–є –±–∞–є–Ї–∞–ї–µ–Є–љ —В–∞–Ї–ґ–µ –Є–Љ–µ–µ—В —Н—Д—Д–µ–Ї—В —Б–Є–љ–µ—А–≥–Є–Є —Б пГҐ-–ї–∞–Ї—В–∞–Љ–∞–Ј–љ—Л–Љ–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є –њ—А–Њ—В–Є–≤ —И—В–∞–Љ–Љ–Њ–≤ –Ь–£–Ч–°, –Ї–Њ—В–Њ—А—Л–µ –љ–µ —Б–Њ–і–µ—А–ґ–∞—В tetK-–≥–µ–љ–Њ–≤.
–Я—А–Є–Љ–µ—А 3. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В —Б–Є–љ–µ—А–≥–Є–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ —В–∞–Ї–ґ–µ –Љ–µ–ґ–і—Г –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ–Є —Е–Љ–µ–ї—П –Њ–±—Л–Ї–љ–Њ–≤–µ–љ–љ–Њ–≥–Њ вАУ –Ї—Б–∞–љ—В–Њ—Е—Г–Љ–Њ–ї–Њ–Љ –Є –ї—Г–њ—Г–ї–Є–љ–Њ–Љ вАУ –Є –љ–µ–Ї–Њ—В–Њ—А—Л–Љ–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є (–њ–Њ–ї–Є–Љ–Є–Ї—Б–Є–љ–Њ–Љ, —В–Њ–±—А–∞–Љ–Є—Ж–Є–љ–Њ–Љ –Є–ї–Є —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–Њ–Љ –Є –і—А.) –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≥—А–∞–Љ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е –Є, –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, –≥—А–∞–Љ–Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є [47].
–Я—А–Є–Љ–µ—А 4. –Я—А–Є –ї–µ—З–µ–љ–Є–Є –∞–Љ—Д–Њ—В–µ—А–Є—Ж–Є–љ–Њ–Љ –Љ—Л—И–µ–є, –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е Candida Albicans, –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —Н–Ї—Б—В—А–∞–Ї—В–Њ–Љ –≤–Є–љ–Њ–≥—А–∞–і–љ—Л—Е –Ї–Њ—Б—В–Њ—З–µ–Ї –Є–Ј –≤–Є–љ–Њ–≥—А–∞–і–∞ –Ї—Г–ї—М—В—Г—А–љ–Њ–≥–Њ –≤—Л—П–≤–ї–µ–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–Њ–є, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–ї—Г—З–∞–ї–∞ —В–Њ–ї—М–Ї–Њ –∞–Љ—Д–Њ—В–µ—А–Є—Ж–Є–љ [48].
–Я—А–Є–Љ–µ—А 5. –Ш–љ—В–µ—А–µ—Б–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –±–µ—А–±–µ—А–Є–љ —В–∞–Ї–ґ–µ –Њ–±–ї–∞–і–∞–µ—В —Н—Д—Д–µ–Ї—В–Њ–Љ —Б–Є–љ–µ—А–≥–Є–Є –њ—А–Њ—В–Є–≤ –Ї–∞–љ–і–Є–і–Њ–Ј–∞ —Г –Љ—Л—И–µ–є [49]. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Н—Д–Є—А–љ—Л—Е –Љ–∞—Б–µ–ї —Б –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л–Љ –Є –њ—А–Њ—В–Є–≤–Њ–≥—А–Є–±–Ї–Њ–≤—Л–Љ —Н—Д—Д–µ–Ї—В–∞–Љ–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –Є –≤—Б–µ –µ—Й–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –≤–љ—Г—В—А—М –і–ї—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–≥–Њ –ї–µ—З–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є, –∞ —В–∞–Ї–ґ–µ –љ–∞—А—Г–ґ–љ–Њ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Ї–Њ–ґ–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є, —В–Њ –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –љ–µ–і–∞–≤–љ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –і–ї—П —Г–ї—Г—З—И–µ–љ–Є—П –њ—А–Њ—В–Є–≤–Њ–Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –Є —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –±—Л–ї–Є –Њ–±—К–µ–і–Є–љ–µ–љ—Л —Н—Д–Є—А–љ—Л–µ –Љ–∞—Б–ї–∞ –≤–Љ–µ—Б—В–µ —Б –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є. –Т–њ–µ—А–≤—Л–µ –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ in vitro —Б —Н—Д–Є—А–љ—Л–Љ–Є –Љ–∞—Б–ї–∞–Љ–Є –і—Г—И–Є—Ж—Л –Њ–±—Л–Ї–љ–Њ–≤–µ–љ–љ–Њ–є, –њ–µ–ї–∞—А–≥–Њ–љ–Є–Є –∞—А–Њ–Љ–∞—В–љ–Њ–є –Є —З–∞–є–љ–Њ–≥–Њ –і–µ—А–µ–≤–∞ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –љ–Њ—А—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–Њ–Љ –Є –∞–Љ—Д–Њ—В–µ—А–Є—Ж–Є–љ–Њ–Љ –Т –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л —А–∞–Ј–ї–Є—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —Б–Є–љ–µ—А–≥–Є–Є –њ—А–Њ—В–Є–≤ Bacillus cereus, B. subtilis, –Ї–Є—И–µ—З–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Є, –Ј–Њ–ї–Њ—В–Є—Б—В–Њ–≥–Њ —Б—В–∞—Д–Є–ї–Њ–Ї–Њ–Ї–Ї–∞ –Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —И—В–∞–Љ–Љ–Њ–≤ Candida, —Б –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –і–Њ–Ј—Л –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ [50, 51].
–Ю–і–љ–Њ–є –Є–Ј –≤–∞–ґ–љ—Л—Е –њ—А–Њ–±–ї–µ–Љ —З–µ–ї–Њ–≤–µ—З–µ—Б—В–≤–∞ —Б—В–∞–ї–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ–Њ–ї–Є–≤–∞–ї–µ–љ—В–љ–Њ–є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї —И—В–∞–Љ–Љ–∞–Љ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –Є –Љ–∞–ї—П—А–Є–Є. –°–Њ–≥–ї–∞—Б–љ–Њ —Б—В–∞—В–Є—Б—В–Є–Ї–µ –Т–Ю–Ч (2004), 2 –Љ–ї–љ —З–µ–ї–Њ–≤–µ–Ї —Г–Љ–Є—А–∞—О—В –Њ—В —Н—В–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –µ–ґ–µ–≥–Њ–і–љ–Њ, –≤ —Б—А–µ–і–љ–µ–Љ —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–ї—П–µ—В 50вАУ80% –≤ —В–µ—З–µ–љ–Є–µ 4вАУ16 –љ–µ–і. —Б –Љ–Њ–Љ–µ–љ—В–∞ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–Є–∞–≥–љ–Њ–Ј–∞. –Ч–љ–∞—З–Є–Љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є –≤ –±–Њ—А—М–±–µ —Б —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ —П–≤–ї—П–µ—В—Б—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Љ–Є–Ї–Њ–±–∞–Ї—В–µ—А–Є–є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ —Б–Њ—Е—А–∞–љ—П—В—М—Б—П –≤ –Љ–∞–Ї—А–Њ—Д–∞–≥–∞—Е –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є, —В. –µ. –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –і–Њ–ї–ґ–љ—Л –≤–Њ–Ј–і–µ–є—Б—В–≤–Њ–≤–∞—В—М –Є –љ–∞ —Н—В–Є ¬Ђ—Б–њ—П—Й–Є–µ –±–∞–Ї—В–µ—А–Є–Є¬ї –≤ –Љ–∞–Ї—А–Њ—Д–∞–≥–∞—Е. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –і–µ—Б—П—В–Є–ї–µ—В–Є—П –і–Њ–ї–≥–Є—Е –њ–Њ–Є—Б–Ї–Њ–≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –љ–∞—В—Г—А–∞–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤, –Њ–љ–Є –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ –љ–∞–є–і–µ–љ—Л. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤ –ї–µ—З–µ–љ–Є–µ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є —Б —Н—Д—Д–µ–Ї—В–Њ–Љ —Б–Є–љ–µ—А–≥–Є–Є —Б–Љ–Њ–≥–ї–Њ –±—Л —Б—Л–≥—А–∞—В—М –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Г—О —А–Њ–ї—М.
–£–ґ–µ –±—Л–ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ—Л –њ–µ—А–≤—Л–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В—Л –њ–Њ –Њ–±—К–µ–і–Є–љ–µ–љ–Є—О –њ—А–Є—А–Њ–і–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ —Б –Є–Ј–≤–µ—Б—В–љ—Л–Љ–Є —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, —В–∞–Ї–Є–Љ–Є –Ї–∞–Ї –Є–Ј–Њ–љ–Є–Њ–Ј–Є–і, —Н—В–∞–Љ–±—Г—В–Њ–ї, —Б—В—А–µ–њ—В–Њ–Љ–Є—Ж–Є–љ –Є–ї–Є –њ–Є—А–∞–Ј–Є–љ–∞–Љ–Є–і, –Є –і–Њ—Б—В—Г–њ–љ—Л –Є—Е –њ–µ—А–≤—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л.
4. –£—Б—В—А–∞–љ–µ–љ–Є–µ –Є–ї–Є –љ–µ–є—В—А–∞–ї–Є–Ј–∞—Ж–Є—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –≤–µ—Й–µ—Б—В–≤, —Г–ґ–µ —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е—Б—П –≤ —Н–Ї—Б—В—А–∞–Ї—В–µ –Є–ї–Є –і–Њ–±–∞–≤–ї–µ–љ–љ—Л—Е –Ї –љ–µ–Љ—Г
–≠—В–Њ —З–µ—В–≤–µ—А—В—Л–є —Н—Д—Д–µ–Ї—В —Б–Є–љ–µ—А–≥–Є–Є, –Ї–Њ—В–Њ—А—Л–є —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –≤ —В–Њ–Љ —Б–ї—Г—З–∞–µ, –Ї–Њ–≥–і–∞ —Б–Њ—Б—В–∞–≤–љ–∞—П —З–∞—Б—В—М —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ —Н–Ї—Б—В—А–∞–Ї—В–∞ –Є–ї–Є –≤–µ—Й–µ—Б—В–≤–Њ, –Ї–Њ—В–Њ—А–Њ–µ –і–Њ–±–∞–≤–ї—П—О—В –Ї –љ–µ–Љ—Г, –љ–µ–є—В—А–∞–ї–Є–Ј—Г–µ—В —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –і—А—Г–≥–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–≥–Њ —Н–Ї—Б—В—А–∞–Ї—В–∞ –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –±–Њ–ї—М—И–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ. –Я—А–Є–Љ–µ—А—Л —В–∞–Ї–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Љ—Л –љ–∞—Е–Њ–і–Є–Љ –≤ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є –Ї–Є—В–∞–є—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ, –≥–і–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —В–µ—А–Љ–Є–љ ¬Ђ–њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –Њ–±—А–∞–±–Њ—В–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л¬ї, –Њ–Ј–љ–∞—З–∞—О—Й–Є–є, —З—В–Њ –њ—А–µ–њ–∞—А–∞—В –њ–Њ–і–≤–µ—А–≥–∞–ї—Б—П –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–µ вАУ –љ–∞–≥—А–µ–≤–∞–ї—Б—П –Є–ї–Є –Ї –љ–µ–Љ—Г –і–Њ–±–∞–≤–ї—П–ї—Б—П —Б–њ–Є—А—В –Є —В. –і. [52].
–Ґ–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є –њ–Њ–і—Е–Њ–і
–Т –њ—А–µ–і—Л–і—Г—Й–µ–є —З–∞—Б—В–Є —Н—В–Њ–≥–Њ –Њ–±–Ј–Њ—А–∞ –Њ–њ–Є—Б–∞–љ—Л —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Л–µ in vitro –Є in vivo, —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Є –Њ–њ—А–µ–і–µ–ї–µ–љ—Л —Н—Д—Д–µ–Ї—В—Л —Б–Є–љ–µ—А–≥–Є–Є, –њ—А–Є—Б—Г—Й–Є–µ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л, –Њ–і–љ–∞–Ї–Њ, –љ–µ –Њ–±–ї–∞–і–∞—О—В 100% –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ—Б—В—М—О –Є—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–µ–≤–Њ—Б—Е–Њ–і—Б—В–≤–∞. –≠—В–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–Њ–ї–ґ–љ—Л –±—Л—В—М –њ—А–Њ–≤–µ—А–µ–љ—Л –≤ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Э–µ —Б—В–Њ–Є—В –Ј–∞–±—Л–≤–∞—В—М –Є –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–∞—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Є–ї–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ—Л –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —А–∞–±–Њ—В–∞—Е [53вАУ56].
–Я–Њ—Н—В–Њ–Љ—Г –Ї—А–∞–є–љ–µ –≤–∞–ґ–љ—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О —Б–≤–Њ–є—Б—В–≤ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (IвАУIII —Д–∞–Ј–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є), –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–Њ–≤–Њ–і–Є–Љ—Л–Љ –≤ —Ж–µ–ї—П—Е –њ–Њ–ї—Г—З–µ–љ–Є—П –њ—А–∞–≤–∞ –љ–∞ —А–µ–≥–Є—Б—В—А–∞—Ж–Є—О. –Т –ї—О–±–Њ–Љ —Б–ї—Г—З–∞–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і—Б—В–≤–Њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –Њ—Ж–µ–љ–µ–љ–Њ –≤ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –і–≤–Њ–є–љ—Л—Е —Б–ї–µ–њ—Л—Е –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е.
–Э–∞–Є–ї—Г—З—И–Є–Љ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–Њ–Љ —Н—Д—Д–µ–Ї—В–∞ —Б–Є–љ–µ—А–≥–Є–Є —П–≤–ї—П—О—В—Б—П —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б –Њ–і–љ–Є–Љ –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ–Є —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –µ—Б–ї–Є —Н—В–Њ –љ–µ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є—В —Н—В–Є—З–µ—Б–Ї–Є–Љ –љ–Њ—А–Љ–∞–Љ. –Ю—Б–љ–Њ–≤–љ—Л–Љ –Ї—А–Є—В–µ—А–Є–µ–Љ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ—Б—В–Є —П–≤–ї—П–µ—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–µ–њ–∞—А–∞—В–Њ–Љ —Б—А–∞–≤–љ–µ–љ–Є—П.
–°—А–µ–і–Є –њ–Њ—А—П–і–Ї–∞ 200 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –љ–∞ —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е —Н–Ї—Б—В—А–∞–Ї—В–∞—Е —А–∞—Б—В–µ–љ–Є–є –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ 10 –ї–µ—В, –Њ–Ї–Њ–ї–Њ 50% –±—Л–ї–Є –≤—Л–њ–Њ–ї–љ–µ–љ—Л –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ–Є —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –±—Л–ї–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ, —З—В–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ—Л —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ, –∞ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Ј –љ–Є—Е –њ–Њ–Ї–∞–Ј–∞–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і—Б—В–≤–Њ –љ–∞–і —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –≤—Л—А–∞–Ј–Є–≤—И–µ–µ—Б—П –≤ –Љ–µ–љ—М—И–µ–є —З–∞—Б—В–Њ—В–µ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Є –ї—Г—З—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є.
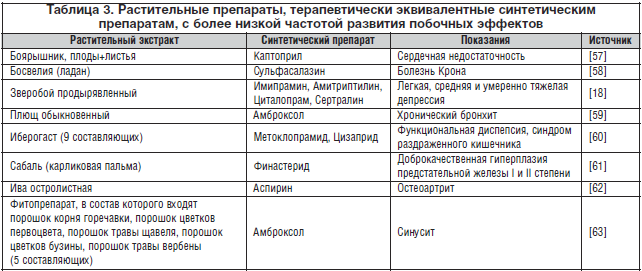
–Э–∞–њ—А–Є–Љ–µ—А, —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є —Н–Ї—Б—В—А–∞–Ї—В –Ј–≤–µ—А–Њ–±–Њ—П –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—Б–Є—Е–Њ—Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ–Є –і–ї—П –ї–µ—З–µ–љ–Є—П –Љ—П–≥–Ї–Њ–є –Є —Г–Љ–µ—А–µ–љ–љ–Њ–є –і–µ–њ—А–µ—Б—Б–Є–Є, –Њ–±–ї–∞–і–∞–µ—В –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ (1вАУ3%) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —В—А–Є—Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Є–Љ–Є –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–∞–Љ–Є (30вАУ60%) –Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Њ–±—А–∞—В–љ–Њ–≥–Њ –Ј–∞—Е–≤–∞—В–∞ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ (15вАУ30%). –Т —В–∞–±–ї–Є—Ж–µ 3 –њ—А–Є–≤–µ–і–µ–љ—Л –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї—Г—О —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ—Б—В—М –Є –±–Њ–ї–µ–µ –љ–Є–Ј–Ї—Г—О —З–∞—Б—В–Њ—В—Г —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ–Є –і–ї—П –ї–µ—З–µ–љ–Є—П —В–µ—Е –ґ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Ю–і–љ–∞–Ї–Њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –ї–Є—И—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –љ–µ —Г–і–∞–ї–Њ—Б—М –µ—Й–µ –Њ–њ—А–µ–і–µ–ї–Є—В—М —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ —Н—Д—Д–µ–Ї—В—Л —Б–Є–љ–µ—А–≥–Є–Є –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є –Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –ї–µ–ґ–∞—Й–Є–µ –≤ –Њ—Б–љ–Њ–≤–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ—Б—В–Є. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–∞—П —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ—Б—В—М –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ —Н—Д—Д–µ–Ї—В–Њ–Љ —Б–Є–љ–µ—А–≥–Є–Є, –Њ —З–µ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –і–∞–љ–љ—Л–µ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Є–≤–µ–і–µ–љ–љ—Л–µ –≤ —Н—В–Њ–Љ –Њ–±–Ј–Њ—А–µ.
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –љ–µ —В–Њ–ї—М–Ї–Њ —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ –Љ–Њ–љ–Њ–њ—А–µ–њ–∞—А–∞—В—Л –Є–ї–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–Њ—П–≤–ї—П—В—М —Н—Д—Д–µ–Ї—В —Б–Є–љ–µ—А–≥–Є–Є, –љ–Њ –Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –Њ—В–і–µ–ї—М–љ—Л—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є–ї–Є —Н–Ї—Б—В—А–∞–Ї—В–Њ–≤ —А–∞—Б—В–µ–љ–Є–є —Б —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Є–ї–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є –Њ–±—А–∞–Ј—Г—О—В —Б–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–µ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П —Б –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ —Г—Б–Є–ї–µ–љ–љ—Л–Љ –ї–µ—З–µ–±–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ. –Э–∞–њ—А–Є–Љ–µ—А, –≤ –Ґ–∞–Є–ї–∞–љ–і–µ –і–ї—П –ї–µ—З–µ–љ–Є—П —В—А–Њ–њ–Є—З–µ—Б–Ї–Њ–є –Љ–∞–ї—П—А–Є–Є —Б —Г—Б–њ–µ—Е–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є: –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л–µ –∞—А—В–µ–Љ–Є–Ј–Є–љ–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–µ—Д–ї–Њ–Ї–Є–љ–Њ–Љ –Є –ї—Г–Љ–µ—Д–∞–љ—В—А–Є–љ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –і–Њ–Ї—Б–Є—Ж–Є–Ї–ї–Є–љ–Њ–Љ –Є–ї–Є —В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ–Њ–Љ [64]. –Э–µ –Є—Б–Ї–ї—О—З–µ–љ–Њ, —З—В–Њ —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –±—Г–і—Г—В —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –Є –≤ –і—А—Г–≥–Є—Е –Њ–±–ї–∞—Б—В—П—Е –Љ–µ–і–Є—Ж–Є–љ—Л. –Т —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є –Ї–Є—В–∞–є—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ —В–∞–Ї–ґ–µ –њ—А–Њ–≤–Њ–і—П—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ–љ–Њ–≥–Њ–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–љ—Л—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ґ–∞–Ї–Њ–≤–Њ, –љ–∞–њ—А–Є–Љ–µ—А, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О –ї–µ—З–µ–±–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –њ—А–µ–њ–∞—А–∞—В–∞ —Б—А–µ–і–Є 37 –Љ–Њ–ї–Њ–і—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б—В—А–∞–і–∞—О—Й–Є—Е —Н–Ї–Ј–µ–Љ–Њ–є [65], –Ї–Њ–≥–і–∞ –±—Л–ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —В–µ—Б—В–Њ–≤, –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—Й–Є—Е, —З—В–Њ —В–Њ–ї—М–Ї–Њ ¬Ђ—Ж–µ–ї—М–љ—Л–µ¬ї —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–µ —Б–Љ–µ—Б–Є –њ—А–Њ–Є–Ј–≤–Њ–і—П—В –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В [66].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤—Б–µ –њ–Њ—Б–ї–µ–і–љ–Є–µ —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –≤ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є–Ї–µ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ—Л –љ–∞ —Б–Њ–Ј–і–∞–љ–Є–µ –љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П —Д–Є—В–Њ–њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Б–Љ–Њ–≥—Г—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –Њ—В–і–µ–ї—М–љ–Њ –Є–ї–Є –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Є–ї–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є. –Я–Њ—П–≤–ї–µ–љ–Є–µ –љ–Њ–≤–Њ–≥–Њ –њ–Њ–Ї–Њ–ї–µ–љ–Є—П —Д–Є—В–Њ–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±—Г–і–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є—О –Є –њ—А–Є–Ј–љ–∞–љ–Є—О —Д–Є—В–Њ—В–µ—А–∞–њ–Є–Є –Є –Њ–њ—А–µ–і–µ–ї–Є—В –µ–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –≤ –ї–µ—З–µ–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –і–Њ —Б–Є—Е –њ–Њ—А –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М —В–Њ–ї—М–Ї–Њ —Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л.
–†–µ—Д–µ—А–∞—В –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ
–Ї.–Љ.–љ. –Ю.–Ш. –Ъ–Њ—Б—В—О–Ї–µ–≤–Є—З –њ–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞–Љ —Б—В–∞—В—М–Є
H. Wagner, G. Ulrich-Merzenich ¬ЂSynergy research: Approaching a new generation of phytopharmaceuticals¬ї. REVIEW (PART I). Phytomedicine. 16 (2009). 97вАУ110.












