Распространенность ОА коленных, тазобедренных суставов и суставов кистей возрастает с возрастом, ОА встречается чаще у женщин, чем у мужчин. После 60–70 лет в той или иной степени это заболевание развивается практически у всех людей, и примерно у половины из них выявляется его клиническая симптоматика. В Европейском союзе насчитывается около 100 млн больных ОА [2]. Распространенность только ОА коленного сустава в Западной Европе составляет 18–25% у мужчин и 24–40% у женщин в возрасте 60–79 лет, причем она неуклонно растет, что связано с увеличением продолжительности жизни населения.
Существуют различные определения ОА. Согласно одному из них, ОА входит в гетерогенную группу заболеваний суставов различной этиологии со сходными биологическими и клиническими признаками, а также общим исходом, приводящим к полной потере хряща. Это заболевание, по определению В.А. Насоновой, – анатомо-клинический синдром, характеризующийся болью механического типа у лиц cтарше 45 лет с соответствующими рентгенологическими данными. По нашему мнению, наиболее адекватно отражает характер этого заболевания определение, согласно которому ОА рассматривается как хроническое прогрессирующее заболевание синовиальных суставов с поражением прежде всего гиалинового хряща и субхондральной кости в результате сложного комплекса биомеханических, биохимических и/или генетических факторов [В.В. Бадокин, 2012].
Несмотря на то, что ОА – группа патогенетически близких заболеваний, имеющих различные факторы риска для своего развития, наблюдаются однотипные морфологические и клинические проявления ОА. В основном это прогрессивная потеря гиалинового хряща и ремоделирование субхондральной кости в сочетании с синовиальным воспалением. Патологические изменения при этом заболевании проявляются истончением и разволокнением суставного хряща, костным венозным стазом и внутримедуллярной гипертензией, трабекулярными микропереломами, субхондральным остеосклерозом, образованием остеофитов, кистовидной перестройкой периартикулярной кости и нестабильностью суставов с развитием их подвывихов. Все эти изменения требуют дифференцированной терапии для снижения их выраженности и купирования.
В чем причина развития ОА? Происходит деградация хряща с уменьшением его объема, которая обусловлена избыточной механической нагрузкой на хрящ и субхондральную кость и неспособностью тканей сустава адекватно противостоять этой нагрузке из-за ограничения репаративных возможностей. Патологическое действие механической нагрузки осуществляется благодаря механорецепторам, расположенным на хондроцитах, а это, в свою очередь, приводит к экспрессии металлопротеиназ (коллагеназа, стромелизин и др.) и провоспалительных цитокинов, прежде всего интерлейкина (ИЛ) -1, который активирует воспаление, деградацию субхондральной кости и гиалинового хряща. Металлопротеиназы способствуют разрушению коллагеновой сети и протеогликанов – основной молекулы, осуществляющей механическую функцию хрящевой ткани.
В основе деградации хряща лежит недостаточный синтез хондроцитами полноценных протеогликанов – основных составляющих патологических нарушений при этом заболевании. В реализации этих изменений участвуют как клеточные факторы, так и растворимые медиаторы [3–5]. К клеточным факторам относятся хондроциты гиалинового хряща, остеоциты и остеобласты субхондральной кости, синовиоциты и мононуклеарные клетки синовиальной оболочки. Что касается растворимых медиаторов, то они вырабатываются хондроцитами, а также синовиоцитами и инфильтрирующими мононуклеарными клетками. Растворимые медиаторы включают провоспалительные цитокины, протеиназы, оксид азота и липидные медиаторы (лептин, адипонектин, вистатин, резистин). Адипокины являются новым классом растворимых медиаторов, участвующих в деградации хряща. Субхондральные остеобласты также способны продуцировать растворимые медиаторы, такие как инсулиноподобный фактор роста 1-го типа (IGF–1), трансформирующий фактор роста-β (ТGF-β), ИЛ-6, липидные медиаторы, протеиназы, фибронектин и нейропептиды.
Большое значение в развитии патологических изменений при ОА принадлежит биомеханическим нарушениям. Механический стресс приводит к активации интегринового рецептора (механорецептора), экспрессии митоген-активированного белка – киназы и ядерного фактора kappa B (NF-kB).
Воспаление в тканях сустава приводит к развитию рецидивирующего вторичного (реактивного) синовита, хондрита, остита и периартрита. Воспаление является важной составляющей патогенеза этого заболевания и предиктором неблагоприятного течения заболевания (рис. 1). В частности, синовит рассматривается как один из признаков ОА, который встречается у половины больных. Полагают, что воспаление в тканях сустава способствует прогрессированию морфологических изменений, в т. ч. и структурных изменений гиалинового хряща [6].
Не меньший интерес вызывает ремоделирование субхондральной кости с формированием остеофитов, тем более что это наблюдается уже на ранней стадии ОА и, по-видимому, является результатом локальной продукции анаболических факторов роста, таких как IGF-1 и ТGF-β. Значение изменений в субхондральной кости в патогенезе ОА доказывают ее воспаление, которое предшествует клинической манифестации этого заболевания (по данным сцинтиграфии и магнитно-резонансной томографии), и склероз, проявляющийся до развития дефектов хряща. В ремодулировании кости/хряща и формировании остеофитов ведущую роль играют ростовые факторы.
Основные направления лечения ОА:
- устранение внешних причин, способствующих развитию этого заболевания и его прогрессированию;
- воздействие на проявления реактивного артрита или сопутствующих периартритов, что предусматривает назначение противовоспалительной терапии;
- влияние на обмен суставного хряща, т. е. проведение симптом-модифицирующей терапии медленного действия (противоартрозной) терапии;
- восстановление функции пораженных суставов, что обосновывает применение большого спектра реабилитационных мероприятий, включая и методы хирургической коррекции.
Медикаментозные препараты, используемые в терапии ОА, делятся на 2 основные группы: симптом-модифицирующие и структурно-модифицирующие. К первым относятся нестероидные противовоспалительные препараты (НПВП), анальгетики (простые и опиоидные), миорелаксанты, а также глюкокортикоиды, которые при этом заболевании применяются только внутрисуставно, причем не более 3–4 раз в один сустав на протяжении 1 года. Иногда их применяют периартикулярно, например, при синдроме «гусиной лапки». Что же касается структурно-модифицирующих (базисных, хондромодулирующих, противоартрозных, симптоматических медленно действующих) препаратов, то они способны контролировать течение заболевания, стабилизировать или приводить к обратному развитию имеющиеся изменения в тканях сустава путем коррекции нарушенного метаболизма гиалинового хряща. Если первая группа препаратов направлена на купирование боли в суставах или значительное уменьшение их интенсивности, а также восстановление функции опорно-двигательного аппарата, то вторая – на замедление темпов прогрессирования заболевания, стабилизацию структурных изменений в гиалиновом хряще, а также на профилактику изменений в непораженном суставе, что, по существу, и составляет основное содержание вторичной профилактики ОА. Терапия ОА является комплексной и определяется выраженностью воспалительной реакции, степенью функциональной недостаточности (ФН), структурными изменениями и наличием сопутствующих заболеваний.
Противоартрозные препараты или симптоматические препараты медленного действия способствуют стимуляции хондроцитов к выработке полноценного межклеточного матрикса гиалинового (суставного) хряща, снижению активности лизосомальных ферментов, активируют анаболические процессы в матриксе хряща (стимулируют продукцию протеогликанов и коллагена), подавляют катаболические процессы, тормозят апоптоз хондроцитов, увеличивают резистентность хондроцитов к воздействию провоспалительных цитокинов и НПВП. Кроме того, они снижают активность металлопротеиназ (фосфолипазы А2, коллагеназы, стромелизина) и провоспалительных цитокинов, что приводит к уменьшению активности воспаления в тканях сустава. Помимо этого, они активируют анаболические процессы в матриксе хряща. В последнее время выявлен молекулярный механизм действия таких препаратов, который заключается в их влиянии на фактор активации провоспалительных генов – NF-kB [2]. В результате такого влияния уменьшается экспрессия провоспалительных генов (ИЛ-1, фактор некроза опухоли-α) и снижается синтез белков, участвующих в воспалительном каскаде деградации хряща, включая циклооксигеназу 2-го типа (ЦОГ-2) и металлопротеиназы.
Для базисной терапии ОА предложено большое количество различных препаратов, хотя многие из них не имеют достаточной доказательной базы. Наиболее широкое применение нашли так называемые структурные аналоги хряща, к которым относятся хондроитина сульфат (ХС) и глюкозамин.
ХС является сульфатированным глюкозамингликаном. Он относится к основным компонентам экстрацеллюлярного матрикса хряща и входит в состав протеогликановых комплексов основного вещества хрящевой ткани. Благодаря наличию карбоксильной и сульфатной групп гликозаминогликаны и, в частности ХС, обладают выраженной гидрофильностью. Это в свою очередь способствует нормальному функционированию хряща и сохранению им эластических свойств. ХС имеет тропность к суставному хрящу и при приеме внутрь в высоких концентрациях накапливается в синовиальной жидкости. Уровень доказательности его лечебного эффекта является наиболее высоким среди препаратов с хондропротективной активностью (1А), что нашло свое отражение в рекомендациях Международного общества по исследованию остеоартроза (OARSI) 2010 г. [7].
Фармакологическая активность ХС [3, 5, 8]:
- разрешение или уменьшение симптомов ОА (противовоспалительный эффект, боль, функциональная способность);
- активация анаболических процессов в гиалиновом хряще (стимуляция синтеза протеогликанов и коллагена, влияние на тканевые ингибиторы матриксных протеиназ);
- повышение синтеза эндогенной гиалуроновой кислоты и увеличение ее концентрации в синовиальной жидкости;
- подавление апоптоза хондроцитов (ингибирование индуцируемой нуклеотидной транслокации NF–kB);
- подавление синтеза энзимов деструкции хряща (металлопротеиназ 3, 9, 13, 14; катепсина-β, лейкоцитарной эластазы);
- улучшение микроциркуляции субхондральной кости и синовиальной ткани;
- противовоспалительная активность (ингибирование медиаторов воспаления: ИЛ-1, ЦОГ-2, простагландина Е2 (ПГЕ2), NF-kB, стимуляция хемотаксиса и фагоцитоза, антиген-индуцируемой продукции иммуноглобулина (ИГ) G1 и ИГE);
- ингибирование синтеза оксида азота и свободных радикалов;
- повышение вязкости синовиальной жидкости.
Структурно-модифицирующее действие ХС связывают с увеличением вязкости синовиальной жидкости, повышением синтеза эндогенной гиалуроновой кислоты, а также с влиянием на метаболизм гиалинового хряща, которое проявляется в стимуляции синтеза протеогликанов, ингибиции энзимов деструкции хряща металлопротеиназ 3, 9, 13, 14, эластазы, катепсина-β, ингибиции медиаторов воспаления – ИЛ-1, ЦОГ-2, ПГЕ2, NF–kB, снижении апоптоза, концентрации оксида азота и свободных радикалов (рис. 2) [8].
Проведено большое количество рандомизированных плацебо-контролируемых исследований по изучению эффективности и переносимости ХС. B.F. Leeb et al. провели метаанализ 7 рандомизированных контролируемых исследований, основанных на изучении 703 больных ОА крупных суставов, при этом 372 больных лечились ХС и 331 принимали плацебо [9]. Длительность терапии колебалась от 3 до 12 мес., а доза препарата – от 800 до 2000 мг/сут. Эффективность ХС оказалась достоверно выше по сравнению с эффективностью плацебо по таким показателям, как боль (по визуально-аналоговой шкале), индекс Лекена и глобальная оценка результатов лечения больным.
Структурно-модифицирующий эффект этого препарата доказан как в экспериментальных, так и в клинических исследованиях. D. Uebelhart et al. (2004) в рандомизированном двойном слепом мультицентровом плацебо-контролируемом исследовании оценивали эффективность и переносимость 2-х курсов терапии оральным ХС у больных гонартрозом. Длительность курсов – по 3 мес. на протяжении 1 года [10]. К концу наблюдения альго-функциональный индекс Лекена уменьшился в основной группе на 36%, в контрольной – на 23%. К концу года отмечалось дальнейшее сужение суставной щели у больных, которые принимали плацебо, чего не наблюдалось на фоне терапии ХС.
В рандомизированном исследовании STOPP A. Каhan et al. (2009) оценивали прогрессирование гонартроза при лечении ХС (рис. 3) [11]. В исследовании участвовали 622 больных, которые принимали или ХС (основная группа), или плацебо (контрольная группа) в течение 2-х лет. В основной группе зарегистрировано менее выраженное сужение суставной щели по сравнению с контрольной (–0,07 и 0,31 мм соответственно, р<0,0005), меньше было больных с рентгенологическим прогрессированием ≥0,25 мм по сравнению с плацебо (28 и 41% соответственно; р<0,0005). Это исследование также показало, что интенсивность боли в суставах лучше контролировалась при применении ХС, чем при приеме плацебо. Не было выявлено различий в частоте и выраженности нежелательных явлений (НЯ) в основной и контрольной группах.
В 2008 г. Hochberg et al. опубликовали результаты систематического обзора и метаанализа всех доступных рандомизированных исследований, в которых оценивалось влияние принимаемого внутрь ХС на скорость изменения ширины суставной щели [12]. Данные этого метаанализа доказывают наличие статистически достоверного структурно-модифицирующего эффекта этого препарата. Позже был проведен обновленный метаанализ, в который вошли ранее неопубликованные исследования продолжительностью не менее 2-х лет [13]. Оценивались структурные изменения на фоне терапии ХС, причем использовали цифровые рентгеновские снимки с компьютерным определением ширины суставной щели, что уменьшало ошибку измерения и повышало его точность. Проведенный метаанализ включал данные более 1000 пациентов с клиническими и рентгенографическими проявлениями ОА коленного сустава. Применение ХС в дозе 800 мг/сут внутрь в течение 2-х лет замедляло скорость сужения суставной щели у больных гонартрозом с клинико-инструментальными проявлениями. Среднее различие в отдельных исследованиях до и после лечения составило 0,13 мм (0,06–0,19).
ХС в терапии ОА применяется не только в пероральной форме. Существуют лекарственные формы, где он используется как для наружной терапии в виде аппликации на пораженный сустав, так и для в/м введения, причем как в режиме монотерапии, так и в комбинации с глюкозамином сульфатом или с препаратами, которые способствуют лучшему проникновению ХС непосредственно в ткани сустава через кожный барьер.
Хондрогард (производитель – ЗАО «ФармФирма «Сотекс») представляет собой новую лекарственную форму ХС – в ампулах, в которых содержится 1 или 2 мл, что соответствует 100 или 200 мг ХС натрия. Согласно официальной инструкции особенностью фармакокинетики Хондрогарда является его быстрое накопление в тканях сустава. Уже через 30 мин после инъекции он обнаруживается в значительных концентрациях в плазме крови. Максимальная концентрация (Сmах) ХС в плазме достигается через 1 ч, затем постепенно снижается в течение 2-х сут. Он накапливается главным образом в хрящевой ткани суставов. В эксперименте показано, что уже через 15 мин после в/м инъекции ХС обнаруживается в синовиальной жидкости, затем проникает в суставной хрящ, где его Сmах достигается через 48 ч. В целом его биодоступность существенно выше, чем у ХС, принимаемого внутрь [14].
В Институте ревматологии им. В.А. Насоновой проведена оценка эффективности, переносимости и безопасности в/м введения ХС больным ОА коленных суставов [15]. В 2-месячном проспективном исследовании приняли участие 70 человек в возрасте 45–70 лет с первичным ОА коленных суставов II (79%) и III (21%) рентгенологических стадий по Kellgren–Lawrence, нуждавшихся в приеме НПВП. Средняя длительность заболевания составляла 9 лет. Препарат Хондрогард вводили в/м через 1 день на протяжении 2-х мес. (всего 30 инъекций, первые 3 инъекции – в дозе 1 мл (100 мг), последующие – в дозе 2 мл (200 мг)).
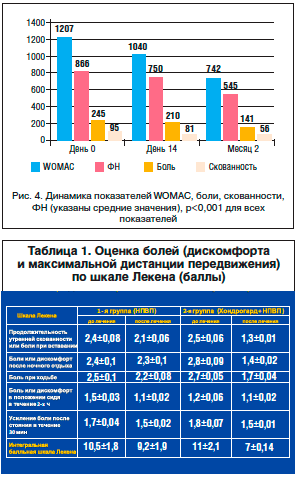
Терапия Хондрогардом привела к существенному улучшению состояния большинства больных ОА. Была выявлена статистически значимая положительная динамика как отдельных показателей заболевания (боль, скованность, ФН), так и показателя WOMAC в целом. Так, зарегистрировано статически значимое уменьшение боли по шкале WOMAC через 2 нед. на 14%, или в абсолютных значениях – на 35 мм. При продолжении терапии ко 2-му мес. положительная динамика достигла 43%, что соответствовало снижению боли в среднем на 104 мм (95%, ДИ 85–124; р<0,001). Примерно такую же динамику претерпели такие показатели, как длительность скованности и улучшение функционального состояния пораженных суставов (рис. 4). Ко 2-му мес. терапии все значения индекса WOMAC (боль, скованность, ФН) снизились на 43, 41 и 37% соответственно.
Результаты исследования показали, что терапевтический эффект наступал в среднем на 23-й день от начала лечения. К концу 2-месячного приема Ходрогарда хороший эффект препарата по оценке больных наблюдался у 59% и удовлетворительный – у 31%. Следует отметить хорошую переносимость Хондрогарда. Серьезных НЯ не наблюдалось, чаще всего они носили локальный характер. Редко наблюдались кожный зуд и папулезная сыпь (6%), диспептические явления (1–2%), болезненные уплотнения в месте инъекции (3%).
В другом исследовании лечению препаратом Хондрогард было подвергнуто 100 больных коксартрозом и гонартрозом [16]. После в/м введения 25 инъекций Хондрогарда наблюдалась положительная динамика многих показателей, характеризующих ОА. Особенно это было выражено в группе больных, которые получали комбинированную терапию этим симптоматическим препаратом медленного действия и НПВП, по сравнению с контрольной группой, получавшей только НПВП (табл. 1). Наиболее яркая положительная динамика наблюдалась при оценке боли как в покое, так и при движении, а также продолжительности утренней скованности. Интегральная балльная оценка ОА по Лекену к концу лечения в основной группе снизилась примерно в 1,5 раза, а в контрольной осталась практически на прежнем уровне.
Препарат Хондрогард был апробирован не только при различных локализациях ОА, но и при основном дегенеративном заболевании позвоночника – межпозвоночном остеохондрозе, патологии фасеточных суставов, а также при плечелопаточном периартрите. Однако об эффективности в/м введения ХС при этих заболеваниях говорить пока рано, т. к. требуются дополнительные рандомизированные контролируемые исследования с детальным анализом динамики отдельных симптомов и синдромов.
Таким образом, препарат Хондрогард – раствор ХС для в/м введения, обладающий положительным эффектом, уменьшающий интенсивность основных клинических проявлений ОА коленных и тазобедренных суставов. Применение Хондрогарда обосновано его более высокой биодоступностью по сравнению с пероральными формами ХС и относительно быстрым наступлением клинического эффекта. По своей переносимости и безопасности он не уступает структурным аналогам хряща, что свидетельствует о его высокой безопасности. Хондрогард следует рассматривать как один из основных компонентов комплексной терапии ОА.