–Ю–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ ¬Ђ–њ–Њ–њ—Г–ї—П—А–љ—Л—Е¬ї –≤ –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, —Б–≤–Њ–µ–≥–Њ —А–Њ–і–∞ ¬Ђ–њ—А–Є—В—З–µ–є –≤–Њ —П–Ј—Л—Ж–µ—Е¬ї, —П–≤–ї—П–µ—В—Б—П Helicobacter pylori. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ H. pylori –≤—Л—П–≤–ї—П–µ—В—Б—П –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ —Г 30вАУ35% –љ–∞—Б–µ–ї–µ–љ–Є—П –≤ –і–µ—В—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –Є —Г 50вАУ85% –≤–Њ –≤–Ј—А–Њ—Б–ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є [1вАУ5]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ H. pylori-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –љ–µ —З–∞—Й–µ 10вАУ20% —Б–ї—Г—З–∞–µ–≤ [6]. –≠—В–Њ –љ–∞–±–ї—О–і–µ–љ–Є–µ –Њ–±—К—П—Б–љ—П–µ—В—Б—П —В–µ–Љ, —З—В–Њ –њ–Њ–њ—Г–ї—П—Ж–Є—П H. pylori –Њ—В–ї–Є—З–∞–µ—В—Б—П –Ї—А–∞–є–љ–µ –≤—Л—Б–Њ–Ї–Њ–є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В—М—О, –∞ –µ–µ —И—В–∞–Љ–Љ—Л –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Њ—В–ї–Є—З–∞—О—В—Б—П –њ–Њ –≤–Є—А—Г–ї–µ–љ—В–љ–Њ—Б—В–Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –љ–µ –≤—Б–µ –Є–Ј –љ–Є—Е —Б–њ–Њ—Б–Њ–±–љ—Л –≤—Л–Ј–≤–∞—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є [7]. –°–ї–µ–і—Г–µ—В —Б–Ї–∞–Ј–∞—В—М, —З—В–Њ –і–∞–ґ–µ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–µ —Ж–Є—В–Њ–њ–∞—В–Њ–≥–µ–љ–љ—Л–Љ–Є —И—В–∞–Љ–Љ–∞–Љ–Є –Њ—В–љ—О–і—М –љ–µ –Њ–Ј–љ–∞—З–∞–µ—В —Д–∞—В–∞–ї—М–љ–Њ–є –љ–µ–Є–Ј–±–µ–ґ–љ–Њ—Б—В–Є —А–∞–Ј–≤–Є—В–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ –Љ–∞–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞, —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –і—А—Г–≥–Є—Е –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Г–≤–µ—А–µ–љ–љ–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –і–∞–љ–љ—Л–є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є (–ѓ–С) –Є –≥–∞—Б—В—А–Є—В–∞, —П–≤–ї—П–µ—В—Б—П –Ї–∞–љ—Ж–µ—А–Њ–≥–µ–љ–Њ–Љ –њ–µ—А–≤–Њ–≥–Њ –њ–Њ—А—П–і–Ї–∞ –Є –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –ґ–µ–ї—Г–і–Ї–∞ (MALT-–ї–Є–Љ—Д–Њ–Љ–∞, –∞–і–µ–љ–Њ–Ї–∞—А—Ж–Є–љ–Њ–Љ–∞). –Ш, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –Љ–Є–Ї—А–Њ–±–љ–∞—П —В–µ–Њ—А–Є—П —А–∞–Ј–≤–Є—В–Є—П –њ–Њ—А–∞–ґ–µ–љ–Є–є –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –Ї–∞–Ї —Г–љ–Є–Ї–∞–ї—М–љ–∞—П –Є –µ–і–Є–љ—Б—В–≤–µ–љ–љ–∞—П –љ–µ –≤—Л–і–µ—А–ґ–Є–≤–∞–µ—В –Ї—А–Є—В–Є–Ї–Є —Б –њ–Њ–Ј–Є—Ж–Є–є –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–≥–Њ —Г—З–µ–љ–Є—П –Њ —А–∞–Ј–≤–Є—В–Є–Є –±–Њ–ї–µ–Ј–љ–Є (–≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є H. pylori –љ–µ –≤—Л–њ–Њ–ї–љ—П—О—В—Б—П —В–∞–Ї–Є–µ –њ–Њ—Б—В—Г–ї–∞—В—Л –Ъ–Њ—Е–∞, –Ї–∞–Ї 100% –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤—И–Є—Е, –Њ—В—Б—Г—В—Б—В–≤–Є–µ —А–∞–Ј–≤–Є—В–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–Є –Ј–∞—А–∞–ґ–µ–љ–Є–Є –Љ–Є–Ї—А–Њ–±–љ–Њ–є –Ї—Г–ї—М—В—Г—А–Њ–є –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ), —Б—Г–ґ–і–µ–љ–Є—П –Њ –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–є —А–Њ–ї–Є –±–∞–Ї—В–µ—А–Є–Є —В–∞–Ї–ґ–µ –Њ—Б—В–∞—О—В—Б—П –±–µ–Ј–і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Л–Љ–Є. –Т–њ–Њ–ї–љ–µ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–Ї–∞–Ј—Л–≤–∞–љ–Є–µ –Њ–і–љ–Њ–≥–Њ –Є–Ј –≤–µ–і—Г—Й–Є—Е —Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Њ–≤ –Љ–Є—А–∞ –Ф. –У—А—Н—Е–µ–Љ–∞: ¬Ђ–•–Њ—А–Њ—И–Є–є —Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А вАУ –Љ–µ—А—В–≤—Л–є —Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А¬ї (—А–∞–Ј—Г–Љ–µ–µ—В—Б—П, –≤ —А–∞–Љ–Ї–∞—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –і–∞–љ–љ–Њ–є –Љ–∞–Ї—Б–Є–Љ—Л —Г –±–Њ–ї—М–љ—Л—Е –Є –≤ –≥—А—Г–њ–њ–∞—Е –ї–Є—Ж –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ —А–Є—Б–Ї–∞, –∞ –љ–µ —Г –≤—Б–µ–є —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –≤ —Ж–µ–ї–Њ–Љ). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Є –љ–∞—Г—З–љ–∞—П —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–µ –і–Є–Ї—В—Г—О—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Я—А–Є–љ—П—В–Њ –њ–Њ–і—А–∞–Ј–і–µ–ї—П—В—М –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ –∞–±—Б–Њ–ї—О—В–љ—Л–µ –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–µ (—В–∞–±–ї. 1). –Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —Б—В–∞–љ–і–∞—А—В–љ—Л–µ —Б—Е–µ–Љ—Л –∞–љ—В–Є—Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Р–•–С–Ґ), –≤ —Б–Њ—Б—В–∞–≤ –Ї–Њ—В–Њ—А—Л—Е –≤—Е–Њ–і—П—В –Є–љ–≥–Є–±–Є—В–Њ—А—Л –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л (–Ш–Я–Я) –Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л.
![–Ґ–∞–±–ї–Є—Ж–∞ 1. –Я–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є [8] –Ґ–∞–±–ї–Є—Ж–∞ 1. –Я–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є [8]](/upload/medialibrary/3fd/3fd0ad022dc3b0cf931fb1513d29baa0.png)
–Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, —Н—А–∞–і–Є–Ї–∞—Ж–Є—О –Є–љ—Д–µ–Ї—Ж–Є–Є H. pylori –±–Њ–ї–µ–µ 80% –њ—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М —Г—Б–њ–µ—И–љ–Њ–є. –Ч–∞—З–∞—Б—В—Г—О –і–∞–љ–љ–Њ–≥–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞ –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–Љ –≤—А–∞—З–∞–Љ —Г–і–∞–µ—В—Б—П –і–Њ—Б—В–Є—З—М –љ–µ –њ–Њ—Б–ї–µ –њ–µ—А–≤–Њ–≥–Њ –Є –њ–Њ—А–Њ–є –і–∞–ґ–µ –љ–µ –њ–Њ—Б–ї–µ –≤—В–Њ—А–Њ–≥–Њ –Ї—Г—А—Б–∞ –Р–•–С–Ґ. –Я–Њ-–њ—А–µ–ґ–љ–µ–Љ—Г —Б—Г—Й–µ—Б—В–≤—Г–µ—В —А—П–і –њ—А–Њ–±–ї–µ–Љ, –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–•–С–Ґ. –Ъ –Њ—Б–љ–Њ–≤–љ—Л–Љ –њ—А–Є—З–Є–љ–∞–Љ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є—О –њ—А–Њ—Ж–µ–љ—В–∞ —Г—Б–њ–µ—И–љ–Њ–є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є, –Њ—В–љ–Њ—Б—П—В—Б—П:
1. –†–Њ—Б—В —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є H. pylori –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ.
2. –Я–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –Ш–Я–Я –Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
3. –Э–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є –Є –љ–µ–ґ–µ–ї–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –њ—А–Є–љ–Є–Љ–∞—В—М –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є.
–Ю—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є H. pylori –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ –њ—А–Є–≤–Њ–і–Є—В –Ї –Ї–∞—В–∞—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Њ–Љ—Г —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є вАУ —Б 80вАУ90% –і–Њ 30вАУ60% [9]. –Ю–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є—Е –љ–µ–≥–∞—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Г—Б–њ–µ—Е –Р–•–С–Ґ, —П–≤–ї—П–µ—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–љ–∞—П –і–ї—П –Љ–љ–Њ–≥–Є—Е —Б—В—А–∞–љ —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —А–Њ—Б—В—Г —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Ї –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ—Г вАУ –≤–∞–ґ–љ–µ–є—И–µ–Љ—Г –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Г —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В—А–Њ–є–љ–Њ–є —Б—Е–µ–Љ—Л —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є 1-–є –ї–Є–љ–Є–Є. –†–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є III –Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Њ–≥–Њ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞ –њ—А–µ–і–њ–Є—Б—Л–≤–∞—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –≤ —Б—Е–µ–Љ–∞—Е —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є 1-–є –ї–Є–љ–Є–Є, –µ—Б–ї–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М H. pylori –Ї —Н—В–Њ–Љ—Г –∞–љ—В–Є–±–Є–Њ—В–Є–Ї—Г –≤ –і–∞–љ–љ–Њ–Љ —А–µ–≥–Є–Њ–љ–µ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 15вАУ20% [10]. –°—Г–Љ–Љ–Є—А—Г—П —А–µ–Ј—Г–ї—М—В–∞—В—Л 20 –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ–≤–µ–і–µ–љ–∞ –Њ—Ж–µ–љ–Ї–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В—А–Њ–є–љ–Њ–є —В–µ—А–∞–њ–Є–Є 1-–є –ї–Є–љ–Є–Є, –≤–Ї–ї—О—З–∞–≤—И–µ–є –Ш–Я–Я, –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ –Є –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ —Г 2751 –њ–∞—Ж–Є–µ–љ—В–∞, –Љ–Њ–ґ–љ–Њ –Ј–∞–Ї–ї—О—З–Є—В—М, —З—В–Њ –≤ —Б–ї—Г—З–∞–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —И—В–∞–Љ–Љ–Њ–≤ —Н—А–∞–і–Є–Ї–∞—Ж–Є—П –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –≤ —Б—А–µ–і–љ–µ–Љ —Г 87,8%, –∞ –њ—А–Є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Ї –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ—Г вАУ —В–Њ–ї—М–Ї–Њ —Г 18,3% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [11], –∞ –њ–Њ –і–∞–љ–љ—Л–Љ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –∞–≤—В–Њ—А–Њ–≤, –≤ —Г—Б–ї–Њ–≤–Є—П—Е —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ—Г –њ—А–Њ—Ж–µ–љ—В —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є —Б–љ–Є–ґ–∞–µ—В—Б—П –і–∞–ґ–µ –і–Њ 14,3% [12]. –Т —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е IV –Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Њ–≥–Њ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Њ, —З—В–Њ –і–ї—П —А–µ–≥–Є–Њ–љ–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Њ–є –Є –љ–Є–Ј–Ї–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О H. pylori –Ї –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ—Г —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ—Л —А–∞–Ј–љ—Л–µ —Б—Е–µ–Љ—Л —В–µ—А–∞–њ–Є–Є –Ї–∞–Ї 1-–є, —В–∞–Ї –Є 2-–є –ї–Є–љ–Є–Є (—В–∞–±–ї. 2).
![–Ґ–∞–±–ї–Є—Ж–∞ 2. –°—Е–µ–Љ—Л, —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ—Л–µ –і–ї—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori [8] –Ґ–∞–±–ї–Є—Ж–∞ 2. –°—Е–µ–Љ—Л, —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ—Л–µ –і–ї—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori [8]](/upload/medialibrary/f47/f47b812d5868f2ce991d61b437b2f3dd.png)
–†–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М H. pylori –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ –≤ –†–Њ—Б—Б–Є–Є —В–∞–Ї–ґ–µ –∞–Ї—В–Є–≤–љ–Њ –Є–Ј—Г—З–∞–µ—В—Б—П. –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–Њ—Б–ї–µ–ґ–Є–≤–∞–µ—В—Б—П —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —А–Њ—Б—В—Г —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Ї –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ—Г, —З—В–Њ —Б–Њ–≥–ї–∞—Б—Г–µ—В—Б—П —Б –Є–Ј–≤–µ—Б—В–љ—Л–Љ–Є –Њ–±—Й–µ–Љ–Є—А–Њ–≤—Л–Љ–Є –і–∞–љ–љ—Л–Љ–Є (—В–∞–±–ї. 3).
![–Ґ–∞–±–ї–Є—Ж–∞ 3. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ –Њ—Ж–µ–љ–Ї–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є H. pylori –≤ –†–Њ—Б—Б–Є–Є [13, 14] –Ґ–∞–±–ї–Є—Ж–∞ 3. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ –Њ—Ж–µ–љ–Ї–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є H. pylori –≤ –†–Њ—Б—Б–Є–Є [13, 14]](/upload/medialibrary/2ce/2ceba0fa37a0d517b8d1d997c5b638ed.png)
–Т —Б–≤—П–Ј–Є —Б –љ–∞—А–∞—Б—В–∞—О—Й–µ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М—О H. pylori –Ї –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ—Г –Є –і—А—Г–≥–Є–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ, –∞ —В–∞–Ї–ґ–µ —Б –љ–∞–ї–Є—З–Є–µ–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –љ–Њ–≤—Л–Љ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ, –Є—Б–њ–Њ–ї—М–Ј—Г—О—Й–Є–Љ—Б—П –≤ –ї–µ—З–µ–љ–Є–Є —Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–Є–Њ–Ј–∞, –њ–Њ–Є—Б–Ї –Є —А–∞–Ј—А–∞–±–Њ—В–Ї–∞ –љ–Њ–≤—Л—Е —Б—Е–µ–Љ —В–µ—А–∞–њ–Є–Є –Њ—З–µ–љ—М –∞–Ї—В—Г–∞–ї—М–љ—Л.
–Ю–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–є –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є–Є —Б—Е–µ–Љ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —П–≤–ї—П–µ—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤ –µ–µ —Б–Њ—Б—В–∞–≤–µ –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–Њ—В–Њ—А—Л—Е —Г–Ї–∞–Ј–∞–љ–∞ –≤ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л—Е —Б—В–∞–љ–і–∞—А—В–∞—Е –ї–µ—З–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–Є H.pylori: IV –Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Њ–µ —Б–Њ–≥–ї–∞—И–µ–љ–Є–µ, —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О H. pylori —Г –≤–Ј—А–Њ—Б–ї—Л—Е (2013), V –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Њ–µ —Б–Њ–≥–ї–∞—И–µ–љ–Є–µ вАУ –°—В–∞–љ–і–∞—А—В—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –Ї–Є—Б–ї–Њ—В–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б Helicobacter pylori –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (2013) [8, 15вАУ17].
–Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ –Ї —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤ –њ–Њ–≤—Л—И–∞–µ—В –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М, —Б–љ–Є–ґ–∞–µ—В —З–∞—Б—В–Њ—В—Г –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ (–і–Є—Б–±–Є–Њ–Ј –Ї–Є—И–µ—З–љ–Є–Ї–∞, –∞–љ—В–Є–±–Є–Њ—В–Є–Ї-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–∞—П –і–Є–∞—А–µ—П), –њ–Њ–≤—Л—И–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є –±–∞–Ї—В–µ—А–Є–Є –Ј–∞ —Б—З–µ—В –њ—А—П–Љ–Њ–≥–Њ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ H. pylori –Є –њ–Њ–≤—Л—И–µ–љ–Є—П –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ [18вАУ21].
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –Њ—Б–Њ–±–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Б—В–∞–ї–Њ –њ—А–Є–і–∞–≤–∞—В—М—Б—П –њ–Њ–Є—Б–Ї—Г –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ –љ–Њ–≤–Њ–≥–Њ —А–µ—И–µ–љ–Є—П –њ–Њ –Њ–њ—В–Є–Љ–Є–Ј–∞—Ж–Є–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –У—А—Г–њ–њ–Њ–є –љ–µ–Љ–µ—Ж–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –±—Л–ї —А–∞–Ј—А–∞–±–Њ—В–∞–љ –њ—А–µ–њ–∞—А–∞—В –љ–∞ –Њ—Б–љ–Њ–≤–µ –Є–љ–∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –њ—А–Њ–±–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е –±–∞–Ї—В–µ—А–Є–є Lactobacillus reuteri DSMZ 17648 (PylopassвДҐ), –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –Є –њ–µ—А–µ—А–∞–±–Њ—В–∞–љ–љ—Л—Е –±–Є–Њ—В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ—Г—В–µ–Љ. –Т–∞–ґ–љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ Lactobacillus reuteri DSMZ 17648 вАУ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ—Л–є —И—В–∞–Љ–Љ –ї–∞–Ї—В–Њ–±–∞—Ж–Є–ї–ї, –Њ–±–ї–∞–і–∞—О—Й–Є–є —Г–љ–Є–Ї–∞–ї—М–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ —Б–≤—П–Ј—Л–≤–∞—В—М—Б—П —Б H. pylori –Є –Њ–±—А–∞–Ј–Њ–≤—Л–≤–∞—В—М –Ї–Њ–∞–≥—А–µ–≥–∞—В—Л, –љ–µ –≤–ї–Є—П—П –љ–∞ –і—А—Г–≥–Є–µ –±–∞–Ї—В–µ—А–Є–Є –Є –љ–Њ—А–Љ–∞–ї—М–љ—Г—О –Ї–Є—И–µ—З–љ—Г—О —Д–ї–Њ—А—Г. –Ф–∞–љ–љ–Њ–µ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–µ —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ —Б–љ–Є–ґ–∞–µ—В –њ–Њ–і–≤–Є–ґ–љ–Њ—Б—В—М Helicobacter, –∞ –∞–≥—А–µ–≥–∞—В—Л –њ–∞—В–Њ–≥–µ–љ–Њ–≤ –њ–µ—А–µ—Б—В–∞—О—В —Б–≤—П–Ј—Л–≤–∞—В—М—Б—П —Б–Њ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Ц–Ъ–Ґ –Є ¬Ђ–≤—Л–Љ—Л–≤–∞—О—В—Б—П¬ї –Є–Ј –ґ–µ–ї—Г–і–Ї–∞, —З—В–Њ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Ї–Њ–ї–Њ–љ–Є–Ј–∞—Ж–Є–Є H. pylori –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –ґ–µ–ї—Г–і–Ї–∞, —Б–љ–Є–ґ–∞—П —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –≥–∞—Б—В—А–Є—В–∞ –Є –ѓ–С [21, 22]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П H. pylori –њ–Њ—Б–ї–µ 2—Е-–љ–µ–і–µ–ї—М–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ –њ—А–Є–µ–Љ–∞ –њ–Њ –і–∞–љ–љ—Л–Љ –і—Л—Е–∞—В–µ–ї—М–љ–Њ–≥–Њ —Г—А–µ–∞–Ј–љ–Њ–≥–Њ —В–µ—Б—В–∞. –Т –Ї–∞—З–µ—Б—В–≤–µ –Ї—А–Є—В–µ—А–Є—П –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є H. pylori –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –Љ–Њ—З–µ–≤–Є–љ–љ—Л–є –і—Л—Е–∞—В–µ–ї—М–љ—Л–є —В–µ—Б—В (–Ь–Ф–Ґ): –љ–∞–≥—А—Г–Ј–Ї–∞ H. pylori –њ–Њ—Б–ї–µ 2 –љ–µ–і. –њ—А–Є–µ–Љ–∞ PylopassвДҐ. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –њ–ї–∞—Ж–µ–±–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Ь–Ф–Ґ –љ–∞ 3% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ, –∞ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є Pylopass вАУ –љ–∞ 16% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Є—Б—Е–Њ–і–љ—Л–Љ [21, 23].
–Т –†–Њ—Б—Б–Є–Є –і–∞–љ–љ—Л–є –њ—А–Њ–і—Г–Ї—В –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ –њ–Њ–і —В–Њ—А–≥–Њ–≤—Л–Љ –љ–∞–Ј–≤–∞–љ–Є–µ–Љ –•–µ–ї–Є–љ–Њ—А–Љ, —П–≤–ї—П–µ—В—Б—П –Є–љ–љ–Њ–≤–∞—Ж–Є–Њ–љ–љ—Л–Љ –±–µ–Ј—А–µ—Ж–µ–њ—В—Г—А–љ—Л–Љ –∞–љ—В–Є—Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–љ—Л–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ —Б –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ –љ–Њ–≤—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П [21].
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Є–Ј—Г—З–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–Њ–і—Г–Ї—В–∞ –•–µ–ї–Є–љ–Њ—А–Љ, –љ–∞–Ј–љ–∞—З–∞–µ–Љ–Њ–≥–Њ —Б —Ж–µ–ї—М—О —В–µ—А–∞–њ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б HP-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є –ѓ–С –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є (–Ф–Я–Ъ).
–Ч–∞–і–∞—З–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П:
–Т—Л—П–≤–Є—В—М –≤–ї–Є—П–љ–Є–µ –њ—А–Њ–і—Г–Ї—В–∞ –•–µ–ї–Є–љ–Њ—А–Љ –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞:
вАУ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –Ї–∞—А—В–Є–љ—Г –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П;
вАУ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї—Г—О –Ї–∞—А—В–Є–љ—Г;
вАУ –Њ–±—Б–µ–Љ–µ–љ–µ–љ–љ–Њ—Б—В—М HP-–Є–љ—Д–µ–Ї—Ж–Є–µ–є;
вАУ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –•–µ–ї–Є–љ–Њ—А–Љ;
вАУ –Њ–±–Њ—Б–љ–Њ–≤–∞—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –•–µ–ї–Є–љ–Њ—А–Љ–∞ –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Ґ–Є–њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П вАУ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Ї–Њ–≥–Њ—А—В–љ–Њ–µ –Њ—В–Ї—А—Л—В–Њ–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ. –Ф–ї—П —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ –≥—А—Г–њ–њ–∞–Љ –±—Л–ї–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–∞ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–∞—П –±–ї–Њ–Ї–Њ–≤–∞—П —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є—П —Б –њ–µ—А–µ–Љ–µ–љ–љ—Л–Љ —А–∞–Ј–Љ–µ—А–Њ–Љ –±–ї–Њ–Ї–∞ (Randomly Mixed Permuted Blocks). –Т—Л–±–Њ—А –і–∞–љ–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є –±—Л–ї –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М—О –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–≥–Њ —А–∞–Ј–Љ–µ—А–∞ –≥—А—Г–њ–њ —Б—А–∞–≤–љ–µ–љ–Є—П вАУ 1:1:1 (–≤ –њ—А–Њ—Ж–µ—Б—Б–µ –њ—А–Њ—Ж–µ–і—Г—А—Л —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –њ—А–Њ—Б—В–Њ–є –≥–µ–љ–µ—А–∞—В–Њ—А —Б–ї—Г—З–∞–є–љ—Л—Е —З–Є—Б–µ–ї).
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –њ–∞—Ж–Є–µ–љ—В—Л —Б –ѓ–С –Ф–Я–Ъ, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б –Є–љ—Д–µ–Ї—Ж–Є–µ–є H. pylori. –°–Њ–≥–ї–∞—Б–љ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ –≤–Ї–ї—О—З–µ–љ–Є—П, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–Љ –љ–Є–ґ–µ, –њ–∞—Ж–Є–µ–љ—В—Л –Є–Љ–µ–ї–Є –ї–Є–±–Њ –ѓ–С –Ф–Я–Ъ –≤ —Д–∞–Ј–µ —А–µ—Ж–Є–і–Є–≤–∞ —П–Ј–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, –ї–Є–±–Њ —А—Г–±—Ж–Њ–≤—Г—О –і–µ—Д–Њ—А–Љ–∞—Ж–Є—О –ї—Г–Ї–Њ–≤–Є—Ж—Л –Ф–Я–Ъ, –љ–∞ —Д–Њ–љ–µ —Н—А–Њ–Ј–Є–≤–љ–Њ–≥–Њ –±—Г–ї—М–±–Є—В–∞ –Є–ї–Є –Є–љ—Л—Е —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ.
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П:
вАУ –њ–Њ–і–њ–Є—Б–∞–љ–Є–µ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ–≥–ї–∞—Б–Є—П;
вАУ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –Є –Є–љ—В–µ–ї–ї–µ–Ї—В—Г–∞–ї—М–љ–Њ-–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є;
вАУ –љ–∞–ї–Є—З–Є–µ –ѓ–С –Ф–Я–Ъ, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б –Є–љ—Д–µ–Ї—Ж–Є–µ–є H. pylori, –≤ —Д–∞–Ј–µ –Њ–±–Њ—Б—В—А–µ–љ–Є—П –љ–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ;
вАУ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –і—А—Г–≥–Є—Е –Њ—Б—В—А—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –љ–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ.
–Ъ—А–Є—В–µ—А–Є–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П:
вАУ –љ–∞–ї–Є—З–Є–µ —В—П–ґ–µ–ї—Л—Е –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Њ—А–≥–∞–љ–Њ–≤ –њ–Є—Й–µ–≤–∞—А–µ–љ–Є—П –Є–ї–Є –Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –љ–∞–њ—А–Є–Љ–µ—А, –ѓ–С (–њ—А–Є–Ј–љ–∞–Ї–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Є–Ј –Ц–Ъ–Ґ, –њ–µ—А—Д–Њ—А–∞—Ж–Є—П, –њ–µ–љ–µ—В—А–∞—Ж–Є—П, —Б—В–µ–љ–Њ–Ј –њ–Є–ї–Њ—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є –Ј–Њ–љ—Л, –Љ–∞–ї–Є–≥–љ–Є–Ј–∞—Ж–Є—П), –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –Ї–Є—И–µ—З–љ–Є–Ї–∞ (–Њ–њ—Г—Е–Њ–ї–Є, –і–Є–≤–µ—А—В–Є–Ї—Г–ї–µ–Ј), –Ю–Ъ–Ш, –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Ї–Є—И–µ—З–љ–Є–Ї–∞ (–±–Њ–ї–µ–Ј–љ—М –Ъ—А–Њ–љ–∞, —П–Ј–≤–µ–љ–љ—Л–є –Ї–Њ–ї–Є—В –Є –њ—А.) –љ–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ;
вАУ –љ–∞–ї–Є—З–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є: –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, –•–Ю–С–Ы —Б –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –≥–µ–њ–∞—В–Є—В—Л —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є, —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –њ–µ—З–µ–љ–Њ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М;
вАУ —Ж–µ–ї–Є–∞–Ї–Є—П;
вАУ —Б–Є—Б—В–µ–Љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є;
вАУ –њ—А–Є–µ–Љ —Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤;
вАУ –љ–∞–ї–Є—З–Є–µ –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –Є–ї–Є –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–∞;
вАУ –Ј–ї–Њ—Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –∞–ї–Ї–Њ–≥–Њ–ї–µ–Љ;
вАУ –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М –Є–ї–Є –Ї–Њ—А–Љ–ї–µ–љ–Є–µ –≥—А—Г–і—М—О;
вАУ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є–ї–Є –љ–µ–ґ–µ–ї–∞–љ–Є–µ –і–∞—В—М –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ —Г—З–∞—Б—В–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є–ї–Є –љ–∞ –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ —В—А–µ–±–Њ–≤–∞–љ–Є–є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П;
вАУ –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤ —В. —З. —А–∞–љ–µ–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ—Л–µ, –Ї–Њ—В–Њ—А—Л–µ, –њ–Њ –Љ–љ–µ–љ–Є—О –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П, –і–µ–ї–∞—О—В –љ–µ–њ—А–Є–µ–Љ–ї–µ–Љ—Л–Љ —Г—З–∞—Б—В–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є;
вАУ –љ–∞—А–Ї–Њ–Љ–∞–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ 1 –≥–Њ–і–∞ –і–Њ –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ;
вАУ —В—П–ґ–µ–ї—Л–µ —Б—Г–і–Њ—А–Њ–ґ–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ;
вАУ –њ–∞—Ж–Є–µ–љ—В—Л, —Б–Ї–ї–Њ–љ–љ—Л–µ –Ї –Њ—В–Ї–∞–Ј—Г –Њ—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є—О –њ—А–µ–і–њ–Є—Б–∞–љ–Є–є –≤—А–∞—З–∞;
вАУ –њ–∞—Ж–Є–µ–љ—В—Л, —Г—З–∞—Б—В–≤—Г—О—Й–Є–µ –≤ –і—А—Г–≥–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є—П—Е.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л 60 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В вАУ 36 –ї–µ—В), –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ 3 —Б—Е–Њ–і–љ—Л–µ –њ–Њ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–Љ—Г –Є –≥–µ–љ–і–µ—А–љ–Њ–Љ—Г —Б–Њ—Б—В–∞–≤—Г –≥—А—Г–њ–њ—Л –њ–Њ 20 —З–µ–ї–Њ–≤–µ–Ї.
–Я–∞—Ж–Є–µ–љ—В—Л –≥—А—Г–њ–њ—Л 1 (–≥—А—Г–њ–њ–∞ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П) –њ—А–Є–љ–Є–Љ–∞–ї–Є —Б–ї–µ–і—Г—О—Й—Г—О —В–µ—А–∞–њ–Є—О –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є:
вАУ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї 20 –Љ–≥ 2 —А./—Б—Г—В;
вАУ –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ 500 –Љ–≥ 2 —А./—Б—Г—В;
вАУ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ 1000 –Љ–≥ 2 —А./—Б—Г—В;
вАУ –Ф–µ-–љ–Њ–ї 240 –Љ–≥ 2 —А./—Б—Г—В.
–†–µ–ґ–Є–Љ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ —В–µ—А–∞–њ–Є–Є –±—Л–ї –љ–µ–Є–Ј–Љ–µ–љ–љ—Л–Љ.
–Я–∞—Ж–Є–µ–љ—В—Л –≥—А—Г–њ–њ—Л 2 (–≥—А—Г–њ–њ–∞ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П) –њ—А–Є–љ–Є–Љ–∞–ї–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ—Г—О —В–µ—А–∞–њ–Є—О –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є:
вАУ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї 20 –Љ–≥ 2 —А./—Б—Г—В;
вАУ –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ 500 –Љ–≥ 2 —А./—Б—Г—В;
вАУ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ 1000 –Љ–≥ 2 —А./—Б—Г—В.
–†–µ–ґ–Є–Љ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ —В–µ—А–∞–њ–Є–Є —В–∞–Ї–ґ–µ –±—Л–ї –љ–µ–Є–Ј–Љ–µ–љ–љ—Л–Љ.
–Я–∞—Ж–Є–µ–љ—В—Л –≥—А—Г–њ–њ—Л 3 (–Њ—Б–љ–Њ–≤–љ–∞—П –≥—А—Г–њ–њ–∞) –њ—А–Є–љ–Є–Љ–∞–ї–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ—Г—О —В–µ—А–∞–њ–Є—О –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є:
вАУ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї 20 –Љ–≥ 2 —А./—Б—Г—В;
вАУ –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ 500 –Љ–≥ 2 —А./—Б—Г—В;
вАУ –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ 1000 –Љ–≥ 2 —А./—Б—Г—В;
вАУ –њ—А–Њ–і—Г–Ї—В –•–µ–ї–Є–љ–Њ—А–Љ –њ–Њ 1 –Ї–∞–њ—Б—Г–ї–µ 2 —А./—Б—Г—В –≤–Њ –≤—А–µ–Љ—П –µ–і—Л –≤ —В–µ—З–µ–љ–Є–µ 28 –і–љ–µ–є (–љ–∞—З–∞–ї–Њ –њ—А–Є–µ–Љ–∞ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–Њ–≤–њ–∞–і–∞–ї–Њ —Б –Њ—Б–љ–Њ–≤–љ—Л–Љ —Б—В–∞—А—В–Њ–Љ —В–µ—А–∞–њ–Є–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –Є –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Њ—Б—М –µ—Й–µ 18 –і–љ–µ–є –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –±–∞–Ј–Є—Б–љ–Њ–≥–Њ –Ї—Г—А—Б–∞).
–Т —В–µ—З–µ–љ–Є–µ –њ–µ—А–Є–Њ–і–∞ –ї–µ—З–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –Ј–∞ –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є. –Я–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є –≤—Б–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±—Л–ї–Є –њ–Њ–≤—В–Њ—А–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ—Л –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –Њ–њ—А–Њ—Б, –Њ—Ж–µ–љ–Ї–∞ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є. –І–µ—А–µ–Ј 2 –Љ–µ—Б. –Њ—В –љ–∞—З–∞–ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ —Б –Ј–∞–±–Њ—А–Њ–Љ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є —Г—А–µ–∞–Ј–љ—Л–Љ —В–µ—Б—В–Њ–Љ. –Ф–Є–Ј–∞–є–љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –≤ —В–∞–±–ї–Є—Ж–µ 4.
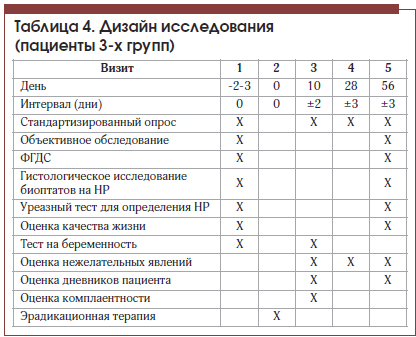
–Ъ–Њ–љ–µ—З–љ—Л–Љ–Є —В–Њ—З–Ї–∞–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є —Б–ї–µ–і—Г—О—Й–Є–µ: —З–∞—Б—В–Њ—В–∞ –ґ–∞–ї–Њ–± –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —З–∞—Б—В–Њ—В–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —В–µ—Б—В–Њ–≤ –љ–∞ H. pylori, —З–∞—Б—В–Њ—В–∞ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е –Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –њ–Њ –і–∞–љ–љ—Л–Љ –§–У–Ф–°, –Ј–љ–∞—З–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ–Њ —И–Ї–∞–ї–∞–Љ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –Њ–њ—А–Њ—Б–љ–Є–Ї–∞ SF-36.
–Р–љ–∞–ї–Є–Ј –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–∞–љ–љ—Л—Е –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ —Б –њ–Њ–Љ–Њ—Й—М—О –њ–∞–Ї–µ—В–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ–≥—А–∞–Љ–Љ SPSS 17.0 (SPSS In—Б., –°–®–Р) —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Љ–µ—В–Њ–і–Њ–≤ –њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–є –Є –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–є —Б—В–∞—В–Є—Б—В–Є–Ї–Є [24вАУ26]. –Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ —В–Є–њ–∞ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї—А–Є—В–µ—А–Є–µ–≤ –®–∞–њ–Є—А–Њ вАУ –£–Є–ї–Ї–∞ –Є –Ъ–Њ–ї–Љ–Њ–≥–Њ—А–Њ–≤–∞ вАУ –°–Љ–Є—А–љ–Њ–≤–∞. –Ґ–∞–Ї –Ї–∞–Ї —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –Є–Љ–µ–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ, –Њ—В–ї–Є—З–љ–Њ–µ –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ, –і–ї—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–њ–Є—Б–∞–љ–Є—П —Б—А–µ–і–љ–Є—Е —В–µ–љ–і–µ–љ—Ж–Є–є –≤–∞—А–Є–∞—Ж–Є–Њ–љ–љ—Л—Е –±—Л–ї–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–∞ –Љ–µ–і–Є–∞–љ–∞.
–Ф–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –њ–∞—А–љ—Л–є –Ї—А–Є—В–µ—А–Є–є –Т–Є–ї–Ї–Њ–Ї—Б–Њ–љ–∞ (–≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В–Є–њ–∞ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –і–∞–љ–љ—Л—Е). –°—А–∞–≤–љ–µ–љ–Є–µ –≥—А—Г–њ–њ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –і–Є—Б–њ–µ—А—Б–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ (–Ї—А–Є—В–µ—А–Є–є –Ъ—А–∞—Б–Ї–µ–ї–∞ вАУ –£–Њ–ї–ї–Є—Б–∞).
–Ф–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≤ –і–Є–љ–∞–Љ–Є–Ї–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –Ї—А–Є—В–µ—А–Є–є –Ь–∞–Ї-–Э–Є–Љ–∞—А–∞, –і–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л –Є—Б—Е–Њ–і–Њ–≤ –≤ –≥—А—Г–њ–њ–∞—Е –љ–∞–±–ї—О–і–µ–љ–Є—П вАУ –Ї—А–Є—В–µ—А–Є–є ѕЗ2 –Я–Є—А—Б–Њ–љ–∞ –Є –µ–≥–Њ –≤–∞—А–Є–∞—Ж–Є–Є (–њ–Њ–њ—А–∞–≤–Ї–∞ –Щ–µ–є—В—Б–∞ –љ–∞ –љ–µ–њ—А–µ—А—Л–≤–љ–Њ—Б—В—М –Є —В–Њ—З–љ—Л–є –Ї—А–Є—В–µ—А–Є–є –§–Є—И–µ—А–∞).
–£—А–Њ–≤–µ–љ—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є p<0,05 —Б—З–Є—В–∞–ї—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ –і–ї—П –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –љ—Г–ї–µ–≤–Њ–є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–Њ—В–µ–Ј—Л –Є –≤—Л–≤–Њ–і–∞ –Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є —А–∞–Ј–ї–Є—З–Є–є –і–∞–љ–љ—Л—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є. –Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л—Е —Б—А–∞–≤–љ–µ–љ–Є–є –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Ї—А–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–∞—Б—М –њ–Њ–њ—А–∞–≤–Ї–∞ –С–Њ–љ—Д–µ—А—А–Њ–љ–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –Ј–∞–≤–µ—А—И–Є–ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–Љ.
–Ю—Ж–µ–љ–Ї–∞ –ґ–∞–ї–Њ–± –њ–∞—Ж–Є–µ–љ—В–Њ–≤
–£ –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –Љ–Њ–Љ–µ–љ—В –љ–∞—З–∞–ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ–Є –ґ–∞–ї–Њ–±–∞–Љ–Є –±—Л–ї–Є –±–Њ–ї–Є –≤ –ґ–Є–≤–Њ—В–µ, –Њ—В—А—Л–ґ–Ї–∞, —В–Њ—И–љ–Њ—В–∞, —З—Г–≤—Б—В–≤–Њ –≥–Њ—А–µ—З–Є –≤–Њ —А—В—Г, —Г—А—З–∞–љ–Є–µ –≤ –ґ–Є–≤–Њ—В–µ –Є –≤–Ј–і—Г—В–Є–µ –ґ–Є–≤–Њ—В–∞. –Ф–Є–љ–∞–Љ–Є–Ї–∞ —З–∞—Б—В–Њ—В—Л –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е –ґ–∞–ї–Њ–± –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 5.

–°—А–µ–і–Є –ґ–∞–ї–Њ–± –љ–∞–Є–±–Њ–ї—М—И–Є–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П–ї –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ –Ї–∞–Ї –љ–∞–Є–±–Њ–ї–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–ї–Є—П–≤—И–Є–є –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –Љ–Њ–Љ–µ–љ—В–∞ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –љ–∞–±–ї—О–і–µ–љ–Є—П –Є –Љ–Њ–Љ–µ–љ—В–∞ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є –≤–Њ –≤—Б–µ—Е 3-—Е –≥—А—Г–њ–њ–∞—Е –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –±–Њ–ї–µ–є –≤ –ґ–Є–≤–Њ—В–µ: —Г—А–Њ–≤–µ–љ—М —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є —Б–Њ—Б—В–∞–≤–Є–ї 0,004, 0,008 –Є <0,001 –і–ї—П –≥—А—Г–њ–њ 1, 2 –Є 3 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
–Я—А–Є –њ–Њ–њ–∞—А–љ–Њ–Љ —Б—А–∞–≤–љ–µ–љ–Є–Є –≥—А—Г–њ–њ –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–љ–Є–ґ–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є 3 –Є 1 (ѕЗ2=12,554, p< 0,001) –Є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є 3 –Є 2 (ѕЗ2 = 11,165, p=0,001), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є 1 –Є 2 —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е —А–∞–Ј–ї–Є—З–Є–є –≤—Л—П–≤–ї–µ–љ–Њ –љ–µ –±—Л–ї–Њ (ѕЗ2=0,036, p=0,849).
–Ю—Ж–µ–љ–Ї–∞ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤
–Я–Њ—Б–ї–µ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л 2 –њ–Њ —И–Ї–∞–ї–∞–Љ GH, VT –Є MH –Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л 3 –њ–Њ —И–Ї–∞–ї–∞–Љ GH, BP, VT –Є MH, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л 1 —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –љ–Є –њ–Њ –Њ–і–љ–Њ–є –Є–Ј —И–Ї–∞–ї. –Ф–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ 6 –Є –љ–∞ —А–Є—Б—Г–љ–Ї–∞—Е 1вАУ3.
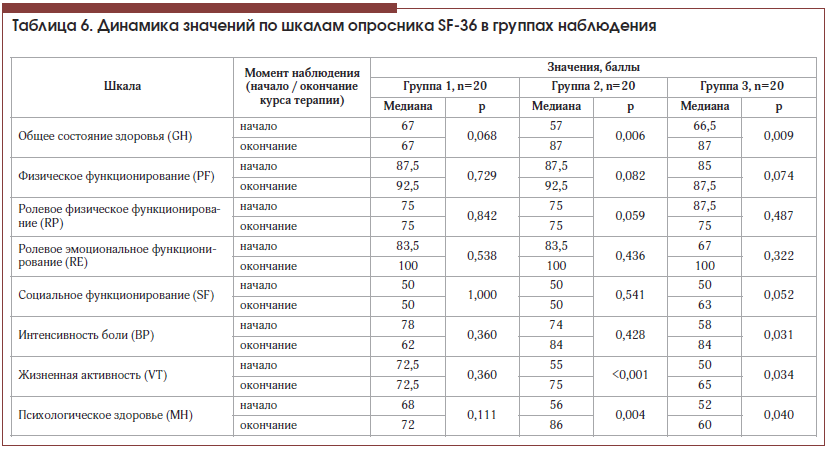

–°—А–∞–≤–љ–µ–љ–Є–µ –і–Є–љ–∞–Љ–Є–Ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —И–Ї–∞–ї –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –≤—Л—П–≤–Є–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є —В–Њ–ї—М–Ї–Њ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —И–Ї–∞–ї—Л ¬Ђ–Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–Є¬ї BP (ѕЗ2=2,920, p=0,012). –С–ї–Є–Ј–Ї–Є–Љ–Є –Ї —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —И–Ї–∞–ї—Л –ґ–Є–Ј–љ–µ–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є VT (ѕЗ2=5,942, p=0,051). –Я–Њ–њ–∞—А–љ—Л–µ –Љ–µ–ґ–≥—А—Г–њ–њ–Њ–≤—Л–µ —Б—А–∞–≤–љ–µ–љ–Є—П –Ј–љ–∞—З–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–Њ —И–Ї–∞–ї–µ ¬Ђ–Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–Є¬ї –њ–Њ–Ї–∞–Ј–∞–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є 3 –Є 1 (U=111,5, p=0,015) –Є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є 3 –Є 2 (U=106,0, p=0,010), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≥—А—Г–њ–њ—Л 1 –Є 2 —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М (U=179,5, p=0,583).
–Ю—Ж–µ–љ–Ї–∞ –і–∞–љ–љ—Л—Е –§–У–Ф–°
–Я–Њ –і–∞–љ–љ—Л–Љ –§–У–Ф–° —Г –≤—Б–µ—Е –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є H. pylori-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–є –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–Є—В. –£ 7 (12%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї–∞—Б—М —А—Г–±—Ж–Њ–≤–∞—П –і–µ—Д–Њ—А–Љ–∞—Ж–Є—П –ї—Г–Ї–Њ–≤–Є—Ж—Л –Ф–Я–Ъ, —Г 13 (22%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї–Є—Б—М —Н—А–Њ–Ј–Є–Є –≤ –ї—Г–Ї–Њ–≤–Є—Ж–µ –Ф–Я–Ъ, —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –Њ—В–µ—З–љ–Њ—Б—В—М –Є –≥–Є–њ–µ—А–µ–Љ–Є—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –Ф–Я–Ъ.
–£ 22 (37%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ —П–Ј–≤–∞ –Ф–Я–Ъ, —Г 14 (23%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї—Б—П —Н—А–Њ–Ј–Є–≤–љ—Л–є –±—Г–ї—М–±–Є—В, —Г –Њ—Б—В–∞–ї—М–љ—Л—Е 24 (40%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї –Љ–µ—Б—В–Њ –Ї–∞—В–∞—А–∞–ї—М–љ—Л–є –і—Г–Њ–і–µ–љ–Є—В.
–Э–∞ —Д–Њ–љ–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–µ–љ–Њ —Г–ї—Г—З—И–µ–љ–Є–µ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л вАУ —П–Ј–≤–µ–љ–љ—Л–є –і–µ—Д–µ–Ї—В –Ј–∞—А—Г–±—Ж–µ–≤–∞–ї—Б—П —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–Љ–µ–≤—И–Є—Е —П–Ј–≤—Г –Ф–Я–Ъ –љ–∞ –Љ–Њ–Љ–µ–љ—В –љ–∞—З–∞–ї–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Н—А–Њ–Ј–Є–≤–љ—Л–Љ –і—Г–Њ–і–µ–љ–Є—В–Њ–Љ –Є–Љ–µ–≤—И–Є–µ—Б—П —Н—А–Њ–Ј–Є–Є –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є —Н–њ–Є—В–µ–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є—Б—М.
–Я—А–Є —Н—В–Њ–Љ –≥–Є–њ–µ—А–µ–Љ–Є—П –Є –Њ—В–µ—З–љ–Њ—Б—В—М —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –ґ–µ–ї—Г–і–Ї–∞ –Є –Ф–Я–Ъ —Б–Њ—Е—А–∞–љ—П–ї–Є—Б—М —Г 5 (25%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л 1, 2 (10%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л 2 –Є —Г 2 (10%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л 3.
–Ю—Ж–µ–љ–Ї–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є H. pylori –Є —Г—А–µ–∞–Ј–љ–Њ–≥–Њ —В–µ—Б—В–∞
–Э–∞ –Љ–Њ–Љ–µ–љ—В –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є H. pylori –Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Г—А–µ–∞–Ј–љ—Л–є —В–µ—Б—В –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л —Г –≤—Б–µ—Е –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—Б–Њ–≥–ї–∞—Б–љ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ).
–Я–Њ—Б–ї–µ –Ї—Г—А—Б–∞ –ї–µ—З–µ–љ–Є—П –≤–Њ –≤—Б–µ—Е 3-—Е –≥—А—Г–њ–њ–∞—Е –Њ—В–Љ–µ—З–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –≤—Л—П–≤–ї–µ–љ–Є—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є—В–Њ–≥–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є H. pylori –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ї–∞–Ї –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —В–∞–Ї –Є —Г—А–µ–∞–Ј–љ–Њ–≥–Њ —В–µ—Б—В–∞ (—В–∞–±–ї. 7, —А–Є—Б. 4). –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –≤ –≥—А—Г–њ–њ–µ, –њ–Њ–ї—Г—З–∞–≤—И–µ–є –•–µ–ї–Є–љ–Њ—А–Љ, –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є —В–Њ–ї—М–Ї–Њ —Г 1 –њ–∞—Ж–Є–µ–љ—В–∞ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –љ–∞–ї–Є—З–Є–µ H. pylori, –≤ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ—Б—В—М 6 –Є 3 –њ–∞—Ж–Є–µ–љ—В–∞–Љ –≥—А—Г–њ–њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П —Б –і–Њ–±–∞–≤–ї–µ–љ–Є–µ–Љ –Ф–µ-–Э–Њ–ї–∞ –Є –њ—А–Њ—Б—В–Њ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
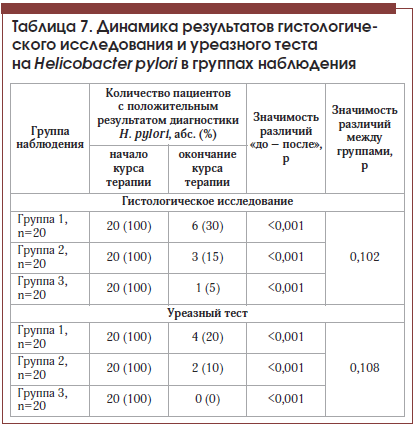
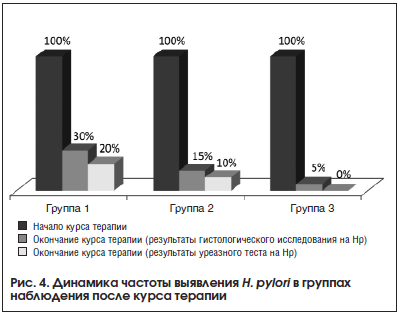
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е, —Г –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤—Л—П–≤–ї–µ–љ–Є—П H. pylori –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –Є —Г—А–µ–∞–Ј–љ–Њ–≥–Њ —В–µ—Б—В–∞ –љ–µ –Є–Љ–µ–ї–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е —А–∞—Б—Е–Њ–ґ–і–µ–љ–Є–є.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –∞–љ–∞–ї–Є–Ј–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Є—Е –і–∞–љ–љ—Л—Е, –њ–Њ—Б–ї–µ –Ї—Г—А—Б–∞ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≤–Њ –≤—Б–µ—Е 3-—Е –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–Њ –њ—А–Є —Н—В–Њ–Љ –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Н–ї–Є–Љ–Є–љ–Є—А–Њ–≤–∞–ї—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л 3, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–є –•–µ–ї–Є–љ–Њ—А–Љ –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ґ–∞–Ї–ґ–µ –Њ–±—А–∞—В–Є–ї–Њ –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –≤ –≥—А—Г–њ–њ–µ –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –њ—А–Њ–і—Г–Ї—В–∞ –•–µ–ї–Є–љ–Њ—А–Љ, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–і–µ–ї–∞—В—М –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ—А–Њ—Д–Є–ї—П –µ–≥–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є.
–Я–Њ—Б–ї–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–Њ–і—Г–Ї—В–∞ –•–µ–ї–Є–љ–Њ—А–Љ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ —Б —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є –Њ—В–Љ–µ—З–µ–љ–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ–±—Л—З–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–Љ–Є —Б—Е–µ–Љ–∞–Љ–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Њ —Б–≤—П–Ј–∞–љ–Њ —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞.
–≠–ї–Є–Љ–Є–љ–∞—Ж–Є—П H. pylori –њ–Њ –і–∞–љ–љ—Л–Љ –Њ–±–Њ–Є—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л—Е —В–µ—Б—В–Њ–≤ (–≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є —Г—А–µ–∞–Ј–љ–Њ–≥–Њ) –±—Л–ї–∞ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –•–µ–ї–Є–љ–Њ—А–Љ (95 –Є 100% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ), –њ—А–Є —Н—В–Њ–Љ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –±—Л–ї–∞ —Б—Е–Њ–і–љ–Њ–є –≤–Њ –≤—Б–µ—Е 3-—Е –≥—А—Г–њ–њ–∞—Е –љ–∞–±–ї—О–і–µ–љ–Є—П.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –≤–Ї–ї—О—З–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—В–∞ –•–µ–ї–Є–љ–Њ—А–Љ –≤ —Б—В–∞–љ–і–∞—А—В–љ—Г—О —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ—Г—О —Б—Е–µ–Љ—Г –ї–µ—З–µ–љ–Є—П –Љ–Њ–ґ–µ—В –њ–Њ–≤—Л—Б–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є Helicobacter pylori-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Я–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–∞–Ї–∞—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Б—А–∞–≤–љ–Є–Љ–∞ —Б –≥—А—Г–њ–њ–Њ–є, –њ–Њ–ї—Г—З–∞–≤—И–µ–є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ—Г—О —В–µ—А–∞–њ–Є—О + –Ф–µ-–Э–Њ–ї, –∞ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —Б—А–µ–і—Б—В–≤–∞ –•–µ–ї–Є–љ–Њ—А–Љ –≤—Л–≥–Њ–і–љ–Њ –≤—Л–і–µ–ї—П–µ—В –њ—А–Њ–і—Г–Ї—В —Б—А–µ–і–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –±–Њ—А—М–±—Л —Б H. pylori.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я—А–Є–µ–Љ –њ—А–Њ–і—Г–Ї—В–∞ –•–µ–ї–Є–љ–Њ—А–Љ –≤–Љ–µ—Б—В–µ —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є:
вАУ –њ–Њ–≤—Л—И–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori –љ–∞ 10%;
вАУ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –Ї–∞—А—В–Є–љ—Г –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П Helicobacter pylori-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є –ѓ–С –Ф–Я–Ъ –Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—О –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–≥–Њ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞;
вАУ –Є–Љ–µ–µ—В —Е–Њ—А–Њ—И—Г—О –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М;
вАУ —Г–ї—Г—З—И–∞–µ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –≤—Л—Б–Њ–Ї–Њ–є –Љ–µ–і–Є–Ї–Њ-—Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –і–∞–љ–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ –Ї –ї–µ—З–µ–љ–Є—О.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –•–µ–ї–Є–љ–Њ—А–Љ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –і–ї—П –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б Helicobacter pylori-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є.
–†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–∞—П —Б—Е–µ–Љ–∞ –њ—А–Є–µ–Љ–∞ –њ—А–Њ–і—Г–Ї—В–∞ –•–µ–ї–Є–љ–Њ—А–Љ вАУ –њ–Њ 1 –Ї–∞–њ—Б—Г–ї–µ 2 —А./—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 28 –і–љ–µ–є, –љ–∞ —Д–Њ–љ–µ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є.












