–•—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā
–ļ–į–ļ –ľ–Ķ–ī–ł–ļ–ĺ–—Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–į—Ź –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ–į
–ü—Ä–ĺ–Ī–Ľ–Ķ–ľ–į —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–į (–•–ü) —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ĺ–ī–Ĺ–ĺ–Ļ –ł–∑ –į–ļ—ā—É–į–Ľ—Ć–Ĺ—č—Ö –≤ —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł–ł. –ē–Ķ –ļ—Ä–į–Ļ–Ĺ—Ź—Ź –ĺ—Ā—ā—Ä–ĺ—ā–į –ł –∑–Ľ–ĺ–Ī–ĺ–ī–Ĺ–Ķ–≤–Ĺ–ĺ—Ā—ā—Ć –∑–į—ā—Ä–į–≥–ł–≤–į—é—ā –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ —Ā—É–≥—É–Ī–ĺ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ, –Ĺ–ĺ —ā–į–ļ–∂–Ķ —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ—č–Ķ –ł —ć–ļ–ĺ–Ĺ–ĺ–ľ–ł—á–Ķ—Ā–ļ–ł–Ķ –į—Ā–Ņ–Ķ–ļ—ā—č –ĺ–ļ–į–∑–į–Ĺ–ł—Ź –ľ–Ķ–ī–ł—Ü–ł–Ĺ—Ā–ļ–ĺ–Ļ –Ņ–ĺ–ľ–ĺ—Č–ł —ć—ā–ĺ–Ļ –ļ–į—ā–Ķ–≥–ĺ—Ä–ł–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤.
–ß–į—Ā—ā–ĺ—ā–į –•–ü –≤–ĺ –≤—Ā–Ķ–ľ –ľ–ł—Ä–Ķ –ĺ—ā—á–Ķ—ā–Ľ–ł–≤–ĺ —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ķ—ā—Ā—Ź. –ó–į –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł–Ķ 30 –Ľ–Ķ—ā –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–ĺ –Ī–ĺ–Ľ–Ķ–Ķ —á–Ķ–ľ –ī–≤—É–ļ—Ä–į—ā–Ĺ–ĺ–Ķ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ķ–ľ–ĺ—Ā—ā–ł. –ě—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –ī—Ä–į–ľ–į—ā–ł—á–Ĺ–ĺ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –•–ü –≤ –†–ĺ—Ā—Ā–ł–ł. –ó–į –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł–Ķ 10 –Ľ–Ķ—ā —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ķ–ľ–ĺ—Ā—ā–ł —Ā—Ä–Ķ–ī–ł –Ľ–ł—Ü –ľ–ĺ–Ľ–ĺ–ī–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į –ł –Ņ–ĺ–ī—Ä–ĺ—Ā—ā–ļ–ĺ–≤ –≤—č—Ä–ĺ—Ā –≤ 4 —Ä–į–∑–į [–ď.–í. –†–ł–ľ–į—Ä—á—É–ļ —Ā–ĺ–į–≤—ā., 2003]. –ü–ĺ––≤–ł–ī–ł–ľ–ĺ–ľ—É, –ī–į–Ĺ–Ĺ–į—Ź —ā–Ķ–Ĺ–ī–Ķ–Ĺ—Ü–ł—Ź –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–į, –≤–ĺ––Ņ–Ķ—Ä–≤—č—Ö, —Ä–ĺ—Ā—ā–ĺ–ľ —É–Ņ–ĺ—ā—Ä–Ķ–Ī–Ľ–Ķ–Ĺ–ł—Ź –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ź –ł, —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ, —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ–ľ —á–ł—Ā–Ľ–į –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ—č–ľ –•–ü, –≤–ĺ––≤—ā–ĺ—Ä—č—Ö, –Ĺ–Ķ—Ä–į—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ—č–ľ –Ĺ–Ķ—Ā–Ī–į–Ľ–į–Ĺ—Ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–ľ –Ņ–ł—ā–į–Ĺ–ł–Ķ–ľ (–≤—č—Ā–ĺ–ļ–į—Ź —á–į—Ā—ā–ĺ—ā–į –∂–Ķ–Ľ—á–Ĺ–ĺ––ļ–į–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł, –ļ–į–ļ –ĺ–ī–Ĺ–į –ł–∑ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č—Ö –Ņ—Ä–ł—á–ł–Ĺ –Ī–ł–Ľ–ł–į—Ä–Ĺ–ĺ–≥–ĺ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–į). –° –ī—Ä—É–≥–ĺ–Ļ —Ā—ā–ĺ—Ä–ĺ–Ĺ—č, –ł–ľ–Ķ–Ķ—ā –ľ–Ķ—Ā—ā–ĺ –ł –≥–ł–Ņ–Ķ—Ä–ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–į –•–ü. –°–į–ľ—č–Ķ —Ä–į–∑–Ĺ–ĺ–ĺ–Ī—Ä–į–∑–Ĺ—č–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –Ņ–ł—Č–Ķ–≤–į—Ä–Ķ–Ĺ–ł—Ź, –∑–į—á–į—Ā—ā—É—é –Ĺ–Ķ —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č–Ķ —Ā –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑–ĺ–Ļ, «—ć—Ö–ĺ–≥–Ķ–Ĺ–Ĺ–į—Ź –Ĺ–Ķ–ĺ–ī–Ĺ–ĺ—Ä–ĺ–ī–Ĺ–ĺ—Ā—ā—Ć» –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č, –≤—č—Ź–≤–Ľ–Ķ–Ĺ–Ĺ–į—Ź –Ņ—Ä–ł —É–Ľ—Ć—ā—Ä–į–∑–≤—É–ļ–ĺ–≤–ĺ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł, –Ĺ–Ķ—Ä–Ķ–ī–ļ–ĺ —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į—é—ā—Ā—Ź –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ–≥–ĺ –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł—Ź –ī–Ľ—Ź –Ņ–ĺ—Ā—ā–į–Ĺ–ĺ–≤–ļ–ł –ī–ł–į–≥–Ĺ–ĺ–∑–į.
–ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ –ľ–Ĺ–ĺ–≥–ł—Ö –į–≤—ā–ĺ—Ä–ĺ–≤, —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –•–ü —Ā—Ä–Ķ–ī–ł –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö —Ā—ā—Ä–į–Ĺ –≤–į—Ä—Ć–ł—Ä—É–Ķ—ā –ĺ—ā 0,2 –ī–ĺ 0,68%, –į —Ā—Ä–Ķ–ī–ł –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ą–ł–Ľ—Ź –ī–ĺ—Ā—ā–ł–≥–į–Ķ—ā 6–9%. –ē–∂–Ķ–≥–ĺ–ī–Ĺ–ĺ —É 8,2–10 —á–Ķ–Ľ–ĺ–≤–Ķ–ļ –Ĺ–į 100 —ā—č—Ā. –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä—É–Ķ—ā—Ā—Ź –•–ü. –†–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –≤ –ē–≤—Ä–ĺ–Ņ–Ķ —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā 25–26,4 —Ā–Ľ—É—á–į–Ķ–≤ –Ĺ–į 100 —ā—č—Ā. –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź, –≤ –†–ĺ—Ā—Ā–ł–ł – —Ā—Ä–Ķ–ī–ł –≤–∑—Ä–ĺ—Ā–Ľ–ĺ–≥–ĺ –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź 27,4–50 –Ĺ–į 100 —ā—č—Ā., —É –ī–Ķ—ā–Ķ–Ļ 9–25 —Ā–Ľ—É—á–į–Ķ–≤ –Ĺ–į 100 —ā—č—Ā. [–Ę.–Ě. –õ–ĺ–Ņ–į—ā–ļ–ł–Ĺ–į –Ę.–Ě. 1997, –ď.–í. –¶—É–ľ–į–Ĺ –ł —Ā–ĺ–į–≤—ā. 2000]. –í –Ņ—Ä–į–ļ—ā–ł–ļ–Ķ –≤—Ä–į—á–į––≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–į –Ņ–ĺ–Ľ–ł–ļ–Ľ–ł–Ĺ–ł–ļ–ł –Ī–ĺ–Ľ—Ć–Ĺ—č–Ķ –•–ü —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź—é—ā –Ņ—Ä–ł–ľ–Ķ—Ä–Ĺ–ĺ 35–45%, –≤ –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–ľ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł–ł —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–į – –ī–ĺ 20–45%.
–ü—Ä–ĺ–≥–Ĺ–ĺ–∑ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ—ā—Ā—Ź —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ĺ–ľ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–į: —á–į—Ā—ā—č–Ķ –į—ā–į–ļ–ł –Ī–ĺ–Ľ–Ķ–≤–ĺ–Ļ —Ą–ĺ—Ä–ľ—č –•–ü —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į—é—ā—Ā—Ź –≤—č—Ā–ĺ–ļ–ł–ľ —Ä–ł—Ā–ļ–ĺ–ľ —Ä–į–∑–≤–ł—ā–ł—Ź –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ, –Ľ–Ķ—ā–į–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –Ņ—Ä–ł –ļ–ĺ—ā–ĺ—Ä—č—Ö —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā –ī–ĺ 5,5% [–ģ.–ź. –Ě–Ķ—Ā—ā–Ķ—Ä–Ķ–Ĺ–ļ–ĺ, 2000]. –í–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–į—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č —ā—Ä—É–ī–Ĺ–ĺ –ļ–ĺ—Ä—Ä–ł–≥–ł—Ä—É–Ķ—ā—Ā—Ź, —á–į—Ā—ā–ĺ —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ķ—ā—Ā—Ź –ł –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É–Ķ—ā (–ī–į–∂–Ķ –Ĺ–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ–ĺ–Ļ –∑–į–ľ–Ķ—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł) –ł –Ĺ–Ķ–ľ–ł–Ĺ—É–Ķ–ľ–ĺ –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź–ľ –Ĺ—É—ā—Ä–ł—ā–ł–≤–Ĺ–ĺ–≥–ĺ —Ā—ā–į—ā—É—Ā–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –ī–ł—Ā—ā—Ä–ĺ—Ą–ł—á–Ķ—Ā–ļ–ł–ľ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź–ľ –≤–Ĺ—É—ā—Ä–Ķ–Ĺ–Ĺ–ł—Ö –ĺ—Ä–≥–į–Ĺ–ĺ–≤.
–í–į–∂–Ĺ–į—Ź –ľ–Ķ–ī–ł–ļ–ĺ–—Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ—É—é –∑–Ĺ–į—á–ł–ľ–ĺ—Ā—ā—Ć –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ—č –•–ü –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–į –Ķ–Ķ —ą–ł—Ä–ĺ–ļ–ł–ľ —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–ł–Ķ–ľ —Ā—Ä–Ķ–ī–ł —ā—Ä—É–ī–ĺ—Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ–≥–ĺ –Ĺ–į—Ā–Ķ–Ľ–Ķ–Ĺ–ł—Ź (–ĺ–Ī—č—á–Ĺ–ĺ –•–ü —Ä–į–∑–≤–ł–≤–į–Ķ—ā—Ā—Ź –≤ –≤–ĺ–∑—Ä–į—Ā—ā–Ķ 35–50 –Ľ–Ķ—ā), –ó–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É–Ķ—ā—Ā—Ź –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ, –Ņ—Ä–ĺ–≥—Ä–Ķ–ī–ł–Ķ–Ĺ—ā–Ĺ—č–ľ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ, –ļ—Ä–į–Ļ–Ĺ–Ķ –Ĺ–Ķ–≥–į—ā–ł–≤–Ĺ–ĺ –≤–Ľ–ł—Ź—é—Č–ł–ľ –Ĺ–į –ļ–į—á–Ķ—Ā—ā–≤–ĺ –∂–ł–∑–Ĺ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ł –Ņ—Ä–ł–≤–ĺ–ī—Ź—Č–ł–ľ –ļ —á–į—Ā—ā–ł—á–Ĺ–ĺ–Ļ –ł–Ľ–ł –Ņ–ĺ–Ľ–Ĺ–ĺ–Ļ —É—ā—Ä–į—ā–Ķ —ā—Ä—É–ī–ĺ—Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā–ł. –ė–Ĺ–≤–į–Ľ–ł–ī–ł–∑–į—Ü–ł—Ź –Ņ—Ä–ł –•–ü –ī–ĺ—Ā—ā–ł–≥–į–Ķ—ā 15% [M. Jaakkola –ł —Ā–ĺ–į–≤—ā., 1998].
–Ě–Ķ–ľ–į–Ľ–ĺ–≤–į–∂–Ĺ—č–ľ–ł –≤ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–ľ –ł —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ–ľ –Ņ–Ľ–į–Ĺ–Ķ —Ź–≤–Ľ—Ź—é—ā—Ā—Ź –ł —ā–į–ļ–ł–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–ĺ–≤, –ļ–į–ļ –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–Ķ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ —Ā –Ņ–ĺ—Ā—ā–Ķ–Ņ–Ķ–Ĺ–Ĺ—č–ľ –Ĺ–į—Ä–į—Ā—ā–į–Ĺ–ł–Ķ–ľ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł, –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —Ā–ĺ—Ö—Ä–į–Ĺ—Ź—é—Č–ł–Ķ—Ā—Ź –ł –Ī—č—Ā—ā—Ä–ĺ –≤–ĺ–∑–≤—Ä–į—Č–į—é—Č–ł–Ķ—Ā—Ź –Ņ—Ä–ł –Ľ—é–Ī–ĺ–Ļ –Ņ–ĺ–≥—Ä–Ķ—ą–Ĺ–ĺ—Ā—ā–ł –≤ –Ņ–ł—ā–į–Ĺ–ł–ł –Ī–ĺ–Ľ—Ć –ł –ī–ł—Ā–Ņ–Ķ–Ņ—Ā–ł—Ź, –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–ł–≤–į—é—Č–ł–Ķ, —Ā –ĺ–ī–Ĺ–ĺ–Ļ —Ā—ā–ĺ—Ä–ĺ–Ĺ—č, –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā—Ć —á–į—Ā—ā–ĺ–≥–ĺ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł—Ź –ī–ĺ—Ä–ĺ–≥–ĺ—Ā—ā–ĺ—Ź—Č–ł—Ö –Ľ–Ķ—á–Ķ–Ī–Ĺ—č—Ö –ľ–Ķ—Ä–ĺ–Ņ—Ä–ł—Ź—ā–ł–Ļ –ł –ī–ł—Ā–Ņ–į–Ĺ—Ā–Ķ—Ä–Ĺ–ĺ–≥–ĺ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź, –į —Ā –ī—Ä—É–≥–ĺ–Ļ —Ā—ā–ĺ—Ä–ĺ–Ĺ—č, —ā—Ä–Ķ–Ī—É—é—Č–ł—Ö –ĺ—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –Ņ–ĺ—Ā—ā–ĺ—Ź–Ĺ–Ĺ–ĺ–≥–ĺ —Ā–ĺ–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź —Ä–Ķ–∂–ł–ľ–į –į–Ī—Ā—ā–ł–Ĺ–Ķ–Ĺ—Ü–ł–ł –ł –ī–ł–Ķ—ā—č, –Ņ—Ä–ł–Ķ–ľ–į —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤.
–ě –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–ľ, –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–Ķ–ľ —ā–Ķ—á–Ķ–Ĺ–ł–ł –•–ü —Ā–≤–ł–ī–Ķ—ā–Ķ–Ľ—Ć—Ā—ā–≤—É–Ķ—ā –≤—č—Ā–ĺ–ļ–į—Ź —Ā–ľ–Ķ—Ä—ā–Ĺ–ĺ—Ā—ā—Ć. –í —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ņ–Ķ—Ä–≤—č—Ö –ī–Ķ—Ā—Ź—ā–ł –Ľ–Ķ—ā –Ņ–ĺ—Ā–Ľ–Ķ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–Ķ–Ĺ–ł—Ź –ī–ł–į–≥–Ĺ–ĺ–∑–į –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –•–ü –ł –Ĺ–į—á–į–Ľ–į –ļ–ĺ–Ĺ—Ā–Ķ—Ä–≤–į—ā–ł–≤–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ–ĺ–≥–ł–Ī–į–Ķ—ā –Ī–ĺ–Ľ–Ķ–Ķ 30% –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –į –∑–į 20––Ľ–Ķ—ā–Ĺ–ł–Ļ –Ņ–Ķ—Ä–ł–ĺ–ī – –ĺ–ļ–ĺ–Ľ–ĺ 50% [Lankisch P.G.1993, –ė–≤–į—ą–ļ–ł–Ĺ –í.–Ę. –ł —Ā–ĺ–į–≤—ā., 1996]. –†–ł—Ā–ļ —ā—Ä–į–Ĺ—Ā—Ą–ĺ—Ä–ľ–į—Ü–ł–ł –•–ü –≤ —Ä–į–ļ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā 5% –ł —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ–ĺ–≤—č—ą–į–Ķ—ā—Ā—Ź —Ā —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł–Ķ–ľ –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ł –≤–ĺ–∑—Ä–į—Ā—ā–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ [–ď—É–Ī–Ķ—Ä–≥—Ä–ł—Ü –Ě.–Ď., –•–į–∑–į–Ĺ–ĺ–≤ –ź.–ė.].
–ď—Ä—É–Ņ–Ņ–į —ć–ļ—Ā–Ņ–Ķ—Ä—ā–ĺ–≤––Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ĺ–Ľ–ĺ–≥–ĺ–≤ –≤ 1995 –≥–ĺ–ī—É –ī–į–Ľ–į —ā–į–ļ–ĺ–Ķ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ: «–•—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–į–Ķ—ā –ĺ—Ā—ā–į–≤–į—ā—Ć—Ā—Ź –∑–į–≥–į–ī–ĺ—á–Ĺ—č–ľ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–ĺ–ľ –Ĺ–Ķ—Ź—Ā–Ĺ–ĺ–≥–ĺ –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑–į, –Ĺ–Ķ–Ņ—Ä–Ķ–ī—Ā–ļ–į–∑—É–Ķ–ľ–ĺ–≥–ĺ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –ł –ī–ĺ –ļ–ĺ–Ĺ—Ü–į –Ĺ–Ķ–Ņ–ĺ–Ĺ—Ź—ā–Ĺ—č—Ö –Ņ–ĺ–ī—Ö–ĺ–ī–ĺ–≤ –ļ –Ķ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—é» [Steer et al., N Engl J Med, 1995].
–ö —Ā–ĺ–∂–į–Ľ–Ķ–Ĺ–ł—é, –ł —Ā–Ķ–≥–ĺ–ī–Ĺ—Ź –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ—č –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł–ł, –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł, –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –ł –ī–į–∂–Ķ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–į –ĺ—Ā—ā–į—é—ā—Ā—Ź –Ĺ–Ķ—Ä–Ķ—ą–Ķ–Ĺ–Ĺ—č–ľ–ł. –Ď–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ–Ķ–Ļ –Ņ–ĺ–ī —ā–Ķ—Ä–ľ–ł–Ĺ–ĺ–ľ –•–ü –ĺ–Ī—ä–Ķ–ī–ł–Ĺ—Ź—é—ā –Ĺ–Ķ–ĺ–ī–Ĺ–ĺ—Ä–ĺ–ī–Ĺ—É—é –≥—Ä—É–Ņ–Ņ—É —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č —Ä–į–∑–Ľ–ł—á–Ĺ–ĺ–Ļ —ć—ā–ł–ĺ–Ľ–ĺ–≥–ł–ł, –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –Ņ—Ä–ł—Ä–ĺ–ī—č.
–ě–ī–Ĺ–į–ļ–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā –≤–ĺ—Ā–Ņ–į–Ľ–Ķ–Ĺ–ł—Ź –≤ —Ā–Ľ—É—á–į–Ķ –•–ü –ł–ľ–Ķ–Ķ—ā —Ā–≤–ĺ–ł –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł. –ú–ĺ—Ä—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —ā–ļ–į–Ĺ–ł –ĺ—Ä–≥–į–Ĺ–į —Ā–≤—Ź–∑–į–Ĺ—č —Ā –≤–ĺ–∑–ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ–ľ —Ā–ĺ–Ī—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –∂–Ķ–Ľ–Ķ–∑—č, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –≤–Ĺ—É—ā—Ä–ł–ĺ—Ä–≥–į–Ĺ–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–į—Ü–ł–ł (—ā—Ä–į–Ĺ—Ā—Ą–ĺ—Ä–ľ–į—Ü–ł–ł –ł–∑ –Ĺ–Ķ–į–ļ—ā–ł–≤–Ĺ—č—Ö –Ņ—Ä–Ķ–ī—ą–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ł–ļ–ĺ–≤ –≤ –į–ļ—ā–ł–≤–Ĺ—č–Ķ —Ą–ĺ—Ä–ľ—č —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤) –ĺ–ļ–į–∑—č–≤–į—é—ā –Ņ–ĺ–≤—Ä–Ķ–∂–ī–į—é—Č–Ķ–Ķ –≤–ĺ–∑–ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ –Ĺ–į —ā–ļ–į–Ĺ—Ć –∂–Ķ–Ľ–Ķ–∑—č, –Ĺ–ĺ—Ā—Ź—ā –Ĺ–Ķ–ĺ–Ī—Ä–į—ā–ł–ľ—č–Ļ —Ö–į—Ä–į–ļ—ā–Ķ—Ä, –Ņ—Ä–ł–≤–ĺ–ī—Ź—ā –ļ –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–Ķ–ľ—É —Ą–ł–Ī—Ä–ĺ–∑—É, —Ā—ā—Ä–ł–ļ—ā—É—Ä–Ķ –Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–≤, –į—ā—Ä–ĺ—Ą–ł–ł –į—Ü–ł–Ĺ—É—Ā–ĺ–≤ –ł –Ĺ–Ķ—Ä–Ķ–ī–ļ–ĺ –ĺ—Ā—ā—Ä–ĺ–≤–ļ–ĺ–≤–ĺ–≥–ĺ –į–Ņ–Ņ–į—Ä–į—ā–į —Ā —Ä–į–∑–≤–ł—ā–ł–Ķ–ľ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł. –í –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ļ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā –≤–ĺ–≤–Ľ–Ķ–ļ–į—é—ā—Ā—Ź –ł–Ĺ—ā–Ķ—Ä—Ā—ā–ł—Ü–ł–į–Ľ—Ć–Ĺ–į—Ź —ā–ļ–į–Ĺ—Ć, –≤–Ĺ—É—ā—Ä–ł–ĺ—Ä–≥–į–Ĺ–Ĺ—č–Ķ —Ā–ĺ—Ā—É–ī—č –ł –Ĺ–Ķ—Ä–≤—č. –ü–ĺ–≤—ā–ĺ—Ä—Ź—é—Č–ł–Ķ—Ā—Ź –į—ā–į–ļ–ł –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–į –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–ł–≤–į—é—ā –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–ł–Ķ –į–Ĺ–į—ā–ĺ–ľ–ł—á–Ķ—Ā–ļ–ł–Ķ –ł —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ—č–Ķ –Ņ–ĺ–≤—Ä–Ķ–∂–ī–Ķ–Ĺ–ł—Ź –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č, –ļ–ĺ—ā–ĺ—Ä–į—Ź –Ĺ–ł–ļ–ĺ–≥–ī–į —É–∂–Ķ –Ņ–ĺ–Ľ–Ĺ–ĺ—Ā—ā—Ć—é –Ĺ–Ķ –≤–ĺ—Ā—Ā—ā–į–Ĺ–į–≤–Ľ–ł–≤–į–Ķ—ā—Ā—Ź. –ü–ĺ –ľ–Ĺ–Ķ–Ĺ–ł—é –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–į –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –≤—Ä–į—á–Ķ–Ļ, –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ļ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā –≤ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑–Ķ –Ņ—Ä–ł –•–ü –ł–ľ–Ķ–Ķ—ā –Ĺ–Ķ–ĺ–Ī—Ä–į—ā–ł–ľ—č–Ļ —Ö–į—Ä–į–ļ—ā–Ķ—Ä, –Ĺ–Ķ—É–ļ–Ľ–ĺ–Ĺ–Ĺ–ĺ –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É–Ķ—ā (–ī–į–∂–Ķ –≤ —Ą–į–∑–Ķ —Ä–Ķ–ľ–ł—Ā—Ā–ł–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź).
–í –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ķ –≤—Ä–Ķ–ľ—Ź –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā –Ņ—Ä–ł–Ĺ—Ź—ā–ĺ —Ä–į—Ā—Ā–ľ–į—ā—Ä–ł–≤–į—ā—Ć –ļ–į–ļ –Ķ–ī–ł–Ĺ–ĺ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ, –ļ–ĺ—ā–ĺ—Ä–ĺ–Ķ –ł–ľ–Ķ–Ķ—ā –ī–≤–Ķ —Ą–į–∑—č —ā–Ķ—á–Ķ–Ĺ–ł—Ź: –ĺ—Ā—ā—Ä—č–Ļ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā, –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł–Ķ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä—É—é—Č–Ķ–≥–ĺ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–į (–≥–ł–Ņ–Ķ—Ä—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ–į—Ź —Ą–į–∑–į), –ļ–ĺ—ā–ĺ—Ä—č–Ļ –≤ –Ņ–ĺ–∑–ī–Ĺ–Ķ–Ļ —Ā—ā–į–ī–ł–ł –Ņ–ĺ—Ā—ā–Ķ–Ņ–Ķ–Ĺ–Ĺ–ĺ —ā—Ä–į–Ĺ—Ā—Ą–ĺ—Ä–ľ–ł—Ä—É–Ķ—ā—Ā—Ź –≤ –≥–ł–Ņ–ĺ—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—É—é —Ą–į–∑—É. –Ě–ĺ –ľ–ĺ–∂–Ĺ–ĺ, —Ā –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ—č–ľ –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–Ķ–ľ, –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–ł—ā—Ć, —á—ā–ĺ –≤ —Ä—Ź–ī–Ķ —Ā–Ľ—É—á–į–Ķ–≤ –ī–Ķ–Ī—é—ā –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į –≤ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑–Ķ, –Ņ—Ä–ĺ—ā–Ķ–ļ–į—é—Č–ł–Ļ –ļ–į–ļ –ĺ—Ā—ā—Ä—č–Ļ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā, –≤ –ī–Ķ–Ļ—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź–Ķ—ā —Ā–ĺ–Ī–ĺ–Ļ –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł–Ķ –ī–ĺ —ć—ā–ĺ–≥–ĺ –Ľ–į—ā–Ķ–Ĺ—ā–Ĺ–ĺ –Ņ—Ä–ĺ—ā–Ķ–ļ–į–≤—ą–Ķ–≥–ĺ –•–ü. –°–ĺ–ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł–Ķ –ĺ—Ā—ā—Ä—č—Ö –ł —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–ĺ–≤ —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā 1:5 [–•–į–∑–į–Ĺ–ĺ–≤ –ź.–ė. 1999].
–ě—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —Ā–Ķ–ľ–ł–ĺ—ā–ł–ļ–ł
—Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–į
–ö–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –•–ü –Ĺ–ĺ—Ā—Ź—ā –ī–ł–Ĺ–į–ľ–ł—á–Ĺ—č–Ļ —Ö–į—Ä–į–ļ—ā–Ķ—Ä, —ć–≤–ĺ–Ľ—é—Ü–ł—Ź —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į—ā–ł–ļ–ł –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ—ā—Ā—Ź –ļ–į–ļ –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–Ķ–Ļ –ī–Ķ—Ā—ā—Ä—É–ļ—Ü–ł–Ķ–Ļ —Ā–į–ľ–ĺ–Ļ —ā–ļ–į–Ĺ–ł –∂–Ķ–Ľ–Ķ–∑—č –ł —ā—Ä–į–Ĺ—Ā—Ą–ĺ—Ä–ľ–į—Ü–ł—Ź–ľ–ł –≤ –Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–≤–ĺ–Ļ —Ā–ł—Ā—ā–Ķ–ľ–Ķ –ł –ĺ—Ā—ā—Ä–ĺ–≤–ļ–ĺ–≤–ĺ–ľ –į–Ņ–Ņ–į—Ä–į—ā–Ķ, —ā–į–ļ –ł –Ĺ–Ķ–ł–∑–Ī–Ķ–∂–Ĺ–ĺ –≤–ĺ–∑–Ĺ–ł–ļ–į—é—Č–ł–ľ–ł —Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ł –į–Ĺ–į—ā–ĺ–ľ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź–ľ–ł –≤ –ĺ—Ä–≥–į–Ĺ–į—Ö, —ā–ĺ–Ņ–ĺ–≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ–ł –ł —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č—Ö —Ā –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑–ĺ–Ļ. –ú–Ĺ–ĺ–≥–ĺ–ĺ–Ī—Ä–į–∑–ł–Ķ –ł –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į—ā–ł–ļ–ł –∑–į–≤–ł—Ā—Ź—ā –ĺ—ā —Ā—ā–į–ī–ł–ł –ł —Ä–į—Ā–Ņ—Ä–ĺ—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į –≤ –∂–Ķ–Ľ–Ķ–∑–Ķ, –Ĺ–į–Ľ–ł—á–ł—Ź –ł –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —ć–ļ–∑–ĺ– –ł —ć–Ĺ–ī–ĺ–ļ—Ä–ł–Ĺ–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł, —Ä–į–∑–≤–ł—ā–ł—Ź –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ –ł —Ā–ĺ–Ņ—É—ā—Ā—ā–≤—É—é—Č–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –Ņ–ĺ—Ä–ĺ–Ļ –≤—č—Ā—ā—É–Ņ–į—é—ā –Ĺ–į –Ņ–Ķ—Ä–≤—č–Ļ –Ņ–Ľ–į–Ĺ.
–•—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā –ĺ—ā–Ĺ—é–ī—Ć –Ĺ–Ķ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ľ–Ķ—Ā—ā–Ĺ—č–ľ —Ā—ā—Ä–į–ī–į–Ĺ–ł–Ķ–ľ, –ĺ–≥—Ä–į–Ĺ–ł—á–Ķ–Ĺ–Ĺ—č–ľ –Ņ—Ä–Ķ–ī–Ķ–Ľ–į–ľ–ł —Ö–ĺ–Ľ–Ķ–ī–ĺ—Ö–ĺ–ī—É–ĺ–ī–Ķ–Ĺ–ĺ–Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –∑–ĺ–Ĺ—č. –Ē–Ľ—Ź –Ĺ–Ķ–≥–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–į –≤–Ķ—Ā—Ć–ľ–į –ĺ–Ī—ą–ł—Ä–Ĺ–į—Ź –Ņ–į–Ľ–ł—ā—Ä–į –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ: –Ī–ĺ–Ľ–Ķ–≤–ĺ–Ļ –ł –ī–ł—Ā–Ņ–Ķ–Ņ—Ā–ł—á–Ķ—Ā–ļ–ł–Ļ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ—č, —ā—Ä–ĺ—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į, –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź —É–≥–Ľ–Ķ–≤–ĺ–ī–Ĺ–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į, —Ā–ł–ľ–Ņ—ā–ĺ–ľ–ĺ–ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā—č –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –ł —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ–ĺ–Ļ –ł–Ĺ—ā–ĺ–ļ—Ā–ł–ļ–į—Ü–ł–ł, –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ķ —Ä–Ķ–į–ļ—Ü–ł–ł –ł –Ņ–ł—Č–Ķ–≤—č–Ķ –ł–Ĺ—ā–ĺ–Ľ–Ķ—Ä–į–Ĺ—ā–Ĺ–ĺ—Ā—ā–ł.
–í –ī–Ķ–Ī—é—ā–Ķ –ł –Ĺ–į –Ĺ–į—á–į–Ľ—Ć–Ĺ–ĺ–ľ —ć—ā–į–Ņ–Ķ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł (–Ņ—Ä–ĺ—ā—Ź–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć—é –≤ —Ā—Ä–Ķ–ī–Ĺ–Ķ–ľ 1 –≥–ĺ–ī–5 –Ľ–Ķ—ā) –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –≤—č—Ä–į–∂–Ķ–Ĺ –Ī–ĺ–Ľ–Ķ–≤–ĺ–Ļ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ. –í –Ņ–Ķ—Ä–ł–ĺ–ī —Ä–į–∑–≤–Ķ—Ä–Ĺ—É—ā–ĺ–Ļ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į—ā–ł–ļ–ł (–Ņ–ĺ—Ā–Ľ–Ķ–ī—É—é—Č–ł–Ķ 5–10 –Ľ–Ķ—ā) –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č–ľ–ł –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź–ľ–ł –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł —Ź–≤–Ľ—Ź—é—ā—Ā—Ź –Ī–ĺ–Ľ—Ć –ł –Ņ—Ä–ł–∑–Ĺ–į–ļ–ł –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –ł –ł–Ĺ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č. –ß–Ķ—Ä–Ķ–∑ 7–10 –Ľ–Ķ—ā –ĺ—ā–ľ–Ķ—á–į–Ķ—ā—Ā—Ź —Ā—ā–ł—Ö–į–Ĺ–ł–Ķ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į –ł–Ľ–ł —Ä–į–∑–≤–ł—ā–ł–Ķ –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ [–•–į–∑–į–Ĺ–ĺ–≤ –ź.–ė., 1999].
–ú—č –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ľ–ł 315 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –•–ü [159 (50,5%) – –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ–ĺ–Ļ —ć—ā–ł–ĺ–Ľ–ĺ–≥–ł–ł,156 (49,5%) – –Ī–ł–Ľ–ł–į—Ä–Ĺ–ĺ–∑–į–≤–ł—Ā–ł–ľ—č–Ļ] —Ā –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć—é –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ī–ĺ–Ľ–Ķ–Ķ 5 –Ľ–Ķ—ā. –í–į—Ä–ł–į–Ĺ—ā—č –ī–Ķ–Ī—é—ā–į –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ł —Ö–į—Ä–į–ļ—ā–Ķ—Ä —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ—č –≤ —ā–į–Ī–Ľ–ł—Ü–į—Ö 1,2,3.
–ü–ĺ –ľ–Ķ—Ä–Ķ —Ą–ł–Ī—Ä–ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ł –ļ–į–Ľ—Ć—Ü–ł—Ą–ł—Ü–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –Ņ–į—Ä–Ķ–Ĺ—Ö–ł–ľ—č –ł –į—ā—Ä–ĺ—Ą–ł–ł –į—Ü–ł–Ĺ–į—Ä–Ĺ—č—Ö –ł –ĺ—Ā—ā—Ä–ĺ–≤–ļ–ĺ–≤—č—Ö –ļ–Ľ–Ķ—ā–ĺ–ļ, –ĺ–Ī—č—á–Ĺ–ĺ —á–Ķ—Ä–Ķ–∑ 7–15 –Ľ–Ķ—ā –ĺ—ā –Ĺ–į—á–į–Ľ–į –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł, –Ī–ĺ–Ľ—Ć, –ļ–į–ļ –Ņ—Ä–į–≤–ł–Ľ–ĺ, —Ā—ā–ł—Ö–į–Ķ—ā, –ĺ–ī–Ĺ–į–ļ–ĺ –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É–Ķ—ā –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–į—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć. –£ 248 (78,7%) –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–Ĺ—č—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ—Ä–ł –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ĺ—ā 6 –ī–ĺ 10 –Ľ–Ķ—ā –•–ü –Ņ—Ä–ĺ—Ź–≤–Ľ—Ź–Ľ—Ā—Ź —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł–Ķ–ľ –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į —Ā –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –Ņ—Ä–ł–∑–Ĺ–į–ļ–į–ľ–ł —ć–ļ—Ā–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č.
–°–ł–Ĺ–ī—Ä–ĺ–ľ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ł –•–ü —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –≥–Ķ—ā–Ķ—Ä–ĺ–≥–Ķ–Ĺ–Ĺ—č–ľ, –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ—č –Ķ–≥–ĺ —Ä–į–∑–≤–ł—ā–ł—Ź –ľ–ĺ–≥—É—ā –Ī—č—ā—Ć –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ—č –ļ–į–ļ –į–Ī—Ā–ĺ–Ľ—é—ā–Ĺ–ĺ–Ļ (–Ņ–Ķ—Ä–≤–ł—á–Ĺ–ĺ–Ļ) –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć—é, —Ā–≤—Ź–∑–į–Ĺ–Ĺ–ĺ–Ļ —Ā —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ–ľ –≤—č—Ä–į–Ī–ĺ—ā–ļ–ł —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤, —ā–į–ļ –ł –ĺ—ā–Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ (–≤—ā–ĺ—Ä–ł—á–Ĺ–ĺ–Ļ) –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć—é –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –ł—Ö –į–ļ—ā–ł–≤–į—Ü–ł–ł –ł–Ľ–ł —Ä–į–∑—Ä—É—ą–Ķ–Ĺ–ł—Ź (—ā–į–Ī–Ľ. 4).
–°–Ľ–Ķ–ī—É–Ķ—ā –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ –≤ —Ä—Ź–ī–Ķ —Ā–Ľ—É—á–į–Ķ–≤ –≤—ā–ĺ—Ä–ł—á–Ĺ–į—Ź –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–į—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć —Ä–į–∑–≤–ł–≤–į–Ķ—ā—Ā—Ź –Ĺ–į —Ą–ĺ–Ĺ–Ķ —Ā–ĺ—Ö—Ä–į–Ĺ–Ĺ–ĺ–Ļ —ć–ļ–∑–ĺ–ļ—Ä–ł–Ĺ–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ł –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č (–Ņ–ĺ–≥—Ä–Ķ—ą–Ĺ–ĺ—Ā—ā–ł –≤ –ī–ł–Ķ—ā–Ķ: –Ņ—Ä–ł–Ķ–ľ –ł–∑–Ī—č—ā–ĺ—á–Ĺ–ĺ–≥–ĺ –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–į –∂–ł—Ä–Ĺ–ĺ–Ļ, –∂–į—Ä–Ķ–Ĺ–ĺ–Ļ, –ĺ—Ā—ā—Ä–ĺ–Ļ –Ņ–ł—Č–ł, –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ź), –į —ā–į–ļ–∂–Ķ –Ņ—Ä–ł —É–∂–Ķ –ł–ľ–Ķ—é—Č–Ķ–Ļ—Ā—Ź –Ņ–Ķ—Ä–≤–ł—á–Ĺ–ĺ–Ļ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł, –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —É—Ā—É–≥—É–Ī–Ľ—Ź—Ź –Ķ–Ķ. –ü–ĺ –Ĺ–į—ą–ł–ľ –ī–į–Ĺ–Ĺ—č–ľ, —É 44,1% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –•–ü –≤ –Ĺ–į—á–į–Ľ—Ć–Ĺ–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –ī–į–∂–Ķ –≤ —Ā—ā–į–ī–ł–ł —Ä–Ķ–ľ–ł—Ā—Ā–ł–ł –≤—č—Ź–≤–Ľ—Ź–Ľ–ł—Ā—Ć –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–ł–∑–Ĺ–į–ļ–ł –≤—ā–ĺ—Ä–ł—á–Ĺ–ĺ–Ļ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č, —á—ā–ĺ —Ā–≤—Ź–∑–į–Ĺ–ĺ, –Ņ–ĺ––≤–ł–ī–ł–ľ–ĺ–ľ—É, —Ā –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–į—Ü–ł–Ķ–Ļ –Ľ–ł–Ī–ĺ —Ā –ł–Ĺ–į–ļ—ā–ł–≤–į—Ü–ł–Ķ–Ļ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –≤ –ļ–ł—ą–Ķ—á–Ĺ–ł–ļ–Ķ. –Ě–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –Ī—č—Ā—ā—Ä–ĺ–Ķ –Ĺ–į—Ä–į—Ā—ā–į–Ĺ–ł–Ķ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į—ā–ł–ļ–ł –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł –ł –į–≥—Ä–Ķ—Ā—Ā–ł–≤–Ĺ–ĺ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–ĺ –ī–Ľ—Ź —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–į –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ–ĺ–Ļ —ć—ā–ł–ĺ–Ľ–ĺ–≥–ł–ł.
–í–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–į—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į–Ķ—ā—Ā—Ź –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į–ľ–ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –Ņ–ł—Č–Ķ–≤–į—Ä–Ķ–Ĺ–ł—Ź. –ē–ī–≤–į –Ľ–ł –Ĺ–Ķ –Ī–ĺ–Ľ–Ķ–Ķ –≤–į–∂–Ĺ—č–ľ –Ķ–Ķ –Ņ–ĺ—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ–ľ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ņ—Ä—Ź–ľ–į—Ź —Ā–≤—Ź–∑—Ć —Ā –ł–Ĺ—ā–Ķ–Ĺ—Ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć—é –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į. –Ę–ĺ–Ľ—Ć–ļ–ĺ —É 67 (21,3%) —á–Ķ–Ľ–ĺ–≤–Ķ–ļ –≤ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –•–ü —Ā –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć—é –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ī–ĺ–Ľ–Ķ–Ķ 5 –Ľ–Ķ—ā –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ĺ —Ā—ā–ł—Ö–į–Ĺ–ł–Ķ –ł–Ľ–ł –Ņ–ĺ–Ľ–Ĺ–ĺ–Ķ –ł—Ā—á–Ķ–∑–Ĺ–ĺ–≤–Ķ–Ĺ–ł–Ķ –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į. –£ 248 (78,7%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ĺ—ā–ľ–Ķ—á–į–Ľ–ĺ—Ā—Ć —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł–Ķ –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į –ł –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–≤ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č.
–Ē–Ķ—Ą–ł—Ü–ł—ā –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ł—Ö —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ (–į–Ī—Ā–ĺ–Ľ—é—ā–Ĺ—č–Ļ –ł–Ľ–ł –ĺ—ā–Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ) –Ņ–ĺ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ—É –ĺ–Ī—Ä–į—ā–Ĺ–ĺ–Ļ —Ā–≤—Ź–∑–ł –ł–Ĺ–ł—Ü–ł–ł—Ä—É—é—ā –Ņ—Ä–ĺ–ī—É–ļ—Ü–ł—é –Ņ–į–Ĺ–ļ—Ä–Ķ–ĺ–∑–ł–ľ–ł–Ĺ–į–—Ö–ĺ–Ľ–Ķ—Ü–ł—Ā—ā–ĺ–ļ–ł–Ĺ–ł–Ĺ–į –ī—É–ĺ–ī–Ķ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ. –ü–ĺ—Ā—ā—É–Ņ–į—é—Č–ł–Ļ –≤ –ļ—Ä–ĺ–≤—Ć –Ņ–į–Ĺ–ļ—Ä–Ķ–ĺ–∑–ł–ľ–ł–Ĺ —Ā—ā–ł–ľ—É–Ľ–ł—Ä—É–Ķ—ā, –≤ —Ā–≤–ĺ—é –ĺ—á–Ķ—Ä–Ķ–ī—Ć, –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ—É—é —Ā–Ķ–ļ—Ä–Ķ—Ü–ł—é. –í —É—Ā–Ľ–ĺ–≤–ł—Ź—Ö –•–ü —ć—ā–ĺ —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É–Ķ—ā –ł–Ĺ—ā–Ķ–Ĺ—Ā–ł—Ą–ł–ļ–į—Ü–ł–ł –ī–Ķ—Ā—ā—Ä—É–ļ—ā–ł–≤–Ĺ—č—Ö –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ–ĺ–≤ (—É—Ā—É–≥—É–Ī–Ľ–Ķ–Ĺ–ł—é –į—É—ā–ĺ–Ľ–ł–∑–į, –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ––ī–Ķ—Ā—ā—Ä—É–ļ—ā–ł–≤–Ĺ—č–ľ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź–ľ –≤ —ā–ļ–į–Ĺ–ł –∂–Ķ–Ľ–Ķ–∑—č, –Ĺ–į—Ä–į—Ā—ā–į–Ĺ–ł—é –≤–Ĺ—É—ā—Ä–ł–Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–≤–ĺ–Ļ –≥–ł–Ņ–Ķ—Ä—ā–Ķ–Ĺ–∑–ł–ł) –ł –ł–ľ–Ķ–Ķ—ā —Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ–ľ —É—Ā–ł–Ľ–Ķ–Ĺ–ł–Ķ –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ī–ĺ–Ľ–ł (–≥–ł–Ņ–Ķ—Ä—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–į—ā–ł–≤–Ĺ—č–Ļ —ā–ł–Ņ). –£ 98 (39,5%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —á–Ķ—Ä–Ķ–∑ 10 –Ľ–Ķ—ā –ĺ—ā –Ĺ–į—á–į–Ľ–į –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ—č–Ķ –Ī–ĺ–Ľ–ł –≤ –∂–ł–≤–ĺ—ā–Ķ —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į–Ľ–ł—Ā—Ć «—É–ļ–Ľ–ĺ–Ĺ–Ķ–Ĺ–ł–Ķ–ľ» —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –≤ –ļ—Ä–ĺ–≤—Ć. –£ –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (68,7%) –Ņ–ĺ –ľ–Ķ—Ä–Ķ –Ĺ–į—Ä–į—Ā—ā–į–Ĺ–ł—Ź —ć–ļ–∑–ĺ–ļ—Ä–ł–Ĺ–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č —á–į—Č–Ķ –ĺ—ā–ľ–Ķ—á–į–Ľ–ł—Ā—Ć –Ī–ĺ–Ľ–ł, —ā–ł–Ņ–ł—á–Ĺ—č–Ķ –ī–Ľ—Ź —ć–Ĺ—ā–Ķ—Ä–ĺ–Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į (—ā–į–Ī–Ľ. 5), –Ĺ–Ķ—Ä–Ķ–ī–ļ–ĺ –ł–ľ–Ķ–Ľ–ĺ –ľ–Ķ—Ā—ā–ĺ —Ā–ĺ—á–Ķ—ā–į–Ĺ–ł–Ķ –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ł—Ö –Ņ—Ä–ł—á–ł–Ĺ.
–ü–ł—Č–Ķ–≤–į—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā—č –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č —Ź–≤–Ľ—Ź—é—ā—Ā—Ź –ĺ–ī–Ĺ–ł–ľ–ł –ł–∑ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ –≥–ł–ī—Ä–ĺ–Ľ–ł—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ä–į—Ā—Č–Ķ–Ņ–Ľ–Ķ–Ĺ–ł—Ź –Ņ—Ä–ĺ–ī—É–ļ—ā–ĺ–≤ –Ņ–ł—ā–į–Ĺ–ł—Ź. –ü—Ä–ł –•–ü –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–į—Ź –∂–Ķ–Ľ–Ķ–∑–į –≤ –ĺ—ā–≤–Ķ—ā –Ĺ–į —Ā–Ķ–Ľ–Ķ–ļ—ā–ł–≤–Ĺ—É—é —Ā—ā–ł–ľ—É–Ľ—Ź—Ü–ł—é –ĺ—ā–≤–Ķ—á–į–Ķ—ā –Ĺ–Ķ–ļ–ĺ–ĺ—Ä–ī–ł–Ĺ–į—Ä–ĺ–≤–į–Ĺ–Ĺ—č–ľ –Ņ–ĺ —Ā–ĺ—Ā—ā–į–≤—É, –Ĺ–Ķ–į–ī–Ķ–ļ–≤–į—ā–Ĺ—č–ľ –Ņ–ĺ –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤—É –≤—č–Ī—Ä–ĺ—Ā–ĺ–ľ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤. –≠—ā–ĺ –∑–į–Ņ—É—Ā–ļ–į–Ķ—ā —Ü–Ķ–Ľ—č–Ļ –ļ–į—Ā–ļ–į–ī –Ņ–į—ā–ĺ—Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–Ķ–į–ļ—Ü–ł–Ļ –ł–∑––∑–į –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ–Ļ –ĺ–Ī—Ä–į–Ī–ĺ—ā–ļ–ł –Ņ–ĺ—Ā—ā—É–Ņ–į—é—Č–Ķ–Ļ –Ņ–ł—Č–ł:
1) –∑–į–ī–Ķ—Ä–∂–ļ–į —ć–≤–į–ļ—É–į—Ü–ł–ł –Ĺ—É—ā—Ä–ł–Ķ–Ĺ—ā–ĺ–≤ –ł–∑ –∂–Ķ–Ľ—É–ī–ļ–į (—Ä–į–Ĺ–Ĺ–Ķ–Ķ –Ĺ–į—Ā—č—Č–Ķ–Ĺ–ł–Ķ, –Ņ–Ķ—Ä–Ķ–Ĺ–į–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł–Ķ –ł –≤–∑–ī—É—ā–ł–Ķ –≤ —ć–Ņ–ł–≥–į—Ā—ā—Ä–į–Ľ—Ć–Ĺ–ĺ–Ļ –ĺ–Ī–Ľ–į—Ā—ā–ł, –ĺ—ā—Ä—č–∂–ļ–į, —ā–ĺ—ą–Ĺ–ĺ—ā–į, —Ä–≤–ĺ—ā–į);
2) –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ –Ņ–ĺ–Ľ–ĺ—Ā—ā–Ĺ–ĺ–≥–ĺ –ł –Ņ—Ä–ł—Ā—ā–Ķ–Ĺ–ĺ—á–Ĺ–ĺ–≥–ĺ –Ņ–ł—Č–Ķ–≤–į—Ä–Ķ–Ĺ–ł—Ź (–ĺ—Ā–ľ–ĺ–Ľ—Ź—Ä–Ĺ–į—Ź –ī–ł–į—Ä–Ķ—Ź; —Ā—ā–Ķ–į—ā–ĺ—Ä–Ķ—Ź; –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ—č–Ķ –Ī–ĺ–Ľ–ł –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł—Ź –≤–Ĺ—É—ā—Ä–ł–ļ–ł—ą–Ķ—á–Ĺ–ĺ–≥–ĺ –ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź; —Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–į—Ź –ī–ł–į—Ä–Ķ—Ź –∑–į —Ā—á–Ķ—ā —Ā—ā–ł–ľ—É–Ľ—Ź—Ü–ł–ł —Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł —ć–Ĺ—ā–Ķ—Ä–ĺ—Ü–ł—ā–ĺ–≤ –Ņ—Ä–ĺ–ī—É–ļ—ā–į–ľ–ł, –ĺ–Ī—Ä–į–∑–ĺ–≤–į–≤—ą–ł–ľ–ł—Ā—Ź –≤ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ –≥–ł–ī—Ä–ĺ–ļ—Ā–ł–Ľ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ļ–ł—ą–Ķ—á–Ĺ—č–ľ–ł –Ī–į–ļ—ā–Ķ—Ä–ł—Ź–ľ–ł –Ĺ–Ķ–Ņ–Ķ—Ä–Ķ–≤–į—Ä–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –∂–ł—Ä–į; –ľ–Ķ—ā–Ķ–ĺ—Ä–ł–∑–ľ –≤ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ –ĺ–Ī—Ä–į–∑–ĺ–≤–į–Ĺ–ł—Ź –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–į –≥–į–∑–ĺ–≤ –ļ–ł—ą–Ķ—á–Ĺ–ĺ–Ļ –ľ–ł–ļ—Ä–ĺ—Ą–Ľ–ĺ—Ä–ĺ–Ļ –Ņ—Ä–ł –Ī–į–ļ—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–ĺ–ľ –≥–ł–ī—Ä–ĺ–Ľ–ł–∑–Ķ –Ĺ–Ķ–≤—Ā–ĺ—Ā–į–≤—ą–ł—Ö—Ā—Ź –≤ —ā–ĺ–Ĺ–ļ–ĺ–Ļ –ļ–ł—ą–ļ–Ķ –Ĺ—É—ā—Ä–ł–Ķ–Ĺ—ā–ĺ–≤);
3) –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ –≤—Ā–į—Ā—č–≤–į–Ĺ–ł—Ź –Ĺ—É—ā—Ä–ł–Ķ–Ĺ—ā–ĺ–≤ (–Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ –ĺ–Ī–ľ–Ķ–Ĺ–į –Ī–Ķ–Ľ–ļ–ĺ–≤, –∂–ł—Ä–ĺ–≤ –ł —É–≥–Ľ–Ķ–≤–ĺ–ī–ĺ–≤, –Ņ–ĺ–Ľ–ł–≥–ł–Ņ–ĺ–≤–ł—ā–į–ľ–ł–Ĺ–ĺ–∑, –ł–ľ–ľ—É–Ĺ–ĺ–ī–Ķ—Ą–ł—Ü–ł—ā, —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į, –ĺ–Ī—Č–į—Ź —Ā–Ľ–į–Ī–ĺ—Ā—ā—Ć, —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —ā—Ä—É–ī–ĺ—Ā–Ņ–ĺ—Ā–ĺ–Ī–Ĺ–ĺ—Ā—ā–ł);
4) –≤–ĺ–∑—Ä–į—Ā—ā–į–Ĺ–ł–Ķ –Ņ—É–Ľ–į —É—Ā–Ľ–ĺ–≤–Ĺ–ĺ––Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ–Ļ –ł –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ–Ļ —Ą–Ľ–ĺ—Ä—č –≤ –∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ––ļ–ł—ą–Ķ—á–Ĺ–ĺ–ľ —ā—Ä–į–ļ—ā–Ķ (–≥–ł–Ņ–Ķ—Ä– –ł–Ľ–ł –≥–ł–Ņ–ĺ–ľ–ĺ—ā–ĺ—Ä–Ĺ—č–Ķ –ī–ł—Ā–ļ–ł–Ĺ–Ķ–∑–ł–ł –ļ–ł—ą–Ķ—á–Ĺ–ł–ļ–į, —É—Ā—É–≥—É–Ī–Ľ—Ź—é—Č–ł–Ķ –∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ––ļ–ł—ą–Ķ—á–Ĺ—É—é –ī–ł—Ā–Ņ–Ķ–Ņ—Ā–ł—é –ł –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –į—Ā—ā–Ķ–Ĺ–ĺ––Ĺ–Ķ–≤—Ä–ĺ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į –ł –≥–ł–Ņ–ĺ–≤–ł—ā–į–ľ–ł–Ĺ–ĺ–∑–ĺ–≤, –ľ–ł–ļ—Ä–ĺ–Ī–Ĺ–į—Ź –ļ–ĺ–Ĺ—ā–į–ľ–ł–Ĺ–į—Ü–ł—Ź –Ī–ł–Ľ–ł–į—Ä–Ĺ–ĺ–Ļ —Ā–ł—Ā—ā–Ķ–ľ—č, –ľ–ĺ—á–Ķ–≤—č–≤–ĺ–ī—Ź—Č–ł—Ö –Ņ—É—ā–Ķ–Ļ, –į–Ľ–Ľ–Ķ—Ä–≥–ł—á–Ķ—Ā–ļ–ł–Ļ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ – –∑—É–ī –ļ–ĺ–∂–ł, –ļ–ĺ–∂–Ĺ—č–Ķ –≤—č—Ā—č–Ņ–į–Ĺ–ł—Ź, –Ņ–ĺ–Ľ–ł–į—Ä—ā—Ä–į–Ľ–≥–ł–ł).
–ü—Ä–ĺ—Ü–Ķ—Ā—Ā –Ņ–ł—Č–Ķ–≤–į—Ä–Ķ–Ĺ–ł—Ź –ł –≤—Ā–į—Ā—č–≤–į–Ĺ–ł—Ź –Ĺ–Ķ—Ä–į–∑—Ä—č–≤–Ĺ–ĺ —Ā–≤—Ź–∑–į–Ĺ —Ā –ľ–ĺ—ā–ĺ—Ä–ł–ļ–ĺ–Ļ –∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ––ļ–ł—ą–Ķ—á–Ĺ–ĺ–≥–ĺ —ā—Ä–į–ļ—ā–į –ł —ā–Ķ–ľ–Ņ–į–ľ–ł –Ņ—Ä–ĺ—Ö–ĺ–∂–ī–Ķ–Ĺ–ł—Ź —Ö–ł–ľ—É—Ā–į –Ņ–ĺ –Ņ–ł—Č–Ķ–≤–į—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–ľ—É –ļ–į–Ĺ–į–Ľ—É. –ě—Ā–Ĺ–ĺ–≤–Ĺ—č–Ķ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č–Ķ –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā—č —Ā–Ķ–ļ—Ä–Ķ—ā–į –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č (–į–ľ–ł–Ľ–į–∑–į, —ā—Ä–ł–Ņ—Ā–ł–Ĺ, —Ö–ł–ľ–ĺ—ā—Ä–ł–Ņ—Ā–ł–Ĺ, –Ľ–ł–Ņ–į–∑–į) –ł–ľ–Ķ—é—ā —Ä–į–∑–Ľ–ł—á–Ĺ—É—é —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć —Ä–į—Ā—Č–Ķ–Ņ–Ľ—Ź—é—Č–Ķ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ņ–ĺ –ľ–Ķ—Ä–Ķ –Ņ—Ä–ĺ–ī–≤–ł–∂–Ķ–Ĺ–ł—Ź —Ö–ł–ľ—É—Ā–į –≤ –ī–ł—Ā—ā–į–Ľ—Ć–Ĺ–ĺ–ľ –Ĺ–į–Ņ—Ä–į–≤–Ľ–Ķ–Ĺ–ł–ł –Ņ–ĺ –ļ–ł—ą–Ķ—á–Ĺ–ł–ļ—É. –Ě–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ–ļ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –≤ 12––ü–ö –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ –Ĺ–Ķ–Ņ–ĺ–Ľ–Ĺ–ĺ–ľ—É —Ä–į—Ā—Č–Ķ–Ņ–Ľ–Ķ–Ĺ–ł—é –ł–Ĺ–≥—Ä–Ķ–ī–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ–ł—Č–Ķ–≤–ĺ–≥–ĺ —Ö–ł–ľ—É—Ā–į, —á—ā–ĺ —É—Ā–ļ–ĺ—Ä—Ź–Ķ—ā —ā—Ä–į–Ĺ–∑–ł—ā –ł —Ā–ľ–Ķ—Č–į–Ķ—ā –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā –Ņ–ł—Č–Ķ–≤–į—Ä–Ķ–Ĺ–ł—Ź –≤—Ā–Ķ –Ī–ĺ–Ľ–Ķ–Ķ –≤ –ī–ł—Ā—ā–į–Ľ—Ć–Ĺ—č–Ķ –ĺ—ā–ī–Ķ–Ľ—č –ļ–ł—ą–ļ–ł, —É—Ā—É–≥—É–Ī–Ľ—Ź—Ź –Ķ–≥–ĺ –Ĺ–Ķ–Ņ–ĺ–Ľ–Ĺ–ĺ—Ü–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć. –≠—ā–ĺ –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ —Ü–Ķ–Ņ–ĺ—á–ļ–Ķ –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–ł—Ö –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ –≤ —Ā—Ą–Ķ—Ä–Ķ –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ –Ī–Ķ–Ľ–ļ–ĺ–≤–ĺ–≥–ĺ –ł –∂–ł—Ä–ĺ–≤–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–ĺ–≤, –Ĺ–ĺ –ł –≤ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į—Ö –≤—Ā–į—Ā—č–≤–į–Ĺ–ł—Ź –∂–ł—Ä–ĺ—Ä–į—Ā—ā–≤–ĺ—Ä–ł–ľ—č—Ö –≤–ł—ā–į–ľ–ł–Ĺ–ĺ–≤ –ź, D, –ē –ł –ö. –ö–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź —ā–į–ļ–ĺ–≥–ĺ –≥–ł–Ņ–ĺ–≤–ł—ā–į–ľ–ł–Ĺ–ĺ–∑–į (–Ī–Ľ–Ķ–ī–Ĺ–ĺ—Ā—ā—Ć, —Ā—É—Ö–ĺ—Ā—ā—Ć –ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–Ĺ—č–Ļ —ā—É—Ä–≥–ĺ—Ä –ļ–ĺ–∂–Ĺ—č—Ö –Ņ–ĺ–ļ—Ä–ĺ–≤–ĺ–≤, –Ľ–ĺ–ľ–ļ–ĺ—Ā—ā—Ć –Ĺ–ĺ–≥—ā–Ķ–Ļ, –≤—č–Ņ–į–ī–Ķ–Ĺ–ł–Ķ –≤–ĺ–Ľ–ĺ—Ā, –Ņ–ĺ–ī–ļ–ĺ–∂–Ĺ—č–Ķ –≥–Ķ–ľ–ĺ—Ä—Ä–į–≥–ł–ł, –ļ—Ä–ĺ–≤–ĺ—ā–ĺ—á–ł–≤–ĺ—Ā—ā—Ć –ī–Ķ—Ā–Ķ–Ĺ, —Ö–Ķ–Ļ–Ľ–ł—ā, –į–Ĺ–≥—É–Ľ—Ź—Ä–Ĺ—č–Ļ —Ā—ā–ĺ–ľ–į—ā–ł—ā, –Ņ–Ķ–Ľ–Ľ–į–≥—Ä–ĺ–ł–ī–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –ļ–ĺ–∂–ł) –ľ–ĺ–≥—É—ā –Ī—č—ā—Ć –Ņ–Ķ—Ä–≤—č–ľ–ł —Ā–ł–ľ–Ņ—ā–ĺ–ľ–į–ľ–ł –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ–Ļ –ľ–į–Ľ—Ć–į–Ī—Ā–ĺ—Ä–Ī—Ü–ł–ł –ł –≤—č—Ź–≤–Ľ–Ķ–Ĺ—č –Ĺ–į–ľ–ł —É 28% –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –•–ü.
–í—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –Ņ—Ä–ł—Ā–ĺ–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź —Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–į —Ä–į–∑–≤–ł—ā–ł—Ź –ī–ł–į—Ä–Ķ–ł –≤–ĺ–∑–Ĺ–ł–ļ–į—é—ā –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–ł–∑–Ĺ–į–ļ–ł, —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č–Ķ —Ā –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź–ľ–ł –≤–≤–ĺ–ī–Ĺ–ĺ–—ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ľ–ł—ā–Ĺ–ĺ–≥–ĺ –Ī–į–Ľ–į–Ĺ—Ā–į (16,5% –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–Ĺ—č—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö). –Ď–ĺ–Ľ–ł –ł —Ā–Ľ–į–Ī–ĺ—Ā—ā—Ć –≤ –ľ—č—ą—Ü–į—Ö, –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ–≥–ĺ —Ä–ł—ā–ľ–į —á–į—Č–Ķ –≤ –≤–ł–ī–Ķ —ć–ļ—Ā—ā—Ä–į—Ā–ł—Ā—ā–ĺ–Ľ–ł–ł – –Ņ—Ä–ł –ī–Ķ—Ą–ł—Ü–ł—ā–Ķ –ļ–į–Ľ–ł—Ź. –ü–ĺ–Ľ–ĺ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ —Ā–ł–ľ–Ņ—ā–ĺ–ľ –ľ—č—ą–Ķ—á–Ĺ–ĺ–≥–ĺ –≤–į–Ľ–ł–ļ–į –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł—Ź –Ĺ–Ķ—Ä–≤–Ĺ–ĺ––ľ—č—ą–Ķ—á–Ĺ–ĺ–Ļ –≤–ĺ–∑–Ī—É–ī–ł–ľ–ĺ—Ā—ā–ł, –ĺ—Č—É—Č–Ķ–Ĺ–ł–Ķ –ĺ–Ĺ–Ķ–ľ–Ķ–Ĺ–ł—Ź –≥—É–Ī –ł –Ņ–į–Ľ—Ć—Ü–Ķ–≤, —Ā—É–ī–ĺ—Ä–ĺ–≥–ł, –ī–ł—Ą—Ą—É–∑–Ĺ—č–Ļ –ĺ—Ā—ā–Ķ–ĺ–Ņ–ĺ—Ä–ĺ–∑, –ł–Ĺ–ĺ–≥–ī–į –ĺ—Ā—ā–Ķ–ĺ–ľ–į–Ľ—Ź—Ü–ł—Ź –ł –Ņ–Ķ—Ä–Ķ–Ľ–ĺ–ľ—č –ļ–ĺ—Ā—ā–Ķ–Ļ – –Ņ—Ä–ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–ł —Ą–ĺ—Ā—Ą–ĺ—Ä–Ĺ–ĺ––ļ–į–Ľ—Ć—Ü–ł–Ķ–≤–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į –ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź –≤—Ā–į—Ā—č–≤–į–Ĺ–ł—Ź –≤–ł—ā–į–ľ–ł–Ĺ–į D. –Ę–į—Ö–ł–ļ–į—Ä–ī–ł—Ź, –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–į—Ź –≥–ł–Ņ–ĺ—ā–ĺ–Ĺ–ł—Ź, —Ā—É—Ö–ĺ—Ā—ā—Ć –ļ–ĺ–∂–ł –ł —Ā–Ľ–ł–∑–ł—Ā—ā—č—Ö – –Ņ—Ä–ł –ī–Ķ—Ą–ł—Ü–ł—ā–Ķ –Ĺ–į—ā—Ä–ł—Ź.
–ü–ĺ—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ–ľ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ī—č—Ā—ā—Ä–ĺ –Ĺ–į—Ä–į—Ā—ā–į—é—Č–į—Ź –Ņ–ĺ—ā–Ķ—Ä—Ź –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į, –į –≥–Ľ–į–≤–Ĺ–ĺ–Ķ – –≥–Ľ—É–Ī–ĺ–ļ–ł–Ķ –Ņ–ĺ–Ľ–ł–ĺ—Ä–≥–į–Ĺ–Ĺ—č–Ķ —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ—č–Ķ –ł –ī–ł—Ā—ā—Ä–ĺ—Ą–ł—á–Ķ—Ā–ļ–ł–Ķ —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤–į (–∂–ł—Ä–ĺ–≤–ĺ–Ļ –≥–Ķ–Ņ–į—ā–ĺ–∑, –ļ–į—Ä–ī–ł–ĺ–ľ–ł–ĺ–Ņ–į—ā–ł—Ź, –Ņ–ĺ–Ľ–ł–≥–Ľ–į–Ĺ–ī—É–Ľ—Ź—Ä–Ĺ–į—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć, –ł–ľ–ľ—É–Ĺ–ĺ–ī–Ķ—Ą–ł—Ü–ł—ā, –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–į—Ź –ľ—č—ą–Ķ—á–Ĺ–į—Ź –į—ā—Ä–ĺ—Ą–ł—Ź). –°–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į –ľ—č –ĺ—ā–ľ–Ķ—ā–ł–Ľ–ł —É 252 (80%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤.
–Ď–ĺ–Ľ—Ć–Ĺ—č–Ķ –•–ü – —ć—ā–ĺ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł –Ī–ĺ–Ľ—Ć–Ĺ—č–Ķ –Ľ—é–ī–ł, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –∑–į—á–į—Ā—ā—É—é —ā—Ź–∂–Ķ–Ľ–ĺ —Ä–Ķ–į–≥–ł—Ä—É—é—ā –Ĺ–į —Ā–≤–ĺ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ –ł –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā—Ć –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź. –ě—Ā–ĺ–∑–Ĺ–į–Ĺ–ł–Ķ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–į –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł —Ā –≤–ĺ–∑–ľ–ĺ–∂–Ĺ—č–ľ–ł –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ–ł –ł —á–į—Ā—ā—č–ľ–ł —Ä–Ķ—Ü–ł–ī–ł–≤–į–ľ–ł, –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā—Ć –Ņ–ĺ—Ā—ā–ĺ—Ź–Ĺ–Ĺ–ĺ–≥–ĺ —Ā–ĺ–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –ī–ł–Ķ—ā—č, –ĺ—ā–ļ–į–∑–į –ĺ—ā —É–Ņ–ĺ—ā—Ä–Ķ–Ī–Ľ–Ķ–Ĺ–ł—Ź –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ—č—Ö –Ĺ–į–Ņ–ł—ā–ļ–ĺ–≤ —Ź–≤–Ľ—Ź—é—ā—Ā—Ź –Ņ—Ä–ł—á–ł–Ĺ–į–ľ–ł —Ä–Ķ–∑–ļ–ĺ–≥–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź –ļ–į—á–Ķ—Ā—ā–≤–į –∂–ł–∑–Ĺ–ł, —Ä–į–∑–≤–ł—ā–ł—Ź –ł–Ņ–ĺ—Ö–ĺ–Ĺ–ī—Ä–ł—á–Ķ—Ā–ļ–ł—Ö –Ĺ–į—Ā—ā—Ä–ĺ–Ķ–Ĺ–ł–Ļ (28%), –ī–Ķ–Ņ—Ä–Ķ—Ā—Ā–ł–ł (22%), —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź —Ā–į–ľ–ĺ–ĺ—Ü–Ķ–Ĺ–ļ–ł (29%), –Ņ–Ķ—Ā—Ā–ł–ľ–ł–∑–ľ–į –≤ –ĺ—Ü–Ķ–Ĺ–ļ–Ķ –∂–ł–∑–Ĺ–Ķ–Ĺ–Ĺ—č—Ö –Ņ–Ķ—Ä—Ā–Ņ–Ķ–ļ—ā–ł–≤ (21%).
–Ē–į–Ĺ–Ĺ—č–Ķ –ľ–Ĺ–ĺ–≥–ł—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ–Ķ–Ļ –ł –Ĺ–į—ą —Ā–ĺ–Ī—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ļ –ĺ–Ņ—č—ā –Ņ–ĺ–ļ–į–∑—č–≤–į—é—ā, —á—ā–ĺ —É –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –•–ü —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä—É–Ķ—ā –Ī–ĺ–Ľ–Ķ–≤–ĺ–Ļ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ, –Ĺ–į—Ä–į—Ā—ā–į–Ķ—ā –Ĺ—É—ā—Ä–ł—ā–ł–≤–Ĺ–į—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć, –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—ā –Ľ–ł—á–Ĺ–ĺ—Ā—ā–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź, –ī–į–∂–Ķ –Ĺ–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į –į–ī–Ķ–ļ–≤–į—ā–Ĺ—č–Ļ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –ĺ—ā–≤–Ķ—ā –Ĺ–į —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—É—é –∑–į–ľ–Ķ—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ—É—é —ā–Ķ—Ä–į–Ņ–ł—é.
–í —ć—ā–ĺ–Ļ —Ā–≤—Ź–∑–ł –≤–ĺ–∑–Ĺ–ł–ļ–į—é—ā –∑–į–ļ–ĺ–Ĺ–ĺ–ľ–Ķ—Ä–Ĺ—č–Ķ –≤–ĺ–Ņ—Ä–ĺ—Ā—č: –Ĺ—É–∂–Ĺ–į –Ľ–ł –∑–į–ľ–Ķ—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–į—Ź —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ–į—Ź —ā–Ķ—Ä–į–Ņ–ł—Ź –ī–ĺ —Ä–į–∑–≤–ł—ā–ł—Ź –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ —ć–ļ–∑–ĺ–ļ—Ä–ł–Ĺ–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł, –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ –Ľ–ł –Ņ—Ä–ł –Ņ–ĺ–ī–Ī–ĺ—Ä–Ķ –ī–ĺ–∑—č —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–į –ĺ—Ä–ł–Ķ–Ĺ—ā–ł—Ä–ĺ–≤–į—ā—Ć—Ā—Ź –Ĺ–į –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –ļ–ĺ–Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ—č –ł –ł–∑–ľ–Ķ—Ä–Ķ–Ĺ–ł—Ź —Ą–Ķ–ļ–į–Ľ—Ć–Ĺ–ĺ–Ļ —ć–Ľ–į—Ā—ā–į–∑—č? –≠—ā–ĺ –ļ–į—Ā–į–Ķ—ā—Ā—Ź –ļ–į–ļ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā—ą–ł—Ö –ĺ—Ā—ā—Ä—č–Ļ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā, —ā–į–ļ –ł –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –•–ü —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä—É—é—Č–Ķ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź —Ā —Ā–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ –ł–Ľ–ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–Ĺ–ĺ–Ļ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–Ķ–Ļ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č.
–†–ĺ–Ľ—Ć —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤
–≤ –Ľ–Ķ—á–Ķ–Ĺ–ł–ł —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–į
–í—Ā–Ķ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—é—ā—Ā—Ź –≤ –Ľ–Ķ—á–Ķ–Ĺ–ł–ł –•–ü, –ł–ľ–Ķ—é—ā –ī–≤–Ķ –≥–Ľ–į–≤–Ĺ—č–Ķ —Ü–Ķ–Ľ–ł: 1) —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į – —Ä–į–Ĺ–Ĺ–ł–Ķ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ł—Ź, 2) –ļ–ĺ–ľ–Ņ–Ķ–Ĺ—Ā–į—Ü–ł—Ź –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č – –Ņ–ĺ–∑–ī–Ĺ–ł–Ķ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ł—Ź [–ď—É–Ī–Ķ—Ä–≥—Ä–ł—Ü –Ě.–Ď. 2005].
–Ď–Ľ–į–≥–ĺ–ī–į—Ä—Ź –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź–ľ —Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ĺ–≤ –ī–ĺ–ļ–į–∑–į–Ĺ–ĺ, —á—ā–ĺ —Ā–į–ľ–ĺ—Ä–Ķ–≥—É–Ľ—Ź—Ü–ł—Ź —ć–ļ–∑–ĺ–ļ—Ä–ł–Ĺ–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ł –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č –ĺ—Ā—É—Č–Ķ—Ā—ā–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ņ–ĺ –Ņ—Ä–ł–Ĺ—Ü–ł–Ņ—É –ĺ–Ī—Ä–į—ā–Ĺ–ĺ–Ļ —Ā–≤—Ź–∑–ł. –£—Ā–ł–Ľ–Ķ–Ĺ–ł–Ķ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ā–Ķ–ļ—Ä–Ķ—Ü–ł–ł –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ —ā—Ä–ł–Ņ—Ā–ł–Ĺ–—á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ—č–ľ —Ā—É–Ī—Ā—ā—Ä–į—ā–ĺ–ľ, —Ā–Ķ–ļ—Ä–Ķ—ā–ł—Ä—É–Ķ–ľ—č–ľ –Ņ—Ä–ĺ–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ—č–ľ–ł –ĺ—ā–ī–Ķ–Ľ–į–ľ–ł –ļ–ł—ą–Ķ—á–Ĺ–ł–ļ–į –ł –Ĺ–į–∑–≤–į–Ĺ–Ĺ—č–ľ –≤–Ņ–ĺ—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–ł —Ö–ĺ–Ľ–Ķ—Ü–ł—Ā—ā–ĺ––ļ–ł–Ĺ–ł–Ĺ–—Ä–ł–Ľ–ł–∑–ł–Ĺ–≥ —Ą–į–ļ—ā–ĺ—Ä–ĺ–ľ (–•–ö–—Ä–ł–Ľ–ł–∑–ł–Ĺ–≥ —Ą–į–ļ—ā–ĺ—Ä). –í –Ņ—Ä–ł—Ā—É—ā—Ā—ā–≤–ł–ł –Ņ—Ä–ĺ—ā–Ķ–ĺ–Ľ–ł—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–į —ā—Ä–ł–Ņ—Ā–ł–Ĺ–į –•–ö–—Ä–ł–Ľ–ł–∑–ł–Ĺ–≥ —Ą–į–ļ—ā–ĺ—Ä —Ā–į–ľ (—Ź–≤–Ľ—Ź—Ź—Ā—Ć –Ņ–Ķ–Ņ—ā–ł–ī–ĺ–ľ) —Ä–į–∑—Ä—É—ą–į–Ķ—ā—Ā—Ź. –ü—Ä–ł –Ņ–ĺ—Ā—ā—É–Ņ–Ľ–Ķ–Ĺ–ł–ł –≤ –Ē–ü–ö –Ī–Ķ–Ľ–ļ–į –Ņ–ł—Č–ł, —ā—Ä–ł–Ņ—Ā–ł–Ĺ —Ä–į—Ā—Ö–ĺ–ī—É–Ķ—ā—Ā—Ź –Ĺ–į –Ņ–ĺ–Ľ–ĺ—Ā—ā–Ĺ–ĺ–Ļ –≥–ł–ī—Ä–ĺ–Ľ–ł–∑ –Ņ–ĺ–Ľ–ł–Ņ–Ķ–Ņ—ā–ł–ī–ĺ–≤ —Ö–ł–ľ—É—Ā–į, —á—ā–ĺ –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł—é –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–ł –•–ö–—Ä–ł–Ľ–ł–∑–ł–Ĺ–≥ —Ą–į–ļ—ā–ĺ—Ä–į –ł, —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ – –ļ —ć–ļ—Ā–Ņ—Ä–Ķ—Ā—Ā–ł–ł —Ö–ĺ–Ľ–Ķ—Ü–ł—Ā—ā–ĺ–ļ–ł–Ĺ–ł–Ĺ––Ņ–į–Ĺ–ļ—Ä–Ķ–ĺ–∑–ł–ľ–ł–Ĺ–į, —Ā—ā–ł–ľ—É–Ľ–ł—Ä—É—é—Č–Ķ–≥–ĺ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ—É—é —Ā–Ķ–ļ—Ä–Ķ—Ü–ł—é.
–í —Ä—Ź–ī–Ķ —Ä–į–Ī–ĺ—ā –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł—Ö –Ľ–Ķ—ā —É–Ī–Ķ–ī–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –ī–ĺ–ļ–į–∑–į–Ĺ–ĺ, —á—ā–ĺ –≤–Ĺ—É—ā—Ä–ł–ļ–ł—ą–Ķ—á–Ĺ–ĺ–Ķ –≤–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ —ā—Ä–ł–Ņ—Ā–ł–Ĺ–į –ł–Ľ–ł —Ö–ł–ľ–ĺ—ā—Ä–ł–Ņ—Ā–ł–Ĺ–į –ł–Ĺ–≥–ł–Ī–ł—Ä—É–Ķ—ā —Ā–Ķ–ļ—Ä–Ķ—Ü–ł—é —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č –∑–į —Ā—á–Ķ—ā –ł–Ĺ–į–ļ—ā–ł–≤–į—Ü–ł–ł –•–ö–—Ä–ł–Ľ–ł–∑–ł–Ĺ–≥ —Ą–į–ļ—ā–ĺ—Ä–į. –ö–ĺ—Ä–ĺ—ā—Ć–ļ–ĺ –ď.–§. –ł —Ā–ĺ–į–≤—ā. –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ –Ĺ–į —ć–ļ—Ā–Ņ–Ķ—Ä–ł–ľ–Ķ–Ĺ—ā–į–Ľ—Ć–Ĺ—č—Ö –ľ–ĺ–ī–Ķ–Ľ—Ź—Ö, –Ĺ–ĺ –ł –Ĺ–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į—Ö —Ā –ī—É–ĺ–ī–Ķ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ą–ł—Ā—ā—É–Ľ–ĺ–Ļ –ī–Ķ—ā–į–Ľ—Ć–Ĺ–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ľ–ł –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –Ņ–Ķ—Ä–ĺ—Ä–į–Ľ—Ć–Ĺ–ĺ –≤–≤–ĺ–ī–ł–ľ—č—Ö –Ņ—Ä–ĺ—ā–Ķ–į–∑ (—ā—Ä–ł–Ņ—Ā–ł–Ĺ–į –ł —Ö–ł–ľ–ĺ—ā—Ä–ł–Ņ—Ā–ł–Ĺ–į), –Ľ–ł–Ņ–į–∑—č –ł –į–ľ–ł–Ľ–į–∑—č –Ĺ–į —Ā–Ķ–ļ—Ä–Ķ—Ü–ł—é –ĺ—ā–ī–Ķ–Ľ—Ć–Ĺ—č—Ö –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–ĺ–≤ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā–ĺ–ļ–į. –Ě–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–Ĺ—č—Ö —Ä–į–Ī–ĺ—ā –į—Ä–≥—É–ľ–Ķ–Ĺ—ā–ł—Ä–ĺ–≤–į–Ĺ–į –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ĺ––ļ–ĺ—Ä—Ä–ł–≥–ł—Ä—É—é—Č–į—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć —ć–ļ–∑–ĺ–≥–Ķ–Ĺ–Ĺ—č—Ö —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ —Ā –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ—č–ľ —Ā–ĺ–ī–Ķ—Ä–∂–į–Ĺ–ł–Ķ–ľ –Ņ—Ä–ĺ—ā–Ķ–į–∑. –ü—Ä–ł —ć—ā–ĺ–ľ –Ņ—Ä–ĺ–ł—Ā—Ö–ĺ–ī–ł—ā —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ĺ–Ī—Č–Ķ–≥–ĺ –ĺ–Ī—ä–Ķ–ľ–į –≤–Ĺ–Ķ—ą–Ĺ–Ķ–Ļ —Ā–Ķ–ļ—Ä–Ķ—Ü–ł–ł –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑–ĺ–Ļ, —É–ľ–Ķ–Ĺ—Ć—ą–į–Ķ—ā—Ā—Ź –≤–Ĺ—É—ā—Ä–ł–Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–≤–ĺ–Ķ –Ĺ–į–Ņ—Ä—Ź–∂–Ķ–Ĺ–ł–Ķ –ł –ī–į–≤–Ľ–Ķ–Ĺ–ł–Ķ –≤ –Ņ–į—Ä–Ķ–Ĺ—Ö–ł–ľ–Ķ –ĺ—Ä–≥–į–Ĺ–į, —á—ā–ĺ –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł—é –ł—ą–Ķ–ľ–ł–ł –ł —Ä–į—Ā—ā—Ź–∂–Ķ–Ĺ–ł—é –ļ–į–Ņ—Ā—É–Ľ—č, –≤ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ —á–Ķ–≥–ĺ –ī–ĺ—Ā—ā–ł–≥–į–Ķ—ā—Ā—Ź –į–Ĺ–į–Ľ—Ć–≥–Ķ–∑–ł—Ä—É—é—Č–ł–Ļ —ć—Ą—Ą–Ķ–ļ—ā.
–Ē–Ľ—Ź –≥–į—Ä–į–Ĺ—ā–ł–ł «–≤–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź» —ć—ā–ĺ–Ļ –ĺ–Ī—Ä–į—ā–Ĺ–ĺ–Ļ —Ā–≤—Ź–∑–ł –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–ĺ –ĺ—ā–Ķ—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –ł –∑–į—Ä—É–Ī–Ķ–∂–Ĺ—č—Ö –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ĺ–Ľ–ĺ–≥–ĺ–≤ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī—É—é—ā –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—ā—Ć –ī–Ľ—Ź –ļ—É–Ņ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –Ī–ĺ–Ľ–ł —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č, –ĺ—ā–≤–Ķ—á–į—é—Č–ł–Ķ —Ā–Ľ–Ķ–ī—É—é—Č–ł–ľ —ā—Ä–Ķ–Ī–ĺ–≤–į–Ĺ–ł—Ź–ľ:
1) –≤—č—Ā–ĺ–ļ–į—Ź –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł—Ź —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤, –≤ –Ņ–Ķ—Ä–≤—É—é –ĺ—á–Ķ—Ä–Ķ–ī—Ć – –Ņ—Ä–ĺ—ā–Ķ–į–∑ (–Ĺ–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ 600–1000 –ē–ī. F.I.P –Ĺ–į –Ņ—Ä–ł–Ķ–ľ);
2) –Ĺ–į–Ľ–ł—á–ł–Ķ —ć–Ĺ—ā–Ķ—Ä–ĺ—Ā–ĺ–Ľ—é–Ī–ł–Ľ—Ć–Ĺ–ĺ–Ļ –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł –ī–Ľ—Ź –ł—Ā–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź –Ņ—Ä–Ķ–∂–ī–Ķ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –ł–Ĺ–į–ļ—ā–ł–≤–į—Ü–ł–ł –≤ –∂–Ķ–Ľ—É–ī–ļ–Ķ;
3) —Ä–į–Ī–ĺ—á–ł–Ļ –ī–ł–į–Ņ–į–∑–ĺ–Ĺ –ī–Ķ–Ļ—Ā—ā–≤–ł—Ź —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ –≤ –Ņ—Ä–Ķ–ī–Ķ–Ľ–į—Ö —Ä–Ě 4,5–5,5;
4) –ľ–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ—č–Ļ —Ä–į–∑–ľ–Ķ—Ä –≥—Ä–į–Ĺ—É–Ľ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł–Ĺ–į, —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤—É—é—Č–ł–Ļ —Ā–ļ–ĺ—Ä–Ķ–Ļ—ą–Ķ–ľ—É –Ņ–Ķ—Ä–Ķ–ľ–Ķ—ą–ł–≤–į–Ĺ–ł—é –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į —Ā –Ņ–ł—Č–Ķ–Ļ –ł —Ā–ł–Ĺ—Ö—Ä–ĺ–Ĺ–Ĺ–ĺ–Ļ —ć–≤–į–ļ—É–į—Ü–ł–ł –≤ –ī–≤–Ķ–Ĺ–į–ī—Ü–į—ā–ł–Ņ–Ķ—Ä—Ā—ā–Ĺ—É—é –ļ–ł—ą–ļ—É.
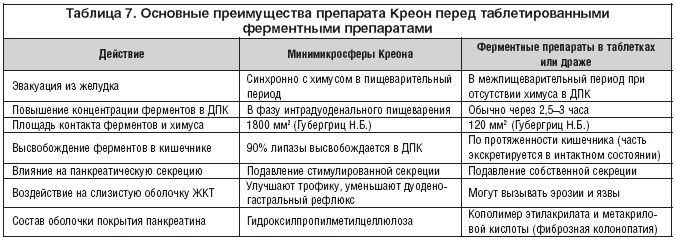
–ė—Ā—Ö–ĺ–ī—Ź –ł–∑ –ł–∑–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ—č—Ö —ā—Ä–Ķ–Ī–ĺ–≤–į–Ĺ–ł–Ļ –ļ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č–ľ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ –ľ–ĺ–∂–Ĺ–ĺ —Ā–ļ–į–∑–į—ā—Ć, —á—ā–ĺ –≤ –Ņ–ĺ–Ľ–Ĺ–ĺ–Ļ –ľ–Ķ—Ä–Ķ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤—É—é—ā –ł–ľ –Ľ–ł—ą—Ć –ī–≤—É—Ö–ĺ–Ī–ĺ–Ľ–ĺ—á–Ķ—á–Ĺ—č–Ķ –ľ–ł–Ĺ–ł–ľ–ł–ļ—Ä–ĺ—Ā—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł–Ķ —Ą–ĺ—Ä–ľ—č –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł–Ĺ–į —Ä–į–∑–ľ–Ķ—Ä–ĺ–ľ 0,8–1,2 –ľ–ľ. –ü—Ä–ł–ľ–Ķ—Ä–ĺ–ľ —ā–į–ļ–ł—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ö—Ä–Ķ–ĺ–Ĺ (—ā–į–Ī–Ľ. 6).
–ö –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–ľ—É –≤—Ä–Ķ–ľ–Ķ–Ĺ–ł –ĺ–Ņ—É–Ī–Ľ–ł–ļ–ĺ–≤–į–Ĺ—č —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ł—Ö –∑–į—Ä—É–Ī–Ķ–∂–Ĺ—č—Ö –Ņ–Ľ–į—Ü–Ķ–Ī–ĺ––ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ–ł—Ä—É–Ķ–ľ—č—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ, –ī–ĺ–ļ–į–∑—č–≤–į—é—Č–ł—Ö —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ľ–ł–Ĺ–ł–ľ–ł–ļ—Ä–ĺ—Ā—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł—Ö —Ą–ĺ—Ä–ľ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł–Ĺ–į –≤ —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–ł –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į –Ņ—Ä–ł –•–ü –∑–į —Ā—á–Ķ—ā —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź —Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –Ĺ–į–Ņ—Ä—Ź–∂–Ķ–Ĺ–ł—Ź –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č –≤ —Ą–į–∑—É –Ņ–ł—Č–Ķ–≤–į—Ä–Ķ–Ĺ–ł—Ź [Kuhneit P., Miundios S., Adier G. 1995; Lipoid B.C., 1998]. –í –Ĺ–į—ą–Ķ–Ļ —Ā—ā—Ä–į–Ĺ–Ķ –≤ –Ņ—É–Ī–Ľ–ł–ļ–į—Ü–ł—Ź—Ö –ď—É–Ī–Ķ—Ä–≥—Ä–ł—Ü –Ě.–Ď., –ė–≤–į—ą–ļ–ł–Ĺ–į –í.–Ę., –ė–≤–į–Ĺ–ĺ–≤–į –ģ.–í., –ú–į–Ķ–≤–į –ė.–í., –Į–ļ–ĺ–≤–Ķ–Ĺ–ļ–ĺ –≠.–ü. –ł –ľ–Ĺ–ĺ–≥–ł—Ö –ī—Ä—É–≥–ł—Ö –į–≤—ā–ĺ—Ä–ĺ–≤ –ī–ĺ–ļ–į–∑–į–Ĺ–ĺ, —á—ā–ĺ –į–Ĺ–į–Ľ—Ć–≥–Ķ—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —ć—Ą—Ą–Ķ–ļ—ā –ö—Ä–Ķ–ĺ–Ĺ–į —Ä–Ķ–į–Ľ–ł–∑—É–Ķ—ā—Ā—Ź –Ņ—Ä–ł 600–1000 –ē–ī. F.I.P. –Ņ—Ä–ĺ—ā–Ķ–į–∑ –Ĺ–į –Ņ—Ä–ł–Ķ–ľ (1–2 –ļ–į–Ņ—Ā—É–Ľ—č –ö—Ä–Ķ–ĺ–Ĺ 10000 –ł–Ľ–ł 1 –ļ–į–Ņ—Ā—É–Ľ–į –ö—Ä–Ķ–ĺ–Ĺ–į 25000).
–í–į–∂–Ĺ–ĺ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ņ—Ä–ł –Ľ–Ķ—á–Ķ–Ĺ–ł–ł –•–ü –ö—Ä–Ķ–ĺ–Ĺ–ĺ–ľ –ł–ľ–Ķ—é—ā —ā–į–ļ–ł–Ķ —Ą–į–ļ—ā—č, —á—ā–ĺ –Ņ–į—Ä–į–Ľ–Ľ–Ķ–Ľ—Ć–Ĺ–ĺ —Ā —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł–Ķ–ľ –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į –Ņ–ĺ–ī–į–≤–Ľ—Ź—é—ā—Ā—Ź –≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –≤ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑–Ķ, —ā–ĺ—Ä–ľ–ĺ–∑—Ź—ā—Ā—Ź –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā—č —Ą–ł–Ī—Ä–ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź. –ė.–í. –ú–į–Ķ–≤ —Ā —Ā–ĺ–į–≤—ā. (2003) –Ņ–ĺ–ļ–į–∑–į–Ľ–ł, —á—ā–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ –ö—Ä–Ķ–ĺ–Ĺ–ĺ–ľ –≤ –į–ī–Ķ–ļ–≤–į—ā–Ĺ—č—Ö –ī–ĺ–∑–į—Ö –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł—é —É—Ä–ĺ–≤–Ĺ—Ź –≤ –ļ—Ä–ĺ–≤–ł –Ņ—Ä–ĺ–≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č—Ö (IL–8, TNF–?) –ł –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł—é —É—Ä–ĺ–≤–Ĺ—Ź –Ņ—Ä–ĺ—ā–ł–≤–ĺ—Ā–Ņ–į–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ—č—Ö (IL–10) —Ü–ł—ā–ĺ–ļ–ł–Ĺ–ĺ–≤, —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ļ TGF–?, –ĺ—ā—Ä–į–∂–į—é—Č–Ķ–≥–ĺ —Ą–ł–Ī—Ä–ĺ–≥–Ķ–Ĺ–Ķ–∑.
–ē—Ā–Ľ–ł –ī–Ľ—Ź —É–ľ–Ķ–Ĺ—Ć—ą–Ķ–Ĺ–ł—Ź –ł–Ĺ—ā–Ķ–Ĺ—Ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ī–ĺ–Ľ–ł –Ņ—Ä–ł –•–ü –ł–ľ–Ķ–Ķ—ā –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ņ—Ä–ĺ—ā–Ķ–į–∑–Ĺ–į—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤, —ā–ĺ –ī–Ľ—Ź –∑–į–ľ–Ķ—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –≤–į–∂–Ĺ–į –Ľ–ł–Ņ–į–∑–Ĺ–į—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć. –°–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —Ā–Ķ–ļ—Ä–Ķ—Ü–ł–ł –Ľ–ł–Ņ–į–∑—č –Ņ—Ä–ł –•–ü —Ä–į–∑–≤–ł–≤–į–Ķ—ā—Ā—Ź —Ä–į–Ĺ—Ć—ą–Ķ –ł –Ī–ĺ–Ľ–Ķ–Ķ –≤—č—Ä–į–∂–Ķ–Ĺ–ĺ –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā –ī—Ä—É–≥–ł–ľ–ł —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–į–ľ–ł. –í —ā–ĺ –∂–Ķ –≤—Ä–Ķ–ľ—Ź –Ķ—Ā–Ľ–ł –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—ā–Ķ–į–∑ –ł –į–ľ–ł–Ľ–į–∑—č –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć –≤ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł –ļ–ĺ–ľ–Ņ–Ķ–Ĺ—Ā–ł—Ä–ĺ–≤–į–Ĺ–į –ļ–ł—ą–Ķ—á–Ĺ—č–ľ–ł –Ņ—Ä–ĺ—ā–Ķ–į–∑–į–ľ–ł, –Ņ–Ķ–Ņ—ā–ł–ī–į–∑–į–ľ–ł, –į–ľ–ł–Ľ–į–∑–į–ľ–ł –ł –į–ľ–ł–Ľ–į–∑–ĺ–Ļ —Ā–Ľ—é–Ĺ—č, —ā–ĺ –ļ–ĺ–ľ–Ņ–Ķ–Ĺ—Ā–į—ā–ĺ—Ä–Ĺ—č–Ķ –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł —Ā–Ľ—é–Ĺ–Ĺ–ĺ–Ļ –ł –∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –Ľ–ł–Ņ–į–∑—č –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –Ĺ–ł–∂–Ķ –ł –Ĺ–Ķ –ľ–ĺ–≥—É—ā –Ņ—Ä–Ķ–ī–ĺ—ā–≤—Ä–į—ā–ł—ā—Ć –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –Ņ–ĺ–Ľ–ĺ—Ā—ā–Ĺ–ĺ–≥–ĺ –≥–ł–ī—Ä–ĺ–Ľ–ł–∑–į –∂–ł—Ä–ĺ–≤. –ö—Ä–ĺ–ľ–Ķ —ā–ĺ–≥–ĺ, –Ľ–ł–Ņ–į–∑–į –Ī—č—Ā—ā—Ä–Ķ–Ķ, —á–Ķ–ľ –ī—Ä—É–≥–ł–Ķ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā—č, —Ä–į–∑—Ä—É—ą–į–Ķ—ā—Ā—Ź –Ņ—Ä–ł —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–ł –ł–Ĺ—ā—Ä–į–ī—É–ĺ–ī–Ķ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ä–Ě. –í —É—Ā–Ľ–ĺ–≤–ł—Ź—Ö –į—Ü–ł–ī–ł—Ą–ł–ļ–į—Ü–ł—Ź –ļ–ł—ą–Ķ—á–Ĺ–ĺ–≥–ĺ —Ā–ĺ–ī–Ķ—Ä–∂–ł–ľ–ĺ–≥–ĺ —É–ľ–Ķ–Ĺ—Ć—ą–į–Ķ—ā—Ā—Ź –Ņ—Ä–Ķ—Ü–ł–Ņ–ł—ā–į—Ü–ł—Ź –∂–Ķ–Ľ—á–Ĺ—č—Ö –ļ–ł—Ā–Ľ–ĺ—ā, –Ĺ–į—Ä—É—ą–į–Ķ—ā—Ā—Ź —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –ľ–ł—Ü–Ķ–Ľ–Ľ, –≤—Ā–Ľ–Ķ–ī—Ā—ā–≤–ł–Ķ —á–Ķ–≥–ĺ –ī–ĺ–Ņ–ĺ–Ľ–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –Ĺ–į—Ä—É—ą–į–Ķ—ā—Ā—Ź –≤—Ā–į—Ā—č–≤–į–Ĺ–ł–Ķ –∂–ł—Ä–ĺ–≤.
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–į—Ź —Ü–Ķ–Ľ—Ć –∑–į–ľ–Ķ—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ł–ľ–ł —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–į–ľ–ł – –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–Ķ–Ĺ–ł–Ķ –ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –Ľ–ł–Ņ–į–∑—č –≤ 12––ü–ö (–Ĺ–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ 30000 –ē–ī. F.I.P. –Ĺ–į –ĺ–ī–ł–Ĺ –Ņ—Ä–ł–Ķ–ľ –Ņ–ł—Č–ł). –ė–∑–≤–Ķ—Ā—ā–Ĺ–ĺ, —á—ā–ĺ –≤–ĺ–∑–ī–Ķ–Ļ—Ā—ā–≤–ł–Ķ —Ā–ĺ–Ľ—Ź–Ĺ–ĺ–Ļ –ļ–ł—Ā–Ľ–ĺ—ā—č –Ĺ–į –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ł–Ķ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā—č —Ä–į–∑—Ä—É—ą–į–Ķ—ā –ī–ĺ 90% –ł—Ö –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–į, –Ņ–ĺ—ć—ā–ĺ–ľ—É –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–ĺ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤—č–Ņ—É—Ā–ļ–į–Ķ—ā—Ā—Ź –≤ –ļ–ł—Ā–Ľ–ĺ—ā–ĺ—É—Ā—ā–ĺ–Ļ—á–ł–≤—č—Ö –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–į—Ö. –ě–ī–Ĺ–į–ļ–ĺ –ī–Ľ—Ź –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–Ķ–Ĺ–ł—Ź –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–Ķ–≤–į—Ä–ł–≤–į–Ĺ–ł—Ź –∂–ł—Ä–ĺ–≤ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ—č: –Ī—č—Ā—ā—Ä–ĺ–Ķ –≥–ĺ–ľ–ĺ–≥–Ķ–Ĺ–Ĺ–ĺ–Ķ —Ā–ľ–Ķ—ą–ł–≤–į–Ĺ–ł–Ķ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ —Ā —Ö–ł–ľ—É—Ā–ĺ–ľ –ł –ĺ–ī–Ĺ–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č–Ļ –ł—Ö –Ņ–į—Ā—Ā–į–∂ –Ņ–ĺ –Ņ–ł—Č–Ķ–≤–į—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–ľ—É –ļ–į–Ĺ–į–Ľ—É. –ü–ĺ—ć—ā–ĺ–ľ—É –Ņ—Ä–ł –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–ł –∑–į–ľ–Ķ—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł —Ā–Ľ–Ķ–ī—É–Ķ—ā –ĺ—Ä–ł–Ķ–Ĺ—ā–ł—Ä–ĺ–≤–į—ā—Ć—Ā—Ź –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ –Ĺ–į —Ā–ĺ–ī–Ķ—Ä–∂–į–Ĺ–ł–Ķ –Ľ–ł–Ņ–į–∑—č –≤ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–Ķ, –Ĺ–ĺ –ł –Ĺ–į —Ą–ĺ—Ä–ľ—É –Ķ–≥–ĺ –≤—č–Ņ—É—Ā–ļ–į. –Ď–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–ĺ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤—č–Ņ—É—Ā–ļ–į–Ķ—ā—Ā—Ź –≤ –≤–ł–ī–Ķ –ī—Ä–į–∂–Ķ –ł–Ľ–ł —ā–į–Ī–Ľ–Ķ—ā–ĺ–ļ —Ä–į–∑–ľ–Ķ—Ä–ĺ–ľ –Ĺ–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ 5–8 –ľ–ľ. –ė–∑–≤–Ķ—Ā—ā–Ĺ–ĺ, —á—ā–ĺ –≤ –Ņ–ł—Č–Ķ–≤–į—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –Ņ–Ķ—Ä–ł–ĺ–ī –ł–∑ –∂–Ķ–Ľ—É–ī–ļ–į —á–Ķ—Ä–Ķ–∑ –Ņ—Ä–ł–≤—Ä–į—ā–Ĺ–ł–ļ –ľ–ĺ–≥—É—ā –Ņ—Ä–ĺ—Ö–ĺ–ī–ł—ā—Ć —ā–≤–Ķ—Ä–ī—č–Ķ —á–į—Ā—ā–ł—Ü—č —Ä–į–∑–ľ–Ķ—Ä–ĺ–ľ –Ĺ–Ķ –Ī–ĺ–Ľ–Ķ–Ķ 2 –ľ–ľ (–ĺ–Ņ—ā–ł–ľ–į–Ľ—Ć–Ĺ—č–Ļ —Ä–į–∑–ľ–Ķ—Ä ?1,4 –ľ–ľ). –Ď–ĺ–Ľ–Ķ–Ķ –ļ—Ä—É–Ņ–Ĺ—č–Ķ —á–į—Ā—ā–ł—Ü—č, –≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł, —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –≤ —ā–į–Ī–Ľ–Ķ—ā–ļ–į—Ö –ł–Ľ–ł –ī—Ä–į–∂–Ķ —ć–≤–į–ļ—É–ł—Ä—É—é—ā—Ā—Ź –≤ –ľ–Ķ–∂–Ņ–ł—Č–Ķ–≤–į—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –Ņ–Ķ—Ä–ł–ĺ–ī, –ļ–ĺ–≥–ī–į –Ņ–ł—Č–Ķ–≤–ĺ–Ļ —Ö–ł–ľ—É—Ā —É–∂–Ķ –ĺ—ā—Ā—É—ā—Ā—ā–≤—É–Ķ—ā –≤ 12––ü–ö.
–ü–ĺ—ć—ā–ĺ–ľ—É –ī–Ľ—Ź –∑–į–ľ–Ķ—Ā—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ņ—Ä–ł –•–ü, –ļ–į–ļ –ł –ī–Ľ—Ź –ļ—É–Ņ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į, –ĺ–Ņ—ā–ł–ľ–į–Ľ—Ć–Ĺ—č–ľ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ —Ā—Ä–Ķ–ī—Ā—ā–≤–ĺ–ľ —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ö—Ä–Ķ–ĺ–Ĺ (—ā–į–Ī–Ľ. 7). –ü—Ä–ł –Ņ–ĺ–Ņ–į–ī–į–Ĺ–ł–ł –≤ –∂–Ķ–Ľ—É–ī–ĺ–ļ –∂–Ķ–Ľ–į—ā–ł–Ĺ–ĺ–≤–į—Ź –ļ–į–Ņ—Ā—É–Ľ–į –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į —Ä–į—Ā—ā–≤–ĺ—Ä—Ź–Ķ—ā—Ā—Ź –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 1–2 –ľ–ł–Ĺ, –ľ–Ĺ–ĺ–∂–Ķ—Ā—ā–≤–ĺ –ľ–ł–Ĺ–ł–ľ–ł–ļ—Ä–ĺ—Ā—Ą–Ķ—Ä (–ĺ—ā 280 –ī–ĺ 500 —á–į—Ā—ā–ł—Ü –ī–ł–į–ľ–Ķ—ā—Ä–ĺ–ľ 1,0–1,2 –ľ–ľ) —Ä–į–≤–Ĺ–ĺ–ľ–Ķ—Ä–Ĺ–ĺ —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź—é—ā—Ā—Ź –≤ –∂–Ķ–Ľ—É–ī–ļ–Ķ, —Ā–ľ–Ķ—ą–ł–≤–į—Ź—Ā—Ć —Ā –Ņ–ł—Č–Ķ–Ļ –ł —É–≤–Ķ–Ľ–ł—á–ł–≤–į—Ź —ā–Ķ–ľ —Ā–į–ľ—č–ľ –Ņ–ł—Č–Ķ–≤–į—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł–į–Ľ –∑–į —Ā—á–Ķ—ā –Ī–ĺ–Ľ—Ć—ą–ĺ–Ļ –Ņ–ĺ–≤–Ķ—Ä—Ö–Ĺ–ĺ—Ā—ā–ł —Ā–ĺ–Ņ—Ä–ł–ļ–ĺ—Ā–Ĺ–ĺ–≤–Ķ–Ĺ–ł—Ź. –ú–ł–Ĺ–ł–ľ–ł–ļ—Ä–ĺ—Ā—Ą–Ķ—Ä—č –ö—Ä–Ķ–ĺ–Ĺ–į –ĺ–ī–Ĺ–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ —Ā –Ņ–ł—Č–Ķ–Ļ –Ņ–ĺ—Ā—ā–Ķ–Ņ–Ķ–Ĺ–Ĺ–ĺ –Ņ–ĺ—Ā—ā—É–Ņ–į—é—ā –≤ 12––ü–ö. –ü—Ä–ł —Ä–Ě –ī—É–ĺ–ī–Ķ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ā–ĺ–ī–Ķ—Ä–∂–ł–ľ–ĺ–≥–ĺ –≤—č—ą–Ķ 5,5 –ĺ–Ī–ĺ–Ľ–ĺ—á–ļ–ł –ľ–ł–ļ—Ä–ĺ—Ā—Ą–Ķ—Ä —Ä–į—Ā—ā–≤–ĺ—Ä—Ź—é—ā—Ā—Ź –ł —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā—č –Ĺ–į—á–ł–Ĺ–į—é—ā –ī–Ķ–Ļ—Ā—ā–≤–ĺ–≤–į—ā—Ć –Ņ–ĺ –≤—Ā–Ķ–ľ—É –ĺ–Ī—ä–Ķ–ľ—É —Ö–ł–ľ—É—Ā–į. –ü—Ä–ł —ć—ā–ĺ–ľ –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł –≤–ĺ—Ā–Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ź—ā—Ā—Ź —Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā—č –Ņ–ł—Č–Ķ–≤–į—Ä–Ķ–Ĺ–ł—Ź, –ļ–ĺ–≥–ī–į –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —Ā–ĺ–ļ –≤—č–ī–Ķ–Ľ—Ź–Ķ—ā—Ā—Ź –Ņ–ĺ—Ä—Ü–ł—Ź–ľ–ł –≤ –ĺ—ā–≤–Ķ—ā –Ĺ–į –Ņ–Ķ—Ä–ł–ĺ–ī–ł—á–Ķ—Ā–ļ–ĺ–Ķ –Ņ–ĺ—Ā—ā—É–Ņ–Ľ–Ķ–Ĺ–ł–Ķ –Ņ–ł—Č–ł –ł–∑ –∂–Ķ–Ľ—É–ī–ļ–į. –ú–Ĺ–ĺ–≥–ĺ—á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—č–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź —Ā –≤—č—Ā–ĺ–ļ–ł–ľ —É—Ä–ĺ–≤–Ĺ–Ķ–ľ –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ—Ā—ā–ł –Ņ–ĺ–ļ–į–∑–į–Ľ–ł, —á—ā–ĺ –ī–Ľ—Ź –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź —ć–ļ–≤–ł–≤–į–Ľ–Ķ–Ĺ—ā–Ĺ–ĺ–≥–ĺ –ö—Ä–Ķ–ĺ–Ĺ—É –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ —Ä–į–∑–ĺ–≤—č–Ļ –Ņ—Ä–ł–Ķ–ľ 20—30 —ā–į–Ī–Ľ–Ķ—ā–ĺ–ļ –ł–Ľ–ł –ī—Ä–į–∂–Ķ.
–ü–ĺ –ł–Ĺ–ī–Ķ–ļ—Ā—É –Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–ĺ—Ā—ā–ł –ö—Ä–Ķ–ĺ–Ĺ —ā–į–ļ–∂–Ķ –Ņ—Ä–Ķ–≤–ĺ—Ā—Ö–ĺ–ī–ł—ā –≤—Ā–Ķ –ī—Ä—É–≥–ł–Ķ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č. –í—č—Ā–ĺ–ļ–ł–Ļ –ł–Ĺ–ī–Ķ–ļ—Ā –Ī–Ķ–∑–ĺ–Ņ–į—Ā–Ĺ–ĺ—Ā—ā–ł –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź—ā—Ć –ö—Ä–Ķ–ĺ–Ĺ –≤ –Ņ–Ķ–ī–ł–į—ā—Ä–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ņ—Ä–į–ļ—ā–ł–ļ–Ķ, –Ĺ–į—á–ł–Ĺ–į—Ź —Ā –ī–Ķ—ā–Ķ–Ļ –≥—Ä—É–ī–Ĺ–ĺ–≥–ĺ –≤–ĺ–∑—Ä–į—Ā—ā–į.
–í —Ā–≤—Ź–∑–ł —Ā –≤—č—ą–Ķ–ł–∑–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ—č–ľ –ľ—č –Ņ—Ä–ĺ–≤–Ķ–Ľ–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ —Ā —Ü–Ķ–Ľ—Ć—é —Ā—Ä–į–≤–Ĺ–ł—ā—Ć —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ–Ľ–ł—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł (–ľ–ł–Ĺ–ł–ľ–ł–ļ—Ä–ĺ—Ā—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ł —ā–į–Ī–Ľ–Ķ—ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł–Ĺ–į) –Ņ—Ä–ł —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–ľ –Ī–ł–Ľ–ł–į—Ä–Ĺ–ĺ–∑–į–≤–ł—Ā–ł–ľ–ĺ–ľ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–Ķ –≤ —Ą–į–∑—É —Ä–Ķ–ľ–ł—Ā—Ā–ł–ł. –ü–į—Ü–ł–Ķ–Ĺ—ā—č —Ā –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ–ĺ–Ļ —ć—ā–ł–ĺ–Ľ–ĺ–≥–ł–Ķ–Ļ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ł–∑ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ī—č–Ľ–ł –ł—Ā–ļ–Ľ—é—á–Ķ–Ĺ—č –ł–∑––∑–į –Ĺ–Ķ–≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź —Ä–Ķ–∂–ł–ľ–į –į–Ī—Ā—ā–ł–Ĺ–Ķ–Ĺ—Ü–ł–ł –ł —Ä–Ķ–≥—É–Ľ—Ź—Ä–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ł–Ķ–ľ–į —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤.
–ó–į–ī–į—á–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź:
1) –ł–∑—É—á–ł—ā—Ć –ī–ł–Ĺ–į–ľ–ł–ļ—É –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –Ī–ł–Ľ–ł–į—Ä–Ĺ–ĺ–∑–į–≤–ł—Ā–ł–ľ–ĺ–≥–ĺ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–į –≤ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –ľ–ł–Ĺ–ł–ľ–ł–ļ—Ä–ĺ—Ā—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł–ľ–ł –ł–Ľ–ł —ā–į–Ī–Ľ–Ķ—ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤;
2) –≤—č—Ź–≤–ł—ā—Ć –∑–į–ļ–ĺ–Ĺ–ĺ–ľ–Ķ—Ä–Ĺ–ĺ—Ā—ā–ł —Ā—ā—Ä—É–ļ—ā—É—Ä–Ĺ—č—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č –ł –Ĺ—É—ā—Ä–ł—ā–ł–≤–Ĺ–ĺ–≥–ĺ —Ā—ā–į—ā—É—Ā–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –•–ü –Ĺ–į —Ą–ĺ–Ĺ–Ķ –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ł–Ķ–ľ–į –Ņ–ĺ–Ľ–ł—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤;
3) –ĺ—Ü–Ķ–Ĺ–ł—ā—Ć –Ņ—Ä–ĺ–≥–Ĺ–ĺ—Ā—ā–ł—á–Ķ—Ā–ļ–ĺ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ —Ä–į–Ĺ–Ĺ–Ķ–≥–ĺ –≤–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź –Ņ–ĺ–Ľ–ł—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤ —Ā—Ö–Ķ–ľ—É –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ –Ī–ł–Ľ–ł–į—Ä–Ĺ–ĺ–∑–į–≤–ł—Ā–ł–ľ—č–ľ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–ĺ–ľ.
–ú–į—ā–Ķ—Ä–ł–į–Ľ –ł –ľ–Ķ—ā–ĺ–ī—č –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź
–í —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ł–ł —Ā –Ņ–ĺ—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ —Ü–Ķ–Ľ—Ć—é –ł –∑–į–ī–į—á–į–ľ–ł –Ī—č–Ľ–ĺ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ĺ –ĺ—ā–ļ—Ä—č—ā–ĺ–Ķ —Ä–į–Ĺ–ī–ĺ–ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ķ –Ņ—Ä–ĺ—Ā–Ņ–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ 156 –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö (102 –∂–Ķ–Ĺ—Č–ł–Ĺ—č, 54 –ľ—É–∂—á–ł–Ĺ—č, —Ā—Ä–Ķ–ī–Ĺ–ł–Ļ –≤–ĺ–∑—Ä–į—Ā—ā 51±3,2 –Ľ–Ķ—ā) –Ĺ–į –Ī–į–∑–Ķ –ď–í–ö–ď –ł–ľ. –Ě. –Ě. –Ď—É—Ä–ī–Ķ–Ĺ–ļ–ĺ –ł —Ü–Ķ–Ĺ—ā—Ä–į–Ľ—Ć–Ĺ—č—Ö –Ņ–ĺ–Ľ–ł–ļ–Ľ–ł–Ĺ–ł–ļ –≥. –ú–ĺ—Ā–ļ–≤—č.
–í –≥—Ä—É–Ņ–Ņ—É –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –≤–ĺ—ą–Ľ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č —Ā —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ –Ī–ł–Ľ–ł–į—Ä–Ĺ–ĺ–∑–į–≤–ł—Ā–ł–ľ—č–ľ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–ĺ–ľ —Ā –ī–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć—é –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ĺ–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ 5 –Ľ–Ķ—ā –Ņ—Ä–ł –ī–ĺ–ļ–į–∑–į–Ĺ–Ĺ–ĺ–Ļ –ĺ—Ä–≥–į–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –∂–Ķ–Ľ—á–Ĺ–ĺ–≥–ĺ –Ņ—É–∑—č—Ä—Ź, –ĺ–Ī—Č–Ķ–≥–ĺ –∂–Ķ–Ľ—á–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ—ā–ĺ–ļ–į, —Ā—Ą–ł–Ĺ–ļ—ā–Ķ—Ä–į –ě–ī–ī–ł, –Ī–ĺ–Ľ—Ć—ą–ĺ–≥–ĺ –ī—É–ĺ–ī–Ķ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ā–ĺ—Ā–ĺ—á–ļ–į –≤ –ļ–ĺ–ľ–Ī–ł–Ĺ–į—Ü–ł–ł —Ā –ĺ–ī–Ĺ–ł–ľ –ł–Ľ–ł –Ī–ĺ–Ľ–Ķ–Ķ –Ņ—Ä–ł–∑–Ĺ–į–ļ–ĺ–≤:
1) –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ķ –ł –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–Ĺ—č–Ķ – –Ī–ĺ–Ľ–Ķ–≤–ĺ–Ļ –ł –ī–ł—Ā–Ņ–Ķ–Ņ—Ā–ł—á–Ķ—Ā–ļ–ł–Ļ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ—č; —Ā–ł–ľ–Ņ—ā–ĺ–ľ—č —ć–ļ–∑–ĺ–ļ—Ä–ł–Ĺ–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł – —Ā—ā–Ķ–į—ā–ĺ—Ä–Ķ—Ź, —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į, –≥–ł–Ņ–ĺ–į–Ľ—Ć–Ī—É–ľ–ł–Ĺ–Ķ–ľ–ł—Ź, —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —Ā–ĺ–ī–Ķ—Ä–∂–į–Ĺ–ł—Ź —Ą–Ķ–ļ–į–Ľ—Ć–Ĺ–ĺ–Ļ —ć–Ľ–į—Ā—ā–į–∑—č–1 –ľ–Ķ–Ĺ–Ķ–Ķ 200 –ľ–ļ–≥/–≥;
2) –ī–į–Ĺ–Ĺ—č–Ķ –Ľ—É—á–Ķ–≤—č—Ö –ľ–Ķ—ā–ĺ–ī–ĺ–≤ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź – —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ł–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –Ņ–Ľ–ĺ—ā–Ĺ–ĺ—Ā—ā–ł, –ļ–ĺ–Ĺ—Ą–ł–≥—É—Ä–į—Ü–ł–ł –ł —Ä–į–∑–ľ–Ķ—Ä–ĺ–≤ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č, –ī–≤–ł–≥–į—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –≤ –≤–ł–ī–Ķ —É—Ā–ļ–ĺ—Ä–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ł–Ľ–ł –∑–į–ľ–Ķ–ī–Ľ–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ĺ–Ņ–ĺ—Ä–ĺ–∂–Ĺ–Ķ–Ĺ–ł—Ź –∂–Ķ–Ľ—É–ī–ļ–į –ł –Ē–ü–ö.
–ė–∑ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –ł—Ā–ļ–Ľ—é—á–į–Ľ–ł—Ā—Ć –Ī–ĺ–Ľ—Ć–Ĺ—č–Ķ –Ņ—Ä–ł –Ĺ–į–Ľ–ł—á–ł–ł –Ĺ–į –ľ–ĺ–ľ–Ķ–Ĺ—ā –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź —Ā–Ľ–Ķ–ī—É—é—Č–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –ł —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–ĺ–≤: —Ö–ĺ–Ľ–Ķ–Ľ–ł—ā–ł–į–∑, –ļ–ł—Ā—ā—č, –į–Ī—Ā—Ü–Ķ—Ā—Ā—č, –ļ–į–Ľ—Ć—Ü–ł—Ą–ł–ļ–į—Ü–ł—Ź –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č, –≤–Ĺ—É—ā—Ä–ł–Ņ—Ä–ĺ—ā–ĺ–ļ–ĺ–≤—č–Ķ –ī–Ķ—Ą–Ķ–ļ—ā—č –Ĺ–į–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ł—Ź, –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ņ–Ķ—á–Ķ–Ĺ–ł –Ľ—é–Ī–ĺ–Ļ —ć—ā–ł–ĺ–Ľ–ĺ–≥–ł–ł, —ć—Ä–ĺ–∑–ł–≤–Ĺ–ĺ–—Ź–∑–≤–Ķ–Ĺ–Ĺ—č–Ķ –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł—Ź —Ā–Ľ–ł–∑–ł—Ā—ā–ĺ–Ļ –∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ––ļ–ł—ą–Ķ—á–Ĺ–ĺ–≥–ĺ —ā—Ä–į–ļ—ā–į, –∑–Ľ–ĺ–ļ–į—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ľ—é–Ī–ĺ–Ļ –Ľ–ĺ–ļ–į–Ľ–ł–∑–į—Ü–ł–ł.
–Ē–Ľ—Ź –Ņ–ĺ—Ā—ā–į–Ĺ–ĺ–≤–ļ–ł –ī–ł–į–≥–Ĺ–ĺ–∑–į –Ĺ–į–ľ–ł –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–į—Ā—Ć —Ä–į–Ī–ĺ—á–į—Ź –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł—Ź, –Ņ—Ä–Ķ–ī–Ľ–ĺ–∂–Ķ–Ĺ–Ĺ–į—Ź –į–ļ–į–ī–Ķ–ľ–ł–ļ–ĺ–ľ –í.–Ę. –ė–≤–į—ą–ļ–ł–Ĺ—č–ľ (1990), —É—ā–≤–Ķ—Ä–∂–ī–Ķ–Ĺ–Ĺ–į—Ź –†–ĺ—Ā—Ā–ł–Ļ—Ā–ļ–ĺ–Ļ –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –į—Ā—Ā–ĺ—Ü–ł–į—Ü–ł–Ķ–Ļ (1992). –°—ā—Ä—É–ļ—ā—É—Ä–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –≤ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑–Ķ –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ľ–ł—Ā—Ć –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ –£–ó–ė –ł–Ľ–ł –ö–Ę –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł –ö–Ķ–ľ–Ī—Ä–ł–ī–∂—Ā–ļ–ĺ–Ļ –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł–ł —Ā—ā—Ä—É–ļ—ā—É—Ä–Ĺ—č—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ.
–ź–Ľ–≥–ĺ—Ä–ł—ā–ľ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –≤–ļ–Ľ—é—á–į–Ľ 3 —ć—ā–į–Ņ–į.
–Ě–į –Ņ–Ķ—Ä–≤–ĺ–ľ —ć—ā–į–Ņ–Ķ (—Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ĺ–ĺ–ľ) –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ĺ—Ā—Ć –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā–Ĺ–ĺ–Ķ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, —Ä–į–Ĺ–ī–ĺ–ľ–ł–∑–į—Ü–ł—Ź –ł –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ, –≤–ļ–Ľ—é—á–į–≤—ą–Ķ–Ķ (–Ņ–ĺ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ł—Ź–ľ) –ł–Ĺ–≥–ł–Ī–ł—ā–ĺ—Ä—č –Ņ—Ä–ĺ—ā–ĺ–Ĺ–Ĺ–ĺ–Ļ –Ņ–ĺ–ľ–Ņ—č, —Ā–Ņ–į–∑–ľ–ĺ–Ľ–ł—ā–ł–ļ–ł, –į–Ĺ—ā–į—Ü–ł–ī—č, –ĺ–ļ—ā—Ä–Ķ–ĺ—ā–ł–ī –ł –ö—Ä–Ķ–ĺ–Ĺ 25000 –Ĺ–į –ļ–į–∂–ī—č–Ļ –Ņ—Ä–ł–Ķ–ľ –Ņ–ł—Č–ł.
–° —É—á–Ķ—ā–ĺ–ľ —ā–ĺ–≥–ĺ, —á—ā–ĺ –ł—Ā—Ö–ĺ–ī–Ĺ–ĺ –Ī–ĺ–Ľ–Ķ–≤–ĺ–Ļ –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ—č–Ļ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ –ł —Ā–ł–ľ–Ņ—ā–ĺ–ľ—č –ī–ł—Ā–Ņ–Ķ–Ņ—Ā–ł–ł —Ä–į–∑–Ĺ–ĺ–Ļ —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ—č —É –≤—Ā–Ķ—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, I —ć—ā–į–Ņ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –∑–į–ļ–į–Ĺ—á–ł–≤–į–Ľ—Ā—Ź –ļ –ľ–ĺ–ľ–Ķ–Ĺ—ā—É —Ā—ā–ĺ–Ļ–ļ–ĺ–≥–ĺ –ļ—É–Ņ–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, –Ĺ–ĺ—Ä–ľ–į–Ľ–ł–∑–į—Ü–ł–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–Ĺ—č—Ö –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–Ĺ—č—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ (–Ľ–Ķ–Ļ–ļ–ĺ—Ü–ł—ā–ĺ–∑, –°–ě–≠, –≥–ł–Ņ–Ķ—Ä—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ķ–ľ–ł—Ź, —Ā–ł–Ĺ–ī—Ä–ĺ–ľ—č —Ü–ł—ā–ĺ–Ľ–ł–∑–į –ł —Ö–ĺ–Ľ–Ķ—Ā—ā–į–∑–į). –Ē–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –Ņ–Ķ—Ä–≤–ĺ–≥–ĺ —ć—ā–į–Ņ–į –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–į 17±1,8 –ī–Ĺ–Ķ–Ļ.
–†–į–∑–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ĺ–į 3 –≥—Ä—É–Ņ–Ņ—č –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ĺ—Ā—Ć –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤ —ć–Ľ–į—Ā—ā–į–∑–Ĺ–ĺ–≥–ĺ —ā–Ķ—Ā—ā–į: 1 –≥—Ä. – 56 (35,9%) —á–Ķ–Ľ–ĺ–≤–Ķ–ļ – –Ī–Ķ–∑ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł, 2 –≥—Ä. – 56 (35,9%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ – —Ā —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ–Ļ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć—é, 3 –≥—Ä. – 44 (28,2%) –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö – —Ā –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ–Ļ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć—é.
–ü–ĺ –ĺ–ļ–ĺ–Ĺ—á–į–Ĺ–ł–ł I —ć—ā–į–Ņ–į –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –≤—Ā–Ķ–ľ –Ī–ĺ–Ľ—Ć–Ĺ—č–ľ –Ī—č–Ľ–į —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–ĺ–≤–į–Ĺ–į –ľ–ĺ–Ĺ–ĺ—ā–Ķ—Ä–į–Ņ–ł—Ź –ö—Ä–Ķ–ĺ–Ĺ–ĺ–ľ, –≤ –ł–Ĺ–ī–ł–≤–ł–ī—É–į–Ľ—Ć–Ĺ–ĺ –Ņ–ĺ–ī–ĺ–Ī—Ä–į–Ĺ–Ĺ–ĺ–Ļ –ī–ĺ–∑–ł—Ä–ĺ–≤–ļ–Ķ, –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 6 –ľ–Ķ—Ā—Ź—Ü–Ķ–≤ (II —ć—ā–į–Ņ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź). –Ď–ĺ–Ľ—Ć–Ĺ—č–ľ 1 –≥—Ä. –Ĺ–į–∑–Ĺ–į—á–į–Ľ–ł – 50000 –ē–ī. F.I.P/—Ā—É—ā., 2 –≥—Ä. – 100000 –ē–ī. F.I.P/—Ā—É—ā., 3 –≥—Ä. – 150000 –ē–ī. F.I.P/—Ā—É—ā.
–°–ĺ–Ī–Ľ—é–ī–Ķ–Ĺ–ł–Ķ —Ā—Ö–Ķ–ľ—č —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–ĺ–≤–į–Ĺ–Ĺ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź –Ī—č–Ľ–ĺ –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–ĺ 86 (55,1%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ–ł. 70 (44,9%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ–ĺ–ļ–į–∑–į–Ľ–ł –Ĺ–ł–∑–ļ–ł–Ļ –ļ–ĺ–ľ–Ņ–Ľ–į–Ļ–Ĺ—Ā –≤–≤–ł–ī—É –Ĺ–Ķ—Ä–Ķ–≥—É–Ľ—Ź—Ä–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ł–Ķ–ľ–į —É–ļ–į–∑–į–Ĺ–Ĺ–ĺ–≥–ĺ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į, –Ņ—Ä–ĺ–ł–∑–≤–ĺ–Ľ—Ć–Ĺ–ĺ–Ļ –∑–į–ľ–Ķ–Ĺ—č –Ķ–≥–ĺ –Ĺ–į —ā–į–Ī–Ľ–Ķ—ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–Ķ –ł–Ľ–ł –≤ –≤–ł–ī–Ķ –ī—Ä–į–∂–Ķ –Ņ–ĺ–Ľ–ł—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č –Ľ–ł–Ī–ĺ –Ņ–ĺ–Ľ–Ĺ–ĺ–Ļ –ĺ—ā–ľ–Ķ–Ĺ—č –Ņ—Ä–ł–Ķ–ľ–į —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤. –Ě–į —ć—ā–ĺ–ľ –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł –Ī—č–Ľ–ĺ –Ņ—Ä–ĺ–ł–∑–≤–Ķ–ī–Ķ–Ĺ–ĺ —Ä–į–∑–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ĺ–į –ī–≤–Ķ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č (—ā–į–Ī–Ľ. 8):
–ź – –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č, –≤—č–Ņ–ĺ–Ľ–Ĺ–ł–≤—ą–ł–Ķ –ī–ł–∑–į–Ļ–Ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź (n=86),
–Ď – –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č, –Ĺ–į–Ī–Ľ—é–ī–į–Ķ–ľ—č–Ķ –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 6 –ľ–Ķ—Ā—Ź—Ü–Ķ–≤ –Ņ–ĺ—Ā–Ľ–Ķ –ĺ–ļ–ĺ–Ĺ—á–į–Ĺ–ł—Ź —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ĺ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź, –Ĺ–ĺ –Ĺ–Ķ –Ņ—Ä–ł–Ĺ–ł–ľ–į–≤—ą–ł–Ķ –ö—Ä–Ķ–ĺ–Ĺ (n=70).
–Ē–ł–Ĺ–į–ľ–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ —á–Ķ—Ä–Ķ–∑ 6 –ľ–Ķ—Ā—Ź—Ü–Ķ–≤ –ĺ—ā –Ĺ–į—á–į–Ľ–į –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –≤–ļ–Ľ—é—á–į–Ľ–ĺ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ, –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–Ĺ–ĺ–Ķ –ł –ł–Ĺ—Ā—ā—Ä—É–ľ–Ķ–Ĺ—ā–į–Ľ—Ć–Ĺ–ĺ–Ķ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ.
–Ę—Ä–Ķ—ā–ł–Ļ —ć—ā–į–Ņ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–į–Ľ—Ā—Ź 3 –≥–ĺ–ī–į, –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –ļ–ĺ—ā–ĺ—Ä—č—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č–Ķ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č –ź –Ņ—Ä–ĺ–ī–ĺ–Ľ–∂–į–Ľ–ł –Ņ—Ä–ł–Ĺ–ł–ľ–į—ā—Ć –ö—Ä–Ķ–ĺ–Ĺ® –≤ –ł–Ĺ–ī–ł–≤–ł–ī—É–į–Ľ—Ć–Ĺ–ĺ –Ņ–ĺ–ī–ĺ–Ī—Ä–į–Ĺ–Ĺ—č—Ö –ī–ĺ–∑–į—Ö, –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č –Ď –Ņ—Ä–ł–Ĺ–ł–ľ–į–Ľ–ł —ā–į–Ī–Ľ–Ķ—ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–Ķ –Ņ–ĺ–Ľ–ł—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č: 1–Ď –≥—Ä. – –ľ–Ķ–∑–ł–ľ–—Ą–ĺ—Ä—ā–Ķ –Ņ–ĺ 1 —ā–į–Ī. 3 —Ä–į–∑–į –≤ —Ā—É—ā–ļ–ł, 2–Ď –ł 3 –Ď –≥—Ä. – –Ņ–į–Ĺ–∑–ł–Ĺ–ĺ—Ä–ľ —Ą–ĺ—Ä—ā–Ķ––Ě –Ņ–ĺ 2 —ā–į–Ī. —Ö 3 —Ä–į–∑–į –≤ —Ā—É—ā–ļ–ł.
–Ē–ł–Ĺ–į–ľ–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ĺ—Ā—Ć –ļ–į–∂–ī—č–Ķ –Ņ–ĺ–Ľ–≥–ĺ–ī–į, –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ľ–ł—Ā—Ć –į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ—Ā—ā—Ć –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ĺ—ā–≤–Ķ—ā–į –Ĺ–į —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—É—é —ā–Ķ—Ä–į–Ņ–ł—é, –ī–ł–Ĺ–į–ľ–ł–ļ–į —ā—Ä–ĺ—Ą–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā—ā–į—ā—É—Ā–į –ł —Ā—ā—Ä—É–ļ—ā—É—Ä–Ĺ—č—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č, –ļ–į—á–Ķ—Ā—ā–≤–ĺ –∂–ł–∑–Ĺ–ł –Ņ–ĺ —Ā—É–Ī—ä–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–Ļ –ĺ—Ü–Ķ–Ĺ–ļ–Ķ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–ľ.
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –ł –ĺ–Ī—Ā—É–∂–ī–Ķ–Ĺ–ł–Ķ
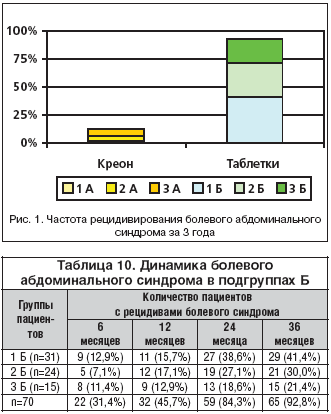
–ö–į–ļ –Ī—č–Ľ–ĺ –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–ĺ —Ä–į–Ĺ–Ķ–Ķ, –ļ –Ĺ–į—á–į–Ľ—É –į–ľ–Ī—É–Ľ–į—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –Ī–ĺ–Ľ–Ķ–≤–ĺ–Ļ –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ—č–Ļ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ –Ī—č–Ľ –ļ—É–Ņ–ł—Ä–ĺ–≤–į–Ĺ —É –≤—Ā–Ķ—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –•–ü–Ď.
–Ě–į —Ą–ĺ–Ĺ–Ķ –ľ–ĺ–Ĺ–ĺ—ā–Ķ—Ä–į–Ņ–ł–ł –ö—Ä–Ķ–ĺ–Ĺ–ĺ–ľ (–Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–į –ź) –≤ –ł–Ĺ–ī–ł–≤–ł–ī—É–į–Ľ—Ć–Ĺ—č—Ö –ī–ĺ–∑–į—Ö —ć–Ņ–ł–∑–ĺ–ī—č —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ī–ĺ–Ľ–ł –∑–į –≤—Ā–Ķ –≤—Ä–Ķ–ľ—Ź –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –ĺ—ā–ľ–Ķ—á–į–Ľ–ł –Ľ–ł—ą—Ć 12,8% –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –Ņ—Ä–ł—á–Ķ–ľ –Ī–ĺ–Ľ–ł –≤ –∂–ł–≤–ĺ—ā–Ķ –Ĺ–Ķ –Ĺ–ĺ—Ā–ł–Ľ–ł –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ—č–Ļ –ł —Ā—ā–ĺ–Ļ–ļ–ł–Ļ —Ö–į—Ä–į–ļ—ā–Ķ—Ä (—ā–į–Ī–Ľ. 9, —Ä–ł—Ā. 1).
–í –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–į—Ö –Ď –Ĺ–Ķ–∑–į–≤–ł—Ā–ł–ľ–ĺ –ĺ—ā —Ā—ā–Ķ–Ņ–Ķ–Ĺ–ł –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł —á–į—Ā—ā–ĺ—ā–į —Ä–Ķ—Ü–ł–ī–ł–≤–ĺ–≤ –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ—č—Ö –Ī–ĺ–Ľ–Ķ–Ļ –Ĺ–į –≤—Ā–Ķ—Ö —ć—ā–į–Ņ–į—Ö –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –Ī—č–Ľ–į –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ –≤—č—ą–Ķ, —á–Ķ–ľ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č –ź. –ß–Ķ—Ä–Ķ–∑ 6 –ľ–Ķ—Ā—Ź—Ü–Ķ–≤ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ—č–Ķ –Ņ—Ä–ł—Ā—ā—É–Ņ—č –Ī–ĺ–Ľ–Ķ–Ļ –ĺ—ā–ľ–Ķ—á–į–Ľ–ł—Ā—Ć —É 31,4%, —á–Ķ—Ä–Ķ–∑ 3 –≥–ĺ–ī–į – —É 92,8% (—ā–į–Ī–Ľ. 10), —á—ā–ĺ –Ņ–ĺ—ā—Ä–Ķ–Ī–ĺ–≤–į–Ľ–ĺ –ī–ĺ–Ņ–ĺ–Ľ–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź —ć—ā–ł–ľ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ –į–Ĺ–į–Ľ—Ć–≥–Ķ—ā–ł–ļ–ĺ–≤, —Ā–Ņ–į–∑–ľ–ĺ–Ľ–ł—ā–ł–ļ–ĺ–≤, –į–Ĺ—ā–ł—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤. 21 (32,3%) —á–Ķ–Ľ–ĺ–≤–Ķ–ļ –ł–∑ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č –Ď –Ņ–ĺ–Ľ—É—á–į–Ľ —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ĺ–ĺ–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł–Ķ.
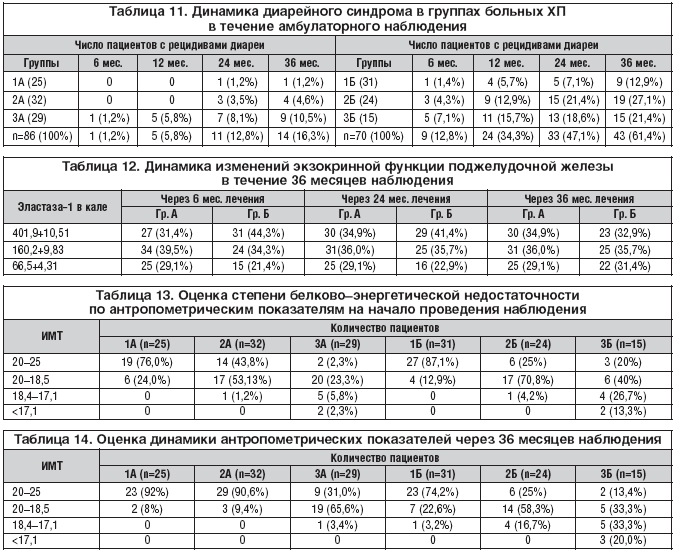
–†–Ķ—Ü–ł–ī–ł–≤–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –ī–ł–į—Ä–Ķ–Ļ–Ĺ–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į –≤ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–į—Ö –ź –Ĺ–į —Ą–ĺ–Ĺ–Ķ –ł–Ĺ–ī–ł–≤–ł–ī—É–į–Ľ—Ć–Ĺ–ĺ –Ņ–ĺ–ī–ĺ–Ī—Ä–į–Ĺ–Ĺ–ĺ–Ļ –ī–ĺ–∑—č –ö—Ä–Ķ–ĺ–Ĺ–į —á–Ķ—Ä–Ķ–∑ 3 –≥–ĺ–ī–į –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –ĺ—ā–ľ–Ķ—á–į–Ľ–ĺ—Ā—Ć —É 16,2% –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö (–≤ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–ĺ–ľ 3–ź –≥—Ä.) –í –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–į—Ö –Ď –ī–ł–į—Ä–Ķ–Ļ–Ĺ—č–Ļ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –į–ľ–Ī—É–Ľ–į—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –Ņ–ĺ–≤—ā–ĺ—Ä—Ź–Ľ—Ā—Ź —É 61,4%, –≤ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–ĺ–ľ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö 2–Ď –ł 3–Ď –≥—Ä. (—Ä–ł—Ā. 2, —ā–į–Ī–Ľ. 11)
–Ē–ł–Ĺ–į–ľ–ł–ļ–į —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ī–ł–į—Ä–Ķ–Ļ–Ĺ–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į —É –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–Ĺ—č—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ļ–ĺ—Ä—Ä–Ķ–Ľ–ł—Ä–ĺ–≤–į–Ľ–į —Ā –ī–į–Ĺ–Ĺ—č–ľ–ł —ć–Ľ–į—Ā—ā–į–∑–Ĺ–ĺ–≥–ĺ —ā–Ķ—Ā—ā–į –ł –ļ–ĺ–Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ—č. –í —ā–Ķ—á–Ķ–Ĺ–ł–Ķ II –ł III –Ņ–Ķ—Ä–ł–ĺ–ī–ĺ–≤ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –≤ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–Ķ –ź —É–≤–Ķ–Ľ–ł—á–ł–Ľ–ĺ—Ā—Ć —á–ł—Ā–Ľ–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ—č–ľ–ł –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ź–ľ–ł —ć–Ľ–į—Ā—ā–į–∑–Ĺ–ĺ–≥–ĺ —ā–Ķ—Ā—ā–į, —Ā–Ĺ–ł–∑–ł–Ľ–ĺ—Ā—Ć –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ–Ļ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć—é. –£ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č –Ď –ī–į–Ĺ–Ĺ—č–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –Ņ—Ä–Ķ—ā–Ķ—Ä–Ņ–Ķ–Ľ–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –≤ —Ö—É–ī—ą—É—é —Ā—ā–ĺ—Ä–ĺ–Ĺ—É: –Ķ—Ā–Ľ–ł –≤ –Ĺ–į—á–į–Ľ–Ķ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź —É 31 –Ī–ĺ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ł–∑ –≥—Ä—É–Ņ–Ņ—č –Ď –≤—č—Ź–≤–Ľ—Ź–Ľ–ł—Ā—Ć –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ—č–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł —ć–Ľ–į—Ā—ā–į–∑–Ĺ–ĺ–≥–ĺ —ā–Ķ—Ā—ā–į, —ā–ĺ —á–Ķ—Ä–Ķ–∑ 3 –≥–ĺ–ī–į —ā–ĺ–Ľ—Ć–ļ–ĺ —É 23. –£ 7 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–ĺ –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł, –ł–∑ –≥—Ä—É–Ņ–Ņ—č 2–Ď –ĺ–Ĺ–ł –Ņ–Ķ—Ä–Ķ—ą–Ľ–ł –≤ –≥—Ä—É–Ņ–Ņ—É 3–Ď (—ā–į–Ī–Ľ. 12).
–Ě–į —Ą–ĺ–Ĺ–Ķ —ā–Ķ—Ä–į–Ņ–ł–ł –ö—Ä–Ķ–ĺ–Ĺ–ĺ–ľ –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–į —ā–Ķ–Ĺ–ī–Ķ–Ĺ—Ü–ł—Ź –ļ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é —á–į—Ā—ā–ĺ—ā—č –≤—Ā—ā—Ä–Ķ—á–į–Ķ–ľ–ĺ—Ā—ā–ł —Ā—ā–Ķ–į—ā–ĺ—Ä–Ķ–ł –≤–ĺ 2–ź –ł 3–ź –≥—Ä—É–Ņ–Ņ–į—Ö (–≤ –≥—Ä—É–Ņ–Ņ–Ķ 1–ź –Ĺ–į –Ņ—Ä–ĺ—ā—Ź–∂–Ķ–Ĺ–ł–ł –≤—Ā–Ķ–≥–ĺ –į–ľ–Ī—É–Ľ–į—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į —Ā—ā–Ķ–į—ā–ĺ—Ä–Ķ—Ź –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–į –Ĺ–Ķ –Ī—č–Ľ–į). –í –≥—Ä—É–Ņ–Ņ–Ķ 2–Ď –ł 3–Ď –∑–į—Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ–į –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ –Ī–ĺ–Ľ–Ķ–Ķ —á–į—Ā—ā–į—Ź –≤—Ā—ā—Ä–Ķ—á–į–Ķ–ľ–ĺ—Ā—ā—Ć –Ĺ–Ķ–Ļ—ā—Ä–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –∂–ł—Ä–į, –ľ—č–Ľ, –∂–ł—Ä–Ĺ—č—Ö –ļ–ł—Ā–Ľ–ĺ—ā –ł –ľ—č—ą–Ķ—á–Ĺ—č—Ö –≤–ĺ–Ľ–ĺ–ļ–ĺ–Ĺ –≤ –ļ–į–Ľ–Ķ –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤—É—é—Č–ł–ľ–ł –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–į–ľ–ł –ź, —Ā –Ĺ–į–ł–Ī–ĺ–Ľ—Ć—ą–ł–ľ–ł –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź–ľ–ł –≤—Ā–Ķ—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –ļ–ĺ–Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ—č –≤ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–Ķ 3–Ď —á–Ķ—Ä–Ķ–∑ 36 –ľ–Ķ—Ā—Ź—Ü–Ķ–≤ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź.
–£ 85 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≤—č—Ź–≤–Ľ–Ķ–Ĺ –ī–Ķ—Ą–ł—Ü–ł—ā –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į –Ĺ–į –Ĺ–į—á–į–Ľ–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź, –Ĺ–Ķ—Ā–ľ–ĺ—ā—Ä—Ź –Ĺ–į –į–ī–Ķ–ļ–≤–į—ā–Ĺ—č–Ļ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–Ļ –ĺ—ā–≤–Ķ—ā –Ĺ–į —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—É—é —ā–Ķ—Ä–į–Ņ–ł—é. –ě–Ī—Ä–į—Č–į–Ķ—ā –Ĺ–į —Ā–Ķ–Ī—Ź –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ, —á—ā–ĺ —É 10 (6 –ł–∑ –≥—Ä. 1–ź –ł 4 –ł–∑ –≥—Ä.1–Ď) –ł–∑ –Ĺ–ł—Ö —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–ĺ –Ĺ–į —Ą–ĺ–Ĺ–Ķ —Ā–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ł –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č. –°–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ł–Ĺ–ī–Ķ–ļ—Ā–į –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į (–ė–ú–Ę) —É 70 –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–Ĺ—č—Ö —Ä–į—Ā—Ü–Ķ–Ĺ–ł–≤–į–Ľ–ĺ—Ā—Ć –ļ–į–ļ —É–ľ–Ķ—Ä–Ķ–Ĺ–Ĺ–ĺ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ–Ķ (–ė–ú–Ę 20,0–18,5). –£ 11 –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –ė–ú–Ę –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ—Ā—Ź –≤ –ł–Ĺ—ā–Ķ—Ä–≤–į–Ľ–Ķ 18,4–17,1, —á—ā–ĺ —Ā–≤–ł–ī–Ķ—ā–Ķ–Ľ—Ć—Ā—ā–≤–ĺ–≤–į–Ľ–ĺ –ĺ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ–ĺ–ľ –ī–Ķ—Ą–ł—Ü–ł—ā–Ķ –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į, —É 4 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ė–ú–Ę –Ī—č–Ľ <17, —á—ā–ĺ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į–Ľ–ĺ —Ä–Ķ–∑–ļ–ĺ –≤—č—Ä–į–∂–Ķ–Ĺ–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –Ĺ—É—ā—Ä–ł—ā–ł–≤–Ĺ–ĺ–≥–ĺ —Ā—ā–į—ā—É—Ā–į (—ā–į–Ī–Ľ. 13).
–Ě–į —Ą–ĺ–Ĺ–Ķ –į–ī–Ķ–ļ–≤–į—ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –ö—Ä–Ķ–ĺ–Ĺ–ĺ–ľ —á–Ķ—Ä–Ķ–∑ 36 –ľ–Ķ—Ā—Ź—Ü–Ķ–≤ —É 33 (38,4%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ł–∑ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č –ź —É–Ľ—É—á—ą–ł–Ľ–ł—Ā—Ć –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –ė–ú–Ę, –ł–∑ –Ĺ–ł—Ö 13 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ī—č–Ľ–ł –ł–∑ –≥—Ä. 3–ź. –Ě–į–Ņ—Ä–ĺ—ā–ł–≤, —É 16 (22,8%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ł–∑ –≥—Ä—É–Ņ–Ņ—č –Ď –ī–Ķ—Ą–ł—Ü–ł—ā –≤–Ķ—Ā–į —Ā—ā–į–Ľ –Ī–ĺ–Ľ—Ć—ą–Ķ, –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į —á–Ķ—Ä–Ķ–∑ 3 –≥–ĺ–ī–į —É 5 (16%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ī–į–∂–Ķ —Ā —Ā–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ –≤–Ĺ–Ķ—ą–Ĺ–Ķ—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–Ķ–Ļ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č (—ā–į–Ī–Ľ. 14).
–£ 55 (35,2%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ—Ä–ł –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł –Ĺ–į I —ć—ā–į–Ņ–Ķ –≤—č—Ź–≤–Ľ—Ź–Ľ–ł—Ā—Ć –Ņ—Ä–ł–∑–Ĺ–į–ļ–ł –ī–Ķ—Ą–ł—Ü–ł—ā–į –≤–ł—Ā—Ü–Ķ—Ä–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ—É–Ľ–į –Ī–Ķ–Ľ–ļ–ĺ–≤: –≥–ł–Ņ–ĺ–Ņ—Ä–ĺ—ā–Ķ–ł–Ĺ–Ķ–ľ–ł—Ź, –≥–ł–Ņ–ĺ–į–Ľ—Ć–Ī—É–ľ–ł–Ĺ–Ķ–ľ–ł—Ź, —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ–Ķ–Ļ —Ā—č–≤–ĺ—Ä–ĺ—ā–ĺ—á–Ĺ—č—Ö –ł–ľ–ľ—É–Ĺ–ĺ–≥–Ľ–ĺ–Ī—É–Ľ–ł–Ĺ–ĺ–≤, –ĺ–Ī—Č–Ķ–≥–ĺ –ļ–ĺ–Ľ–ł—á–Ķ—Ā—ā–≤–į –Ľ–ł–ľ—Ą–ĺ—Ü–ł—ā–ĺ–≤ –≤ –Ņ–Ķ—Ä–ł—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ—Ä–ĺ–≤–ł. –ü–ĺ –≥—Ä—É–Ņ–Ņ–į–ľ —ć—ā–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ–ł—Ā—Ć —Ā–Ľ–Ķ–ī—É—é—Č–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ: 2–ź – 17; 3–ź – 19; 2–Ď – 9; 3–Ď – 10 —á–Ķ–Ľ–ĺ–≤–Ķ–ļ. –í –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–Ķ –ź —É–∂–Ķ —á–Ķ—Ä–Ķ–∑ –≥–ĺ–ī –Ņ–ĺ—Ā–Ľ–Ķ –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł –ī–ĺ–∑—č —É 30 (83,3%) –≤—Ā–Ķ –≤—č—ą–Ķ–Ņ–Ķ—Ä–Ķ—á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—č–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –ī–ĺ—Ā—ā–ł–≥–Ľ–ł –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ—č—Ö –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ļ, —É 6 —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ —É–≤–Ķ–Ľ–ł—á–ł–Ľ–ł—Ā—Ć. –í –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–Ķ –Ď –ī–į–Ĺ–Ĺ—č–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –Ľ–ł–Ī–ĺ –Ĺ–Ķ –ľ–Ķ–Ĺ—Ź–Ľ–ł—Ā—Ć, –ĺ—Ā—ā–į–≤–į—Ź—Ā—Ć –Ĺ–ł–∂–Ķ –Ĺ–ĺ—Ä–ľ—č, –Ľ–ł–Ī–ĺ –ł–ľ–Ķ–Ľ–ł —ā–Ķ–Ĺ–ī–Ķ–Ĺ—Ü–ł—é –ļ –ī–į–Ľ—Ć–Ĺ–Ķ–Ļ—ą–Ķ–ľ—É —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é. –ß–Ķ—Ä–Ķ–∑ 36 –ľ–Ķ—Ā—Ź—Ü–Ķ–≤ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź —á–ł—Ā–Ľ–ĺ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā–ĺ —Ā–Ĺ–ł–∂–Ķ–Ĺ–Ĺ—č–ľ–ł –ĺ–ī–Ĺ–ł–ľ –ł–Ľ–ł –Ī–ĺ–Ľ—Ć—ą–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ź–ľ–ł –≤–ł—Ā—Ü–Ķ—Ä–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ņ—É–Ľ–į –Ī–Ķ–Ľ–ļ–ĺ–≤ –≤ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–Ķ –Ď —É–≤–Ķ–Ľ–ł—á–ł–Ľ–ĺ—Ā—Ć –Ĺ–į 9 —á–Ķ–Ľ–ĺ–≤–Ķ–ļ: 2–Ď – 15; 3–Ď – 13. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ—Ä–ł–Ķ–ľ —ā–į–Ī–Ľ–Ķ—ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –Ĺ–Ķ –Ņ—Ä–Ķ–ī–ĺ—ā–≤—Ä–į—Č–į–Ķ—ā –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –Ĺ—É—ā—Ä–ł—ā–ł–≤–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–ĺ–ľ.
–ü—Ä–ł –ī–ł–Ĺ–į–ľ–ł—á–Ķ—Ā–ļ–ĺ–ľ –£–ó–ė –Ņ–ĺ –ĺ–ļ–ĺ–Ĺ—á–į–Ĺ–ł–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–ĺ, —á—ā–ĺ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č –ź –Ĺ–į–ľ–Ķ—ā–ł–Ľ–į—Ā—Ć —ā–Ķ–Ĺ–ī–Ķ–Ĺ—Ü–ł—Ź –ļ —É–Ľ—É—á—ą–Ķ–Ĺ–ł—é –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ —É–Ľ—Ć—ā—Ä–į–∑–≤—É–ļ–ĺ–≤–ĺ–Ļ –ļ–į—Ä—ā–ł–Ĺ—č –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č. –£–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–Ĺ—č–Ķ —Ä–į–∑–ľ–Ķ—Ä—č –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ —Ä–Ķ–∂–Ķ –≤—Ā—ā—Ä–Ķ—á–į–Ľ–ł—Ā—Ć –≤ 1–ź, 2–ź –ł 3–ź –≥—Ä—É–Ņ–Ņ–į—Ö, —á–Ķ–ľ –≤ 1–Ď, 2–Ď –ł 3–Ď –≥—Ä—É–Ņ–Ņ–į—Ö. –ó–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č –Ĺ–į –Ĺ–į—á–į–Ľ–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –ĺ—ā–ľ–Ķ—á–į–Ľ–ł—Ā—Ć —É –ĺ–ī–ł–Ĺ–į–ļ–ĺ–≤–ĺ–≥–ĺ –Ņ—Ä–ĺ—Ü–Ķ–Ĺ—ā–į –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –≤ –ĺ–Ī–Ķ–ł—Ö –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–į—Ö (18,5%). –ü–ĺ –ĺ–ļ–ĺ–Ĺ—á–į–Ĺ–ł–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź —É 3 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č –ź —Ā—ā—Ä—É–ļ—ā—É—Ä–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č —É–ľ–Ķ–Ĺ—Ć—ą–ł–Ľ–ł—Ā—Ć; –Ĺ–į–Ņ—Ä–ĺ—ā–ł–≤, –≤ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ–Ķ –Ď –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ķ –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź —Ā—ā—Ä—É–ļ—ā—É—Ä—č –∂–Ķ–Ľ–Ķ–∑—č —Ā—ā–į–Ľ–ł –≤—č—Ź–≤–Ľ—Ź—ā—Ć—Ā—Ź —É 25 (35,7%) –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö (—ā–į–Ī–Ľ. 15 –ł 16, —Ä–ł—Ā. 3 –ł 4).
–ü—Ä–ł –ĺ—Ü–Ķ–Ĺ–ļ–Ķ –ī–ł–Ĺ–į–ľ–ł–ļ–ł –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –ļ–į—á–Ķ—Ā—ā–≤–į –∂–ł–∑–Ĺ–ł, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –ł–∑–Ĺ–į—á–į–Ľ—Ć–Ĺ–ĺ –Ī—č–Ľ–ł —Ā–Ĺ–ł–∂–Ķ–Ĺ—č —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≤—Ā–Ķ—Ö –≥—Ä—É–Ņ–Ņ, –ĺ—ā–ľ–Ķ—á–į–Ľ–ĺ—Ā—Ć –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ–Ķ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ –Ņ–ĺ –≤—Ā–Ķ–ľ —ą–ļ–į–Ľ–į–ľ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ–ĺ–ī–≥—Ä—É–Ņ–Ņ—č –ź (1, 2, 3 –≥—Ä—É–Ņ–Ņ) –ł —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ 1–Ď –≥—Ä—É–Ņ–Ņ—č.
–í—č–≤–ĺ–ī—č
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–Ĺ–ĺ–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ņ–ĺ–ļ–į–∑–į–Ľ–ĺ –Ī–ĺ–Ľ—Ć—ą—É—é —ć—Ą—Ą–Ķ–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –≤ –Ņ–ĺ–ī–ī–Ķ—Ä–∂–į–Ĺ–ł–ł —Ä–Ķ–ľ–ł—Ā—Ā–ł–ł, –Ņ—Ä–ĺ—Ą–ł–Ľ–į–ļ—ā–ł–ļ–Ķ –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł–Ļ –•–ü –ī–≤—É—Ö–ĺ–Ī–ĺ–Ľ–ĺ—á–Ķ—á–Ĺ—č—Ö –ľ–ł–Ĺ–ł–ľ–ł–ļ—Ä–ĺ—Ā—Ą–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł—Ö —Ą–ĺ—Ä–ľ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł–Ĺ–į –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā —ā–į–Ī–Ľ–Ķ—ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ–ł —Ą–ĺ—Ä–ľ–į–ľ–ł.
–Ě–į —Ą–ĺ–Ĺ–Ķ –Ĺ–Ķ–Ņ—Ä–Ķ—Ä—č–≤–Ĺ–ĺ–Ļ –ľ–ĺ–Ĺ–ĺ—ā–Ķ—Ä–į–Ņ–ł–ł –ö—Ä–Ķ–ĺ–Ĺ–ĺ–ľ –≤ —Ą–į–∑—É —Ä–Ķ–ľ–ł—Ā—Ā–ł–ł —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ –Ņ–į–Ĺ–ļ—Ä–Ķ–į—ā–ł—ā–ĺ–ľ –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ —Ä–Ķ–∂–Ķ –≤–ĺ–∑–Ĺ–ł–ļ–į—é—ā —Ä–Ķ—Ü–ł–ī–ł–≤—č –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ –ł –ī–ł—Ā–Ņ–Ķ–Ņ—Ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–į, –ĺ—ā–ľ–Ķ—á–į–Ķ—ā—Ā—Ź –Ĺ–ĺ—Ä–ľ–į–Ľ–ł–∑–į—Ü–ł—Ź –Ī–Ķ–Ľ–ļ–ĺ–≤–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į –ł –Ĺ—É—ā—Ä–ł—ā–ł–≤–Ĺ–ĺ–≥–ĺ —Ā—ā–į—ā—É—Ā–į —Ā —É—Ā—ā—Ä–į–Ĺ–Ķ–Ĺ–ł–Ķ–ľ –ī–Ķ—Ą–ł—Ü–ł—ā–į –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į, –Ĺ–Ķ –≤—č—Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ —Ā—ā—Ä—É–ļ—ā—É—Ä–Ĺ—č—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ –≤ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑–Ķ –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ —É–Ľ—Ć—ā—Ä–į–∑–≤—É–ļ–ĺ–≤–ĺ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź, –Ņ–ĺ–≤—č—ą–į–Ķ—ā—Ā—Ź –ļ–į—á–Ķ—Ā—ā–≤–ĺ –∂–ł–∑–Ĺ–ł.
–Ě–Ķ–Ņ—Ä–Ķ—Ä—č–≤–Ĺ–į—Ź —ā–Ķ—Ä–į–Ņ–ł—Ź –ö—Ä–Ķ–ĺ–Ĺ–ĺ–ľ –≤ —Ą–į–∑—É —Ä–Ķ–ľ–ł—Ā—Ā–ł–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ł–ľ–Ķ–Ķ—ā –ł –ĺ—á–Ķ–≤–ł–ī–Ĺ—č–Ķ —Ą–į—Ä–ľ–į–ļ–ĺ—ć–ļ–ĺ–Ĺ–ĺ–ľ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–į. –í —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 36 –ľ–Ķ—Ā—Ź—Ü–Ķ–≤ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č, –Ņ—Ä–ł–Ĺ–ł–ľ–į–≤—ą–ł–Ķ –ö—Ä–Ķ–ĺ–Ĺ, –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł –Ĺ–Ķ –ł—Ā–Ņ—č—ā—č–≤–į–Ľ–ł –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ—Ā—ā–ł –≤ —Ā–ĺ–Ņ—É—ā—Ā—ā–≤—É—é—Č–Ķ–ľ –Ľ–Ķ—á–Ķ–Ĺ–ł–ł (–į–Ĺ–į–Ľ—Ć–≥–Ķ—ā–ł–ļ–ł, –į–Ĺ—ā–į—Ü–ł–ī—č, –į–Ĺ—ā–ł—Ā–Ķ–ļ—Ä–Ķ—ā–ĺ—Ä–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č), —Ā—Ä–Ķ–ī–ł –Ĺ–ł—Ö –Ĺ–Ķ –Ī—č–Ľ–ĺ –Ĺ–ł –ĺ–ī–Ĺ–ĺ–≥–ĺ —Ā–Ľ—É—á–į—Ź –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł –Ņ–ĺ –Ņ–ĺ–≤–ĺ–ī—É –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł—Ź –•–ü.
–Ě–į–Ņ—Ä–ĺ—ā–ł–≤, –≤ –≥—Ä—É–Ņ–Ņ–į—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –•–ü, –Ņ—Ä–ł–Ĺ–ł–ľ–į–≤—ą–ł—Ö —ā–į–Ī–Ľ–Ķ—ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–Ķ –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–Ķ —Ā—Ä–Ķ–ī—Ā—ā–≤–į, –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–ĺ –Ī–ĺ–Ľ–Ķ–Ķ —á–į—Ā—ā–ĺ–Ķ —Ä–Ķ—Ü–ł–ī–ł–≤–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –Ī–ĺ–Ľ–Ķ–≤–ĺ–≥–ĺ –ł –ī–ł—Ā–Ņ–Ķ–Ņ—Ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ā–ł–Ĺ–ī—Ä–ĺ–ľ–ĺ–≤ –Ĺ–į —Ą–ĺ–Ĺ–Ķ –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä—É—é—Č–ł—Ö –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ –Ĺ—É—ā—Ä–ł—ā–ł–≤–Ĺ–ĺ–≥–ĺ —Ā—ā–į—ā—É—Ā–į, —á—ā–ĺ –Ņ–ĺ—ā—Ä–Ķ–Ī–ĺ–≤–į–Ľ–ĺ –≤ 32,3% —Ā–Ľ—É—á–į–Ķ–≤ —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ĺ–ĺ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź.