Микрофлора пищеварительного тракта представляет собой сложную экологическую систему, включающую наряду с кишечными бактериями, слизистые оболочки хозяина, компоненты пищи, вирусы, грибы. Основная масса микрофлоры фиксирована к специфическим рецепторам энтероцитов слизистой оболочки (СО) желудочно–кишечного тракта (ЖКТ), образуя микроколонии (мукозная микрофлора), и лишь незначительная часть ее находится в свободном состоянии в просвете кишки (внутрипросветная микрофлора).
Состав кишечных бактерий каждого биотопа пищеварительного тракта является постоянным, что связано со способностью микроорганизмов фиксироваться к строго определенным рецепторам эпителиальных клеток слизистой оболочки. У здорового человека в проксимальных отделах тонкой кишки содержится относительно небольшое количество грамположительных аэробов и факультативных анаэробов, таких как лактобактерии или энтерококки в концентрации до 104 колониеобразующих единиц на 1 г (КОЕ/г) тонкокишечного содержимого. В данном биотопе транзиторно могут присутствовать колиформные бактерии, количество которых редко достигает 103 КОЕ/г содержимого. В дистальных отделах тонкой кишки основными представителями являются энтеробактерии, включая и колиформные анаэробы, при этом концентрация микроорганизмов возрастает и достигает 105–109 КОЕ/г содержимого. Основным местом обитания нормальной кишечной флоры является толстая кишка. Общая биомасса микробных клеток толстой кишки составляет около 1,5 кг, что соответствует 1011–12 КОЕ/г кишечного содержимого и приблизительно 1/3 сухой массы фекалий [3]. Именно толстая кишка в силу такой высокой микробной контаминации несет самую большую функциональную нагрузку по сравнению с другими биотопами [1]. К постоянным видам толстокишечных бактерий относят неспорообразующие анаэробы (до 1012), такие как бактероиды, бифидобактерии, эубактерии, а также аэробы и факультативные анаэробы – стрептококки, лактобактерии, энтеробактерии (эшерихии), грибы.
По характеру метаболизма микрофлора толстой кишки подразделяется на протеолитическую и амилолитическую. Протеолитические бактерии (бактероиды, протей, эшерихии, клостридии и др.) используют в качестве питательного субстрата белок и продукты его гидролиза, вызывая гнилостные процессы, конечными метаболитами которых являются аммиак, ароматические аминокислоты, эндогенные канцерогены, сульфиды и др. Большинство протеолитических микроорганизмов являются условно–патогенными, вызывают развитие воспаления СО, диареи, неоплазий. Амилолитические бактерии (бифидобактерии, лактобактерии и др.), составляющие основную массу микробных клеток толстой кишки, используют в своей жизнедеятельности пищевые углеводные субстраты и полисахариды кишечной слизи. Метаболические функции, выполняемые амилолитическими микробами, являются полезными для организма хозяина, так как они поддерживают гомеостаз и нейтрализуют негативные влияния протеолитической микрофлоры.
В организме человека нормальная, преимущественно амилолитическая микрофлора выполняет ряд важных функций. Так, кишечные бактерии синтезируют витамины (В1, В2, В6, К, фолиевую, никотиновую кислоту и др.), участвуют в процессах пищеварения, и прежде всего – в гидролизе клетчатки. Компоненты пищи расщепляются широким спектром бактериальных полисахаридаз, гликозидаз, протеаз и пептидаз до олигомеров (глюкозы и аминокислот), которые, в свою очередь, ферментируются до короткоцепочных жирных кислот, органических кислот, водорода, углекислого газа и других продуктов. Конечные компоненты гидролиза оказывают различное действие на функцию толстой кишки: стимулируют моторику, способствуют задержке жидкости в просвете кишки. Короткоцепочные жирные кислоты улучшают трофику СО кишки и печени, усиливают их клеточную регенерацию. Органические кислоты, всасываясь в толстой кишке, увеличивают энергетический потенциал макроорганизма. В то же время продукты микробного гидролиза белка (аммиак, амины, индол, скатол) усиливают эндогенную интоксикацию. Микрофлора разрушает пищеварительные ферменты, различные стеролы и стероиды, включая холестерин, андрогены и эстрогены, а также деконъюгирует желчные кислоты.
Чрезвычайно важной функцией нормальной кишечной микрофлоры является участие в активации защитных местных и общих иммунных реакций, а также создание иммунологической толерантности макроорганизма. Слизистая оболочка желудочно–кишечного тракта относится к одному из независимых компонентов иммунной системы и обладает собственной лимфоидной тканью, известной как ассоциированная с желудочно–кишечным трактом лимфоидная ткань (gut–associated lymphoid tissue – GALT). GALT является одним из самых значимых компонентов иммунной системы макроорганизма. При нормальном ее функционировании растворимые бактериальные субстанции и частички, размером до 150 мкм, а также бактерии проникают в GALT двумя путями: в результате персорбции и за счет их транспортировки специальными М–клетками, расположенными в СО кишки. Бактериальные антигены в начале презентуются Т–хелперам (CD4) и макрофагам, которые инициируют синтез цитокинов. Последние одновременно с антигенами активируют незрелые В–лимфоциты с последующей миграцией их из стенки кишки в лимфу, лимфатические узлы, селезенку, в которых происходит их активная пролиферация, созревание и трансформация в плазматические клетки, синтезирующие секреторный IgA (sIgA). В последующем зрелые лимфоциты и плазматические клетки с током крови расселяются во все слизистые оболочки организма и до 80% их количества возвращается обратно в желудочно–кишечный тракт (homing – эффект), где они обеспечивают адекватный синтез sIgA и повышают колонизационную резистентность СО [11].
Основное количество IgA секретируется в просвет желудочно–кишечного тракта и лишь небольшое количество поступает в кровь. Слизистая оболочка плотно покрывается состоящими из 2 молекул димерными секреторными IgA (sIgA), которые устойчивы к действию ферментов и продуктам кишечного метаболизма. Данные иммуноглобулины равномерно распределяются на слизистой оболочке и защищают ее от внедрения микроорганизмов. Оказавшись в просвете кишки, sIgA связывает бактерии, предотвращая адгезию и способствуя удалению их из кишечника. Кроме того, sIgA может конъюгироваться с лектинподобными бактериальными адгезинами через свой Fc–домен, что приводит к увеличению агглютинации различных видов бактерий.
Кишечные эпителиальные клетки также выполняют ряд важных иммунологических функций, в том числе презентацию антигена с помощью молекул главного комплекса гистосовместимости, участвуют в синтезе ряда воспалительных и регуляторных цитокинов. Цитокины, синтезируемые эпителиальными клетками, стимулируют развитие клеток кишечной иммунной системы и поддерживают иммунный гомеостаз в кишечнике. Так, при контакте с патогенными бактериями кишечные эпителиальные клетки регулируют продукцию провоспалительных и хемотаксических цитокинов, в том числе интерлейкина–8 (ИЛ–8), моноцитарного хемоаттрактантного белка 1 и туморнекротизирующего фактора
α (TНФ–
α), стимулируя миграцию нейтрофилов и макрофагов к зонам адгезии патогенов и последующую активацию Т–клеток и В–клеток, что в общей сложности обеспечивает выведение их из тканей хозяина.
Определенная роль в иммунной защите принадлежит специализированным лимфоцитам, располагающимся между эпителиальными клетками – кишечным интраэпителиальным лимфоцитам (кИЭЛ). В противоположность большинству Т–клеток кИЭЛ развиваются вне тимуса и составляют около половины всех Т–клеток в организме. Интраэпителиальное расположение делает их доступными для контакта с эпителиальными клетками, с находящимися в просвете кишки антигенами и иммуноцитами lamina propria. Помимо координирующей роли в иммулогических реакциях, они участвуют в цитолитических реакциях, а также в супрессии ответной реакции организма на компоненты индигенной микрофлоры [6].
Защитная функция нормальной кишечной микрофлоры обусловлена «колонизационной резистентностью СО». В настоящее время этот термин используется для обозначения ряда функций нормальных бактерий, способных ингибировать колонизацию СО другими штаммами (например, конкуренция за питательные вещества и рецепторы для адгезии, изменение рН, продукция «бактериоцинов» или других пептидов с противомикробной активностью и др.). В общей сложности эти механизмы составляют прочный барьер слизистой, предотвращая прикрепление патогенов и их инвазию.
Защитная и иммунизирующая функции нормальной флоры направлены на поддержание колонизационной резистентности слизистой оболочки кишечника по отношению к патогенной и условно–патогенной флоре, препятствуя транслокации кишечной микрофлоры во внутреннюю среду макроорганизма [2]. Механизмами, блокирующими транслокацию кишечной микрофлоры во внутреннюю среду макроорганизма, являются кишечный слизистый барьер, состоящий из преэпителиального, эпителиального и постэпителиального компонентов, и кишечной лимфатической системы.
Преэпителиальный барьер включает в себя следующие защитные факторы: продукция слизи; иммуноглобулины А1 и А2, связанные с гликопротеинами слизи; лизоцим, лактоферрин и др., участвующие в лизисе бактерий; гликокаликс, его нормальные реологические параметры, обеспечивающие резистентность эпителия к бактериальным и химическим агентам; окислительно–восстановительный потенциал [Eh], определяющий видовой состав микробиоценоза кишки; ряд низкомолекулярных кишечных метаболитов, продуцируемых нормальной микрофлорой, обеспечивающих колонизационную резистентность слизистой оболочки в отношении условно–патогенных и патогенных микроорганизмов. Продукты жизнедеятельности нормальной кишечной микрофлоры могут использоваться в виде препаратов или в виде некоторых кисломолочных продуктов, изготовленных с участием нормальных кишечных бактерий (кисломолочные продукты Активия). Эпителиальный (внутренний) защитный барьер составляют апикальные клеточные мембраны, блокирующие пассаж в клетку макромолекул, и тесные межклеточные соединения, блокирующие межклеточный пассаж макромолекул. В постэпителиальный барьер входят сеть кровеносных капилляров. При этом кровоток обеспечивает фагоцитоз, гуморальные иммунные реакции и другие механизмы защиты, а также функционирование преэпителиального и эпителиального барьеров [6,11].
К основным факторам, приводящим к повреждению кишечного барьера и транслокации кишечной микрофлоры во внутреннюю среду макроорганизма, относятся заселение кишки патогенной и условно–патогенной микрофлорой; использование нестероидных противовоспалительных препаратов, повреждающих основные механизмы преэпителиальной защиты; прием глюкокортикостероидов, цитостатиков, нарушающих иммунологическое звено защитного барьера; соли желчных кислот, оказывающих детергентный эффект на слизистую оболочку; нарушение кровотока (абдоминальная ишемия, портальная гипертензия и др.).
Дисбактериоз кишечника – клинико–лабораторный синдром, характеризующийся нарушением качественного и количественного состава кишечной микрофлоры в результате влияния многочисленных неблагоприятных экзогенных и эндогенных причин: заболеваний органов пищеварения с наличием воспаления и моторно–секреторных расстройств; перенесенных острых кишечных инфекций и инвазий; длительного приема лекарственных препаратов, влияющих на секрецию пищеварительных желез, моторику и регенерацию эпителия пищеварительного тракта, а также антибиотиков; неполноценных диет, приводящих к развитию гнилостной и бродильной диспепсии и другим расстройствам процессов пищеварения и всасывания; декомпенсированных заболеваний всех органов и систем.
В результате снижения колонизационной резистентности СО в отношении патогенной и условно–патогенной флоры создаются условия для нарушения кишечного слизистого барьера и проникновения бактерий за пределы кишечной стенки. При транслокации кишечных бактерий в патологический процесс вовлекаются различные органы–мишени. Так, при поступлении бактерий в лимфатические узлы возможно развитие мезаденитов и лимфаденитов брюшной полости. Транслокация бактерий в кровь приводит к циркуляции и накоплению в тканях бактериальных токсинов, активации гуморальных иммунных реакций, формированию перекрестной иммунологической реактивности и других патологических процессов, приводящих к появлению полиартралгий, реже реактивных артритов, миалгий, аллергических дерматозов, пищевой псевдоаллергии. Кроме того, при элиминации бактерий из организма могут поражаться почки и мочевыводящие пути с развитием острых и хронических пиелонефритов, мочекаменной болезни.
При длительном течении дисбиоз кишечника, особенно это касается избыточного бактериального роста в тонкой кишке, увеличивает риск развития метаболических заболеваний печени и поражения внепеченочной билиарной системы, таких как неалкогольный стеатоз, стеатогепатит, неспецифический реактивный гепатит, внутрипеченочный интралобулярный холестаз, печеночно–клеточная дисфункция, воспалительные процессы и дискинетические нарушения внепеченочного билиарного тракта [14].
Формирование метаболических заболеваний печени (неалкогольный стеатоз и стеатогепатит) складывается из нескольких этапов [12]. На первом этапе выявляются: избыточное поступление или синтез жирных кислот в гепатоците и нарушение их окисления; относительный или абсолютный дефицит апопротеинов; нарушение синтеза липопротеинов очень низкой плотности (ЛПОНП), транспортирующих липиды из гепатоцита; накопление в гепатоците триглицеридов. Субстратом для синтеза триглицеридов в гепатоците являются жирные кислоты, глюкоза и алкоголь эндогенного и экзогенного происхождения. Экзогенными факторами риска развития стеатоза печени являются избыточное поступление в гепатоцит из кишечника продуктов гидролиза липидов (жирных кислот), глюкозы, фруктозы, галактозы, алкоголя; эндогенными – повышение концентрации и нарушение окисления жирных кислот в гепатоците, образующихся при липолизе периферического жира, который усиливается при дефиците или снижении тканевой чувствительности к инсулину, под влиянием кортизола, катехоламинов, дефицита инсулина, при беременности и других состояниях. В результате избыточной концентрации жирных кислот и нарушения глюконеогенеза происходит не только усиление синтеза триглицеридов, но и перегрузка гепатоцитов свободными жирными кислотами. Кроме того, накопление липидов в гепатоците может быть обусловлено снижением продукции апопротеинов В, С1–С3, Е (дефицит аминокислот, нарушение их состава и др.) и синтеза ЛПОНП из–за дефицита липотропных факторов (инсулин, витамины и др.), блокадой ферментов, участвующих в их синтезе, снижением энергетического потенциала клетки и др. Трансформация стеатоза в стеатогепатит (второй этап) обусловлена: повышением продукции TNF–a жировой тканью, обладающего цитотоксичным эффектом; увеличением концентрации свободных жирных кислот, которые оказывают прямой повреждающий эффект на мембраны гепатоцитов и активирует цитохром Р450–2Е1 с повышением перекисного окисления липидов, накоплением реактивных форм кислорода (оксидативный стресс) и образованием избыточного количества высокотоксичных ксенобиотиков. При этом индукция цитохрома Р450–2Е1 является ключевым фактором трансформации стеатоза в стеатогепатит.
Существенное значение в трансформации стеатоза в стеатогепатит играет наличие избыточного бактериального роста в кишечнике. При этом основными факторами, способствующими развитию стеатогепатита, являются: эндотоксемия в результате поступления с портальной кровью микробов, бактериальных липополисахаридов и токсинов из кишечника, что приводит к активации клеток Купффера с избыточной продукцией провоспалительных цитокинов (ТНФ–a и др.), а также увеличение содержания алкоголя в кишечнике в результате бродильных процессов и поступление его в печень [14].
Основные механизмы формирования метаболических поражений печени при дисбактериозе кишечника представлены в таблице 1.
Под воздействием гепатотоксичных цитокинов, хемокинов, прооксидантов, эйкозоноидов, ацеталдегида, железа, продуктов пероксидации липидов, некрозов гепатоцитов и других факторов происходит активация стеллатных клеток и превращение их в миофибробласты, что является ведущим звеном в прогрессировании стеатогепатита. В результате происходит пролиферация, хемотаксис данных клеток и избыточная продукция компонентов соединительной ткани в пространствах Диссе и перицеллюлярно (фиброз).
Последствиями прогрессирования стеатогепатита является формирование фиброза печени (третий этап) в результате слияния жировых депозитов при разрыве гепатоцитов с образованием кист, поступления большого объема липидов из гепатоцитов в интерстициальное пространство с развитием воспалительной реакции и фиброза, механического и воспалительного повреждения печеночных вен и развития перивенулярного фиброза.
Конечным (четвертым) этапом патологического процесса является формирование цирроза печени, обусловленного обструкцией печеночных вен, ишемическими некрозами и коллабированием печеночных долек, формированием соединительнотканых септ и, как следствие, цирроза печени.
Терапия метаболических нарушений в печени, ассоциированных с дисбактериозом кишечника, включает в себя воздействие как на печеночные, так и на кишечные звенья патогенеза. Воздействие на кишечные звенья патогенеза предусматривает: лечение основного заболевания ЖКТ, приведшего к развитию дисбактериоза кишечника, нормализацию состава кишечного биоценоза, а также процессов пищеварения и всасывания. С целью восстановления нормального состава кишечной микрофлоры рекомендуется диета в зависимости от типа диспепсии и основного заболевания: при бродильной диспепсии – на 7–10 дней целесообразно ограничить овощи, фрукты, растительную клетчатку, особенно бобовые, пресное молоко, при гнилостной диспепсии – на период обострения питание с преобладанием овощей и фруктов в кулинарной обработке.
Ведущая роль в нормализации состава кишечной микрофлоры принадлежит пробиотикам, препаратам или продуктам питания, содержащим живые штаммы нормальной кишечной микрофлоры [13]. Важным механизмом действия пробиотиков является антагонистический эффект в отношении ненормальных штаммов кишечной микрофлоры, обусловленный действием метаболитов нормальных бактерий, основными из которых являются короткоцепочечные жирные кислоты и молочная кислота. Короткоцепочечные жирные кислоты являются основным источником питания эпителия кишки, способствуя его регенерации и росту и нормализации функций СО кишечника; улучшают всасывание электролитов и воды; участвуют в адаптации толстой кишки к его содержимому; влияют на моторику желудочно–кишечного тракта (снижают тонус желудка и замедляют эвакуацию, препятствуют забросу толстокишечного содержимого в тонкую кишку, в высоких концентрациях ингибируют моторику толстой кишки). Молочная кислота подавляет рост и колонизацию СО патологической микрофлорой, препятствуя адгезии ненормальной микрофлоры к кишечному эпителию, способствует восстановлению нормального состава кишечной микрофлоры. Пробиотики не только предотвращают колонизацию СО патогенами, но и способствуют стабилизации эпителиальнго барьера, предотвращая транслокацию бактерий во внутреннюю среду. Механизм действия пробиотиков обусловлен также конкуренцией за нутриенты (даже кратковременное лишение только одного питательного субстрата, необходимого для жизнедеятельности определенного вида кишечной микрофлоры, приводит к подавлению его роста).
Важная роль в механизме действия пробиотиков отводится стимуляции иммунного ответа слизистой оболочки ЖКТ и других органов. Известно, что некоторые виды бактерий индуцируют сильный иммунный ответ организма «хозяина», а другие являются слабо иммуногенными или неиммуногенными. Данные литературы свидетельствует, что обогащение кишечной микрофлоры пробиотиками может усилить иммунные реакции. Это обеспечивается в основном благодаря вышеуказанному «хоминг–эффекту», а также предотвращению колонизации слизистой оболочки желудочно–кишечного тракта патогенными и условно–патогенными бактериями и в результате косвенной, адъювантноподобной стимуляции врожденных и приобретенных иммунных функций [6].
При патологии тонкой кишки назначаются пробиотики, содержащие аэробную микрофлору (лактобактерии, энтерококки), при патологии толстой – анаэробную микрофлору (бифидобактерии), однако предпочтение отдается комбинированным препаратам. Дозы пробиотиков зависят от используемых препаратов, продолжительность терапии составляет от 2 недель и более. Одними из широко используемых продуктов, содержащих штаммы бактерий с пробиотическими свойствами, являются кисломолочные продукты Активия, которые в своем составе имеют молочнокислые микроорганизмы не менее 107 КОЕ/г и бифидобактерии ActiRegularis не менее 108 КОЕ/г. В ряде исследований доказана эффективность Активиа в ускорении времени кишечного транзита у взрослых, особенно у пожилых пациентов и женщин [5,7]. Последнее имеет особое значение, поскольку замедление времени кишечного транзита является одним из установленных факторов патогенеза дисбиоза кишечника. При этом эффективность воздействия приема йогурта Активия на скорость кишечного транзита имеет дозозависимый характер, возрастая с увеличением кратности приема продукта до 2–3 раз [8]. Показано, что эффект продукта напрямую связан с наличием в нем штаммов бифидобактерий [10]. Обычно кисломолочный продукт Активия назначается 250–500 мл в сутки в течение 2–3 недель.
Значительной части больных перед назначением пробиотиков проводится антибактериальная терапия с использованием кишечных антисептиков – 1–2 курса по 5–7 дней каждый. Показаниями для проведения антибактериальной деконтаминации кишечника являются: а) избыточный бактериальный рост в тонкой кишке, б) транслокация кишечных бактерий за пределы кишки, в) воспалительные процессы в кишечнике, г) выявление условно–патогенной флоры в содержимом кишечника, д) отсутствие эффекта от предшествующих курсов лечения, не предусматривающих деконтаминацию кишки. Прием кишечных антисептиков целесообразно сочетать с пребиотиками (лактулоза и др.), представляющими собой натуральные или синтетические средства немикробного происхождения, селективно стимулирующие рост и/или метаболическую (ферментативную) активность нормальной кишечной микрофлоры и восстанавливающие защитный кишечный барьер [6]. По показаниям могут использоваться ферментные препараты, средства, нормализующие моторную функцию ЖКТ, витамины и др., в зависимости от основного заболевания. Патогенетическая терапия поражений печени при дисбиозе кишечника включает: 1) восстановление метаболических процессов в гепатоците; 2) стимуляцию экскреции с желчью ксенобиотиков. Всем пациентам с наличием жировой болезни печени в качестве базисной терапии необходимо исключить действие этиологических факторов и употребление алкоголя, назначить диету, богатую белком (1,5 г/кг/сут.), водорастворимыми витаминами и бедную жирами, нормализовать в крови содержание глюкозы, липидов, мочевой кислоты.
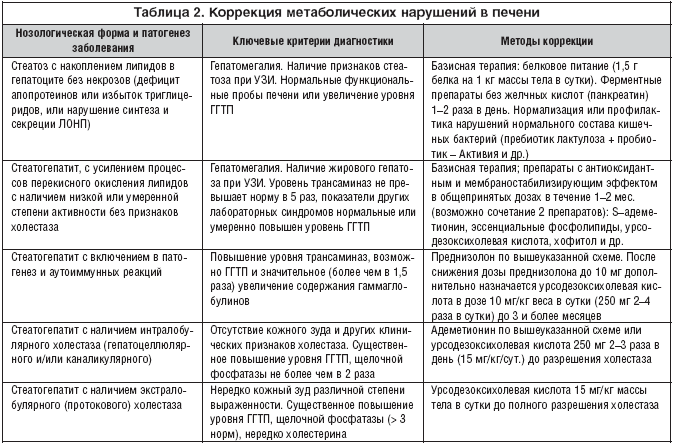
Определяющим фактором при выборе гепатопротекторов является преобладание тех или иных патогенетических механизмов в основе метаболических нарушений в печени [4]. Критерии диагностики и методы коррекции метаболических нарушений печени, обусловленных накоплением липидов в гепатоцитах, в зависимости от выявляемых патогенетических механизмов представлены в таблице 2.
Примерная схема лечения стеатоза печени и стеатогепатита низкой и умеренной степени активности с наличием дисбактериоза кишечника включает в себя:
• Диета: 1,5 г белка на 1 кг м.т., исключение алкоголя, резкое ограничение животного жира и исключение жирных кислот (жареные продукты), химических консервантов и эфирных веществ, а также с учетом характера диспепсии
• Гепатопротектор (выбор препарата с учетом ведущего патогенетического механизма стеатогепатита) в течение 3 и более месяцев
• Нормализация состава кишечной микрофлоры (пребиотик лактулоза 5–10 мл длительно + пробиотик, включая кисломолочный продукт Активия, в течение 2 и более недель, при необходимости – курсы кишечных антисептиков продолжительностью 5–7 дней)
• Ферменты без желчных кислот (1–2 дозы в сутки) – до нормализации процессов пищеварения.

Литература
1. Белоусова Е.А., Никитина Н.В., Мишуровская Т.С., Златкина А.Р. Возможности препаратов на основе микробных метаболитов для восстановления кишечной микробиоты // Consilium medicum. – 2005. – Выпуск № 1. – с. 9–13
2. Бондаренко В.М., Грачева Н.М. Пробиотики, пребиотики и синбиотики // Фарматека. – 2003. – №7. – С. 56–63.
3. Шендеров Б.А. Медицинская микробная экология и функциональное питание // Микрофлора человека и животных и ее функции. – Т. 1. – М.: Грантъ. – 1998.
4. Яковенко Э.П. Агафонова Н.А., Григорьева В.П., Волошейникова Т.В. Метаболические заболевания печени: неалкогольный стеатоз и стеатогепатит. Диагностика и лечение // Качество жизни. Медицина. – 2004. – № 2 (5). – С.53 – 59.
5. Bouvier M, et al. Effects of consumption of a milk fermented by the probiotic Bifidobacterium animalis DN 173 010 on colonic transit time in healthy humans // Bioscience and Microflora. – 2001. – Vol 20 (2). – P. 43–48.
6. Gibson G.R., Macbarlane G.T. Human colonic bacteria: role in nutrition, physiolody and pathology. Boca Ratoh: CRC Press.–1995.–250.Р.
7. Marteau P. et al. Bifidobacterium animalis, souche DN173 010 shortens the colonic transit time in healthy women. A double blind randomised controlled study // Aliment. Pharmacol. Ther. – 2002. – Vol. 16. – P. 587–593
8. Meance S. et al. Recent advance in the use of fucntional foods : Effect of the commercial fermented milk with Bifidobacterium animalis strain DN–173 010 and yoghurt strains on gut transit time in the elderly // Microb. Ecol. Health. Dis. – 2003. – Vol. 15. – P. 15–22.
9. Mitsuoka T. The fecal flora of man. Communication: the composition of Bifidobacterium flora of different age groups // Zentrabl. Bakteriol. – 1974. – Vol. 226. – P. 469–478.
10. Pochart P. et al. Isolement des bifidobacteries dans les selles apres ingestion prolongee de lait аи bifidus // Med.Mai. Infect. – 1990. – Vol. 20. – P. 75–78.
11. Rose S. Gastrointestinal and Hepatobiliary pathophysiology. Fence Greek Publishing, LLC, Madison. 1998. 475 p.
12. Sahai A., Malladi P., Melin–Aldana H. et al. Progress in understanding the pathogenesis of nonalcoholic fatty liver disease // Hepatology. – 2005. – Vol. 41, N 1. – P. 204 – 206.
13. Schaafsma G. State of the art concerning probiotic strains in milk products // IDF Nutr. Newslett. – 1996. – Vol. 5. – P. 23–24.
14. Wigg A.J., Robert – Thompson J. G., Dymock R.B. The role small intestinal bacterial overgrowth, intestinal permeability, endotoxaemia and tumor necrosis factor – alfa in a pathogenesis of nonalcoholic steatohepatitis. // Gut. – 2001. – Vol. 48. – P. 206 – 211.












