–í–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ
–ß–į—Ā—ā–ĺ—ā–į —Ä–Ķ–≥–ł—Ā—ā—Ä–į—Ü–ł–ł –Ĺ–Ķ–į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ–ĺ–Ļ –∂–ł—Ä–ĺ–≤–ĺ–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł (–Ě–ź–Ė–Ď–ü) –≤ –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–Ķ–Ķ –ī–Ķ—Ā—Ź—ā–ł–Ľ–Ķ—ā–ł–Ķ –≤ –†–ĺ—Ā—Ā–ł–Ļ—Ā–ļ–ĺ–Ļ –§–Ķ–ī–Ķ—Ä–į—Ü–ł–ł –∑–į–ľ–Ķ—ā–Ĺ–ĺ –≤–ĺ–∑—Ä–ĺ—Ā–Ľ–į. –ü–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ –ĺ—ā–Ķ—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –ľ–Ĺ–ĺ–≥–ĺ—Ü–Ķ–Ĺ—ā—Ä–ĺ–≤—č—Ö –Ĺ–į–Ī–Ľ—é–ī–į—ā–Ķ–Ľ—Ć–Ĺ—č—Ö —ć–Ņ–ł–ī–Ķ–ľ–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ DIREG_L_0193 [1] –ł DIREG 2 [2], –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–Ĺ—č—Ö –≤ 2007 –≥. –ł 2014 –≥. —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ, –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ł–Ķ –Ě–ź–Ė–Ď–ü –≤–ĺ–∑—Ä–ĺ—Ā–Ľ–ĺ —Ā 26,1% –ī–ĺ 33,3%. –Ē–į–Ĺ–Ĺ–į—Ź —ā–Ķ–Ĺ–ī–Ķ–Ĺ—Ü–ł—Ź –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć –ĺ–Ī—É—Ā–Ľ–ĺ–≤–Ľ–Ķ–Ĺ–į –Ĺ–Ķ —ā–ĺ–Ľ—Ć–ļ–ĺ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ–ľ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź. –Ē–Ľ–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ –≤—Ä–Ķ–ľ—Ź –≤–Ķ–ī—É—Č–į—Ź —Ä–ĺ–Ľ—Ć –≤ –Ņ–į—ā–ĺ–≥–Ķ–Ĺ–Ķ–∑–Ķ –Ě–ź–Ė–Ď–ü –ĺ—ā–≤–ĺ–ī–ł–Ľ–į—Ā—Ć —É–Ĺ–ł–≤–Ķ—Ä—Ā–į–Ľ—Ć–Ĺ–ĺ–ľ—É –Ņ–į—ā–ĺ—Ą–ł–∑–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–ľ—É —Ā–ł–Ĺ–ī—Ä–ĺ–ľ—É –ł–Ĺ—Ā—É–Ľ–ł–Ĺ–ĺ—Ä–Ķ–∑–ł—Ā—ā–Ķ–Ĺ—ā–Ĺ–ĺ—Ā—ā–ł (–ė–†) –ł –≥–ł–Ņ–Ķ—Ä–ł–Ĺ—Ā—É–Ľ–ł–Ĺ–Ķ–ľ–ł–ł, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –ľ–ĺ–≥–Ľ–ł —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į—ā—Ć—Ā—Ź —É–∂–Ķ –Ĺ–į —Ā–į–ľ—č—Ö –Ĺ–į—á–į–Ľ—Ć–Ĺ—č—Ö —Ā—ā–į–ī–ł—Ź—Ö –Ě–ź–Ė–Ď–ü. –≠—ā–ĺ –Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ķ—ā—Ā—Ź –ł –Ĺ–į –ī–į–Ĺ–Ĺ—č–Ļ –ľ–ĺ–ľ–Ķ–Ĺ—ā [3]. –ě–ī–Ĺ–į–ļ–ĺ –≤ —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ–ĺ–Ļ –ľ–Ķ–ī–ł—Ü–ł–Ĺ–Ķ –≤–ĺ–∑—Ä–į—Ā—ā–į–Ķ—ā —Ä–ĺ–Ľ—Ć –Ņ—Ä–ł–ľ–Ķ–Ĺ–Ķ–Ĺ–ł—Ź –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ-–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ł —Ā–Ņ–Ķ—Ü–ł–į–Ľ—Ć–Ĺ—č—Ö –ľ–Ķ—ā–ĺ–ī–ĺ–≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź, —á—ā–ĺ –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā —Ā –Ī–ĺ–Ľ—Ć—ą–Ķ–Ļ —ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć—é –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—Ä–ĺ–≤–į—ā—Ć –ł –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä–ĺ–≤–į—ā—Ć —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –≤–Ĺ—É—ā—Ä–Ķ–Ĺ–Ĺ–ł—Ö –ĺ—Ä–≥–į–Ĺ–ĺ–≤, –≤ —ā–ĺ–ľ —á–ł—Ā–Ľ–Ķ —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ņ–Ķ—á–Ķ–Ĺ–ł –ł –Ě–ź–Ė–Ď–ü, –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä–ĺ–≤–į—ā—Ć —Ä–ł—Ā–ļ –≤–ĺ–∑–Ĺ–ł–ļ–Ĺ–ĺ–≤–Ķ–Ĺ–ł—Ź –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ –ł –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–≥–ĺ –ł—Ā—Ö–ĺ–ī–į [4‚Äď6]. –í —ć—ā–ĺ–ľ –Ņ–Ľ–į–Ĺ–Ķ –į–ļ—ā–ł–≤–Ĺ–ĺ –ł–∑—É—á–į–Ķ—ā—Ā—Ź —Ä–ĺ–Ľ—Ć —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö –≥–Ķ–Ĺ–ĺ–≤-–ļ–į–Ĺ–ī–ł–ī–į—ā–ĺ–≤, –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ –ļ–ĺ—ā–ĺ—Ä—č—Ö –ľ–ĺ–∂–Ķ—ā –ł–≥—Ä–į—ā—Ć —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—É—é —Ä–ĺ–Ľ—Ć –≤ —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–ł –ł –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł–ł –Ě–ź–Ė–Ď–ü, –≤ —á–į—Ā—ā–Ĺ–ĺ—Ā—ā–ł, –ĺ–Ī—Ā—É–∂–ī–į–Ķ—ā—Ā—Ź —Ā–≤—Ź–∑—Ć —Ā –Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć—Ā—ā–≤–ĺ–ľ G-–į–Ľ–Ľ–Ķ–Ľ–ł –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–Ĺ–ĺ–≥–ĺ –≥–Ķ–Ĺ–į rs666089 ADIPOR1, –į —ā–į–ļ–∂–Ķ –Ņ–ĺ–Ľ–ł–ľ–ĺ—Ä—Ą–ł–∑–ľ –≥–Ķ–Ĺ–į PNPLA3/148M [5, 7]. –ė–ľ–Ķ–Ĺ–Ĺ–ĺ –≥–Ķ–Ĺ–Ĺ–ĺ-–ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ–Ļ –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ–Ķ –ł –Ņ–ĺ—Ā–≤—Ź—Č–Ķ–Ĺ–į –Ĺ–į—ą–į —Ā—ā–į—ā—Ć—Ź.
–¶–Ķ–Ľ—Ć –Ĺ–į—ą–Ķ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź: –ĺ—Ü–Ķ–Ĺ–ł—ā—Ć –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ—Ā—ā—Ć –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö –ł—Ā—Ö–ĺ–ī–ĺ–≤ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ě–ź–Ė–Ď–ü —Ā —É—á–Ķ—ā–ĺ–ľ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö, –Ī–ł–ĺ—Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ł—Ö –ł –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ-–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–į—Ä–į–ľ–Ķ—ā—Ä–ĺ–≤.
–ú–į—ā–Ķ—Ä–ł–į–Ľ –ł –ľ–Ķ—ā–ĺ–ī—č
–ě–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ĺ 115 –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö (84 –ľ—É–∂—á–ł–Ĺ—č –ł 31 –∂–Ķ–Ĺ—Č–ł–Ĺ–į) –≤ –≤–ĺ–∑—Ä–į—Ā—ā–Ķ –ĺ—ā 23 –ī–ĺ 69 –Ľ–Ķ—ā (—Ā—Ä–Ķ–ī–Ĺ–ł–Ļ –≤–ĺ–∑—Ä–į—Ā—ā 49,3¬Ī1,1 –≥–ĺ–ī–į) —Ā –≤–Ķ—Ä–ł—Ą–ł—Ü–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ –Ě–ź–Ė–Ď–ü. –Ē–ł–į–≥–Ĺ–ĺ–∑ –Ě–ź–Ė–Ď–ü –Ī—č–Ľ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–Ķ–Ĺ –≤ —Ö–ĺ–ī–Ķ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā–Ĺ–ĺ–≥–ĺ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł—Ź–ľ –Ņ–ĺ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–Ķ –ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é –Ě–ź–Ė–Ď–ü –†–ĺ—Ā—Ā–ł–Ļ—Ā–ļ–ĺ–≥–ĺ –ĺ–Ī—Č–Ķ—Ā—ā–≤–į –Ņ–ĺ –ł–∑—É—á–Ķ–Ĺ–ł—é –Ņ–Ķ—á–Ķ–Ĺ–ł –ł –†–ĺ—Ā—Ā–ł–Ļ—Ā–ļ–ĺ–Ļ –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–Ļ –į—Ā—Ā–ĺ—Ü–ł–į—Ü–ł–ł [8]. –Ē–Ľ—Ź –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–Ķ–Ĺ–ł—Ź —Ā—ā–Ķ–į—ā–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ě–ź–Ė–Ď–ü —Ä–į—Ā—Ā—á–ł—ā—č–≤–į–Ľ–ł –ł–Ĺ–ī–Ķ–ļ—Ā HIS (Hepatic steatosis index) –Ņ–ĺ —Ą–ĺ—Ä–ľ—É–Ľ–Ķ: HIS = 8 √ó (–į–Ľ–į–Ĺ–ł–Ĺ–į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑–į (–ź–Ľ–ź–Ę) / –į—Ā–Ņ–į—Ä—ā–į-—ā–į–ľ–ł–Ĺ–ĺ—ā—Ä–į–Ĺ—Ā—Ą–Ķ—Ä–į–∑–į (–ź—Ā–ź–Ę)) + –ł–Ĺ–ī–Ķ–ļ—Ā –ľ–į—Ā—Ā—č —ā–Ķ–Ľ–į (–ė–ú–Ę) + 2 (–Ķ—Ā–Ľ–ł –∂–Ķ–Ĺ—Č–ł–Ĺ—č) + 2 (–Ķ—Ā–Ľ–ł –ł–ľ–Ķ–Ķ—ā—Ā—Ź —Ā–į—Ö–į—Ä–Ĺ—č–Ļ –ī–ł–į–Ī–Ķ—ā (–°–Ē)).
–ü–ĺ—Ä–ĺ–≥–ĺ–≤–ĺ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –ł–Ĺ–ī–Ķ–ļ—Ā–į HIS –Ī–ĺ–Ľ–Ķ–Ķ 36,0 —Ā–≤–ł–ī–Ķ—ā–Ķ–Ľ—Ć—Ā—ā–≤—É–Ķ—ā –≤ –Ņ–ĺ–Ľ—Ć–∑—É —Ā—ā–Ķ–į—ā–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā —á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć—é 93,1% –ł —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ĺ–ĺ—Ā—ā—Ć—é 92,4% [9]. –ö–ĺ—ć—Ą—Ą–ł—Ü–ł–Ķ–Ĺ—ā HIS –Ņ—Ä–Ķ–≤—č—ą–į–Ľ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ć–Ĺ—č–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź –≤ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ, —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź—Ź 41,4¬Ī1,3, —á—ā–ĺ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–į–Ľ–ĺ –Ĺ–į–Ľ–ł—á–ł–Ķ —Ā—ā–Ķ–į—ā–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł. –ė—Ā–ļ–Ľ—é—á–Ķ–Ĺ—č –≥–Ķ–Ņ–į—ā–ĺ—ā—Ä–ĺ–Ņ–Ĺ–į—Ź –≤–ł—Ä—É—Ā–Ĺ–į—Ź –ł–Ĺ—Ą–Ķ–ļ—Ü–ł—Ź –ł —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ–į—Ź –∑–į–≤–ł—Ā–ł–ľ–ĺ—Ā—ā—Ć [10].
–ď—Ä—É–Ņ–Ņ—É —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź (–Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ—É—é) —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–ł 325 —á–Ķ–Ľ–ĺ-–≤–Ķ–ļ (153 –∂–Ķ–Ĺ—Č–ł–Ĺ—č –ł 172 –ľ—É–∂—á–ł–Ĺ—č) –≤ –≤–ĺ–∑—Ä–į—Ā—ā–Ķ –ĺ—ā 25 –ī–ĺ 67 –Ľ–Ķ—ā (—Ā—Ä–Ķ–ī–Ĺ–ł–Ļ –≤–ĺ–∑—Ä–į—Ā—ā 47,9¬Ī0,6 –≥–ĺ–ī–į). –ď—Ä—É–Ņ–Ņ–į —Ā—Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–į –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–Ķ —Ā–Ľ—É—á–į–Ļ–Ĺ–ĺ–Ļ –≤—č–Ī–ĺ—Ä–ļ–ł –Ņ–ĺ—Ā—ā–ĺ—Ź–Ĺ–Ĺ—č—Ö –∂–ł—ā–Ķ–Ľ–Ķ–Ļ –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ–į (–Ņ–ĺ–ī–ĺ–Ī—Ä–į–Ĺ–į –Ņ–ĺ –≤–ĺ–∑—Ä–į—Ā—ā—É –≤ —Ā–ĺ–ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł–ł 1:3 ‚ÄĒ 1 —Ā–Ľ—É—á–į–Ļ –Ĺ–į 3 –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź), –ļ–ĺ—ā–ĺ—Ä—č–Ķ –Ī—č–Ľ–ł –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ—č –≤ —Ä–į–ľ–ļ–į—Ö –Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ MONI–°A [11] –ł HAPIEE [12] ‚ÄĒ –ľ–Ķ–∂–ī—É–Ĺ–į—Ä–ĺ–ī–Ĺ—č—Ö —ć–Ņ–ł–ī–Ķ–ľ–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ –í–ě–ó –Ņ–ĺ –ł–∑—É—á–Ķ–Ĺ–ł—é –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ķ–ľ–ĺ—Ā—ā–ł –ł —Ā–ľ–Ķ—Ä—ā–Ĺ–ĺ—Ā—ā–ł –ĺ—ā —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ-—Ā–ĺ—Ā—É–ī–ł—Ā—ā—č—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ –Ľ–ł–Ņ–ł–ī–Ĺ–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į –≤ —Ä–į–∑–Ĺ—č—Ö —Ä–Ķ–≥–ł–ĺ–Ĺ–į—Ö –ł –≤ —Ä–į–∑–Ĺ—č—Ö –Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł—Ź—Ö.
–í—Ā–Ķ–ľ —É—á–į—Ā—ā–Ĺ–ł–ļ–į–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ī—č–Ľ–ĺ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ĺ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā–Ĺ–ĺ–Ķ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ-–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –≤ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–ł–ł –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ-–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ě–ė–ė–Ę–ü–ú ‚ÄĒ —Ą–ł–Ľ–ł–į–Ľ–į –ė–¶–ł–ď –°–ě –†–ź–Ě. –í —Ö–ĺ–ī–Ķ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ī—č–Ľ–ĺ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ĺ –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –Ĺ–į –Ĺ–į–Ľ–ł—á–ł–Ķ –ł/–ł–Ľ–ł –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –ľ—É—ā–į—Ü–ł–Ļ Glu342Lys (PIZ) –ł Glu264Val (PIS) –≥–Ķ–Ĺ–į őĪ1-–į–Ĺ—ā–ł—ā—Ä–ł–Ņ—Ā–ł–Ĺ–į (SERPINA1), –ľ—É—ā–į—Ü–ł–Ļ –į–Ľ–Ľ–Ķ–Ľ–Ķ–Ļ C282Y –ł H63D –≥–Ķ–Ĺ–į –≥–Ķ–ľ–ĺ—Ö—Ä–ĺ–ľ–į—ā–ĺ–∑–į (HFE), –≥–Ķ–Ĺ–į TCF7L2.
–í—Ā–Ķ–ľ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ—č –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ł –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā–Ĺ–ĺ–Ķ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ: –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ľ–ł —Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ—č–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł —Ą—É–Ĺ–ļ—Ü–ł–ł –Ņ–Ķ—á–Ķ–Ĺ–ł –ł –Ľ–ł–Ņ–ł–ī–Ĺ–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ–ł –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł —Ü–ł—ā–ĺ–ļ–ł–Ĺ–ĺ–≤–ĺ–≥–ĺ —Ā–Ņ–Ķ–ļ—ā—Ä–į: –ł–Ĺ—ā–Ķ—Ä–Ľ–Ķ–Ļ–ļ–ł–Ĺ—č (–ė–õ): –ė–õ-1ő≤, -6, -8, -10, -1Ra, —Ą–į–ļ—ā–ĺ—Ä –Ĺ–Ķ–ļ—Ä–ĺ–∑–į –ĺ–Ņ—É—Ö–ĺ–Ľ–ł őĪ (–§–Ě–ě-őĪ). –ė—Ö –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ĺ—ā–ľ–Ķ—á–į—é—ā –Ņ—Ä–ł –≤–ł—Ä—É—Ā–Ĺ—č—Ö –≥–Ķ–Ņ–į—ā–ł—ā–į—Ö, —Ü–ł—Ä—Ä–ĺ–∑–Ķ –Ņ–Ķ—á–Ķ–Ĺ–ł, –į—É—ā–ĺ–ł–ľ–ľ—É–Ĺ–Ĺ–ĺ–ľ –≥–Ķ–Ņ–į—ā–ł—ā–Ķ, –į–Ľ–ļ–ĺ–≥–ĺ–Ľ—Ć–Ĺ–ĺ–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł –Ņ–Ķ—á–Ķ–Ĺ–ł, –≥–Ķ–Ņ–į—ā–ĺ—Ü–Ķ–Ľ–Ľ—é–Ľ—Ź—Ä–Ĺ–ĺ–Ļ –ļ–į—Ä—Ü–ł–Ĺ–ĺ–ľ–Ķ –ł –ī—Ä—É–≥–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź—Ö –ĺ—Ä–≥–į–Ĺ–ĺ–≤ –Ņ–ł—Č–Ķ–≤–į—Ä–Ķ–Ĺ–ł—Ź [13‚Äď15]. –í—Ā–Ķ –≤—č—ą–Ķ–Ņ–Ķ—Ä–Ķ—á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—č–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ–ł —Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ—č–ľ–ł –ł–ľ–ľ—É–Ĺ–ĺ—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ĺ—č–ľ–ł –Ĺ–į–Ī–ĺ—Ä–į–ľ–ł —Ä–Ķ–į–≥–Ķ–Ĺ—ā–ĺ–≤ (¬ę–í–Ķ–ļ—ā–ĺ—ĬĽ, –†–ĺ—Ā—Ā–ł—Ź). –ė—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ł –≤ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–ł–ł —Ü–ł—ā–ĺ–ļ–ł–Ĺ–ĺ–≤ –ź–ě ¬ę–í–Ķ–ļ—ā–ĺ—Ä-–Ď–Ķ—Ā—ā¬Ľ.
–ú–Ķ—ā–ĺ–ī–ĺ–ľ —Ö—Ä–ĺ–ľ–į—ā–ĺ–≥—Ä–į—Ą–ł–ł-—Ā–Ņ–Ķ–ļ—ā—Ä–ĺ—Ą–ĺ—ā–ĺ–ľ–Ķ—ā—Ä–ł–ł —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é —ā–Ķ—Ā—ā-–Ĺ–į–Ī–ĺ—Ä–į Biosystems (–ė—Ā–Ņ–į–Ĺ–ł—Ź) –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ–ł –Ņ—Ä–Ķ–ī—ą–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ł–ļ–ł –Ņ–ĺ—Ä—Ą–ł—Ä–ł–Ĺ–ĺ–≤: őī-–į–ľ–ł–Ĺ–ĺ–Ľ–Ķ–≤—É–Ľ–ł–Ĺ–ĺ–≤—É—é –ļ–ł—Ā–Ľ–ĺ—ā—É, –Ņ–ĺ—Ä—Ą–ĺ–Ī–ł–Ľ–ł–Ĺ–ĺ–≥–Ķ–Ĺ; —Ą—Ä–į–ļ—Ü–ł–ł –Ņ–ĺ—Ä—Ą–ł—Ä–ł–Ĺ–ĺ–≤: —É—Ä–ĺ–Ņ–ĺ—Ä—Ą–ł—Ä–ł–Ĺ –ł –ļ–ĺ–Ņ—Ä–ĺ–Ņ–ĺ—Ä—Ą–ł—Ä–ł–Ĺ. –ė—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ĺ—Ā—Ć –Ĺ–į –Ī–į–∑–Ķ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –ď–Ď–£–ó –Ě–°–ě ¬ę–ď–ö–Ď ‚ĄĖ 1¬Ľ –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ–į.
–í—Ā–Ķ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–Ĺ—č–Ķ –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č –Ĺ–į–Ī–Ľ—é–ī–į–Ľ–ł—Ā—Ć –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 5 –Ľ–Ķ—ā, —É –Ĺ–ł—Ö —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ľ–ł –≤–ĺ–∑–Ĺ–ł–ļ–Ĺ–ĺ–≤–Ķ–Ĺ–ł–Ķ –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö —Ź–≤–Ľ–Ķ–Ĺ–ł–Ļ, –ļ –ļ–ĺ—ā–ĺ—Ä—č–ľ –ĺ—ā–Ĺ–ĺ—Ā–ł–Ľ–ł: –Ľ–Ķ—ā–į–Ľ—Ć–Ĺ—č–Ļ –ł—Ā—Ö–ĺ–ī, –ĺ—Ā—ā—Ä—É—é —Ā–ĺ—Ā—É–ī–ł—Ā—ā—É—é –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—é (–ł–Ĺ—Ą–į—Ä–ļ—ā –ľ–ł–ĺ–ļ–į—Ä–ī–į, —ā—Ä–į–Ĺ–∑–ł—ā–ĺ—Ä–Ĺ—É—é –ł—ą–Ķ–ľ–ł—á–Ķ—Ā–ļ—É—é –į—ā–į–ļ—É, –ł–Ĺ—Ā—É–Ľ—Ć—ā), —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ —Ü–ł—Ä—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł.
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –ł –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–Ĺ—č—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ –ĺ–Ī—Ä–į–Ī–į—ā—č–≤–į–Ľ–ł –ľ–Ķ—ā–ĺ–ī–ĺ–ľ –≤–į—Ä–ł–į—Ü–ł–ĺ–Ĺ–Ĺ–ĺ–Ļ —Ā—ā–į—ā–ł—Ā—ā–ł–ļ–ł. –°—Ä–į–≤–Ĺ–Ķ–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ—Ź –Ĺ–Ķ–Ņ—Ä–Ķ—Ä—č–≤–Ĺ—č—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ł –Ņ–ĺ—Ā–Ľ–Ķ –Ņ—Ä–ĺ–≤–Ķ—Ä–ļ–ł –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –ł—Ö —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –Ņ–ĺ —ā–Ķ—Ā—ā—É –ö–ĺ–Ľ–ľ–ĺ–≥–ĺ—Ä–ĺ–≤–į ‚ÄĒ –°–ľ–ł—Ä–Ĺ–ĺ–≤–į. –ē—Ā–Ľ–ł –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć –ĺ—ā–≤–Ķ—á–į–Ľ –ļ—Ä–ł—ā–Ķ—Ä–ł—Ź–ľ –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź, —ā–ĺ –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–ł –ĺ–ī–Ĺ–ĺ—Ą–į–ļ—ā–ĺ—Ä–Ĺ—č–Ļ –ī–ł—Ā–Ņ–Ķ—Ä—Ā–ł–ĺ–Ĺ–Ĺ—č–Ļ –į–Ĺ–į–Ľ–ł–∑. –ē—Ā–Ľ–ł –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć –Ĺ–Ķ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ĺ–≤–į–Ľ –ļ—Ä–ł—ā–Ķ—Ä–ł—Ź–ľ –Ĺ–ĺ—Ä–ľ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ —Ä–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź, —ā–ĺ –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź–Ľ–ł —ā–Ķ—Ā—ā –ú–į–Ĺ–Ĺ–į ‚ÄĒ –£–ł—ā–Ĺ–ł –ī–Ľ—Ź –ī–≤—É—Ö –Ĺ–Ķ–∑–į–≤–ł—Ā–ł–ľ—č—Ö –≤—č–Ī–ĺ—Ä–ĺ–ļ. –†–į–∑–Ľ–ł—á–ł—Ź –ľ–Ķ–∂–ī—É —Ā—Ä–Ķ–ī–Ĺ–ł–ľ–ł –≤–Ķ–Ľ–ł—á–ł–Ĺ–į–ľ–ł —Ā—á–ł—ā–į–Ľ–ł –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ—č–ľ–ł –Ņ—Ä–ł —Ä<0,05. –†–į–∑–Ľ–ł—á–ł—Ź —á–į—Ā—ā–ĺ—ā–Ĺ—č—Ö —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł—Ā—ā–ł–ļ –ļ–į—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –Ņ–Ķ—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č—Ö –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ľ–ł —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é –ļ—Ä–ł—ā–Ķ—Ä–ł—Ź —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ł—Ź (–ľ–Ķ—ā–ĺ–ī c2) –ł–Ľ–ł –ļ–ĺ—ć—Ą—Ą–ł—Ü–ł–Ķ–Ĺ—ā–į –ü–ł—Ä—Ā–ĺ–Ĺ–į. –ü—Ä–ł —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ł–ł –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ—Ā—ā–ł —Ā–≤—Ź–∑–Ķ–Ļ –Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–ł—Ā—Ć —ā–į–Ī–Ľ–ł—Ü–Ķ–Ļ c2, —Ā—á–ł—ā–į—Ź —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ—č–ľ–ł, –Ķ—Ā–Ľ–ł —Ä<0,05 –Ņ—Ä–ł —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤—É—é—Č–ł—Ö —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ź—Ö —Ā–≤–ĺ–Ī–ĺ–ī—č (n1). –ź—Ā—Ā–ĺ—Ü–ł–į—Ü–ł—Ź –ī–≤—É—Ö –ļ–į—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ľ–į—Ā—Ć –Ņ—Ä–ł –Ņ–ĺ–ľ–ĺ—Č–ł —á–Ķ—ā—č—Ä–Ķ—Ö–Ņ–ĺ–Ľ—Ć–Ĺ—č—Ö —ā–į–Ī–Ľ–ł—Ü —Ā–ĺ–Ņ—Ä—Ź–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł —Ā –Ņ–ĺ–ī—Ā—á–Ķ—ā–ĺ–ľ –ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł—Ź —ą–į–Ĺ—Ā–ĺ–≤ (–ě–®) –ł –ī–ĺ–≤–Ķ—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ—č—Ö –ł–Ĺ—ā–Ķ—Ä–≤–į–Ľ–ĺ–≤ (95% –Ē–ė). –ü—Ä–ł–≤–ĺ–ī–ł–ľ—č–Ķ –≤ —Ä–į–Ī–ĺ—ā–Ķ –Ē–ė —Ā—ā—Ä–ĺ–ł–Ľ–ł—Ā—Ć –ī–Ľ—Ź –ī–ĺ–≤–Ķ—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ—Ā—ā–ł —Ä=95%.
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –ł –ĺ–Ī—Ā—É–∂–ī–Ķ–Ĺ–ł–Ķ
–í –≥—Ä—É–Ņ–Ņ–Ķ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ě–ź–Ė–Ď–ü –ľ—É—ā–į–Ĺ—ā–Ĺ—č–Ķ –į–Ľ–Ľ–Ķ–Ľ–ł 342Lys (PIZ) –ł 264Val (PIS) –≥–Ķ–Ĺ–į SERPINA1 –∑–į—Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ—č —É 22 (19,1%) —á–Ķ–Ľ–ĺ–≤–Ķ–ļ, –Ņ—Ä–ł —ć—ā–ĺ–ľ –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ —á–į—Č–Ķ —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ľ–į—Ā—Ć –ľ—É—ā–į—Ü–ł—Ź –Ņ–ĺ –į–Ľ–Ľ–Ķ–Ľ–ł 264Val (PIS) (—ā–į–Ī–Ľ. 1). –í –≥—Ä—É–Ņ–Ņ–Ķ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź (–Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ–ĺ–Ļ) –ľ—É—ā–į–Ĺ—ā–Ĺ—č–Ķ –į–Ľ–Ľ–Ķ–Ľ–ł 342Lys (PIZ) –ł 264Vol (PIS) –≥–Ķ–Ĺ–į SERPINA1 –Ī—č–Ľ–ł –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ—č —ā–ĺ–Ľ—Ć–ļ–ĺ —É 14 (4,3%) —á–Ķ–Ľ–ĺ–≤–Ķ–ļ. –°—Ä–į–≤–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –į–Ĺ–į–Ľ–ł–∑ —ć—ā–ł—Ö –ī–į–Ĺ–Ĺ—č—Ö –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ķ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–Ķ —á–į—Ā—ā–ĺ—ā—č –Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć—Ā—ā–≤–į –ľ—É—ā–į–Ĺ—ā–Ĺ—č—Ö –į–Ľ–Ľ–Ķ–Ľ–Ķ–Ļ 342Lys (PIZ) –ł 264Val (PIS) –≤ –≥—Ä—É–Ņ–Ņ–Ķ –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ě–ź–Ė–Ď–ü. –í–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ—Ā—ā—Ć –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ–ł—Ź –≤ –≥—Ä—É–Ņ–Ņ–Ķ –Ě–ź–Ė–Ď–ü –Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ź –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–į Glu342Lys (PIZ) –≤—č—ą–Ķ –≤ 3,9 —Ä–į–∑–į (NZ + ZZ –Ņ—Ä–ĺ—ā–ł–≤ NN: –ě–® 3,90, 95% –Ē–ė 1,5‚Äď10,5, —Ä=0,007), –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–į Glu264Vol (PIS) ‚ÄĒ –≤ 6,6 —Ä–į–∑–į (NS –Ņ—Ä–ĺ—ā–ł–≤ NN: –ě–® 6,6, 95% –Ē–ė 2,4‚Äď18,3, —Ä<0,001), —á–Ķ–ľ –≤ –Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ.
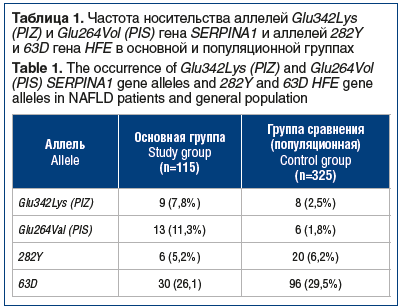
–ė–Ĺ–į—Ź –ļ–į—Ä—ā–ł–Ĺ–į –Ĺ–į–Ī–Ľ—é–ī–į–Ľ–į—Ā—Ć –Ņ—Ä–ł –ĺ—Ü–Ķ–Ĺ–ļ–Ķ —á–į—Ā—ā–ĺ—ā –ľ—É—ā–į–Ĺ—ā–Ĺ—č—Ö –į–Ľ–Ľ–Ķ–Ľ–Ķ–Ļ 282Y –ł 63D –≥–Ķ–Ĺ–į HFE. –ě–Ĺ–ł –Ī—č–Ľ–ł –≤—č—Ź–≤–Ľ–Ķ–Ĺ—č —É 36 (31,3%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ě–ź–Ė–Ď–ü. –ó–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ —á–į—Č–Ķ –ĺ–Ī–Ĺ–į—Ä—É–∂–ł–≤–į–Ľ–į—Ā—Ć –ľ—É—ā–į—Ü–ł—Ź –Ņ–ĺ –į–Ľ–Ľ–Ķ–Ľ–ł 63D, –≤—č—Ź–≤–Ľ–Ķ–Ĺ–Ĺ–į—Ź —É 30 (26,1%) –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö. –ú—É—ā–į—Ü–ł—Ź –Ņ–ĺ –į–Ľ–Ľ–Ķ–Ľ–ł 282Y –∑–į—Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ–į —ā–ĺ–Ľ—Ć–ļ–ĺ —É 6 (5,2%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤. –í –≥—Ä—É–Ņ–Ņ–Ķ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź –ľ—É—ā–į–Ĺ—ā–Ĺ—č–Ķ –į–Ľ–Ľ–Ķ–Ľ–ł –Ī—č–Ľ–ł –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ—č —É 115 (35,4%) —á–Ķ–Ľ–ĺ–≤–Ķ–ļ. –ó–į–ľ–Ķ—ā–Ĺ–ĺ —á–į—Č–Ķ (–≤ 4,5 —Ä–į–∑–į), –ļ–į–ļ –ł –≤ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ–ĺ–Ļ –≥—Ä—É–Ņ–Ņ–Ķ, —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ľ–į—Ā—Ć –ľ—É—ā–į—Ü–ł—Ź –Ņ–ĺ –į–Ľ–Ľ–Ķ–Ľ–ł 63D. –Ē–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ—č—Ö —Ä–į–∑–Ľ–ł—á–ł–Ļ –Ņ–ĺ —á–į—Ā—ā–ĺ—ā–Ķ —Ä–Ķ–≥–ł—Ā—ā—Ä–į—Ü–ł–ł –ľ—É—ā–į—Ü–ł–Ļ –Ņ–ĺ –į–Ľ–Ľ–Ķ–Ľ—Ź–ľ 282Y –ł 63D –≥–Ķ–Ĺ–į HFE –ľ–Ķ–∂–ī—É –≥—Ä—É–Ņ–Ņ–į–ľ–ł –Ĺ–Ķ –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ–ĺ (Ōá2=0,63, —Ä>0,5 –Ņ—Ä–ł n¬ī=3).
–°—Ä–į–≤–Ĺ–ł—ā–Ķ–Ľ—Ć–Ĺ–į—Ź –ĺ—Ü–Ķ–Ĺ–ļ–į —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł—Ź —É–≥–Ľ–Ķ–≤–ĺ–ī–Ĺ–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į –Ī—č–Ľ–į –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–į —É 115 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ě–ź–Ė–Ď–ü —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł—Ź–ľ ¬ę–ź–Ľ–≥–ĺ—Ä–ł—ā–ľ—č —Ā–Ņ–Ķ—Ü–ł–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ –ľ–Ķ–ī–ł—Ü–ł–Ĺ—Ā–ļ–ĺ–Ļ –Ņ–ĺ–ľ–ĺ—Č–ł –Ī–ĺ–Ľ—Ć–Ĺ—č–ľ —Ā–į—Ö–į—Ä–Ĺ—č–ľ –ī–ł–į–Ī–Ķ—ā–ĺ–ľ¬Ľ [16] (—ā–į–Ī–Ľ. 2). –ü–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ-–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ–ĺ –≥–Ķ–Ĺ—É TCF7L2 –ł —Ā —É—á–Ķ—ā–ĺ–ľ –≤—č—Ź–≤–Ľ–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–į –Ī–ĺ–Ľ—Ć–Ĺ—č–Ķ –Ī—č–Ľ–ł —Ä–į–∑–ī–Ķ–Ľ–Ķ–Ĺ—č –Ĺ–į 3 –≥—Ä—É–Ņ–Ņ—č: 1-—Ź ‚ÄĒ —Ā –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–ľ –Ę–° (58; 50,4%), 2-—Ź ‚ÄĒ —Ā –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–ľ –°–° (50; 43,5%), 3-—Ź ‚ÄĒ —Ā –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–ľ –Ę–Ę (7; 6,1%). –ď–Ķ–Ĺ TCF7L2 —Ā—á–ł—ā–į–Ķ—ā—Ā—Ź –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –∑–Ĺ–į—á–ł–ľ—č–ľ –Ņ–ĺ —É—á–į—Ā—ā–ł—é –≤ —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź —Ą—É–Ĺ–ļ—Ü–ł–ł ő≤-–ļ–Ľ–Ķ—ā–ĺ–ļ –Ņ–ĺ–ī–∂–Ķ–Ľ—É–ī–ĺ—á–Ĺ–ĺ–Ļ –∂–Ķ–Ľ–Ķ–∑—č, –≤–ĺ–∑–Ĺ–ł–ļ–Ĺ–ĺ–≤–Ķ–Ĺ–ł–ł —Ä–į—Ā—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ —É–≥–Ľ–Ķ–≤–ĺ–ī–Ĺ–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į, –ľ–į–Ĺ–ł—Ą–Ķ—Ā—ā–į—Ü–ł–ł –°–Ē [13, 17]. –ü–į—ā–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł–Ķ –ĺ—ā–ļ–Ľ–ĺ–Ĺ–Ķ–Ĺ–ł—Ź –≤ —É–≥–Ľ–Ķ–≤–ĺ–ī–Ĺ–ĺ–ľ –ĺ–Ī–ľ–Ķ–Ĺ–Ķ –≤ –≥—Ä—É–Ņ–Ņ–Ķ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ě–ź–Ė–Ď–ü –∑–į—Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ—č —É 84 (73,0%) —á–Ķ–Ľ–ĺ–≤–Ķ–ļ, –Ņ—Ä–Ķ–ī–ł–į–Ī–Ķ—ā –≤—č—Ź–≤–Ľ–Ķ–Ĺ —É 21 –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į. –ü—Ä–ł —ć—ā–ĺ–ľ –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ —á–į—Č–Ķ –ĺ–Ĺ –Ĺ–į–Ī–Ľ—é–ī–į–Ľ—Ā—Ź –Ĺ–į —Ą–ĺ–Ĺ–Ķ –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–į –Ę–°. –Ě–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –∑–Ĺ–į—á–ł–ľ—É—é –≥—Ä—É–Ņ–Ņ—É —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č —Ā –ľ–į–Ĺ–ł—Ą–Ķ—Ā—ā–Ĺ–ĺ–Ļ —Ą–ĺ—Ä–ľ–ĺ–Ļ –°–Ē 2 —ā–ł–Ņ–į —Ā –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–į–ľ–ł –Ę–° –ł –°–°: 34 (58,6%) –ł 26 (52,0%) —á–Ķ–Ľ–ĺ–≤–Ķ–ļ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ. –í —Ö–ĺ–ī–Ķ –ĺ–Ī—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –°–Ē –Ī—č–Ľ –≤–Ņ–Ķ—Ä–≤—č–Ķ –≤—č—Ź–≤–Ľ–Ķ–Ĺ —É 12 (10,4%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤: —É 7 —Ā –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–ľ –Ę–° –ł —É 5 —Ā –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–ľ –°–°.

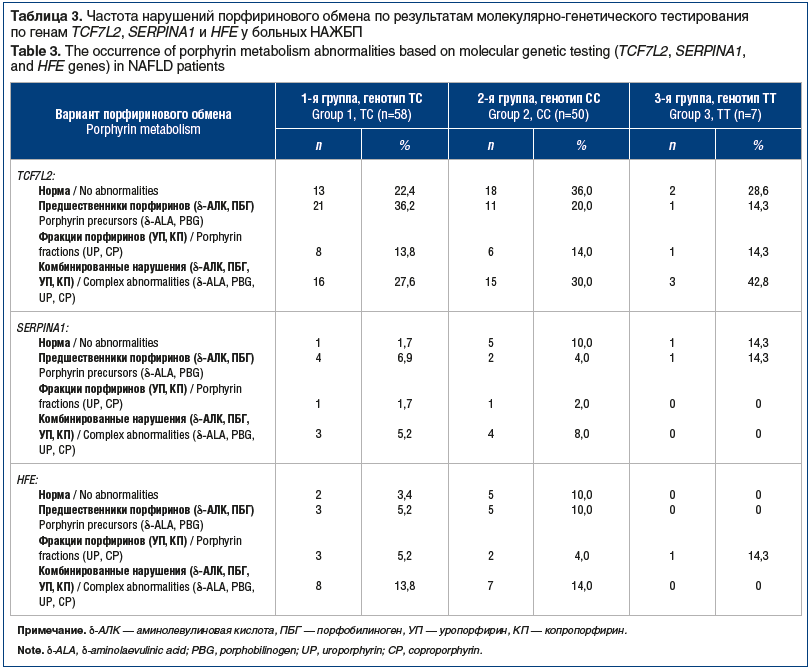
–Ě–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –Ņ–ĺ—Ä—Ą–ł—Ä–ł–Ĺ–ĺ–≤–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į –≤—č—Ź–≤–Ľ–Ķ–Ĺ—č —É –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–į –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö (82; 71,3%) –ł –∑–į–ľ–Ķ—ā–Ĺ–ĺ —á–į—Č–Ķ –Ĺ–į–Ī–Ľ—é–ī–į–Ľ–ł—Ā—Ć —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–ĺ–ľ –Ę–° –≥–Ķ–Ĺ–į TCF7L2 (45; 39,1%), –Ĺ–ĺ –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ—č—Ö —Ä–į–∑–Ľ–ł—á–ł–Ļ —Ā –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–į–ľ–ł –°–° –ł –Ę–Ę –Ĺ–Ķ –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ–ĺ (Ōá2=0,57, —Ä>0,5 –Ņ—Ä–ł n¬ī=4). –ü—Ä–ł –Ĺ–į–Ľ–ł—á–ł–ł –ľ—É—ā–į—Ü–ł–Ļ –Ņ–ĺ –į–Ľ–Ľ–Ķ–Ľ—Ź–ľ Glu324Lys (PIZ) –ł Glu246Vol (PIS) –≥–Ķ–Ĺ–į SERPINA1 –ł –į–Ľ–Ľ–Ķ–Ľ—Ź–ľ 282Y –ł 63D –≥–Ķ–Ĺ–į HFE –ī–ł—Ā–ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ –Ņ–ĺ—Ä—Ą–ł—Ä–ł–Ĺ–ĺ–≤ —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ľ—Ā—Ź –Ņ—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł —Ā –ĺ–ī–ł–Ĺ–į–ļ–ĺ–≤–ĺ–Ļ —á–į—Ā—ā–ĺ—ā–ĺ–Ļ: —É 16 (72,7%) –ł —É 29 (80,6%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ (—ā–į–Ī–Ľ. 3).
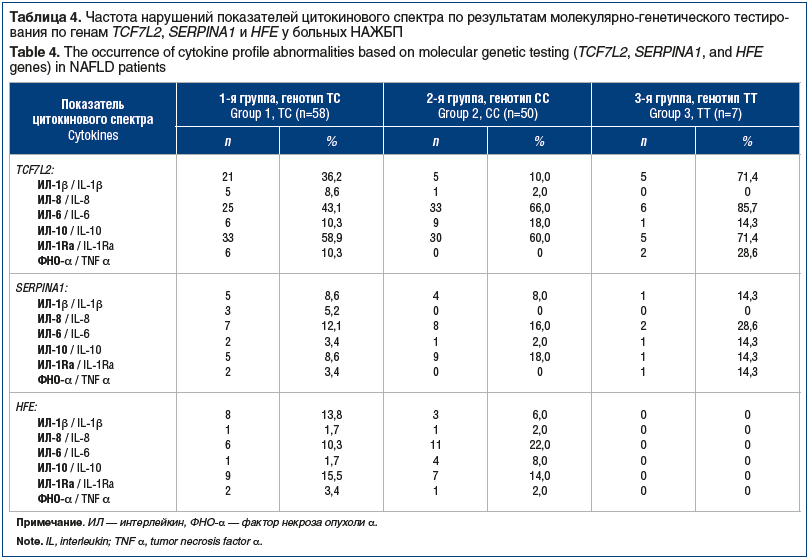
–ź–Ĺ–į–Ľ–ł–∑ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ —Ü–ł—ā–ĺ–ļ–ł–Ĺ–ĺ–≤–ĺ–≥–ĺ —Ā–Ņ–Ķ–ļ—ā—Ä–į –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ —É—Ā—ā–į–Ĺ–ĺ–≤–ł—ā—Ć, —á—ā–ĺ –Ĺ–Ķ–∑–į–≤–ł—Ā–ł–ľ–ĺ –ĺ—ā –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–į –≥–Ķ–Ĺ–į TCF7L2 –ī–ĺ–ľ–ł–Ĺ–ł—Ä–ĺ–≤–į–Ľ–į –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ė–õ-1ő≤, -6 –ł -1Ra (—ā–į–Ī–Ľ. 4). –ü—Ä–ł –Ĺ–į–Ľ–ł—á–ł–ł –ľ—É—ā–į—Ü–ł–ł –Ņ–ĺ –į–Ľ–Ľ–Ķ–Ľ—Ź–ľ Glu324Lys (PIZ) –ł Glu246Vol (PIS) –≥–Ķ–Ĺ–į SERPINA1 –ł –į–Ľ–Ľ–Ķ–Ľ—Ź–ľ 282Y –ł 63D –≥–Ķ–Ĺ–į HFE –Ĺ–į–Ī–Ľ—é–ī–į–Ľ–į—Ā—Ć –į–Ĺ–į–Ľ–ĺ–≥–ł—á–Ĺ–į—Ź –ī–ł–Ĺ–į–ľ–ł–ļ–į.
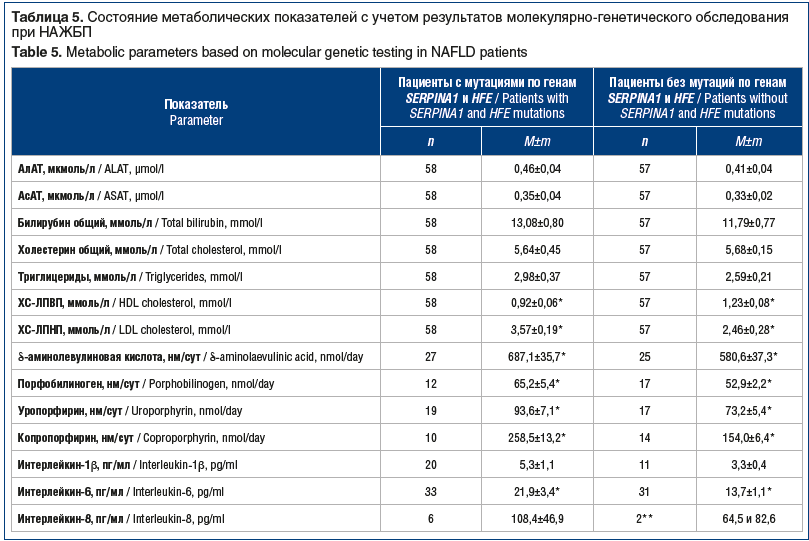
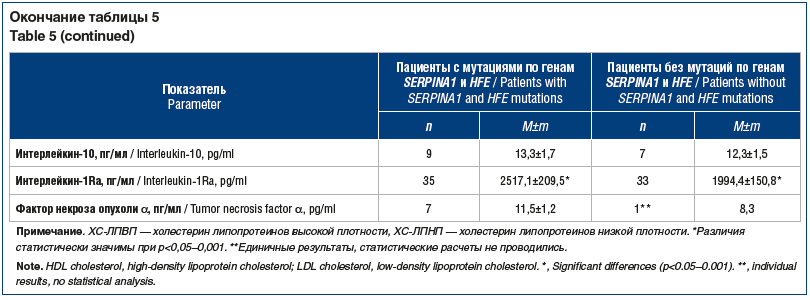
–ü–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł —Ą—É–Ĺ–ļ—Ü–ł–ł –Ņ–Ķ—á–Ķ–Ĺ–ł (–ź–Ľ–ź–Ę, –ź—Ā–ź–Ę, –ĺ–Ī—Č–ł–Ļ –Ī–ł–Ľ–ł—Ä—É–Ī–ł–Ĺ) —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ĺ–≤–į–Ľ–ł –Ĺ–ĺ—Ä–ľ–į—ā–ł–≤–Ĺ—č–ľ –∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź–ľ –ł –Ņ—Ä–ł –Ĺ–į–Ľ–ł—á–ł–ł –ł/–ł–Ľ–ł –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–ł –ľ—É—ā–į—Ü–ł–Ļ –Ņ–ĺ –≥–Ķ–Ĺ–į–ľ SERPINA1 –ł HFE –Ĺ–Ķ –ł–ľ–Ķ–Ľ–ł –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ—č—Ö —Ä–į–∑–Ľ–ł—á–ł–Ļ (—ā–į–Ī–Ľ. 5). –Ě–į–Ņ—Ä–ĺ—ā–ł–≤, –≤—Ā–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł –Ľ–ł–Ņ–ł–ī–Ĺ–ĺ–≥–ĺ —Ā–Ņ–Ķ–ļ—ā—Ä–į —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –Ņ—Ä–Ķ–≤—č—ą–į–Ľ–ł –Ĺ–ĺ—Ä–ľ—É. –ü—Ä–ł —ć—ā–ĺ–ľ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł —Ö–ĺ–Ľ–Ķ—Ā—ā–Ķ—Ä–ł–Ĺ–į –Ľ–ł–Ņ–ĺ–Ņ—Ä–ĺ—ā–Ķ–ł–Ĺ–ĺ–≤ –≤—č—Ā–ĺ–ļ–ĺ–Ļ –ł –Ĺ–ł–∑–ļ–ĺ–Ļ –Ņ–Ľ–ĺ—ā–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ł –Ĺ–į–Ľ–ł—á–ł–ł –ľ—É—ā–į—Ü–ł–Ļ –Ņ–ĺ –≥–Ķ–Ĺ–į–ľ SERPINA1 –ł HFE –Ī—č–Ľ–ł –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ —Ö—É–∂–Ķ. –Ě–į–Ľ–ł—á–ł–Ķ –ī–į–Ĺ–Ĺ—č—Ö –ľ—É—ā–į—Ü–ł–Ļ –ī–ĺ—Ā—ā–ĺ–≤–Ķ—Ä–Ĺ–ĺ (—Ä<0,02‚Äď0,05) —Ā–Ņ–ĺ—Ā–ĺ–Ī—Ā—ā–≤–ĺ–≤–į–Ľ–ĺ —É—Ö—É–ī—ą–Ķ–Ĺ–ł—é –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –Ņ–ĺ—Ä—Ą–ł—Ä–ł–Ĺ–ĺ–≤–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į ‚ÄĒ –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł—é –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā–ł –ė–õ-6 –ł -1Ra.
–Ě–į—ą–ł –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź —Ā 2016 –≥. –Ņ–ĺ 2020 –≥. –Ņ–ĺ–∑–≤–ĺ–Ľ–ł–Ľ–ł –∑–į—Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į—ā—Ć –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č–Ķ –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –Ě–ź–Ė–Ď–ü —É 30 (26,1%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤. –ö –Ĺ–ł–ľ –ĺ—ā–Ĺ–ĺ—Ā–ł–Ľ–ł –Ľ–Ķ—ā–į–Ľ—Ć–Ĺ—č–Ļ –ł—Ā—Ö–ĺ–ī (17; 56,7% –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö), –ĺ—Ā—ā—Ä—É—é —Ā–ĺ—Ā—É–ī–ł—Ā—ā—É—é –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł—é (–ł–Ĺ—Ą–į—Ä–ļ—ā –ľ–ł–ĺ–ļ–į—Ä–ī–į, –ł—ą–Ķ–ľ–ł—á–Ķ—Ā–ļ–ł–Ļ –ł–Ĺ—Ā—É–Ľ—Ć—ā, —ā—Ä–į–Ĺ–∑–ł—ā–ĺ—Ä–Ĺ–į—Ź –ł—ą–Ķ–ľ–ł—á–Ķ—Ā–ļ–į—Ź –į—ā–į–ļ–į) (8; 26,7%), —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ —Ü–ł—Ä—Ä–ĺ–∑–į –Ņ–Ķ—á–Ķ–Ĺ–ł (5; 16,6%).
–ó–į–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ķ
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–Ĺ–ĺ–Ķ –Ĺ–į–ľ–ł –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ —É –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ě–ź–Ė–Ď–ü –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –ļ–ĺ–Ĺ—Ā—ā–į—ā–ł—Ä–ĺ–≤–į—ā—Ć —Ä—Ź–ī –Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ļ. –í–ĺ-–Ņ–Ķ—Ä–≤—č—Ö, —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ě–ź–Ė–Ď–ü –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ-–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ĺ–Ķ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ķ –≥–Ķ–Ĺ–į TCF7L2 –Ņ–ĺ–ļ–į–∑—č–≤–į–Ķ—ā, —á—ā–ĺ –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č–Ķ –ł—Ā—Ö–ĺ–ī—č —á–į—Č–Ķ —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä—É—é—ā—Ā—Ź –Ņ—Ä–ł –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–Ķ –°–° (15; 50,0%), –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ —Ä–Ķ–∂–Ķ ‚ÄĒ –Ņ—Ä–ł –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–Ķ –Ę–° (13; 43,3%), –∑–į–ľ–Ķ—ā–Ĺ–ĺ —Ä–Ķ–∂–Ķ ‚ÄĒ –Ņ—Ä–ł –≥–Ķ–Ĺ–ĺ—ā–ł–Ņ–Ķ –Ę–Ę (2; 6,7%). –í–ĺ-–≤—ā–ĺ—Ä—č—Ö, —É 50% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č–ľ–ł –ł—Ā—Ö–ĺ–ī–į–ľ–ł –∑–į—Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ—č –ľ—É—ā–į—Ü–ł–ł –Ņ–ĺ –į–Ľ–Ľ–Ķ–Ľ—Ź–ľ 282Y, 63D –≥–Ķ–Ĺ–į HFE –ł –į–Ľ–Ľ–Ķ–Ľ—Ź–ľ 342Lys (PIZ), 264Val (PIS) –≥–Ķ–Ĺ–į SERPINA1. –í-—ā—Ä–Ķ—ā—Ć–ł—Ö, –į–Ĺ–į–Ľ–ł–∑ —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ —Ä–ł—Ā–ļ–į –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö –ł—Ā—Ö–ĺ–ī–ĺ–≤ –Ě–ź–Ė–Ď–ü –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ –∑–į–ľ–Ķ—ā–Ĺ–ĺ —á–į—Č–Ķ —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä—É–Ķ—ā—Ā—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ —Ü–ł—ā–ĺ–ļ–ł–Ĺ–ĺ–≤–ĺ–≥–ĺ —Ā–Ņ–Ķ–ļ—ā—Ä–į (–ė–õ-1ő≤, -6, -1Ra), –ļ–ĺ—ā–ĺ—Ä–į—Ź –∑–į—Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ–į —É 27 (90%) –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤. –ü—Ä–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł —ā–į–ļ–∂–Ķ —á–į—Ā—ā–ĺ –ĺ–Ī–Ĺ–į—Ä—É–∂–ł–≤–į–Ľ–ł—Ā—Ć –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź –Ņ–ĺ—Ä—Ą–ł—Ä–ł–Ĺ–ĺ–≤–ĺ–≥–ĺ –ĺ–Ī–ľ–Ķ–Ĺ–į (22; 73,3%), –ł–∑ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ–į—Ä–į–ľ–Ķ—ā—Ä–ĺ–≤ –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –∑–Ĺ–į—á–ł–ľ—č–ľ –ĺ–ļ–į–∑–į–Ľ–ĺ—Ā—Ć –į–Ī–ī–ĺ–ľ–ł–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ķ –ĺ–∂–ł—Ä–Ķ–Ĺ–ł–Ķ. –í-—á–Ķ—ā–≤–Ķ—Ä—ā—č—Ö, –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ-–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ł —Ā–Ņ–Ķ—Ü–ł–į–Ľ—Ć–Ĺ—č—Ö –Ī–ł–ĺ—Ö–ł–ľ–ł—á–Ķ—Ā–ļ–ł—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä–ĺ–≤–į—ā—Ć –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ—Ā—ā—Ć –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ě–ź–Ė–Ď–ü.
–°–≤–Ķ–ī–Ķ–Ĺ–ł—Ź –ĺ–Ī –į–≤—ā–ĺ—Ä–į—Ö:
–ö—Ä–ł–≤–ĺ—ą–Ķ–Ķ–≤ –ź–Ľ–Ķ–ļ—Ā–į–Ĺ–ī—Ä –Ď–ĺ—Ä–ł—Ā–ĺ–≤–ł—á ‚ÄĒ –ī.–ľ.–Ĺ., –Ņ—Ä–ĺ—Ą–Ķ—Ā—Ā–ĺ—Ä –ļ–į—Ą–Ķ–ī—Ä—č —Ą–į–ļ—É–Ľ—Ć—ā–Ķ—ā—Ā–ļ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –ł–ľ. –Ņ—Ä–ĺ—Ą. –ď.–Ē. –ó–į–Ľ–Ķ—Ā—Ā–ļ–ĺ–≥–ĺ –§–ď–Ď–ě–£ –í–ě –Ě–ď–ú–£ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 630091, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, –ö—Ä–į—Ā–Ĺ—č–Ļ –Ņ—Ä-—ā, –ī. 52; ORCID iD 0000-0002-4845-8753.
–ú–į–ļ—Ā–ł–ľ–ĺ–≤ –í–Ľ–į–ī–ł–ľ–ł—Ä –Ě–ł–ļ–ĺ–Ľ–į–Ķ–≤–ł—á ‚ÄĒ –ī.–ľ.–Ĺ., –Ņ—Ä–ĺ—Ą–Ķ—Ā—Ā–ĺ—Ä, –∑–į–≤–Ķ–ī—É—é—Č–ł–Ļ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–ł–Ķ–Ļ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ź—Ä–Ĺ–ĺ-–≥–Ķ–Ĺ–Ķ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ —ā–Ķ—Ä–į–Ņ–Ķ–≤—ā–ł—á–Ķ—Ā–ļ–ł—Ö –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ļ –Ě–ė–ė–Ę–ü–ú ‚ÄĒ —Ą–ł–Ľ–ł–į–Ľ–į –ė–¶–ł–ď –°–ě –†–ź–Ě; 630089, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, —É–Ľ. –Ď–ĺ—Ä–ł—Ā–į –Ď–ĺ–≥–į—ā–ļ–ĺ–≤–į, –ī. 175/1; –Ņ—Ä–ĺ—Ą–Ķ—Ā—Ā–ĺ—Ä –ļ–į—Ą–Ķ–ī—Ä—č –Ī–ł–ĺ–Ľ–ĺ–≥–ł–ł –ł –ľ–Ķ–ī–ł—Ü–ł–Ĺ—Ā–ļ–ĺ–Ļ –≥–Ķ–Ĺ–Ķ—ā–ł–ļ–ł –§–ď–Ď–ě–£ –í–ě –Ě–ď–ú–£ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 630091, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, –ö—Ä–į—Ā–Ĺ—č–Ļ –Ņ—Ä-—ā, –ī. 52; ORCID iD 0000-0002-7165-4496.
–Ď–ĺ–Ļ–ļ–ĺ –ö–ĺ–Ĺ—Ā—ā–į–Ĺ—ā–ł–Ĺ –ģ—Ä—Ć–Ķ–≤–ł—á ‚ÄĒ –≤—Ä–į—á-–ĺ—Ä–ī–ł–Ĺ–į—ā–ĺ—Ä –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź —ć–Ĺ–ī–ĺ–ļ—Ä–ł–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –ď–Ď–£–ó –Ě–°–ě ¬ę–ď–ö–Ď ‚ĄĖ 1¬Ľ; 630047, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, —É–Ľ. –ó–į–Ľ–Ķ—Ā—Ā–ļ–ĺ–≥–ĺ, –ī. 6; ORCID iD 0000-0003-3293-0061.
–õ–Ķ–≤—č–ļ–ł–Ĺ–į –ē–Ľ–Ķ–Ĺ–į –ē–≤–≥–Ķ–Ĺ—Ć–Ķ–≤–Ĺ–į ‚ÄĒ –≤—Ä–į—á-–ĺ—Ä–ī–ł–Ĺ–į—ā–ĺ—Ä –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –≥–į—Ā—ā—Ä–ĺ—ć–Ĺ—ā–Ķ—Ä–ĺ–Ľ–ĺ–≥–ł–ł –ď–Ď–£–ó –Ě–°–ě ¬ę–ď–ö–Ď ‚ĄĖ 1¬Ľ; 630047, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, —É–Ľ. –ó–į–Ľ–Ķ—Ā—Ā–ļ–ĺ–≥–ĺ, –ī. 6; ORCID iD 0000-0002-2029-0557.
–ú–ł—Ö–į–Ļ–Ľ–ĺ–≤–į –ē–Ľ–Ķ–Ĺ–į –°–Ķ–ľ–Ķ–Ĺ–ĺ–≤–Ĺ–į ‚ÄĒ –Ĺ–į—É—á–Ĺ—č–Ļ —Ā–ĺ—ā—Ä—É–ī–Ĺ–ł–ļ —Ü–Ķ–Ĺ—ā—Ä–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ĺ–į—É—á–Ĺ–ĺ-–ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ—Ć—Ā–ļ–ĺ–Ļ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–ł–ł –§–ď–Ď–ě–£ –í–ě –Ě–ď–ú–£ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 630091, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, –ö—Ä–į—Ā–Ĺ—č–Ļ –Ņ—Ä-—ā, –ī. 52; –Ĺ–į—É—á–Ĺ—č–Ļ —Ā–ĺ—ā—Ä—É–ī–Ĺ–ł–ļ –§–ė–¶ –§–Ę–ú; 630117, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, —É–Ľ. –Ę–ł–ľ–į–ļ–ĺ–≤–į, –ī. 2; ORCID iD 0000-0001-8576-3717.
–í–į—Ä–į–ļ—Ā–ł–Ĺ –Ě–ł–ļ–ĺ–Ľ–į–Ļ –ź–Ĺ–į—ā–ĺ–Ľ—Ć–Ķ–≤–ł—á ‚ÄĒ –∑–į–≤–Ķ–ī—É—é—Č–ł–Ļ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–ł–Ķ–Ļ —Ü–ł—ā–ĺ–ļ–ł–Ĺ–ĺ–≤ –ź–ě ¬ę–í–Ķ–ļ—ā–ĺ—Ä-–Ď–Ķ—Ā—ā¬Ľ; 630559, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, —Ä–į–Ļ–ĺ–Ĺ–Ĺ—č–Ļ –Ņ–ĺ—Ā–Ķ–Ľ–ĺ–ļ –ö–ĺ–Ľ—Ć—Ü–ĺ–≤–ĺ, –Ĺ–į—É—á–Ĺ–ĺ-–Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī—Ā—ā–≤–Ķ–Ĺ–Ĺ–į—Ź –∑–ĺ–Ĺ–į, –ļ–ĺ—Ä–Ņ. 36, –ļ–ĺ–ľ. 211; ORCID iD 0000-0002-0733-7787.
–ö–ĺ–Ĺ–ī—Ä–į—ā–ĺ–≤–į –ú–į—Ä–ł—Ź –ź–Ľ–Ķ–ļ—Ā–į–Ĺ–ī—Ä–ĺ–≤–Ĺ–į ‚ÄĒ –ļ.–ľ.–Ĺ., –į—Ā—Ā–ł—Ā—ā–Ķ–Ĺ—ā –ļ–į—Ą–Ķ–ī—Ä—č —Ą–į–ļ—É–Ľ—Ć—ā–Ķ—ā—Ā–ļ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –ł–ľ. –Ņ—Ä–ĺ—Ą. –ď.–Ē. –ó–į–Ľ–Ķ—Ā—Ā–ļ–ĺ–≥–ĺ –§–ď–Ď–ě–£ –í–ě –Ě–ď–ú–£ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 630091, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, –ö—Ä–į—Ā–Ĺ—č–Ļ –Ņ—Ä-—ā, –ī. 52; ORCID iD 0000-0002-7971-6479.
–ö—Ä–ł–≤–ĺ—ą–Ķ–Ķ–≤–į –ė–Ĺ–≥–į –ź–Ĺ–į—ā–ĺ–Ľ—Ć–Ķ–≤–Ĺ–į ‚ÄĒ –ļ.–ľ.–Ĺ., –į—Ā—Ā–ł—Ā—ā–Ķ–Ĺ—ā –ļ–į—Ą–Ķ–ī—Ä—č –Ņ—Ä–ĺ—Ą–Ī–ĺ–Ľ–Ķ–∑–Ĺ–Ķ–Ļ —Ā –ļ—É—Ä—Ā–ĺ–ľ —ć–Ĺ–ī–ĺ–ļ—Ä–ł–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –§–ď–Ď–ě–£ –í–ě –Ě–ď–ú–£ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 630091, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, –ö—Ä–į—Ā–Ĺ—č–Ļ –Ņ—Ä-—ā, –ī. 52; –∑–į–≤–Ķ–ī—É—é—Č–į—Ź –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ–ľ —ć–Ĺ–ī–ĺ–ļ—Ä–ł–Ĺ–ĺ–Ľ–ĺ–≥–ł–ł –ď–Ď–£–ó –Ě–°–ě ¬ę–ď–ö–Ď ‚ĄĖ 1¬Ľ; 630047, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, —É–Ľ. –ó–į–Ľ–Ķ—Ā—Ā–ļ–ĺ–≥–ĺ, –ī. 6; ORCID iD 0000-0002-3575-4983.
–ź—É—ā–Ķ–Ĺ—ą–Ľ—é—Ā –ź–Ľ–Ķ–ļ—Ā–į–Ĺ–ī—Ä –ė—Ā–į–Ķ–≤–ł—á ‚ÄĒ –ī.–Ī.–Ĺ., –∑–į–≤–Ķ–ī—É—é—Č–ł–Ļ —Ü–Ķ–Ĺ—ā—Ä–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ĺ–į—É—á–Ĺ–ĺ-–ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ—Ć—Ā–ļ–ĺ–Ļ –Ľ–į–Ī–ĺ—Ä–į—ā–ĺ—Ä–ł–Ķ–Ļ –§–ď–Ď–ě–£ –í–ě –Ě–ď–ú–£ –ú–ł–Ĺ–∑–ī—Ä–į–≤–į –†–ĺ—Ā—Ā–ł–ł; 630091, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, –ö—Ä–į—Ā–Ĺ—č–Ļ –Ņ—Ä-—ā, –ī. 52; –≥–Ľ–į–≤–Ĺ—č–Ļ –Ĺ–į—É—á–Ĺ—č–Ļ —Ā–ĺ—ā—Ä—É–ī–Ĺ–ł–ļ –§–ė–¶ –§–Ę–ú; 630117, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ě–ĺ–≤–ĺ—Ā–ł–Ī–ł—Ä—Ā–ļ, —É–Ľ. –Ę–ł–ľ–į–ļ–ĺ–≤–į, –ī. 2; ORCID iD 0000-0002-6538-0089.
–ö–ĺ–Ĺ—ā–į–ļ—ā–Ĺ–į—Ź –ł–Ĺ—Ą–ĺ—Ä–ľ–į—Ü–ł—Ź: –ö—Ä–ł–≤–ĺ—ą–Ķ–Ķ–≤ –ź–Ľ–Ķ–ļ—Ā–į–Ĺ–ī—Ä –Ď–ĺ—Ä–ł—Ā–ĺ–≤–ł—á, e-mail: krivosheev-ab@narod.ru.
–ü—Ä–ĺ–∑—Ä–į—á–Ĺ–ĺ—Ā—ā—Ć —Ą–ł–Ĺ–į–Ĺ—Ā–ĺ–≤–ĺ–Ļ –ī–Ķ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł: –Ĺ–ł–ļ—ā–ĺ –ł–∑ –į–≤—ā–ĺ—Ä–ĺ–≤ –Ĺ–Ķ –ł–ľ–Ķ–Ķ—ā —Ą–ł–Ĺ–į–Ĺ—Ā–ĺ–≤–ĺ–Ļ –∑–į–ł–Ĺ—ā–Ķ—Ä–Ķ—Ā–ĺ–≤–į–Ĺ–Ĺ–ĺ—Ā—ā–ł –≤ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ—č—Ö –ľ–į—ā–Ķ—Ä–ł–į–Ľ–į—Ö –ł–Ľ–ł –ľ–Ķ—ā–ĺ–ī–į—Ö.
–ö–ĺ–Ĺ—Ą–Ľ–ł–ļ—ā –ł–Ĺ—ā–Ķ—Ä–Ķ—Ā–ĺ–≤ –ĺ—ā—Ā—É—ā—Ā—ā–≤—É–Ķ—ā.
–°—ā–į—ā—Ć—Ź –Ņ–ĺ—Ā—ā—É–Ņ–ł–Ľ–į 27.03.2022.
–ü–ĺ—Ā—ā—É–Ņ–ł–Ľ–į –Ņ–ĺ—Ā–Ľ–Ķ —Ä–Ķ—Ü–Ķ–Ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź 19.04.2022.
–ü—Ä–ł–Ĺ—Ź—ā–į –≤ –Ņ–Ķ—á–į—ā—Ć 18.05.2022.
About the authors:
Aleksandr B. Krivosheev ‚ÄĒ Dr. Sc. (Med.), professor of the Prof. G.D. Zalesskiy Department of Faculty Therapy, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-4845-8753.
Vladimir N. Maksimov ‚ÄĒ Dr. Sc. (Med.), Professor, Head of the Laboratory of Molecular Genetic Testing of Therapeutic Diseases, Research Institute for Therapy and Preventive Medicine ‚ÄĒ Branch of the Federal Research Center Institute of Cytology and Genetics of the Siberian Branch of the RAS; 175/1, B. Bogatkov str., Novosibirsk, 630089, Russian Federation; professor of the Department of Biology and Medical Genetics, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-7165-4496.
Konstantin Yu. Boyko ‚ÄĒ resident of the Department of Endocrinology, City Clinical Hospital No. 1; 6 build. 4, Zalesskiy str., Novosibirsk, 630047, Russian Federation; ORCID iD 0000-0003-3293-0061.
Elena E. Levykina ‚ÄĒ resident of the Department of Gastroenterology, City Clinical Hospital No. 1; 6 build. 4, Zalesskiy str., Novosibirsk, 630047, Russian Federation; ORCID iD 0000-0002-2029-0557.
Elena S. Mikhailova ‚ÄĒ researcher of the Central Research Laboratory, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; researcher, Federal Research Center for Fundamental and Translational Medicine; 2, Timakov str., Novosibirsk, 630060, Russian Federation; ORCID iD 0000-0001-8576-3717.
Nikolay A. Varaksin ‚ÄĒ Head of the Laboratory of Cytokines, JSC "Vektor-Best"; build. 36, working settlement Koltsovo, Research and Production Zone, Novosibirsk, 630559, Russian Federation; ORCID iD 0000-0002-0733-7787.
Maria A. Kondratova ‚ÄĒ C. Sc. (Med.), assistant of the Prof. G.D. Zalesskiy Department of Faculty Therapy, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-7971-6479.
Inga A. Krivosheeva ‚ÄĒ C. Sc. (Med.), assistant of the Department of Occupational Diseases with the Course of Endocrinology, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; Head of the Department of Endocrinology, City Clinical Hospital No. 1; 6 build. 4, Zalesskiy str., Novosibirsk, 630047, Russian Federation; ORCID iD 0000-0002-3575-4983.
Aleksandr I. Autenshlyus ‚ÄĒ Dr. Sc. (Biol.), Head of the Central Research Laboratory, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; leading researcher, Federal Research Center for Fundamental and Translational Medicine; 2, Timakov str., Novosibirsk, 630060, Russian Federation; ORCID iD 0000-0002-6538-0089.
Contact information: Aleksandr B. Krivosheev, e-mail: krivosheev-ab@narod.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 27.03.2022.
Revised 19.04.2022.
Accepted 18.05.2022.












