–Т —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є –њ—А–Є —Г–≥–ї–µ–≤–Њ–і–љ–Њ–Љ –Њ–±–Љ–µ–љ–µ —Б—З–Є—В–∞–ї–Є—Б—М –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ, –Њ–і–љ–∞–Ї–Њ –і–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В –і–Њ–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ –њ—А–Є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є (–Ш–†) –Љ–Њ–≥—Г—В —Б–Њ–њ—Г—В—Б—В–≤–Њ–≤–∞—В—М —Б–µ—А—М–µ–Ј–љ—Л–µ —Б–Є–ї—М–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П. –Ґ–µ—З–µ–љ–Є–µ –Э–Р–Ц–С–Я –≤ —Ж–µ–ї–Њ–Љ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –Є –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–Є—Е –∞–≥–µ–љ—В–Њ–≤ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –і–ї–Є—В–µ–ї—М–љ—Л–Љ —Б—В–∞–±–Є–ї—М–љ—Л–Љ, –љ–µ–њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ.
–Я—А–Є –љ–∞–ї–Є—З–Є–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —Г —З–∞—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ —Б—В–µ–∞—В–Њ–Ј–Њ–Љ –њ–µ—З–µ–љ–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г–µ—В —Д–Є–±—А–Њ–Ј (–і–Њ 20–37%). –Э–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є –њ—А–µ–і–Є–Ї—В–Њ—А–∞–Љ–Є —В—П–ґ–µ–ї–Њ–≥–Њ, –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–≥–Њ —В–µ—З–µ–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є —П–≤–ї—П—О—В—Б—П: –≤–Њ–Ј—А–∞—Б—В —Б—В–∞—А—И–µ 45 –ї–µ—В, –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Њ–ґ–Є—А–µ–љ–Є–µ, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В 2 —В–Є–њ–∞, –ґ–µ–љ—Б–Ї–Є–є –њ–Њ–ї [2]. –£ 20% –Є–Ј –љ–Є—Е –≤ —В–µ—З–µ–љ–Є–µ 20 –ї–µ—В —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П —Ж–Є—А—А–Њ–Ј —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –њ–µ—З–µ–љ–Њ—З–љ–Њ––Ї–ї–µ—В–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є. –Я–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ 60–80% –Ї—А–Є–њ—В–Њ–≥–µ–љ–љ—Л—Е —Ж–Є—А—А–Њ–Ј–Њ–≤ –њ–µ—З–µ–љ–Є —П–≤–ї—П—О—В—Б—П –Є—Б—Е–Њ–і–∞–Љ–Є –Э–Р–°–У [3]. –Ф–Њ —Б–Є—Е –њ–Њ—А –љ–µ –≤—Л—П—Б–љ–µ–љ—Л —В–Њ—З–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–∞ –њ–µ—З–µ–љ–Є –њ—А–Є –Ш–†.
–Ю—Б–љ–Њ–≤–љ—Л–Љ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –ї–µ–ґ–∞—Й–Є–Љ –≤ –Њ—Б–љ–Њ–≤–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Э–Р–Ц–С–Я, —П–≤–ї—П–µ—В—Б—П –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М [4]. –Я—А–Є —А–∞–Ј–≤–Є—В–Є–Є –Ш–† –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –љ–∞—А—Г—И–µ–љ–Є–µ —Ж–Є–Ї–ї–∞ –≥–ї—О–Ї–Њ–Ј–∞ – —Б–≤–Њ–±–Њ–і–љ—Л–µ –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л (–°–Ц–Ъ). –Ш–Ј–±—Л—В–Њ—З–љ–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –°–Ц–Ъ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ —Г—Б–Є–ї–µ–љ–љ—Л–Љ –ї–Є–њ–Њ–ї–Є–Ј–Њ–Љ –љ–∞ —Д–Њ–љ–µ –Њ–ґ–Є—А–µ–љ–Є—П, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Ш–† [5]. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –њ—Г–ї–∞ –°–Ц–Ъ –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ—В–ї–Њ–ґ–µ–љ–Є—О –ґ–Є—А–∞ –≤ –љ–µ—Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –і–ї—П –љ–µ–≥–Њ –Њ—А–≥–∞–љ–∞—Е –Є —В–Ї–∞–љ—П—Е, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –њ—А–Є—З–Є–љ–Њ–є —Б—В–µ–∞—В–Њ–Ј–∞ –њ–µ—З–µ–љ–Є –Є –ї–Є–њ–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є. –°–Ц–Ъ –Њ–±–ї–∞–і–∞—О—В –њ—А—П–Љ–Њ–є –Є –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–є –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ї–Є–њ–Є–і–Њ–≤ (–Я–Ю–Ы) —В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—О –Ъ/Na –Р–Ґ–§––∞–Ј—Л, —Г–≥–љ–µ—В–µ–љ–Є—О –≥–ї–Є–Ї–Њ–ї–Є–Ј–∞, —А–∞–Ј–Њ–±—Й–µ–љ–Є—О –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Д–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–Є—П, –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–Є PPAR–a –њ—Г—В–Є —Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є –Є–Ј–±—Л—В–Ї–∞ –°–Ц–Ъ [1,6–9]. –Я—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –Ј–∞—Й–Є—В–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ –Љ–µ–Љ–±—А–∞–љ—Л –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ –Њ—В –°–Ц–Ъ–—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ—А—П–Љ–Њ–µ –Є–ї–Є –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–µ –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ—Л–Љ —Б—В—А–µ—Б—Б–Њ–Љ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є, –∞–њ–Њ–њ—В–Њ–Ј –Є –љ–µ–Ї—А–Њ–Ј –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ [4,10,11].
–•–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–∞—П –Љ–Њ–і–µ–ї—М –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Э–Р–Ц–С–Я – «—В–µ–Њ—А–Є—П –і–≤—Г—Е —Г–і–∞—А–Њ–≤» – –Њ–±—К–µ–і–Є–љ—П–µ—В —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Э–Р–°–У –Є —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є. –Я–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –°–Ц–Ъ –≤ –њ–µ—З–µ–љ—М –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї «–њ–µ—А–≤—Л–є —Г–і–∞—А» – –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Б—В–µ–∞—В–Њ–Ј–∞ –њ–µ—З–µ–љ–Є. –Я–∞—А–∞–ї–ї–µ–ї—М–љ–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ї–∞—Б–Ї–∞–і —А–µ–∞–Ї—Ж–Є–є –Њ–Ї–Є—Б–ї–µ–љ–Є—П –°–Ц–Ъ —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Я–Ю–Ы –Є –∞–Ї—В–Є–≤–љ—Л—Е —Д–Њ—А–Љ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ – «–≤—В–Њ—А–Њ–є —Г–і–∞—А». –Я—А–Њ–Є—Б—Е–Њ–і—П—Й–Є–µ –≤—Б–ї–µ–і –Ј–∞ —Н—В–Є–Љ —А–µ–∞–Ї—Ж–Є–Є –≤–µ–і—Г—В –Ї —А–∞–Ј–Њ–±—Й–µ–љ–Є—О –Њ–Ї–Є—Б–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ —Д–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–Є—П, –Є—Б—В–Њ—Й–µ–љ–Є—О –Љ–Є—В–Њ—Е–Њ–љ–і–Є—А–∞–ї—М–љ–Њ–є –Р–Ґ–§ –Є, –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ —Б—З–µ—В–µ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –љ–µ–Ї—А–Њ–Ј—Г –Є –∞–њ–Њ–њ—В–Њ–Ј—Г –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤, —В.–µ. –њ—А–Є–≤–Њ–і—П—В –Ї —Д–Є–±—А–Њ–Ј—Г –њ–µ—З–µ–љ–Є.
–Я—А–Њ–≤–Њ–і–Є–ї–Є—Б—М —В–∞–Ї–ґ–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–µ –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л (—В–∞–±–ї. 1).
–Ь–Њ–ґ–љ–Њ –љ–∞–і–µ—П—В—М—Б—П, —З—В–Њ –і–∞–ї—М–љ–µ–є—И–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –Њ–±–ї–∞—Б—В–Є –≥–µ–љ–µ—В–Є–Ї–Є –њ–Њ–Ј–≤–Њ–ї—П—В –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М —Д–∞–Ї—В–Њ—А—Л, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є [12–15].
–§–Є–±—А–Њ–Ј –њ–µ—З–µ–љ–Є —П–≤–ї—П–µ—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ–µ—З–µ–љ–Є –Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–∞—В—А–Є–Ї—Б–љ—Л—Е –њ—А–Њ—В–µ–Є–љ–Њ–≤ (–Т–Ь–Я), —З—В–Њ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —В–Є–њ–Њ–≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї–µ–Ј–љ–µ–є –њ–µ—З–µ–љ–Є [16]. –Я—А–Є—З–Є–љ–Њ–є —А–∞–Ј–≤–Є—В–Є—П —Д–Є–±—А–Њ–Ј–∞ –≤ –Є–љ–і—Г—Б—В—А–Є–∞–ї—М–љ–Њ —А–∞–Ј–≤–Є—В—Л—Е —Б—В—А–∞–љ–∞—Е —П–≤–ї—П–µ—В—Б—П –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є–µ –≥–µ–њ–∞—В–Є—В–Њ–Љ –°, –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–∞—П –±–Њ–ї–µ–Ј–љ—М –њ–µ—З–µ–љ–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ–∞—П –ґ–Є—А–Њ–≤–∞—П –±–Њ–ї–µ–Ј–љ—М –њ–µ—З–µ–љ–Є. –Т—Б–ї–µ–і—Б—В–≤–Є–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л—Е –њ—А–Њ—В–µ–Є–љ–Њ–≤, –Є—Б–Ї–∞–ґ–∞—О—Й–Є—Е –љ–Њ—А–Љ–∞–ї—М–љ—Г—О –∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї—Г –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ –Ј–∞ —Б—З–µ—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —А—Г–±—Ж–Њ–≤, –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –Њ—З–∞–≥–Њ–≤ —А–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Ж–Є—А—А–Њ–Ј–∞. –Э–∞—З–∞–ї–Њ —Д–Є–±—А–Њ–Ј–∞ –Ї–Њ–≤–∞—А–љ–Њ: –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –њ–Њ—Б–ї–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Ж–Є—А—А–Њ–Ј–∞ [17].
–Ф–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є «–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ» –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є —Б—В–∞–і–Є–Є —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є –Њ—Б—В–∞–µ—В—Б—П –њ—Г–љ–Ї—Ж–Є–Њ–љ–љ–∞—П –±–Є–Њ–њ—Б–Є—П –њ–µ—З–µ–љ–Є [18]. –У–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —В–Ї–∞–љ–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –±–Њ–ї–µ–µ —З–µ—В–Ї–Њ–Љ—Г –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—О –Њ–± —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М —Б—В–µ–њ–µ–љ—М —Д–Є–±—А–Њ–Ј–∞ (—Б –њ–Њ–Љ–Њ—Й—М—О —И–Ї–∞–ї –Ш—И–∞–Ї–∞ (1–5) –Є –Ь–µ—В–∞–≤–Є—А (1–4)). –°–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–µ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–µ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–∞—В—А–Є–Ї—Б–љ—Л—Е –њ—А–Њ—В–µ–Є–љ–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б—В–µ–њ–µ–љ–Є —Д–Є–±—А–Њ–Ј–∞ –Є –і–ї—П –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–≥–Њ –Љ–Њ—А—Д–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞.
–Т —Б–ї—Г—З–∞–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ (–Ї–∞–Ї –њ—А–Є –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ–µ—З–µ–љ–Є) –≥–µ–њ–∞—В–Њ—Ж–Є—В—Л –Ј–∞–Љ–µ—Й–∞—О—В—Б—П –Є–Ј–±—Л—В–Њ—З–љ—Л–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –±–µ–ї–Ї–Њ–≤ —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞, –≤–Ї–ї—О—З–∞—П —Д–Є–±—А–Є–ї–ї—П—А–љ—Л–є –Ї–Њ–ї–ї–∞–≥–µ–љ. –Я—А–Є –≤–Є—А—Г—Б–љ—Л—Е –Є —Е–Њ–ї–µ—Б—В–∞—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е –Ї–Њ–ї–ї–∞–≥–µ–љ –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ –ї–Њ–Ї–∞–ї–Є–Ј—Г–µ—В—Б—П –≤–Њ–Ї—А—Г–≥ –њ–Њ—А—В–∞–ї—М–љ—Л—Е —В—А–∞–Ї—В–Њ–≤, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –њ—А–Є –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є – –≤ –њ–µ—А–Є—Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –Є–ї–Є –њ–µ—А–Є—Б–Є–љ—Г—Б–Њ–Є–і–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є [19]. –Я–Њ –Љ–µ—А–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–µ—З–µ–љ–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є—П –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –≤ –Љ–Њ—Б—В–Њ–≤–Є–і–љ—Л–є —Д–Є–±—А–Њ–Ј, —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —З–µ–≥–Њ —П–≤–ї—П–µ—В—Б—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —Ж–Є—А—А–Њ–Ј–∞.
–Я–µ—З–µ–љ–Њ—З–љ—Л–є —Д–Є–±—А–Њ–Ј –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –Ї–∞–Ї –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞, —В–∞–Ї –Є –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–≥–Њ –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ (–≠–Ъ–Ь) [20]. –Я—А–Є —Б–Є–ї—М–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П—Е –њ–µ—З–µ–љ—М —Б–Њ–і–µ—А–ґ–Є—В –њ—А–Є–Љ–µ—А–љ–Њ –≤ 6 —А–∞–Ј –±–Њ–ї—М—И–µ –≠–Ъ–Ь, –≤–Ї–ї—О—З–∞—П –Ї–Њ–ї–ї–∞–≥–µ–љ (1, 3 –Є 4 —В–Є–њ–Њ–≤), —Д–Є–±—А–Њ–љ–µ–Ї—В–Є–љ, —Г–љ–і—Г–ї–Є–љ, —Н–ї–∞—Б—В–Є–љ –Є –њ—А–Њ—В–µ–Њ–≥–ї–Є–Ї–∞–љ—Л [21].
–Ч–≤–µ–Ј–і—З–∞—В—Л–µ –Ї–ї–µ—В–Ї–Є –њ–µ—З–µ–љ–Є (–Ч–Ъ–Я) —П–≤–ї—П—О—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –њ—А–Њ–і—Г—Ж–µ–љ—В–Њ–Љ –≠–Ъ–Ь –≤ –њ–Њ–≤—А–µ–ґ–і–µ–љ–љ–Њ–є –њ–µ—З–µ–љ–Є [36]. –Т –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –њ–µ—З–µ–љ–Є –Ч–Ъ–Я –љ–∞—Е–Њ–і—П—В—Б—П –≤ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ –Ф–Є—Б—Б–µ –Є —П–≤–ї—П—О—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –∞–Ї–Ї—Г–Љ—Г–ї—П—В–Њ—А–Њ–Љ (—Е—А–∞–љ–Є–ї–Є—Й–µ–Љ) –≤–Є—В–∞–Љ–Є–љ–∞ –Р. –Т—Б–ї–µ–і—Б—В–≤–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –љ–∞–±–ї—О–і–∞–µ—В—Б—П –∞–Ї—В–Є–≤–∞—Ж–Є—П –Ч–Ъ–Я –Є–ї–Є –Є—Е –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–∞ –≤ –Љ–Є–Њ—Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–њ–Њ–і–Њ–±–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–Њ–±—А–µ—В–∞—О—В —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ—Л–µ, –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Є —Д–Є–±—А–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ [22,23]. –Ф—А—Г–≥–Є–µ –њ–µ—З–µ–љ–Њ—З–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –Њ—В–ї–Є—З–љ—Л–µ –Њ—В –Ч–Ъ–Я, —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –Є–Љ–µ—В—М —Д–Є–±—А–Њ–≥–µ–љ–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї. –Ь–Є–Њ—Д–Є–±—А–Њ–±–ї–∞—Б—В—Л, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є–µ –Є–Ј –љ–µ–±–Њ–ї—М—И–Њ–≥–Њ —А–∞–Ј–Љ–µ—А–∞ –њ–Њ—А—В–∞–ї—М–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤, –њ—А–Њ–ї–Є—Д–µ—А–Є—А—Г—О—В –≤–Њ–Ї—А—Г–≥ –±–Є–ї–Є–∞—А–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –њ–µ—З–µ–љ–Є, –Ї–Њ—В–Њ—А–∞—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ –њ–Њ–і–≤–µ—А–ґ–µ–љ–∞ —Е–Њ–ї–µ—Б—В–∞–Ј—Г –Є –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ [24,25]
–Р–і–Є–њ–Њ–Ї–Є–љ—Л, –Ї–Њ—В–Њ—А—Л–µ —П–≤–ї—П—О—В—Б—П —Ж–Є—В–Њ–Ї–Є–љ–∞–Љ–Є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є, —В–∞–Ї–ґ–µ –њ—А–Є–љ–Є–Љ–∞—О—В —Г—З–∞—Б—В–Є–µ –≤ —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–µ –≤ –њ–µ—З–µ–љ–Є. –Ы–µ–њ—В–Є–љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ –і–ї—П –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ч–Ъ–Я –Є —А–∞–Ј–≤–Є—В–Є—П —Д–Є–±—А–Њ–Ј–∞ [26,27]. –Э–∞–њ—А–Њ—В–Є–≤, –∞–і–Є–њ–Њ–љ–µ–Ї—В–Є–љ –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Є–љ–≥–Є–±–Є—А—Г–µ—В —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј –њ–µ—З–µ–љ–Є –Ї–∞–Ї in vivo, —В–∞–Ї –Є in vitro [28]. –Ф–µ–є—Б—В–≤–Є–µ —Н—В–Є—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ –≤–∞–ґ–љ–Њ –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–∞, —Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ (–љ–∞–њ—А–Є–Љ–µ—А, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Т–У–°) [29].
–У–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–њ—А–µ–і–µ–ї–Є—В—М —Б—В–µ–њ–µ–љ—М –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Э–Р–°–У –Є —Б—В–∞–і–Є—О —Д–Є–±—А–Њ–Ј–∞ –њ–µ—З–µ–љ–Є.
–Ф–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Э–Р–Ц–С–Я –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –Ї—А—Г–њ–љ–Њ–Ї–∞–њ–µ–ї—М–љ—Л–Љ —Б—В–µ–∞—В–Њ–Ј–Њ–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ 3 –Ј–Њ–љ–µ –∞—Ж–Є–љ—Г—Б–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –Є–ї–Є –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ —В–µ–ї–µ—Ж –Ь—Н–ї–ї–Њ—А–Є, –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ–Љ (–±–∞–ї–ї–Њ–љ–љ–∞—П –і–Є—Б—В—А–Њ—Д–Є—П) –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ –Є –ї–Њ–±—Г–ї—П—А–љ—Л–Љ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ–Љ (–њ–Њ–ї–Є–Љ–Њ—А—Д–љ–Њ—П–і–µ—А–љ—Л–µ –ї–µ–є–Ї–Њ—Ж–Є—В—Л –Є –Љ–Њ–љ–Њ–љ—Г–Ї–ї–µ–∞—А—Л). –Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П E. Brunt (2002) –љ–∞–Є–±–Њ–ї–µ–µ —З–µ—В–Ї–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М –Э–Р–Ц–С–Я (—В–∞–±–ї. 2) [30].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є–Љ–µ—О—Й–Є–µ—Б—П –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є –њ–Њ–Ј–≤–Њ–ї—П—О—В –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М –Э–Р–Ц–С–Я –Є –њ—А–Њ–≤–Њ–і–Є—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г —Б –і—А—Г–≥–Є–Љ–Є –і–Є—Д—Д—Г–Ј–љ—Л–Љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П–Љ–Є –њ–µ—З–µ–љ–Є.
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ–µ—З–µ–љ–Є, –љ–µ –і–Њ –Ї–Њ–љ—Ж–∞ –Њ—Б—В–∞—О—В—Б—П –≤—Л—П—Б–љ–µ–љ–љ—Л–Љ–Є –њ—А–Њ—Ж–µ—Б—Б—Л —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–∞ –њ—А–Є –і–∞–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –њ–µ—З–µ–љ–Є –њ—А–Є –Ш–†. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ —Ж–µ–ї—М—О –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б—В–∞–ї–Њ —Г—В–Њ—З–љ–µ–љ–Є–µ —Е–∞—А–∞–Ї—В–µ—А–∞ –њ–Њ—А–∞–ґ–µ–љ–Є—П –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Ш–†.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 140 –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ–µ—З–µ–љ–Є —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е 78 –ґ–µ–љ—Й–Є–љ (55,7%) –≤ –≤–Њ–Ј—А–∞—Б—В–µ 50,9±1,89 –ї–µ—В –Є 62 – –Љ—Г–ґ—З–Є–љ—Л (44,2%) –≤ –≤–Њ–Ј—А–∞—Б—В–µ 41,6±6,22 –ї–µ—В. –Ш–Ј –љ–Є—Е –љ–µ –Є–Љ–µ–ї–Њ –љ–∞—А—Г—И–µ–љ–Є–є —Г–≥–ї–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ 93 (66,4%) –±–Њ–ї—М–љ—Л—Е, –љ–∞—А—Г—И–µ–љ–Є–µ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –≥–ї—О–Ї–Њ–Ј–µ –±—Л–ї–Њ —Г 47 –±–Њ–ї—М–љ—Л—Е (33,5%), –Є–Ј –Ї–Њ—В–Њ—А—Л—Е 10 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (7,14%) –Є–Љ–µ–ї–Є —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В 2 —В–Є–њ–∞.
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –±–Њ–ї—М–љ—Л–µ —Б –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є, –≤–Є—А—Г—Б–љ–Њ–є, –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –њ–µ—З–µ–љ–Є, –±–Њ–ї–µ–Ј–љ—П–Љ–Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П, –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –њ–µ—З–µ–љ–Є –Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –±–Њ–ї—М–љ—Л–µ. –Ъ–Њ–љ—В—А–Њ–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г —Б–Њ—Б—В–∞–≤–Є–ї–Є 15 –Ј–і–Њ—А–Њ–≤—Л—Е –і–Њ–±—А–Њ–≤–Њ–ї—М—Ж–µ–≤, —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л—Е –њ–Њ –њ–Њ–ї—Г –Є –≤–Њ–Ј—А–∞—Б—В—Г.
–Т—Б–µ—Е –±–Њ–ї—М–љ—Л—Е –Њ–±—Б–ї–µ–і–Њ–≤–∞–ї–Є –њ–Њ —Б—Е–µ–Љ–µ: –∞–љ–∞–ї–Є–Ј –ґ–∞–ї–Њ–±, –∞–љ–∞–Љ–љ–µ–Ј–∞, –Ї–ї–Є–љ–Є–Ї–Њ––Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Я—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —В—А–Њ—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞, –∞–љ–Ї–µ—В–Є—А–Њ–≤–∞–љ–Є–µ –±–Њ–ї—М–љ—Л—Е —Б –њ–Њ–Љ–Њ—Й—М—О –Њ–њ—А–Њ—Б–љ–Є–Ї–∞ SF 36.
–Ф–ї—П —Г—В–Њ—З–љ–µ–љ–Є—П —Е–∞—А–∞–Ї—В–µ—А–∞ –Є —Б—В–µ–њ–µ–љ–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є 27 –±–Њ–ї—М–љ—Л–Љ –њ—А–Њ–≤–µ–і–µ–љ–∞ –њ—Г–љ–Ї—Ж–Є–Њ–љ–љ–∞—П –±–Є–Њ–њ—Б–Є—П –њ–µ—З–µ–љ–Є. –Я—Г–љ–Ї—Ж–Є—П –њ–µ—З–µ–љ–Є –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ–Њ–і —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤—Л–Љ (–£–Ч–Ш) –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –Є–≥–ї–Њ–є –Ь–µ–љ–≥–Є–љ–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
–Ю–Ї–Њ–ї–Њ –њ–Њ–ї–Њ–≤–Є–љ—Л –Њ–±—Б–ї–µ–і—Г–µ–Љ—Л—Е (69 —З–µ–ї–Њ–≤–µ–Ї – 49,28%) —Б–Њ—Б—В–∞–≤–Є–ї–Є –±–Њ–ї—М–љ—Л–µ —Б–Њ —Б—В–µ–∞—В–Њ–Ј–Њ–Љ –њ–µ—З–µ–љ–Є, 71 —З–µ–ї–Њ–≤–µ–Ї (50,7%) – —Б –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ—Л–Љ —Б—В–µ–∞—В–Њ–≥–µ–њ–∞—В–Є—В–Њ–Љ –њ–Њ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –і–∞–љ–љ—Л–Љ.
–Ш–≥–Њ–ї—М–љ–∞—П –њ—Г–љ–Ї—Ж–Є–Њ–љ–љ–∞—П –±–Є–Њ–њ—Б–Є—П –њ–µ—З–µ–љ–Є –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ 27 –њ–∞—Ж–Є–µ–љ—В–∞–Љ.
–Ь–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ—Л–є —Б—В–µ–∞—В–Њ–≥–µ–њ–∞—В–Є—В —Г 19 (70,3%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Њ—Б—В–∞–ї—М–љ—Л—Е 8 (29,62%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ – –њ–Њ—А—В–∞–ї—М–љ—Л–є, –њ–µ—А–Є–њ–Њ—А—В–∞–ї—М–љ—Л–є –Є –ї–Њ–±—Г–ї—П—А–љ—Л–є –≥–µ–њ–∞—В–Є—В —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є.
–°—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–є –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –њ–µ—З–µ–љ–Є 14 –±–Њ–ї—М–љ—Л—Е (70%) —Б–Њ—Б—В–∞–≤–Є–ї–Є –ґ–µ–љ—Й–Є–љ—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ 48,93±2,28 –ї–µ—В –Є 5 –Љ—Г–ґ—З–Є–љ (30%) –≤ –≤–Њ–Ј—А–∞—Б—В–µ 40,66±4,2 –ї–µ—В.
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј —В–∞–±–ї–Є—Ж—Л 3, –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–µ—З–µ–љ–Њ—З–љ—Л—Е —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј —Б—А–µ–і–Є –Љ—Г–ґ—З–Є–љ –±—Л–ї–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–Є–ґ–µ, —З–µ–Љ —Г –ґ–µ–љ—Й–Є–љ, –љ–Њ, –≤–µ—А–Њ—П—В–љ–µ–µ –≤—Б–µ–≥–Њ, —Н—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –Љ–µ–љ—М—И–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –Љ—Г–ґ—З–Є–љ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є.
–Я—А–Њ–≤–Њ–і–Є–ї—Б—П —В–∞–Ї–ґ–µ –∞–љ–∞–ї–Є–Ј –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–† –Є –±–µ–Ј –љ–µ–µ. –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 4.
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –∞–љ–∞–ї–Є–Ј–∞ –і–∞–љ–љ—Л—Е –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–µ—З–µ–љ–Њ—З–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б –Ш–†, —З–µ–Љ –±–µ–Ј –љ–µ–µ. –Ю–і–љ–∞–Ї–Њ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Љ–µ–ґ–і—Г –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –њ–µ—З–µ–љ–Є –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —З–µ—В–Ї–Њ–є –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј –њ–Њ –і–∞–љ–љ—Л–Љ –±–Є–Њ–њ—Б–Є–Є –њ–µ—З–µ–љ–Є –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П. –Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –Є–љ–і–µ–Ї—Б–∞ —Б—В–µ–∞—В–Њ–Ј–∞ –Є –Є–љ–і–µ–Ї—Б–∞ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є (–Ш–У–Р) —Г—А–Њ–≤–µ–љ—М —В—А–∞–љ—Б–∞–Љ–Є–љ–∞–Ј –њ–Њ—Б–ї–µ–і–љ–µ–є –±–Њ–ї–µ–µ —В–µ—Б–љ–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є.
–Я–Њ –ї–Є—В–µ—А–∞—В—Г—А–љ—Л–Љ –і–∞–љ–љ—Л–Љ –і–ї—П –Э–Р–Ц–С —Е–∞—А–∞–Ї—В–µ—А–љ–Њ:
• –°—В–µ–∞—В–Њ–Ј —Б –Љ–∞–Ї—Б–Є–Љ—Г–Љ–Њ–Љ –≤ 3 –Ј–Њ–љ–µ
• –°–Љ–µ—И–∞–љ–љ–љ–Њ–µ –ї–Њ–±—Г–ї—П—А–љ–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ
• –†–∞—Б—Б–µ—П–љ–љ–∞—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—П –љ–µ–є—В—А–Њ—Д–Є–ї–∞–Љ–Є
• –С–∞–ї–ї–Њ–љ–љ–∞—П –і–Є—Б—В—А–Њ—Д–Є—П —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –ґ–Є—А–Њ–≤–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є
• –Я–µ—А–Є—Б–Є–љ—Г—Б–Њ–Є–і–∞–ї—М–љ—Л–є —Д–Є–±—А–Њ–Ј –≤ 3 –Ј–Њ–љ–µ
• –У–ї–Є–Ї–Њ–≥–µ–љ–Њ–Ј —П–і–µ—А 1 –Ј–Њ–љ—Л
• –Ы–Є–њ–Њ–≥—А–∞–љ—Г–ї–µ–Љ—Л –≤ –і–Њ–ї—М–Ї–∞—Е
• –Ц–Є—А–Њ–≤—Л–µ –Ї–Є—Б—В—Л
• –Ґ–µ–ї—М—Ж–∞ –Ь—Н–ї–ї–Њ—А–Є
• –Ь–µ–≥–∞–Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–Є –≤ –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞—Е
–Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —Г 100% –±–Њ–ї—М–љ—Л—Е —Б –Ш–† (n=27) –±—Л–ї –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ —Б—В–µ–∞—В–Њ–Ј –њ–µ—З–µ–љ–Є. –•–∞—А–∞–Ї—В–µ—А–µ–љ –±—Л–ї –Ї—А—Г–њ–љ–Њ–Ї–∞–њ–µ–ї—М–љ—Л–є —Б—В–µ–∞—В–Њ–Ј –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ 3 –Ј–Њ–љ–µ –∞—Ж–Є–љ—Г—Б–∞ (—А–Є—Б. 1, 2). –£ 80% (n=22) –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П –њ–µ—А–Є—Б–Є–љ—Г—Б–Њ–Є–і–∞–ї—М–љ—Л–є —Д–Є–±—А–Њ–Ј –≤ 3 –Ј–Њ–љ–µ –∞—Ж–Є–љ—Г—Б–∞ (—А–Є—Б. 3). –С–∞–ї–ї–Њ–љ–љ–∞—П –і–Є—Б—В—А–Њ—Д–Є—П —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –ґ–Є—А–Њ–≤–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є –±—Л–ї–∞ —Г 73% –±–Њ–ї—М–љ—Л—Е (—А–Є—Б. 4). –°–Љ–µ—И–∞–љ–љ–Њ–µ –ї–Њ–±—Г–ї—П—А–љ–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Г 62% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (—А–Є—Б. 5). –Т—Б–µ –≤—Л—И–µ–њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л –і–ї—П –њ–Њ—А–∞–ґ–µ–љ–Є—П –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ –њ—А–Є –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–Љ —В–µ—З–µ–љ–Є–Є –Э–Р–Ц–С–Я.
–Ю–і–љ–∞–Ї–Њ –≤–Њ –Љ–љ–Њ–≥–Є—Е –ї–Є—В–µ—А–∞—В—Г—А–љ—Л—Е –Є—Б—В–Њ—З–љ–Є–Ї–∞—Е –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П —В–∞–Ї–ґ–µ –њ—А–Є–Ј–љ–∞–Ї–Є, –љ–µ —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –і–ї—П –Э–Р–Ц–С–Я.
• –Ь–µ–ї–Ї–Њ–Ї–∞–њ–µ–ї—М–љ–∞—П –ґ–Є—А–Њ–≤–∞—П –і–Є—Б—В—А–Њ—Д–Є—П –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤
• –Я–Њ—А—В–∞–ї—М–љ–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –Є/–Є–ї–Є —Д–Є–±—А–Њ–Ј
• –Ю—В—Б—Г—В—Б—В–≤–Є–µ –њ–µ—А–Є—Б–Є–љ—Г—Б–Њ–Є–і–∞–ї—М–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞ –≤ 3 –Ј–Њ–љ–µ
• –Я–Њ—А–∞–ґ–µ–љ–Є–µ –ґ–µ–ї—З–љ—Л—Е –њ—А–Њ—В–Њ–Ї–Њ–≤ –Є–ї–Є –Є—Е –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—П
• –Т–µ–љ–Њ––Њ–Ї–Ї–ї—О–Ј–Є–≤–љ—Л–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П
• –Ъ—А—Г–њ–љ–Њ–Ї–∞–њ–µ–ї—М–љ–∞—П –ґ–Є—А–Њ–≤–∞—П –і–Є—Б—В—А–Њ—Д–Є—П –Љ–µ–љ–µ–µ 30% –∞—Ж–Є–љ—Г—Б–∞
• –Ы–Є–Љ—Д–Њ–Є–і–љ—Л–µ —Д–Њ–ї–ї–Є–Ї—Г–ї—Л
• –≠–Њ–Ј–Є–љ–Њ—Д–Є–ї–Є—П —В–Ї–∞–љ–Є
• –Я–ї–∞–Ј–Љ–Њ—Ж–Є—В—Л –≤ –±–Њ–ї—М—И–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ
• –Т—Л—А–∞–ґ–µ–љ–љ—Л–є —Д–Є–±—А–Њ–Ј –±–µ–Ј –њ–µ—А–Є—Б–Є–љ—Г—Б–Њ–Є–і–∞–ї—М–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞
• –Ь–Њ—Б—В–Њ–≤–Є–і–љ—Л–µ –љ–µ–Ї—А–Њ–Ј—Л
• –≠–љ–і–Њ—Д–ї–µ–±–Є—В
• –•–Њ–ї–µ—Б—В–∞–Ј
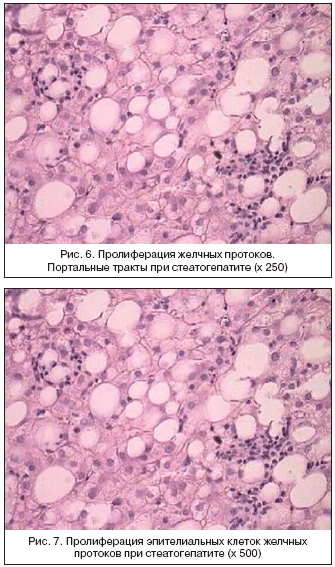
–°—А–µ–і–Є –љ–Є—Е –Њ–±–Њ–Ј–љ–∞—З–µ–љ–Њ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –ґ–µ–ї—З–љ—Л—Е –њ—А–Њ—В–Њ–Ї–Њ–≤, –Ї–∞–Ї –њ—А–Є–Ј–љ–∞–Ї, –љ–µ –≤—Б—В—А–µ—З–∞—О—Й–Є–є—Б—П –њ—А–Є –Э–Р–Ц–С–Я. –Ю–і–љ–∞–Ї–Њ –≤ –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—П –Ї–ї–µ—В–Њ–Ї —Н–њ–Є—В–µ–ї–Є—П –ґ–µ–ї—З–љ—Л—Е –њ—А–Њ—В–Њ–Ї–Њ–≤, –Є—Е –і–Є—Б—В—А–Њ—Д–Є—П –Є –і–µ—Б–Ї–≤–∞–Љ–∞—Ж–Є—П —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ –њ—А–Њ—Б–≤–µ—В –ґ–µ–ї—З–љ—Л—Е –њ—А–Њ—В–Њ–Ї–Њ–≤ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Г 37% (—А–Є—Б. 6, 7).
–Т–µ—А–Њ—П—В–љ–µ–µ –≤—Б–µ–≥–Њ, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е, —Е–∞—А–∞–Ї—В–µ—А–љ—Л–µ –і–ї—П —Б–Є–љ–і—А–Њ–Љ–∞ —Е–Њ–ї–µ—Б—В–∞–Ј–∞, –Љ–Њ–≥—Г—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є –≤ –ґ–µ–ї—З–µ–≤—Л–≤–Њ–і—П—Й–µ–є —Б–Є—Б—В–µ–Љ–µ. –Я—А–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П—Е –њ–µ—З–µ–љ–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –≥–ї—О–Ї–Њ–Ј–µ —Б–љ–∞—З–∞–ї–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–Њ—А–∞–ґ–µ–љ–Є–µ –ґ–µ–ї—З–љ—Л—Е –њ—А–Њ—В–Њ–Ї–Њ–≤, –∞ –Ј–∞—В–µ–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ—А—В–∞–ї—М–љ—Л—Е —В—А–∞–Ї—В–Њ–≤. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Љ–Њ–ґ–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –љ–∞ —Д–Њ–љ–µ –Њ–±—Й–µ–Є–Ј–≤–µ—Б—В–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–Њ—А–∞–ґ–µ–љ–Є—П –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ –њ—А–Є –Э–Р–Ц–С–Я –Є–Ј–Љ–µ–љ–µ–љ–Є—П –ґ–µ–ї—З–љ—Л—Е –њ—А–Њ—В–Њ–Ї–Њ–≤ – —Е–∞—А–∞–Ї—В–µ—А–љ–∞—П –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М –њ—А–Є –Є–љ—Б—Г–ї–Є–љ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є.
–Т—Л–≤–Њ–і—Л
1. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М—О –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –њ–µ—З–µ–љ–Є –≤—Б—В—А–µ—З–∞—О—В—Б—П –≤ 74 % —Б–ї—Г—З–∞–µ–≤.
2. –Я—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є –њ–µ—З–µ–љ–Є –њ—А–Є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –љ–µ –≤—Б–µ–≥–і–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ.
3. –Э–∞–ї–Є—З–Є–µ –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Њ —Б–Њ —Б—В–µ–њ–µ–љ—М—О –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞—Е.
4. –Я—А–Є –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –њ–Њ—А–∞–ґ–∞—О—В—Б—П –≤—Б–µ –∞–љ–∞—В–Њ–Љ–Њ––≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б—В—А—Г–Ї—В—Г—А—Л –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –ґ–µ–ї—З–µ–≤—Л–≤–Њ–і—П—Й–Є–µ –њ—А–Њ—В–Њ–Ї–Є.





–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –С–Њ–≥–Њ–Љ–Њ–ї–Њ–≤ –Я.–Ю., –Я–∞–≤–ї–Њ–≤–∞ –Ґ.–Т. –Э–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ—Л–є —Б—В–µ–∞—В–Њ–≥–µ–њ–∞—В–Є—В: –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—П, –њ–∞—В–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—П, –Ї–ї–Є–љ–Є–Ї–∞ –Є –њ–Њ–і—Е–Њ–і—Л –Ї –ї–µ—З–µ–љ–Є—О. –Ь–Ю–Э–Ш–Ъ–Ш –Є–Љ. –Ь.–§. –Т–ї–∞–і–Є–Љ–Є—А—Б–Ї–Њ–≥–Њ, –Ь–Њ—Б–Ї–≤–∞.
2. Angulo P. et al. Independent predictors of liver fibrosis in patients with nonalcoholic steatohepatitis. Hepatology 1999;30:1356–62.
3. Clark J.M. The prevalence and etiology of elevated aminotransferase levels in the United States. Am J Gastroenterol 2003;98:955–6.
4. Sanyal A.J. et al. Nonalciholic steatohepatitis: Association of insulin resistance with mitochondrial abnormalities. Gastroenterology 2001;120:1183–92.
5. Mylonas C. et al. Lipid peroxidation and tissue damage. In Vivo 1999,13:295–309.
6. Rao M.S. et al. Peroxisomal beta–oxidation and steatohepatitis. Semin Liver Dis 2001;21:43–55.
7. Mavrelis PG, et al. Hepatic free fatty acids in alcoholic liver disease and morbid obesity. Hepatology 1983;3:223–6.
8. Bass NM. Interaction of fatty acid–binding proteins (FABP) with the peroxisome proliferator–activated receptor alpha. In: Frontiers in Bioactive Lipids/ Plenum Press, 1996:67–72.
9. Pessayre D, et al. Mitochondria in steatohepatitis. Semin Liver Dis 2001;21:57–69.
10. Robertson G. et al. Nonalcoholic steatosis and steatohepatitis II. Cytochrome P450 and oxidative stress. Am J Physiol Gastrointest Liver Physiol 2001;282:G1135–9.
11. Reddy J.K. Nonalcoholic steatosis and steatohepatitis III. Peroxisomal b–oxidation, PPAR–a and steatohepatitis. Am J Physiol Gastrointest Liver Physiol 2001;282:G1333–9.
12. Masuzaki H. et al. A transgenic model of visceral obesity and the metabolic syndrome. Science 2001;294:2166–70.
13. Martinelli A.C. et al. Nonalcoholic fatty liver disease and familial partial lipodystrophy – a strong association. Hepatology 2001;34:461A.
14. Lee Y. et al. Liporegulation in diet–induced obesity: the antisteatotic role of hyperleptinemia. J Biol Chem 2001;276:5629–35.
15. Valenti L. et al. Tumor necrosis factor–a promoter polymorphisms and insulin resistance in nonalcoholic fatty liver disease. Gastroenterology 2002;122:274–80.
16. Friedman, S.L. 2003. Liver fibrosis – from bench to bedside. J. Hepatol. 38(Suppl. 1):S38–S53.
17. Poynard T. et al. 2000. Natural history of HCV infection. Baillieres Best Pract. Res. Clin. Gastroenterol. 14:211–228.
18. Afdhal N.H. and Nunes D. 2004. Evaluation of liver fibrosis: a concise review. Am. J. Gastroenterol. 99:1160–1174.
19. Pinzani M. 1999. Liver fibrosis. Springer Semin. Immunopathol. 21:475–490.
20. Benyon R.C. and Iredale J.P. 2000. Is liver fibrosis reversible? Gut. 46:443–446.
21. Arthur M.J. 2000. Fibrogenesis II. Metalloproteinases and their inhibitors in liver fibrosis. Am. J. Physiol. Gastrointest. Liver Physiol. 279:G245–G249.
22. Milani S. et al. 1990. Procollagen expression by nonparenchymal rat liver cells in experimental biliary fibrosis. Gastroenterology. 98:175–184.
23. Marra F. 1999. Hepatic stellate cells and the regulation of liver inflammation. J. Hepatol. 31:1120–1130. 39. Lindquist, J.N., Marzluff, W.F., and Stefanovic, B. 2000. Fibrogenesis. III. Posttranscriptional regulation of type I collagen. Am. J. Physiol. Gastrointest. Liver Physiol. 279:G471–G476.
24. Kinnman N. and Housset C. 2002. Peribiliary myofibroblasts in biliary type liver fibrosis. Front. Biosci. 7:d496–d503.
25. Magness S.T., Bataller R., Yang L. and Brenner D.A. 2004. A dual reporter gene transgenic mouse demonstrates heterognity in hepatic fibrogenic cell populations. Hepatology. 40:1151–1159.
26. Marra F. 2002. Leptin and liver fibrosis: a matter of fat. Gastroenterology. 122:1529–1532.
27. Ikejima K. et al. 2002. Leptin receptor–mediated signaling regulates hepatic fibrogenesis and remodeling of extracellular matrix in the rat. Gastroenterology. 122:1399–1410.
28. Kamada Y. et al. 2003. Enhanced carbon tetrachloride–induced liver fibrosis in mice lacking adiponectin. Gastroenterology. 125:1796–1807.
29. Ortiz V., Berenguer M., Rayon J.M., Carrasco D. and Berenguer J. 2002. Contribution of obesity to hepatitis C–related fibrosis progression. Am. J. Gastroenterol. 97:2408–2414.
30. Brunt E.M. Nonalcoholic steatohepatitis: Definition and pathology. Semin Liver Dis 2001;21:3–16.












