–£—З–µ—В —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –ї–µ—З–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–Є H. pylori –љ–∞—И–µ–ї —Б–≤–Њ–µ –Њ—В—А–∞–ґ–µ–љ–Є–µ –≤ –њ–µ—А–≤–Њ–Љ –Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Њ–Љ —Б–Њ–≥–ї–∞—И–µ–љ–Є–Є (1996), –≥–і–µ –±—Л–ї–Њ —Г–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –і–ї—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М —В—А–Њ–є–љ—Г—О –Є–ї–Є –Ї–≤–∞–і—А–Њ—В–µ—А–∞–њ–Є—О (—В. –µ. –і–≤–∞ –Є–ї–Є —В—А–Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–∞, –љ–Њ —В–Њ–ї—М–Ї–Њ —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г–ґ–µ –≤ —Б–∞–Љ–Њ–Љ –љ–∞—З–∞–ї–µ –Є–Ј—Г—З–µ–љ–Є—П H. pylori —Б—В–∞–ї–Њ –њ–Њ–љ—П—В–љ–Њ, —З—В–Њ –і–ї—П —Н—В–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є –њ—А–Є—З–Є–љ–Њ–є –±–µ–Ј—Г—Б–њ–µ—И–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є–ї–Є –µ–µ —А–µ—Ж–Є–і–Є–≤–∞ —П–≤–ї—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –њ—А–Є–Њ–±—А–µ—В–µ–љ–љ–∞—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ—Г—В–∞—Ж–Є–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М, –љ–Њ –Є —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–∞—П (–Њ–±—А–∞—В–Є–Љ–∞—П, –љ–µ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–∞—П) —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М, –Ї–Њ—В–Њ—А–∞—П –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –љ–µ–Ї–Њ—В–Њ—А—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є H. pylori –Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –µ–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Б–Њ —Б–ї–Є–Ј–Є—Б—В–Њ–є –ґ–µ–ї—Г–і–Ї–∞ –Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є H. pylori –Ї –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ. –†–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –∞–љ–∞–ї–Є–Ј IвАУV –Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Є—Е —Б–Њ–≥–ї–∞—И–µ–љ–Є–є –Є –ї–Є—В–µ—А–∞—В—Г—А–љ—Л—Е –і–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В, —З—В–Њ –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –Є —З—Г—В—М –ї–Є –љ–µ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є —Б–љ–Є–ґ–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л—Е —Б—Е–µ–Љ –њ—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М —А–Њ—Б—В –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Є –љ–Є–Ј–Ї—Г—О –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М –±–Њ–ї—М–љ—Л—Е (–љ–µ—Б–Њ–±–ї—О–і–µ–љ–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є, –і–Њ–Ј –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤) [1вАУ4]. –Ф–∞–љ–љ—Л–µ –Њ —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –љ–µ —Б–Є—Б—В–µ–Љ–∞—В–Є–Ј–Є—А–Њ–≤–∞–љ—Л –Є –љ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б–Ї–Њ–ї—М-–ї–Є–±–Њ –Ј–љ–∞—З–Є–Љ—Л—Е –њ—А–Є—З–Є–љ, –Ї–Њ—В–Њ—А—Л–µ —Б–љ–Є–ґ–∞—О—В –і–µ–є—Б—В–≤–µ–љ–љ–Њ—Б—В—М —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є–ї–Є –Њ–±—К—П—Б–љ—П—О—В —Б—В–Њ–ї—М –±—Л—Б—В—А–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л—Е —Б—Е–µ–Љ –ї–µ—З–µ–љ–Є—П. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –њ–Њ–љ–Є–Љ–∞–љ–Є–µ –Њ—Б–љ–Њ–≤–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є, –∞ —В–∞–Ї–ґ–µ –∞–љ–∞–ї–Є–Ј –Є —Г—Б—В—А–∞–љ–µ–љ–Є–µ –Њ—Б–љ–Њ–≤–љ—Л—Е –њ—А–Є—З–Є–љ –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —П–≤–ї—П—О—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ —А–µ–Ј–µ—А–≤–Њ–Љ –і–ї—П –њ–Њ–≤—Л—И–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori.
I. –§–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–∞—П —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М
–Р–љ–∞–ї–Є–Ј –ї–Є—В–µ—А–∞—В—Г—А–љ—Л—Е –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤ –Є —Б–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е —Б —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є –љ–∞–Љ –Њ–±–Њ–±—Й–Є—В—М –Њ—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є—З–Є–љ—Л —А–∞–Ј–≤–Є—В–Є—П —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Њ–є (–Њ–±—А–∞—В–Є–Љ–Њ–є, –љ–µ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є) —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є.
–Ю–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–Ї–Ї–Њ–≤—Л—Е –Є U-—Д–Њ—А–Љ
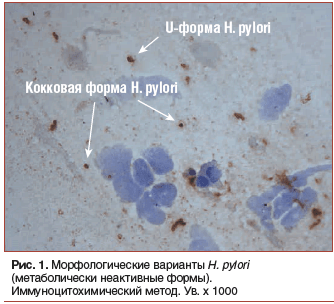
–Ю —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є —Б—В–∞–ї–Є –∞–Ї—В–Є–≤–љ–Њ –≥–Њ–≤–Њ—А–Є—В—М –њ–Њ—Б–ї–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П —Г H. pylori –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–Ї–Ї–Њ–≤—Л—Е –Є U-—Д–Њ—А–Љ (—А–Є—Б. 1) [5]. –Ъ–∞–Ї –Є–Ј–≤–µ—Б—В–љ–Њ, –Є—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ—А–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –і–ї—П —А–∞–Ј–Љ–љ–Њ–ґ–µ–љ–Є—П H. pylori —Г—Б–ї–Њ–≤–Є–є: –њ—А–Є –Ї–Њ–ї–µ–±–∞–љ–Є–Є —А–Э –љ–Є–ґ–µ 4,5 –Є –≤—Л—И–µ 8,0, –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е —Б—А–µ–і—Б—В–≤, —А–µ–Ј–Ї–Њ–Љ —Г—Б–Є–ї–µ–љ–Є–Є —Д–∞–Ї—В–Њ—А–Њ–≤ –∞–≥—А–µ—Б—Б–Є–Є –Є —В. –і. –Э–∞–њ—А–Њ—В–Є–≤, –і–ї—П —В–Њ–≥–Њ, —З—В–Њ–±—Л H. pylori —Б—В–∞–ї–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М –∞–Ї—В–Є–≤–љ—Г—О –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В—М –Є –≤—Б—В—Г–њ–∞—В—М –≤ —Д–∞–Ј—Г –і–µ–ї–µ–љ–Є—П, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–≤—Л—Б–Є—В—М –Є–љ—В—А–∞–≥–∞—Б—В—А–∞–ї—М–љ—Л–є —А–Э –і–Њ 6,0вАУ7,0 –љ–∞ —Б—А–Њ–Ї –љ–µ –Љ–µ–љ–µ–µ 18 —З –≤ —Б—Г—В–Ї–Є. –Ш–Љ–µ–љ–љ–Њ —Н—В–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –≤ –њ–µ—А–≤—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –Њ–±–Њ—Б–љ–Њ–≤—Л–≤–∞–ї–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –ї–Є—И—М –љ–∞ 4-–µ —Б—Г—В –њ—А–Є–µ–Љ–∞ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞, –Ї–Њ–≥–і–∞ –Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–є –Є –љ–∞–Є–±–Њ–ї–µ–µ —Б—В–∞–±–Є–ї—М–љ—Л–є –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ—Л–є —Н—Д—Д–µ–Ї—В.
–°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М H. pylori —Д–Њ—А–Љ–Є—А–Њ–≤–∞—В—М –±–Є–Њ–њ–ї–µ–љ–Ї–Є
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є J. M. Coticchia et al. –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М H. pylori –Њ–±—А–∞–Ј–Њ–≤—Л–≤–∞—В—М –±–Є–Њ–њ–ї–µ–љ–Ї—Г –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –ґ–µ–ї—Г–і–Ї–∞, –њ–ї–Њ—В–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А–Њ–є –Ј–∞–≤–Є—Б–µ–ї–∞ –Њ—В —Г—А–µ–∞–Ј–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞ [6].–Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ in vivo –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ –±–Њ–ї—М—И–∞—П —З–∞—Б—В—М –Є–Ј –љ–Є—Е —Б—Г—Й–µ—Б—В–≤—Г–µ—В –љ–µ –≤ –≤–Є–і–µ –Њ—В–і–µ–ї—М–љ–Њ –ґ–Є–≤—Г—Й–Є—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –∞ –≤ —Б–Њ—Б—В–∞–≤–µ —Б–ї–Њ–ґ–љ–Њ –Њ—А–≥–∞–љ–Є–Ј–Њ–≤–∞–љ–љ—Л—Е —Б–Њ–Њ–±—Й–µ—Б—В–≤ вАФ –±–Є–Њ–њ–ї–µ–љ–Њ–Ї [7, 8]. –С–Є–Њ–њ–ї–µ–љ–Ї–∞ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –≤—Л–і–µ–ї—П–µ–Љ—Л–є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є —Н–Ї–Ј–Њ–њ–Њ–ї–Є—Б–∞—Е–∞—А–Є–і, –Ї–Њ—В–Њ—А—Л–є –Њ–±—А–∞–Ј—Г–µ—В –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–є –Љ–∞—В—А–Є–Ї—Б, –Њ–Ї—А—Г–ґ–∞—О—Й–Є–є –Љ–Є–Ї—А–Њ–±–љ—Л–µ –Ї–ї–µ—В–Ї–Є –Є –Ј–∞—Й–Є—Й–∞—О—Й–Є–є
–Є—Е –Њ—В –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Њ–Ї—А—Г–ґ–∞—О—Й–µ–є —Б—А–µ–і—Л. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є —Д—Г–љ–Ї—Ж–Є—П–Љ–Є –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–∞—В—А–Є–Ї—Б–∞ —П–≤–ї—П—О—В—Б—П: —Б–Њ–Ј–і–∞–љ–Є–µ –≤–љ—Г—В—А–µ–љ–љ–µ–є —Б—А–µ–і—Л, —Г–і–µ—А–ґ–∞–љ–Є–µ –≤–Њ–і—Л –Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–µ –≤—Л—Б—Л—Е–∞–љ–Є—П, –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –Є —В–Њ–Ї—Б–Є–љ–Њ–≤, —В—А–∞–љ—Б–њ–Њ—А—В –Љ–Њ–ї–µ–Ї—Г–ї, –Ї–Њ–Њ–њ–µ—А–∞—Ж–Є—П –Ї–ї–µ—В–Њ–Ї –Ј–∞ —Б—З–µ—В —Б–Є–≥–љ–∞–ї—М–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї, —Б–≤—П–Ј—Л–≤–∞–љ–Є–µ –≤–µ—Й–µ—Б—В–≤, –њ—А–Њ–љ–Є–Ї–∞—О—Й–Є—Е –≤ —Б–Њ–Њ–±—Й–µ—Б—В–≤–Њ, –≤–Ї–ї—О—З–∞—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є. –°–Њ–і–µ—А–ґ–∞—Й–∞—П—Б—П –≤ –Љ–∞—В—А–Є–Ї—Б–µ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–∞—П –Ф–Э–Ъ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–µ—А–µ—А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—О –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є, –∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–∞—П –њ–ї–µ–љ–Ї–∞ –Ј–∞—Й–Є—Й–∞–µ—В –Њ—В –≤–љ–µ—И–љ–Є—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–є –Є —П–≤–ї—П–µ—В—Б—П –±–∞—А—М–µ—А–Њ–Љ –і–ї—П –≤–µ—Й–µ—Б—В–≤, –≤–Ї–ї—О—З–∞—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є.
–Ь–∞—В—А–Є–Ї—Б —З–∞—Б—В–Њ —П–≤–ї—П–µ—В—Б—П –њ—А–Є—З–Є–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –Ї –і–µ–є—Б—В–≤–Є—О –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –≤ —Б–Њ—Б—В–∞–≤–µ –±–Є–Њ–њ–ї–µ–љ–Ї–Є –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤ 10вАУ1000 —А–∞–Ј). –†–Њ—Б—В —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ј–∞ —Б—З–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є—П –і–Њ—Б—В—Г–њ–∞ –њ—А–µ–њ–∞—А–∞—В–∞ (–Є–Ј-–Ј–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –Љ–∞—В—А–Є–Ї—Б–∞, —Б–љ–Є–ґ–µ–љ–Є—П —Б–≤–Њ–±–Њ–і–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї –Ј–∞ —Б—З–µ—В –Є—Е –Ї–Њ–љ—В–∞–Ї—В–∞ –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є), —Б–≤—П–Ј—Л–≤–∞–љ–Є—П –Є/–Є–ї–Є –Є–љ–∞–Ї—В–Є–≤–∞—Ж–Є–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞, –љ–∞–ї–Є—З–Є—П –Ї–ї–µ—В–Њ–Ї-–њ–µ—А—Б–Є—Б—В–µ—А–Њ–≤, –љ–µ–≤–Њ—Б–њ—А–Є–Є–Љ—З–Є–≤—Л—Е –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ, –∞ —В–∞–Ї–ґ–µ –Ј–∞ —Б—З–µ—В –њ–µ—А–µ—А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –≥–µ–љ–Њ–≤ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ-
—Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є —Б –њ–Њ–Љ–Њ—Й—М—О –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–є –Ф–Э–Ъ –Є/–Є–ї–Є –њ—А—П–Љ–Њ–є –њ–µ—А–µ–і–∞—З–Є –≥–µ–љ–Њ–≤ –Є–Ј –Ї–ї–µ—В–Ї–Є –≤ –Ї–ї–µ—В–Ї—Г [7, 8].
–Э–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ—Л–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ –±–Њ—А—М–±—Л —Б –±–Є–Њ–њ–ї–µ–љ–Ї–∞–Љ–Є —П–≤–ї—П–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Љ–∞–Ї—А–Њ–ї–Є–і–Њ–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ –і–µ–є—Б—В–≤–Њ–≤–∞—В—М –љ–∞ –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ—Л–є –Љ–∞—В—А–Є–Ї—Б. –Э–∞–Є–±–Њ–ї–µ–µ –Њ–±—И–Є—А–љ–Њ–є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –±–∞–Ј–Њ–є –≤ —Н—В–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ–±–ї–∞–і–∞–µ—В –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ. –Э–µ–ї—М–Ј—П –Є—Б–Ї–ї—О—З–∞—В—М, —З—В–Њ –Є–Љ–µ–љ–љ–Њ –±–ї–∞–≥–Њ–і–∞—А—П –і–µ–є—Б—В–≤–Є—О –љ–∞ –Љ–∞—В—А–Є–Ї—Б –±–Є–Њ–њ–ї–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б—Е–µ–Љ, –≤–Ї–ї—О—З–∞—О—Й–Є—Е –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –њ–Њ-–њ—А–µ–ґ–љ–µ–Љ—Г –≤—Л—Б–Њ–Ї–∞, –≤ —В. —З. –Є –њ—А–Є –љ–∞–ї–Є—З–Є–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –Ї –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ—Г —И—В–∞–Љ–Љ–Њ–≤ H. pylori [7].
–Ю–±–Є—В–∞–љ–Є–µ –і–≤—Г—Е —А–∞–Ј–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ H. pylori
–≤ –ґ–µ–ї—Г–і–Ї–µ –Њ–і–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ
–Ю–±–љ–∞—А—Г–ґ–µ–љ–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ–±–Є—В–∞–љ–Є—П –і–≤—Г—Е —А–∞–Ј–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ H. pylori –≤ –ґ–µ–ї—Г–і–Ї–µ –Њ–і–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Њ–±—К—П—Б–љ–Є—В—М –њ—А–Є–Њ–±—А–µ—В–µ–љ–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –њ—Г—В–µ–Љ —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –њ—А–Є –њ–µ—А–µ–і–∞—З–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є —Б –њ–Њ–Љ–Њ—Й—М—О –њ–ї–∞–Ј–Љ–Є–і (—В—А–∞–љ—Б–њ–Њ–Ј–Њ–љ–Њ–≤) –Є–ї–Є –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–є –Ф–Э–Ъ, —Б–Њ–і–µ—А–ґ–∞—Й–µ–є—Б—П –≤ –Љ–∞—В—А–Є–Ї—Б–µ –±–Є–Њ–њ–ї–µ–љ–Њ–Ї [9, 10].–Э–∞–ї–Є—З–Є–µ —Г H. pylori –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ —Н—Д—Д–ї—О–Ї—Б–∞
–Ю–і–љ–Є–Љ –Є–Ј –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, —Б–љ–Є–ґ–∞—О—Й–Є—Е —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М H. pylori –Ї —А—П–і—Г –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (—В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ, –Љ–µ—В—А–Њ–љ–Є–і–∞–Ј–Њ–ї –Є —В. –і.), —П–≤–ї—П–µ—В—Б—П –Љ–µ—Е–∞–љ–Є–Ј–Љ —Н—Д—Д–ї—О–Ї—Б–∞, –Ї–Њ—В–Њ—А—Л–є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –≤—Л–≤–µ–і–µ–љ–Є–µ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –≤–µ—Й–µ—Б—В–≤ (–≤ —В. —З. –Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤) –Є–Ј –Љ–Є–Ї—А–Њ–±–љ–Њ–є –Ї–ї–µ—В–Ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е —Н—Д—Д–ї—О–Ї—Б-–њ–Њ–Љ–њ (–±–µ–ї–Ї–Є-—В—А–∞–љ—Б–њ–Њ—А—В–µ—А—Л –≤ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ–Љ–±—А–∞–љ–µ). –†–∞–Ј–ї–Є—З–∞—О—В –∞–Ї—В–Є–≤–љ—Л–µ (–њ–µ—А–≤–Є—З–љ—Л–µ) —Н—Д—Д–ї—О–Ї—Б-–њ–Њ–Љ–њ—Л, –Ї–Њ—В–Њ—А—Л–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —Н–љ–µ—А–≥–Є—О, –Њ—Б–≤–Њ–±–Њ–ґ–і–∞—О—Й—Г—О—Б—П –њ—А–Є –≥–Є–і—А–Њ–ї–Є–Ј–µ –∞–і–µ–љ–Њ–Ј–Є–љ—В—А–Є—Д–Њ—Б—Д–∞—В–∞, –Є –њ–∞—Б—Б–Є–≤–љ—Л–µ (–≤—В–Њ—А–Є—З–љ—Л–µ), –Ї–Њ—В–Њ—А—Л–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А—Г—О—В –±–µ–Ј –Ј–∞—В—А–∞—В—Л —Н–љ–µ—А–≥–Є–Є вАФ –Ј–∞ —Б—З–µ—В —А–∞–Ј–љ–Є—Ж—Л —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞, —Б–Њ–Ј–і–∞–≤–∞–µ–Љ–Њ–є –њ—А–Є –Њ—В–Ї–∞—З–Ї–µ –Є–Њ–љ–Њ–≤ –≤–Њ–і–Њ—А–Њ–і–∞ –Є –љ–∞—В—А–Є—П [9, 10]. –У–µ–љ—Л, –Ї–Њ–і–Є—А—Г—О—Й–Є–µ —Н—Д—Д–ї—О–Ї—Б-—Б–Є—Б—В–µ–Љ—Л, —А–∞—Б–њ–Њ–ї–∞–≥–∞—О—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –≤ —Е—А–Њ–Љ–Њ—Б–Њ–Љ–∞—Е, –љ–Њ –Є –≤ –њ–ї–∞–Ј–Љ–Є–і–∞—Е (—В—А–∞–љ—Б–њ–Њ–Ј–Њ–љ–∞—Е), —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –ї–µ–≥–Ї–Њ—Б—В—М –Є—Е –њ–µ—А–µ–і–∞—З–Є. –≠–Ї—Б–њ—А–µ—Б—Б–Є—П —Н—В–Є—Е –≥–µ–љ–Њ–≤ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ—В–±–Њ—А—Г —И—В–∞–Љ–Љ–Њ–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е —Н—Д—Д–ї—О–Ї—Б-–Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є. –Ю–њ—А–µ–і–µ–ї–µ–љ–љ—Л–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –і–∞–љ–љ—Л–µ –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–Љ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є –Ш–Я–Я —Б —Н—Д—Д–ї—О–Ї—Б-–њ–Њ–Љ–њ–∞–Љ–Є –≤–≤–Є–і—Г –Є—Е —Б—В—А—Г–Ї—В—Г—А–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Є–Є. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ–Њ–Љ–Є–Љ–Њ —Б—Г–њ—А–µ—Б—Б–Є–Є –њ—А–Њ–і—Г–Ї—Ж–Є–Є —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Ш–Я–Я –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М –Є–љ–≥–Є–±–Є—А—Г—О—Й–µ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ —Н—Д—Д–ї—О–Ї—Б-–њ–Њ–Љ–њ—Л, —Б–љ–Є–ґ–∞—П —А–µ–Ј–Є—Б—В–Є–≤–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї H. pylori [11, 12].–Ч–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Њ—В –≤–∞—А–Є–∞–љ—В–∞ —В–µ—З–µ–љ–Є—П —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –Є–ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–∞—Б—В—А–Є—В–∞
–Ч–∞–љ–Є–Љ–∞—П—Б—М –ї–µ—З–µ–љ–Є–µ–Љ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –Љ—Л —Б—В–Њ–ї–Ї–љ—Г–ї–Є—Б—М —Б —В–µ–Љ —Д–∞–Ї—В–Њ–Љ, —З—В–Њ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori —Б—В–∞–љ–і–∞—А—В–љ—Л–µ —Б—Е–µ–Љ—Л –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є —П–Ј–≤—Л –±—Л–ї–Є –Љ–µ–љ–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л, —З–µ–Љ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (—А–Є—Б. 2) [10].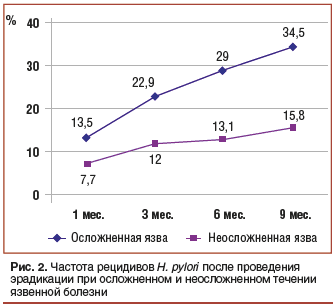
–Ґ–∞–Ї, –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л—Е –Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Є–Љ–Є —Б–Њ–≥–ї–∞—И–µ–љ–Є—П–Љ–Є —Б—Е–µ–Љ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–ї–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ H. pylori –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –љ–∞–±–ї—О–і–µ–љ–Є—П (9 –Љ–µ—Б.) —Г 84,2% –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Х—Б–ї–Є —В–µ –ґ–µ —Б—Е–µ–Љ—Л –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М –±–Њ–ї—М–љ—Л–Љ, —Г –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Њ –Ї–∞–Ї–Њ–µ-–ї–Є–±–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–µ, —В–Њ —А–µ—Ж–Є–і–Є–≤ –Є–љ—Д–µ–Ї—Ж–Є–Є H. pylori —З–µ—А–µ–Ј 9 –Љ–µ—Б. –љ–∞–±–ї—О–і–∞–ї—Б—П —Г 34,5% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є —Н—В–Њ–Љ —З–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Ј–∞–≤–Є—Б–µ–ї–∞ –Њ—В –≤–∞—А–Є–∞–љ—В–∞ —В–µ—З–µ–љ–Є—П —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –Є –≤–Є–і–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П. –Т –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–Љ –Њ—В–і–µ–ї—М–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–∞–Љ —Г–і–∞–ї–Њ—Б—М –≤—Л–і–µ–ї–Є—В—М –Ї—Г–ї—М—В—Г—А—Л H. pylori –Є –Є–Ј—Г—З–Є—В—М –Є—Е —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ —Г 21 –Є–Ј 50 –±–Њ–ї—М–љ—Л—Е —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –≥–∞—Б—В—А–Є—В–Њ–Љ –Є 15 –Є–Ј 27 –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О. –°–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ —Н—В–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –љ–µ –≤—Л—П–≤–Є–ї–Њ –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –≤ —Н—В–Є—Е –≥—А—Г–њ–њ–∞—Е.
–Э–∞–є—В–Є –Њ–±—К—П—Б–љ–µ–љ–Є–µ —Н—В–Њ–Љ—Г —Д–∞–Ї—В—Г –≤ –і–Њ—Б—В—Г–њ–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ –љ–∞–Љ –љ–µ —Г–і–∞–ї–Њ—Б—М, –њ–Њ—Н—В–Њ–Љ—Г –Љ—Л –њ—А–Њ–≤–µ–ї–Є –Њ–±–Њ–±—Й–µ–љ–Є–µ –Є —Б–Є—Б—В–µ–Љ–∞—В–Є–Ј–∞—Ж–Є—О —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —А—П–і–∞ —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –Є–Ј—Г—З–µ–љ–Є—О –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є —В–µ—З–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–Є H. pylori –њ—А–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є [10].
–£–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї–Њ–Ї–Ї–Њ–≤—Л—Е —Д–Њ—А–Љ H. pylori –њ—А–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П—Е —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є
–Ш–Љ–Љ—Г–љ–Њ—Ж–Є—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–µ –Є–Ј—Г—З–µ–љ–Є–µ –Љ–∞–Ј–Ї–Њ–≤-–Њ—В–њ–µ—З–∞—В–Ї–Њ–≤ –±–Є–Њ–њ—В–∞—В–Њ–≤, –≤–Ј—П—В—Л—Е —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–Љ–Є –≤–∞—А–Є–∞–љ—В–∞–Љ–Є —В–µ—З–µ–љ–Є—П —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–Ї–Ї–Њ–≤—Л—Е —Д–Њ—А–Љ H. pylori –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (—А–Є—Б. 3), —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –љ–∞—З–∞–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є –і–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е —Б—А–µ–і—Б—В–≤.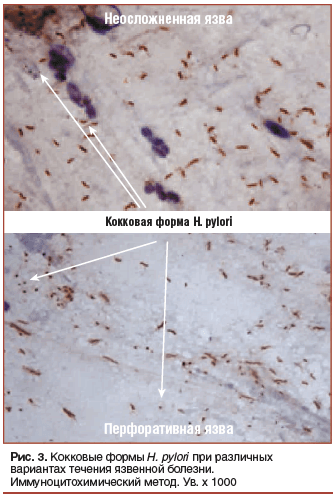
–°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –≤—Л–ґ–Є–≤–∞—В—М –≤–љ—Г—В—А–Є —Д–∞–≥–Њ—Ж–Є—В–Њ–≤
–Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –Љ–∞–Ј–Ї–Њ–≤-–Њ—В–њ–µ—З–∞—В–Ї–Њ–≤ —Г —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –±–Њ–ї—М–љ—Л—Е –Љ—Л —В–∞–Ї–ґ–µ –Њ–±—А–∞—В–Є–ї–Є –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ –љ–µ–є—В—А–Њ—Д–Є–ї—Л, –±—Г–Ї–≤–∞–ї—М–љ–Њ ¬Ђ–љ–∞—Д–∞—А—И–Є—А–Њ–≤–∞–љ–љ—Л–µ¬ї –∞–Ї—В–Є–≤–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є H. pylori (—А–Є—Б. 4), –Ї–Њ—В–Њ—А—Л–µ –≤—Б—В—А–µ—З–∞–ї–Є—Б—М —З–∞—Й–µ –≤—Б–µ–≥–Њ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є [10].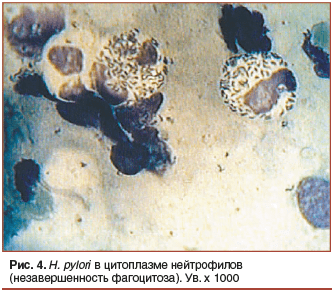
–Я–Њ—Б–ї–µ–і—Г—О—Й–µ–µ –Є–Ј—Г—З–µ–љ–Є–µ –ї–Є—В–µ—А–∞—В—Г—А—Л –≤ –њ–Њ–Є—Б–Ї–∞—Е –Њ–±—К—П—Б–љ–µ–љ–Є—П —Н—В–Њ–≥–Њ —Д–∞–Ї—В–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ H. pylori –Њ–±–ї–∞–і–∞—О—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –≤—Л–ґ–Є–≤–∞—В—М –≤–љ—Г—В—А–Є —Д–∞–≥–Њ—Ж–Є—В–Њ–≤ –Ј–∞ —Б—З–µ—В –≤—Л—А–∞–±–Њ—В–Ї–Є –Ї–∞—В–∞–ї–∞–Ј—Л –Є —Б—Г–њ–µ—А–Њ–Ї—Б–Є–і–і–Є—Б–Љ—Г—В–∞–Ј—Л, –Ї–Њ—В–Њ—А—Л–µ –±–ї–Њ–Ї–Є—А—Г—О—В –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Є –љ–µ–Ј–∞–≤–µ—А—И–µ–љ–љ–Њ—Б—В–Є —Д–∞–≥–Њ—Ж–Є—В–Њ–Ј–∞. –°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –љ–∞ —Н—В–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л –Љ–Њ–≥—Г—В –њ–Њ–і–µ–є—Б—В–≤–Њ–≤–∞—В—М —В–Њ–ї—М–Ї–Њ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є —Б –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ–Њ–і–Њ–±–љ—Л–µ –љ–µ–є—В—А–Њ—Д–Є–ї—Л –Љ–Њ–≥—Г—В —Б–ї—Г–ґ–Є—В—М –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —А–µ—Ж–Є–і–Є–≤–∞ –Є–љ—Д–µ–Ї—Ж–Є–Є –њ–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —З—В–Њ –і–Є–Ї—В—Г–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–Њ–ї–µ—З–Є–≤–∞–љ–Є—П —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ї–Њ–ї–ї–Њ–Є–і–љ–Њ–≥–Њ –≤–Є—Б–Љ—Г—В–∞ –Є–ї–Є –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤.
–Ш–љ–≤–∞–Ј–Є—П H. pylori –≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –≤–∞–Ї—Г–Њ–ї–µ–є
–Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –±–Є–Њ–њ—В–∞—В–Њ–≤ –Љ—Л —В–∞–Ї–ґ–µ –Ј–∞–Љ–µ—В–Є–ї–Є, –Ї–∞–Ї H. pylori –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤ —Б–ї–Є–Ј–Є—Б—В—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –≤–∞–Ї—Г–Њ–ї–µ–є (—А–Є—Б. 5) [10].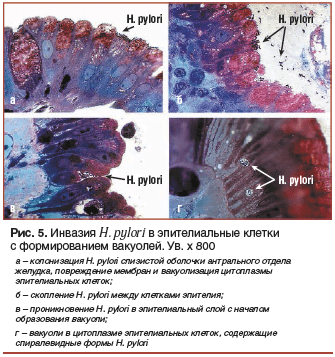
–Я—А–Є—З–µ–Љ —Н—В–Њ—В —Д–µ–љ–Њ–Љ–µ–љ –љ–∞–±–ї—О–і–∞–ї—Б—П —В–Њ–ї—М–Ї–Њ —Г –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ вАФ –њ—А–Є –њ–µ—А—Д–Њ—А–∞—Ж–Є–Є. –≠—В–Њ —В–∞–Ї–ґ–µ –Љ–Њ–≥–ї–Њ –±—Л—В—М –Њ–і–љ–Є–Љ –Є–Ј —Д–∞–Ї—В–Њ—А–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –Њ–±—К—П—Б–љ—П—О—В —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М H. pylori –Ї –і–µ–є—Б—В–≤–Є—О –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, —В. –Ї. –≤–љ—Г—В—А—М –≤–∞–Ї—Г–Њ–ї–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Є –њ—А–Њ–љ–Є–Ї–∞—В—М –љ–µ —Б–њ–Њ—Б–Њ–±–љ—Л. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞—Е–Њ–і—П—Й–Є–µ—Б—П –≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–є –≤–∞–Ї—Г–Њ–ї–Є –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ—Л–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л –њ—А–Є –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–Љ —А–∞–Ј—А—Г—И–µ–љ–Є–Є —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –≤–∞–Ї—Г–Њ–ї–µ–є —Б–њ–Њ—Б–Њ–±–љ—Л –≤—Л—Е–Њ–і–Є—В—М –≤ –Њ–Ї—А—Г–ґ–∞—О—Й—Г—О –њ—А–Є—Б—В–µ–љ–Њ—З–љ—Г—О —Б–ї–Є–Ј—М –Є —Б–ї—Г–ґ–Є—В—М –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —А–µ—Ж–Є–і–Є–≤–∞ –Є–љ—Д–µ–Ї—Ж–Є–Є H. pylori. –Э–∞–ї–Є—З–Є–µ –њ–Њ–і–Њ–±–љ–Њ–≥–Њ —Д–µ–љ–Њ–Љ–µ–љ–∞ –і–Є–Ї—В—Г–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є –Ї—Г—А—Б–Њ–≤–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ї–Њ–ї–ї–Њ–Є–і–љ–Њ–≥–Њ –≤–Є—Б–Љ—Г—В–∞ (–Ї–∞–Ї –≤–∞—А–Є–∞–љ—В –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є), –љ–µ —В–Њ–ї—М–Ї–Њ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—Й–Є—Е –±–∞—А—М–µ—А–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, –љ–Њ –Є –Њ–±–ї–∞–і–∞—О—Й–Є—Е –∞–љ—В–Є—Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є.
–°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М H. pylori –Ї –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є
–Ф–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П —Н—В–Њ–≥–Њ —Д–µ–љ–Њ–Љ–µ–љ–∞ –љ–∞–Љ–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–Њ–і–∞, –Ї–Њ—В–Њ—А—Л–є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ—Ж–µ–љ–Є—В—М —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –∞–љ—В–Є–≥–µ–љ–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ H. pylori –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е —Б–ї–Њ—П—Е —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, —Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В–∞—Е –Є –Ї–ї–µ—В–Ї–∞—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є–љ—Д–Є–ї—М—В—А–∞—В–∞ [10]. –≠—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ —В–Њ–ї—М–Ї–Њ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Њ –љ–∞–ї–Є—З–Є–µ –њ–Њ–і–Њ–±–љ–Њ–≥–Њ —П–≤–ї–µ–љ–Є—П, –љ–Њ –Є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Є–Ј—Г—З–Є—В—М –µ–≥–Њ –±–Њ–ї–µ–µ –і–µ—В–∞–ї—М–љ–Њ. –Ю–±–љ–∞—А—Г–ґ–µ–љ–љ—Л–µ –љ–∞–Љ–Є –≤–∞—А–Є–∞–љ—В—Л —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є—П H. pylori –Є/–Є–ї–Є –µ–≥–Њ –∞–љ—В–Є–≥–µ–љ–Њ–≤ –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –∞–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –ґ–µ–ї—Г–і–Ї–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ 6.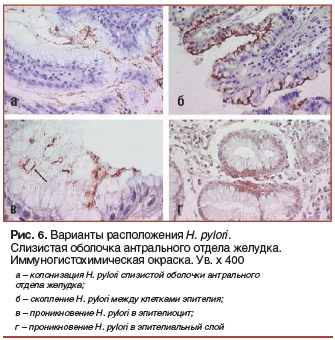
–Ю–±–љ–∞—А—Г–ґ–µ–љ–Є–µ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є –Њ–Ї—А–∞—И–µ–љ–љ—Л—Е –∞–љ—В–Є–≥–µ–љ–Њ–≤ H. pylori, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –≤ —Б–ї–Њ–µ —Б–ї–Є–Ј–Є, –Љ–µ–ґ–і—Г —Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В–∞–Љ–Є, –≤ —Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В–∞—Е, —Б—В—А–Њ–Љ–µ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Є —Б—А–µ–і–Є –Ї–ї–µ—В–Њ–Ї –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є–љ—Д–Є–ї—М—В—А–∞—В–∞ –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ H. pylori —Б–њ–Њ—Б–Њ–±–µ–љ –њ—А–Њ–љ–Є–Ї–∞—В—М –≤ —Б—Г–±—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–є —Б–ї–Њ–є –Є —Б–Њ—Е—А–∞–љ—П—В—М—Б—П —В–∞–Љ –≤ –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ–Љ –Є–ї–Є —А–∞–Ј—А—Г—И–µ–љ–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–µ —Б–Њ–њ–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є, –≤–∞—А–Є–∞–љ—В–∞ –Є –њ–µ—А–Є–Њ–і–∞ —В–µ—З–µ–љ–Є—П —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Б —З–∞—Б—В–Њ—В–Њ–є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –∞–љ—В–Є–≥–µ–љ–∞ H. pylori –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –Њ–љ–∞:
–Љ–Є–љ–Є–Љ–∞–ї—М–љ–∞ –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є HCl –Є –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ—А–Є –≥–Є–њ–µ—А—Б–µ–Ї—А–µ—Ж–Є–Є (—Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є –≤ –њ—А–Є—Б—В–µ–љ–Њ—З–љ–Њ–є —Б–ї–Є–Ј–Є), —Б–љ–Є–ґ–µ–љ–Є–Є —А–Э –∞–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –ґ–µ–ї—Г–і–Ї–∞, –њ–Њ—В–µ—А–µ –Є–ї–Є —Б–љ–Є–ґ–µ–љ–Є–Є
–µ–µ –љ–µ–є—В—А–∞–ї–Є–Ј—Г—О—Й–µ–є —Д—Г–љ–Ї—Ж–Є–Є;
–Ј–∞–≤–Є—Б–Є—В –Њ—В –≤–∞—А–Є–∞–љ—В–∞ —В–µ—З–µ–љ–Є—П —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є (–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞ –њ—А–Є –њ–µ—А—Д–Њ—А–∞—Ж–Є–Є –Є –љ–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –≥–∞—Б—В—А–Є—В–µ);
–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞ –≤ –њ–µ—А–Є–Њ–і —А—Г–±—Ж–µ–≤–∞–љ–Є—П –Ј–∞ —Б—З–µ—В –∞–Ї—В–Є–≤–љ–Њ–≥–Њ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П –∞–љ—В–Є–≥–µ–љ–∞ –Ї–ї–µ—В–Ї–∞–Љ–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є–љ—Д–Є–ї—М—В—А–∞—В–∞ (–≤ —В. —З. –љ–µ–є—В—А–Њ—Д–Є–ї–∞–Љ–Є).
–Ю–±–љ–∞—А—Г–ґ–µ–љ–љ—Л–µ —Д–∞–Ї—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є (–њ—А–Є –љ–∞–ї–Є—З–Є–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є) –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –њ—А–Є–µ–Љ–∞ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ—А–Њ–і–Њ–ї–ґ–Є—В—М –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –њ—А–Њ—В–Є–≤–Њ—П–Ј–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–є –љ–∞ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –ґ–µ–ї—Г–і–Ї–∞ –Є –Ф–Я–Ъ.
–Т –і–∞–ї—М–љ–µ–є—И–µ–Љ, –њ–Њ –Љ–µ—А–µ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –Ј–∞—Й–Є—В–љ—Л—Е (–±–∞—А—М–µ—А–љ—Л—Е) —Б–≤–Њ–є—Б—В–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –ґ–Є–Ј–љ–µ—Б–њ–Њ—Б–Њ–±–љ—Л—Е –±–∞–Ї—В–µ—А–Є–є –њ–Њ–ї–љ–Њ–µ –Њ—З–Є—Й–µ–љ–Є–µ —Б—Г–±—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–≥–Њ —Б–ї–Њ—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ—В –∞–љ—В–Є–≥–µ–љ–∞ H. pylori –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ —Б—А–Њ–Ї–Є –Њ—В 1 –і–Њ 3 –Љ–µ—Б. –≠—В–Њ—В —Д–∞–Ї—В –Њ–±—К—П—Б–љ—П–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–Њ–ї—Г—З–µ–љ–Є—П –≤ —Г–Ї–∞–Ј–∞–љ–љ—Л–µ —Б—А–Њ–Ї–Є –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –µ—Б–ї–Є –±–Є–Њ–њ—В–∞—В—Л –Є–ї–Є –Ї–∞–ї –Є—Б—Б–ї–µ–і—Г—О—В—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О –Ш–§–Р –Є–ї–Є –Я–¶–†.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ—Б–љ–Њ–≤–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є вАФ —Н—В–Њ:
–љ–∞–ї–Є—З–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–Ї–Ї–Њ–≤—Л—Е –Є U-—Д–Њ—А–Љ;
—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М H. pylori —Д–Њ—А–Љ–Є—А–Њ–≤–∞—В—М –±–Є–Њ–њ–ї–µ–љ–Ї–Є;
–њ—А–Є–Њ–±—А–µ—В–µ–љ–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –њ—Г—В–µ–Љ —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –Њ–±–Є—В–∞–љ–Є—П –і–≤—Г—Е —А–∞–Ј–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ H. pylori –≤ –ґ–µ–ї—Г–і–Ї–µ –Њ–і–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ;
–љ–∞–ї–Є—З–Є–µ —Г H. pylori –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ —Н—Д—Д–ї—О–Ї—Б–∞, –Ї–Њ—В–Њ—А—Л–є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Б–љ–Є–ґ–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї —А—П–і—Г –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (—В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ, –Љ–µ—В—А–Њ–љ–Є–і–∞–Ј–Њ–ї –Є —В. –і.)
–Ј–∞ —Б—З–µ—В –∞–Ї—В–Є–≤–љ—Л—Е —Н—Д—Д–ї—О–Ї—Б-–њ–Њ–Љ–њ –Є–ї–Є –њ–∞—Б—Б–Є–≤–љ—Л—Е
—В—А–∞–љ—Б–њ–Њ—А—В–µ—А–Њ–≤ –Є–Ј-–Ј–∞ —А–∞–Ј–љ–Є—Ж—Л —Н–ї–µ–Ї—В—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞;
–Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Њ—В –≤–∞—А–Є–∞–љ—В–∞ —В–µ—З–µ–љ–Є—П —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –Є–ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–∞—Б—В—А–Є—В–∞;
—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –≤—Л–ґ–Є–≤–∞—В—М –≤–љ—Г—В—А–Є —Д–∞–≥–Њ—Ж–Є—В–Њ–≤ –Ј–∞ —Б—З–µ—В —Б–љ–Є–ґ–µ–љ–Є—П —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤ –Є –љ–µ–Ј–∞–≤–µ—А—И–µ–љ–љ–Њ—Б—В–Є —Д–∞–≥–Њ—Ж–Є—В–Њ–Ј–∞;
–Є–љ–≤–∞–Ј–Є—П H. pylori –≤ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –≤–∞–Ї—Г–Њ–ї–µ–є;
—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М H. pylori –Ї –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є: –≤ —Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В–∞—Е –Є —Б—В—А–Њ–Љ–µ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –ґ–µ–ї—Г–і–Ї–∞ –Є —Б—А–µ–і–Є –Ї–ї–µ—В–Њ–Ї –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є–љ—Д–Є–ї—М—В—А–∞—В–∞.
II. –Э–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ –≤–Њ–њ—А–Њ—Б–Њ–≤ –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В—Б—П –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ–Љ —Б–њ–Њ—Б–Њ–±–Њ–≤ –њ–Њ–≤—Л—И–µ–љ–Є—П –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–ї–Є –і–Њ—Б—А–Њ—З–љ–Њ–≥–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –ї–µ—З–µ–љ–Є—П –Є–Ј-–Ј–∞ —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ–Њ–і–Њ–±–љ–Њ–є —В–µ—А–∞–њ–Є–Є [1, 2, 13]. –Ш –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ —Г—Б—В–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А–Є—А–Њ–≤–∞–љ–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В—Г, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є, —Ж–µ–ї–Є, —Е–∞—А–∞–Ї—В–µ—А–∞ –Є —А–µ–≥—Г–ї—П—А–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П, –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ —В–µ—А–∞–њ–Є–Є, –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –њ–Њ–≤—Л—И–∞—О—В –µ–≥–Њ –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В—М (–і–Њ 92,1%) –Є, –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Н—В–Њ–≥–Њ, вАФ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б —В–∞–Ї–Њ–≤–Њ–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–Є–≤—И–Є—Е —В–Њ–ї—М–Ї–Њ –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є–Њ–љ–љ—Л–є –±–ї–∞–љ–Ї —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –њ–Њ –ї–µ—З–µ–љ–Є—О (94,7% –њ—А–Њ—В–Є–≤ 73,7%; p = 0,02) [13].–Э–µ —Б—В–∞–≤—П –њ–Њ–і —Б–Њ–Љ–љ–µ–љ–Є–µ –≤–∞–ґ–љ–Њ—Б—В—М —Н—В–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –Љ—Л —Е–Њ—В–µ–ї–Є –±—Л –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ –≤–Њ–њ—А–Њ—Б, –Ї–Њ—В–Њ—А—Л–є –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ –Њ–±—Б—Г–ґ–і–∞–µ—В—Б—П, вАФ –Ї–∞—З–µ—Б—В–≤–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –≤ —Б—Е–µ–Љ–∞—Е —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ—Л—Е –Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Т–µ–і—М –Є–Љ–µ–љ–љ–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ –≤–љ—Г—В—А–Є–ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ —А–Э > 6,0 –љ–µ –Љ–µ–љ–µ–µ 18 —З/—Б—Г—В, –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –і–ї—П –∞–Ї—В–Є–≤–љ–Њ–є –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є, –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–Є –Ї–Њ–Ї–Ї–Њ–≤—Л—Е –Є U-—Д–Њ—А–Љ –Є –њ–µ—А–µ—Е–Њ–і–∞ H. pylori –≤ —Д–∞–Ј—Г –і–µ–ї–µ–љ–Є—П, —П–≤–ї—П–µ—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ —Г—Б–ї–Њ–≤–Є–µ–Љ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Љ—Л —Б—В–∞–ї–Ї–Є–≤–∞–µ–Љ—Б—П —Б —А–∞–Ј–ї–Є—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
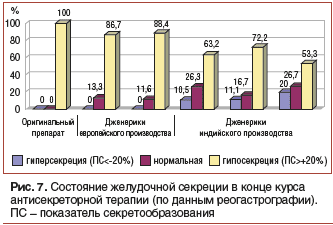
–Т –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є–Љ–µ—А–∞ —Е–Њ—В–µ–ї–Њ—Б—М –±—Л –њ—А–Є–≤–µ—Б—В–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ –Є –µ–≥–Њ –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤, –њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ—Л—Е –і–≤—Г–Љ—П –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є–Љ–Є –Є —В—А–µ–Љ—П –Є–љ–і–Є–є—Б–Ї–Є–Љ–Є –Ї–Њ–Љ–њ–∞–љ–Є—П–Љ–Є [10]. –£–Ї–∞–Ј–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М –љ–∞–Љ–Є 128 –±–Њ–ї—М–љ—Л–Љ —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є 2 —А./—Б—Г—В (—Г—В—А–Њ–Љ –Є –≤–µ—З–µ—А–Њ–Љ) –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ 40 –Љ–≥. –Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–Є–љ–Є–Љ–∞–ї–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –≤ –њ–Њ–ї–љ–Њ–Љ –Њ–±—К–µ–Љ–µ. –Ъ–Њ–љ—В—А–Њ–ї—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є –Љ–µ—В–Њ–і–Њ–Љ —А–µ–Њ–≥–∞—Б—В—А–Њ–≥—А–∞—Д–Є–Є –љ–∞ 10-–µ —Б—Г—В. –Я—А–Є –Њ—Ж–µ–љ–Ї–µ —Б—А–µ–і–љ–Є—Е –Ј–љ–∞—З–µ–љ–Є–є —А–Э –≤ —В–µ–ї–µ –ґ–µ–ї—Г–і–Ї–∞ –љ–∞–Љ–Є –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Ю–і–љ–∞–Ї–Њ –∞–љ–∞–ї–Є–Ј —З–∞—Б—В–Њ—В—Л —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —Б–µ–Ї—А–µ—В–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ, —Б–љ–Є–ґ–µ–љ–љ—Л–Љ –Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є—П–Љ —Б–µ–Ї—А–µ—Ж–Є–Є –≤—Л—П–≤–Є–ї –љ–µ–Ї–Њ—В–Њ—А—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ –Є—Е –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є.
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј —А–Є—Б—Г–љ–Ї–∞ 7, –Є–Љ–µ–љ–љ–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б—В–∞–±–Є–ї—М–љ–Њ–≥–Њ –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ (–љ–Њ—А–Љ–∞–ї—М–љ–∞—П –Є–ї–Є –≥–Є–њ–µ—А—Б–µ–Ї—А–µ—Ж–Є—П –Э–°l, –∞ –љ–µ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ —А–Э = 6,0вАУ7,0), —З–∞—Б—В–Њ—В–∞ –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ –Є–љ–і–Є–є—Б–Ї–Њ–≥–Њ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ 27,8% –Є 36,8%, –∞ —Г —Б–∞–Љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–∞–µ–Љ–Њ–≥–Њ –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ –і–ґ–µ–љ–µ—А–Є–Ї–∞ вАФ 46,7%, –∞ –љ–µ –љ–∞–ї–Є—З–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ —И—В–∞–Љ–Љ–Њ–≤ —Г –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –±–Њ–ї—М–љ–Њ–≥–Њ –Љ–Њ–ґ–µ—В –ї–µ–ґ–∞—В—М –≤ –Њ—Б–љ–Њ–≤–µ –љ–Є–Ј–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л—Е —Б—Е–µ–Љ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ф—А—Г–≥–Є–Љ –њ—А–Є–Љ–µ—А–Њ–Љ —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞ –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ —П–≤–ї—П–µ—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ C. H. Nightingale [14], –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –≤ 2005 –≥. –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О 40 –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Є–Ј 18 —Б—В—А–∞–љ –Љ–Є—А–∞. –Ю–Ї–∞–Ј–∞–ї–Њ—Б—М, —З—В–Њ 34% –Њ–±—А–∞–Ј—Ж–Њ–≤ –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–ї–Є –Љ–µ–љ—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Ј–∞ 30-–Љ–Є–љ—Г—В–љ—Л–є –њ–µ—А–Є–Њ–і, —З–µ–Љ –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–є –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –њ—А–Є –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є 70% –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ –≤ —Ж–µ–ї–Њ–Љ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–ї–Є –Љ–µ–љ—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ, 20% –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ –љ–µ —Б–Њ–і–µ—А–ґ–∞–ї–Є —Г–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ –љ–∞ —Г–њ–∞–Ї–Њ–≤–Ї–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞, —Г 13 –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є—Е –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ –Є–Ј 21 –≤—Л—П–≤–ї–µ–љ–Њ –њ—А–µ–≤—Л—И–µ–љ–Є–µ —В—А–µ–±—Г–µ–Љ–Њ–≥–Њ 0,8% —Г—А–Њ–≤–љ—П –њ—А–Є–Љ–µ—Б–Є 6,11-–і–Є–Њ–Ї—Б–Є-–Љ–µ—В–Є–ї—Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Р. –° —Г—З–µ—В–Њ–Љ —В–Њ–≥–Њ —Д–∞–Ї—В–∞, —З—В–Њ –і–∞–ґ–µ –љ–µ–±–Њ–ї—М—И–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –≤ —Б–ї–Њ–µ –њ—А–Є—Б—В–µ–љ–Њ—З–љ–Њ–є –ґ–µ–ї—Г–і–Њ—З–љ–Њ–є —Б–ї–Є–Ј–Є –Љ–µ–љ—П–µ—В –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ –±–∞–Ї—В–µ—А–Є–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–µ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞ –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –Њ–і–љ–Њ–є –Є–Ј –њ—А–Є—З–Є–љ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
III. –Э–µ–∞–і–µ–Ї–≤–∞—В–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori
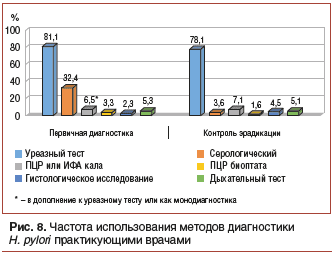
–Х—Й–µ –Њ–і–љ–Є–Љ –≤–∞–ґ–љ—Л–Љ –∞—Б–њ–µ–Ї—В–Њ–Љ –≤ –Њ—Ж–µ–љ–Ї–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori —П–≤–ї—П–µ—В—Б—П –∞–і–µ–Ї–≤–∞—В–љ–Њ—Б—В—М –Ї–Њ–љ—В—А–Њ–ї—П, –≤–µ–і—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–Є—Б–ї–∞ –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Б–Њ–Ј–і–∞–µ—В –≤–њ–µ—З–∞—В–ї–µ–љ–Є–µ –Њ ¬Ђ–Љ–∞–ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є¬ї –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е —Б—Е–µ–Љ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є —А–Њ—Б—В–µ ¬Ђ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є¬ї H. pylori –Ї —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л–Љ —Б—Е–µ–Љ–∞–Љ. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г –≤ —Б–Њ–≥–ї–∞—И–µ–љ–Є—П—Е ¬Ђ–Ь–∞–∞—Б—В—А–Є—Е—В V¬ї —Г–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П, —З—В–Њ –±—Л—Б—В—А—Л–є —Г—А–µ–∞–Ј–љ—Л–є —В–µ—Б—В (–С–£–Ґ) –Љ–Њ–ґ–µ—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –Ї–∞–Ї –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–є —В–µ—Б—В –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Є–Љ–µ—О—В—Б—П –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П —Н–љ–і–Њ—Б–Ї–Њ–њ–Є–Є –Є –љ–µ—В –љ–Є–Ї–∞–Ї–Є—Е –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–є –і–ї—П –±–Є–Њ–њ—Б–Є–Є. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В —В–µ—Б—В–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞—З–∞—В—М –љ–µ–Љ–µ–і–ї–µ–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ. –Х–≥–Њ –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤ –Ї–∞—З–µ—Б—В–≤–µ —В–µ—Б—В–∞ –і–ї—П –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori –њ–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П (–£—В–≤–µ—А–ґ–і–µ–љ–Є–µ 3). –Ф–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori –ї—Г—З—И–Є–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –њ—А–Є–Ј–љ–∞–µ—В—Б—П —Г—А–µ–∞–Ј–љ—Л–є –і—Л—Е–∞—В–µ–ї—М–љ—Л–є —В–µ—Б—В. –Т –Ї–∞—З–µ—Б—В–≤–µ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤—Л –њ—А–µ–і–ї–∞–≥–∞–µ—В—Б—П —В–µ—Б—В —Б –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л–Љ–Є –∞–љ—В–Є—В–µ–ї–∞–Љ–Є –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –∞–љ—В–Є–≥–µ–љ–Њ–≤ H. pylori –≤ –Ї–∞–ї–µ (–£—В–≤–µ—А–ґ–і–µ–љ–Є–µ 10) [15].–Я—А–Њ–≤–µ–і–µ–љ–љ—Л–є –љ–∞–Љ–Є –∞–љ–∞–ї–Є–Ј –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е –Ї–∞—А—В –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –≤—А–∞—З–Є –њ—А–µ–і–њ–Њ—З–Є—В–∞—О—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –С–£–Ґ –Ї–∞–Ї –і–ї—П –њ–µ—А–≤–Є—З–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є H. pylori, —В–∞–Ї –Є –і–ї—П –Њ—Ж–µ–љ–Ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (—А–Є—Б. 8).
–Я–Њ—Н—В–Њ–Љ—Г –Љ—Л –њ—А–Њ–≤–µ–ї–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Г—О –Њ—Ж–µ–љ–Ї—Г –і–≤—Г—Е –љ–∞–Є–±–Њ–ї–µ–µ –њ–Њ–њ—Г–ї—П—А–љ—Л—Е –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ —Н–Ї—Б–њ—А–µ—Б—Б-—В–µ—Б—В–Њ–≤ –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Г—А–µ–∞–Ј–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є H. pylori –≤ –±–Є–Њ–њ—В–∞—В–µ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є —Д–Є–љ—Б–Ї–Њ–≥–Њ –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї–µ–є. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Њ—И–ї–Є 77 –±–Њ–ї—М–љ—Л—Е —Б H. pylori-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–Є—В–Њ–Љ –Є —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –≤–∞—А–Є–∞–љ—В–∞–Љ–Є —В–µ—З–µ–љ–Є—П —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –Ф–Я–Ъ, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ H. pylori –≤ –±–Є–Њ–њ—В–∞—В–µ –і–Њ –Є —З–µ—А–µ–Ј 4вАУ6 –љ–µ–і. –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Т –Ї–∞—З–µ—Б—В–≤–µ —А–µ—Д–µ—А–µ–љ—Б-–Љ–µ—В–Њ–і–Њ–≤ –њ—А–Є–Љ–µ–љ—П–ї–Є –Є–Љ–Љ—Г–љ–Њ—Ж–Є—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –Я–¶–†-–і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г H. pylori –≤ –±–Є–Њ–њ—В–∞—В–µ, –∞ —В–∞–Ї–ґ–µ –њ–Њ—Б–µ–≤ –±–Є–Њ–њ—В–∞—В–∞ –і–ї—П –Є–Ј—Г—З–µ–љ–Є—П –Ї—Г–ї—М—В—Г—А—Л H. pylori –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –Љ–Є–Ї—А–Њ–±–Њ–≤ –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є –≤—Л—Б–Њ–Ї—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М (Se = 97,4%) –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —В–µ—Б—В–∞, –Ї–Њ—В–Њ—А–∞—П —Б–Њ—З–µ—В–∞–ї–∞—Б—М —Б –Ї—А–∞–є–љ–µ –љ–Є–Ј–Ї–Њ–є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М—О (Sp = 23,1%), —З—В–Њ –Њ—В—А–∞–Ј–Є–ї–Њ—Б—М –љ–∞ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ (pVp = 64,9%) –Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–≥–Њ (pVn = 54,5%) —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —В–Њ—З–љ–Њ—Б—В–Є (Ac = 67,2%). –§–Є–љ—Б–Ї–Є–є —В–µ—Б—В, –љ–∞–њ—А–Њ—В–Є–≤, –њ–Њ–Ї–∞–Ј–∞–ї –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤—Л—Б–Њ–Ї–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л: Se = 92,1%, Sp = 100,0%, pVp = 92,1%, pVn = 59,1%, Ac = 95,3%.
–Я–Њ—Н—В–Њ–Љ—Г –≤ 30 –±–Є–Њ–њ—В–∞—В–∞—Е –Љ—Л –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Њ—Ж–µ–љ–Є–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О —Н—В–Є—Е —В–µ—Б—В–Њ–≤ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –≤–µ–≥–µ—В–Є—А—Г—О—Й–Є—Е —Д–Њ—А–Љ H. pylori, —В. –µ. –Ї–Њ–≥–і–∞ —А–µ–Ј—Г–ї—М—В–∞—В —Г—А–µ–∞–Ј–љ–Њ–≥–Њ —В–µ—Б—В–∞ –і–Њ–ї–ґ–µ–љ –±—Л—В—М –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–Љ. –Ш–Ј —Н—В–Є—Е 30 –±–Є–Њ–њ—В–∞—В–Њ–≤ –≤ 9 —Б–ї—Г—З–∞—П—Е H. pylori –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–ї—Б—П –љ–Є –Њ–і–љ–Є–Љ –Є–Ј –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л—Е —А–µ—Д–µ—А–µ–љ—Б-–Љ–µ—В–Њ–і–Њ–≤, –≤ 8 вАФ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–ї–Є—Б—М —В–Њ–ї—М–Ї–Њ –Ї–Њ–Ї–Ї–Њ–≤—Л–µ —Д–Њ—А–Љ—Л H. pylori, –≤ 4 вАФ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —В–Њ–ї—М–Ї–Њ –Ф–Э–Ъ H. pylori. –Т 9 —Б–ї—Г—З–∞—П—Е –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ —Г–Љ—Л—И–ї–µ–љ–љ–Њ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤. –Ы–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —В–µ—Б—В–∞ –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –≤ 21 —Б–ї—Г—З–∞–µ –Є–Ј 30 (–≤ 1 —Б–ї—Г—З–∞–µ +++, –≤ 4 ++ –Є –≤ 16 +), –∞ —Д–Є–љ—Б–Ї–Њ–≥–Њ вАФ —В–Њ–ї—М–Ї–Њ –≤ –Њ–і–љ–Њ–Љ.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ—Ж–µ–љ–Ї–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —В–Њ–ї—М–Ї–Њ —Г—А–µ–∞–Ј–љ–Њ–≥–Њ —В–µ—Б—В–∞ –≤ —Б–ї—Г—З–∞–µ –ї–Њ–ґ–љ–Њ–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –ї–Њ–ґ–љ–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є, –љ–Њ –Є –њ–Њ—Б–ї—Г–ґ–Є—В—М –њ—А–Є—З–Є–љ–Њ–є –љ–µ–Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е —Б—А–µ–і—Б—В–≤.
–Я–Њ–≤—Л—И–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є
–£—З–µ—В–∞ —Н—В–Є—Е —Б–≤–Њ–є—Б—В–≤ –Є —Б–Њ–±–ї—О–і–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—О —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Є–Ј–ї–Њ–ґ–µ–љ–љ—Л—Е –≤ –Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Њ–Љ —Б–Њ–≥–ї–∞—И–µ–љ–Є–Є V –Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л—Е –љ–∞ –µ–≥–Њ –Њ—Б–љ–Њ–≤–µ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е, –≤–њ–Њ–ї–љ–µ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –≥–∞—Б—В—А–Є—В–µ –Є–ї–Є –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є. –Я—А–Є —А–µ—Ж–Є–і–Є–≤–µ –Є–љ—Д–µ–Ї—Ж–Є–Є –Є–ї–Є –љ–∞–ї–Є—З–Є–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є (–Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–Є, –њ–µ—А—Д–Њ—А–∞—Ж–Є–Є, —Б—В–µ–љ–Њ–Ј–µ) –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –і–Њ–ї–ґ–љ—Л —Г—З–Є—В—Л–≤–∞—В—М—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ —В—А–µ–±–Њ–≤–∞–љ–Є—П –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є.1. –Т—А–µ–Љ—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є
–Я—А–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –≤–µ–і—Г—Й–Є–Љ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –љ–µ —Н—А–∞–і–Є–Ї–∞—Ж–Є—П H. pylori, –њ—А–Є–≤–Њ–і—П—Й–∞—П –Ї –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—О —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –њ—А–Њ—В–Є–≤–Њ—П–Ј–≤–µ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П (—Б–Њ—З–µ—В–∞–љ–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ш–Я–Я —Б —Ж–Є—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–∞–Љ–Є –Є —А–µ–≥—Г–ї—П—В–Њ—А–∞–Љ–Є –Љ–Њ—В–Њ—А–Є–Ї–Є), –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–∞—П –љ–∞ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–µ —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є, —Г—Б—Г–≥—Г–±–ї–µ–љ–Є–µ —Н–≤–∞–Ї—Г–∞—В–Њ—А–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –њ—А–Є —Б—В–µ–љ–Њ–Ј–µ –Є–ї–Є –љ–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ–Њ—Б–ї–µ —Г—И–Є–≤–∞–љ–Є—П –њ–µ—А—Д–Њ—А–∞—В–Є–≤–љ–Њ–є —П–Ј–≤—Л. –Я–Њ—Н—В–Њ–Љ—Г –Ї—Г—А—Б –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –і–Њ–ї–ґ–µ–љ –љ–∞—З–Є–љ–∞—В—М—Б—П –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ—В–Є–≤–Њ—П–Ј–≤–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –≤–µ–і—Г—Й–Є—Е –Љ–Њ—А—Д–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤:–њ—А–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–Є вАФ –≤ —А–∞–љ–љ–µ–Љ –њ–Њ—Б—В–≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–Љ –њ–µ—А–Є–Њ–і–µ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї —А–µ—Ж–Є–і–Є–≤–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –∞ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є–≤–Њ–і–Є—В –Ї —Г—Б–Є–ї–µ–љ–Є—О –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, —З—В–Њ –µ—Й–µ –±–Њ–ї—М—И–µ –њ–Њ–≤—Л—И–∞–µ—В —Н—В–Є —А–Є—Б–Ї–Є, –њ–Њ—Н—В–Њ–Љ—Г —Н—А–∞–і–Є–Ї–∞—Ж–Є—П H. pylori –і–Њ–ї–ґ–љ–∞ –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П —В–Њ–ї—М–Ї–Њ –њ–Њ—Б–ї–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Г—Б—В–Њ–є—З–Є–≤–Њ–≥–Њ –≥–µ–Љ–Њ—Б—В–∞–Ј–∞, –∞ –ї—Г—З—И–µ вАФ –њ–Њ—Б–ї–µ —А—Г–±—Ж–µ–≤–∞–љ–Є—П —П–Ј–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞;
–њ—А–Є —Б—В–µ–љ–Њ–Ј–µ вАФ –њ–Њ—Б–ї–µ —А—Г–±—Ж–µ–≤–∞–љ–Є—П —П–Ј–≤—Л, —Г–Љ–µ–љ—М—И–µ–љ–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—В–µ–Ї–∞ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Є —Г–ї—Г—З—И–µ–љ–Є—П –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ–Є–ї–Њ—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–∞–љ–∞–ї–∞;
–њ—А–Є –њ–µ—А—Д–Њ—А–∞—В–Є–≤–љ–Њ–є —П–Ј–≤–µ вАФ –љ–µ —А–∞–љ–µ–µ 1вАУ1,5 –Љ–µ—Б. –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є, —Б –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Њ–є H. pylori, —В. –Ї. –≤ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –ї–µ—З–µ–љ–Є–µ –њ–µ—А–Є—В–Њ–љ–Є—В–∞ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Є –і–≤—Г—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (—З–∞—Б—В–Њ —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–µ—В—А–Њ–љ–Є–і–∞–Ј–Њ–ї–Њ–Љ).
2. –Т—Л–±–Њ—А –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞
–Я—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ –≤–∞–ґ–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –≤—Л–±–Њ—А –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞, –Ї–Њ—В–Њ—А—Л–є –і–Њ–ї–ґ–µ–љ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—В—М –≤–љ—Г—В—А–Є–ґ–µ–ї—Г–і–Њ—З–љ—Л–є —А–Э > 6,0 –љ–µ –Љ–µ–љ–µ–µ 18 —З/—Б—Г—В, –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–є –і–ї—П –∞–Ї—В–Є–≤–љ–Њ–є –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є, –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є–Є –Ї–Њ–Ї–Ї–Њ–≤—Л—Е –Є U-—Д–Њ—А–Љ –Є –њ–µ—А–µ—Е–Њ–і–∞ H. pylori –≤ —Д–∞–Ј—Г –і–µ–ї–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є H. pylori. –Я—А–Є –≤—Л–±–Њ—А–µ –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —Б–ї–µ–і—Г—О—Й–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є:–∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ—Л–є —Н—Д—Д–µ–Ї—В вАФ –Љ–Є–љ–Є–Љ–∞–ї–µ–љ (–љ–Њ –і–Њ—Б—В–∞—В–Њ—З–µ–љ) —Г –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞, –Љ–∞–Ї—Б–Є–Љ–∞–ї–µ–љ —Г —Н–Ј–Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞, —А–∞–±–µ–њ—А–∞–Ј–Њ–ї–∞ –Є –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞;
—Б–Ї–Њ—А–Њ—Б—В—М —Б—В–∞–±–Є–ї—М–љ–Њ–≥–Њ –њ–Њ–≤—Л—И–µ–љ–Є—П —А–Э, —З—В–Њ –≤–ї–Є—П–µ—В –љ–∞ –≤—А–µ–Љ—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤: —Г –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ вАФ –љ–∞ 4-–µ —Б—Г—В, —Г –ї–∞–љ—Б–Њ–њ—А–∞–Ј–Њ–ї–∞ вАФ –љ–∞ 2-–µ —Б—Г—В, —Г —А–∞–±–µ-
–њ—А–∞–Ј–Њ–ї–∞ –Є –њ–∞–љ—В–Њ–њ—А–∞–Ј–Њ–ї–∞ вАФ –≤ —В–µ—З–µ–љ–Є–µ 24 —З, —Г —Н–Ј–Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ вАФ —З–µ—А–µ–Ј 12 —З;
–Ї–∞—З–µ—Б—В–≤–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤;
–Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Ш–Я–Я вАФ —Г –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ —Г—Б–Ї–Њ—А–µ–љ–љ–∞—П (–≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–µ—З–µ–љ–Њ—З–љ–Њ–≥–Њ –Є–Ј–Њ—Д–µ—А–Љ–µ–љ—В–∞ —Ж–Є—В–Њ—Е—А–Њ–Љ–∞
–†-450 2–°19 (CYP2C19) –Є–љ–∞–Ї—В–Є–≤–∞—Ж–Є—П (–±–Є–Њ—В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є—П) –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ—Е –Ш–Я–Я –≤ –њ–µ—З–µ–љ–Є, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ —Н–Ј–Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ –Є —А–∞–±–µ–њ—А–∞–Ј–Њ–ї–∞, —Г –Ї–Њ—В–Њ—А—Л—Е –Є–љ–∞–Ї—В–Є–≤–∞—Ж–Є—П –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Љ–µ–і–ї–µ–љ–љ–µ–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–Њ–Љ –Є –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –±—Л—В—М –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤—Л–±–Њ—А–∞ –≤ –Х–≤—А–Њ–њ–µ –Є –°–µ–≤–µ—А–љ–Њ–є –Р–Љ–µ—А–Є–Ї–µ, –≥–і–µ –њ—А–µ–Њ–±–ї–∞–і–∞—О—В –±—Л—Б—В—А—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–∞—В–Њ—А—Л –Ш–Я–Я (¬Ђ–Ь–∞–∞—Б—В—А–Є—Е—В V¬ї, –£—В–≤–µ—А–ґ–і–µ–љ–Є–µ 10) [15];
—Н—Д—Д–µ–Ї—В–Є–≤–љ—Г—О –і–Њ–Ј—Г вАФ –њ—А–Є —А–µ—Ж–Є–і–Є–≤–µ –Є–љ—Д–µ–Ї—Ж–Є–Є H. pylori –Є–ї–Є –њ–Њ—Б–ї–µ —Г—И–Є–≤–∞–љ–Є—П –њ–µ—А—Д–Њ—А–∞—В–Є–≤–љ–Њ–є —П–Ј–≤—Л (–Ї–Њ–≥–і–∞ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—Б–µ–Ї—А–µ—Ж–Є—П —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л) —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј—Л –Ш–Я–Я –≤ –і–≤–∞ —А–∞–Ј–∞ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В—А–Њ–є–љ–Њ–є 7-–і–љ–µ–≤–љ–Њ–є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б 74% –і–Њ 82% [15]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Н—А–∞–і–Є–Ї–∞—Ж–Є—П –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є H. pylori –Ї –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ—Г, –µ—Б–ї–Є –≤—А–µ–Љ—П —Б –≤–љ—Г—В—А–Є–ґ–µ–ї—Г–і–Њ—З–љ—Л–Љ —А–Э < 4,0 –Љ–µ–љ–µ–µ —З–µ–Љ 10% –≤ —В–µ—З–µ–љ–Є–µ —Б—Г—В–Њ–Ї, –∞ —Б—А–µ–і–љ–µ—Б—Г—В–Њ—З–љ—Л–є —А–Э —Б–Њ—Б—В–∞–≤–ї—П–µ—В
–±–Њ–ї–µ–µ 6 [17];
—З–∞—Б—В–Њ—В—Г –њ—А–Є–µ–Љ–∞ вАФ —Б —Г—З–µ—В–Њ–Љ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ–Њ–≤—Л—И–µ–љ–Є—П –≤–љ—Г—В—А–Є–ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ —А–Э —Б—Г—В–Њ—З–љ–∞—П –і–Њ–Ј–∞ –љ–∞–Ј–љ–∞—З–∞–µ–Љ—Л—Е –Ш–Я–Я –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є –і–Њ–ї–ґ–љ–∞ –±—Л—В—М —А–∞–Ј–і–µ–ї–µ–љ–∞ –љ–∞ 2 –њ—А–Є–µ–Љ–∞ (¬Ђ–Ь–∞–∞—Б—В—А–Є—Е—В V¬ї, –£—В–≤–µ—А–ґ–і–µ–љ–Є–µ 10) [15];
–њ—Г—В—М –≤–≤–µ–і–µ–љ–Є—П вАФ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Н–≤–∞–Ї—Г–∞—В–Њ—А–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є (–њ—А–Є —П–Ј–≤–µ–љ–љ–Њ–Љ —Б—В–µ–љ–Њ–Ј–µ) —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ –Ш–Я–Я.
3. –Т—Л–±–Њ—А –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤
–Я—А–Є–љ—Ж–Є–њ—Л –≤—Л–±–Њ—А–∞ —А–µ–ґ–Є–Љ–∞ (—В—А–Њ–є–љ–∞—П, –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–∞—П –Є –Ї–≤–∞–і—А–Њ—В–µ—А–∞–њ–Є—П) –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (7, 10, 14 –і–љ–µ–є) –њ–Њ–і—А–Њ–±–љ–Њ –Є–Ј–ї–Њ–ґ–µ–љ—Л –≤ –Ь–∞–∞—Б—В—А–Є—Е—В—Б–Ї–Њ–Љ —Б–Њ–≥–ї–∞—И–µ–љ–Є–Є V [15]. –Я—А–Є –≤—Л–±–Њ—А–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М —А–µ–≥–Є–Њ–љ–∞–ї—М–љ—Г—О –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М, –∞ —В–∞–Ї–ґ–µ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –≤ —В. —З. –Є –њ–Њ –њ–Њ–≤–Њ–і—Г –і—А—Г–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Т —Б—Е–µ–Љ–∞—Е —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ —Б –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, —Б —Г—З–µ—В–Њ–Љ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є–Ї–Є, –∞ —В–∞–Ї–ґ–µ –≤–Ї–ї—О—З–µ–љ–Є–µ –≤ —Б—Е–µ–Љ—Г –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –Є —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –Ї–ї–∞—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј—А—Г—И–µ–љ–Є—О –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –±–Є–Њ–њ–ї–µ–љ–Њ–Ї. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е —Б—А–µ–і—Б—В–≤ –≤ —Б–ї–Њ–µ –њ—А–Є—Б—В–µ–љ–Њ—З–љ–Њ–є —Б–ї–Є–Ј–Є –і–Є–Ї—В—Г–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —Г–≤–µ–ї–Є—З–µ–љ–Є—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –і–ґ–µ–љ–µ—А–Є–Ї–Њ–≤ –Є–Ј-–Ј–∞ —Б–Љ–µ–љ—Л –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П –љ–∞ –±–∞–Ї—В–µ—А–Є–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–µ –і–∞–ґ–µ –њ—А–Є –љ–µ–±–Њ–ї—М—И–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ [14].4. –Т–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –±–∞—А—М–µ—А–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є
–Ф–ї—П —Г–Љ–µ–љ—М—И–µ–љ–Є—П –∞–љ—В–Є–≥–µ–љ–љ–Њ–є –∞–≥—А–µ—Б—Б–Є–Є –≤ —Б—Е–µ–Љ–∞—Е —Н—А–∞–і–Є–Ї–∞—Ж–Є–Є H. pylori –њ—А–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–µ–њ–∞—А–∞—В—Л –Ї–Њ–ї–ї–Њ–Є–і–љ–Њ–≥–Њ –≤–Є—Б–Љ—Г—В–∞ (–≤ —Б–Њ—Б—В–∞–≤–µ –Ї–≤–∞–і—А–Њ—В–µ—А–∞–њ–Є–Є –Є –≤ —В–µ—З–µ–љ–Є–µ 3вАУ4 –љ–µ–і. –њ–Њ—Б–ї–µ –µ–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П), –Ї–Њ—В–Њ—А—Л–µ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В –Ј–∞—Й–Є—В–љ—Л–µ –±–∞—А—М–µ—А–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —Б–љ–Є–ґ–µ–љ–Є—О –∞–і–≥–µ–Ј–Є–≤–љ–Њ—Б—В–Є, –Є–љ–≤–∞–Ј–Є–≤–љ–Њ—Б—В–Є H. pylori –Є –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –µ–µ –≥–Є–±–µ–ї–Є –Є –≤—Л–≤–µ–і–µ–љ–Є—О, –≤ —В. —З. –Є–љ—В—А–∞—Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –Є –Ї–Њ–Ї–Ї–Њ–≤—Л—Е —Д–Њ—А–Љ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –ґ–µ–ї—Г–і–Ї–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—О –Ї–Њ–ї–Њ–љ–Є–Ј–∞—Ж–Є–Њ–љ–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Є –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –њ–Њ–≤—В–Њ—А–љ–Њ–Љ—Г –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є—О.5. –Ш–Љ–Љ—Г–љ–Њ—В–µ—А–∞–њ–Є—П
–Я—А–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ—В—А–Њ–њ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є—Е —Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є –∞–љ—В–Є–≥–µ–љ–∞ H. pylori –Є –Є–Љ–Љ—Г–љ–љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤, –∞–Ї—В–Є–≤–∞—Ж–Є–Є Th-1 —Е–µ–ї–њ–µ—А–Њ–≤ –і–ї—П –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤. –Т –Ї–∞—З–µ—Б—В–≤–µ –Є–Љ–Љ—Г–љ–Њ—В—А–Њ–њ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞–Љ–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л [10] –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ-2, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–є —Г—В–Є–ї–Є–Ј–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤, –±—Л—Б—В—А–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –Њ—В–µ–Ї–∞, —А—Г–±—Ж–µ–≤–∞–љ–Є—О —П–Ј–≤—Л, –Є –Є–љ–і—Г–Ї—В–Њ—А ќ≥-–Є–љ—В–µ—А—Д–µ—А–Њ–љ–∞ вАФ –Љ–µ–≥–ї—О–Љ–Є–љ–∞ –∞–Ї—А–Є–і–Њ–љ–∞—Ж–µ—В–∞—В, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–є —Г–љ–Є—З—В–Њ–ґ–µ–љ–Є—О –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е –њ–∞—В–Њ–≥–µ–љ–Њ–≤ –Є –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—Й–Є–є –Љ–Є–Ї—А–Њ–±–Є–Њ—Ж–Є–і–љ–Њ—Б—В—М —Д–∞–≥–Њ—Ж–Є—В–Њ–≤.6. –Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤
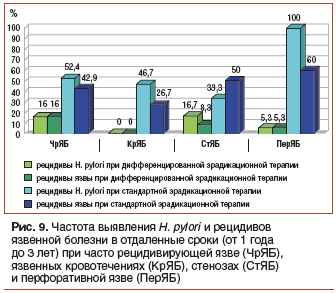
–Ф–ї–Є—В–µ–ї—М–љ–∞—П –Ї–Њ—А—А–µ–Ї—Ж–Є—П –Љ–Њ—А—Д–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є (–≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Є–і–∞ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є) –Є –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –њ—А–Њ—В–Є–≤–Њ—А–µ—Ж–Є–і–Є–≤–љ—Л—Е –Ї—Г—А—Б–Њ–≤ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –і–Є—Б–њ–∞–љ—Б–µ—А–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–ї—П –њ–Њ–≤—Л—И–µ–љ–Є—П –Ї–Њ–ї–Њ–љ–Є–Ј–∞—Ж–Є–Њ–љ–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є—П –Є –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –і–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.–Я–Њ–і–Њ–±–љ—Л–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ–Ј–≤–Њ–ї–Є–ї –љ–∞–Љ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–ї—Г—З—И–Є—В—М –±–ї–Є–ґ–∞–є—И–Є–µ –Є –Њ—В–і–∞–ї–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є —Б–љ–Є–Ј–Є—В—М —З–∞—Б—В–Њ—В—Г —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Є –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–Є—П H. pylori, —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –Є –µ–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є. –Э–∞–Љ —Г–і–∞–ї–Њ—Б—М –њ—А–Њ—Б–ї–µ–і–Є—В—М –Њ—В–і–∞–ї–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Њ—В 1 –≥–Њ–і–∞ –і–Њ 3 –ї–µ—В) —Г 143 –±–Њ–ї—М–љ—Л—Е —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є —П–Ј–≤—Л –Ф–Я–Ъ: 89 –±–Њ–ї—М–љ—Л–Љ (–Њ—Б–љ–Њ–≤–љ–∞—П –≥—А—Г–њ–њ–∞) —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б–Њ–≥–ї–∞—Б–љ–Њ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л–Љ –љ–∞–Љ–Є –њ—А–Є–љ—Ж–Є–њ–∞–Љ, 54 –±–Њ–ї—М–љ—Л–Љ (–Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П –≥—А—Г–њ–њ–∞) вАФ –њ–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ —Б—Е–µ–Љ–∞–Љ. –Ю—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М —З–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤ —П–Ј–≤–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –Є —З–∞—Б—В–Њ—В–∞ –≤—Л—П–≤–ї–µ–љ–Є—П H. pylori –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ї—Г—А—Б–∞ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (—А–Є—Б. 9) [10].
7. –Я–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–µ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П
–Э–∞–Є–±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Б—З–Є—В–∞–µ—В—Б—П –Є–Ј—Г—З–µ–љ–Є–µ –і–µ–є—Б—В–≤–Є—П –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤ (Saccharomyces boulardii, Bacillus clausi, Lactobacillus strains, Bifidobacterium strains), –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ—В–Њ—А—Л—Е –њ–Њ–Ї–∞–Ј–∞–ї–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є H. pylori –Є —Б–љ–Є–ґ–µ–љ–Є–µ —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –љ–µ–є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ (¬Ђ–Ь–∞–∞—Б—В—А–Є—Е—В V¬ї, –£—В–≤–µ—А–ґ–і–µ–љ–Є—П 9, 10) [15]. –Ф–µ–є—Б—В–≤–Є–µ –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤ –Њ—Б–љ–Њ–≤–∞–љ–Њ –љ–∞ –≤—Л—А–∞–±–Њ—В–Ї–µ –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤, –њ–Њ–і–∞–≤–ї—П—О—Й–Є—Е —А–Њ—Б—В H. pylori, —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї–Њ–љ–Ї—Г—А–Є—А–Њ–≤–∞—В—М –Ј–∞ –њ–Є—В–∞—В–µ–ї—М–љ—Л–µ –≤–µ—Й–µ—Б—В–≤–∞ –Є —А–µ—Ж–µ–њ—В–Њ—А—Л –∞–і–≥–µ–Ј–Є–Є, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –∞–і–≥–µ–Ј–Є–Є H. pylori –Ї —Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В–∞–Љ –ґ–µ–ї—Г–і–Ї–∞.–Ю—Б–Њ–±—Л–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л–µ —И—В–∞–Љ–Љ—Г Lactobacillus reuteri DSMZ17648 (PylopassвДҐ, –•–µ–ї–Є–љ–Њ—А–Љ). –≠—В–Њ—В —И—В–∞–Љ–Љ ¬Ђ—А–∞—Б–њ–Њ–Ј–љ–∞–µ—В¬ї –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л H. pylori –Є –њ—А–Є–Ї—А–µ–њ–ї—П–µ—В—Б—П –Ї –љ–Є–Љ, —Б–Њ–Ј–і–∞–≤–∞—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ –Ї–Њ–∞–≥—А–µ–≥–∞—В—Л, –Ї–Њ—В–Њ—А—Л–µ –Ј–∞—В–µ–Љ –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–Љ –њ—Г—В–µ–Љ –≤—Л–≤–Њ–і—П—В—Б—П –Є–Ј –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, —Г–Љ–µ–љ—М—И–∞—П –Њ–±—Й—Г—О H. pylori-–Њ–±—Б–µ–Љ–µ–љ–µ–љ–љ–Њ—Б—В—М –ґ–µ–ї—Г–і–Ї–∞. –†—П–і —А–∞–±–Њ—В, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Ї–∞–Ї –Ј–∞ —А—Г–±–µ–ґ–Њ–Љ, —В–∞–Ї –Є –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ, –њ–Њ–Ї–∞–Ј–∞–ї–Є –≤–µ—Б—М–Љ–∞ –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ PylopassвДҐ (–•–µ–ї–Є–љ–Њ—А–Љ) –≤ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є —Б–љ–Є–ґ–∞–ї–Њ –Њ–±—Б–µ–Љ–µ–љ–µ–љ–љ–Њ—Б—В—М —Б–ї–Є–Ј–Є—Б—В–Њ–є –ґ–µ–ї—Г–і–Ї–∞, –∞ –≤ —Б–Њ—Б—В–∞–≤–µ —Н—А–∞–і–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є вАФ –њ–Њ–≤—Л—И–∞–ї–Њ –µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М [18вАУ21].












