–†–∞—Б—В—Г—Й–∞—П –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ –њ–Њ–њ—Г–ї—П—А–љ–Њ—Б—В—М —Д–Є—В–Њ—В–µ—А–∞–њ–Є–Є –Є–Љ–µ–µ—В —Ж–µ–ї—Л–є —А—П–і –њ—А–Є—З–Є–љ, –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —Б—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М: 1) –љ–µ—Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –љ–µ–±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Њ—Д–Є—Ж–Є–∞–ї—М–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –Њ—Б–Њ–±–µ–љ–љ–Њ —В–∞–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ї–∞–Ї –≥–µ–њ–∞—В–Є—В—Л –Т –Є –°, –ґ–Є—А–Њ–≤–∞—П –і–Є—Б—В—А–Њ—Д–Є—П –њ–µ—З–µ–љ–Є –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ –Є –њ–µ—З–µ–љ–Њ—З–љ–Њ–Ї–ї–µ—В–Њ—З–љ—Л–є —А–∞–Ї; 2) –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ —Д–Є—В–Њ–њ—А–µ–њ–∞—А–∞—В—Л –љ–∞—В—Г—А–∞–ї—М–љ—Л –Є –∞–њ—А–Є–Њ—А–Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л; 3) –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–µ–≤—Л—Б–Њ–Ї–∞—П —Б—В–Њ–Є–Љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П. –•–Њ—В—П –Ј–∞—З–∞—Б—В—Г—О –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Д–Є—В–Њ–њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–µ—З–µ–љ–Є –Є –ї–µ—З–µ–љ–Є—П, –∞ –њ—А–Њ—Б—В–Њ —Б–≤–Њ–є—Б—В–≤–µ–љ–љ–Њ –ґ–µ–љ—Й–Є–љ–∞–Љ —Б –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –і–Њ—Е–Њ–і–Њ–≤ –Є–ї–Є –≤—Л—Б—И–Є–Љ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ. –Я—А–Є —Н—В–Њ–Љ –≤—Л—Б–Њ–Ї–∞—П –њ–Њ–њ—Г–ї—П—А–љ–Њ—Б—В—М —Д–Є—В–Њ—В–µ—А–∞–њ–Є–Є —Г –љ–∞—Б–µ–ї–µ–љ–Є—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Љ–∞—Б—Б–Њ–≤—Л–Љ –љ–µ–і–Њ–≤–µ—А–Є–µ–Љ –Ї –љ–µ–є –≤—А–∞—З–µ–є, –њ—А–Є–≤–Њ–і—П—Й–Є–Љ –Ї —В–Њ–Љ—Г, —З—В–Њ –њ–Њ—З—В–Є 31–70% –њ—А–Є–≤–µ—А–ґ–µ–љ—Ж–µ–≤ –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б–Ї—А—Л–≤–∞—О—В —Н—В–Њ—В —Д–∞–Ї—В –њ—А–Є –Ї–Њ–љ—В–∞–Ї—В–µ —Б –њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–Њ–є. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–µ –љ–µ–њ—А–Є—П—В–Є–µ —Д–Є—В–Њ—В–µ—А–∞–њ–Є–Є –Њ—Д–Є—Ж–Є–∞–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–Њ–є —В–∞–Ї–ґ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї —В–Њ–Љ—Г, —З—В–Њ –≤—А–∞—З–Є –Љ–∞–ї–Њ –Ј–љ–∞—О—В –Њ –њ—А–µ–њ–∞—А–∞—В–∞—Е —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П –Є —З–∞—Б—В–Њ –љ–µ –Љ–Њ–≥—Г—В –∞–і–µ–Ї–≤–∞—В–љ–Њ –Њ—Ж–µ–љ–Є—В—М –Є—Е –њ–Њ–Ј–Є—В–Є–≤–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ј–і–Њ—А–Њ–≤—М–µ –Є –≤–Ї–ї–∞–і –≤ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є –ї–µ—З–µ–љ–Є—П [4]. –Я–Њ—Н—В–Њ–Љ—Г –Ъ–Њ–љ–≥—А–µ—Б—Б –°–®–Р –≤ 1998 –≥. –Њ—Б–љ–Њ–≤–∞–ї –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є —Ж–µ–љ—В—А –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–є –Є –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л (–Р–Ь), –Ї–Њ—В–Њ—А—Л–є –≤—Е–Њ–і–Є—В –≤ —Б–Њ—Б—В–∞–≤ –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є–љ—Б—В–Є—В—Г—В–Њ–≤ –Ј–і–Њ—А–Њ–≤—М—П –Є –њ–Њ–ї—Г—З–∞–µ—В —Б—А–µ–і—Б—В–≤–∞ –Њ—В –Ъ–Њ–љ–≥—А–µ—Б—Б–∞ –°–®–Р. –Ю—Б–љ–Њ–≤–љ–∞—П —Ж–µ–ї—М –¶–µ–љ—В—А–∞ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ–±—Л –њ—А–µ–і–Њ—Б—В–∞–≤–ї—П—В—М –љ–∞–і–µ–ґ–љ—Г—О –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–µ—В–Њ–і–Њ–≤ –Р–Ь –Є —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –≤–љ–µ–і—А–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Р–Ь –≤ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Г—О –Љ–µ–і–Є—Ж–Є–љ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є –Ј–∞–і–∞—З–µ–є –¶–µ–љ—В—А–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ –≥—А–∞–љ—В–Њ–≤ –љ–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –Њ–±–ї–∞—Б—В–Є –Р–Ь. –Ґ–∞–Ї, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Њ–≤–Њ–і–Є—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ—А–Є–Ј–≤–∞–љ–љ–Њ–µ –Њ—В–≤–µ—В–Є—В—М –љ–∞ –≤–Њ–њ—А–Њ—Б, –Љ–Њ–ґ–µ—В –ї–Є –љ–∞—Б—В–Њ–є –Є–Ј –њ–Њ–±–µ–≥–Њ–≤ –±—А–Њ–Ї–Ї–Њ–ї–Є –њ—А–µ–і—Г–њ—А–µ–і–Є—В—М —А–∞–Ј–≤–Є—В–Є–µ —А–∞–Ї–∞ –њ–µ—З–µ–љ–Є. –Я—А–Њ—З–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Б–њ–Њ–љ—Б–Є—А—Г–µ–Љ—Л–µ –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є –Є–љ—Б—В–Є—В—Г—В–∞–Љ–Є –Ј–і–Њ—А–Њ–≤—М—П, –≤–Ї–ї—О—З–∞—О—В –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Г –ї–Є—Ж, –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Т–Ш–І –Є –≤–Є—А—Г—Б–Њ–Љ –≥–µ–њ–∞—В–Є—В–∞ –° (HCV). –Э–∞ —Н—В–Њ–Љ —Д–Њ–љ–µ –Є—Б—В–Њ—А–Є—П –Є –њ—А–∞–Ї—В–Є–Ї–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ – —Н–Ї—Б—В—А–∞–Ї—В–∞ –Є–Ј –њ–ї–Њ–і–Њ–≤ —А–∞—Б—В–Њ—А–Њ–њ—И–Є –њ—П—В–љ–Є—Б—В–Њ–є —П–≤–ї—П–µ—В—Б—П —Б—З–∞—Б—В–ї–Є–≤—Л–Љ –њ—А–Є–Љ–µ—А–Њ–Љ –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Г—О –Њ—Д–Є—Ж–Є–∞–ї—М–љ—Г—О —Д–∞—А–Љ–∞–Ї–Њ–њ–µ—О, —З—В–Њ, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –њ—А–Є–≤–µ–ї–Њ –Ї —В—Й–∞—В–µ–ї—М–љ–Њ–Љ—Г –Є–Ј—Г—З–µ–љ–Є—О –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –≤ –љ–∞—Г—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Є —В–Њ–Ї—Б–Є–Ї–Њ––Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ–µ—З–µ–љ–Є —Б–Є–ї–Є–Љ–∞—А–Є–љ –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М, –њ—А–µ–≤—Л—И–∞—О—Й–Є–µ —В–∞–Ї–Њ–≤—Л–µ —Г —Б—А–µ–і—Б—В–≤ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ—В–µ–Ј–∞.
–Ь–µ–ґ–і—Г —В–µ–Љ –≤ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–є –Є –љ–∞—А–Њ–і–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ —А–∞—Б—В–Њ—Аo–њ—И–∞ –њ—П—В–љ–Є—Б—В–∞—П –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П —Г–ґ–µ –±–Њ–ї–µ–µ 2000 –ї–µ—В. –Я–µ—А–≤–Њ–µ –љ–∞—Г—З–љ–Њ–µ –Њ–њ–Є—Б–∞–љ–Є–µ —А–∞—Б—Вo—А–Њ–њ—И–Є, –Ї–∞–Ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —А–∞—Б—В–µ–љ–Є—П, –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ —В—А—Г–і–∞—Е –Ґ–µ–Њ—Д—А–∞—Б—В–∞ –Є –і–∞—В–Є—А—Г–µ—В—Б—П IV –≤–µ–Ї–Њ–Љ –і–Њ –љ–∞—И–µ–є —Н—А—Л (—А–Є—Б. 1 –Є 2).
–Ю–і–љ–∞–Ї–Њ –Ї–∞–Ї –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А —А–∞—Б—В–Њ—Аo–њ—И–∞ –њ–Њ–ї—Г—З–Є–ї–∞ –њ—А–Є–Ј–љ–∞–љ–Є–µ –≤ —Б—А–µ–і–љ–Є–µ –≤–µ–Ї–∞, –Є –≤ —Н—В–Њ–Љ –Ї–∞—З–µ—Б—В–≤–µ, –љ–∞—З–Є–љ–∞—П —Б XVI –≤–µ–Ї–∞, —А–∞–Ј–ї–Є—З–љ—Л–µ —З–∞—Б—В–Є —А–∞—Б—В–µ–љ–Є—П (–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–∞—Б—В–Њ–є–Ї—Г –Є–Ј —Б–µ–Љ—П–љ) –∞–Ї—В–Є–≤–љ–Њ –њ—А–Є–Љ–µ–љ—П–ї–Є –≤ –Х–≤—А–Њ–њ–µ. –Т –љ–∞—З–∞–ї–µ XVIII –≤–µ–Ї–∞ –Є–Ј–≤–µ—Б—В–љ—Л–є –љ–µ–Љ–µ—Ж–Ї–Є–є –Ї–ї–Є–љ–Є—Ж–Є—Б—В –†–∞–і–µ–Љ–∞—Е–µ—А (Rademacher) –∞–Ї—В–Є–≤–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї —Б–Є–ї–Є–Љ–∞—А–Є–љ –њ—А–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ–µ—З–µ–љ–Є –Є —Б–µ–ї–µ–Ј–µ–љ–Ї–Є, —Б—З–Є—В–∞—П –µ–≥–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ —Б—А–µ–і—Б—В–≤–Њ–Љ –њ—А–Є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –Ї–Њ–ї–Є–Ї–µ, –ґ–µ–ї—В—Г—Е–µ, –ґ–µ–ї—З–љ–Њ––Ї–∞–Љ–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –Ї—А–Њ–≤–∞–≤–Њ–є —А–≤–Њ—В–µ, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –Ї–∞—И–ї–µ –Є –Є—И–Є–∞—Б–µ [5]. –Т —Н—В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ –У–µ—А–Љ–∞–љ–Є–Є –і–Њ–Ї—В–Њ—А –†–µ–є–ї—М (Reil) –≤–≤–µ–ї –љ–∞—Б—В–Њ–є–Ї—Г –Є–Ј —Б–µ–Љ—П–љ –†–∞—Б—В–Њ—А–Њ–њ—И–Є –≤ –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –њ–Њ–і –љ–∞–Ј–≤–∞–љ–Є–µ–Љ Carduus marianus. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –љ–µ–Љ–µ—Ж–Ї–Є–є –≥–Њ–Љ–µ–Њ–њ–∞—В –Т–Є–љ–і–µ–љ–±–∞–љ–і (Windenband) —Г—Б–њ–µ—И–љ–Њ –њ—А–Є–Љ–µ–љ—П–ї Carduus marianus –њ—А–Є –љ–Њ—Б–Њ–≤—Л—Е –Є –≥–µ–Љ–Њ—А—А–Њ–Є–і–∞–ї—М–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П—Е –њ—А–Є –њ–Њ—А—В–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є –Є –Ј–∞—Б—В–Њ–µ –≤ –њ–Њ—А—В–∞–ї—М–љ–Њ–є –≤–µ–љ–µ, –∞ –і–Њ–Ї—В–Њ—А –Я—А–µ–ї—М (Proell) – –њ—А–Є –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–Љ —Ж–Є—А—А–Њ–Ј–µ –њ–µ—З–µ–љ–Є. –Ф–Њ–Ї—В–Њ—А –®–∞—А–µ—В—В (Charette) —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї Carduus marianus –њ—А–Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —Б –Ї–∞—А–і–Є–∞–ї—М–љ—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –њ–µ—З–µ–љ–Є.
–Т —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Г—О –Љ–µ–і–Є—Ж–Є–љ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –†–∞—Б—В–Њ—А–Њ–њ—И–∞ –±—Л–ї–∞ –≤–≤–µ–і–µ–љ–∞ –≤ 60–—Е –≥–Њ–і–∞—Е –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞, –Ї–Њ–≥–і–∞ —Н–Ї—Б—В—А–∞–Ї—В –Є–Ј –µ–µ —Б–µ–Љ—П–љ – —Б–Є–ї–Є–Љ–∞—А–Є–љ —Б—В–∞–ї–Є –њ–Њ–ї—Г—З–∞—В—М –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ—Л–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ. –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –і–µ–є—Б—В–≤—Г—О—Й–Є–Љ–Є –≤–µ—Й–µ—Б—В–≤–∞–Љ–Є —А–∞—Б—В–Њ—А–Њ–њ—И–Є –њ—П—В–љ–Є—Б—В–Њ–є —П–≤–ї—П—О—В—Б—П —Д–ї–∞–≤–Њ–љ–Њ–Є–і—Л –Є —Д–ї–∞–≤–Њ–љ–Њ–ї–Є–≥–љ–∞–љ—Л, –∞–ї–Ї–∞–ї–Њ–Є–і—Л (—В–∞–Ї—Б–Є—Д–Њ–ї–Є–љ) –Є —Б–∞–њ–Њ–љ–Є–љ—Л. –Я–Њ–Љ–Є–Љ–Њ —Б–Љ–µ—Б–Є —Д–ї–∞–≤–Њ–љ–Њ–ї–Є–≥–љ–∞–љ–Њ–≤, —Б–Є–ї–Є–Љ–∞—А–Є–љ —Б–Њ–і–µ—А–ґ–Є—В —В–∞–Ї–ґ–µ –і–Њ 25% —А–∞—Б—В–Є—В–µ–ї—М–љ–Њ–≥–Њ –Љ–∞—Б–ї–∞, –љ–µ–Ї–Њ—В–Њ—А–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –±–µ–ї–Ї–∞, –≤–Є—В–∞–Љ–Є–љ –Ъ, —Б–Љ–Њ–ї—Л, –і—Г–±–Є–ї—М–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ «–Ї–∞—В–µ—Е—Г», —Б–ї–Є–Ј—М, —В–Є—А–∞–Љ–Є–љ, –≥–Є—Б—В–∞–Љ–Є–љ, –Љ–Є–Ї—А–Њ—Н–ї–µ–Љ–µ–љ—В—Л, –Ї—А–∞—Б–Є—В–µ–ї—М.
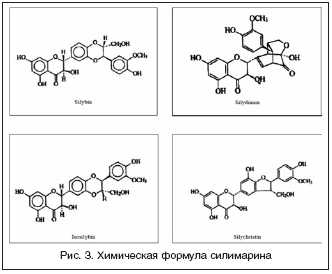
–Ф–Њ 1970 –≥–Њ–і–∞ —В–µ—Е–љ–Њ–ї–Њ–≥–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –±—Л–ї–∞ –Ј–∞–њ–∞—В–µ–љ—В–Њ–≤–∞–љ–∞ –Є –Њ–љ –≤–њ–µ—А–≤—Л–µ –њ—А–Њ—И–µ–ї —Б—В–∞–љ–і–∞—А—В–Є–Ј–∞—Ж–Є—О –Ї–∞–Ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–є, –∞ –љ–µ –≥–∞–ї–µ–љ–Њ–≤—Л–є –Є–ї–Є –≥–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–є –њ—А–µ–њ–∞—А–∞—В. –Т–њ–µ—А–≤—Л–µ –±—Л–ї–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б–Є–ї–Є–Љ–∞—А–Є–љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Б—Г–Љ–Љ—Г —З–µ—В—Л—А–µ—Е –Њ—Б–љ–Њ–≤–љ—Л—Е —Д–ї–∞–≤–Њ–љ–Њ–ї–Є–≥–љ–∞–љ–Њ–≤, –њ–Њ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є —Б—В—А—Г—В—Г—А–µ –±–ї–Є–Ј–Ї–Є—Е –Ї —Б—В–µ—А–Њ–Є–і–∞–Љ: —Б–Є–ї–Є–±–Є–љ (60%), –Є–Ј–Њ—Б–Є–ї–Є–±–Є–љ (10%), —Б–Є–ї–Є–і–∞–љ–Є–љ (10%) –Є —Б–Є–ї–Є–Ї—А–Є—Б—В–Є–љ (20%) (—А–Є—Б. 3). –≠–Љ–њ–Є—А–Є—З–µ—Б–Ї–∞—П —Д–Њ—А–Љ—Г–ї–∞ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞: C25H22O10.
–Э–∞—З–Є–љ–∞—П —Б–Њ –≤—В–Њ—А–Њ–є –њ–Њ–ї–Њ–≤–Є–љ—Л XX –≤–µ–Ї–∞, –њ–Њ–њ—Г–ї—П—А–љ–Њ—Б—В—М —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –Њ—Б—В–∞–µ—В—Б—П –±–µ—Б–њ—А–µ—Ж–µ–і–µ–љ—В–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є: –µ–≥–Њ –њ—А–Њ–і–∞–ґ–∞ —В–Њ–ї—М–Ї–Њ –≤ –У–µ—А–Љ–∞–љ–Є–Є —Б–µ–≥–Њ–і–љ—П –њ—А–Є–љ–Њ—Б–Є—В –Њ–Ї–Њ–ї–Њ 180 –Љ–ї–љ. –і–Њ–ї–ї–∞—А–Њ–≤ –≤ –≥–Њ–і. –Т–њ—А–Њ—З–µ–Љ, –љ—Г–ґ–љ–Њ –њ—А–Є–Ј–љ–∞—В—М, —З—В–Њ –≤ 90–—Е –≥–Њ–і–∞—Е –≤ –¶–µ–љ—В—А–∞–ї—М–љ–Њ–є –Х–≤—А–Њ–њ–µ, –њ–Њ –Љ–µ–љ—М—И–µ–є –Љ–µ—А–µ, –≤ —В—А–Є —А–∞–Ј–∞ –≤—Л—А–Њ—Б –Њ–±–Њ—А–Њ—В –љ–µ —В–Њ–ї—М–Ї–Њ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞, –љ–Њ –Є –і—А—Г–≥–Є—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–Њ–≤: –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є–Ј –Ї–Њ—А–љ—П —Б–Њ–ї–Њ–і–Ї–Є, –Ї—Г—А–Ї—Г–Љ—Л –Є –і—А—Г–≥–Є—Е.
–†–∞—Б—В–Њ—А–Њ–њ—И–∞ –њ—П—В–љ–Є—Б—В–∞—П (Silybum marianum (L.) Gaertn; Carduus marianus (L.)) – —Н—В–Њ –Њ–і–љ–Њ–ї–µ—В–љ–µ–µ –Є–ї–Є –і–≤—Г—Е–ї–µ—В–љ–µ–µ –Ї–Њ–ї—О—З–µ–µ —А–∞—Б—В–µ–љ–Є–µ —А–Њ–і–∞ —А–∞—Б—В–Њ—А–Њ–њ—И–∞ —Б–µ–Љ–µ–є—Б—В–≤–∞ –∞—Б—В—А–Њ–≤—Л—Е. –†–∞—Б—В–µ—В –љ–∞ —Б–Ї–∞–ї–Є—Б—В—Л—Е –њ–Њ—З–≤–∞—Е –Є —И–Є—А–Њ–Ї–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–∞ –≤ –Х–≤—А–Њ–њ–µ (–°—А–µ–і–Є–Ј–µ–Љ–љ–Њ–Љ–Њ—А—М–µ), –°–µ–≤–µ—А–љ–Њ–є –Р—Д—А–Є–Ї–µ, –°–µ–≤–µ—А–љ–Њ–є –Р–Љ–µ—А–Є–Ї–µ, –Р–≤—Б—В—А–∞–ї–Є–Є, –љ–∞ –Ъ–∞–≤–Ї–∞–Ј–µ –Є –С–ї–Є–ґ–љ–µ–Љ –Т–Њ—Б—В–Њ–Ї–µ, –≤ –°—А–µ–і–љ–µ–є –Р–Ј–Є–Є.
–Т –≤—Л—Б–Њ—В—Г —А–∞—Б—В–µ–љ–Є–µ –і–Њ—Б—В–Є–≥–∞–µ—В 1,5 –Љ–µ—В—А–Њ–≤, —Ж–≤–µ—В–µ—В –≤ –Є—О–ї–µ––∞–≤–≥—Г—Б—В–µ –Ї—А–∞—Б–Є–≤—Л–Љ–Є –±–Њ—А–і–Њ–≤—Л–Љ–Є –Є–ї–Є –њ—Г—А–њ—Г—А–љ—Л–Љ–Є —Ж–≤–µ—В–Ї–∞–Љ–Є, —Б–Њ–±—А–∞–љ–љ—Л–Љ–Є –≤ –Ї—А—Г–њ–љ—Л–µ –Њ–і–Є–љ–Њ—З–љ—Л–µ –Ї–Њ—А–Ј–Є–љ–Ї–Є —Б —З–µ—А–µ–њ–Є—В—З–∞—В–Њ–є –Њ–±–µ—А—В–Ї–Њ–є, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј –Ї–Њ–ї—О—З–Є—Е –Ј–µ–ї–µ–љ—Л—Е –ї–Є—Б—В–Њ—З–Ї–Њ–≤. –Т –і—А–µ–≤–љ–Њ—Б—В–Є —Ж–≤–µ—В–Ї–Є –њ—А–Є–Љ–µ–љ—П–ї–Є –і–ї—П –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П —В–Ї–∞–љ–µ–є –≤ –њ—Г—А–њ—Г—А–љ—Л–є —Ж–≤–µ—В, –±–ї–∞–≥–Њ–і–∞—А—П —З–µ–Љ—Г –Є–Ј–≤–µ—Б—В–љ–Њ –Є –і—А—Г–≥–Њ–µ, –љ–µ—Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –љ–∞–Ј–≤–∞–љ–Є–µ —А–∞—Б—В–µ–љ–Є—П – –Ь–∞—А–µ–љ–∞ –Ї—А–∞—Б–Є–ї—М–љ–∞—П. –Ы–Є—Б—В—М—П –†–∞—Б—В–Њ—А–Њ–њ—И–Є –њ—П—В–љ–Є—Б—В–Њ–є –Ї—А—Г–њ–љ—Л–µ, —П—А–Ї–Њ––Ј–µ–ї–µ–љ—Л–µ –Є –±–ї–µ—Б—В—П—Й–Є–µ. –Т—Б—П –њ–ї–∞—Б—В–Є–љ–Ї–∞ –ї–Є—Б—В–∞ –њ–Њ–Ї—А—Л—В–∞ –±–µ–ї—Л–Љ–Є –њ—П—В–љ–∞–Љ–Є –Є –њ—А–Њ–љ–Є–Ј–∞–љ–∞ –ґ–Є–ї–Ї–∞–Љ–Є, –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –љ–∞ —А–∞–Ј–ї–Њ–Љ–µ –≤—Л–і–µ–ї—П–µ—В—Б—П –Љ–ї–µ—З–љ—Л–є —Б–Њ–Ї. –Ъ—А–∞—П –ї–Є—Б—В—М–µ–≤ –Є –ґ–Є–ї–Ї–Є —Б –Њ–±—А–∞—В–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л –ї–Є—Б—В–∞ –Є–Љ–µ—О—В –ґ–µ–ї—В–Њ–≤–∞—В—Л–µ –Ї–Њ–ї—О—З–Ї–Є, –≤—Б–ї–µ–і—Б—В–≤–Є–µ —З–µ–≥–Њ —А–∞—Б—В–µ–љ–Є–µ –≤ –†–Њ—Б—Б–Є–Є –љ–∞–Ј—Л–≤–∞—О—В «—З–µ—А—В–Њ–њ–Њ–ї–Њ—Е» –Є–ї–Є «–Њ—Б—В—А–Њ––њ–µ—Б—В—А–Њ», –∞ –≤ –∞–љ–≥–ї–Њ—П–Ј—Л—З–љ—Л—Е —Б—В—А–∞–љ–∞—Е «milk thiestl» –Є–ї–Є «lady’s thistle» – «–Љ–Њ–ї–Њ—З–љ—Л–є –Є–ї–Є –ґ–µ–љ—Б–Ї–Є–є —З–µ—А—В–Њ–њ–Њ–ї–Њ—Е» (—А–Є—Б. 4–6).
–Я–ї–Њ–і –†–∞—Б—В–Њ—А–Њ–њ—И–Є –њ—П—В–љ–Є—Б—В–Њ–є – —Б–µ–Љ—П–љ–Ї–∞ —Б —Е–Њ—Е–Њ–ї–Ї–Њ–Љ, –Ї–Њ—В–Њ—А–∞—П –Є —Б–Њ–і–µ—А–ґ–Є—В –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –≤ –Љ–µ–і–Є—Ж–Є–љ–µ –∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ –Є —П–≤–ї—П–µ—В—Б—П —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ —Б—Л—А—М–µ–Љ. –Т –њ—А–Є—А–Њ–і–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –†–∞—Б—В–Њ—А–Њ–њ—И–∞ –њ—П—В–љ–Є—Б—В–∞—П —П–і–Њ–≤–Є—В–∞ –і–ї—П –Љ–ї–µ–Ї–Њ–њ–Є—В–∞—О—Й–Є—Е –ґ–Є–≤–Њ—В–љ—Л—Е –Є –і–Њ–Љ–∞—И–љ–µ–≥–Њ —Б–Ї–Њ—В–∞, –љ–Њ —П–≤–ї—П–µ—В—Б—П —Е–Њ—А–Њ—И–Є–Љ –Љ–µ–і–Њ–љ–Њ—Б–Њ–Љ (—А–Є—Б. 7 –Є 8).
–Я—А–Є –њ—А–Є–µ–Љ–µ –≤–љ—Г—В—А—М –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –і–Њ—Б—В–Є–≥–∞–µ—В –Љ–∞–Ї—Б–Є–Љ—Г–Љ–∞ —Г–ґ–µ —З–µ—А–µ–Ј 30 –Љ–Є–љ—Г—В, –∞ –Љ–∞–Ї—Б–Є–Љ—Г–Љ –≤—Л–і–µ–ї–µ–љ–Є—П —Б –ґ–µ–ї—З—М—О –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П —З–µ—А–µ–Ј 2 —З–∞—Б–∞. –Я–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В 5,5–6 —З–∞—Б–Њ–≤. –Я—А–µ–њ–∞—А–∞—В —Б–ї–∞–±–Њ —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П —Б –±–µ–ї–Ї–∞–Љ–Є –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є. –§–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–∞ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –њ–Њ–і—З–Є–љ—П–µ—В—Б—П –Њ–±—Й–Є–Љ –і–ї—П —Б—В–µ—А–Њ–Є–і–Њ–≤ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В—П–Љ:
– –њ—А–Є –њ—А–Є–µ–Љ–µ –≤–љ—Г—В—А—М –і–ї—П –љ–µ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –љ–Є–Ј–Ї–∞—П (–љ–µ –±–Њ–ї–µ–µ 5%) –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М, –Ї–Њ—В–Њ—А–∞—П —П–≤–ї—П–µ—В—Б—П —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –≥–Є–і—А–Њ—Д–Њ–±–љ–Њ—Б—В–Є;
– —Б–Є–ї–Є–Љ–∞—А–Є–љ –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –њ—А–µ–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–µ—З–µ–љ–Њ—З–љ–Њ–Љ—Г –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ—Г: –њ–µ—А–≤–Є—З–љ–Њ–Љ—Г – c —Г—З–∞—Б—В–Є–µ–Љ –°–£–†450 3–Р4; –≤—В–Њ—А–Є—З–љ–Њ–Љ—Г (–Њ–Ї–Њ–ї–Њ 40% –Њ—В –њ—А–Є–љ—П—В–Њ–є –і–Њ–Ј—Л) – –њ—Г—В–µ–Љ —Б—Г–ї—М—Д–∞—В–Є—А–Њ–≤–∞–љ–Є—П –Є–ї–Є –≥–ї—О–Ї—Г—А–Њ–љ–Є–Ј–∞—Ж–Є–Є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –∞–Ї—В–Є–≤–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–µ–є –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤ –ґ–µ–ї—З—М.
–°–µ–Ї—А–µ—Ж–Є—П —Б—Г–ї—М—Д–∞—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є –≥–ї—О–Ї—Г—А–Њ–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤ –ґ–µ–ї—З—М –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –∞–Ї—В–Є–≤–љ–Њ —Б —Г—З–∞—Б—В–Є–µ–Љ –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–∞ –† (MDR2) –Є Na+––Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–µ—А–∞ –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є—Е –∞–љ–Є–Њ–љ–Њ–≤ –Є —Б–Њ–ї–µ–є –ґ–µ–ї—З–љ—Л—Е –Ї–Є—Б–ї–Њ—В —З–µ—А–µ–Ј –Ї–∞–љ–∞–ї–Є–Ї—Г–ї—П—А–љ—Г—О –Љ–µ–Љ–±—А–∞–љ—Г –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞ (–ТSEP) [6]. –У–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ MDR2 —Б–µ–≥–Њ–і–љ—П —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В, –Ї–∞–Ї –Њ–і–Є–љ –Є–Ј —Д–∞–Ї—В–Њ—А–Њ–≤ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–є –≤–∞—А–Є–∞–±–µ–ї—М–љ–Њ—Б—В–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є –Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Б—В–∞–љ–і–∞—А—В–Є–Ј–∞—Ж–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –≤ –†–Ъ–Ш [7,8].
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —А–∞—Б—Й–µ–њ–ї–µ–љ–Є—П –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–Њ–є –і–Њ 40% –≤—Л–і–µ–ї–Є–≤—И–µ–≥–Њ—Б—П —Б –ґ–µ–ї—З—М—О —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –≤–љ–Њ–≤—М —А–µ–∞–±—Б–Њ—А–±–Є—А—Г–µ—В—Б—П, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ —Б–Њ–Ј–і–∞–µ—В—Б—П –Ї–Є—И–µ—З–љ–Њ––њ–µ—З–µ–љ–Њ—З–љ—Л–є –Ї—А—Г–≥–Њ–Њ–±–Њ—А–Њ—В. –Т –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≤ –љ–µ–Љ —Б–Є–ї–Є–±–Є–љ–—Д–Њ—Б—Д–∞—В–Є–і–Є–ї—Е–Њ–ї–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є –Њ–±—Л—З–љ–Њ –≤ —Н–Ї—Б—В—А–∞–Ї—В–µ –Є–Ј —Б–µ–Љ—П–љ –†–∞—Б—В–Њ—А|–Њ–њ—И–Є –њ—П—В–љ|–Є—Б—В–Њ–є —Б–Њ–і–µ—А–ґ–Є—В—Б—П –≤ –Њ—З–µ–љ—М –љ–µ–±–Њ–ї—М—И–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ. –С–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М —Н—В–Њ–≥–Њ –Є–Ј–Њ–Љ–µ—А–∞ —Б–Є–ї–Є–±–Є–љ–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –µ–≥–Њ –≤—Л—Б–Њ–Ї–Є–Љ —Б—А–Њ–і—Б—В–≤–Њ–Љ –Ї –Ї–ї–µ—В–Њ—З–љ—Л–Љ –Љ–µ–Љ–±—А–∞–љ–∞–Љ —Н–њ–Є—В–µ–ї–Є–Њ—Ж–Є—В–Њ–≤ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є [9].
–Я–µ—А–≤—Л–µ –љ–∞—Г—З–љ—Л–µ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –Ї–∞–Ї –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–∞ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –≤ —Ж–µ–ї–Њ–Љ —А—П–і–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ –љ–∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –≤ –Ї–Њ—В–Њ—А—Л—Е –і–Є—Д—Д—Г–Ј–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –њ–µ—З–µ–љ–Є –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–ї–Є –њ–∞—А–∞—Ж–µ—В–∞–Љ–Њ–ї–Њ–Љ, —З–µ—В—Л—А–µ—Е—Е–ї–Њ—А–Є—Б—В—Л–Љ —Г–≥–ї–µ—А–Њ–і–Њ–Љ, —Н—В–∞–љ–Њ–ї–Њ–Љ, D––≥–∞–ї–∞–Ї—В–Њ–Ј–∞–Љ–Є–љ–Њ–Љ –Є —В–Њ–Ї—Б–Є–љ–Њ–Љ –±–ї–µ–і–љ–Њ–є –њ–Њ–≥–∞–љ–Ї–Є. –Т–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є —Б–Є–ї–Є–Љ–∞—А–Є–љ –Њ–Ї–∞–Ј–∞–ї—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –њ—А–Њ—В–Є–≤ –Њ—Б—В—А–Њ–≥–Њ —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ —Е–Њ–ї–µ—Б—В–∞–Ј–∞, —Г—Б–Є–ї–Є–≤–∞–ї —Е–Њ–ї–µ—А–µ–Ј –Є –Њ–Ї–∞–Ј—Л–≤–∞–ї –њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ –љ–∞—А—Г–ґ–љ—Г—О –Љ–µ–Љ–±—А–∞–љ—Г –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤ –Є –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–µ –Љ–µ–Љ–±—А–∞–љ—Л –Њ—А–≥–∞–љ–µ–ї–ї, –њ—А–µ–њ—П—В—Б—В–≤—Г—П –і–µ—Б—В—А—Г–Ї—Ж–Є–Є –Њ–±—А–∞–Ј—Г—О—Й–µ–≥–Њ —Н—В–Є –Љ–µ–Љ–±—А–∞–љ—Л —Д–Њ—Б—Д–∞—В–Є–і–Є–ї—Е–Њ–ї–Є–љ–∞ –Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—О –≤ –љ–Є—Е —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞. –Ъ–∞–Ї –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А, —Б–Є–ї–Є–Љ–∞—А–Є–љ —В–∞–Ї–ґ–µ –Њ–Ї–∞–Ј–∞–ї—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –њ—А–Є —А–∞–і–Є–∞—Ж–Є–Њ–љ–љ–Њ–Љ, –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–Љ –Є –≤–Є—А—Г—Б–љ–Њ–Љ (HBV) –њ–Њ—А–∞–ґ–µ–љ–Є–Є –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤. –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –±—Л–ї–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Њ—Б–љ–Њ–≤–љ—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —П–≤–ї—П—О—В—Б—П:
– –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –њ—А–Є–≤–Њ–і—П—Й–∞—П –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Я–Ю–Ы –Є –µ–≥–Њ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є–є, –Ј–∞—Й–Є—Й–∞—О—Й–∞—П –њ–Њ–ї–Є–љ–µ–љ–∞—Б—Л—Й–µ–љ–љ—Л–µ –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л, –≤—Е–Њ–і—П—Й–Є–µ –≤ —Б–Њ—Б—В–∞–≤ —Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ—Л—Е —Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–Њ–≤ –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ –Њ—В –Њ–Ї–Є—Б–ї–µ–љ–Є—П —Б–≤–Њ–±–Њ–і–љ—Л–Љ–Є —А–∞–і–Є–Ї–∞–ї–∞–Љ–Є;
– —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞—В—М —А–µ–≥–µ–љ–µ—А–∞—В–Њ—А–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї, —Б–Є–љ—В–µ–Ј –Ф–Э–Ъ –Є –±–µ–ї–Ї–∞ –≤ –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞—Е –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –†–Э–Ъ––Ј–∞–≤–Є—Б–Є–Љ—Л—Е –њ–Њ–ї–Є–Љ–µ—А–∞–Ј –Є —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —А–Є–±–Њ—Б–Њ–Љ. –Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –Њ–±–∞ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –њ—А–Є–≤–Њ–і—П—В –Ї –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —Б—В—А—Г–Ї—В—Г—А—Л –Љ–µ–Љ–±—А–∞–љ –Є –Њ—А–≥–∞–љ–µ–ї–ї –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤, —З—В–Њ, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –≤—Б–µ—Е —Д—Г–љ–Ї—Ж–Є–є –њ–µ—З–µ–љ–Є.
–Т –±–Њ–ї–µ–µ –њ–Њ–Ј–і–љ–Є—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞—Е –±—Л–ї–Њ —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –Є –∞–љ—В–Є—Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞, –Ї–Њ—В–Њ—А–Њ–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –±–ї–Њ–Ї–∞–і—Л –¶–Ю–У–2 –Є —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ –і—А—Г–≥–Є—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, TNF–α –Є –ї–µ–є–Ї–Њ—В—А–Є–µ–љ–∞ –Т4. –С–ї–∞–≥–Њ–і–∞—А—П —А–∞–Ј–≤–Є—В–Є—О –Љ–µ—В–Њ–і–Њ–≤ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –≥–µ–љ–µ—В–Є–Ї–Є —Г–і–∞–ї–Њ—Б—М —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞—В—М, —З—В–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –Њ–њ–Њ—Б—А–µ–і—Г–µ—В—Б—П —З–µ—А–µ–Ј –±–ї–Њ–Ї–∞–і—Г –≤ –≥–µ–њ–∞—В–Њ—Ж–Є—В–∞—Е –Є –Ј–≤–µ–Ј–і—З–∞—В—Л—Е –Ї–ї–µ—В–Ї–∞—Е —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ κB, –Ї–ї—О—З–µ–≤–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–∞ –Є –Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ –Њ—В –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞. –Э–∞ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Љ–Њ–і–µ–ї—П—Е –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Б–Ї–Њ—А–Њ—Б—В–Є —Д–Є–±—А–Њ–Ј–љ–Њ–є —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є —В–Ї–∞–љ–Є –њ–µ—З–µ–љ–Є, —З—В–Њ —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П –Ї–∞–Ї —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ї–ї–Є—А–µ–љ—Б–∞ —Б–≤–Њ–±–Њ–і–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤, —В–∞–Ї –Є —Б –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Л–Љ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ–Љ —Б–Є–љ—В–µ–Ј–∞ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞.
–Я–Њ –і–∞–љ–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ–∞—Е –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ–µ—З–µ–љ–Є —В–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –Ї–∞–Ї –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–Є–љ–і—А–Њ–Љ–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є —Ж–Є—В–Њ–ї–Є–Ј–∞, —В–∞–Ї –Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–∞, –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є, —З—В–Њ –ї–µ—З–µ–љ–Є–µ –±—Г–і–µ—В –њ—А–Њ–і–Њ–ї–ґ–∞—В—М—Б—П –≤ —В–µ—З–µ–љ–Є–µ 3–6 –Љ–µ—Б—П—Ж–µ–≤. –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —В–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –љ–µ –≤–ї–Є—П–µ—В –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ —Н—В–∞–љ–Њ–ї–∞, –љ–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –±—Л—Б—В—А–Њ–Љ—Г —Г–ї—Г—З—И–µ–љ–Є—О –і–µ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є –Є –±–µ–ї–Ї–Њ–≤–Њ–—Б–Є–љ—В–µ—В–Є—З–µ—Б–Ї–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є [10–14]. –Я–Њ –і–∞–љ–љ—Л–Љ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –∞–≤—В–Њ—А–Њ–≤, –њ—А–Є —В–Њ–Ї—Б–Є–Ї–Њ––Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е –њ–µ—З–µ–љ–Є —В–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ —В–∞–Ї–ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –Є –±–µ–Ј–Њ–њ–∞—Б–љ–∞ –њ—А–Є –≤–љ—Г—В—А–Є–њ–µ—З–µ–љ–Њ—З–љ–Њ–Љ —Е–Њ–ї–µ—Б—В–∞–Ј–µ [15].
–Х—Б—В–µ—Б—В–≤–µ–љ–љ–Њ, —З—В–Њ –њ—А–Є –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–Љ —Ж–Є—А—А–Њ–Ј–µ –њ–µ—З–µ–љ–Є —В–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Ж–Є—А—А–Њ–Ј–Њ–Љ (–Ї–ї–∞—Б—Б –Р –њ–Њ –І–∞–є–ї–і—Г), —Г –Ї–Њ—В–Њ—А—Л—Е –Њ–љ–∞ –њ—А–Є–≤–Њ–і–Є—В –љ–µ —В–Њ–ї—М–Ї–Њ –Ї —Г–ї—Г—З—И–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є –Є –њ–µ—З–µ–љ–Њ—З–љ—Л—Е –њ—А–Њ–±, –љ–Њ –Є —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є [16,17]. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –∞–≤—В–Њ—А—Л, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—П —Б–Є—Б—В–µ–Љ–љ–Њ–µ –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–µ –Є –∞–љ—В–Є—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞, –њ—А–Є–≤–Њ–і—П—Й–µ–µ –њ—А–Є –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–Љ —Ж–Є—А—А–Њ–Ј–µ –њ–µ—З–µ–љ–Є –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Я–Ю–Ы, —В–Є—В—А–Њ–≤ —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—О —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–ї—Г—В–∞—В–Є–Њ–љ–∞ –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–∞—Е, —Б—В–∞–≤—П—В –њ–Њ–і —Б–Њ–Љ–љ–µ–љ–Є–µ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Д–Є–±—А–Њ–≥–µ–љ–µ–Ј–∞ [18–20].
–Ю–і–љ–∞–Ї–Њ –≤ —Ж–µ–ї–Њ–Љ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Г–Љ–µ–љ—М—И–∞—В—М –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ—А–Є –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–Љ —Ж–Є—А—А–Њ–Ј–µ –њ–µ—З–µ–љ–Є –Ј–∞ —Б—З–µ—В —Г–Љ–µ–љ—М—И–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л –Є —В—П–ґ–µ—Б—В–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є–Ј –≤–∞—А–Є–Ї–Њ–Ј–љ—Л—Е –≤–µ–љ –Є —Г–ї—Г—З—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –њ–µ—З–µ–љ–Є –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Њ–Љ–љ–µ–љ–Є—П. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞––∞–љ–∞–ї–Є–Ј–∞, –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –њ—А–Є —Ж–Є—А—А–Њ–Ј–µ –њ–µ—З–µ–љ–Є —Г –±–Њ–ї—М–љ—Л—Е, –і–ї–Є—В–µ–ї—М–љ–Њ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б–Є–ї–Є–Љ–∞—А–Є–љ, —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 10% (17% –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–љ—В—А–Њ–ї—П) [17]. –£ –±–Њ–ї—М–љ—Л—Е —Б –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –њ–µ—З–µ–љ–Є —В–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Є —Г–Љ–µ–љ—М—И–µ–љ–Є—О –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Љ–∞—А–Ї–µ—А–Њ–≤ —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П [21,22].
–Ґ–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ —В–∞–Ї–ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –њ—А–Є –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ—Л—Е —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е –Є —П—В—А–Њ–≥–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е –њ–µ—З–µ–љ–Є, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є –ї–µ—З–µ–љ–Є–Є —А–Є—Д–∞–Љ–њ–Є—Ж–Є–љ–Њ–Љ, –Є–Ј–Њ–љ–Є–∞–Ј–Є–і–Њ–Љ –Є —Д–µ–љ–Њ—В–Є–∞–Ј–Є–љ–∞–Љ–Є [23]. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –≤ –Ї–ї–Є–љ–Є–Ї–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –µ–≥–Њ —Г—Б–њ–µ—И–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –і–ї—П —Г–Љ–µ–љ—М—И–µ–љ–Є—П –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –∞–љ—В–Є—Е–Њ–ї–Є–љ—Н—Б—В–µ—А–∞–Ј–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л—Е –і–ї—П –ї–µ—З–µ–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ [24]. –Ґ–∞–Ї–ґ–µ –Є–Љ–µ—О—В—Б—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ, —З—В–Њ —Б–Є–ї–Є–Љ–∞—А–Є–љ –Љ–Њ–ґ–µ—В –±—Л—В—М –Є —Б–∞–Љ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –љ–µ–є—А–Њ–і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б–њ–Њ—Б–Њ–±–µ–љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ TNF–α –Є –њ—А–Њ–і—Г–Ї—Ж–Є—О NO–—Б–Є–љ—В–µ—В–∞–Ј—Л, –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е –∞–Ї—В–Є–≤–∞—Ж–Є—О –Љ–Є–Ї—А–Њ–≥–ї–Є–Є, –Є–≥—А–∞—О—Й–µ–є –Ї–ї—О—З–µ–≤—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є —Н—В–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є [25,26]. –С–ї–∞–≥–Њ–і–∞—А—П –∞–Ї—В–Є–≤–љ–Њ–Љ—Г –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–Љ—Г –і–µ–є—Б—В–≤–Є—О –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Г–Љ–µ–љ—М—И–∞—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ –Є –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ —З—Г–≤—Б—В–≤–∞ —Б–ї–∞–±–Њ—Б—В–Є, –Љ—Л—И–µ—З–љ–Њ–≥–Њ –љ–∞–њ—А—П–ґ–µ–љ–Є—П, –і–µ–њ—А–µ—Б—Б–Є–Є, –Њ—Й—Г—Й–µ–љ–Є—П –љ–∞—З–Є–љ–∞—О—Й–µ–≥–Њ—Б—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Б–Є–ї–Є–Љ–∞—А–Є–љ –Љ–Њ–ґ–µ—В —Г—Б–њ–µ—И–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б–Є–љ–і—А–Њ–Љ–∞ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Г—Б—В–∞–ї–Њ—Б—В–Є [27].
–Я—А–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е –њ–µ—З–µ–љ–Є –≤ –Њ–±—Й–µ–є –њ—А–∞–Ї—В–Є–Ї–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ –Љ–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –і–ї—П —Г–Љ–µ–љ—М—И–µ–љ–Є—П –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –∞–Љ–Є–Њ–і–∞—А–Њ–љ–∞ –Є –і–Њ–Ї—Б–Њ—А—Г–±–Є—Ж–Є–љ–∞ [28].
–Ю–і–љ–Є–Љ –Є–Ј —Б–∞–Љ—Л—Е –Ј–∞–Љ–µ—З–∞—В–µ–ї—М–љ—Л—Е —Б–≤–Њ–є—Б—В–≤ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Б—З–Є—В–∞—О—В –µ–≥–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Г–Љ–µ–љ—М—И–∞—В—М –Љ–∞—Б—И—В–∞–± –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—З–µ–љ–Є –њ—А–Є –Њ—В—А–∞–≤–ї–µ–љ–Є–Є –±–ї–µ–і–љ–Њ–є –њ–Њ–≥–∞–љ–Ї–Њ–є. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Б–Є–ї–Є–Љ–∞—А–Є–љ —П–≤–ї—П–µ—В—Б—П –∞–Ї—В–Є–≤–љ—Л–Љ –∞–љ—В–Є–і–Њ—В–Њ–Љ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —В–Њ–Ї—Б–Є–љ–∞ –±–ї–µ–і–љ–Њ–є –њ–Њ–≥–∞–љ–Ї–Є – –∞–Љ–∞–љ—В–Є–љ–∞ [29,30].
–Т —Ж–µ–ї–Њ–Љ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –і–µ—Б—П—В–Є–ї–µ—В–Є—П –±—Л–ї–∞ –њ–Њ–Ї–∞–Ј–∞–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е –≤–Є—А—Г—Б–љ—Л–Љ –≥–µ–њ–∞—В–Є—В–Њ–Љ. –Т —А–∞–±–Њ—В–∞—Е Polyak S.J. et al. –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ in vitro —Б–Є–ї–Є–Љ–∞—А–Є–љ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ –∞–љ—В–Є–≤–Є—А—Г—Б–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Ј–∞ c—З–µ—В –±–ї–Њ–Ї–∞–і—Л –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є NS5B –њ–Њ–ї–Є–Љ–µ—А–∞–Ј—Л, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–є —А–µ–њ–ї–Є–Ї–∞—Ж–Є—О HCV, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –Є –∞–љ—В–Є—Д–Є–±—А–Њ—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –љ–∞ —В–Ї–∞–љ—М –њ–µ—З–µ–љ–Є –Є –ї–µ–є–Ї–Њ—Ж–Є—В—Л. –Р–≤—В–Њ—А—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Г —Б–µ–Љ–Є –≤–∞–ґ–љ–µ–є—И–Є—Е —Д–ї–∞–≤–Њ–љ–Њ–ї–Є–≥–љ–∞–љ–Њ–≤ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –љ–∞–Є–±–Њ–ї—М—И–µ–є –∞–љ—В–Є–≤–Є—А—Г—Б–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Њ–±–ї–∞–і–∞–µ—В —В–∞–Ї—Б–Є—Д–Њ–ї–Є–љ, –∞ –і–∞–ї–µ–µ –≤ –њ–Њ—А—П–і–Ї–µ —Г–±—Л–≤–∞–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є: –Є–Ј–Њ—Б–Є–ї–Є–±–Є–љ –Р, —Б–Є–ї–Є–±–Є–љ –Т, —Б–Є–ї–Є–±–Є–љ –Р –Є —Б–Є–ї–Є–Ї—А–Є—Б—В–Є–љ (—В–∞–±–ї. 1).
–Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –≤–ї–Є—П—В—М –љ–∞ —А–µ–њ–ї–Є–Ї–∞—Ж–Є—О HBV –Є HCV –њ–Њ–Ї–∞ –љ–µ –і–Њ–Ї–∞–Ј–∞–љ–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Б—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є–Є –±–Њ–ї—М–љ—Л—Е –Є –љ–µ—Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–Њ—Б—В–Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е –і–∞–љ–љ—Л—Е –Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –∞–Ї—В–Є–≤–љ–Њ –і–Є—Б–Ї—Г—В–Є—А—Г–µ—В—Б—П. –Ю–і–љ–∞–Ї–Њ –≤—Б–µ –∞–≤—В–Њ—А—Л —Б—Е–Њ–і—П—В—Б—П –≤ –Њ–і–љ–Њ–Љ: —Б–Є–ї–Є–Љ–∞—А–Є–љ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–Љ–µ–љ—М—И–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–∞—Б–Ї–∞–і–∞ –Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В —А–µ–≥–µ–љ–µ—А–∞—Ж–Є—О –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤. –Э–∞ –њ—А–∞–Ї—В–Є–Ї–µ —Б—А–µ–і–Є –і—А—Г–≥–Є—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–Њ–≤ —Б–Є–ї–Є–Љ–∞—А–Є–љ –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ –≤–Є—А—Г—Б–љ–Њ–Љ –≥–µ–њ–∞—В–Є—В–µ –≤ –°–®–Р –њ—А–Є–Љ–µ–љ—П—О—В –Њ–Ї–Њ–ї–Њ 8–33% –±–Њ–ї—М–љ—Л—Е. –Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –њ–Њ–њ—Г–ї—П—А–љ–Њ—Б—В—М —Д–Є—В–Њ—В–µ—А–∞–њ–Є–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є HCV, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є –њ–ї–Њ—Е–Њ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –ї–µ—З–µ–љ–Є—П. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —В–µ—А–∞–њ–Є—П –њ–µ–≥–Є–ї–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Є–љ—В–µ—А—Д–µ—А–Њ–љ–Њ–Љ –Є —А–Є–±–∞–≤–Є—А–Є–љ–Њ–Љ –њ—А–Є–≤–Њ–і–Є—В –Ї —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є –≤–Є—А—Г—Б–∞ –љ–µ –±–Њ–ї–µ–µ —З–µ–Љ –≤ 55% —Б–ї—Г—З–∞–µ–≤ –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞—П —З–∞—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ –Љ–Њ–ґ–µ—В –њ–µ—А–µ–љ–Њ—Б–Є—В—М –і–ї–Є—В–µ–ї—М–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –Є–ї–Є –Є–Љ–µ–µ—В –Ї –љ–µ–Љ—Г –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П. –Т —Ж–µ–ї–Њ–Љ —А—П–і–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —В–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ —Г –±–Њ–ї—М–љ—Л—Е –љ–∞ —Д–Њ–љ–µ —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ї–Њ—А—А–µ–Ї—В–Є—А—Г–µ—В –љ–∞—А—Г—И–µ–љ–Є—П –њ–Є—Й–µ–≤–∞—А–µ–љ–Є—П, –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Б–ї–∞–±–Њ—Б—В–Є –Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞ [6,32].
–†–∞–Ј–ї–Є—З–љ—Л–µ –∞—Б–њ–µ–Ї—В—Л –ї–µ—З–µ–±–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Г –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е —Б–µ–≥–Њ–і–љ—П –љ–∞—Е–Њ–і—П—В—Б—П –≤ —Ж–µ–љ—В—А–µ –≤–љ–Є–Љ–∞–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –Є –Ї–ї–Є–љ–Є—Ж–Є—Б—В–Њ–≤. –Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б–Є–ї–Є–Љ–∞—А–Є–љ —Б–њ–Њ—Б–Њ–±–µ–љ –њ–Њ–і–∞–≤–ї—П—В—М –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –Ї–ї–µ—В–Њ–Ї —А–∞–Ї–∞ –њ—А–Њ—Б—В–∞—В—Л, –Љ–Њ–ї–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —П–Є—З–љ–Є–Ї–∞, –ї–µ–≥–Ї–Є—Е, —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є –Є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П [28,33–36].
–Р–љ—В–Є—А–∞–Ї–Њ–≤–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –µ–≥–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М –Љ–Є—В–Њ–Ј—Л –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ G1/S–—Д–∞–Ј–µ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ –Є –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—В—М –∞–њ–Њ–њ—В–Њ–Ј –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ —А–∞—Б—В–Њ—А–Љ–∞–ґ–Є–≤–∞–љ–Є—П —Ж–Є–Ї–ї–Є–љ––Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Ї–Є–љ–∞–Ј (p15, p21 –Є p27), –Ї–Њ—В–Њ—А—Л–µ –±–ї–Њ–Ї–Є—А—Г—О—В –і–µ–є—Б—В–≤–Є–µ –∞–љ—В–Є–∞–њ–Њ–њ—В–Њ–Ј–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї (Bcl–2 and Bcl–xL). –Я—А–Є –Њ–њ—Г—Е–Њ–ї—П—Е, –Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Њ—В –њ–Њ–ї–Њ–≤—Л—Е —Б—В–µ—А–Њ–Є–і–Њ–≤, —Б–Є–ї–Є–Љ–∞—А–Є–љ —Б–њ–Њ—Б–Њ–±–µ–љ —Б–≤—П–Ј—Л–≤–∞—В—М—Б—П –Ї–∞–Ї —Б —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤—Л–Љ–Є, —В–∞–Ї –Є —Б –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤—Л–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, –∞ —В–∞–Ї–ґ–µ –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М –њ—А–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є–є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є –∞–љ—В–Є–≥–µ–љ (–Я–°–Р). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П —П–і–µ—А–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (NF–kappa B) —Б–њ–Њ—Б–Њ–±–µ–љ —Г–Љ–µ–љ—М—И–∞—В—М –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –Я–Ю–Ы –Є —Г—А–Њ–≤–µ–љ—М –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –≥–Њ—В–Њ–≤–љ–Њ—Б—В–Є –≥–µ–њ–∞—В–Њ—Ж–Є—В–Њ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–Є–ї–Є–Љ–∞—А–Є–љ –њ–Њ–і–∞–≤–ї—П–µ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Ж–µ–ї–Њ–≥–Њ —А—П–і–∞ —Д–∞–Ї—В–Њ—А–Њ–≤, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е –і–ї—П –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї (cyclin D1, EGFR, COX–2, TGF–beta, IGF–IR), –Є—Е –Є–љ–≤–∞–Ј–Є–Є –≤ —В–Ї–∞–љ–Є (MMP–9), –∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј–∞ –≤ –Њ–њ—Г—Е–Њ–ї–Є (VEGF) –Є –Љ–µ—В–∞—Б—В–∞–Ј–Є—А–Њ–≤–∞–љ–Є—П (–Љ–Њ–ї–µ–Ї—Г–ї—Л –∞–і–≥–µ–Ј–Є–Є). –Т—Б–ї–µ–і—Б—В–≤–Є–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –±–µ–ї–Ї–Њ–≤ –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є (MDR) –≤ –Ї–ї–µ—В–Ї–∞—Е —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є, –њ–µ—З–µ–љ–Є –Є –њ–Њ—З–µ–Ї —Б–Є–ї–Є–Љ–∞—А–Є–љ —В–∞–Ї–ґ–µ —Б–њ–Њ—Б–Њ–±–µ–љ —Б–µ–љ—Б–Є–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞—В—М –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–µ –Ї–ї–µ—В–Ї–Є –Ї –і–µ–є—Б—В–≤–Є—О —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є. –Т—Б–ї–µ–і—Б—В–≤–Є–µ —Б–≤–Њ–µ–є –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б–Є–ї–Є–Љ–∞—А–Є–љ —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤–ї–Є—П–љ–Є—П –љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ –њ—А–Њ–Њ–љ–Ї–Њ–≥–µ–љ–Њ–≤: –ґ–µ—Б—В–Ї–Њ–≥–Њ —Г–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–∞, –і–Є–Љ–µ—В–Є–ї–±–µ–љ–Ј–∞–љ—В—А–∞—Ж–µ–љ–∞ (DMBA) –Є –і—А—Г–≥–Є—Е [37].
–Т —Ж–µ–ї–Њ–Љ —А—П–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–ї—Г—З–µ–љ—Л –Њ–±–љ–∞–і–µ–ґ–Є–≤–∞—О—Й–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є:
1) –Я–∞—Ж–Є–µ–љ—В—Л —Б HCV, –і–ї–Є—В–µ–ї—М–љ–Њ –њ–Њ–ї—Г—З–∞—О—Й–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ, —А–µ–ґ–µ –њ–Њ–≥–Є–±–∞—О—В –Њ—В –≥–µ–њ–∞—В–Њ–—Ж–µ–ї–ї—О–ї—П—А–љ–Њ–≥–Њ —А–∞–Ї–∞ [23].
2) –Я—А–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є —А–∞–Ї–∞ —Б–Є–ї–Є–Љ–∞—А–Є–љ –≤ –і–Њ–Ј–µ 800 –Љ–≥ –≤ —Б—Г—В–Ї–Є —Б–њ–Њ—Б–Њ–±–µ–љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Г–Љ–µ–љ—М—И–∞—В—М –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є–Є (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і–∞) [38–40].
–Ґ–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ –Њ–±–ї–∞–і–∞–µ—В –≤—Л—Б–Њ–Ї–Њ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М—О. –Э–Є –≤ –Њ–і–љ–Њ–Љ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —В–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ –≤ –і–Њ–Ј–µ 240–900 –Љ–≥ –≤ —Б—Г—В–Ї–Є –љ–µ –њ—А–Є–≤–µ–ї–∞ –Ї —А–∞–Ј–≤–Є—В–Є—О –Ј–љ–∞—З–Є–Љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –†—П–і –∞–≤—В–Њ—А–Њ–≤ —Б–Њ–Њ–±—Й–∞—О—В, —З—В–Њ –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –±–Њ–ї–µ–µ 1500 –Љ–≥ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –≤ —Б—Г—В–Ї–Є —Г 2–10% –±–Њ–ї—М–љ—Л—Е (–Ї–∞–Ї –Є –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ) –Љ–Њ–ґ–µ—В —А–∞–Ј–≤–Є—В—М—Б—П —Г–Љ–µ—А–µ–љ–љ–∞—П —В–Њ—И–љ–Њ—В–∞, –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М, —Б–ї–∞–±–Њ—Б—В—М, –Љ–µ—В–µ–Њ—А–Є–Ј–Љ –Є –њ–Њ—Б–ї–∞–±–ї–µ–љ–Є–µ —Б—В—Г–ї–∞, –Ї–Њ—В–Њ—А—Л–µ —П–≤–ї—П—О—В—Б—П —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –ґ–µ–ї—З–µ–≥–Њ–љ–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ [32,41,42].
–Ґ–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є —В–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–Љ—Г –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—О, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б–Є–ї–Є–Љ–∞—А–Є–љ –њ–Њ–і–∞–≤–ї—П–µ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М CYP3A4, CYP2D6 –Є CYP2C9. –Ю–і–љ–∞–Ї–Њ –љ–∞ –њ—А–∞–Ї—В–Є–Ї–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є —Б–Њ–≥–ї–∞—Б–љ—Л —Б —В–µ–Љ, –њ—А–Є —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ < 1500 –Љ–≥ —В–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ –љ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–Љ—Г –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–Љ—Г –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—О —Б –і—А—Г–≥–Є–Љ–Є —Б—Г–±—Б—В—А–∞—В–∞–Љ–Є —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ –Є –≥–ї–Є–Ї–Њ–њ—А–Њ—В–µ–Є–љ–∞ P [43–46].
–Ю—В–і–µ–ї—М–љ–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П —В—А–µ–±—Г–µ—В –Њ—Ж–µ–љ–Ї–∞ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –њ—А–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Є —В–Њ–Ї—Б–Є–Ї–Њ––Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ–µ—З–µ–љ–Є, –њ—А–Њ—В–µ–Ї–∞—О—Й–Є—Е —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Е–Њ–ї–µ—Б—В–∞–Ј–∞ – –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–Љ–Є –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–∞–Љ–Є –Є —Е–Њ–ї–µ—А–µ—В–Є–Ї–∞–Љ–Є [47].
–Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, —Б–Є–ї–Є–Љ–∞—А–Є–љ –Њ–±–ї–∞–і–∞–µ—В –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є —Е–Њ–ї–µ—А–µ—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Ї–∞–Ї –Ј–∞–≤–Є—Б–Є–Љ–Њ–є –Њ—В –ґ–µ–ї—З–љ—Л—Е –Ї–Є–ї–Њ—В, —В–∞–Ї –Є HCO3–––Ј–∞–≤–Є—Б–Є–Љ—Л—Е —Д—А–∞–Ї—Ж–Є–є –ґ–µ–ї—З–Є [48]. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —В–µ—А–∞–њ–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ «–љ–∞–≥—А—Г–ґ–∞–µ—В» –≤ –≥–µ–њ–∞—В–Њ—Ж–Є—В–µ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ —Б–Є—Б—В–µ–Љ—Л –∞–Ї—В–Є–≤–љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–∞ –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є—Е –∞–љ–Є–Њ–љ–Њ–≤ –Є –ґ–µ–ї—З–љ—Л—Е –Ї–Є—Б–ї–Њ—В, –∞ —В–∞–Ї–ґ–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —Б—Г–ї—М—Д—Г—А–Є—А–Њ–≤–∞–љ–Є—П –Є –≥–ї—О–Ї—Г—А–Њ–љ–Є–Ј–∞—Ж–Є–Є –Є —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –і–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –≤–љ—Г—В—А–Є–њ–µ—З–µ–љ–Њ—З–љ–Њ–≥–Њ —Е–Њ–ї–µ—Б—В–∞–Ј–∞. –Ю–і–љ–∞–Ї–Њ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Н—В–Њ–≥–Њ –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В. –Э–∞–њ—А–Њ—В–Є–≤, –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –≤—Л—П–≤–ї–µ–љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –≤ –і–Њ–Ј–µ 100 –Љ–≥/–Ї–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 5 –і–љ–µ–є –Ї—Г–њ–Є—А–Њ–≤–∞—В—М –≤–љ—Г—В—А–Є–њ–µ—З–µ–љ–Њ—З–љ—Л–є —Е–Њ–ї–µ—Б—В–∞–Ј –њ–Њ—Б–ї–µ –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–≥–Њ –≤/–≤ –≤–≤–µ–і–µ–љ–Є—П —В–Њ–Ї—Б–Є—З–љ–Њ–є –і–Њ–Ј—Л —В–∞—Г—А–Њ—Е–Њ–ї–∞—В–∞ (30 –Љ–Ї–Љ–Њ–ї—М/–Ї–≥) –Є–ї–Є –≤—Л–Ј–≤–∞–љ–љ—Л–є —Н—Б—В—А–Њ–≥–µ–љ–∞–Љ–Є. –Я–Њ –Љ–љ–µ–љ–Є—О –∞–≤—В–Њ—А–Њ–≤, –∞–љ—В–Є—Е–Њ–ї–µ—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П —З–µ—А–µ–Ј —Б—В–Є–Љ—Г–ї—П—Ж–Є—О –і–µ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є –Є BSEP––Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ —В—А–∞–љ—Б–њ–Њ—А—В–∞ –ґ–µ–ї—З–љ—Л—Е –Ї–Є—Б–ї–Њ—В —З–µ—А–µ–Ј –Ї–∞–љ–∞–ї–Є–Ї—Г–ї—П—А–љ—Г—О –Љ–µ–Љ–±—А–∞–љ—Г [49,50].
–Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–µ –≤–≤–µ–і–µ–љ–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –Ї—А—Л—Б–∞–Љ –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—О —А–∞–Ј–≤–Є—В–Є—П —Е–Њ–ї–µ—Б—В–∞–Ј–∞, –≤—Л–Ј–≤–∞–љ–љ–Њ–≥–Њ —Н—Б—В—А–Њ–≥–µ–љ–∞–Љ–Є [51]. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Е–Њ–ї–µ—Б—В–∞–Ј–∞ –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ –і–Њ–Ї–∞–Ј–∞–љ–∞ –≤ –†–Ъ–Ш, –∞ –њ–Њ—В–Њ–Љ—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –≤ —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ–Њ.
–Р–Ї—В–Є–≤–љ–Њ–µ —Е–Њ–ї–µ—А–µ—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –Љ–Њ–ґ–µ—В —В–∞–Ї–ґ–µ –њ—А–Є–≤–µ—Б—В–Є –Ї —А–∞–Ј–≤–Є—В–Є—О –і–Є—Б–њ–µ–њ—Б–Є–Є —Г –±–Њ–ї—М–љ—Л—Е —Б –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є —Б—Д–Є–љ–Ї—В–µ—А–∞ –Ю–і–і–Є –Є–ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –±–Є–ї–Є–∞—А–љ—Л–Љ –њ–∞–љ–Ї—А–µ–∞—В–Є—В–Њ–Љ. –Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —Н—В–Њ—В —А–Є—Б–Ї –Љ–Њ–ґ–љ–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–Ј–Є—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б–Њ —Б–њ–∞–Ј–Љ–Њ–ї–Є—В–Є–Ї–∞–Љ–Є —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–ї–Є –њ—А–Є—А–Њ–і–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П, —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≥–ї–∞–і–Ї–Њ–є –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Л –ґ–µ–ї—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є –Є –Ї–Є—И–µ—З–љ–Є–Ї–∞. –Ю–і–љ–Њ–є –Є–Ј –Є—Б—В–Њ—А–Є—З–µ—Б–Ї–Є –≤—Л–≤–µ—А–µ–љ–љ—Л—Е —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е —Б—Е–µ–Љ —В–∞–Ї–Њ–є —В–µ—А–∞–њ–Є–Є —П–≤–ї—П–µ—В—Б—П –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ —Б –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Є–Ј —А–∞—Б—В–µ–љ–Є–є —Б–µ–Љ–µ–є—Б—В–≤–∞ –Љ–∞–Ї–Њ–≤—Л—Е (—З–Є—Б—В–Њ—В–µ–ї, —Б–∞–љ–≥–≤–Є–љ–∞—А–Є—П, –і—Л–Љ—П–љ–Ї–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–∞—П), –Њ–±–ї–∞–і–∞—О—Й–Є—Е –∞–Ї—В–Є–≤–љ—Л–Љ —Б–њ–∞–Ј–Љ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–Љ –њ–∞–њ–∞–≤–µ—А–Є–љ–Њ–њ–Њ–і–Њ–±–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ.
–Ф—Л–Љ—П–љ–Ї–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–∞—П, –Є–ї–Є –і–Є–Ї–∞—П —А—Г—В–∞ (Fum|aria officin|alis.L) – –Њ–і–љ–Њ–ї–µ—В–љ–µ–µ —А–∞—Б—В–µ–љ–Є–µ —А–Њ–і–∞ –і—Л–Љ—П–љ–Ї–∞ (–њ–Њ–і—Б–µ–Љ–µ–є—Б—В–≤–Њ —Б–µ–Љ–µ–є—Б—В–≤–∞ –Љ–∞–Ї–Њ–≤—Л—Е). –†–∞—Б—В–µ—В –љ–∞ –Ј–∞–ї–µ–ґ–љ—Л—Е –ї—Г–≥–∞—Е, –њ–Њ–ї—П—Е, –Њ–≥–Њ—А–Њ–і–∞—Е, –Є–љ–Њ–≥–і–∞ –Ї–∞–Ї —Б–Њ—А–љ–Њ–µ —А–∞—Б—В–µ–љ–Є–µ –љ–∞ –њ–Њ—Б–µ–≤–∞—Е. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–∞ –њ–Њ –≤—Б–µ–є –Х–≤—А–Њ–њ–µ, –°—А–µ–і–Є–Ј–µ–Љ–љ–Њ–Љ–Њ—А—Б–Ї–Њ–Љ—Г –њ–Њ–±–µ—А–µ–ґ—М—О, –љ–∞ –Ъ–∞–≤–Ї–∞–Ј–µ –Є –≤ –Т–Њ—Б—В–Њ—З–љ–Њ–є –°–Є–±–Є—А–Є (—А–Є—Б. 9 –Є 10).
–Т –љ–∞—А–Њ–і–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –љ–∞—Б—В–Њ–Є –Є –љ–∞—Б—В–Њ–є–Ї–Є —В—А–∞–≤—Л –≤ –Ї–∞—З–µ—Б—В–≤–µ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–µ–≥–Њ, –Њ–±—Й–µ—Г–Ї—А–µ–њ–ї—П—О—Й–µ–≥–Њ, –Љ–Њ—З–µ–≥–Њ–љ–љ–Њ–≥–Њ, –њ–Њ—В–Њ–≥–Њ–љ–љ–Њ–≥–Њ –Є —Г–ї—Г—З—И–∞—О—Й–µ–≥–Њ –њ–µ—А–Є—Б—В–∞–ї—М—В–Є–Ї—Г –Ї–Є—И–µ—З–љ–Є–Ї–∞ —Б—А–µ–і—Б—В–≤–∞, –њ—А–Є —П–Ј–≤–µ –ґ–µ–ї—Г–і–Ї–∞ –Є –Љ–µ—В–µ–Њ—А–Є–Ј–Љ–µ. –Т –Ѓ–ґ–љ–Њ–є –Ш—В–∞–ї–Є–Є –Є –°–µ–≤–µ—А–љ–Њ–є –Р—Д—А–Є–Ї–µ –і—Л–Љ|—П–љ–Ї–∞ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –њ—А–Є–Љ–µ–љ—П–ї–∞—Б—М –і–ї—П –ї–µ—З–µ–љ–Є—П –Њ—В–µ–Ї–Њ–≤ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Њ—З–µ–≥–Њ–љ–љ–Њ–≥–Њ, –њ–Њ—В–Њ–≥–Њ–љ–љ–Њ–≥–Њ –Є –Њ—З–Є—Й–∞—О—Й–µ–≥–Њ —Б—А–µ–і—Б—В–≤–∞ –њ—А–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ–µ—З–µ–љ–Є –Є —Б–µ—А–і—Ж–∞ [52,53]. –Т –љ–∞—А–Њ–і–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ –С–Њ–ї–≥–∞—А–Є–Є –Є –У–µ—А–Љ–∞–љ–Є–Є –і—Л–Љ—П–љ–Ї—Г –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –і–ї—П –ї–µ—З–µ–љ–Є—П –≥–µ–њ–∞—В–Є—В–∞ —Б –ґ–µ–ї—В—Г—Е–Њ–є, –∞ —Б–≤–µ–ґ–Є–є —Б–Њ–Ї –њ—А–Є–Љ–µ–љ—П—О—В –њ—А–Є –Ї–Њ–ґ–љ–Њ–є —Б—Л–њ–Є –Є –ї–Є—И–∞—П—Е. –Т –љ–∞—Г—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Њ—Б–љ–Њ–≤–љ—Л–Љ –і–µ–є—Б—В–≤—Г—О—Й–Є–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ –і—Л–Љ—П–љ–Ї–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —П–≤–ї—П–µ—В—Б—П –∞–ї–Ї–∞–ї–Њ–Є–і —Д—Г–Љ–∞—А–Є–љ. –§—Г–Љ–∞—А–Є–љ, –њ—А–Њ—В–Њ–њ–Є–љ –Є –і—А—Г–≥–Є–µ –∞–ї–Ї–∞–ї–Њ–Є–і—Л –і—Л–Љ|—П–љ–Ї–Є –ї–µ–Ї|–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Б–њ–Њ—Б–Њ–±–љ—Л in vivo –∞–Ї—В–Є–≤–Є–Ј–Є—А–Њ–≤–∞—В—М –њ—А–Њ–і—Г–Ї—Ж–Є—О —Е–Њ–ї–µ—Ж–Є—Б—В–Њ–Ї–Є–љ–Є–љ–∞ –Є —Б–µ–Ї—А–µ—В–Є–љ–∞, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —Е–Њ–ї–µ—А–µ–Ј–∞ –Ј–∞ —Б—З–µ—В –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ–є –Њ—В –ґ–µ–ї—З–љ—Л—Е –Ї–Є—Б–ї–Њ—В —Д—А–∞–Ї—Ж–Є–Є, —Б–Њ–Ї—А–∞—Й–µ–љ–Є—О –ґ–µ–ї—З–љ–Њ–≥–Њ –њ—Г–Ј—Л—А—П –Є —Б–љ–Є–ґ–µ–љ–Є—О —В–Њ–љ—Г—Б–∞ —Б—Д–Є–љ–Ї—В–µ—А–∞ –Ю–і–і–Є [54]. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —В–∞–Ї–ґ–µ, —З—В–Њ —Д—Г–Љ–∞—А–Є–љ —Б–њ–Њ—Б–Њ–±–µ–љ —А–µ–≥—Г–ї–Є—А–Њ–≤–∞—В—М –Ї–∞–Ї –Њ—Б–ї–∞–±–ї–µ–љ–љ—Л–є, —В–∞–Ї –Є —Г—Б–Є–ї–µ–љ–љ—Л–є —Е–Њ–ї–µ—А–µ–Ј, –∞ —В–∞–Ї–ґ–µ, —Г—Б—В—А–∞–љ—П—П —Б–њ–∞–Ј–Љ —Б—Д–Є–љ–Ї—В–µ—А–∞ –Ю–і–і–Є, –Њ–±–ї–µ–≥—З–∞—В—М –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –ґ–µ–ї—З–Є –≤ –Ї–Є—И–µ—З–љ–Є–Ї, –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –Ї–Њ–љ–Ї—А–µ–Љ–µ–љ—В–Њ–≤ –≤ –њ—А–Њ—В–Њ–Ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ–µ –Є —А–µ–≥—Г–ї–Є—А–Њ–≤–∞—В—М –њ—А–Њ—Ж–µ—Б—Б—Л –ґ–µ–ї—З–µ–≤—Л–і–µ–ї–µ–љ–Є—П. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —З–µ—А–µ–Ј –Љ–µ—Е–∞–љ–Є–Ј–Љ –Њ–±—А–∞—В–љ–Њ–є —Б–≤—П–Ј–Є –Њ–љ —Б–љ–Є–ґ–∞–µ—В –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ, —Б–µ–Ї—А–µ—Ж–Є—О —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –≤ –ґ–µ–ї—З—М –Є —Б–Є–љ—В–µ–Ј —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –≤ –њ–µ—З–µ–љ–Є, —З—В–Њ —Г–Љ–µ–љ—М—И–∞–µ—В –ї–Є—В–Њ–≥–µ–љ–љ–Њ—Б—В—М –ґ–µ–ї—З–Є [55].
–Т–Љ–µ—Б—В–µ —Б —Б–Є–ї–Є–Љ–∞—А–Є–љ–Њ–Љ —Н–Ї—Б—В—А–∞–Ї—В –Є–Ј –і—Л–Љ|—П–љ–Ї–Є –ї–µ–Ї|–∞—А—Б—В–≤–µ–љ–љ–Њ–є –≤—Е–Њ–і–Є—В –≤ —Б–Њ—Б—В–∞–≤ –њ—А–µ–њ–∞—А–∞—В–∞ –У–µ–њ–∞–±–µ–љ–µ, –≤ –Њ–і–љ–Њ–є –Ї–∞–њ—Б—Г–ї–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–Є—В—Б—П 275 –Љ–≥ —Н–Ї—Б—В—А–∞–Ї—В–∞ Fumaria officinalis (–љ–µ –Љ–µ–љ–µ–µ 4,13 –Љ–≥ –∞–ї–Ї–∞–ї–Њ–Є–і–Њ–≤ –≤ –њ–µ—А–µ—Б—З–µ—В–µ –љ–∞ –њ—А–Њ—В—А–Њ–њ–Є–љ) –Є 70–150 –Љ–≥ —Н–Ї—Б—В—А–∞–Ї—В–∞ Fructus Sylibi mariani (50 –Љ–≥ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –Є 22 –Љ–≥ —Б–Є–ї–Є–±–Є–љ–Є–љ–∞). –Я–Њ –і–∞–љ–љ—Л–Љ –ѓ–Ї–Њ–≤–µ–љ–Ї–Њ –≠.–Я., –У—А–Є–≥–Њ—А—М–µ–≤–∞ –Я.–ѓ., –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –У–µ–њ–∞–±–µ–љ–µ –≤ –і–Њ–Ј–µ 1–2 –Ї–∞–њ—Б—Г–ї—Л 3 —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є –≤ —В–µ—З–µ–љ–Є–µ –Њ–і–љ–Њ–≥–Њ –Љ–µ—Б—П—Ж–∞ –њ—А–Є —В–Њ–Ї—Б–Є–Ї–Њ––Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е –њ–µ—З–µ–љ–Є, –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –≤–љ—Г—В—А–Є–њ–µ—З–µ–љ–Њ—З–љ–Њ–≥–Њ —Е–Њ–ї–µ—Б—В–∞–Ј–∞ (–ґ–Є—А–Њ–≤–Њ–є –≥–µ–њ–∞—В–Њ–Ј, —Б—В–µ–∞—В–Њ–≥–µ–њ–∞—В–Є—В, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –≥–µ–њ–∞—В–Є—В—Л –љ–Є–Ј–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞ –њ—А–Є —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, –њ—А–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є), –∞ —В–∞–Ї–ґ–µ –њ—А–Є –Ї–Њ–Љ–њ–µ–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л—Е —Ж–Є—А—А–Њ–Ј–∞—Е –њ–µ—З–µ–љ–Є –њ—А–Є–≤–Њ–і–Є–ї –Ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г —Г–ї—Г—З—И–µ–љ–Є—О –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ–± –њ–µ—З–µ–љ–Є –Є —Б—Г–±—К–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –±–Њ–ї—М–љ—Л—Е [54]. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –У–µ–њ–∞–±–µ–љ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Ї–ї–Є–љ–Є–Ї–Њ––±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Г –±–Њ–ї—М–љ—Л—Е –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ—А–∞–ґ–µ–љ–Є—П—Е –њ–µ—З–µ–љ–Є –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е —Б–і–≤–Є–≥–∞—Е. –У–µ–њ–∞–±–µ–љ–µ —Г—Б—В—А–∞–љ—П–µ—В –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Њ—В–Њ—А–љ–Њ–—Н–≤–∞–Ї—Г–∞—В–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –ґ–µ–ї—З–љ—Л—Е –њ—Г—В–µ–є –Є –Љ–Њ–ґ–µ—В –њ—А–Є–Љ–µ–љ—П—В—М—Б—П, –Ї–∞–Ї —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ —Б—А–µ–і—Б—В–≤–Њ –≤ –ї–µ—З–µ–љ–Є–Є –њ—А–µ–і–Ї–∞–Љ–µ–љ–љ–Њ–є —Б—В–∞–і–Є–Є –ґ–µ–ї—З–љ–Њ––Ї–∞–Љ–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є [55]. –Я–Њ –і–∞–љ–љ—Л–Љ –Ш–ї—М—З–µ–љ–Ї–Њ –Р.–Р. (2004), —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –У–µ–њ–∞–±–µ–љ–µ –њ—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є –±–Є–ї–Є–∞—А–љ–Њ–≥–Њ —Б–ї–∞–і–ґ–∞ –≤ —Д–Њ—А–Љ–µ –≤–Ј–≤–µ—Б–Є –≥–Є–њ–µ—А—Н—Е–Њ–≥–µ–љ–љ—Л—Е —З–∞—Б—В–Є—Ж –≤ 100% —Б–ї—Г—З–∞–µ–≤ –њ—А–Є–≤–µ–ї–∞ –Ї –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Б–Њ—Б—В–∞–≤–∞ –ґ–µ–ї—З–Є. –Я—А–Є –±–Є–ї–Є–∞—А–љ–Њ–Љ —Б–ї–∞–і–ґ–µ –≤ —Д–Њ—А–Љ–µ —Б–≥—Г—Б—В–Ї–Њ–≤ —Н—Е–Њ–љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ–є –ґ–µ–ї—З–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ 70% [56].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –У–µ–њ–∞–±–µ–љ–µ —Б–Њ–і–µ—А–ґ–Є—В –њ—А–Є—А–Њ–і–љ—Л–µ –≤–µ—Й–µ—Б—В–≤–∞ (—Б–Є–ї–Є–Љ–∞—А–Є–љ –Є —Д—Г–Љ–∞—А–Є–љ), –і–Њ–њ–Њ–ї–љ—П—О—Й–Є–µ –і—А—Г–≥ –і—А—Г–≥–∞ –њ–Њ —Б–њ–µ–Ї—В—А—Г –≥–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–є, –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ–Њ–є –Є —Е–Њ–ї–µ—А–µ—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є. –Я—А–µ–њ–∞—А–∞—В –Љ–Њ–ґ–µ—В –±–µ–Ј–Њ–њ–∞—Б–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М—Б—П –і–ї—П –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –њ–µ—З–µ–љ–Є, —В–Њ–Ї—Б–Є–Ї–Њ––Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Є –≤–Є—А—Г—Б–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ–µ—З–µ–љ–Є, –њ—А–Њ—В–µ–Ї–∞—О—Й–Є—Е –±–µ–Ј —Б–Є–љ–і—А–Њ–Љ–∞ —Е–Њ–ї–µ—Б—В–∞–Ј–∞, –∞ —В–∞–Ї–ґ–µ –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –≥–µ–њ–∞—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є –≤ –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є.



![–Ґ–∞–±–ї–Є—Ж–∞ 1. –У–µ–њ–∞—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Њ—Б–љ–Њ–≤–љ—Л—Е —Д–ї–∞–≤–Њ–љ–Њ–ї–Є–≥–љ–∞–љ–Њ–≤ —Б–Є–ї–Є–Љ–∞—А–Є–љ–∞ –њ—А–Є HCV [31]](/data/articles/Image/t18/n30/1837-6.gif)

–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. White C. P., Hirsch G., Patel S. et al.Complementary and alternative medicine use by patients chronically infected with hepatitis C virus Can J Gastroenterol. 2007 September; 21(9): 589–595.
2. Verma S., Thuluvath P. J.A–ї—М—В–µ—А–љ–∞—В–Є–≤–љ–∞—П –Љ–µ–і–Є—Ж–Є–љ–∞ –≤ –≥–µ–њ–∞—В–Њ–ї–Њ–≥–Є–Є: –Њ–±–Ј–Њ—А –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—П –Є –≥–µ–њ–∞—В–Њ–ї–Њ–≥–Є—П. —А—Г—Б—Б–Ї–Њ–µ –Є–Ј–і–∞–љ–Є–µ 2008; —В–Њ–Љ 1, –љ–Њ–Љ–µ—А 5: 361–371.
3. Pradhan S.C., Girish C. Hepatoprotective herbal drug, silymarin from experimental pharmacology to clinical medicine. Indian J Med Res 124, November 2006, pp 491–504.
4. Robinson A, McGrail MR. Disclosure of CAM use to medical practitioners: A review of qualitative and quantitative studies. Complement Ther Med. 2004;12:90–8.
5. 5–Т–∞–≤–Є–ї–Њ–≤–∞. –Э.–Ь. –У–Њ–Љ–µ–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є–Ї–∞. –Ь–¶ ”–≠–≤–µ—А–µ—Б—В”, –Ь–Њ—Б–Ї–≤–∞, 1994.
6. Miranda S.R., Lee,J. K., Brouwer K.L.R. et al. Hepatic Metabolism and Biliary Excretion of Silymarin Flavonolignans in Isolated Perfused Rat Livers Role of Mrp2 (Abcc2). Drug Metab Dispos. 2008 November; 36(11): 2219–2226.
7. Mayer KE, Myers RP, Lee SS. Silymarin treatment of viral hepatitis: a systematic review. J Viral Hepat. 2005;12:559–567.
8. Schrieber SJ, Wen Z, Dumas TE, Vourvahis M, Smith PC, Kashuba AD, Fried MW, Hawke RL. The pharmacokinetics of silymarin is altered in patients with chronic hepatitis c virus and nonalcoholic fatty liver disease and correlates with plasma caspase–3/7 activity. Drug Metab Dispos. 2008a;36:1909–1916.
9. Barzaghi N, Crema F, Gatti G, Pifferi G, Perucca E. Pharmacokinetic studies on Idb 1016, a silybinphosphatidylcholine complex, in healthy human subjects. Eur J Drug Meta Pharmacokinet 1990; 15 : 333–8.
10. Luper S. A review of plants used in the treatment of liver diseases: Part 1. Altern Med Rev 1998; 3 : 410–21.
11. Flora K, Hahn M, Rosen H, Benner K. Milk thistle (Silybum marianum) for the therapy of liver disease.
12. Miller AL. Antioxidant flavonoids: tructure, function and clinical usage. Altern Med Rev 1996; 1 : 103–11.J Gastroenterol 1998; 93 : 139–43.
13. Salmi HA, Sarna S. Effects of silymarin on chemical, functional and morphological alterations of the liver. A double–blind controlled study. Scand J Gastroenterol 1982; 17 : 517– 21.
14. Varga M, Buris L, Fodor M. Ethanol elimination in man under influence of hepatoprotective silibinin. Blutalkohol 1991; 28 : 405–8.
15. Muriel P; Rivera–Espinoza Y Beneficial drugs for liver diseases.J Appl Toxicol. 2008; 28(2):93–103.
16. Ferenci P, Dragosics B, Dittrich H, Frank H, Benda L, Lochs H, et al. Randomized controlled trial of silymarin treatment in patients with cirrhosis of the liver. J Hepatol 1989; 9 : 105–13.
17. Pares A, Planas R, Torres M, Caballera J, Viver JM, Acero D, et al. Effects of silymarin in alcoholic patients with cirrhosis of liver: results of a controlled doubleblind randomized and multicenter trial. J Hepatol 1998; 28 : 615–21.
18. Lucena MI, Andrade RJ, De la Cruz JP, Rodriguez–Mendizabal M, Blanco E, Sanchez de la Cuesta F. Effects of silymarin MZ–80 on oxidative stress in patients with alcoholic cirrhosis. Results of a randomized, double–blind, placebo–controlled clinical study. Int J Clin Pharmacol Ther 2002; 40 : 2–8.
19. Jacobs BP, Dennehy C, Ramirez G et al. Milk thistle for the treatment of liver disease: a systematic review and meta–analysis. Am J Med. 2002 Oct 15;113(6):506–15.
20. Rambaldi A, Jacobs BP, Gluud C.Milk thistle for alcoholic and/or hepatitis B or C virus liver diseases. Cochrane Database Syst Rev. 2007 Oct 17;(4):CD003620.
21. Velussi M, Cernigoi AM, De Monte A, Dapas F, Caffau C,Zilli M. Long–term (12 months) treatment with an antioxidant drug (silymarin) is effective on hyperinsulinemia, exogenous insulin need and malondialdehyde levels in cirrhotic diabetic patients. J Hepatol 1997; 26 : 871–9.
22. Tamayo C, Diamond S.Review of clinical trials evaluating safety and efficacy of milk thistle (Silybum marianum [L.] Gaertn.). Integr Cancer Ther. 2007 Jun;6(2):146–57.
23. Saller R, Meier R, Brignoli R. The use of silymarin in the treatment of liver diseases. Drugs 2001; 61 : 2035–63.
24. Saba P, Galeone F, Salvadorini F. Therapeutic actions of silymarin on chronic hepatopathies caused by psychopharmaceuticals. Gszz Med Ital 1976; 135 : 236–51.
25. Wang MJ, Lin WW, Chen HL, Chang YH, Ou HC, Kuo JS, et al. Silymarin protects dopaminergic neurons against lipopolysaccharide–induced neurotoxicity by inhibiting microglia activation. Eur J Neurosci 2002; 16 : 2103–12.
26. Khazanov VA; Vengerovsky AI Effect of silimarin, succinic acid, and their combination on bioenergetics of the brain in experimental encephalopathy.Bull Exp Biol Med. 2007; 144(6):806–9.
27. Maes M; Mihaylova I; Bosmans E. Not in the mind of neurasthenic lazybones but in the cell nucleus: patients with chronic fatigue syndrome have increased production of nuclear factor kappa beta.Neuro Endocrinol Lett. 2007; 28(4):456–62.
28. Kren V, Walterova D. Silybin and silymarin– New effects and applications. Biomed Papres 2005; 149 : 29–41.
29. Carducci R, Armellino MF, Volpe C, Basile G, Caso N,Apicella A, et al. Silibinin and acute poisoning with Amanita phalloides. Minerva Anestesiol 1996; 62 :187–93.
30. Enjalbert F, Rapior S, Nouguier–Soule J, Guillon S,Amouroux N, Cabot C. Treatment of amatoxin poisoning:20–year retrospective analysis. J Toxicol Clin Toxicol 2002; 40 : 715–57.
31. Polyak S.J., Morishima C., Lohmann V. et al. Identification of hepatoprotective flavonolignans from silymarin. Proc Natl Acad Sci U S A. 2010 March 30; 107(13): 5995–5999.
32. White C. P., Hirsch G., Patel S. et al.Complementary and alternative medicine use by patients chronically infected with hepatitis C virus Can J Gastroenterol. 2007 September; 21(9): 589–595.
33. Agarwal R; Agarwal C; Ichikawa H et al. Anticancer potential of silymarin: from bench to bed side.Anticancer Res. 2006; 26(6B):4457–98.
34. Ramasamy K; Agarwal R. Multitargeted therapy of cancer by silymarin.Cancer Lett. 2008; 269(2):352–62.
35. Hogan FS; Krishnegowda NK; Mikhailova M; Kahlenberg MS Flavonoid, silibinin, inhibits proliferation and promotes cell–cycle arrest of human colon cancer.J Surg Res. 2007; 143(1):58–65.
36. Deep G, Agarwal R.Chemopreventive efficacy of silymarin in skin and prostate cancer. Integr Cancer Ther. 2007 Jun;6(2):130–45.
37. Katiyar SK Silymarin and skin cancer prevention: anti–inflammatory, antioxidant and immunomodulatory effects (Review).Int J Oncol. 2005; 26(1):169–76.
38. Rat’kin AV; Saratikov AS; Chuchalin VS; Burkova VN; Frolov VN. Hepatoprotectors prevent the toxic action of cyclophosphamide on the liver of rats with CCl4–induced hepatitis model. Eksp Klin Farmakol. 2005; 68(2):47–50.
39. Comelli MC, Mengs U, Schneider C, Prosdocimi M.Toward the definition of the mechanism of action of silymarin: activities related to cellular protection from toxic damage induced by chemotherapy. Integr Cancer Ther. 2007 Jun;6(2):120–9.
40. Post–White J, Ladas EJ, Kelly KM.Advances in the use of milk thistle (Silybum marianum). Integr Cancer Ther. 2007 Jun;6(2):104–9.
41. Jacobs PB, Dennehy C, Ramirez G, Sapp J, Lawrence VA. Milk thistle for the treatment of liver disease: A systematic review and meta–analysis. Am J Med 2002; 113 : 506–15.
42. Adverse Reaction Advisory Committee. An adverse reaction to the herbal medication Milk thistle (Silybum marianum). Med J Aust 1999; 170 : 218–9.
43. Rao BN; Srinivas M; Kumar YS; Rao YM. Effect of silymarin on the oral bioavailability of ranitidine in healthy human volunteers.Drug Metabol Drug Interact. 2007; 22(2–3):175–85).
44. Doehmer J; Tewes B; Klein KU et al. Assessment of drug–drug interaction for silymarin.Toxicol In Vitro. 2008; 22(3):610–7.
45. Fuhr U; Beckmann–Knopp S; Jetter A; L—Мck ; Mengs U. The effect of silymarin on oral nifedipine pharmacokinetics.Planta Med. 2007; 73(14):1429–35.
46. Beckmann–Knopp S; Rietbrock S; Weyhenmeyer R et al.Inhibitory effects of silibinin on cytochrome P–450 enzymes in human liver microsomes.Pharmacol Toxicol. 2000; 86(6):250–6.
47. –≠.–Я. –ѓ–Ї–Њ–≤–µ–љ–Ї–Њ –Я. –ѓ. –У—А–Є–≥–Њ—А—М–µ–≤ –Э. –Р. –Р–≥–∞—Д–Њ–љ–Њ–≤–∞ –Р. –Т. –ѓ–Ї–Њ–≤–µ–љ–Ї–Њ. –Ь–µ—Е–∞–љ–Є–Ј–Љ—Л –ґ–µ–ї—З–µ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П–Є –ґ–µ–ї—З–µ–≥–Њ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л. –Ы–µ—З–∞—Й–Є–є –≤—А–∞—З, 2005, вДЦ 6 –љ–∞ —Б–∞–є—В–µ http://www.lvrach.ru.
48. Crocenzi FA, Sanchez Pozzi EJ. Beneficial effects of silymarin on estrogen–induced cholestasis in the rat: a study in vivo and in isolated hepatocyte couplets. Hepatology. 2001 Aug;34(2):329–39.
49. Crocenzi FA, Sanchez Pozzi EJ, Pellegrino JM et al. Preventive effect of silymarin against taurolithocholate–induced cholestasis in the rat. Biochem Pharmacol. 2003 Jul 15;66(2):355–64.
50. Crocenzi FA, Roma MG. Silymarin as a new hepatoprotective agent in experimental cholestasis: new possibilities for an ancient medication.Curr Med Chem. 2006;13(9):1055–74.
51. Crocenzi FA, Basiglio CL, Perez LM et al. Silibinin prevents cholestasis–associated retrieval of the bile salt export pump, Bsep, in isolated rat hepatocyte couplets: possible involvement of cAMP. Biochem Pharmacol. 2005 Apr 1;69(7):1113–20.
52. Tagarelli G., Tagarelli A., Piro A. Folk medicine used to heal malaria in Calabria (southern Italy). J Ethnobiol Ethnomed. 2010; 6: 27.
53. Leporatti M. L., Ghedira K. Comparative analysis of medicinal plants used in traditional medicine in Italy and Tunisia. J Ethnobiol Ethnomed. 2009; 5: 31.
54. –ѓ–Ї–Њ–≤–µ–љ–Ї–Њ –≠.–Я., –У—А–Є–≥–Њ—А—М–µ–≤ –Я.–ѓ. –•—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–µ—З–µ–љ–Є: –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є –ї–µ—З–µ–љ–Є–µ. –†–Ь–Ц, —В–Њ–Љ 11, вДЦ 5 . —Б—В—А. 291.
55. –Ш–ї—М—З–µ–љ–Ї–Њ –Ы.–Ѓ. –У–µ–њ–∞–±–µ–љ–µ –≤ –ї–µ—З–µ–љ–Є–Є –≥–µ–њ–∞—В–Њ–±–Є–ї–Є–∞—А–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Г –њ–Њ–ґ–Є–ї—Л—Е. –†–Ь–Ц, —В–Њ–Љ 5, вДЦ 1, —Б—В—А. 24.
56. –Ш–ї—М—З–µ–љ–Ї–Њ –Р.–Р. –Т–Њ–Ј–Љ–Њ–ґ–љ–∞ –ї–Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ —Е–Њ–ї–µ—Ж–Є—Б—В–Њ–ї–Є—В–Є–∞–Ј–∞? –Ґ–µ—А.–∞—А—Е–Є–≤. – 2004. – вДЦ2. – —Б.30–36.












