–Ш–Ј–Љ–µ–љ–Є–ї–Є—Б—М –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Є –Њ–± –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ —Б–Њ–Њ–±—Й–µ—Б—В–≤–∞ –Ї–Є—И–µ—З–љ–Є–Ї–∞. –Ь–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л, –љ–∞—Е–Њ–і—П—Й–Є–µ—Б—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ—Л –≤ –Љ–∞—В—А–Є—Ж–µ –њ–Њ–ї–Є–Љ–µ—А–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А, –њ—А–Њ–і—Г—Ж–Є—А—Г–µ–Љ—Л—Е —Б–∞–Љ–Є–Љ–Є –Љ–Є–Ї—А–Њ–±–∞–Љ–Є. –Я—А–Є —Н—В–Њ–Љ –і–∞–љ–љ–∞—П —Б—В—А—Г–Ї—В—Г—А–∞ –Є–Љ–µ–µ—В –≤–њ–Њ–ї–љ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Г—О –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є—О, –∞ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—В –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є, –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б—В–µ–њ–µ–љ–Є –Ї–Њ–Њ—А–і–Є–љ–Є—А—Г—П —Б–≤–Њ—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М. –Ф–∞–љ–љ–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –Ј–∞–ї–Њ–ґ–Є–ї–Њ –Њ—Б–љ–Њ–≤—Г –і–ї—П –≤–≤–µ–і–µ–љ–Є—П –њ–Њ–љ—П—В–Є—П Quorum Sensing (QS) (¬Ђ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–є –Ї–≤–Њ—А—Г–Љ¬ї), –Њ–њ—А–µ–і–µ–ї—П—О—Й–µ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ –Љ–Є–Ї—А–Њ–±–Њ–≤ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є. –†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –≤ —В–Њ–ї—Й–µ —Б–ї–Є–Ј–Є –Є –њ—А–Њ—Б–≤–µ—В–µ –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Љ–Є–Ї—А–Њ–±—Л —З–µ—А–µ–Ј QS –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –Ї–Њ–Њ—А–і–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Є–Љ–±–Є–Њ–љ—В–љ–Њ–µ –њ–Є—Й–µ–≤–∞—А–µ–љ–Є–µ, –Ї–Њ–ї–Њ–љ–Є–Ј–∞—Ж–Є–Њ–љ–љ—Г—О —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М, —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —Б –Ї–ї–µ—В–Ї–∞–Љ–Є –Љ–∞–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞.
–Т —Б–≤—П–Ј–Є —Б –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л–Љ–Є —Д—Г–љ–Ї—Ж–Є—П–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –≤—Л–њ–Њ–ї–љ—П–µ—В –Ї–Є—И–µ—З–љ–∞—П –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–∞, –∞ —В–∞–Ї–ґ–µ —Б —Г—З–µ—В–Њ–Љ –µ–µ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –Є —Б—В—А–Њ–≥–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –і–∞–љ–љ–Њ–µ —Б–Њ–Њ–±—Й–µ—Б—В–≤–Њ –і–Њ–ї–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М—Б—П –Ї–∞–Ї –µ—Й–µ –Њ–і–Є–љ –Њ—А–≥–∞–љ —З–µ–ї–Њ–≤–µ—З–µ—Б–Ї–Њ–≥–Њ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л —В–µ—А–Љ–Є–љ ¬Ђ–Ї–Є—И–µ—З–љ–∞—П –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–∞¬ї (intestinal flora) –Ј–∞–Љ–µ–љ—П–µ—В—Б—П —В–µ—А–Љ–Є–љ–Њ–Љ ¬Ђ–Ї–Є—И–µ—З–љ–∞—П –Љ–Є–Ї—А–Њ–±–Є–Њ—В–∞¬ї (gut microbiota) [4].
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є —Д—Г–љ–Ї—Ж–Є—П–Љ–Є –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л —П–≤–ї—П—О—В—Б—П:
вАУ –∞–љ—В–Є–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–∞—П –Ј–∞—Й–Є—В–∞;
вАУ –њ–Є—В–∞–љ–Є–µ —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є;
вАУ –≤—Б–∞—Б—Л–≤–∞–љ–Є–µ –Љ–Є–љ–µ—А–∞–ї–Њ–≤, –≤–Њ–і—Л;
вАУ —Б–Є–љ—В–µ–Ј –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –≥—А—Г–њ–њ—Л –Т –Є –Ъ;
вАУ —А–µ–≥—Г–ї—П—Ж–Є—П –ї–Є–њ–Є–і–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞;
вАУ —А–µ–≥—Г–ї—П—Ж–Є—П –∞–Ј–Њ—В–Є—Б—В–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞;
вАУ —А–µ–≥—Г–ї—П—Ж–Є—П –Ї–Є—И–µ—З–љ–Њ–є –Љ–Њ—В–Њ—А–Є–Ї–Є;
вАУ –Є–Љ–Љ—Г–љ–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Є.
–Ч–і–Њ—А–Њ–≤—М–µ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–∞–Љ–Є –≤–љ—Г—В—А–Є—Г—В—А–Њ–±–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П, —Г—Б–ї–Њ–≤–Є—П–Љ–Є –ґ–Є–Ј–љ–Є —А–µ–±–µ–љ–Ї–∞ –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е –Љ–µ—Б—П—Ж–µ–≤ –ґ–Є–Ј–љ–Є, –∞ —В–∞–Ї–ґ–µ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–є –ґ–Є–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Є–Љ–µ–љ–љ–Њ –њ–µ—А–≤—Л–µ –≥–Њ–і—Л –ґ–Є–Ј–љ–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ–µ—А–≤—Л–µ –Љ–µ—Б—П—Ж—Л, —П–≤–ї—П—О—В—Б—П –≤ —Н—В–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –љ–∞–Є–±–Њ–ї–µ–µ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є–Љ–Є вАУ –≤ —Б–≤—П–Ј–Є —Б –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ –Ї–Њ–ї–Њ–љ–Є–Ј–∞—Ж–Є–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Є —Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ–Љ –Ї–Є—И–µ—З–љ–Њ–≥–Њ –Љ–Є–Ї—А–Њ–±–Є–Њ—Ж–µ–љ–Њ–Ј–∞.
–Э–∞—А—Г—И–µ–љ–Є–µ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л (–і–Є—Б–±–Є–Њ–Ј) –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ—А–Є –Љ–љ–Њ–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –Є —Б–Њ—Б—В–Њ—П–љ–Є—П—Е. –Ґ–∞–Ї, –і–Є—Б–±–Є–Њ–Ј—Г –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –Ї–ї—О—З–µ–≤–∞—П —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –Љ–Њ—В–Њ—А–Є–Ї–Є –Њ—А–≥–∞–љ–Њ–≤ –њ–Є—Й–µ–≤–∞—А–µ–љ–Є—П, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –°–†–Ъ. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, —Б–Є–љ–і—А–Њ–Љ –Є–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ —А–Њ—Б—В–∞ (–°–Ш–С–†) –≤ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–µ –≤—Л—П–≤–ї—П–µ—В—Б—П —Г 75вАУ80% –і–µ—В–µ–є —Б –°–†–Ъ. –Я–Њ –і–∞–љ–љ—Л–Љ B.S. Collins –Є H.C. Lin (2010), –≤–Њ–і–Њ—А–Њ–і–љ—Л–є –і—Л—Е–∞—В–µ–ї—М–љ—Л–є —В–µ—Б—В (–Т–Ф–Ґ) —Б –ї–∞–Ї—В—Г–ї–Њ–Ј–Њ–є –≤—Л—П–≤–Є–ї –°–Ш–С–† —Г 91% –і–µ—В–µ–є 8вАУ18 –ї–µ—В —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–Љ–Є –±–Њ–ї—П–Љ–Є –Є –ї–Є—И—М —Г 35% –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (OR = 16,7, 95% –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї: 6,0вАУ57,5, p<0,0001) [5]. –Я–Њ –і–∞–љ–љ—Л–Љ E. Scarpellini (2009), –°–Ш–С–† –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Т–Ф–Ґ –±—Л–ї –≤—Л—П–≤–ї–µ–љ —Г 65% –і–µ—В–µ–є —Б –°–†–Ъ 4вАУ18 –ї–µ—В (28/43) –Є —Г 7% –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ (4/56; OR 3,9, 95% –Ф–Ш 7,3вАУ80,1, p<0,00001) [6].
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —А–∞–±–Њ—В –Х.–Р. –Ъ–Њ—А–љ–Є–µ–љ–Ї–Њ –Є —Б–Њ–∞–≤—В., –і–Є—Б–±–∞–Ї—В–µ—А–Є–Њ–Ј –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г 100% –і–µ—В–µ–є —Б –°–†–Ъ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 5 –і–Њ 17 –ї–µ—В –Є –≤—Л—А–∞–ґ–∞–µ—В—Б—П –≤ —Б–љ–Є–ґ–µ–љ–Є–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–Є—Д–Є–і–Њ–±–∞–Ї—В–µ—А–Є–є, –ї–∞–Ї—В–Њ–±–∞–Ї—В–µ—А–Є–є, —В–Є–њ–Є—З–љ–Њ–є –Ї–Є—И–µ—З–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Є, –∞ —В–∞–Ї–ґ–µ –њ—А–µ–≤—Л—И–µ–љ–Є–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ї–∞–Ї—В–Њ–Ј–Њ–љ–µ–≥–∞—В–Є–≤–љ–Њ–є –Ї–Є—И–µ—З–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Є. –Э–∞–ї–Є—З–Є–µ —Г—Б–ї–Њ–≤–љ–Њ-–њ–∞—В–Њ–≥–µ–љ–љ–Њ–є —Д–ї–Њ—А—Л (Staphylococcus aureus, Enterobacter cloacae, Pseudomonas aeruginosa, Candida albicans, Proteus mirabilis, Klebsiella pneumonia–µ, Acinetobacter anitratus) —В–∞–Ї–ґ–µ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –і–ї—П —Н—В–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П. –°–Ш–С–† –±—Л–ї –≤—Л—П–≤–ї–µ–љ —Г 88% –і–µ—В–µ–є. –Я—А–Є —Н—В–Њ–Љ —Г –≤—Б–µ—Е –і–µ—В–µ–є –±—Л–ї–∞ –њ–Њ–≤—Л—И–µ–љ–∞ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М, —З—В–Њ —П–≤–ї—П–µ—В—Б—П —Е–∞—А–∞–Ї—В–µ—А–љ—Л–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ –°–†–Ъ [7].
–Ъ–Є—И–µ—З–љ–∞—П –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–∞ —Б–њ–Њ—Б–Њ–±–љ–∞ –Љ–Њ–і—Г–ї–Є—А–Њ–≤–∞—В—М –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Г—О —А–µ—Ж–µ–њ—Ж–Є—О. –С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Є –њ—А–Є–µ–Љ–µ L. acidophilus —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —З–Є—Б–ї–Њ –Њ–њ–Є–Њ–Є–і–љ—Л—Е –Є –Ї–∞–љ–љ–∞–±–Є–љ–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Г –ґ–Є–≤–Њ—В–љ—Л—Е –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—О –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ –њ—А–Є–µ–Љ—Г 0,1 –Љ–≥ –Љ–Њ—А—Д–Є–љ–∞ –љ–∞ –Ї–≥ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ [8]. E. coli Nissle 1917 –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–µ –њ–Њ–і–∞–≤–ї—П–µ—В –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Г—О –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–Є —Е–Є–Љ–Є—З–µ—Б–Ї–Є –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Ї–Њ–ї–Є—В–µ [9]. L. paracasei —Б–љ–Є–ґ–∞–µ—В –≤–Є—Б—Ж–µ—А–∞–ї—М–љ—Г—О –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–Є, —Б–≤—П–Ј–∞–љ–љ–Њ–Љ —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ [10].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–Є—И–µ—З–љ–∞—П –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–∞ –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –Њ—А–≥–∞–љ–Њ–≤ –њ–Є—Й–µ–≤–∞—А–µ–љ–Є—П.
–Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –і–Є—Б–±–Є–Њ–Ј –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П —А–∞–Ј–≤–Є—В–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –љ–∞ –њ–µ—А–≤—Л–є –≤–Ј–≥–ї—П–і –љ–µ —Б–≤—П–Ј–∞–љ–љ—Л—Е –љ–∞–њ—А—П–Љ—Г—О —Б —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –Ї–Є—И–µ—З–љ–Є–Ї–∞. –Ъ —В–∞–Ї–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ –Њ—В–љ–Њ—Б—П—В—Б—П, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –Њ–ґ–Є—А–µ–љ–Є–µ, –°–Ф 2-–≥–Њ —В–Є–њ–∞, –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј, –Є—И–µ–Љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї–µ–Ј–љ—М —Б–µ—А–і—Ж–∞, —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В, –∞—Г—В–Є–Ј–Љ, —А–∞—Б—Б–µ—П–љ–љ—Л–є —Б–Ї–ї–µ—А–Њ–Ј.
–Ю–±—Б—Г–ґ–і–∞—П –≤–Њ–њ—А–Њ—Б—Л –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –Ї–Є—И–µ—З–љ–Њ–≥–Њ –і–Є—Б–±–Є–Њ–Ј–∞, —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ –µ–≥–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—А–µ–±–Є–Њ—В–Є–Ї–Њ–≤ –Є –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤ –≤ –њ—А–Њ–і—Г–Ї—В–∞—Е –њ–Є—В–∞–љ–Є—П. –Т –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —А–µ—З—М –Є–і–µ—В –Њ –њ–Є—Й–µ–≤—Л—Е –≤–Њ–ї–Њ–Ї–љ–∞—Е –Є –Ї–Є—Б–ї–Њ–Љ–Њ–ї–Њ—З–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–∞—Е. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —Г–ґ–µ –Є–Љ–µ—О—Й–Є—Е—Б—П –і–Є—Б–±–Є–Њ—В–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є, —В–Њ –љ–∞—З–Є–љ–∞—В—М –µ–µ —Б–ї–µ–і—Г–µ—В —Б —Г—Б—В—А–∞–љ–µ–љ–Є—П –Є—Е –њ—А–Є—З–Є–љ—Л. –Ф–Є—Б–±–Є–Њ–Ј –≤—Б–µ–≥–і–∞ —П–≤–ї—П–µ—В—Б—П –≤—В–Њ—А–Є—З–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ, –Є –њ–Њ–Є—Б–Ї –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –≤ –µ–≥–Њ —А–∞–Ј–≤–Є—В–Є–Є —Б–Њ—Б—В–Њ—П–љ–Є—П –Є–ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –Є—Е –Ї–Њ—А—А–µ–Ї—Ж–Є–µ–є вАУ –Ј–∞–і–∞—З–∞ –њ–µ—А–≤–Њ—Б—В–µ–њ–µ–љ–љ–Њ–є –≤–∞–ґ–љ–Њ—Б—В–Є. –Э—Г–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ —Б–≤—П–Ј–Є —Б –љ–∞—И–Є–Љ–Є –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л–Љ–Є –Ј–љ–∞–љ–Є—П–Љ–Є –Њ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–µ –≥–Њ–≤–Њ—А–Є—В—М –Њ —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –љ–∞ –љ–µ–µ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Ї–Њ—А—А–µ–Ї—Ж–Є—П –µ–µ —Б–Њ—Б—В–∞–≤–∞ –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –≤–њ–Њ–ї–љ–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ —Б –њ–Њ–Љ–Њ—Й—М—О —Б—А–µ–і—Б—В–≤, –Є–Ј–Љ–µ–љ—П—О—Й–Є—Е –≤–љ—Г—В—А–µ–љ–љ—О—О —Б—А–µ–і—Г –≤ –Ї–Є—И–Ї–µ, —Б–Њ–Ј–і–∞—О—Й–Є—Е –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —Г—Б–ї–Њ–≤–Є—П –і–ї—П —Б–∞–Љ–Њ–≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Љ–Є–Ї—А–Њ–±–Є–Њ—Ж–µ–љ–Њ–Ј–∞. –° —Н—В–Њ–є —Ж–µ–ї—М—О –љ–∞–Ј–љ–∞—З–∞—О—В—Б—П –њ—А–µ- –Є –њ—А–Њ–±–Є–Њ—В–Є–Ї–Є –≤ —Б–Њ—Б—В–∞–≤–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ґ–∞–Ї–ґ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —П–≤–ї—П–µ—В—Б—П —Д–µ–Ї–∞–ї—М–љ–∞—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П, –Њ–і–љ–∞–Ї–Њ –і–Њ –µ–µ –≤–љ–µ–і—А–µ–љ–Є—П –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –њ—А–µ–і—Б—В–Њ–Є—В –њ—А–Њ–є—В–Є –µ—Й–µ –і–ї–Є—В–µ–ї—М–љ—Л–є –њ—Г—В—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є.
–Я—А–µ–±–Є–Њ—В–Є–Ї–Є вАУ —Г–≥–ї–µ–≤–Њ–і—Л, –љ–µ–њ–µ—А–µ–≤–∞—А–Є–≤–∞–µ–Љ—Л–µ –≤ –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–∞—Е –Ц–Ъ–Ґ, –Ї–Њ—В–Њ—А—Л–µ –≤ —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–µ –Є–Ј–±–Є—А–∞—В–µ–ї—М–љ–Њ —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В —А–Њ—Б—В –Є/–Є–ї–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М ¬Ђ–њ–Њ–ї–µ–Ј–љ–Њ–є¬ї –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л. –Я—А–Њ–±–Є–Њ—В–Є–Ї–Є вАУ —Н—В–Њ –ґ–Є–≤—Л–µ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –≤ –∞–і–µ–Ї–≤–∞—В–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е –Њ–Ї–∞–Ј—Л–≤–∞—О—В –±–ї–∞–≥–Њ—В–≤–Њ—А–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ј–і–Њ—А–Њ–≤—М–µ —З–µ–ї–Њ–≤–µ–Ї–∞.
–Я—А–µ–±–Є–Њ—В–Є–Ї–Є —П–≤–ї—П—О—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ —Б—Г–±—Б—В—А–∞—В–Њ–Љ –і–ї—П —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –Ц–Ъ–Ґ, –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є. –І–µ—А–µ–Ј –њ—А–Њ—Ж–µ—Б—Б—Л –±—А–Њ–ґ–µ–љ–Є—П –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л –њ–Њ–ї—Г—З–∞—О—В —Н–љ–µ—А–≥–Є—О, –≤—Л–і–µ–ї—П—П –≤ –Њ–Ї—А—Г–ґ–∞—О—Й—Г—О –Є—Е —Б—А–µ–і—Г –ї–µ—В—Г—З–Є–µ –ґ–Є—А–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л, –Љ–Њ–ї–Њ—З–љ—Г—О –Ї–Є—Б–ї–Њ—В—Г, –≤–Њ–і–Њ—А–Њ–і –Є —А—П–і –і—А—Г–≥–Є—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–ї—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –Љ–љ–Њ–≥–Є—Е –ґ–Є–Ј–љ–µ–љ–љ–Њ –≤–∞–ґ–љ—Л—Е –і–ї—П –Љ–∞–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Ї–∞–Ї –≤ —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–µ, —В–∞–Ї –Є –Ј–∞ –µ–µ –њ—А–µ–і–µ–ї–∞–Љ–Є. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –±—Г—В–Є—А–∞—В —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ —Н–љ–µ—А–≥–Є–Є –і–ї—П —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є, —А–µ–≥—Г–ї—П—В–Њ—А–Њ–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Ї–Њ–ї–Њ–љ–Њ—Ж–Є—В–Њ–≤. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ–µ–є—И–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –Ј–і–Њ—А–Њ–≤—М—П –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ –≤ —Ж–µ–ї–Њ–Љ. –Т –≥—А—Г–і–љ–Њ–Љ –Љ–Њ–ї–Њ–Ї–µ —Б–Њ–і–µ—А–ґ–∞—В—Б—П –Њ–±–ї–∞–і–∞—О—Й–Є–µ –њ—А–µ–±–Є–Њ—В–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –Њ–ї–Є–≥–Њ—Б–∞—Е–∞—А–Є–і—Л, –∞ —Б–Љ–µ—Б–Є –і–ї—П –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤—Б–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є—П –і–Њ–ї–ґ–љ—Л –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –≤–Ї–ї—О—З–∞—В—М –Є—Е –≤ —Б–≤–Њ–є —Б–Њ—Б—В–∞–≤. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ —Д—А—Г–Ї—В–Њ–Њ–ї–Є–≥–Њ—Б–∞—Е–∞—А–Є–і—Л, –Є–љ—Г–ї–Є–љ, –њ–Є—Й–µ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –і–Њ–ї–ґ–љ—Л –њ—А–Є—Б—Г—В—Б—В–≤–Њ–≤–∞—В—М –≤ —А–∞—Ж–Є–Њ–љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞, –Њ–і–љ–∞–Ї–Њ –≤ –Њ–±—Л—З–љ–Њ–Љ —А–∞—Ж–Є–Њ–љ–µ –њ–Є—В–∞–љ–Є—П —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –њ—А–µ–±–Є–Њ—В–Є–Ї–Њ–≤ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ.
–Ъ –њ—А–Њ–±–Є–Њ—В–Є—З–µ—Б–Ї–Є–Љ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ –Њ—В–љ–Њ—Б—П—В—Б—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ —И—В–∞–Љ–Љ—Л –±–Є—Д–Є–і–Њ–±–∞–Ї—В–µ—А–Є–є, –ї–∞–Ї—В–Њ–±–∞—Ж–Є–ї–ї, –∞ —В–∞–Ї–ґ–µ –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Н–љ—В–µ—А–Њ–Ї–Њ–Ї–Ї–Є (Lactobacillus acidophilus, Lactobacillus ramnosus GG, Lactobacillus fermentum, Strepto (Entero) coccus faecium SF68, S. Thermophiles, Bifidobacterium spp.) –Є –≥—А–Є–±—Л (–≤ —З–∞—Б—В–љ–Њ—Б—В–Є, Saccharomices boulardii).
–Я—А–Њ–±–Є–Њ—В–Є–Ї–Є –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –њ—А–Є —В–∞–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е, –Ї–∞–Ї –Њ—Б—В—А—Л–µ –і–Є–∞—А–µ–Є (–Ї–Є—И–µ—З–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є), –∞–љ—В–Є–±–Є–Њ—В–Є–Ї-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–∞—П –і–Є–∞—А–µ—П, –і–Є–∞—А–µ—П –њ—Г—В–µ—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤, –°–†–Ъ, —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –Ј–∞–њ–Њ—А—Л, –Љ–ї–∞–і–µ–љ—З–µ—Б–Ї–Є–µ –Ї–Њ–ї–Є–Ї–Є, —Е–µ–ї–Є–Ї–Њ–±–∞–Ї—В–µ—А–љ–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П, –љ–µ–Ї—А–Њ—В–Є–Ј–Є—А—Г—О—Й–Є–є —Н–љ—В–µ—А–Њ–Ї–Њ–ї–Є—В —Г –љ–µ–і–Њ–љ–Њ—И–µ–љ–љ—Л—Е –і–µ—В–µ–є, –∞–ї–ї–µ—А–≥–Є—П –Є –∞—В–Њ–њ–Є—З–µ—Б–Ї–Є–є –і–µ—А–Љ–∞—В–Є—В [11]. –Ф–ї—П –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –і–Њ–Ї–∞–Ј–∞–љ–∞ –Є—Е –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М, –∞ –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –Ї—А–∞–є–љ–µ —А–µ–і–Ї–Њ [12, 13].
–Ю–і–љ–∞–Ї–Њ –і–∞–ї–µ–Ї–Њ –љ–µ –≤—Б–µ–≥–і–∞ —Г–і–∞–µ—В—Б—П –і–Њ—Б—В–Є—З—М —Е–Њ—А–Њ—И–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –і–Є—Б–±–Є–Њ–Ј–∞ –Ї–Є—И–µ—З–љ–Є–Ї–∞, –њ—А–Є–Љ–µ–љ—П—П —В–Њ–ї—М–Ї–Њ –њ—А–µ- –Є –њ—А–Њ–±–Є–Њ—В–Є–Ї–Є. –Э–µ—А–µ–і–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –њ—А–µ–њ–∞—А–∞—В—Л —Б –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –і–ї—П —Б–∞–љ–∞—Ж–Є–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ —Б–Њ–≥–ї–∞—Б–љ–Њ –њ—А–Њ—В–Њ–Ї–Њ–ї—Г –≤–µ–і–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –і–Є—Б–±–∞–Ї—В–µ—А–Є–Њ–Ј–Њ–Љ –Ї–Є—И–µ—З–љ–Є–Ї–∞ (–њ—А–Є–Ї–∞–Ј –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–§ –Њ—В 09.06.2003 вДЦ 231) [14].
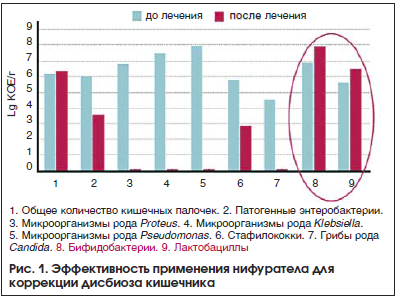
–Э–∞ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ —А—Л–љ–Ї–µ –†–§ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –Њ—А–Є–≥–Є–љ–∞–ї—М–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –µ–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ –љ–Є—Д—Г—А–∞—В–µ–ї (–Ь–∞–Ї–Љ–Є—А–Њ—А¬Ѓ), –Ї–Њ—В–Њ—А—Л–є –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –љ–Є—В—А–Њ—Д—Г—А–∞–љ–Њ–≤–Њ–Љ—Г —А—П–і—Г. –Ю–љ –Љ–Њ–ґ–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М—Б—П —Г–ґ–µ –љ–∞ –љ–∞—З–∞–ї—М–љ–Њ–Љ —Н—В–∞–њ–µ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –і–Є—Б–±–Є–Њ–Ј–∞ –љ–∞—А—П–і—Г —Б –∞–і—Б–Њ—А–±–µ–љ—В–∞–Љ–Є, —Д–µ—А–Љ–µ–љ—В–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –њ—А–Њ- –Є –њ—А–µ–±–Є–Њ—В–Є–Ї–∞–Љ–Є. –Ь–∞–Ї–Љ–Є—А–Њ—А¬Ѓ —Е–Њ—А–Њ—И–Њ –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –≤ –Ц–Ъ–Ґ –Є –Њ–±–ї–∞–і–∞–µ—В —И–Є—А–Њ–Ї–Є–Љ —Б–њ–µ–Ї—В—А–Њ–Љ –і–µ–є—Б—В–≤–Є—П –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –±–∞–Ї—В–µ—А–Є–є, –њ—А–Њ—Б—В–µ–є—И–Є—Е, –≥—А–Є–±–Њ–≤ (Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus, Bacillus subtilis, Escherichia coli, Shigella, Salmonella, Klebsiella spp., Enterobacter sph., Serratia spp., Citrobacter spp., Morganella spp., Rettgerella spp., Pragia fontium, Budvicia aquatica, Rachnella aquatilis –Є Acinetobacter spp., —Н–љ—В–µ—А–Њ–±–∞–Ї—В–µ—А–Є–є, —В—А–Є—Е–Њ–Љ–Њ–љ–∞–і, –∞–Љ–µ–±, –ї—П–Љ–±–ї–Є–є, Proteus, Pseudomonas, –≥—А–Є–±–Њ–≤ —А–Њ–і–∞ Candida). –Я—А–Є –і–Є—Б–±–∞–Ї—В–µ—А–Є–Њ–Ј–µ –Ї–Є—И–µ—З–љ–Є–Ї–∞ —З–∞—Б—В–Њ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –Є–Ј–±—Л—В–Њ—З–љ—Л–є —А–Њ—Б—В –≥—А–Є–±–Њ–≤ —А–Њ–і–∞ Candida. –Ь–∞–Ї–Љ–Є—А–Њ—А¬Ѓ, –Њ–±–ї–∞–і–∞—П –њ—А–Њ—В–Є–≤–Њ–≥—А–Є–±–Ї–Њ–≤–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –њ–Њ–і–∞–≤–ї—П–µ—В —А–Њ—Б—В –≥—А–Є–±–Њ–≤ —А–Њ–і–∞ Candida –Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞–µ—В —А–∞–Ј–≤–Є—В–Є–µ –Ї–∞–љ–і–Є–і–Њ–Ј–∞ —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤. –Т–∞–ґ–љ–Њ –њ—А–Є —Н—В–Њ–Љ, —З—В–Њ –Ь–∞–Ї–Љ–Є—А–Њ—А¬Ѓ —Б–љ–Є–ґ–∞–µ—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —Г—Б–ї–Њ–≤–љ–Њ-–њ–∞—В–Њ–≥–µ–љ–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—П –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —А–Њ—Б—В—Г –±–Є—Д–Є–і–Њ- –Є –ї–∞–Ї—В–Њ–±–∞–Ї—В–µ—А–Є–є (—А–Є—Б. 1) [14].
–С–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –љ–Є—Д—Г—А–∞—В–µ–ї–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 95%. –Э–Є—Д—Г—А–∞—В–µ–ї –≤–Љ–µ—И–Є–≤–∞–µ—В—Б—П –≤ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –љ–∞ —Г—А–Њ–≤–љ–µ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Ї–ї–µ—В–Ї–Є, –±–ї–Њ–Ї–Є—А—Г–µ—В —А—П–і —Н–љ–Ј–Є–Љ–љ—Л—Е —Ж–µ–њ–Њ—З–µ–Ї –Є —В–µ–Љ —Б–∞–Љ—Л–Љ –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В —А–∞–Ј–Љ–љ–Њ–ґ–µ–љ–Є—О –Є —А–Њ—Б—В—Г –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –Њ–±–ї–∞–і–∞—П –±–∞–Ї—В–µ—А–Є–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Ъ –љ–Є—Д—Г—А–∞—В–µ–ї—Г –љ–µ —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, —В. –Ї. –Њ–љ –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –њ–Њ—П–≤–ї–µ–љ–Є—О —Г—Б—В–Њ–є—З–Є–≤—Л—Е —И—В–∞–Љ–Љ–Њ–≤ (—А–∞–Ј–≤–Є—В–Є—О —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є —Г –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤). –Я—А–µ–њ—П—В—Б—В–≤—Г–µ—В –Њ–љ –Є —А–∞–Ј–≤–Є—В–Є—О –њ–µ—А–µ–Ї—А–µ—Б—В–љ–Њ–є —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ (–Љ–∞–Ї—А–Њ–ї–Є–і–∞–Љ, –∞–Љ–Є–љ–Њ–≥–ї–Є–Ї–Њ–Ј–Є–і–∞–Љ, –ї–Є–љ–Ї–Њ–Ј–∞–Љ–Є–і–∞–Љ, —В–µ—В—А–∞—Ж–Є–Ї–ї–Є–љ–∞–Љ, —Б—В—А–µ–њ—В–Њ–њ—А–∞–Љ–Є–љ–∞–Љ, —Е–ї–Њ—А–∞–Љ—Д–µ–љ–Є–Ї–Њ–ї—Г –Є —В. –і.).
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –Ь–∞–Ї–Љ–Є—А–Њ—А¬Ѓ –і–Њ–Ї–∞–Ј–∞–љ–∞ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ш–С–†, –Ї–Њ—В–Њ—А—Л–є —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї—Б—П –љ–∞ —Д–Њ–љ–µ –°–†–Ъ. –Я–Њ –і–∞–љ–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Г 30 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Т–Ф–Ґ —Б –ї–∞–Ї—В—Г–ї–Њ–Ј–Њ–є –њ—А–µ–≤—Л—И–∞–ї–Є –љ–Њ—А–Љ–∞–ї—М–љ—Л–µ, —З—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–ї–Њ –љ–∞ –љ–∞–ї–Є—З–Є–µ –°–Ш–С–†. –Я—А–Є –њ–Њ—Б—В—А–Њ–µ–љ–Є–Є –Њ–±—Й–µ–≥–Њ (—Г—Б—А–µ–і–љ–µ–љ–љ–Њ–≥–Њ) –≥—А–∞—Д–Є–Ї–∞ —А–µ–Ј—Г–ї—М—В–∞—В–∞ —В–µ—Б—В–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ-–°–Ш–С–† –љ–∞–±–ї—О–і–∞—О—В—Б—П 2 –њ–Є–Ї–∞ –њ–Њ–≤—Л—И–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤—Л–і—Л—Е–∞–µ–Љ–Њ–≥–Њ –≤–Њ–і–Њ—А–Њ–і–∞, —З—В–Њ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –і–ї—П –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –Ї–Њ–љ—В–∞–Љ–Є–љ–∞—Ж–Є–Є —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є. –£ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л –љ–∞–±–ї—О–і–∞–µ—В—Б—П —В–Њ–ї—М–Ї–Њ 1 –њ–Є–Ї. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –≤ –љ–Њ—А–Љ–µ –ї–∞–Ї—В—Г–ї–Њ–Ј–∞ –љ–µ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –≤ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–µ, –∞ –≤ —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–µ –ї–∞–Ї—В—Г–ї–Њ–Ј–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г–µ—В—Б—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –∞–љ–∞—Н—А–Њ–±–љ–Њ–є —В–Њ–ї—Б—В–Њ–Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–Њ–є –і–Њ –Ї–Њ—А–Њ—В–Ї–Њ—Ж–µ–њ–Њ—З–µ—З–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В —Б –≤—Л–і–µ–ї–µ–љ–Є–µ–Љ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –≤–Њ–і–Њ—А–Њ–і–∞. –≠—В–Њ—В –≤–Њ–і–Њ—А–Њ–і —А–µ–≥–Є—Б—В—А–Є—А—Г–µ—В—Б—П –њ—А–Є –µ–≥–Њ –≤—Л–і—Л—Е–∞–љ–Є–Є –Є–Ј –ї–µ–≥–Ї–Є—Е —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–Љ –њ—А–Є–±–Њ—А–Њ–Љ (Gastrolyzer). –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ш–С–† –≤ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Є–Ј–±—Л—В–Њ—З–љ–∞—П –Ї–Њ–љ—В–∞–Љ–Є–љ–∞—Ж–Є—П —В–Њ–ї—Б—В–Њ–Ї–Є—И–µ—З–љ–Њ–є –∞–љ–∞—Н—А–Њ–±–љ–Њ–є (–љ–µ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–љ–Њ–є) –Љ–Є–Ї—А–Њ—Д–ї–Њ—А–Њ–є, –њ–Њ—Н—В–Њ–Љ—Г –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –ї–∞–Ї—В—Г–ї–Њ–Ј—Л –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–∞–љ—М—И–µ, —В. –µ. –≤ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–µ. –≠—В–Њ—В —Д–µ–љ–Њ–Љ–µ–љ —А–µ–≥–Є—Б—В—А–Є—А—Г–µ—В—Б—П –њ—А–Є –Т–Ф–Ґ, –і–µ–ї–∞—П –µ–≥–Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ. –Ь–∞–Ї–Љ–Є—А–Њ—А¬Ѓ –њ–Њ–і–∞–≤–ї—П–µ—В —А–Њ—Б—В —Д–ї–Њ—А—Л –≤ —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–µ, —Б–љ–Є–ґ–∞—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤–Њ–і–Њ—А–Њ–і–∞ –≤ –≤—Л–і—Л—Е–∞–µ–Љ–Њ–Љ –≤–Њ–Ј–і—Г—Е–µ. –Ъ–∞–ґ–і—Л–є –њ–∞—Ж–Є–µ–љ—В –њ—А–Є–љ–Є–Љ–∞–ї –љ–Є—Д—Г—А–∞—В–µ–ї (–Ь–∞–Ї–Љ–Є—А–Њ—А¬Ѓ) –њ–Њ 400 –Љ–≥ 3 —А./—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 7 –і–љ–µ–є. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–∞—Е 2 –Є 3 [15].

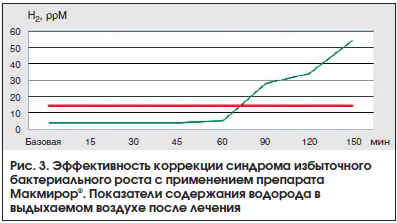
–Я–Њ—Б–ї–µ –і–µ–Ї–Њ–љ—В–∞–Љ–Є–љ–∞—Ж–Є–Є —В–Њ–љ–Ї–Њ–є –Ї–Є—И–Ї–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞ –Ь–∞–Ї–Љ–Є—А–Њ—А¬Ѓ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (28 —З–µ–ї–Њ–≤–µ–Ї, 93,3%) –Њ—В–Љ–µ—З–∞–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Є–ї–Є –њ–Њ–ї–љ–Њ–µ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –Љ–µ—В–µ–Њ—А–Є–Ј–Љ–∞, –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О —Б—В—Г–ї–∞ –Є–ї–Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –µ–≥–Њ —З–∞—Б—В–Њ—В—Л, –њ–Њ–ї–љ–Њ–µ –Є–ї–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞.
–Ь–∞–Ї–Љ–Є—А–Њ—А¬Ѓ –њ–Њ–Ї–∞–Ј–∞–љ –≤ —Б–ї–µ–і—Г—О—Й–Є—Е —Б–ї—Г—З–∞—П—Е: –і–Є—Б–±–∞–Ї—В–µ—А–Є–Њ–Ј –Ї–Є—И–µ—З–љ–Є–Ї–∞, –°–Ш–С–†, –Ї–Є—И–µ—З–љ—Л–µ –Є–љ—Д–µ–Ї—Ж–Є–Є, –∞–Љ–µ–±–Є–∞–Ј, –ї—П–Љ–±–ї–Є–Њ–Ј, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –Ц–Ъ–Ґ, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б H. —Аylori. –Я—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ–Є —П–≤–ї—П—О—В—Б—П –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М, –∞ —В–∞–Ї–ґ–µ –і–µ—Д–Є—Ж–Є—В —Б–∞—Е–∞—А–Њ–Ј—Л/–Є–Ј–Њ–Љ–∞–ї—М—В–Њ–Ј—Л, –љ–µ–њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М —Д—А—Г–Ї—В–Њ–Ј—Л, –≥–ї—О–Ї–Њ–Ј–Њ-–≥–∞–ї–∞–Ї—В–Њ–Ј–љ–∞—П –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є—П. –Я–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л —А–µ–і–Ї–Є: –і–Є—Б–њ–µ–њ—Б–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –Є –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є. –Ф–µ—В—П–Љ —Б –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Љ–µ–љ–µ–µ 40 –Ї–≥ –Ь–∞–Ї–Љ–Є—А–Њ—А¬Ѓ –љ–∞–Ј–љ–∞—З–∞—О—В –≤ –і–Њ–Ј–µ 30 –Љ–≥/–Ї–≥/—Б—Г—В –≤ 2вАУ3 –њ—А–Є–µ–Љ–∞, –∞ –≤–Ј—А–Њ—Б–ї—Л–Љ –Є –і–µ—В—П–Љ —Б –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –±–Њ–ї–µ–µ 40 –Ї–≥ вАУ –њ–Њ 2 —В–∞–±–ї–µ—В–Ї–Є 2вАУ3 —А./—Б—Г—В. –Ъ—Г—А—Б —В–µ—А–∞–њ–Є–Є вАУ 7 –і–љ–µ–є.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –љ–∞—А—Г—И–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–∞ –Є —Д—Г–љ–Ї—Ж–Є–Є –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ—Д–ї–Њ—А—Л –Є–≥—А–∞—О—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Љ–љ–Њ–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г –і–µ—В–µ–є –Є –≤–Ј—А–Њ—Б–ї—Л—Е, –Њ–і–љ–∞–Ї–Њ –Љ–љ–Њ–≥–Є–µ –≤–Њ–њ—А–Њ—Б—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Ї–Њ—А—А–µ–Ї—Ж–Є–µ–є –Ї–Є—И–µ—З–љ–Њ–≥–Њ –Љ–Є–Ї—А–Њ–±–Є–Њ—Ж–µ–љ–Њ–Ј–∞, –Њ—Б—В–∞—О—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л–Љ–Є. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–є –њ—Г—В—М —А–µ—И–µ–љ–Є—П –і–∞–љ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ—Л —Б—Г—Й–µ—Б—В–≤—Г–µ—В вАУ —Н—В–Њ —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–∞—П –Є –∞–і–µ–Ї–≤–∞—В–љ–∞—П –Ї–Њ—А—А–µ–Ї—Ж–Є—П –Ї–Є—И–µ—З–љ–Њ–є —Д–ї–Њ—А—Л.












