Задачи исследования:
1. Дать характеристику требованиям, предъявляемым к пробиотическим препаратам, и методам оценки их эффективности.
2. В качестве примера проанализировать «терапевтические возможности» отечественного пробиотика Аципол®.
К настоящему моменту сформированы требования к пробиотическим препаратам и их производству [12,16]. Предпочтение отдается поликомпонентным препаратам, которые содержат микроорганизмы нескольких видов. Микроорганизмы могут быть фиксированы на сорбенте (сорбированные пробиотики) или находиться вместе с компонентами питательной среды (комбинированные пробиотики). Информация о видовой принадлежности микроорганизмов, об их антагонистической активности и чувствительности к антибиотикам, о физиологических свойствах (способность ферментировать полисахариды, синтезировать витамины, биогенные амины и др.) является необходимой для оценки качества пробиотика. Сведения об устойчивости штаммов в кислой среде, к солям желчи определяют их способность к выживанию на пути к топическому органу – кишечнику.
Возможными механизмами действия пробиотиков являются: выработка веществ, подавляющих рост патогенной и условно–патогенной флоры; блокирование рецепторов адгезии; конкуренция за питательную среду; разрушение токсинов; стимуляция иммунитета [20].
Заключение о безопасности пробиотиков основывается на соответствующих условиях производства, результатах клинических исследований и применения в реальной практике. Вероятность того, что они могут вызвать инфекционные осложнения, неблагоприятную метаболическую активность, чрезмерную стимуляцию иммунитета, передачу генов, весьма мала. Приводятся несколько случаев системных инфекций при их применении, хотя эта связь оспаривается [17]. Причиной нозокомиальных инфекций могут быть представители вида Enterococcus, особенно штаммы устойчивые к ванкомицину. Некоторые представители Lactobacillus устойчивы к ванкомицину, но их гены, кодирующие устойчивость к данному антибиотику, являются хромосомными и их горизонтальная передача невозможна.
Современное состояние знаний по применению пробиотиков определяется результатами клинических исследований. При их обобщении все большее значение придается формализованным методам. В таблице 1 представлен анализ эффективности пробиотиков [10], в котором использованы уровни доказательств в области терапии/профилактики, разработанные Оксфордским центром доказательной медицины (http://www.cebm.net/ index.aspx?o=1025).
Получение достоверной информации об эффективности пробиотиков, преимуществах одних препаратов над другими – сложная задача, которая даже в условиях клинических исследований не всегда решается. Доказательствами терапевтического действия пробиотических препаратов являются клинические наблюдения, исследования микрофлоры кишечника и (или) их метаболитов [1]. Объективность «симптоматических эффектов», надежность и доступность лабораторных методов явно недостаточны для исчерпывающего заключения о той или иной степени их эффективности даже при хорошо спланированных и проведенных исследованиях. Как правило, систематические ошибки связаны с выявлением и подтверждением определенного клинического эффекта. Неопределенность в принятии решений о клинической важности наблюдаемого различия является основной причиной недостаточно обоснованных заключений, особенно тогда, когда доказательства эффективности анализируются без учета или при отсутствии сведений, характеризующих препарат.
В настоящее время широко развивается класс компьютерных систем, направленных на выработку объективной оценки при выборе решения. Их принято называть «системами поддержки принятия решений» (Decision Support Systems) – это гибридные системы, объединяющие разветвленный пользовательский сервис с обширными базами данных и функциями поддержки решения. Они отличаются методом учета неопределенности, положенным в их основу [2,6]. Согласно исследованиям Кохрановской рабочей группы по эффективности методов воздействия на клиническую практику EPOC (Effective Practice and Organization of Care group) «компьютерные подсказки» относятся к стабильно эффективным методам при принятии решений, связанных с необходимостью учета неопределенных факторов. Так как формирование конструктивной информации о пробиотике представляет собой многокритериальную задачу, решение которой требует обобщенной оценки как его свойств, так и доказательств эффективности в условиях неопределенности, целесообразно предусмотреть возможность использования «систем поддержки принятия решений». При этом измерение «доброкачественности» принимаемых решений должно основываться на максимизации вероятности ожидаемого результата, выраженного в виде интегрального показателя «терапевтических возможностей» того или иного препарата.
В качестве примера приводится анализ «терапевтических возможностей» отечественного препарата Аципол®.
Аципол® – комбинированный пробиотический препарат из смеси живых облигатных ацидофильных лактобацилл (Lactobacillus acidophilus NK1, NK2, NK5, NK12) и полисахарида кефирных грибков. История создания препарата Аципол® началась в 1952 г., когда во Всесоюзном научно–исследовательском институте молочной промышленности в ходе селекционной работы были выделены четыре штамма ацидофильных лактобацилл от здоровых лиц разных возрастов. Lactobacillus acidophilus NK1, NK2, NK5, NK12 принадлежат в виду Lactobacillus acidophilus, роду Lactobacteriaceae, семейству Lactobacillus. Пробиотические культуры совместно с кефирным грибком использовались при производстве препарата Аципол® (таблетки), хорошо известного многим поколениям людей. Микроорганизмы прошли паспортизацию при депонировании в ФГУП ГосНИИ «Генетика». Производственные штаммы признаны непатогенными для человека (СП 1.2.731–99). Проведенная в 2005–2006 гг. модернизация производства и внедрение новых технологий лиофилизации позволили наладить выпуск лекарственной формы в капсулах, сохранив при этом все полезные свойства пробиотических культур. Инструкция по применению препарата Аципол® (капсулы) утверждена 12.08.2006 г. № 01–11/129–06. Препарат внесен в Государственный регистр лекарственных средств № ЛС–001915 от 18.09.2006 г.
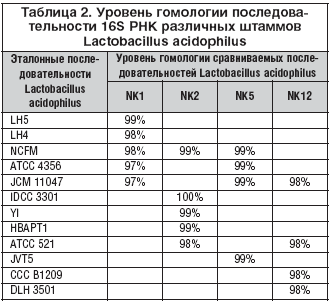
В 2007 г. в ФГУП ГосНИИ «Генетика» проведены дополнительные исследования (in vitro) по уточнению свойств Аципола®. Так, секвенирование гена 16S РНК штаммов более убедительно доказало их принадлежность к виду Lactobacillus acidophilus (табл. 2). Уровень гомологии с эталонными последовательностями Lactobacillus acidophilus составил в основном более 97%.
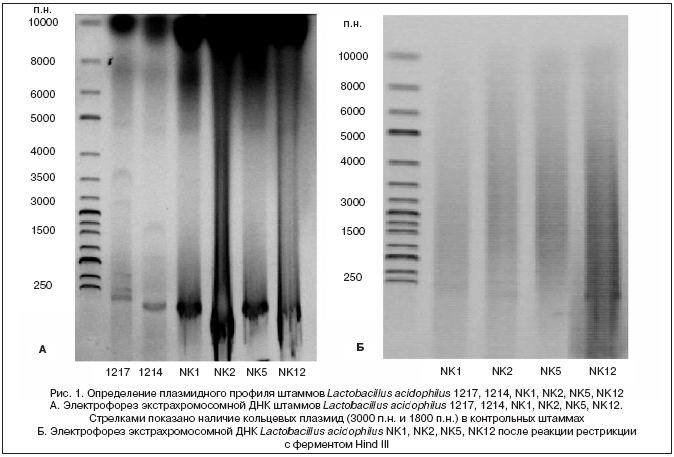
Для определения плазмидного профиля производственных штаммов проведен электрофорез в агарозном геле экстрахромосомной ДНК. В качестве контроля взяты штаммы Lactobacillus acidophilus 1217 и 1214, содержащие плазмиды. На электрофореграмме (рис. 1а) наличие кольцевых ДНК отмечено только в контрольных штаммах. Кроме того, не были обнаружены образования линейных структур ДНК после обработки рестриктазой Hind III (рис. 1б), что подтверждает отсутствие в Lactobacillus acidophilus NK1, NK2, NK5, NK12 мобильной генетической информации.
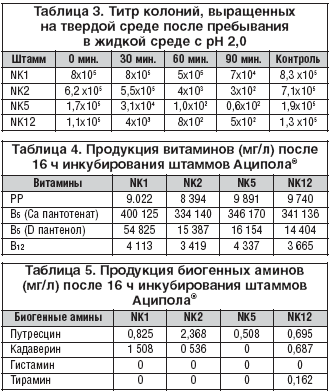
Устойчивость культур в неблагоприятных условиях обеспечивают экзополисахариды – вещества, защищающие клеточную стенку от воздействия кислой среды и ферментов. Способность штаммов Аципола® синтезировать экзополисахариды оценивалась при их росте на среде с содержанием рутениевого красного. В опыте Lactobacillus acidophilus NK1, NK2, NK5, NK12 остались бесцветными, то есть были защищены от проникновения в клетку красителя экзополисахаридами. Выживаемость бактерий в неблагоприятных условиях оценивалась в эксперименте по определению устойчивости культур в жидкой среде с pH 2 (табл. 3).
Для оценки устойчивости к солям желчи культуры Lactobacillus acidophilus NK1, NK2, NK5, NK12 засевались в жидкие среды с 20% содержанием желчи, в которых они культивировались в течение 12 часов. Результаты опытов показали, что способность штаммов Аципола® к росту в среде с 20% содержанием желчи сохраняется.
Для Аципола® характерна высокая активность кислотообразования – выше 200° Тернера при инкубации 48 ч. Это свойство лежит в основе показателей антагонистической активности Lactobacillus acidophilus NK1, NK2, NK5, NK12 в отношении патогенных и условно–патогенных бактерий. Штаммы препарата чувствительны к антибиотикам пенициллинового, тетрациклинового ряда, рифампицину, цефалоспоринам, аминогликозидам, ванкомицину и устойчивы к метронидазолу. Они ферментируют лактозу, галактозу, глюкозу, фруктозу, мальтозу, сахарозу, целлобиозу, маннозу, тригалозу, салицин; синтезируют витамины PP, B5, В12 (табл. 4).
Результаты исследования продукции биогенных аминов Lactobacillus acidophilus NK1, NK2, NK5, NK12 представлены в таблице 5. Отмечена минимальная продукция кадаверина, путресцина и полное отсутствие в среде культивирования гистамина, что весьма важно при применении препарата у лиц с аллергическими заболеваниями.
Представленные свойства и характеристики Аципола® с учетом значимости их влияния на его качество дают возможность наиболее объективно оценить соответствие препарата требованиям, предъявляемым к пробиотикам.
Сведения о лечебно–профилактической эффективности Аципола® при различных патологических состояниях формировались по результатам клинических исследований и наблюдениям в реальной практике [5,7,8]. За весь период многолетнего применения Аципола® не было отмечено каких–либо побочных реакций.
Так как современная концепция оценки и использования информации предусматривает различные уровни доказательности, проведен анализ исследований в соответствии с принципами «доказательной медицины» [13]. Использованы уровни и градации доказательств Оксфордского центра доказательной медицины. До 2006 г. клинические исследования соответствовали 2b, 2c, 3a, 3b, 4 уровням доказательств (градации доказательств «С», «D»), а рекомендации по применению препарата расценены, как относительно убедительные. В последующем проведены исследования с уровнем доказательств 1b (градация доказательств «В»). В частности, выполнено открытое исследование, которое позволило в идеальных условиях уточнить эффективность Аципола® в комплексной терапии острых кишечных инфекций у детей [4]. Методы контроля включали рандомизацию со стратификацией и модель исследования в параллельных группах. В результате установлено, что сочетание этиотропной терапии с Ациполом® при острых кишечных инфекциях у детей способствует более быстрой нормализации количественного и качественного состава микрофлоры кишечника и достоверно сокращает продолжительность болезни.
Особого внимания заслуживают исследования, в которых наряду с анализом качества диагностики идиопатической антибиотико–ассоциированной диареи у детей и взрослых в реальной практике и идеальных условиях, проведено изучение лечебно–профилактической эффективности Аципола® (материалы подготовлены к публикации). Понятие антибиотико–ассоциированная диарея включает в себя появление жидкого стула в период после назначения антибактериальной терапии и вплоть до 4–недельного срока после ее отмены (при исключении других причин ее развития). Считается, что одним из способов снизить вероятность возникновения антибиотико–ассоциированной диареи у детей, а также тяжесть ее течения является применение пробиотиков, особенно содержащих Lactobacillus GG, Lactobacillus sporogens [11,15,18].
В проведенном нами ретроспективном исследовании установлено, что антибиотико–ассоциированная диарея диагностируется в реальной практике у детей до 3 лет в 33% (доверительный интервал 29–37%) и у взрослых в 2% (доверительный интервал 0,1–4% при 95% достоверности). В проспективном рандомизированном открытом сравнительном исследовании частота антибиотико–ассоциированной диареи оказалась выше. Так, у детей в возрасте до 3 лет она диагностирована в 85% наблюдений (доверительный интервал 75–95%, p<0,05), в возрасте от 3 до 15 лет – в 25% (доверительный интервал 4–46%, p<0,05), у взрослых – в 12% (в доверительном интервале 4,5–19,5%, p<0,05). Установлено, что при применении Аципола® снижается частота ее развития до 64% у детей до 3 лет, до 3% детей в возрасте от 3 до 15 лет, до 0,7% у взрослых. При этом по сравнению с контрольной группой диарея была менее выраженной и продолжительной.
Для более полного и объективного представления о препарате проведен последовательный анализ качества препарата, его безопасности, эффективности и рассчитан интегральный показатель «терапевтических возможностей» Аципола® с помощью специальной компьютерной программы «ПРИНН» [6] – многокритериальной оценки и выбора решений в условиях неопределенности (табл. 6).
Необходимо отметить, что комплексная оценка пробиотика представляет собой открытую систему, способную принимать и анализировать дополнительную информацию. Предлагаемый метод позволяет наиболее объективно оценивать возможности препарата в первую очередь при лечении конкретной патологии. При этом данные о лечебно–профилактической эффективности могут быть использованы для обоснования «готовности платить». Например, для пациента в условиях амбулаторной медицинской помощи снижение вероятности развития или тяжести течения антибиотико–ассоциированной диареи связано с дополнительными расходами на курс лечения Ациполом®. В условиях лечебного учреждения, помимо клинического обоснования решения о включении Аципола® в протокол ведения больных, получающих антибиотики, требуется проведение фармакоэкономического анализа. Так, при снижении вероятности развития диареи у детей в среднем на 21,5% затраты лечебного учреждения на один предотвращенный случай будут равны почти пятикратной курсовой стоимости Аципола®. При этом возможные события, рассмотренные, например, в эконометрической модели с анализом последствий затрат (cost consequences analysis) могут свидетельствовать о том, что такие затраты вполне оправданы, так как минимизируют расходы, связанные с диагностикой и лечением антибиотико–ассоциированной диареи.
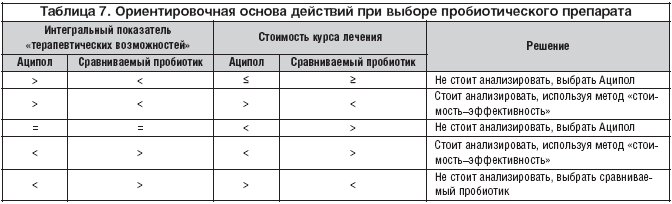
Интегральный показатель, представляющий собой количественную оценку «терапевтических возможностей» пробиотика, может быть использован при сравнении альтернатив, при фармакоэпидемиологических, фармакоэкономических исследованиях. Фармакоэпидемиологические исследования должны включать в себя также комплексный анализ производства и использования пробиотика с точки зрения социальных, медицинских, экономических последствий. Фармакоэкономический анализ применительно к рассматриваемой ситуации базируется в основном на соотношении значений «терапевтических возможностей» препарата и стоимости курса лечения. Наиболее часто анализируемые варианты на примере препарата Аципол представлены в таблице 7.
Представленный материал, отражающий в основном формализованный подход к совершенствованию применения пробиотиков в медицинской практике, рассчитан на использование как практическими врачами, так и организаторами здравоохранения.


Литература
1. Ардатская М.Д. Дисбактериоз кишечника,17с. Представлено на www.disbak.ru
2. Ларичев О.И. Объективные модели и субъективные решения. М.: Наука, 1987, 141 с.
3. Материалы круглого стола «Рациональный выбор пробиотика в практике гастроэнтеролога», Москва, 18 декабря 2006 г., Российские Медицинские Вести, 2007, Том XII, №4, с. 46–48.
4. Новокшонов А.А., Соколова Н.В., Бережкова Т.В., Сахарова А.А., Ларина Т.С. Клиническая эффективность и воздействие на микробиоценоз кишечника пробиотика Аципол в комплексной терапии острых кишечных инфекций у детей Педиатрия/2007/Том 86/№2 с. 87–92.
5. Перламутров Ю.Н., Ольховская К.Б., Ивашкина Н.Ю., Шустер А.М., Мартьянов В.А. Влияние пробиотиков на функциональное состояние эпидермального барьера кожи лица. Вестник дерматологии и венерологии.–2008.–№4.– С. 80–83.
6. Пиявский С.А. Численные методы принятия решений в компьютерных технологиях технического творчества в строительстве. Учебное пособие. М., 1994, 190 с.
7. Савенкова М.с., Афанасьева А.А. Лечение инфекций: антибактериальное и пробиотическое воздействие. Педиатрия. – 2008. – №1, приложение consilium medicum. С. 38–40.
8. Феклисова Л.В. Применение лактосодержащих пробиотиков: оценка многолетнего использования Аципола в педиатрической практике педиатрия /№2/ 2007/ приложение consilium medicum, с.123–127.
9. Урсова Н.И.Особенности формирования хронической патологии у детей в экологически неблагоприятных условиях (факторы риска, лечение, реабилитация) Автореф. дисс. докт. мед. наук.–М., 2001. – 38 с.
10. Gill HS, Guarner F. Probiotics and human health: a clinical perspective Postgrad Med J. 2004 Sep;80(947):516–26.
11. Guandalini S, Pensabene L, Zikri MA, Dias JA, Casali LG, Hoekstra H, Kolacek S, Massar K, Micetic–Turk D, Papadopoulou A, de Sousa JS, Sandhu B, Szajewska H, Weizman Z. Lactobacillus GG administered in oral rehydration solution to children with acute diarrhea: a multicenter European trial. J Pediatr Gastroenterol Nutr. 2000 Jan;30(1):54–60.
12. Guidelines for the Evaluation of Probiotics in Food: Joint FAO/WHO Working Group meeting, London Ontario, Canada, 30 April–1 May 2002.
13. Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология, Основы доказательной медицины (Пер. с англ.). М., 1998. – 347 с.
14. Fuller R. Probiotics in man and animals. J Appl Bacteriol. 1989 May;66(5):365–78.
15. D’Souza AL, Rajkumar C, Cooke J, Bulpitt CJ. Probiotics in prevention of antibiotic associated diarrhoea: meta–analysis. BMJ. 2002 Jun 8;324(7350):1361.
16. Health and Nutritional Properties of Probiotics in Food including Powder Milk with Live Lactic Acid Bacteria Report of a Joint FAO/WHO Expert Consultation on Evaluation of Health and Nutritional Properties of Probiotics in Food Including Powder Milk with Live Lactic Acid Bacteria Cordoba, Argentina, 1–4 October 2001.
17. Land M.H., Rouster–Stevens K., Woods C,R., Cannon M.I., J Cnota A.K. Shtetty Sepsis Associated With Probiotic Therapy Lactobacillus. Pediatrics 2005.– Vol.115.– P. 178–181.
18. Lilly DM, Stillwell RH. Probiotics: growth–promoting factors produced by microorganisms.Science. 1965 Feb 12;147:747–8.
19. McFarland LV. Meta–analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease. Am J Gastroenterol. 2006 Apr;101(4):812–22.
20. Rolfe RD. The role of probiotic cultures in the control of gastrointestinal health J Nutr. 2000 Feb;130(2S Suppl):396S–402 S.












