–Ь–µ—В–Њ–і—Л
–Э–∞—И–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –≤ —Г—Б–ї–Њ–≤–Є—П—Е –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞: –∞–Ї–∞–і–µ–Љ–Є—З–µ—Б–Ї–Є–є —Ж–µ–љ—В—А (57 –њ–∞—Ж–Є–µ–љ—В–Њ–≤) –Є 8 —З–∞—Б—В–љ—Л—Е –Њ–±—Й–Є—Е –њ—А–∞–Ї—В–Є–Ї (87 –њ–∞—Ж–Є–µ–љ—В–Њ–≤). –Я–∞—Ж–Є–µ–љ—В—Л –≤–Ї–ї—О—З–∞–ї–Є—Б—М –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –і–µ–Ї–∞–±—А—П 1997-–≥–Њ –њ–Њ –Љ–∞—А—В 2000-–≥–Њ. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є–љ–Є–Љ–∞–ї–Є —Г—З–∞—Б—В–Є–µ –ґ–µ–љ—Й–Є–љ—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 18 –і–Њ 55 –ї–µ—В –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є, —З—В–Њ –≥–ї–∞–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –Є—Е –Њ–±—А–∞—Й–µ–љ–Є—П –Ј–∞ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й—М—О –±—Л–ї–∞ —Г—Б—В–∞–ї–Њ—Б—В—М. –Ш–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є—Б–Ї–ї—О—З–∞–ї–Є—Б—М –ґ–µ–љ—Й–Є–љ—Л, –µ—Б–ї–Є —Г –љ–Є—Е –≤—Л—П–≤–ї—П–ї–Є—Б—М: —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –љ–Є–ґ–µ 117 –≥/–ї, –і—А—Г–≥–Є–µ –Њ—З–µ–≤–Є–і–љ—Л–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Є–ї–Є –њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Є—З–Є–љ—Л –і–ї—П —Г—Б—В–∞–ї–Њ—Б—В–Є –Є–ї–Є —Б–Є–љ–і—А–Њ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Г—Б—В–∞–ї–Њ—Б—В–Є. –Ю—В–Ї–ї–Њ–љ–µ–љ–Є–µ –Њ—В –њ—А–Њ—В–Њ–Ї–Њ–ї–∞, –≤—Л—П–≤–ї–µ–љ–љ–Њ–µ –њ–Њ—Б–ї–µ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є, –њ—А–Є–≤–Њ–і–Є–ї–Њ –Ї –Є—Б–Ї–ї—О—З–µ–љ–Є—О –ґ–µ–љ—Й–Є–љ—Л –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Я—А–Є—З–Є–љ—Л –і–ї—П —Б—В–Њ–ї—М –њ–Њ–Ј–і–љ–µ–≥–Њ –Є—Б–Ї–ї—О—З–µ–љ–Є—П –±—Л–ї–Є –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –Ј–∞—А–∞–љ–µ–µ: –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М, –≤—Л—П–≤–ї–µ–љ–љ–∞—П –≤–Њ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≥–µ–Љ–Њ—Е—А–Њ–Љ–∞—В–Њ–Ј, —Д–Є–Ј–Є—З–µ—Б–Ї–Є–µ –Є–ї–Є –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞, –≤—Л—П–≤–ї–µ–љ–љ—Л–µ –њ–Њ—Б–ї–µ –≤–Ї–ї—О—З–µ–љ–Є—П, –њ—А–Є–µ–Љ –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є–ї–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞ –≤–Њ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–†–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є—П, –≥–ї–∞–≤–љ—Л–µ –Є—Б—Е–Њ–і—Л
–Є –Ї–Њ–Љ–њ–ї–∞–є–µ–љ—Б
–Э–∞—И–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ, –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–Љ. –Я–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є –ї–Є–±–Њ 80 –Љ–≥/—Б—Г—В. per os –і–ї–Є—В–µ–ї—М–љ–Њ –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ —Б—Г–ї—М—Д–∞—В–∞ –ґ–µ–ї–µ–Ј–∞ –Є–ї–Є –њ–ї–∞—Ж–µ–±–Њ –≤ —В–µ—З–µ–љ–Є–µ 4 –љ–µ–і. –Ц–µ–ї–µ–Ј–Њ –Є –њ–ї–∞—Ж–µ–±–Њ –≤—Л–≥–ї—П–і–µ–ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ, –±—Л–ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤—Л –њ–Њ –≤–Ї—Г—Б—Г –Є –њ–Њ —А–µ–ґ–Є–Љ—Г –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П. –†–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є—П –≤—Л–њ–Њ–ї–љ—П–ї–∞—Б—М –≤ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ–є –∞–њ—В–µ–Ї–µ, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Ј–∞—А–∞–љ–µ–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ —Б–њ–Є—Б–Ї–Њ–Љ. –Я–∞—Ж–Є–µ–љ—В—Л, —Д–∞—А–Љ–∞—Ж–µ–≤—В—Л –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –±—Л–ї–Є «–Њ—Б–ї–µ–њ–ї–µ–љ—Л» –Ї –љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О –і–Њ –Ї–Њ–љ—Ж–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ъ–∞–ґ–і–∞—П —Г–њ–∞–Ї–Њ–≤–Ї–∞ –Є–Љ–µ–ї–∞ —Г–љ–Є–Ї–∞–ї—М–љ—Л–є –љ–Њ–Љ–µ—А –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Њ–љ–љ—Л–Љ —Б–њ–Є—Б–Ї–Њ–Љ. –Э–Њ–Љ–µ—А–∞ –≤—Л–і–∞–≤–∞–ї–Є—Б—М —Д–∞—А–Љ–∞—Ж–µ–≤—В–Њ–Љ –Є –Њ—Б—В–∞–≤–∞–ї–Є—Б—М –љ–µ—А–∞—Б—Б–ї–µ–њ–ї–µ–љ–љ—Л–Љ–Є –і–Њ –Ј–∞–≤–µ—А—И–µ–љ–Є—П –∞–љ–∞–ї–Є–Ј–∞.
–У–ї–∞–≤–љ—Л–Љ –Є—Б—Е–Њ–і–Њ–Љ –±—Л–ї —Г—А–Њ–≤–µ–љ—М —Г—Б—В–∞–ї–Њ—Б—В–Є, –Њ –Ї–Њ—В–Њ—А–Њ–Љ —Б–Њ–Њ–±—Й–∞–ї –њ–∞—Ж–Є–µ–љ—В, –Њ—Ж–µ–љ–Є–≤–∞–µ–Љ—Л–є –Є—Б—Е–Њ–і–љ–Њ –Є —З–µ—А–µ–Ј 1 –Љ–µ—Б. –ї–µ—З–µ–љ–Є—П –њ–Њ 10-–±–∞–ї–ї—М–љ–Њ–є –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —И–Ї–∞–ї–µ, –Њ—В 1 (—Б–Њ–≤—Б–µ–Љ –љ–µ—В —Г—Б—В–∞–ї–Њ—Б—В–Є) –і–Њ 10 (–Њ—З–µ–љ—М —Б–Є–ї—М–љ–∞—П —Г—Б—В–∞–ї–Њ—Б—В—М). –Ґ–∞–Ї–ґ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –≤–∞–ї–Є–і–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –≤–Њ–њ—А–Њ—Б–љ–Є–Ї –њ–Њ —Б–∞–Љ–Њ–Ї–Њ–љ—В—А–Њ–ї—О, —Б–Њ—Б—В–Њ—П—Й–Є–є –Є–Ј 24 –њ—Г–љ–Ї—В–Њ–≤, –Њ–±—К–µ–і–Є–љ–µ–љ–љ—Л—Е –њ–Њ 8 –≤–Њ–њ—А–Њ—Б–Њ–≤ –љ–∞ –Ї–∞–ґ–і—Л–є –Є–Ј 3 —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ (—Г—Б—В–∞–ї–Њ—Б—В—М, —В—А–µ–≤–Њ–≥–∞, –і–µ–њ—А–µ—Б—Б–Є—П) [10]. –£—А–Њ–≤–µ–љ—М –і–µ–њ—А–µ—Б—Б–Є–Є –Є —В—А–µ–≤–Њ–≥–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–ї–Є—Б—М –Ї–∞–Ї –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Є—Б—Е–Њ–і—Л. –С–∞–ї–ї—Л –њ–Њ –Ї–∞–ґ–і–Њ–Љ—Г –≤–Њ–њ—А–Њ—Б—Г –Њ–њ—А–µ–і–µ–ї—П–ї–Є—Б—М –њ–Њ –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —И–Ї–∞–ї–µ. –Ю–±—Й–Є–є –±–∞–ї–ї –њ–Њ–ї—Г—З–∞–ї—Б—П –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ —Б–Є–Љ–њ—В–Њ–Љ–∞ –њ—Г—В–µ–Љ —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ–Є—П –±–∞–ї–ї–Њ–≤ –њ–Њ 8 –≤–Њ–њ—А–Њ—Б–∞–Љ (–Њ—В 0 –і–Њ 40). –Я–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–њ—А–∞—И–Є–≤–∞–ї–Є –Њ –ї—О–±—Л—Е –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–∞—Е –Є –Є–љ—В–µ—А–Ї—Г—А—А–µ–љ—В–љ—Л—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е, –њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є—П—Е. –Я–Њ–ї–љ—Л–є –∞–љ–∞–ї–Є–Ј –Ї—А–Њ–≤–Є –≤—Л–њ–Њ–ї–љ—П–ї—Б—П –Є—Б—Е–Њ–і–љ–Њ, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Д–µ—А—А–Є—В–Є–љ–∞ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О —Е–µ–Љ–Њ–ї—О–Љ–Є–љ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞. –Т—А–∞—З–Є –Љ–Њ–≥–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –і—А—Г–≥–Є–µ —В–µ—Б—В—Л –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –њ–∞—В–Њ–ї–Њ–≥–Є–Є –і–ї—П –Њ–±—К—П—Б–љ–µ–љ–Є—П —Г—Б—В–∞–ї–Њ—Б—В–Є. –°—Л–≤–Њ—А–Њ—В–Њ—З–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Д–µ—А—А–Є—В–Є–љ–∞ –Є–Ј–Љ–µ—А—П–ї–∞—Б—М —З–µ—А–µ–Ј 1 –Љ–µ—Б. —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –Є–Ј–љ–∞—З–∞–ї—М–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–ї—П–ї–Њ 20 µ–≥/–ї.
–Ъ–Њ–Љ–њ–ї–∞–є–µ–љ—Б –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞–ї—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О —Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ–≥–Њ –њ—А–Є–±–Њ—А–∞ (MEMS; Aardex Europe, –®–≤–µ–є—Ж–∞—А–Є—П), –Ї–Њ—В–Њ—А—Л–є –Ј–∞–њ–Є—Б—Л–≤–∞–ї –і–∞—В—Г –Є –≤—А–µ–Љ—П –Њ—В–Ї—А—Л—В–Є—П –Ї–Њ–љ—В–µ–є–љ–µ—А–∞ —Б –њ—А–µ–њ–∞—А–∞—В–Њ–Љ [11]. –Ґ–∞–Ї–ґ–µ –њ–Њ–і—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М –љ–µ–Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л–µ —В–∞–±–ї–µ—В–Ї–Є. –Ъ–Њ–Љ–њ–ї–∞–є–µ–љ—Б —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї—Б—П –њ—Г—В–µ–Љ –і–µ–ї–µ–љ–Є—П —З–Є—Б–ї–∞ —А–∞–Ј –Њ—В–Ї—А—Л—В–Є—П –Ї–Њ–љ—В–µ–є–љ–µ—А–∞ –Ї –Њ–±—Й–µ–Љ—Г –Ї–Њ–ї–Є—З–µ—Б—В–≤—Г –і–љ–µ–є –љ–∞–±–ї—О–і–µ–љ–Є—П.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј
–†–∞—Б—Б—З–Є—В–∞–љ–љ—Л–є —А–∞–Ј–Љ–µ—А –≤—Л–±–Њ—А–Ї–Є –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П —А–∞–Ј–ї–Є—З–Є–є –≤ 1 –±–∞–ї–ї –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –њ–Њ –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —И–Ї–∞–ї–µ —Б–Њ—Б—В–∞–≤–Є–ї 63 –њ–∞—Ж–Є–µ–љ—В–∞. –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –≤–Ї–ї—О—З–∞–ї —А–∞—Б—З–µ—В —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –≤ 2 –±–∞–ї–ї–∞ –і–ї—П –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–µ–≥–Њ –Ї—А–Є—В–µ—А–Є—П (t=0,05, –Љ–Њ—Й–љ–Њ—Б—В—М=0,80). –Ь—Л –≤—Л—З–Є—Б–ї–Є–ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є –±–∞–ї–ї–Њ–≤ –≤–Њ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –њ—Г—В–µ–Љ —Б—А–∞–≤–љ–µ–љ–Є—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –љ–∞ follow-up-–≤–Є–Ј–Є—В–µ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Є—Б—Е–Њ–і–љ—Л–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є. –Я—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј –≤—Л–њ–Њ–ї–љ—П–ї—Б—П –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –њ—А–Њ—В–Њ–Ї–Њ–ї–Њ–Љ –њ–Њ –љ–∞–Љ–µ—А–µ–љ–Є—О –ї–µ—З–Є—В—М—Б—П. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л–µ —В–µ—Б—В—Л – —В–µ—Б—В –і–ї—П 2 –≤—Л–±–Њ—А–Њ–Ї – t —В–µ—Б—В, 2 —В–µ—Б—В—Л –Є –ї–Є–љ–µ–є–љ—Л–є —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –Є –і—А.
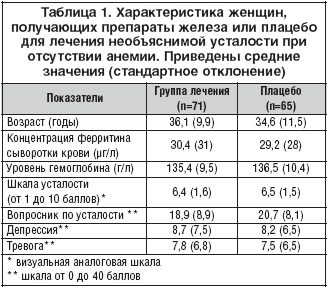
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–£ 366 –ґ–µ–љ—Й–Є–љ —Г—Б—В–∞–ї–Њ—Б—В—М –±—Л–ї–∞ –≥–ї–∞–≤–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є –Њ–±—А–∞—Й–µ–љ–Є—П –Ј–∞ –Ї–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є–µ–є –Ї –≤—А–∞—З—Г, 222 –±—Л–ї–Є –Є—Б–Ї–ї—О—З–µ–љ—Л –Є–Ј-–Ј–∞ –њ—Б–Є—Е–Є–∞—В—А–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ (110 –ґ–µ–љ—Й–Є–љ), —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є (61), –Њ—В–Ї–∞–Ј–Њ–≤ (16) –Є–ї–Є –і—А—Г–≥–Є—Е –њ—А–Є—З–Є–љ (35). –Ш–Ј 144 –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 136 (94%) –Ј–∞–≤–µ—А—И–Є–ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, —Б 7 (5%) –±—Л–ї –њ–Њ—В–µ—А—П–љ –Ї–Њ–љ—В–∞–Ї—В –Є –Њ–і–љ–∞ –≤—Л–±—Л–ї–∞ –Є–Ј-–Ј–∞ —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ – —В–Њ—И–љ–Њ—В—Л –Є —А–≤–Њ—В—Л (—А–Є—Б. 1). –У—А—Г–њ–њ—Л –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –њ–Њ –Є—Б—Е–Њ–і–љ—Л–Љ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ (—В–∞–±–ї. 1). –С—Л–ї–Є —В–Є–њ–Є—З–љ—Л –љ–Є–Ј–Ї–Є–µ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ—Л–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Д–µ—А—А–Є—В–Є–љ–∞: 50 µ–≥/–ї —Г 115 (85%) –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Є 20 µ–≥/–ї —Г 69 (51%). –І–Є—Б–ї–Њ –±–∞–ї–ї–Њ–≤ –њ–Њ —В—А–µ–≤–Њ–≥–µ –Є –і–µ–њ—А–µ—Б—Б–Є–Є –±—Л–ї–Њ –љ–Є–Ј–Ї–Є–Љ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е.
–°—А–µ–і–љ–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ–±—Й–µ–є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Г—Б—В–∞–ї–Њ—Б—В–Є –Љ–µ–ґ–і—Г –Є—Б—Е–Њ–і–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –Є —З–µ—А–µ–Ј 1 –Љ–µ—Б. –±—Л–ї –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ –ї–µ—З–µ–љ–Є—П, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ (–1,82±1,7) -0,85 (2,1) –±–∞–ї–ї–∞, —А–∞–Ј–ї–Є—З–Є–µ 0,95 –±–∞–ї–ї–∞, 95%-–љ—Л–є –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї (–Ф–Ш) 0,32 –і–Њ 1,62, p=0,004; —В–∞–±–ї. 2). –Я—Г—В–µ–Љ –≤—Л–±–Њ—А–∞ —В–Њ—З–Ї–Є –Њ—В—Б—З–µ—В–∞ –≤ 50 µ–≥/–ї –Љ—Л –≤—Л—П–≤–Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ –±–Њ–ї–µ–µ 50 µ–≥/–ї (—А=0,64). –Т –≥—А—Г–њ–њ–µ –ї–µ—З–µ–љ–Є—П –ґ–µ–ї–µ–Ј–Њ–Љ –≤—Л—П–≤–ї–µ–љ–Њ –±–Њ–ї—М—И–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ –Њ–±—Й–µ–є —И–Ї–∞–ї–µ —Г—Б—В–∞–ї–Њ—Б—В–Є (–7,5±8,0 –4,6 (7,5) –±–∞–ї–ї–∞, –Њ—В–ї–Є—З–Є–µ 3,0 –±–∞–ї–ї–Њ–≤, 0,3 –і–Њ 5,6, —А=0,03). –†–∞–Ј–ї–Є—З–Є–µ –њ–Њ —И–Ї–∞–ї–µ –і–µ–њ—А–µ—Б—Б–Є–Є –љ–µ –±—Л–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ –Љ–µ–ґ–і—Г 2 –≥—А—Г–њ–њ–∞–Љ–Є (–2,1±6 –1 (7) –±–∞–ї–ї–Њ–≤, —А=0,31), –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –±–Њ–ї—М—И–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —В—А–µ–≤–Њ–≥–Є –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –≤ –≥—А—Г–њ–њ–µ –ї–µ—З–µ–љ–Є—П (–1,7±6 1,3 (6), —А=0,003).
–Я–Њ—Б–ї–µ —Б—В–∞–љ–і–∞—А—В–Є–Ј–∞—Ж–Є–Є –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г, –љ–∞—З–∞–ї—М–љ–Њ–Љ—Г —Г—А–Њ–≤–љ—О –і–µ–њ—А–µ—Б—Б–Є–Є –Є —В—А–µ–≤–Њ–≥–Є –Є —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–Љ—Г —Г—А–Њ–≤–љ—О —Д–µ—А—А–Є—В–Є–љ–∞ –≤–Њ –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–Љ –ї–Є–љ–µ–є–љ–Њ–Љ —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ, —В–µ—А–∞–њ–Є—П –ґ–µ–ї–µ–Ј–Њ–Љ –±—Л–ї–∞ –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ–Њ–є –њ–µ—А–µ–Љ–µ–љ–љ–Њ–є, —Б–≤—П–Ј–∞–љ–љ–Њ–є —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Њ–±—Й–µ–є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Г—Б—В–∞–ї–Њ—Б—В–Є, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В —Н—Д—Д–µ–Ї—В—Г –≤ –1 –±–∞–ї–ї –њ–Њ –≤–Є–Ј—Г–∞–ї—М–љ–Њ–є –∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —И–Ї–∞–ї–µ. –Ь–µ–љ—М—И–Є–є –≤–Њ–Ј—А–∞—Б—В –±—Л–ї —В–∞–Ї–ґ–µ —Б–≤—П–Ј–∞–љ —Б –±–Њ–ї—М—И–Є–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Г—Б—В–∞–ї–Њ—Б—В–Є.
–Ь–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–є –ї–Є–љ–µ–є–љ—Л–є —А–µ–≥—А–µ—Б—Б–Є–Њ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –≤ –≥—А—Г–њ–њ–µ –ї–µ—З–µ–љ–Є—П –ґ–µ–ї–µ–Ј–Њ–Љ –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –≤–Њ–Ј—А–∞—Б—В, –Є—Б—Е–Њ–і–љ—Л–µ —Г—А–Њ–≤–љ–Є –і–µ–њ—А–µ—Б—Б–Є–Є –Є —В—А–µ–≤–Њ–≥–Є, —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ —Д–µ—А—А–Є—В–Є–љ–∞ –Є —Г—А–Њ–≤–µ–љ—М –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –љ–µ –±—Л–ї–Є –њ—А–µ–і–Є–Ї—В–Є–≤–љ—Л–Љ–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–љ–Є–ґ–µ–љ–Є—П –Њ–±—Й–µ–є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Г—Б—В–∞–ї–Њ—Б—В–Є. –Ы—Г—З—И–Є–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ –Њ—В–≤–µ—В–∞ –±—Л–ї–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—А–Є–љ—П—В—Л—Е —В–∞–±–ї–µ—В–Њ–Ї –≤ –≥—А—Г–њ–њ–µ –ї–µ—З–µ–љ–Є—П, —З–µ–≥–Њ –љ–µ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ.
–Ъ–Њ–Љ–њ–ї–∞–є–µ–љ—Б –Є —Г—А–Њ–≤–µ–љ—М –≤—Л–±—Л—В–Є—П –±—Л–ї–Є —Б—Е–Њ–і–љ—Л–Љ–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е: 95% (12) 98% (9), —А=0,25) –і–ї—П –Ї–Њ–Љ–њ–ї–∞–є–µ–љ—Б–∞ –Є 4 –Є–Ј 75 (5%) 4 –Є–Ј 69 (6%) –і–ї—П –≤—Л–±—Л—В–Є—П –і–ї—П –≥—А—Г–њ–њ—Л –ї–µ—З–µ–љ–Є—П –Є –њ–ї–∞—Ж–µ–±–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Я–Њ—Б–ї–µ –ї–µ—З–µ–љ–Є—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ —Д–µ—А—А–Є—В–Є–љ–∞ –±—Л–ї–∞ –≤—Л—И–µ –≤ –≥—А—Г–њ–њ–µ –ґ–µ–ї–µ–Ј–∞ (21,0 (9,2) vs 13,7 (6,9), —А<0,001). –Я–Њ—Б–ї–µ –Є—Б–Ї–ї—О—З–µ–љ–Є—П 5 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –∞–љ–∞–ї–Є–Ј –њ–Њ –њ—А–Њ—В–Њ–Ї–Њ–ї—Г –љ–µ –Њ—В–ї–Є—З–∞–ї—Б—П –Њ—В –∞–љ–∞–ї–Є–Ј–∞ –њ–Њ –љ–∞–Љ–µ—А–µ–љ–Є—О –ї–µ—З–Є—В—М—Б—П.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –љ–∞—И–Є–Љ–Є –і–∞–љ–љ—Л–Љ–Є —Н—В–Њ –њ–µ—А–≤–Њ–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –ґ–µ–љ—Й–Є–љ –і–µ—В–Њ—А–Њ–і–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (18–55 –ї–µ—В), –Ї–Њ—В–Њ—А–Њ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –ґ–µ–ї–µ–Ј–∞ –Љ–Њ–ґ–µ—В –≤–ї–Є—П—В—М –љ–∞ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Г—Б—В–∞–ї–Њ—Б—В–Є –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –∞–љ–µ–Љ–Є–Є. –≠—Д—Д–µ–Ї—В, –Њ–і–љ–∞–Ї–Њ, –Њ–≥—А–∞–љ–Є—З–µ–љ —Г –ґ–µ–љ—Й–Є–љ —Б –љ–Є–Ј–Ї–Є–Љ –Є–ї–Є –њ–Њ–≥—А–∞–љ–Є—З–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Д–µ—А—А–Є—В–Є–љ–∞. –Т –Њ–і–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г 35 –ґ–µ–љ—Й–Є–љ –±–µ–Ј –∞–љ–µ–Љ–Є–Є —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В—М—О –Є–ї–Є –њ–ї–Њ—Е–Њ –Њ–њ—А–µ–і–µ–ї—П–µ–Љ—Л–Љ–Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є —Г–ї—Г—З—И–Є–ї–Њ—Б—М —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є–µ –њ—А–Є –њ—А–Є–µ–Љ–µ –ґ–µ–ї–µ–Ј–∞ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ –њ—А–Є –њ—А–Є–µ–Љ–µ –њ–ї–∞—Ж–µ–±–Њ [12]. –Ь–Њ–ї–Њ–і—Л–µ –ґ–µ–љ—Й–Є–љ—Л —В–∞–Ї–ґ–µ –≤—Л–Є–≥—А—Л–≤–∞—О—В –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –ґ–µ–ї–µ–Ј–∞: —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В—М, —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї–Њ–љ—Ж–µ–љ—В—А–Є—А–Њ–≤–∞—В—М—Б—П –љ–∞ –Ј–∞–љ—П—В–Є—П—Е –≤ —И–Ї–Њ–ї–µ, —Г–ї—Г—З—И–∞–µ—В—Б—П –љ–∞—Б—В—А–Њ–µ–љ–Є–µ. –Т –і—А—Г–≥–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є–µ–Љ 20 –Љ–≥ —Н–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ –≤ —Б—Г—В–Ї–Є —Г–ї—Г—З—И–Є–ї –≤–µ—А–±–∞–ї—М–љ–Њ–µ –Ј–∞–њ–Њ–Љ–Є–љ–∞–љ–Є–µ –Є –њ–∞–Љ—П—В—М [13,14]. –Т –љ–µ—А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ —Б—А–∞–≤–љ–µ–љ–Є–Є –∞–≤—Б—В—А–∞–ї–Є–є—Б–Ї–Є—Е –ґ–µ–љ—Й–Є–љ —Г—Б—В–∞–ї–Њ—Б—В—М —Б–љ–Є–Ј–Є–ї–∞ –Є –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є, –Ї–Њ—В–Њ—А–Њ–µ –њ–Њ–≤—Л—Б–Є–ї–Є –њ—А–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞ –Є–ї–Є –і–Є–µ—В–∞ —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –ґ–µ–ї–µ–Ј–∞ [15].
–Ц–µ–љ—Й–Є–љ—Л —Б —Г—Б—В–∞–ї–Њ—Б—В—М—О —З–∞—Б—В–Њ —Б–≤—П–Ј—Л–≤–∞—О—В –µ–µ —Б–Є–Љ–њ—В–Њ–Љ—Л —Б –њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Б—В—А–µ—Б—Б–Њ–Љ, –∞ –љ–µ —Б –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ–Є —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є –Є–ї–Є –±–Є–Њ–Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є [4,16,17]. –Э–∞–њ—А–Њ—В–Є–≤, –≤—А–∞—З–Є –Њ–±—Л—З–љ–Њ —Б–≤—П–Ј—Л–≤–∞—О—В —Г—Б—В–∞–ї–Њ—Б—В—М —Б —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є –Є –љ–∞–Љ–љ–Њ–≥–Њ —А–µ–ґ–µ —Б –±–Є–Њ–Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ—А–Є—З–Є–љ–Њ–є [4–6,16,18]. –Ь—Л –≤—Л—П–≤–Є–ї–Є, —З—В–Њ –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–µ–і–Њ–Њ—Ж–µ–љ–µ–љ–љ–Њ–є –њ—А–Є—З–Є–љ–Њ–є —Г—Б—В–∞–ї–Њ—Б—В–Є —Г –ґ–µ–љ—Й–Є–љ –і–µ—В–Њ—А–Њ–і–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ —Г –ґ–µ–љ—Й–Є–љ –±–µ–Ј –∞–љ–µ–Љ–Є–Є – –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –њ—А–Є—З–Є–љ–∞ —Г—Б—В–∞–ї–Њ—Б—В–Є, —З—В–Њ –Ї—А–∞–є–љ–µ –≤–∞–ґ–љ–Њ –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–±–µ–ґ–∞—В—М –њ—А–Є—Б–≤–Њ–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Л–Љ —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ –њ—А–Є—З–Є–љ–∞–Љ –Є–ї–Є –ґ–Є–Ј–љ–µ–љ–љ—Л–Љ —Б—В—А–µ—Б—Б–Њ–≤—Л–Љ —Б–Є—В—Г–∞—Ж–Є—П–Љ –Є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Б–љ–Є–Ј–Є—В—М –љ–µ–Њ–њ—А–∞–≤–і–∞–љ–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —А–µ—Б—Г—А—Б–Њ–≤ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П. –†–∞–љ–љ–µ–µ –љ–∞—З–∞–ї–Њ —В–µ—А–∞–њ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –ґ–µ–ї–µ–Ј–∞ —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –њ–Њ–≤—Л—Б–Є—В—М –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є [8].
–Ь—Л –≤—Л—П–≤–Є–ї–Є –Ј–љ–∞—З–Є–Љ—Л–є –Њ—В–≤–µ—В —В–Њ–ї—М–Ї–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є—Б—Е–Њ–і–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–µ–є —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ —Д–µ—А—А–Є—В–Є–љ–∞ 50 µ–≥/–ї. –≠—В–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–є –і–µ—Д–Є—Ж–Є—В –і–∞–ґ–µ –њ—А–Є «–љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ» —Г—А–Њ–≤–љ–µ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ —Д–µ—А—А–Є—В–Є–љ–∞. –Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Є–µ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Њ–є –≥—А–∞–љ–Є—Ж—Л —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Д–µ—А—А–Є—В–Є–љ–∞ –і–∞–µ—В –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л: –Ј–∞–њ–∞—Б—Л –ґ–µ–ї–µ–Ј–∞ –≤ –Ї–Њ—Б—В–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –Љ–Њ–≥—Г—В —Б–ї—Г–ґ–Є—В—М –ї—Г—З—И–Є–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ [19]. –Т –Њ–і–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Д–µ—А—А–Є—В–Є–љ–∞ —Б –Ј–∞–њ–∞—Б–Њ–Љ –ґ–µ–ї–µ–Ј–∞ –≤ –Ї–Њ—Б—В–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –Ј–љ–∞—З–µ–љ–Є–µ —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Д–µ—А—А–Є—В–Є–љ–∞ –≤ 50 µ–≥/–ї –±—Л–ї–Њ —Б–≤—П–Ј–∞–љ–Њ —Б 50%-–љ–Њ–є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О —А–∞–Ј–≤–Є—В–Є—П –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ –≤ –Ї–Њ—Б—В–љ–Њ–Љ –Љ–Њ–Ј–≥–µ [20]. –С–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–µ —А–µ—Д–µ—А–µ–љ—В–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Д–µ—А—А–Є—В–Є–љ–∞ –Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ —Б—З–Є—В–∞—О—В—Б—П —Б–ї–Є—И–Ї–Њ–Љ –љ–Є–Ј–Ї–Є–Љ–Є –і–ї—П –ґ–µ–љ—Й–Є–љ [21]. –Р–≤—В–Њ—А—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—В –∞–і–∞–њ—В–∞—Ж–Є—О —В–∞–Ї–Є—Е —А–µ—Д–µ—А–µ–љ—В–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –Ї–∞–Ї –і–ї—П –Љ—Г–ґ—З–Є–љ, —В–∞–Ї –Є –і–ї—П –ґ–µ–љ—Й–Є–љ –Є —Б—З–Є—В–∞—О—В, —З—В–Њ –Њ–љ–Є «–≤–љ–µ—Б—Г—В —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ—Л–є –Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є –≤–Ї–ї–∞–і –≤ –ґ–µ–љ—Б–Ї–Њ–µ –Ј–і–Њ—А–Њ–≤—М–µ –Є –±–ї–∞–≥–Њ—Б–Њ—Б—В–Њ—П–љ–Є–µ». –Э–∞—И–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Ї–Њ—Б–≤–µ–љ–љ–Њ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–µ—В –Є—Е –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ, –њ–Њ–Ї–∞–Ј—Л–≤–∞—П, —З—В–Њ –ґ–µ–љ—Й–Є–љ—Л –≤—Л–Є–≥—А—Л–≤–∞—О—В –њ—А–Є –њ—А–Є–µ–Љ–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞ –і–∞–ґ–µ –њ—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≤ –Ї—А–Њ–≤–Є.
–Ф–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –і–∞–ґ–µ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –∞–љ–µ–Љ–Є–Є —Б–≤—П–Ј–∞–љ —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –ґ–µ–ї–µ–Ј–Њ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ –Є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤–ї–Є—П–µ—В –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–Њ–≤ [22,23]. –£ –ї—О–і–µ–є —Б –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–µ–є —Б–Є–Љ–њ—В–Њ–Љ—Л –Є—Б—З–µ–Ј–љ—Г—В –±—Л—Б—В—А–µ–µ, —З–µ–Љ –њ—А–Њ–Є–Ј–Њ–є–і–µ—В –њ—А–Є—А–Њ—Б—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–љ–і–µ–Ї—Б–Њ–≤ [24]. –≠—В–Њ –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Ї–ї–µ—В–Њ—З–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ–і–і–∞—О—В—Б—П –ї–µ—З–µ–љ–Є—О –ґ–µ–ї–µ–Ј–Њ–Љ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Г—А–Њ–≤–љ—П –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞. –Ю–і–љ–∞–Ї–Њ –Љ—Л –љ–µ –Є–Ј–Љ–µ—А—П–ї–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞ –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –ґ–µ–ї–µ–Ј–∞ –Є –њ–Њ—Н—В–Њ–Љ—Г –љ–µ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є, –њ–Њ–≤—Л—И–∞–ї—Б—П –ї–Є –µ–≥–Њ —Г—А–Њ–≤–µ–љ—М —Г –ї—О–і–µ–є —Б –Є—Б—Е–Њ–і–љ–Њ –љ–Є–Ј–Ї–Є–Љ–Є, –љ–Њ –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є –≥–µ–Љ–Њ–≥–ї–Њ–±–Є–љ–∞, —З—В–Њ –Љ–Њ–≥–ї–Њ –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ —Б —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є —Г—Б—В–∞–ї–Њ—Б—В–Є.
–Ю–≥—А–∞–љ–Є—З–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Э–∞—И–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є–Љ–µ–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–є. –Т–Њ-–њ–µ—А–≤—Л—Е, «–Њ—Б–ї–µ–њ–ї–µ–љ–Є–µ» –і–ї—П —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–Њ –њ–Њ–і–≥—А—Г–њ–њ–∞–Љ –±—Л–ї–Њ –≤–∞–ґ–љ—Л–Љ –Љ–Њ–Љ–µ–љ—В–Њ–Љ, –Њ—Б–Њ–±–µ–љ–љ–Њ –і–ї—П –≥—А—Г–њ–њ—Л –ї–µ—З–µ–љ–Є—П, –≤ —Б–≤—П–Ј–Є —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –Э–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–ї–Њ—Б—М –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ —Б–Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–∞—В—М –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Ж–≤–µ—В–∞ —Б—В—Г–ї–∞ –њ—Г—В–µ–Љ –і–Њ–±–∞–≤–ї–µ–љ–Є—П –≤–Є—Б–Љ—Г—В–∞ –≤ –њ–ї–∞—Ж–µ–±–Њ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Њ–љ —П–≤–ї—П–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ–є —Б—Г–±—Б—В–∞–љ—Ж–Є–µ–є. –Ф–ї—П –Љ–Є–љ–Є–Љ–Є–Ј–∞—Ж–Є–Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –Љ—Л –љ–∞–Ј–љ–∞—З–∞–ї–Є –љ–Є–Ј–Ї–Є–µ –і–Њ–Ј—Л —Б—Г–ї—М—Д–∞—В–∞ –ґ–µ–ї–µ–Ј–∞ –≤–Њ –≤—А–µ–Љ—П –Ј–∞–≤—В—А–∞–Ї–∞. –£—З–∞—Б—В–љ–Є–Ї–Є –Њ–±–µ–Є—Е –≥—А—Г–њ–њ —В–∞–Ї–ґ–µ –±—Л–ї–Є –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ—Л –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є–Є —Ж–≤–µ—В–∞ —Б—В—Г–ї–∞. –Ь—Л –љ–µ –њ—А–Њ—Б–Є–ї–Є —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—В—М –Є—Е –њ—А–Є–љ–∞–і–ї–µ–ґ–љ–Њ—Б—В—М –Ї —В–Њ–є –Є–ї–Є –Є–љ–Њ–є –≥—А—Г–њ–њ–µ. –Т –љ–µ–і–∞–≤–љ–µ–Љ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–є —А–∞–Ј–љ–Є—Ж—Л –њ–Њ —З–∞—Б—В–Њ—В–µ «—Г–≥–∞–і—Л–≤–∞–љ–Є—П» –Љ–µ—В–Њ–і–∞ –ї–µ—З–µ–љ–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –ґ–µ–ї–µ–Ј–∞ –Є –њ–ї–∞—Ж–µ–±–Њ –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ—П–ї–∞—Б—М –≤ 3 —А–∞–Ј–∞ –±–Њ–ї—М—И–∞—П –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –љ–∞—И–Є–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ –і–Њ–Ј–∞ —Н–ї–µ–Љ–µ–љ—В–∞—А–љ–Њ–≥–Њ –ґ–µ–ї–µ–Ј–∞ [14]. –Ь—Л –љ–µ –≤—Л—П–≤–Є–ї–Є —А–∞–Ј–ї–Є—З–Є–є –≤ –Ї–Њ–Љ–њ–ї–∞–є–µ–љ—Б–µ –Љ–µ–ґ–і—Г 2 –≥—А—Г–њ–њ–∞–Љ–Є, –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—П, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В—Л –љ–µ —Г–Ј–љ–∞–≤–∞–ї–Є –Њ –њ–Њ–њ–∞–і–∞–љ–Є–Є –≤ –≥—А—Г–њ–њ—Г –њ–ї–∞—Ж–µ–±–Њ. –Т–Њ-–≤—В–Њ—А—Л—Е, —Г –љ–∞—Б –љ–µ –±—Л–ї–Њ –њ—А–Њ—Ж–µ–і—Г—А –њ–Њ –Ї–Њ–љ—В—А–Њ–ї—О –≤–Ї–ї—О—З–µ–љ–Є—П –≤—Б–µ—Е –≤–Њ–Ј–Љ–Њ–ґ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Н—В–Њ —В—А—Г–і–љ–Њ –њ—А–Є–Љ–µ–љ–Є–Љ–Њ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Ї—А–∞–є–љ–µ –Ј–∞–≥—А—Г–ґ–µ–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є. –Т-—В—А–µ—В—М–Є—Е, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П —Д–µ—А—А–Є—В–Є–љ–∞ –±—Л–ї–∞ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ґ–µ–ї–µ–Ј–∞ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ–Њ—В–Њ–Љ—Г —З—В–Њ –Њ–љ —Б—З–Є—В–∞–µ—В—Б—П –ї—Г—З—И–Є–Љ –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ –Є–љ–і–Є–Ї–∞—В–Њ—А–Њ–Љ –Ј–∞–њ–∞—Б–Њ–≤ –ґ–µ–ї–µ–Ј–∞ [20]. –Ш, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–∞—И–Є–Љ –њ–µ—А–≤–Є—З–љ—Л–Љ –Є—Б—Е–Њ–і–Њ–Љ –±—Л–ї–∞ —Г—Б—В–∞–ї–Њ—Б—В—М – —Б—Г–±—К–µ–Ї—В–Є–≤–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М, —Б–Њ–Њ–±—Й–∞–µ–Љ—Л–є –њ–∞—Ж–Є–µ–љ—В–Њ–Љ.
–њ–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞–Љ —Б—В–∞—В—М–Є F. Verdon, B. Burnand,
C-L. Fallab Stubi, –µt al. «Iron supplementation
for unexplained fatigue in non-anaemic women: double blind randomised placebo controlled trial».
lBMJ 2003; 326: 1124
–І—В–Њ —Г–ґ–µ –Є–Ј–≤–µ—Б—В–љ–Њ –њ–Њ –і–∞–љ–љ–Њ–Љ—Г –≤–Њ–њ—А–Њ—Б—Г?
–Э–µ–Њ–±—К—П—Б–љ–Є–Љ–∞—П —Г—Б—В–∞–ї–Њ—Б—В—М —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –і–ї—П –Љ–Њ–ї–Њ–і—Л—Е –ґ–µ–љ—Й–Є–љ
–Ф–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –≤—Л—Б–Њ–Ї–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ —Б—А–µ–і–Є –ґ–µ–љ—Й–Є–љ –і–µ—В–Њ-
—А–Њ–і–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞
–Ґ–µ—А–∞–њ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –ґ–µ–ї–µ–Ј–∞ – —Е–Њ—А–Њ—И–Њ –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ
—Г—Б—В–∞–ї–Њ—Б—В–Є –њ—А–Є –љ–∞–ї–Є—З–Є–Є –ґ–µ–ї–µ–Ј–Њ–і–µ—Д–Є—Ж–Є—В–љ–Њ–є –∞–љ–µ–Љ–Є–Є, –љ–Њ –љ–µ –њ—А–Є –µ–µ
–Њ—В—Б—Г—В—Б—В–≤–Є–Є
–І—В–Њ –њ—А–Є–≤–љ–µ—Б–ї–Њ –і–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ?
–Ч–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –ґ–µ–ї–µ–Ј–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М
–Њ–њ—А–∞–≤–і–∞–љ–∞ —Г –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 18 –і–Њ 55 –ї–µ—В –±–µ–Ј –∞–љ–µ–Љ–Є–Є –Є —Б
–љ–µ–Њ–±—К—П—Б–љ–Є–Љ–Њ–є —Г—Б—В–∞–ї–Њ—Б—В—М—О. –Ю–і–љ–∞–Ї–Њ —Н—Д—Д–µ–Ї—В –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–≥—А–∞–љ–Є-
—З–µ–љ —Г –ґ–µ–љ—Й–Є–љ —Б –љ–Є–Ј–Ї–Є–Љ –Є–ї–Є –њ–Њ–≥—А–∞–љ–Є—З–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ —Д–µ—А—А–Є—В–Є–љ–∞
—Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є


–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Cathebras PJ, Robbins JM, Kirmayer LJ, Hayton BC. Fatigue in primary care. J Gen Intern Med 1992;7: 276-86.[ISI][Medline]
2. Bates DW, Schmitt W, Buchwald D, Ware NC, Lee J, Thoyer E, et al. Prevalence of fatigue and chronic fatigue syndrome in a primary care practice. Arch Intern Med 1993;153: 2759-65.[Abstract/Free Full Text]
3. Kroenke K, Arrington ME, Mangelsdorff AD. The prevalence of symptoms in medical outpatients and the adequacy of therapy. Arch Intern Med 1990;150: 1685-9.[Abstract/Free Full Text]
4. Pawlikowska T, Chalder T, Hirsch SR, Wallace P, Wright DJM, Wesley SC. Population based study of fatigue and psychological distress. BMJ 1994;308: 763-6.[Abstract/Free Full Text]
5. Sugarman JR, Berg AO. Evaluation of fatigue in family practice. J Fam Pract 1984;19: 643-7.[ISI][Medline]
6. Morrison JD. Fatigue as a presenting complaint in family practice. J Fam Pract 1980;10: 795-801.[ISI][Medline]
7. Ridsdale L, Evans A, Jerrett W, Mandalia S, Osler K, Vora H. Patients with fatigue in general practice: a prospective study. BMJ 1993;307: 103-6.[Abstract/Free Full Text]
8. Patterson AJ, Brown WJ, Powers JR, Roberts DC. Iron deficiency, general health and fatigue: results from the Australian longitudinal study on women’s health. Qual Life Res 2000;9: 491-7.[CrossRef][ISI][Medline]
9. Galan P, Yoon H-C, Preziosi P, Viteri P, Fieux B, Briancon S, et al. Determining factors in the iron status of adult women in the SU.VI.MAX study. Eur J Clin Nutr 1998;52: 383-8.[CrossRef][ISI][Medline]
10. Pichot P, Brun JP. Questionnaire bref d’auto-evaluation des dimensions depressive, asthenique et anxieuse. Ann Med Psychol 1984;142: 862-5.
11. Averbuch M, Weintraubn M, Pollak DJ. Compliance assessment in clinical trials: the MEMS device. J Clin Res Pharmacoepidemiol 1990;4: 199-204.
12. Beutler E, Larsh SE, Gurney CW. Iron therapy in chronically fatigued, nonanaemic women: a double-blind study. Ann Intern Med 1960;52: 378-94.[Abstract/Free Full Text]
13. Ballin A, Berar M, Rubinstein U, Kleter Y, Hershkovitz A, Meytes D. Iron state in female adolescents. Am J Dis Child 1992;146: 803-5.[Abstract/Free Full Text]
14. Bruner AB, Joffe A, Duggan A, Casella JF, Brandt J. Randomised study of cognitive effects of iron supplementation in non-anaemic iron-deficient girls. Lancet 1996;348: 992-6.[CrossRef][ISI][Medline]
15. Patterson AJ, Brown WJ, Roberts DC. Dietary and supplement treatment of iron deficiency results in improvements in general health and fatigue in Australian women of childbearing age. J Am Coll Nutr 2001;20: 337-42.[Abstract/Free Full Text]
16. Stewart D, Abbey S, Meana M, Boydell KM. What makes women tired? A community sample. J Women’s Health 1998;7: 69-76.[ISI][Medline]
17. Bensing JM, Hulsman RL, Schreurs KM. Gender differences in fatigue: biopsychosocial actors relating to fatigue in men and women. Med Care 1999;37: 1078-83.[CrossRef][ISI][Medline]
Manu P, Matthew DA, Lane TJ. The mental health of patients with a chief complaint of chronic fatigue. A prospective evaluation and follow-up. Arch Intern Med 1988;l48: 2213-7.
18. Hallberg L, Bengtsson C, Lapidus L, Lindstedt G, Lundberg PA, Hulten L. Screening for iron deficiency: an analysis based on bone-marrow examinations and serum ferritin determinations in a population sample of women. Br J Haematol 1993;85: 787-98.[ISI][Medline]
19. Guyatt GH, Oxman AD, Ali M, Willan A, McIlroy W, Patterson C. Laboratory diagnosis of iron-deficiency anaemia. J Gen Intern Med 1992;7: 145-53.[ISI][Medline]
20. Rushton DH, Dover R, Sainsbury AW, Norris MJ, Gilkes JJ, Ramsay ID. Why should women have lower reference limits for haemoglobin and ferritin concentrations than men? BMJ 2001;322: 1355-7.[Free Full Text]
21. Dallman PR. Iron deficiency: does it matter? J Intern Med 1989;226: 367-72.[ISI][Medline]
Scrimshaw NS. Functional consequences or iron deficiency in human populations. J Nutr Sci Vitaminol 1984;30: 47-63.
22. Ohira Y, Edgerton VR, Gardner GW, Senewiratine RJ, Barnard RJ, Simpson DR. Work capacity heart rate and blood lactate response to iron treatment. Br J Heamatol 1979;41: 365-72.[ISI][Medline]












